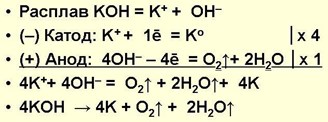Электрохимия – это раздел химии, который изучает процессы, протекающие в расплавах или растворах электролитов при прохождении через них постоянного электрического тока.
Данные процессы сопровождаются окислительно-восстановительными реакциями.
Собственно электрохимические превращения называются электролизом.
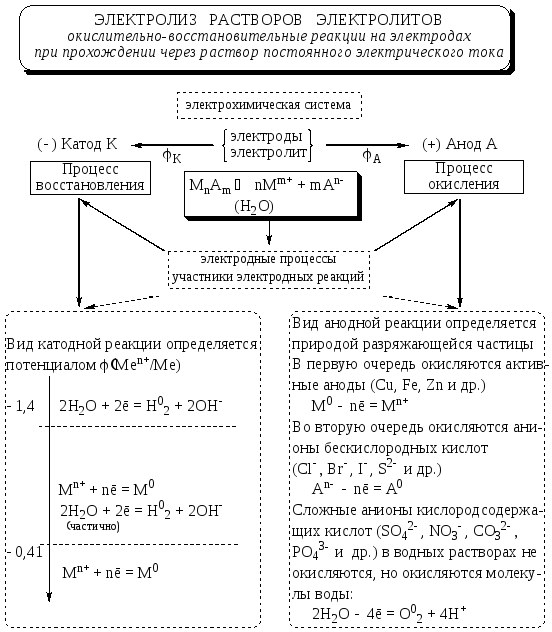
Любой процесс электролиза протекает с применением электродов – положительно или отрицательно заряженных материалов, которые участвуют в переносе электронов на границе двух фаз: расплав или раствор электролита – материал электрода.
Электрохимические процессы исследуют в т.н. электрохимических ячейках, состоящих из сосуда с расплавом или раствором электролита и помещёнными в него электродами, через которые пропускают постоянный электрический ток
Электроды могут состоять из различных материалов. Нерастворимые электроды, как правило, состоят из графита, золота, платины а растворимые – из любых металлов (кроме щелочных).
Как известно, процесс диссоциации электролита сопровождается распадом его на катионы (положительно заряженные частицы) и анионы (отрицательно заряженные частицы).
Например, в случае диссоциации хлорида натрия, это можно изобразить схемой:
NaCl ↔ Na+ + Cl—
Если расплав данного электролита поместить в электрохимическую ячейку и пропустить через него электрический ток, то на катоде будут восстанавливаться катионы, а на аноде будут окисляться анионы.
Таким образом, в совокупности, процесс электролиза представляет собой катодный и анодный процессы или окислительно-восстановительные реакции.
Продукты электролиза зависят прежде всего от того, в каком виде находится электролит (расплав или раствор), от материала электрода (инертный или растворимый) и от положения металла, входящего в состав соли, в ряду напряжения. В общем виде, всё это может быть сведено в следующие правила:
1) Катион электролита расположен в ряду напряжения до алюминия (включительно), то на катоде идёт процесс восстановления воды – выделяется водород.
2) Катион металла находится в ряду напряжения между алюминием и водородом, то на катоде одновременно восстанавливаются ионы металла и молекулы воды.
3) Катион металла расположен в ряду напряжения после водорода, то на катоде восстанавливается металл.
4) В растворе содержатся катионы разных металлов, то сначала восстанавливаются катионы металла, стоящего в ряду напряжения правее.
5) При растворимом аноде окисляется металл анода, независимо от вида катиона в электролите и природу аниона.
6) При нерастворимом аноде
— а) в случае электролиза раcтворов бескислородных кислот ( кроме фторидов) на аноде идёт процесс окисления аниона.
— б) в случае электролиза растворов солей кислородсодержащих кислот и фторидов на аноде идёт процесс окисления воды (выделяется кислород). Анионы не окисляются.
— в) анионы по их способности окисляться располагаются в следующем порядке:
Электролиз расплавов электролитов.
Как правило, электролиз данного вида осуществляется для соединений с ионным типом связей (соли, щёлочи).
При электролизе расплава гидроксида калия происходят следующие процессы:
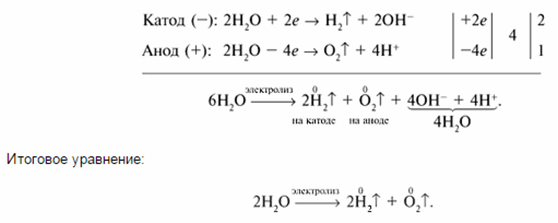
Электролиз растворов электролитов.
В растворах электролитов, помимо катионов и анионов, присутствуют молекулы воды. При электролизе воды происходят следующие процессы:
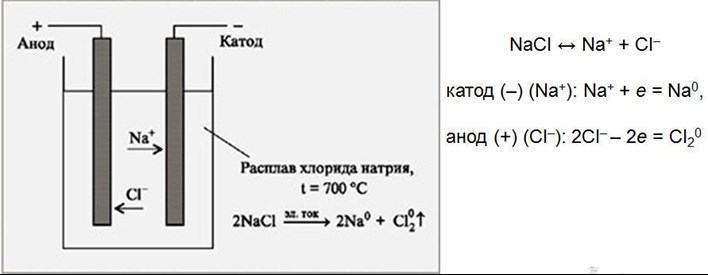
Рассмотрим электролиз хлорида натрия в случае нерастворимого и растворимого анода.
а) Анод нерастворимый.
В растворе протекает процесс электролитической диссоциации:
NaCl = Na+ + Cl—
на катоде (-) ионы натрия не восстанавливаются, остаются в растворе: 2H2O + 2ē → H2 + 2OH—
на аноде (+): 2Cl— — 2ē → Cl2
Суммарное ионное уравнение:
2H2O + 2Cl— = H2 + Cl2 + 2OH—
Учитывая присутствие ионов натрия в растворе, составим молекулярное уравнение:
2NaCl + 2H2O → H2 + Cl2 + 2NaCl
б) Анод растворимый (например, медный).
Если анод растворимый, то металл анода будет окисляться:
Cuо — 2ē → Cu2+
Катионы меди в ряду напряжений стоят после водорода, поэтому они будут восстанавливаться на катоде.
на катоде (-): Cu2+ + 2ē → Cuо
на аноде (+): Cuо — 2ē → Cu2+
При этом концентрация хлорида натрия в растворе не меняется.
Если Вам нужна помощь по химии, записывайтесь в расписании на сайте ко мне на занятия.
С уважением, Ваш Владимир Смирнов.
© blog.tutoronline.ru,
при полном или частичном копировании материала ссылка на первоисточник обязательна.
Электролиз
Электролиз
Химические реакции, сопровождающиеся переносом электронов (окислительно-восстановительные реакции) делятся на два типа: реакции, протекающие самопроизвольно и реакции, протекающие при прохождении тока через раствор или расплав электролита.
Раствор или расплав электролита помещают в специальную емкость — электролитическую ванну .
Электрический ток — это упорядоченное движение заряженных частиц — ионов, электронов и др. под действием внешнего электрического поля. Электрическое поле в растворе или расплаве электролита создают электроды .
Электроды — это, как правило, стержни из материала, проводящего электрический ток. Их помещают в раствор или расплав электролита, и подключают к электрической цепи с источником питания.
При этом отрицательно заряженный электрод катод — притягивает положительно заряженные ионы — катионы . Положительно заряженный электрод ( анод ) притягивает отрицательно заряженные частицы ( анионы ). Катод выступает в качестве восстановителя, а анод — в качестве окислителя.
Различают электролиз с активными и инертными электродами. Активные (растворимые) электроды подвергаются химическим превращениям в процессе электролиза. Обычно их изготавливают из меди, никеля и других металлов. Инертные (нерастворимые) электроды химическим превращениям не подвергаются. Их изготавливают из неактивных металлов, например, платины , или графита .
Электролиз растворов
Различают электролиз раствора или расплава химического вещества. В растворе присутствует дополнительное химическое вещество — вода, которая может принимать участие в окислительно-восстановительных реакциях.
Катодные процессы
В растворе солей катод притягивает катионы металлов. Катионы металлов могут выступать в качестве окислителей. Окислительные способности ионов металлов различаются. Для оценки окислительно-восстановительных способностей металлов применяют электро-химический ряд напряжений :
Каждый металл характеризуется значением электрохимического потен-циала. Чем меньше потенциал , тем больше восстановительные свойства металла и тем меньше окислительные свойства соответствующего иона этого металла. Разным ионам соответствуют разные значения этого потенциала. Электрохимический потенциал — относительная величина. Электрохимический потенциал водорода принят равным нулю.
Также около катода находятся молекулы воды Н2О. В составе воды есть окислитель — ион H + .
При электролизе растворов солей на катоде наблюдаются следующие закономерности:
1. Если металл в соли — активный ( до Al 3+ включительно в ряду напряжений ), то вместо металла на катоде восстанавливается (разряжается) водород , т.к. потенциал водорода намного больше. Протекает процесс восстановления молекулярного водорода из воды, при этом образуются ионы OH — , среда возле катода — щелочная:
2H2O +2ē → H2 + 2OH —
Например , при электролизе раствора хлорида натрия на катоде будет вос-станавливаться только водород из воды.
2. Если металл в соли – средней активности (между Al 3+ и Н + ) , то на катоде восстанавливается (разряжается) и металл , и водород , так как потенциал таких металлов сравним с потенциалом водорода:
Me n+ + nē → Me 0
2 H + 2O +2ē → H2 0 + 2OH —
Например , при электролизе раствора сульфата железа (II) на катоде будет восстанавливаться (разряжаться) и железо, и водород:
Fe 2+ + 2ē → Fe 0
2 H + 2O +2ē → H2 0 + 2OH —
3. Если металл в соли — неактивный (после водорода в ряду стандартных электрохимических металлов) , то ион такого металла является более сильным окислителем, чем ион водорода, и на катоде восстанавливается только металл:
Me n+ + nē → Me 0
Например, при электролизе раствора сульфата меди (II) на катоде будет восстанавливаться медь:
Cu 2+ + 2ē → Cu 0
4. Если на катод попадают катионы водорода H + , то они и восстанавливаются до молекулярного водорода:
2H + + 2ē → H2 0
Анодные процессы
Положительно заряженный анод притягивает анионы и молекулы воды. Анод – окислитель. В качестве восстановителей выступаю либо анионы кислотных остаток, либо молекулы воды (за счет кислорода в степени окисления -2: H 2 O -2 ).
При электролизе растворов солей на аноде наблюдаются следующие закономерности:
1. Если на анод попадает бескислородный кислотный остаток , то он окисляется до свободного состояния (до степени окисления 0):
неМе n- – nē = неМе 0
Например : при электролизе раствора хлорида натрия на аноде окисляют-ся хлорид-ионы:
2Cl — – 2ē = Cl2 0
Действительно, если вспомнить Периодический закон: при увеличении электроотрицательности неметалла его восстановительные свойства уменьшаются. А кислород – второй по величине электроотрицательности элемент. Таким образом, проще окислить практически любой неметалл, а не кислород. Правда, есть одно исключение . Наверное, вы уже догадались. Конечно же, это фтор. Ведь электроотрицательность фтора больше, чем у кислорода. Таким образом, при электролизе растворов фторидов окисляться будут именно молекулы воды, а не фторид-ионы :
2H2 O -2 – 4ē → O2 0 + 4H +
2. Если на анод попадает кислородсодержащий кислотный остаток, либо фторид-ион , то окислению подвергается вода с выделением молекулярно-го кислорода:
2H2 O -2 – 4ē → O2 0 + 4H +
3. Если на анод попадает гидроксид-ион, то он окисляется и происходит выделение молекулярного кислорода:
4 O -2 H – – 4ē → O2 0 + 2H2O
4. При электролизе растворов солей карбоновых кислот окислению под-вергается атом углерода карбоксильной группы, выделяется углекислый газ и соответствующий алкан.
Например , при электролизе растворов ацетатов выделяется углекислый газ и этан:
2 CH3 C +3 OO – –2ē → 2 C +4 O2+ CH3-CH3
Суммарные процессы электролиза
Рассмотрим электролиз растворов различных солей.
Например , электролиз раствора сульфата меди. На катоде восстанавливаются ионы меди:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются молекулы воды:
Анод (+): 2H2 O -2 – 4ē → O2 + 4H +
Сульфат-ионы в процессе не участвуют. Мы их запишем в итоговом уравнении с ионами водорода в виде серной кислоты:
2 Cu 2+ SO4 + 2H2 O -2 → 2 Cu 0 + 2H2SO4 + O2 0
Электролиз раствора хлорида натрия выглядит так:
На катоде восстанавливается водород:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются хлорид-ионы:
Анод (+): 2 Cl – – 2ē → Cl2 0
Ионы натрия в процессе электролиза не участвуют. Мы записываем их с гидроксид-анионами в суммарном уравнении электролиза раствора хлорида натрия :
2 H + 2O +2Na Cl – → H2 0 + 2NaOH + Cl2 0
Следующий пример : электролиз водного раствора карбоната калия.
На катоде восстанавливается водород из воды:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются молекулы воды до молекулярного кислорода:
Анод (+): 2H2 O -2 – 4ē → O2 0 + 4H +
Таким образом, при электролизе раствора карбоната калия ионы калия и карбонат-ионы в процессе не участвуют. Происходит электролиз воды:
2 H2 + O -2 → 2 H2 0 + O2 0
Еще один пример : электролиз водного раствора хлорида меди (II).
На катоде восстанавливается медь:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются хлорид-ионы до молекулярного хлора:
Анод (+): 2 Cl – – 2ē → Cl2 0
Таким образом, при электролизе раствора карбоната калия происходит электролиз воды:
Cu 2+ Cl2 – → Cu 0 + Cl2 0
Еще несколько примеров: электролиз раствора гидроксида натрия.
На катоде восстанавливается водород из воды:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются гидроксид-ионы до молекулярного кислорода:
Анод (+): 4 O -2 H – – 4ē → O2 0 + 2H2O
Таким образом, при электролизе раствора гидроксида натрия происходит разложение воды, катионы натрия в процессе не участвуют:
2 H2 + O -2 → 2 H2 0 + O2 0
Электролиз расплавов
При электролизе расплава на аноде окисляются анионы кислотных остатков, а на катоде восстанавливаются катионы металлов. Молекул воды в системе нет.
Например: электролиз расплава хлорида натрия. На катоде восстанавли-ваются катионы натрия:
Катод (–): Na + + ē → Na 0
На аноде окисляются анионы хлора:
Анод (+): 2 Cl – – 2ē → Cl2 0
Суммарное уравнение электролиза расплава хлорида натрия:
2 Na + Cl – → 2 Na 0 + Cl2 0
Еще один пример: электролиз расплава гидроксида натрия. На катоде восстанавливаются катионы натрия:
Катод (–): Na + + ē → Na 0
На аноде окисляются гидроксид-ионы:
Анод (+): 4 OH – – 4ē → O2 0 + 2H2O
Суммарное уравнение электролиза расплава гидроксида натрия:
4 Na + OH – → 4 Na 0 + O2 0 + 2H2O
Многие металлы получают в промышленности электролизом расплавов.
Например , алюминий получают электролизом раствора оксида алюминия в расплаве криолита. Криолит – Na3[AlF6] плавится при более низкой температуре (1100 о С), чем оксид алюминия (2050 о С). А оксид алюминия отлично растворяется в расплавленном криолите.
В растворе криолите оксид алюминия диссоциирует на ионы:
На катоде восстанавливаются катионы алюминия:
Катод (–): Al 3+ + 3ē → Al 0
На аноде окисляются алюминат-ионы:
Анод (+): 4Al O 3 3 – – 12ē → 2Al2O3 + 3 O2 0
Общее уравнение электролиза раствора оксида алюминия в расплаве криолита:
2 Al 2 О 3 = 4 Al 0 + 3 О 2 0
В промышленности при электролизе оксида алюминия в качестве электродов используют графитовые стержни. При этом электроды частично окисляются (сгорают) в выделяющемся кислороде:
C 0 + О2 0 = C +4 O2 -2
Электролиз с растворимыми электродами
Если материал электродов выполнен из того же металла, который присут-ствует в растворе в виде соли, или из более активного металла, то на аноде разряжаются не молекулы воды или анионы, а окисляются частицы самого металла в составе электрода.
Например , рассмотрим электролиз раствора сульфата меди (II) с медными электродами.
На катоде разряжаются ионы меди из раствора:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются частицы меди из электрода :
Анод (+): Cu 0 – 2ē → Cu 2+
Правила составления окислительно-восстановительных реакций
Электролиз растворов электролитов с инертными электродами
Напомним, что на катоде протекают процессы восстановления, на аноде — процессы окисления.
Процессы, протекающие на катоде:
В растворе имеются несколько видов положительно заряженных частиц, способных восстанавливаться на катоде:
1) Катионы металла восстанавливаются до простого вещества, если металл находится в ряду напряжений правее алюминия (не включая сам Al). Например:
Zn 2+ +2e → Zn 0 .
2) В случае раствора соли или щелочи: катионы водорода восстанавливаются до простого вещества, если металл находится в ряду напряжений металлов до H2:
2H2O + 2e → H2 0 + 2OH – .
Например, в случае электролиза растворов NaNO3 или KOH.
3) В случае электролиза раствора кислоты: катионы водорода восстанавливаются до простого вещества:
2H + +2e → H2.
Например, в случае электролиза раствора H2SO4.
Процессы, протекающие на аноде:
На аноде легко окисляются кислотные остатки не содержащие кислород. Например, галогенид-ионы (кроме F – ), сульфид-анионы, гидроксид-анионы и молекулы воды:
1) Галогенид-анионы окисляются до простых веществ:
2Cl – – 2e → Cl2.
2) В случае электролиза раствора щелочи в гидроксид-анионах кислород окисляется до простого вещества. Водород уже имеет степень окисления +1 и не может быть окислен дальше. Также будет выделение воды — почему? Потому что больше ничего написать и не получится: 1) H + написать не можем, так как OH – и H + не могут стоять по разные стороны одного уравнения; 2) H2 написать также не можем, так как это был бы процесс восстановления водорода (2H + +2e → H2), а на аноде протекают только процессы окисления.
4OH – – 4e → O2 + 2H2O.
3) Если в растворе есть анионы фтора или любые кислородсодержащие анионы, то окислению будет подвергаться вода с подкислением прианодного пространства согласно следующему уравнению:
2H2O – 4e → O2 + 4H + .
Такая реакция идет в случае электролиза растворов кислородсодержащих солей или кислородсодержащих кислот. В случае электролиза раствора щелочи окисляться будут гидроксид-анионы согласно правилу 2) выше.
4) В случае электролиза раствора соли органической кислоты на аноде всегда происходит выделение CO2 и удвоение остатка углеродной цепи:
2R-COO – – 2e → R-R + 2CO2.
Примеры:
1. Раствор NaCl
Расписываем диссоциацию на ионы:
NaCl → Na + + Cl –
Металл Na стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу выше, на катоде восстанавливается водород. Хлорид-анионы будут окисляться на аноде до простого вещества:
К: 2Na + (в растворе)
2H2O + 2e → H2 0 + 2OH –
А: 2Cl – – 2e → Cl2
Коэффициент 2 перед Na + появился из-за наличия аналогичного коэффициента перед хлорид-ионами, так как в соли NaCl их соотношение 1:1.
Проверяем, что количество принимаемых и отдаваемых электронов одинаковое, и суммируем левые и правые части катодных и анодных процессов:
2Na + + 2Cl – + 2H2O → H2 0 + 2Na + + 2OH – + Cl2. Соединяем катионы и анионы:
2NaCl + 2H2O → H2 0 + 2NaOH + Cl2.
2. Раствор Na2SO4
Расписываем диссоциацию на ионы:
Na2SO4 → 2Na + + SO4 2–
Натрий стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу выше, на катоде восстанавливается только водород. Сульфат-анионы содержат кислород, поэтому окисляться не будут, также оставаясь в растворе. Согласно правилу выше, в этом случае окисляются молекулы воды:
К: 2H2O + 2e → H2 0 + 2OH –
А: 2H2O – 4e → O2 0 + 4H + .
Уравниваем число принимаемых и отдаваемых электронов на катоде и аноде. Для этого необходимо умножить все коэффициенты катодного процесса на 2:
К: 4H2O + 4e → 2H2 0 + 4OH –
А: 2H2O – 4e → O2 0 + 4H + .
Складываем левые и правые части катодных и анодных процессов:
6H2O → 2H2 0 + 4OH – + 4H + + O2 0 .
4OH- и 4H+ соединяем в 4 молекулы H2O:
6H2O → 2H2 0 + 4H2O + O2 0 .
Сокращаем молекулы воды, находящиеся по обе стороны уравнения, т.е. вычитаем из каждой части уравнения 4H2O и получаем итоговое уравнение гидролиза:
2H2O → 2H2 0 + O2 0 .
Таким образом, гидролиз растворов кислородсодержащих солей активных металлов (до Al включительно) сводится к гидролизу воды, так как ни катионы металлов, ни анионы кислотных остатков не принимают участие в окислительно-восстановительных процессах, протекающих на электродах.
3. Раствор CuCl2
Расписываем диссоциацию на ионы:
CuCl2 → Cu 2+ + 2Cl –
Медь находится в ряду напряжений металлов после водорода, следовательно, только она будет восстанавливаться на катоде. На аноде будут окисляться только хлорид-анионы.
К: Cu 2+ + 2e → Cu 0
A: 2Cl – – 2e → Cl2
Записываем суммарное уравнение:
CuCl2 → Cu 0 + Cl2.
4. Раствор CuSO4
Расписываем диссоциацию на ионы:
CuSO4 → Cu 2+ + SO4 2–
Медь находится в ряду напряжений металлов после водорода, следовательно, только она будет восстанавливаться на катоде. На аноде будут окисляться молекулы воды, так как кислородсодержащие кислотные остатки в растворах на аноде не окисляются.
К: Cu 2+ + 2e → Cu 0
A: SO4 2– (в растворе)
2H2O – 4e → O2 + 4H + .
Уравниваем количество электронов на катоде и аноде. Для это умножим все коэффициенты катодного уравнения на 2. Количество сульфат-ионов также необходимо удвоить, так как в сульфате меди соотношение Cu 2+ и SO4 2– 1:1.
К: 2Cu 2+ + 4e → 2Cu 0
A: 2SO4 2– (в растворе)
2H2O – 4e → O2 + 4H + .
Записываем суммарное уравнение:
2Cu 2+ + 2SO4 2– + 2H2O → 2Cu 0 + O2 + 4H + + 2SO4 2– .
Соединив катионы и анионы, получаем итоговое уравнение электролиза:
2CuSO4 + 2H2O → 2Cu 0 + O2 + 2H2SO4.
5. Раствор NiCl2
Расписываем диссоциацию на ионы:
NiCl2 → Ni 2+ + 2Cl –
Никель находится в ряду напряжений металлов после алюминия и до водорода, следовательно, на катоде будут восстанавливаться и металл, и водород. На аноде будут окисляться только хлорид-анионы.
К: Ni 2+ + 2e → Ni 0
2H2O + 2e → H2 0 + 2OH –
A: 2Cl – – 2e → Cl2
Уравниваем количество электронов, принимаемых и отдаваемых на катоде и аноде. Для этого умножаем все коэффициенты анодного уравнения на 2:
К: Ni 2+ + 2e → Ni 0
2H2O + 2e → H2 0 + 2OH –
Ni 2+ (в растворе)
A: 4Cl – – 4e → 2Cl2
Замечаем, что согласно формуле NiCl2, соотношение атомов никеля и хлора 1:2, следовательно, в раствор необходимо добавить Ni 2+ для получения общего количества 2NiCl2. Также это необходимо сделать, так как в растворе должны присутствовать противоионы для гидроксид-анионов.
Складываем левые и правые части катодных и анодных процессов:
Ni 2+ + Ni 2+ + 4Cl – + 2H2O → Ni 0 + H2 0 + 2OH – + Ni 2+ + 2Cl2.
Соединяем катионы и анионы для получения итогового уравнения электролиза:
2NiCl2 + 2H2O → Ni 0 + H2 0 + Ni(OH)2 + 2Cl2.
6. Раствор NiSO4
Расписываем диссоциацию на ионы:
NiSO4 → Ni 2+ + SO4 2–
Никель находится в ряду напряжений металлов после алюминия и до водорода, следовательно, на катоде будут восстанавливаться и металл, и водород. На аноде будут окисляться молекулы воды, так как кислородсодержащие кислотные остатки в растворах на аноде не окисляются.
К: Ni 2+ + 2e → Ni 0
2H2O + 2e → H2 0 + 2OH –
A: SO4 2– (в растворе)
2H2O – 4e → O2 + 4H + .
Проверяем, что количество принятых и отданных электронов совпадает. Также замечаем, что в растворе есть гидроксид-ионы, но в записи электродных процессов для них нет противоионов. Следовательно, нужно добавить в раствор Ni 2+ . Так как удвоилось количество ионов никеля, необходимо удвоить и количество сульфат-ионов:
К: Ni 2+ + 2e → Ni 0
2H2O + 2e → H2 0 + 2OH –
Ni 2+ (в растворе)
A: 2SO4 2– (в растворе)
2H2O – 4e → O2 + 4H + .
Складываем левые и правые части катодных и анодных процессов:
Ni 2+ + Ni 2+ + 2SO4 2– + 2H2O + 2H2O → Ni 0 + Ni 2+ + 2OH – + H2 0 + O2 0 + 2SO4 2– + 4H + .
Соединяем катионы и анионы и записываем итоговое уравнение электролиза:
2NiSO4 + 4H2O → Ni 0 + Ni(OH)2 + H2 0 + O2 0 + 2H2SO4.
В других источниках литературы также говорится об альтернативном протекании электролиза кислородсодержащих солей металлов средней активности. Разница состоит в том, что после сложения левых и правых частей процессов электролиза необходимо соединить H + и OH – с образованием двух молекул воды. Оставшиеся 2H + расходуются на образование серной кислоты. В этом случае не нужно прибавлять дополнительные ионы никеля и сульфат-ионы:
Ni 2+ + SO4 2– + 2H2O + 2H2O → Ni 0 + 2OH – + H2 0 + O2 0 + SO4 2– + 4H + .
Ni 2+ + SO4 2– + 4H2O → Ni 0 + H2 0 + O2 0 + SO4 2– + 2H + + 2H2O.
NiSO4 + 2H2O → Ni 0 + H2 0 + O2 0 + H2SO4.
7. Раствор CH3COONa
Расписываем диссоциацию на ионы:
CH3COONa → CH3COO – + Na +
Натрий стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу выше, на катоде восстанавливается только водород. На аноде будет происходит окисление ацетат-ионов с образованием углекислого газа и удвоением остатка углеродной цепи:
К: 2Na + (в растворе)
2H2O + 2e → H2 0 + 2OH –
А: 2CH3COO – – 2e → CH3-CH3 + CO2
Так как количества электронов в процессах окисления и восстановления совпадают, составляем суммарное уравнение:
2Na + + 2CH3COO – + 2H2O → 2Na + + 2OH – + H2 0 + CH3-CH3 + CO2
Соединяем катионы и анионы:
2CH3COONa + 2H2O → 2NaOH + H2 0 + CH3-CH3 + CO2.
8. Раствор H2SO4
Расписываем диссоциацию на ионы:
H2SO4 → 2H + + SO4 2–
Из катионов в растворе присутствуют только катионы H+, они и будут восстанавливаться до простого вещества. На аноде будет протекать окисление воды, так как кислород содержащие кислотные остатки в растворах на аноде не окисляются.
К: 2H + +2e → H2
A: 2H2O – 4e → O2 + 4H +
Уравниваем число электронов. Для этого удваиваем каждый коэффициент в уравнении катодного процесса:
К: 4H + +4e → 2H2
A: 2H2O – 4e → O2 + 4H +
Суммируем левые и правые части уравнений:
4H + + 2H2O → 2H2 + O2 + 4H +
Катионы H + находятся в обеих частях реакции, следовательно, их нужно сократить. Получаем, что в случае растворов кислот, электролизу подвергаются только молекулы H2O:
2H2O → 2H2 + O2.
9. Раствор NaOH
Расписываем диссоциацию на ионы:
NaOH → Na + + OH –
Натрий стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу, на катоде восстанавливается только водород. На аноде будут окисляться гидроксид-анионы с образованием кислорода и воды:
К: Na+ (в растворе)
2H2O + 2e → H2 0 + 2OH –
А: 4OH – – 4e → O2 + 2H2O
Уравниваем число электронов, принимаемых и отдаваемых на электродах:
К: Na + (в растворе)
4H2O + 4e → 2H2 0 + 4OH –
А: 4OH – – 4e → O2 + 2H2O
Суммируем левые и правые части процессов:
4H2O + 4OH – → 2H2 0 + 4OH – + O2 0 + 2H2O
Сокращая 2H2O и ионы OH – , получаем итоговое уравнение электролиза:
2H2O → 2H2 + O2.
Вывод:
При электролизе растворов 1) кислородсодержащих кислот;
2) щелочей;
3) солей активных металлов и кислородсодержащих кислот
на электродах протекает электролиз воды:
2H2O → 2H2 + O2.
Составление электронных уравнений анодного и катодного процессов происходящих при коррозии
Решение задач на коррозию металлов
Задание 287.
Составьте электронные уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары магний — никель. Какие продукты коррозии образуются в первом и во втором случаях?
Решение:
Магний имеет более электроотрицательный стандартный электродный потенциал (-2,36 В), чем никель (-0,24 В), поэтому он является анодом, никель – катодом.
Анодный процесс – окисление металла: Mе 0 — 2 = Mе n+
и катодный процесс – восстановление ионов водорода (водородная деполяризация) или молекул кислорода (кислородная деполяризация). Поэтому при коррозии пары Mg — Ni с водородной деполяризацией происходит следующие процессы:
Анодный процесс: Mg 0 — 2 = Mg 2+
Катодный процесс: в кислой среде: 2Н + + 2 = Н2↑
Продуктом коррозии будет газообразный водород соединение магния с кислотным остатком (соль).
При коррозии пары Mg — Ni в атмосферных условиях на катоде происходит кислородная деполяризация, а на аноде – окисление магния:
Анодный процесс: Mg 0 — 2 = Mg 2+
Катодный процесс: в нейтральной среде: 1/2O2 + H2O + 2 = 2OH —
в нейтральной или в щелочной среде: 1/2O 2 + H 2 O + 2 = 2OH —
Так как ионы Mg 2+ с гидроксид-ионами ОН — образуют нерастворимый гидроксид, то продуктом коррозии будет Mg(OH)2.
Задание 288.
В раствор хлороводородной (соляной) кислоты поместили цинковую пластинку и цинковую пластинку, частично покрытую медью. В каком случае процесс коррозии цинка происходит интенсивнее? Ответ мотивируйте, составив электронные уравнения соответствующих процессов.
Решение:
а) При помещении цинковой пластинки в раствор хлороводородной (соляной) кислоты происходит реакция замещения:
Через некоторое время цинковая пластинка в растворе разбавленной соляной кислоте пассивируется оксидной плёнкой, образующейся при взаимодействии цинка с кислородом растворённым в воде по схеме: Zn + 1/2 O2 = ZnO, поэтому коррозия цинка вскоре замедлится.
б) При помещении цинковой пластинки, частично покрытой медью, в раствор соляной кислоты образуется гальваническая пара Zn — Cu, в которой цинк будет анодом, а медь – катодом. Происходит это так, потому что цинк имеет более электроотрицательный электродный потенциал (-0,763 В), чем медь (+0-,34 В).
Анодный процесс: Zn 0 — 2 = Zn 2+ ;
Катодный процесс: в кислой среде: 2Н + + 2 = Н2↑
Ионы цинка Zn 2+ с ионами хлора Cl — будут давать соль ZnCl2 – сильный электролит, а водород будет интенсивно выделяться в виде пузырьков газа. Этот процесс будет бурно протекать до тех пор пока не закончится приход ионов водорода Н + соляной кислоты или пока полностью не растворится цинковая пластинка. Ионно-молекулярное уравнение коррозии:
Zn 0 + 2H + = Zn 2+ + H2О↑
Молекулярная форма уравнения:
Задание 289.
Почему химически чистое железо более стойко против коррозии, чем техническое железо? Составьте электронные уравнения анодного и катодного процессов происходящих при коррозии технического железа во влажном воздухе и в кислой среде.
Решение:
Химически чистое железо более стойко к коррозии, потому что с кислородом образует на поверхности оксидную плёнку, которая препятствует дальнейшему разрушению металла. Техническое железо содержит примеси различных металлов и неметаллов, которые образуют различные гальванические пары железо — примесь. Железо, имея отрицательный стандартный электродный потенциал (-0,44 В) со многими примесями, потенциал которых значительно положительнее, является анодом, а примеси – катодом:
Анодный процесс: Fe 0 -2 = Fe 2+
Катодный процесс: в кислой среде: 2Н + + 2 = Н2 ↑
в нейтральной или в щелочной среде: 1/2O2 + H2O + 2 = 2OH —
Так как ионы Fe 2+ с гидроксильной группой образуют нерастворимый гидроксид, то продуктом атмосферной коррозии железа будет Fe(OH)2. При контакте с кислородом воздуха Fe(OH)2 быстро окисляется до метагидроксида железа FeO(OH), приобретая характерный для него бурый цвет:
http://chemrise.ru/theory/inorganic_11/electrolysis_solution_11
http://buzani.ru/zadachi/khimiya-shimanovich/952-elektronnye-uravneniya-anodnogo-i-katodnogo-protsessov-zadachi-287-289
Электролиз
–
совокупность окислительно-восстановительных
процессов, происходящих на электродах
при прохождении постоянного электрического
тока через раствор или расплав
электролита.
Анод
(А) – это электрод, на котором происходит
процесс окисления. Катод (К) – электрод,
на котором происходит процесс
восстановления. При электролизе катод
подключается к отрицательному полюсу
источника тока, а анод – к положительному.
Рассмотрим
сущность процесса на примере электролиза
расплава
NaОН
с угольными электродами. В расплавах,
как и в растворах, молекулы электролитов
диссоциируют на ионы:
NaОН
Na+
+ ОН–.
Прохождение
электрического тока вызывает направленное
перемещение ионов. Катионы натрия Na+
движутся к катоду и принимают от него
электроны:
Анионы
ОН–
подходят к аноду и отдают электроны:
Суммарная
реакция электролиза расплава вещества
NaОН
представлена суммой двух электродных
процессов и выражается уравнением:
Электролиз
расплавов солей или оксидов используют
в технике для получения активных
металлов (Li,
Na,
K,
Ca,
Al).
В
водных
растворах,
кроме ионов самого электролита, находятся
молекулы воды, которые также могут
участвовать в процессах окисления и
восстановления на электродах.
Для
определения результатов электролиза
растворов
можно пользоваться следующими правилами.
11.1 Катодные процессы
На
катоде легче восстанавливаются катионы
с бóльшим стандартным электродным
потенциалом φ0.
Так,
если стандартный электродный потенциал
металла больше величины –0,41 В, то на
катоде обычно восстанавливаются
ионы этого металла. Если потенциал
металла находится в интервале

то на катоде одновременно восстанавливаются
и ионы металла, и вода. Если потенциал
металла меньше величины –1,4 В, то на
катоде восстанавливается только вода.
Отмеченное выше можно представить в
виде следующей схемы:
11.2 Анодные процессы
Аноды,
используемые при электролизе,
подразделяются на инертные
(графит,
уголь, платина, золото, иридий) и активные
(остальные металлы).
На аноде в первую
очередь окисляется система с меньшим
окислительно-восстановительным
потенциалом. Но в ряде случаев из-за
сложности разряда кислородосодержащих
ионов (NO–3,SO2–4,PO3–4,CO2–3и т. д.)
это правило не выполняется. Вид анодной
реакции в общем случае определяется
природой разряжающей частицы.
В случае
использования активного(растворимого)
анода окисляется металл анода:
Ме0–nē = Меn+.
При электролизе
с инертныманодом легко окисляются
простые анионы бескислородных кислот,
присутствующие в растворе (I–,Br–,Cl–).
Сложные ионы
кислородсодержащих кислот (SO,CO
,PO
и др.) в водных растворах, как правило,
не окисляются – вместо них окисляется
вода:
2Н2О – 4ē = О2+ 4Н+.
Последовательность
процессов окисления на аноде можно
представить следующей схемой:
Пример 1.Составить уравнения катодного и анодного
процессов, протекающих при электролизе
водного раствораK2SO4на угольных электродах.
Решение
В водном растворе
соль K2SO4диссоциирует:K2SO4
2К++SO2–4
.
К катоду подходят
катионы К+и молекулы Н2О,
к аноду – ионыSO2–4и молекулы Н2О. Поскольку потенциал
системы(см. табл. 9.1) меньше, чем –1,4 В, на катоде
будут восстанавливаться молекулы воды
(см. вышеприведенную схему).
Анионы SO2–4– это сложные ионы, в водных растворах
они не окисляются. Поэтому на аноде
окисляются молекулы воды.
Раствор у катода
подщелачивается (появляются ионы ОН–),
у анода становится более кислым
(появляются ионы Н+). Суммарное
молекулярное уравнение реакции
электролиза:
КОН
и Н2SO4
образуются из К+
и ОН–,
Н+
и SO2–4,
находящихся в растворе.
Пример 2.Составить уравнения катодного и анодного
процессов, протекающих при электролизе
раствораCuCl2с
медным анодном.
Решение
В водном растворе
соль CuCl2диссоциирует:CuCl2 Сu2++ 2Cl–.
К катоду подходят
катионы Сu2+и Н2О;
к аноду – ионыCl–и Н2О. Медный анод – растворимый,
он принимает участие в электродной
реакции. Потенциал φ0Сu/Cu2+= 0,34 В, и на катоде, в соответствии с
вышеприведенной схемой, будет
восстанавливаться Сu2+.
В анодном процессе участвует металл
анода (Cu-растворимый
анод):
В результате
электролиза медь переносится с анода
на катод, а соль оказывается не затронутой
этим процессом и обеспечивает лишь
электропроводность.
Количественная
характеристика процессов электролиза
даётся законамиФарадея. Им
можно дать следующую общую формулировку:
масса электролита,
подвергшаяся превращению при электролизе,
а также массы образующихся на
электродах веществ прямо пропорциональны
количеству электричества, прошедшего
через раствор или расплав электролита,
и эквивалентным массам соответствующих
веществ.
Объединенный закон
Фарадея выражается следующим уравнением:
,
где А– атомная масса вещества простого
вещества, выделяющегося на электроде;
n– заряд
иона или число электронов, принимающих
участие в процессе электролиза;
I–
сила тока в амперах, А;
t–
время пропускания тока в секундах, с;
F– число
Фарадея (F= 96 500 Кл/моль).
Эквивалентная масса вещества
.
Поскольку обычно имеются
конкурирующие процессы, законы Фарадея
нуждаются в поправках.
Отношение массы
фактически выделившегося на электроде
вещества mпр.
к массе вещества, которая должна
была выделиться в соответствии с законом
Фарадея, называется выходом по току:

Пример 3.
При прохождении электрического тока
силой 1 А через растворFeCl2
(электроды инертные) в течение 1 ч
выделилось 0,90 г железа. Определите
выход по току. На какие процессы
расходуется остальной ток?
Решение
Так как атомная масса Feравна 56 г/моль, то в соответствии с
законом Фарадея теоретическое значение
массы железа, выделяющегося на катоде,
составляет:

Выход по току:

Обратимся к
схеме процессов на катоде. Поскольку
величина лежит в области –1,4 В < φ < –0,41 В, то
на катоде идет совместное восстановление
ионов железаFe2+ и
молекул воды. Преимущественно
восстанавливаются ионыFe2+:
Fe2+ + 2ē =Fe
и,
частично, молекулы воды:
2Н2O + 2ē = Н2↑ + 2OH–.
Таким образом,
часть тока, протекающая через электролит,
затрачивается на восстановление воды.
Пример 4.Электрический ток силой 1 А проходит в
течение 1 часа через растворZnCl2(электроды инертные). Определить
количество выделившегося на катоде
за указанное время цинка, если выход
по току равен
64%. Объяснить, на какие процессы
расходуется остальной ток.
Решение
Потенциал
В
(см. табл. 9.1) и лежит в области
–1,4 В
<<0,41
В. Следовательно, на катоде будет идти
совместное восстановление катионовZn2+и, частично,
молекул воды:
Zn2++ 2ē =Zn
2H2O+ 2ē = 2OH+H2(частично, побочный процесс)
Для определения
теоретического количества выделившегося
на катоде цинка воспользуемся уравнением
закона Фарадея:
г.
Выход по току
вычисляется по формуле
следовательно

На получение
цинка на катоде расходуется 64 % всего
прошедшего через электролит тока,
остальной ток тратится на восстановление
воды.
Задачи
271–277Составьте
электронные уравнения процессов,
протекающих на катоде и аноде при
электролизе:
1) расплава
вещества А с графитовыми электродами;
2) раствора
вещества Б с графитовыми электродами;
3) раствора
вещества В с растворимым (активным)
анодом.
Масса твердого
вещества, выделившегося на катоде при
электролизе раствора вещества Б при
прохождении тока I(А) в течение времени τ (ч), составляетm (г). Вычислите
выход по току. Объясните, почему в ряде
случаев не весь ток расходуется на
выделение металла.
|
№ задачи |
Соединения |
Растворимый |
I, |
τ, час |
m, |
||
|
А |
Б |
В |
|||||
|
271 |
KCl |
SnCl2 |
ZnSO4 |
Zn |
8,5 |
2 |
36,6 |
|
272 |
FeCl2 |
ZnSO4 |
MgCl2 |
Mg |
10 |
1,5 |
11,3 |
|
273 |
NaOH |
FeCl2 |
MnSO4 |
Mn |
12 |
0,5 |
4,2 |
|
274 |
PbCl2 |
Cu(NO3)2 |
FeCl2 |
Fe |
6 |
1 |
7,1 |
|
275 |
Ca(OH)2 |
NiCl2 |
AlCl3 |
Al |
9,3 |
2 |
18,8 |
|
276 |
LiBr |
MnSO4 |
CoCl2 |
Co |
10,5 |
0,5 |
3,0 |
|
277 |
SnCl2 |
FeSO4 |
Pb(NO3)2 |
Pb |
8,8 |
2 |
14,2 |
Ответ:
271) 97 %; 272) 62 %; 273) 67 %; 274) 99 %; 275) 91,9 %;
276)
55,8 %; 277) 77,3 %.
278–284.Составьте электронные
уравнения процессов, протекающих на
катоде и аноде при электролизе:
1) расплава
вещества А с графитовыми электродами;
2) раствора
вещества Б с графитовыми электродами;
3) раствора
вещества В с растворимым (активным)
анодом.
Вычислите
время, необходимое для практического
получения 100 г металла из раствора
вещества Б при силе тока I, если выход по току.
|
№ задачи |
Вещества |
Растворимый |
I, |
, |
||
|
А |
Б |
В |
||||
|
278 |
SnCl2 |
Fe(NO3)2 |
NiSO4 |
Ni |
12 |
66,7 |
|
279 |
Ni(OH)2 |
CoCl2 |
Pb(NO3)2 |
Pb |
9,5 |
96 |
|
280 |
MgCl2 |
ZnSO4 |
NiSO4 |
Zn |
6,4 |
82 |
|
281 |
ZnCl2 |
AgNO3 |
CuCl2 |
Cu |
14,8 |
99 |
|
282 |
CuBr2 |
Cd(NO3)2 |
AgNO3 |
Ag |
8,7 |
86 |
|
283 |
NaOH |
Pb(NO3)2 |
NiCl2 |
Ni |
5,9 |
94 |
|
284 |
PbCl2 |
CоSO4 |
Mg(NO3)2 |
Mg |
10 |
74 |
Ответ:
278) 12 ч; 279) 10 ч; 280) 17,3 ч; 281) 1,7 ч; 282) 6,4 ч; 283)
4,7 ч; 284) 12,3 ч.
285–291Составьте электронные
уравнения процессов, протекающих на
катоде и аноде при электролизе:
1) расплава
вещества А с графитовыми электродами;
2) раствора
вещества Б с графитовыми электродами;
3) раствора
вещества В с растворимым (активным)
анодом.
Как изменится
масса анода после пропускания тока
силой I(А) в течение
времени τ (ч) через раствор В?
|
№ задачи |
Вещества |
Растворимый |
I, |
τ, |
||
|
А |
Б |
В |
||||
|
285 |
NaI |
MgSO4 |
ZnCl2 |
Zn |
8,5 |
2 |
|
286 |
CaCl2 |
Cu(NO3)2 |
FeCl2 |
Fe |
10 |
3 |
|
287 |
RbCl |
AgNO3 |
CuSO4 |
Cu |
7,5 |
2,5 |
|
288 |
KOH |
ZnCl2 |
CoCl2 |
Co |
3,7 |
1 |
|
289 |
CuCl2 |
NaNO3 |
Pb(NO3)2 |
Pb |
2,5 |
4 |
|
290 |
NaOH |
Bi(NO3)3 |
NiCl2 |
Ni |
2,0 |
2,5 |
|
291 |
CaI2 |
H2SO4 |
Cd(NO3)2 |
Cd |
6,8 |
0,8 |
Ответ:
285) 20,6 г; 286) 31,3 г; 287) 22,4 г; 288) 4,1 г; 289) 38,6 г;
290) 5,5 г; 291) 7,1 г.
292–300Составьте электронные
уравнения процессов, протекающих на
катоде и аноде при электролизе:
1) расплава
вещества А с графитовыми электродами;
2) раствора
вещества Б с графитовыми электродами;
3) раствора
вещества В с растворимым (активным)
анодом.
Постройте
график зависимости изменения массы
растворимого анода mот силы токаIпри
времени электролиза 0,5 ч. Сила токаIравна 0,5; 1; 2; 3 и 5 А.
|
№ задачи |
Соединения |
Растворимый |
||
|
А |
Б |
В |
||
|
292 |
KOH |
Na2SO4 |
NiCl2 |
Ni |
|
293 |
RbCl |
Li2SO4 |
Pb(NO3)2 |
Pb |
|
294 |
NaCl |
Ni(NO3)2 |
AgNO3 |
Ag |
|
295 |
AlCl3 |
Fe2(SO4)3 |
CuSO4 |
Cu |
|
296 |
NaI |
Cu(NO3)2 |
ZnCl2 |
Zn |
|
297 |
SnCl2 |
CoSO4 |
CuSO4 |
Cu |
|
298 |
CoCl2 |
BiСl3 |
AgNO3 |
Ag |
|
№ задачи |
Соединения |
Растворимый |
||
|
А |
Б |
В |
||
|
299 |
KCl |
SnCl2 |
ZnSO4 |
Zn |
|
300 |
NaI |
Cu(NO3)2 |
PbCl2 |
310 |
Рис.
11.1. Структурно-логическая схема
взаимосвязи электродных процессов при
электролизе
Анодный процесс
Cтраница 1
Анодный процесс сводится к электрохимической реакции образования высшего оксида никеля, который на второй стадии вступает в химическое взаимодействие с адсорбированными органическими соединениями. Для изготовления активных электродов из оксидов никеля применяют технологию, разработанную для производства положительных безламельных пластин щелочных аккумуляторов. Электроды получают путем прессования смеси: карбонильного никеля и карбоната аммония с последующим спеканием при температуре 920 — 950 С. В результате разложения карбоната аммония и удаления из основы диоксида углерода получается пористая заготовка ( объемная пористость 70 %), которая пропитывается раствором нитрата никеля и потом обрабатывается раствором щелочи.
[1]
Анодный процесс, повидимому, протекает следующим образом.
[2]
Анодный процесс при цинковании обладает некоторыми особенностями. В кислых ваннах анодный выход по, току даже превышает 100 % за счет химического растворения; кислотность раствора понижается.
[3]
Анодный процесс при никелировании связан с двумя осложнениями. Во-первых, никелевые аноды дают шлам, состоящий из углерода, кремния, сернистых соединений, окислов и др. Взмучиваясь в электролите и попадая на катод, они загрязняют осадок. Приходится заключать аноды в суконные чехлы или фильтровать электролит. Следует применять аноды из возможно более чистого электролитического никеля. Во-вторых, никель склонен к пассивированию. Пассивные аноды перестают растворяться, начинается выделение кислорода с образованием в растворе серной кислоты, кислотность электролита повышается. Отдельные кристаллы никеля пассивируются в различной степени; одни кристаллы растворяются легко, другие остаются нерастворенными и выкрашиваются, опадая в шлам.
[4]
Анодный процесс в целом принимает относительно простую форму, когда ионы металла остаются в растворе. И в этом случае, естественно, возникает концентрационная поляризация, но она не достигает больших значений и может быть уменьшена путем перемешивания. Если же растворение потребует значительной энергии активации, то может установиться очень сильная поляризация. Энергия активации связана с плотностью тока обмена, соответствующего равновесному потенциалу. Для большинства электродов ток обмена относительно велик ( 10 1 — 10 — 5 А / см2), что указывает на малую величину энергии активации процесса растворения. Для растворения таких металлов ( например, свинца) достаточно очень слабого перенапряжения активации, при растворении они очень мало поляризуются.
[5]
Анодный процесс характеризуется выделением ионов металла трубопроводов в окружающую среду с одновременным выходом из металла свободных электронов. Катодный процесс характеризуется тем, что положительно заряженные ионы металла, соприкасаясь с отрицательно заряженными частицами электролита, образуют нейтральные молекулы. В почвах большой кислотности катодный процесс сопровождается водородной поляризацией с выделением нейтральных атомов и молекул воды. Электроны, освободившиеся в результате анодного процесса, перемещаются в металле от анодных зон к катодным, где присоединяются к положительно заряженным ионам электролита и нейтрализует их. При этом возникает движение электронов — электрический ток коррозии. На всем протяжении трубопроводов возникает множество мелких гальванических пар-элементов, что вызывает разрушение металла и переход его в почву.
[6]
Анодный процесс состоит в том, что ионы металла переходят в раствор почвенного электролита, где происходит их гидратация. В результате на анодных участках происходит разрушение металла вследствие выноса ионов металла в почву. При этом в металле эквивалентное количество электронов переходит на катод.
[7]
Анодный процесс протекает на участках с более отрицательным начальным потенциалом поверхности, катодный — с более положительным. Материальный эффект процесса коррозионного разрушения металла преобладает на анодных участках, так как из сооружения уносятся ионы железа в почву.
[8]
Анодный процесс в этом случае остается тем же, что и в первом примере.
[9]
Анодные процессы в некоторых случаях похожи на катодные, но протекают в обратном порядке. В других случаях первичным является разряд и дегидратация анионов, которые затем либо вторично влияют на металл катода, либо выделяются в виде газа.
[10]
Анодный процесс по существу очень прост и для него нет оснований прибегать к гипотезе о первичном выделении кислорода.
[11]
Анодный процесс в обычных для котельной практики условиях всегда протекает с большей готовностью и по этой причине не лимитирует хода всего разрушения. Точно так же не оказывает заметного действия на развитие коррозии электропроводность металла и водной среды; в данном случае приходится иметь дело с короткозамкнутыми, полностью заполя-ризованными микропарами, в которых омическое сопротивление играет второстепенную роль.
[12]
Анодный процесс связан с разрывом связей решетки, а катодный — с выделением дырок. Поэтому травление с анодным контролем на разных участках происходит с различной скоростью. Там, где имеются дислокации или другие нарушения структуры, ослабляющие связи решетки, там скорость травления больше. Поэтому травители с анодным контролем применяются для выявления дислокаций на поверхности полупроводника.
[13]
Анодный процесс при электроэкстракции совершенно иной, чем при электролитическом рафинировании — он проводится с нерастворимыми ( преимущественно свинцовыми) анодами.
[14]
Анодный процесс сопровождается образованием шлама. Количество шлама достигает 2 — 5 % от веса растворившихся анодов. Шлам состоит из содержащихся в анодах сульфидов, окислов, шлаковых и других включений, а также содержит металлы платиновой группы, которые, являясь значительно более электроположительными, чем никель, не растворяются на аноде. В шлам переходит до 1 % от содержания в анодах никеля, кобальта и железа и 5 — 20 % меди. Основными компонентами шлама являются сульфиды этих металлов. При электролизе металлических анодов содержащиеся в них примеси сульфидов почти не растворяются, поэтому переход металлов в шлам и количество последнего резко возрастают с увеличением содержания серы в металлических анодах.
[15]
Страницы:
1
2
3
4
5
Электролиз растворов электролитов с инертными электродами
Напомним, что на катоде протекают процессы восстановления, на аноде — процессы окисления.
Процессы, протекающие на катоде:
В растворе имеются несколько видов положительно заряженных частиц, способных восстанавливаться на катоде:
1) Катионы металла восстанавливаются до простого вещества, если металл находится в ряду напряжений правее алюминия (не включая сам Al). Например:
Zn2+ +2e → Zn0.
2) В случае раствора соли или щелочи: катионы водорода восстанавливаются до простого вещества, если металл находится в ряду напряжений металлов до H2:
2H2O + 2e → H20 + 2OH–.
Например, в случае электролиза растворов NaNO3 или KOH.
3) В случае электролиза раствора кислоты: катионы водорода восстанавливаются до простого вещества:
2H+ +2e → H2.
Например, в случае электролиза раствора H2SO4.
Процессы, протекающие на аноде:
На аноде легко окисляются кислотные остатки не содержащие кислород. Например, галогенид-ионы (кроме F–), сульфид-анионы, гидроксид-анионы и молекулы воды:
1) Галогенид-анионы окисляются до простых веществ:
2Cl– – 2e → Cl2.
2) В случае электролиза раствора щелочи в гидроксид-анионах кислород окисляется до простого вещества. Водород уже имеет степень окисления +1 и не может быть окислен дальше. Также будет выделение воды — почему? Потому что больше ничего написать и не получится: 1) H+ написать не можем, так как OH– и H+ не могут стоять по разные стороны одного уравнения; 2) H2 написать также не можем, так как это был бы процесс восстановления водорода (2H+ +2e → H2), а на аноде протекают только процессы окисления.
4OH– – 4e → O2 + 2H2O.
3) Если в растворе есть анионы фтора или любые кислородсодержащие анионы, то окислению будет подвергаться вода с подкислением прианодного пространства согласно следующему уравнению:
2H2O – 4e → O2 + 4H+.
Такая реакция идет в случае электролиза растворов кислородсодержащих солей или кислородсодержащих кислот. В случае электролиза раствора щелочи окисляться будут гидроксид-анионы согласно правилу 2) выше.
4) В случае электролиза раствора соли органической кислоты на аноде всегда происходит выделение CO2 и удвоение остатка углеродной цепи:
2R-COO– – 2e → R-R + 2CO2.
Примеры:
1. Раствор NaCl
Расписываем диссоциацию на ионы:
NaCl → Na+ + Cl–
Металл Na стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу выше, на катоде восстанавливается водород. Хлорид-анионы будут окисляться на аноде до простого вещества:
К: 2Na+ (в растворе)
2H2O + 2e → H20 + 2OH–
А: 2Cl– – 2e → Cl2
Коэффициент 2 перед Na+ появился из-за наличия аналогичного коэффициента перед хлорид-ионами, так как в соли NaCl их соотношение 1:1.
Проверяем, что количество принимаемых и отдаваемых электронов одинаковое, и суммируем левые и правые части катодных и анодных процессов:
2Na+ + 2Cl– + 2H2O → H20 + 2Na+ + 2OH– + Cl2. Соединяем катионы и анионы:
2NaCl + 2H2O → H20 + 2NaOH + Cl2.
2. Раствор Na2SO4
Расписываем диссоциацию на ионы:
Na2SO4 → 2Na+ + SO42–
Натрий стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу выше, на катоде восстанавливается только водород. Сульфат-анионы содержат кислород, поэтому окисляться не будут, также оставаясь в растворе. Согласно правилу выше, в этом случае окисляются молекулы воды:
К: 2H2O + 2e → H20 + 2OH–
А: 2H2O – 4e → O20 + 4H+.
Уравниваем число принимаемых и отдаваемых электронов на катоде и аноде. Для этого необходимо умножить все коэффициенты катодного процесса на 2:
К: 4H2O + 4e → 2H20 + 4OH–
А: 2H2O – 4e → O20 + 4H+.
Складываем левые и правые части катодных и анодных процессов:
6H2O → 2H20 + 4OH– + 4H+ + O20.
4OH- и 4H+ соединяем в 4 молекулы H2O:
6H2O → 2H20 + 4H2O + O20.
Сокращаем молекулы воды, находящиеся по обе стороны уравнения, т.е. вычитаем из каждой части уравнения 4H2O и получаем итоговое уравнение гидролиза:
2H2O → 2H20 + O20.
Таким образом, гидролиз растворов кислородсодержащих солей активных металлов (до Al включительно) сводится к гидролизу воды, так как ни катионы металлов, ни анионы кислотных остатков не принимают участие в окислительно-восстановительных процессах, протекающих на электродах.
3. Раствор CuCl2
Расписываем диссоциацию на ионы:
CuCl2 → Cu2+ + 2Cl–
Медь находится в ряду напряжений металлов после водорода, следовательно, только она будет восстанавливаться на катоде. На аноде будут окисляться только хлорид-анионы.
К: Cu2+ + 2e → Cu0
A: 2Cl– – 2e → Cl2
Записываем суммарное уравнение:
CuCl2 → Cu0 + Cl2.
4. Раствор CuSO4
Расписываем диссоциацию на ионы:
CuSO4 → Cu2+ + SO42–
Медь находится в ряду напряжений металлов после водорода, следовательно, только она будет восстанавливаться на катоде. На аноде будут окисляться молекулы воды, так как кислородсодержащие кислотные остатки в растворах на аноде не окисляются.
К: Cu2+ + 2e → Cu0
A: SO42– (в растворе)
2H2O – 4e → O2 + 4H+.
Уравниваем количество электронов на катоде и аноде. Для это умножим все коэффициенты катодного уравнения на 2. Количество сульфат-ионов также необходимо удвоить, так как в сульфате меди соотношение Cu2+ и SO42– 1:1.
К: 2Cu2+ + 4e → 2Cu0
A: 2SO42– (в растворе)
2H2O – 4e → O2 + 4H+.
Записываем суммарное уравнение:
2Cu2+ + 2SO42– + 2H2O → 2Cu0 + O2 + 4H+ + 2SO42–.
Соединив катионы и анионы, получаем итоговое уравнение электролиза:
2CuSO4 + 2H2O → 2Cu0 + O2 + 2H2SO4.
5. Раствор NiCl2
Расписываем диссоциацию на ионы:
NiCl2 → Ni2+ + 2Cl–
Никель находится в ряду напряжений металлов после алюминия и до водорода, следовательно, на катоде будут восстанавливаться и металл, и водород. На аноде будут окисляться только хлорид-анионы.
К: Ni2+ + 2e → Ni0
2H2O + 2e → H20 + 2OH–
A: 2Cl– – 2e → Cl2
Уравниваем количество электронов, принимаемых и отдаваемых на катоде и аноде. Для этого умножаем все коэффициенты анодного уравнения на 2:
К: Ni2+ + 2e → Ni0
2H2O + 2e → H20 + 2OH–
Ni2+ (в растворе)
A: 4Cl– – 4e → 2Cl2
Замечаем, что согласно формуле NiCl2, соотношение атомов никеля и хлора 1:2, следовательно, в раствор необходимо добавить Ni2+ для получения общего количества 2NiCl2. Также это необходимо сделать, так как в растворе должны присутствовать противоионы для гидроксид-анионов.
Складываем левые и правые части катодных и анодных процессов:
Ni2+ + Ni2+ + 4Cl– + 2H2O → Ni0 + H20 + 2OH– + Ni2+ + 2Cl2.
Соединяем катионы и анионы для получения итогового уравнения электролиза:
2NiCl2 + 2H2O → Ni0 + H20 + Ni(OH)2 + 2Cl2.
6. Раствор NiSO4
Расписываем диссоциацию на ионы:
NiSO4 → Ni2+ + SO42–
Никель находится в ряду напряжений металлов после алюминия и до водорода, следовательно, на катоде будут восстанавливаться и металл, и водород. На аноде будут окисляться молекулы воды, так как кислородсодержащие кислотные остатки в растворах на аноде не окисляются.
К: Ni2+ + 2e → Ni0
2H2O + 2e → H20 + 2OH–
A: SO42– (в растворе)
2H2O – 4e → O2 + 4H+.
Проверяем, что количество принятых и отданных электронов совпадает. Также замечаем, что в растворе есть гидроксид-ионы, но в записи электродных процессов для них нет противоионов. Следовательно, нужно добавить в раствор Ni2+. Так как удвоилось количество ионов никеля, необходимо удвоить и количество сульфат-ионов:
К: Ni2+ + 2e → Ni0
2H2O + 2e → H20 + 2OH–
Ni2+ (в растворе)
A: 2SO42– (в растворе)
2H2O – 4e → O2 + 4H+.
Складываем левые и правые части катодных и анодных процессов:
Ni2+ + Ni2+ + 2SO42– + 2H2O + 2H2O → Ni0 + Ni2+ + 2OH– + H20 + O20 + 2SO42– + 4H+.
Соединяем катионы и анионы и записываем итоговое уравнение электролиза:
2NiSO4 + 4H2O → Ni0 + Ni(OH)2 + H20 + O20 + 2H2SO4.
В других источниках литературы также говорится об альтернативном протекании электролиза кислородсодержащих солей металлов средней активности. Разница состоит в том, что после сложения левых и правых частей процессов электролиза необходимо соединить H+ и OH– с образованием двух молекул воды. Оставшиеся 2H+ расходуются на образование серной кислоты. В этом случае не нужно прибавлять дополнительные ионы никеля и сульфат-ионы:
Ni2+ + SO42– + 2H2O + 2H2O → Ni0 + 2OH– + H20 + O20 + SO42– + 4H+.
Ni2+ + SO42– + 4H2O → Ni0 + H20 + O20 + SO42– + 2H+ + 2H2O.
Итоговое уравнение:
NiSO4 + 2H2O → Ni0 + H20 + O20 + H2SO4.
7. Раствор CH3COONa
Расписываем диссоциацию на ионы:
CH3COONa → CH3COO– + Na+
Натрий стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу выше, на катоде восстанавливается только водород. На аноде будет происходит окисление ацетат-ионов с образованием углекислого газа и удвоением остатка углеродной цепи:
К: 2Na+ (в растворе)
2H2O + 2e → H20 + 2OH–
А: 2CH3COO– – 2e → CH3-CH3 + CO2
Так как количества электронов в процессах окисления и восстановления совпадают, составляем суммарное уравнение:
2Na+ + 2CH3COO– + 2H2O → 2Na+ + 2OH– + H20 + CH3-CH3 + CO2
Соединяем катионы и анионы:
2CH3COONa + 2H2O → 2NaOH + H20 + CH3-CH3 + CO2.
8. Раствор H2SO4
Расписываем диссоциацию на ионы:
H2SO4 → 2H+ + SO42–
Из катионов в растворе присутствуют только катионы H+, они и будут восстанавливаться до простого вещества. На аноде будет протекать окисление воды, так как кислород содержащие кислотные остатки в растворах на аноде не окисляются.
К: 2H+ +2e → H2
A: 2H2O – 4e → O2 + 4H+
Уравниваем число электронов. Для этого удваиваем каждый коэффициент в уравнении катодного процесса:
К: 4H+ +4e → 2H2
A: 2H2O – 4e → O2 + 4H+
Суммируем левые и правые части уравнений:
4H+ + 2H2O → 2H2 + O2 + 4H+
Катионы H+ находятся в обеих частях реакции, следовательно, их нужно сократить. Получаем, что в случае растворов кислот, электролизу подвергаются только молекулы H2O:
2H2O → 2H2 + O2.
9. Раствор NaOH
Расписываем диссоциацию на ионы:
NaOH → Na+ + OH–
Натрий стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу, на катоде восстанавливается только водород. На аноде будут окисляться гидроксид-анионы с образованием кислорода и воды:
К: Na+ (в растворе)
2H2O + 2e → H20 + 2OH–
А: 4OH– – 4e → O2 + 2H2O
Уравниваем число электронов, принимаемых и отдаваемых на электродах:
К: Na+ (в растворе)
4H2O + 4e → 2H20 + 4OH–
А: 4OH– – 4e → O2 + 2H2O
Суммируем левые и правые части процессов:
4H2O + 4OH– → 2H20 + 4OH– + O20 + 2H2O
Сокращая 2H2O и ионы OH–, получаем итоговое уравнение электролиза:
2H2O → 2H2 + O2.
Вывод:
При электролизе растворов 1) кислородсодержащих кислот;
2) щелочей;
3) солей активных металлов и кислородсодержащих кислот
на электродах протекает электролиз воды:
2H2O → 2H2 + O2.