From Wikipedia, the free encyclopedia
In chemistry and thermodynamics, the standard enthalpy of formation or standard heat of formation of a compound is the change of enthalpy during the formation of 1 mole of the substance from its constituent elements in their reference state, with all substances in their standard states. The standard pressure value p⦵ = 105 Pa (= 100 kPa = 1 bar) is recommended by IUPAC, although prior to 1982 the value 1.00 atm (101.325 kPa) was used.[1] There is no standard temperature. Its symbol is ΔfH⦵. The superscript Plimsoll on this symbol indicates that the process has occurred under standard conditions at the specified temperature (usually 25 °C or 298.15 K). Standard states are as follows:
- For a gas: the hypothetical state the gas would assume if it obeyed the ideal gas equation at a pressure of 1 bar
- For a gaseous or solid solute present in a diluted ideal solution: the hypothetical state of concentration of the solute of exactly one mole per liter (1 M) at a pressure of 1 bar extrapolated from infinite dilution
- For a pure substance or a solvent in a condensed state (a liquid or a solid): the standard state is the pure liquid or solid under a pressure of 1 bar
For elements that have multiple allotropes, the reference state usually is chosen to be the form in which the element is most stable under 1 bar of pressure. One exception is phosphorus, for which the most stable form at 1 bar is black phosphorus, but white phosphorus is chosen as the standard reference state for zero enthalpy of formation.[2]
For example, the standard enthalpy of formation of carbon dioxide would be the enthalpy of the following reaction under the above conditions:
All elements are written in their standard states, and one mole of product is formed. This is true for all enthalpies of formation.
The standard enthalpy of formation is measured in units of energy per amount of substance, usually stated in kilojoule per mole (kJ mol−1), but also in kilocalorie per mole, joule per mole or kilocalorie per gram (any combination of these units conforming to the energy per mass or amount guideline).
All elements in their reference states (oxygen gas, solid carbon in the form of graphite, etc.) have a standard enthalpy of formation of zero, as there is no change involved in their formation.
The formation reaction is a constant pressure and constant temperature process. Since the pressure of the standard formation reaction is fixed at 1 bar, the standard formation enthalpy or reaction heat is a function of temperature. For tabulation purposes, standard formation enthalpies are all given at a single temperature: 298 K, represented by the symbol ΔfH⦵
298 K.
Hess’s law[edit]
For many substances, the formation reaction may be considered as the sum of a number of simpler reactions, either real or fictitious. The enthalpy of reaction can then be analyzed by applying Hess’s Law, which states that the sum of the enthalpy changes for a number of individual reaction steps equals the enthalpy change of the overall reaction. This is true because enthalpy is a state function, whose value for an overall process depends only on the initial and final states and not on any intermediate states. Examples are given in the following sections.
Ionic compounds: Born–Haber cycle[edit]
Standard enthalpy change of formation in Born–Haber diagram for lithium fluoride. ΔHlatt corresponds to UL in the text. The downward arrow «electron affinity» shows the negative quantity –EAF, since EAF is usually defined as positive.
For ionic compounds, the standard enthalpy of formation is equivalent to the sum of several terms included in the Born–Haber cycle. For example, the formation of lithium fluoride,
may be considered as the sum of several steps, each with its own enthalpy (or energy, approximately):
- Hsub, the standard enthalpy of atomization (or sublimation) of solid lithium.
- IELi, the first ionization energy of gaseous lithium.
- B(F–F), the standard enthalpy of atomization (or bond energy) of fluorine gas.
- EAF, the electron affinity of a fluorine atom.
- UL, the lattice energy of lithium fluoride.
The sum of all these enthalpies will give the standard enthalpy of formation (ΔHf) of lithium fluoride:
In practice, the enthalpy of formation of lithium fluoride can be determined experimentally, but the lattice energy cannot be measured directly. The equation is therefore rearranged in order to evaluate the lattice energy:[3]
Organic compounds[edit]
The formation reactions for most organic compounds are hypothetical. For instance, carbon and hydrogen will not directly react to form methane (CH4), so that the standard enthalpy of formation cannot be measured directly. However the standard enthalpy of combustion is readily measurable using bomb calorimetry. The standard enthalpy of formation is then determined using Hess’s law. The combustion of methane:
is equivalent to the sum of the hypothetical decomposition into elements followed by the combustion of the elements to form carbon dioxide (CO2) and water (H2O):
Applying Hess’s law,
Solving for the standard of enthalpy of formation,
The value of 
It is possible to predict heats of formation for simple unstrained organic compounds with the heat of formation group additivity method.
Use in calculation for other reactions[edit]
The standard enthalpy change of any reaction can be calculated from the standard enthalpies of formation of reactants and products using Hess’s law. A given reaction is considered as the decomposition of all reactants into elements in their standard states, followed by the formation of all products. The heat of reaction is then minus the sum of the standard enthalpies of formation of the reactants (each being multiplied by its respective stoichiometric coefficient, ν) plus the sum of the standard enthalpies of formation of the products (each also multiplied by its respective stoichiometric coefficient), as shown in the equation below:[4]
If the standard enthalpy of the products is less than the standard enthalpy of the reactants, the standard enthalpy of reaction is negative. This implies that the reaction is exothermic. The converse is also true; the standard enthalpy of reaction is positive for an endothermic reaction. This calculation has a tacit assumption of ideal solution between reactants and products where the enthalpy of mixing is zero.
For example, for the combustion of methane, 
However 

which is the equation in the previous section for the enthalpy of combustion 
Key concepts for enthalpy calculations[edit]
- When a reaction is reversed, the magnitude of ΔH stays the same, but the sign changes.
- When the balanced equation for a reaction is multiplied by an integer, the corresponding value of ΔH must be multiplied by that integer as well.
- The change in enthalpy for a reaction can be calculated from the enthalpies of formation of the reactants and the products
- Elements in their standard states make no contribution to the enthalpy calculations for the reaction, since the enthalpy of an element in its standard state is zero. Allotropes of an element other than the standard state generally have non-zero standard enthalpies of formation.
Examples: standard enthalpies of formation at 25 °C[edit]
Thermochemical properties of selected substances at 298.15 K and 1 atm
Inorganic substances[edit]
| Species | Phase | Chemical formula | ΔfH⦵ /(kJ/mol) |
|---|---|---|---|
| Aluminium | Solid | Al | 0 |
| Aluminium chloride | Solid | AlCl3 | −705.63 |
| Aluminium oxide | Solid | Al2O3 | −1675.5 |
| Aluminium hydroxide | Solid | Al(OH)3 | −1277 |
| Aluminium sulphate | Solid | Al2(SO4)3 | −3440 |
| Barium chloride | Solid | BaCl2 | −858.6 |
| Barium carbonate | Solid | BaCO3 | −1216 |
| Barium hydroxide | Solid | Ba(OH)2 | −944.7 |
| Barium oxide | Solid | BaO | −548.1 |
| Barium sulfate | Solid | BaSO4 | −1473.3 |
| Beryllium | Solid | Be | 0 |
| Beryllium hydroxide | Solid | Be(OH)2 | −903 |
| Beryllium oxide | Solid | BeO | −609.4 |
| Boron trichloride | Solid | BCl3 | −402.96 |
| Bromine | Liquid | Br2 | 0 |
| Bromide ion | Aqueous | Br− | −121 |
| Bromine | Gas | Br | 111.884 |
| Bromine | Gas | Br2 | 30.91 |
| Bromine trifluoride | Gas | BrF3 | −255.60 |
| Hydrogen bromide | Gas | HBr | −36.29 |
| Cadmium | Solid | Cd | 0 |
| Cadmium oxide | Solid | CdO | −258 |
| Cadmium hydroxide | Solid | Cd(OH)2 | −561 |
| Cadmium sulfide | Solid | CdS | −162 |
| Cadmium sulfate | Solid | CdSO4 | −935 |
| Caesium | Solid | Cs | 0 |
| Caesium | Gas | Cs | 76.50 |
| Caesium | Liquid | Cs | 2.09 |
| Caesium(I) ion | Gas | Cs+ | 457.964 |
| Caesium chloride | Solid | CsCl | −443.04 |
| Calcium | Solid | Ca | 0 |
| Calcium | Gas | Ca | 178.2 |
| Calcium(II) ion | Gas | Ca2+ | 1925.90 |
| Calcium(II) ion | Aqueous | Ca2+ | −542.7 |
| Calcium carbide | Solid | CaC2 | −59.8 |
| Calcium carbonate (Calcite) | Solid | CaCO3 | −1206.9 |
| Calcium chloride | Solid | CaCl2 | −795.8 |
| Calcium chloride | Aqueous | CaCl2 | −877.3 |
| Calcium phosphate | Solid | Ca3(PO4)2 | −4132 |
| Calcium fluoride | Solid | CaF2 | −1219.6 |
| Calcium hydride | Solid | CaH2 | −186.2 |
| Calcium hydroxide | Solid | Ca(OH)2 | −986.09 |
| Calcium hydroxide | Aqueous | Ca(OH)2 | −1002.82 |
| Calcium oxide | Solid | CaO | −635.09 |
| Calcium sulfate | Solid | CaSO4 | −1434.52 |
| Calcium sulfide | Solid | CaS | −482.4 |
| Wollastonite | Solid | CaSiO3 | −1630 |
| Carbon (Graphite) | Solid | C | 0 |
| Carbon (Diamond) | Solid | C | 1.9 |
| Carbon | Gas | C | 716.67 |
| Carbon dioxide | Gas | CO2 | −393.509 |
| Carbon disulfide | Liquid | CS2 | 89.41 |
| Carbon disulfide | Gas | CS2 | 116.7 |
| Carbon monoxide | Gas | CO | −110.525 |
| Carbonyl chloride (Phosgene) | Gas | COCl2 | −218.8 |
| Carbon dioxide (un–ionized) | Aqueous | CO2(aq) | −419.26 |
| Bicarbonate ion | Aqueous | HCO3– | −689.93 |
| Carbonate ion | Aqueous | CO32– | −675.23 |
| Monatomic chlorine | Gas | Cl | 121.7 |
| Chloride ion | Aqueous | Cl− | −167.2 |
| Chlorine | Gas | Cl2 | 0 |
| Chromium | Solid | Cr | 0 |
| Copper | Solid | Cu | 0 |
| Copper(II) oxide | Solid | CuO | −155.2 |
| Copper(II) sulfate | Aqueous | CuSO4 | −769.98 |
| Fluorine | Gas | F2 | 0 |
| Monatomic hydrogen | Gas | H | 218 |
| Hydrogen | Gas | H2 | 0 |
| Water | Gas | H2O | −241.818 |
| Water | Liquid | H2O | −285.8 |
| Hydrogen ion | Aqueous | H+ | 0 |
| Hydroxide ion | Aqueous | OH− | −230 |
| Hydrogen peroxide | Liquid | H2O2 | −187.8 |
| Phosphoric acid | Liquid | H3PO4 | −1288 |
| Hydrogen cyanide | Gas | HCN | 130.5 |
| Hydrogen bromide | Liquid | HBr | −36.3 |
| Hydrogen chloride | Gas | HCl | −92.30 |
| Hydrogen chloride | Aqueous | HCl | −167.2 |
| Hydrogen fluoride | Gas | HF | −273.3 |
| Hydrogen iodide | Gas | HI | 26.5 |
| Iodine | Solid | I2 | 0 |
| Iodine | Gas | I2 | 62.438 |
| Iodine | Aqueous | I2 | 23 |
| Iodide ion | Aqueous | I− | −55 |
| Iron | Solid | Fe | 0 |
| Iron carbide (Cementite) | Solid | Fe3C | 5.4 |
| Iron(II) carbonate (Siderite) | Solid | FeCO3 | −750.6 |
| Iron(III) chloride | Solid | FeCl3 | −399.4 |
| Iron(II) oxide (Wüstite) | Solid | FeO | −272 |
| Iron(II,III) oxide (Magnetite) | Solid | Fe3O4 | −1118.4 |
| Iron(III) oxide (Hematite) | Solid | Fe2O3 | −824.2 |
| Iron(II) sulfate | Solid | FeSO4 | −929 |
| Iron(III) sulfate | Solid | Fe2(SO4)3 | −2583 |
| Iron(II) sulfide | Solid | FeS | −102 |
| Pyrite | Solid | FeS2 | −178 |
| Lead | Solid | Pb | 0 |
| Lead dioxide | Solid | PbO2 | −277 |
| Lead sulfide | Solid | PbS | −100 |
| Lead sulfate | Solid | PbSO4 | −920 |
| Lead(II) nitrate | Solid | Pb(NO3)2 | −452 |
| Lead(II) sulfate | Solid | PbSO4 | −920 |
| Lithium fluoride | Solid | LiF | −616.93 |
| Magnesium | Solid | Mg | 0 |
| Magnesium ion | Aqueous | Mg2+ | −466.85 |
| Magnesium carbonate | Solid | MgCO3 | −1095.797 |
| Magnesium chloride | Solid | MgCl2 | −641.8 |
| Magnesium hydroxide | Solid | Mg(OH)2 | −924.54 |
| Magnesium hydroxide | Aqueous | Mg(OH)2 | −926.8 |
| Magnesium oxide | Solid | MgO | −601.6 |
| Magnesium sulfate | Solid | MgSO4 | −1278.2 |
| Manganese | Solid | Mn | 0 |
| Manganese(II) oxide | Solid | MnO | −384.9 |
| Manganese(IV) oxide | Solid | MnO2 | −519.7 |
| Manganese(III) oxide | Solid | Mn2O3 | −971 |
| Manganese(II,III) oxide | Solid | Mn3O4 | −1387 |
| Permanganate | Aqueous | MnO− 4 |
−543 |
| Mercury(II) oxide (red) | Solid | HgO | −90.83 |
| Mercury sulfide (red, cinnabar) | Solid | HgS | −58.2 |
| Nitrogen | Gas | N2 | 0 |
| Ammonia (ammonium hydroxide) | Aqueous | NH3 (NH4OH) | −80.8 |
| Ammonia | Gas | NH3 | −46.1 |
| Ammonium nitrate | Solid | NH4NO3 | −365.6 |
| Ammonium chloride | Solid | NH4Cl | −314.55 |
| Nitrogen dioxide | Gas | NO2 | 33.2 |
| Hydrazine | Gas | N2H4 | 95.4 |
| Hydrazine | Liquid | N2H4 | 50.6 |
| Nitrous oxide | Gas | N2O | 82.05 |
| Nitric oxide | Gas | NO | 90.29 |
| Dinitrogen tetroxide | Gas | N2O4 | 9.16 |
| Dinitrogen pentoxide | Solid | N2O5 | −43.1 |
| Dinitrogen pentoxide | Gas | N2O5 | 11.3 |
| Nitric acid | Aqueous | HNO3 | −207 |
| Monatomic oxygen | Gas | O | 249 |
| Oxygen | Gas | O2 | 0 |
| Ozone | Gas | O3 | 143 |
| White phosphorus | Solid | P4 | 0 |
| Red phosphorus | Solid | P | −17.4[5] |
| Black phosphorus | Solid | P | −39.3[5] |
| Phosphorus trichloride | Liquid | PCl3 | −319.7 |
| Phosphorus trichloride | Gas | PCl3 | −278 |
| Phosphorus pentachloride | Solid | PCl5 | −440 |
| Phosphorus pentachloride | Gas | PCl5 | −321 |
| Phosphorus pentoxide | Solid | P2O5 | −1505.5[6] |
| Potassium bromide | Solid | KBr | −392.2 |
| Potassium carbonate | Solid | K2CO3 | −1150 |
| Potassium chlorate | Solid | KClO3 | −391.4 |
| Potassium chloride | Solid | KCl | −436.68 |
| Potassium fluoride | Solid | KF | −562.6 |
| Potassium oxide | Solid | K2O | −363 |
| Potassium nitrate | Solid | KNO3 | −494.5 |
| Potassium perchlorate | Solid | KClO4 | −430.12 |
| Silicon | Gas | Si | 368.2 |
| Silicon carbide | Solid | SiC | −74.4,[7] −71.5[8] |
| Silicon tetrachloride | Liquid | SiCl4 | −640.1 |
| Silica (Quartz) | Solid | SiO2 | −910.86 |
| Silver bromide | Solid | AgBr | −99.5 |
| Silver chloride | Solid | AgCl | −127.01 |
| Silver iodide | Solid | AgI | −62.4 |
| Silver oxide | Solid | Ag2O | −31.1 |
| Silver sulfide | Solid | Ag2S | −31.8 |
| Sodium | Solid | Na | 0 |
| Sodium | Gas | Na | 107.5 |
| Sodium bicarbonate | Solid | NaHCO3 | −950.8 |
| Sodium carbonate | Solid | Na2CO3 | −1130.77 |
| Sodium chloride | Aqueous | NaCl | −407.27 |
| Sodium chloride | Solid | NaCl | −411.12 |
| Sodium chloride | Liquid | NaCl | −385.92 |
| Sodium chloride | Gas | NaCl | −181.42 |
| Sodium chlorate | Solid | NaClO3 | −365.4 |
| Sodium fluoride | Solid | NaF | −569.0 |
| Sodium hydroxide | Aqueous | NaOH | −469.15 |
| Sodium hydroxide | Solid | NaOH | −425.93 |
| Sodium hypochlorite | Solid | NaOCl | −347.1 |
| Sodium nitrate | Aqueous | NaNO3 | −446.2 |
| Sodium nitrate | Solid | NaNO3 | −424.8 |
| Sodium oxide | Solid | Na2O | −414.2 |
| Sulfur (monoclinic) | Solid | S8 | 0.3 |
| Sulfur (rhombic) | Solid | S8 | 0 |
| Hydrogen sulfide | Gas | H2S | −20.63 |
| Sulfur dioxide | Gas | SO2 | −296.84 |
| Sulfur trioxide | Gas | SO3 | −395.7 |
| Sulfuric acid | Liquid | H2SO4 | −814 |
| Titanium | Gas | Ti | 468 |
| Titanium tetrachloride | Gas | TiCl4 | −763.2 |
| Titanium tetrachloride | Liquid | TiCl4 | −804.2 |
| Titanium dioxide | Solid | TiO2 | −944.7 |
| Zinc | Gas | Zn | 130.7 |
| Zinc chloride | Solid | ZnCl2 | −415.1 |
| Zinc oxide | Solid | ZnO | −348.0 |
| Zinc sulfate | Solid | ZnSO4 | −980.14 |
Aliphatic hydrocarbons[edit]
| Formula | Name | ΔfH⦵ /(kcal/mol) | ΔfH⦵ /(kJ/mol) |
|---|---|---|---|
| Straight-chain | |||
| CH4 | Methane | −17.9 | −74.9 |
| C2H6 | Ethane | −20.0 | −83.7 |
| C2H4 | Ethylene | 12.5 | 52.5 |
| C2H2 | Acetylene | 54.2 | 226.8 |
| C3H8 | Propane | −25.0 | −104.6 |
| C4H10 | n-Butane | −30.0 | −125.5 |
| C5H12 | n-Pentane | −35.1 | −146.9 |
| C6H14 | n-Hexane | −40.0 | −167.4 |
| C7H16 | n-Heptane | −44.9 | −187.9 |
| C8H18 | n-Octane | −49.8 | −208.4 |
| C9H20 | n-Nonane | −54.8 | −229.3 |
| C10H22 | n-Decane | −59.6 | −249.4 |
| C4 Alkane branched isomers | |||
| C4H10 | Isobutane (methylpropane) | −32.1 | −134.3 |
| C5 Alkane branched isomers | |||
| C5H12 | Neopentane (dimethylpropane) | −40.1 | −167.8 |
| C5H12 | Isopentane (methylbutane) | −36.9 | −154.4 |
| C6 Alkane branched isomers | |||
| C6H14 | 2,2-Dimethylbutane | −44.5 | −186.2 |
| C6H14 | 2,3-Dimethylbutane | −42.5 | −177.8 |
| C6H14 | 2-Methylpentane (isohexane) | −41.8 | −174.9 |
| C6H14 | 3-Methylpentane | −41.1 | −172.0 |
| C7 Alkane branched isomers | |||
| C7H16 | 2,2-Dimethylpentane | −49.2 | −205.9 |
| C7H16 | 2,2,3-Trimethylbutane | −49.0 | −205.0 |
| C7H16 | 3,3-Dimethylpentane | −48.1 | −201.3 |
| C7H16 | 2,3-Dimethylpentane | −47.3 | −197.9 |
| C7H16 | 2,4-Dimethylpentane | −48.2 | −201.7 |
| C7H16 | 2-Methylhexane | −46.5 | −194.6 |
| C7H16 | 3-Methylhexane | −45.7 | −191.2 |
| C7H16 | 3-Ethylpentane | −45.3 | −189.5 |
| C8 Alkane branched isomers | |||
| C8H18 | 2,3-Dimethylhexane | −55.1 | −230.5 |
| C8H18 | 2,2,3,3-Tetramethylbutane | −53.9 | −225.5 |
| C8H18 | 2,2-Dimethylhexane | −53.7 | −224.7 |
| C8H18 | 2,2,4-Trimethylpentane (isooctane) | −53.5 | −223.8 |
| C8H18 | 2,5-Dimethylhexane | −53.2 | −222.6 |
| C8H18 | 2,2,3-Trimethylpentane | −52.6 | −220.1 |
| C8H18 | 3,3-Dimethylhexane | −52.6 | −220.1 |
| C8H18 | 2,4-Dimethylhexane | −52.4 | −219.2 |
| C8H18 | 2,3,4-Trimethylpentane | −51.9 | −217.1 |
| C8H18 | 2,3,3-Trimethylpentane | −51.7 | −216.3 |
| C8H18 | 2-Methylheptane | −51.5 | −215.5 |
| C8H18 | 3-Ethyl-3-Methylpentane | −51.4 | −215.1 |
| C8H18 | 3,4-Dimethylhexane | −50.9 | −213.0 |
| C8H18 | 3-Ethyl-2-Methylpentane | −50.4 | −210.9 |
| C8H18 | 3-Methylheptane | −60.3 | −252.5 |
| C8H18 | 4-Methylheptane | ? | ? |
| C8H18 | 3-Ethylhexane | ? | ? |
| C9 Alkane branched isomers (selected) | |||
| C9H20 | 2,2,4,4-Tetramethylpentane | −57.8 | −241.8 |
| C9H20 | 2,2,3,3-Tetramethylpentane | −56.7 | −237.2 |
| C9H20 | 2,2,3,4-Tetramethylpentane | −56.6 | −236.8 |
| C9H20 | 2,3,3,4-Tetramethylpentane | −56.4 | −236.0 |
| C9H20 | 3,3-Diethylpentane | −55.7 | −233.0 |
Other organic compounds[edit]
| Species | Phase | Chemical formula | ΔfH⦵ /(kJ/mol) |
|---|---|---|---|
| Acetone | Liquid | C3H6O | −248.4 |
| Benzene | Liquid | C6H6 | 48.95 |
| Benzoic acid | Solid | C7H6O2 | −385.2 |
| Carbon tetrachloride | Liquid | CCl4 | −135.4 |
| Carbon tetrachloride | Gas | CCl4 | −95.98 |
| Ethanol | Liquid | C2H5OH | −277.0 |
| Ethanol | Gas | C2H5OH | −235.3 |
| Glucose | Solid | C6H12O6 | −1271 |
| Isopropanol | Gas | C3H7OH | −318.1 |
| Methanol (methyl alcohol) | Liquid | CH3OH | −238.4 |
| Methanol (methyl alcohol) | Gas | CH3OH | −201.0 |
| Methyl linoleate (Biodiesel) | Gas | C19H34O2 | −356.3 |
| Sucrose | Solid | C12H22O11 | −2226.1 |
| Trichloromethane (Chloroform) | Liquid | CHCl3 | −134.47 |
| Trichloromethane (Chloroform) | Gas | CHCl3 | −103.18 |
| Vinyl chloride | Solid | C2H3Cl | −94.12 |
See also[edit]
- Calorimetry
- Thermochemistry
References[edit]
- ^ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the «Gold Book») (1997). Online corrected version: (2006–) «standard pressure». doi:10.1351/goldbook.S05921
- ^ Oxtoby, David W; Pat Gillis, H; Campion, Alan (2011). Principles of Modern Chemistry. p. 547. ISBN 978-0-8400-4931-5.
- ^ Moore, Stanitski, and Jurs. Chemistry: The Molecular Science. 3rd edition. 2008. ISBN 0-495-10521-X. pages 320–321.
- ^ «Enthalpies of Reaction». www.science.uwaterloo.ca. Archived from the original on 25 October 2017. Retrieved 2 May 2018.
- ^ a b Housecroft, C. E.; Sharpe, A. G. (2004). Inorganic Chemistry (2nd ed.). Prentice Hall. p. 392. ISBN 978-0-13-039913-7.
- ^ Green, D.W., ed. (2007). Perry’s Chemical Engineers’ Handbook (8th ed.). Mcgraw-Hill. p. 2–191. ISBN 9780071422949.
- ^ Kleykamp, H. (1998). «Gibbs Energy of Formation of SiC: A contribution to the Thermodynamic Stability of the Modifications». Berichte der Bunsengesellschaft für physikalische Chemie. 102 (9): 1231–1234. doi:10.1002/bbpc.19981020928.
- ^ «Silicon Carbide, Alpha (SiC)». March 1967. Retrieved 5 February 2019.
- Zumdahl, Steven (2009). Chemical Principles (6th ed.). Boston. New York: Houghton Mifflin. pp. 384–387. ISBN 978-0-547-19626-8.
External links[edit]
- NIST Chemistry WebBook
Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Тепловой эффект процесса
Термохимические уравнения
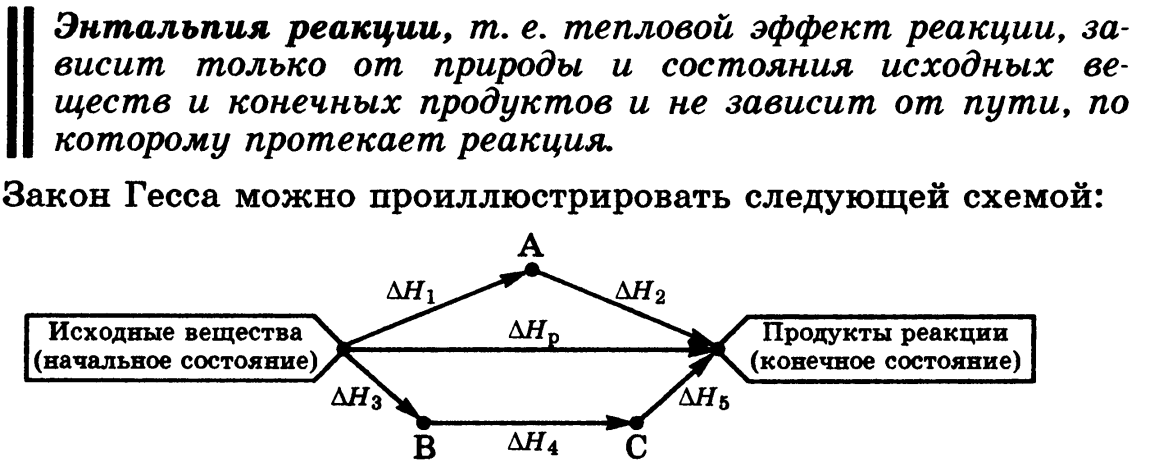
Закон Гесса
Следствия из закона Гесса
Стандартные термодинамические величины
Стандартные энтальпии образования и сгорания
Примеры решения задач
Задачи для самостоятельного решения
Тепловой эффект процесса
Количество выделенной (или поглощенной) теплоты Q в данном процессе называют тепловым эффектом процесса. Экзотермической является реакция, протекающая с выделением теплоты, а эндотермической – с поглощением теплоты из окружающей среды.
Для лабораторных и промышленных процессов наиболее типичен изобарный режим (Р=const). Поэтому обычно рассматривают тепловой эффект при Р,Т = const, т.е. изменение энтальпии процесса ΔН.
Следует отметить, что абсолютные значения энтальпии Н определить не представляется возможным, так как не известна абсолютная величина внутренней энергии.
Для экзотермической реакции (Q > 0) ΔН < 0, а в эндотермическом процессе (Q < 0) ΔН > 0.
Термохимические уравнения
Химические уравнения, в которых дополнительно указывается величина изменения энтальпии реакции, а также агрегатное состояние веществ и температура, называются термохимическими уравнениями.
В термохимических уравнениях отмечают фазовое состояние и аллотропные модификации реагентов и образующихся веществ: г – газообразное, ж – жидкое, к – кристаллическое; S(ромб), S(монокл), С(графит), С(алмаз) и т.д.
Важно подчеркнуть, что с термохимическими уравнениями можно проводить алгебраические операции сложения, вычитания, деления, умножения.
Закон Гесса
Изменение энтальпии (внутренней энергии) химической реакции зависит от вида, состояния и количества исходных веществ и продуктов реакции, но не зависит от пути процесса.
Следствия из закона Гесса
- Изменение энтальпии реакции равно сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ (суммирование проводится с учетом стехиометрических коэффициентов).
- Изменение энтальпии реакции равно сумме энтальпий сгорания исходных веществ за вычетом суммы энтальпий сгорания продуктов реакции (суммирование проводится с учетом стехиометрических коэффициентов).
Стандартные термодинамические величины
Стандартные термодинамические величины – это такие величины, которые относятся к процессам, все ингредиенты которых находятся в стандартных состояниях.
Стандартным состоянием вещества, находящегося в конденсированной фазе (кристаллической или жидкой), является реальное состояние вещества, находящегося при данной температуре и давлении 1 атм.
Следует подчеркнуть, что стандартное состояние может иметь место при любой температуре.
Обычно тепловой эффект (изменение энтальпии) реакции приводится для температуры 25оС (298,15 К) и давления 101,325 кПа (1 атм), т.е. указывается стандартная энтальпия ΔНо298.
Стандартные энтальпии образования и сгорания
Стандартная энтальпия образования ΔНоf,298 (или ΔНообр,298) – это изменение энтальпии в процессе образования данного вещества (обычно 1 моль), находящегося в стандартном состоянии, из простых веществ, также находящихся в стандартном состоянии, причем простые вещества присутствуют в наиболее термодинамически устойчивых состояниях при данной температуре.
Например, ΔНof,298(Н2О(ж)) = — 285,83 кДж/моль соответствует изменению энтальпии в процессе
Н2(г) + ½O2(г) = Н2О(ж)
при Т = 298,15 К и Р = 1 атм.
Стандартная энтальпия образования простых веществ равна нулю по определению (для наиболее устойчивых их модификаций при данной температуре).
Стандартной энтальпией сгорания ΔНoсгор,298 называют энтальпию сгорания вещества (обычно 1 моль), находящегося в стандартном состоянии с образованием СО2(г), Н2О(ж) и других веществ, состав которых должен быть специально указан. Все продукты сгорания также должны находиться в стандартном состоянии.
Примеры решения задач
Задача 1. Используя справочные термодинамические данные вычислить ΔНo298 реакции:
2H2S(г) + 3O2(г) = 2SO2(г) + 2H2O(ж); ΔНoх.р.,298 = ?
Решение. Решим задачу, используя оба следствия из закона Гесса. Ниже для исходных веществ и продуктов реакции приведены значения энтальпий образования и сгорания в кДж/моль (энтальпия сгорания сероводорода до SO2(г) и H2O(ж)):
| Вещество | H2S(г) | O2(г) | SO2(г) | H2O(ж) |
| ΔНof,298 | -20,60 | 0 | -296,90 | -285,83 |
| ΔНoсгор,298 | -562,10 | 0 | 0 | 0 |
Cогласно первому следствию закона Гесса энтальпия этой реакции ΔНох.р. равна:
ΔНох.р.,298 = 2ΔНоf,298(SO2(г)) + 2ΔНоf,298(H2O(ж)) — 2ΔНоf,298(H2S(г)) — 3ΔНоf,298(O2(г)) = 2(- 296,90) + 2(- 285,83) — 2(- 20,60) = — 1124,21 кДж.
В соответствии со вторым следствием закона Гесса получаем:
ΔНох.р.,298 = 2ΔНосгор,298(H2S(г)) = 2(-562,10) = — 1124,20 кДж.
Задача 2. Вычислите ΔНо298 реакции N2(г) + 3H2(г) = 2NH3(г), используя следующие данные:
4NH3(г) + 3O2(г) = 2N2(г) + 6H2O(ж); ΔНо1 = -1531,22 кДж;
2H2O(ж) = O2(г) + 2H2(г); ΔНо2= 571,66 кДж.
Определите стандартную энтальпию образования NH3(г).
Решение. Поскольку с термохимическими уравнениями можно производить все алгебраические действия, то искомое уравнение получится, если:
-
-
- разделить на два тепловой эффект первого уравнения и изменить его знак на противоположный, т.е:
-
N2(г) + 3H2O(ж) = 2NH3(г) + 3/2O2(г); ΔНо = 765,61 кДж;
-
-
- умножить на 3/2 второе уравнение и соответствующую ему величину δНo , изменив ее знак на противоположный:
-
3/2O2(г) + 3H2(г) = 3H2O(ж); ΔНо = -857,49 кДж;
-
-
- сложить полученные первое и второе уравнения.
-
Таким образом, тепловой эффект реакции N2(г) + 3H2(г) = 2NH3(г) равен:
Δ Но298 = (- ΔНо1/2) + (- 3/2·ΔНо2) = 765,61 + (- 857,49) = — 91,88 кДж.
Поскольку в рассматриваемой реакции образуется 2 моль NH3(г), то
ΔНоf,298(NH3(г)) = — 91,88/2 = — 45,94 кДж/моль.
Задача 3. Определите энтальпию процесса
CuSO4(к) + 5H2O(ж) = CuSO4·5H2O(к)
если при 298,15 К энтальпия растворения CuSO4(к) в n моль Н2О с образованием раствора CuSO4(р-р, nH2O) равна –40, а энтальпия растворения CuSO4·5H2O(к) с образованием раствора той же концентрации равна +10,5 кДж/моль.
Решение. Составляем цикл Гесса:
ΔНо1 = ΔНо2 + ΔНох (по закону Гесса). Отсюда получаем:
ΔНох = ΔНо1 – ΔНо2 = – 40,0 – 10,5 = -50,5 кДж.
Другой вариант решения.
CuSO4(к) + (n H2O) = CuSO4(р-р, n H2O); ΔНо1 = – 40,0 кДж; (1)
CuSO4(к) + 5H2O(ж) = CuSO4·5H2O(к); ΔНох = Но2; (2)
CuSO4·5H2O(к) + (n – 5)H2O = CuSO4(р-р, nH2O); ΔНо3 = 10,5 кДж. (3)
По закону Гесса: ΔНо1 = ΔНох+ ΔНо3, т.е. при сложении уравнений (2) и (3) получим уравнение (1).
Задача 4. Вычислите энтальпию образования химической связи С= С в молекуле этилена, если его стандартная энтальпия образования равна 52,3 кДж/моль, энтальпия возгонки графита составляет 716,7 кДж/моль, энтальпия атомизации водорода равна +436,0 кДж/моль, энтальпия образования связи С–Н равна –414,0 кДж/моль.
Решение. Составляем цикл Гесса:
ΔНоf,298(С2Н4(г)) = 2ΔНовозг(С(графит)) + 2ΔНоатом (H2(г)) + ΔНо(С= С) + 4ΔНо(С–Н).
ΔНо(С = С) = 52,3 — 2·716,7 — 2·436,0 + 4·414,0 = — 597,1 кДж/моль.
Задачи для самостоятельного решения
1. Составьте уравнение реакции, для которой ΔНо соответствует стандартной энтальпии образования ВaCl2·2H2O(к).
2. Определить ΔНо298 реакции:
CH3CНO(ж) + H2(г) = CH3CH2OH(ж),
если ΔНосгор,298(CH3CНO(ж)) = — 1193,07 кДж/моль; ΔНосгор,298(CH3CH2OH(ж)) = — 1370,68 кДж/моль; ΔНоf,298(Н2О(ж)) = — 285,83 кДж/моль.
10.3. Энтальпии растворения BaCl2(к) и BaCl2·2H2O(к) с образованием раствора хлорида бария (с мольным отношением BaCl2: H2O = 1: 500) соответственно равны –11,18 и 18,74 кДж/моль.
Определить величину ΔНо присоединения воды к BaCl2(к) с образованием BaCl2·2H2O(к).
10.4. Рассчитать энтальпию связи в молекуле NO на основании следующих термохимических уравнений:
N2(г) + O2(г) = 2NO(г); ΔНо298 = +182,52 кДж;
2O(г) = O2(г); ΔНо298 = — 498,34 кДж;
N2(г) = 2N(г); ΔНо298 = +945,42 кДж.
10.5. Вычислить ΔНо298 реакции 2C(г) + 2H2(г) = C2H4(г), используя следующие термохимические уравнения:
С(графит) = С(г) ; ΔНо298 = +716,67 кДж;
С2H4(г) + 3O2(г) = 2CO2(г) + 2H2O(г); ΔНо298 = — 1322,94 кДж;
C(графит) + O2(г) = CO2(г); ΔНо298 = — 393,51 кДж;
H2(г) + 1/2O2(г) = H2O(г); ΔНо298 = — 241,81 кДж.
10.6. Определите стандартную энтальпию реакции взаимодействия метана с оксидом углерода (IV), если стандартные энтальпии образования метана, оксида углерода (IV) и оксида углерода (II) при 298 К равны соответственно: -75; -393 и -111 кДж/моль.
7. Определите стандартную энтальпию образования С2Н5ОН(ж), если стандартные энтальпии сгорания углерода, водорода и этанола при 298 К равны соответственно: -393; -286 и -1366 кДж/моль.
8. Вычислите энтальпию химической реакции 4KClO3(к)=KCl(к)+3KClO4(к) по следующим данным:
2KClO3(к)=2KCl(к)+3O2(г); ΔНо298 = — 95 кДж;
4KClO4(к)=KCl(к)+2O2(г); ΔНо298 = 9 кДж/моль.
9. Вычислите среднюю энтальпию связи P-Cl в молекуле PCl5, используя следующие термохимические уравнения:
P(к, бел.)+5/2Cl2(г)=PCl5(г); ΔНо1 = — 374,8 кДж;
P(к, бел.)=P(г); ΔНо2 = — 17,4 кДж;
Cl2(г)=2Cl(г); ΔНо3 = 242,6 кДж.
10. Вычислите среднюю энтальпию связи N-H в молекуле NH3, используя следующие термохимические уравнения:
1/2N2(г)+3/2H2(г)=NH3(г); ΔНо1 = — 46,2 кДж;
N2(г)=2N(г); ΔНо2 = 945,4 кДж;
H2(г)=2H(г); ΔНо3 = 436,0 кДж.
Стандартная
энтальпия сгорания ΔHoсгор
–
тепловой эффект реакции сгорания одного
моля вещества до образования высших
оксидов. Для органических веществ –до
CO2(г)
и
H2O(ж).
Теплота сгорания негорючих веществ
принимается равной нулю. Теплота сгорания
топлива характеризует его теплотворную
способность.
Стандартная
энтальпия образования вещества (ΔfH0)
– увеличение или уменьшение энтальпии,
сопровождающее образование 1 моль
вещества из простых веществ, при условии,
что все участники реакции находятся в
стандартном состоянии
Стандартная
энтальпия сгорания вещества (ΔсH0)
– уменьшение
энтальпии при окислении в избытке
кислорода 1 моль вещества, взятого в
стандартном состоянии, до конечных
продуктов окисления.
Закон Гесса
– энергия не создаётся и не уничтожается,
а лишь переходит из одного вида энергии
в другой.
Закон Гесса
Тепловой эффект
реакции зависит только от природы и
состояния исходных вещ-в и не зависит
от пути, по которому реакция протекает
Следствие
1.
Тепловой эффект химической реакции
равен разности сумм теплот
образования(ΔHf)
продуктов реакции и исходных веществ,
умноженных на стехиометрическиекоэффициенты (ν):
ΔHof,i
— стандартная энтальпия образование
веществ
vi
– стехиометрические коэффициенты
Следствие
2.
Тепловой эффект химической реакции
равен разности сумм теплот
сгорания(ΔHc)
исходных веществ и продуктов реакции,
умноженных на стехиометрические
коэффициенты (ν):
ΔHoс,i—
стандартная энтальпия сгорания веществ
vi
– стехиометрические коэффициенты
Следствие
3. Энтальпия
реакции равна разности сумм энергий
связей Eсв исходных
и конечных реагентов с учетом их
стехиометрических коэффициентов.
В ходе
химической реакции энергия затрачивается на
разрушение связей в исходных веществах
(ΣEисх)
и выделяется при образовании
продуктов реакции (–ΣEпрод).
Отсюда
|
ΔH° = ΣEисх – ΣEпрод |
Следовательно,
экзотермический эффект реакции
свидетельствует о том, что образуются
соединения с более прочными связями,
чем исходные. В случае эндотермической
реакции, наоборот, прочнее исходные
вещества.
При
определении энтальпии реакции по
энергиям связей уравнение реакции пишут
с помощью структурных формул для удобства
определения числа и характера связей.
Следствие
4. Энтальпия
реакции образования вещества равна
энтальпии реакции разложения его до
исходных веществ с обратным знаком.
Следствие
5. Энтальпия
гидратации равна разности энтальпий
растворения безводной соли (ΔHoраств.б/с)и
кристаллогидрата (ΔHoраств.крист)
6.Второе начало термодинамики. Формулировка. Обратимые и необратимые в термодинамическом смысле процессы. Энтропия как критерий возможности протекания самопроизвольных процессов.
Второе начало
термодинамики:
В изобарно-изотермических условиях (р,
Т = const)
в системе самопроизвольно могут протекать
только такие процессы, в результате
которых энергия Гиббса системы уменьшается
(ΔG
< 0). В состоянии равновесия G
= const,
G
= 0
Обратимый
процесс (то есть равновесный)
— термодинамический процесс, который
может проходить как в прямом, так и в
обратном направлении, проходя через
одинаковые промежуточные состояния,
причем система возвращается в исходное
состояние без затрат энергии, и в
окружающей среде не остается
макроскопических изменений. Обратимый
процесс можно в любой момент заставить
протекать в обратном направлении,
изменив какую-либо независимую переменную
на бесконечно малую величину.
Необратимым
называется процесс,
который нельзя провести в противоположном
направлении через все те же самые
промежуточные состояния. Все реальные
процессы необратимы.
Энтропия
– энтропия – функция состояния,
приращение которой ΔS
равно теплоте Qмин
подведённой к системе в обратимом
изотермическом процессе, делённой на
абсолютную температуру T,
три которой осуществляется процесс: ΔS
= Qмин/
T
или мера вероятности пребывания системы
в данном состоянии – мера неупорядоченности
системы.
7.
Энергия
Гиббса – главный критерий возможности
протекания самопроизвольных процессов.
Прогнозирование
направления самопроизвольно протекающих
процессов в изолированной и закрытой
системах; роль энтальпийного и энтропийного
факторов.
Критериями
направления самопроизвольного протекания
необратимых процессов являются
неравенства ΔG < 0 (для закрытых систем),
ΔS > 0 (для изолированных систем).
Если
величина ΔG
имеет отрицательный знак (ΔG
< 0),
то реакция самопроизвольно может
протекать
только в прямом направлении.
Причем абсолютное значение разности
ΔH
– TΔS
= ΔG
будет определять движущую силу данного
процесса.
Если
же ΔG
> 0,
то в условиях, для которых были измерены
ΔH
и TΔS,
в прямом
направлении данная реакция протекать
не может. Зато осуществимой окажется
обратная реакция,
для которой ΔG
будет иметь отрицательное значение.
Реакции,
для которых ΔH
< 0, а ΔS
> 0,
могут самопроизвольно протекать в
прямом
направлении при любых температурах,
т.к. ΔG
у них всегда будет меньше нуля. Примером
такой реакции может служить гидролиз
пептидов или белков.
Если
для химической реакции ΔH
> 0, а ΔS
< 0,
то ее самопроизвольное протекание в
прямом
направлении всегда неосуществимо,
т.к. энергия Гиббса в данном случае
возрастает. Примером такой реакции
может служить процесс фотосинтеза –
образование глюкозы и кислорода из
углекислого газа и воды, – который
невозможен без участия солнечной
энергии.
В
случае ΔH
> 0 и ΔS
> 0
самопроизвольному протеканию реакции
в
прямом направлении способствует
энтропийный фактор.
При низких температурах отрицательное
значение ΔH
– TΔS
может быть невозможно, но при нагревании
– оно возможно и реакция становится
осуществимой в прямом направлении.
Например, тепловая денатурация белковых
молекул.
Если
ΔH
< 0 и ΔS
< 0,
то отрицательное значение ΔG
такой химической реакции наблюдается
только при достаточно низких температурах.
При
вычислении ΔG
в химической реакции можно использовать
следствие из закона Гесса, применяемое
для расчета ее теплового эффекта
(изменения энтальпии). В данном случае
оно будет звучать следующим образом.
В ходе самопроизвольного
процесса в закрытых системах G
уменьшается до определенной величины,
принимая минимально возможное для
данной системы значение Gmin. Система
переходит в состояние химического
равновесия (ΔG= 0). Самопроизвольное
течение реакций в закрытых системах
контролируется как энтальпийным (ΔrH),
так и энтропийным (TΔrS) фактором. Для
реакций, у которых ΔrH< 0 иΔrS> 0, энергия
Гиббса всегда будет убывать, т.е.ΔrG<
0, и такие реакции могут протекать
самопроизвольно при любых температурах
В изолированных
системах энтропия
приобретает максимально возможное для
данной системы значение Smax; в состоянии
равновесияΔS= 0
Под стандартной
энергией Гиббса образования ΔG°, понимают
изменение энергии Гиббса при реакции
образования 1 моль вещества, находящегося
в стандартном состоянии. Это определение
подразумевает, что стандартная энергия
Гиббса образования простого вещества,
устойчивого в стандартных условиях,
равна нулю. В самопроизвольной реакции:
∆G<0 (G2-G1<0)
∆S>0 (S2-S1>0)
реакция пойдет → ∆G>0
∆S<0 реакция
пойдет ←
Формула для I и II
т/д: ∆Gт=∆H0хр — Т∆S
Энтальпийный и
энтропийный факторы Из приведенного
выражения следует, что самопроизвольное
течение реакции может контролироваться
как энтальпийным (∆H), так и энтропийным
фактором (T∆S). Очевидно, что для реакций,
характеризующихся ∆Hr< 0 и ∆Sr> О,
энергия Гиббса должна обязательно
убывать, т. е. ∆Gr< 0, и такие реакции
могут протекать самопроизвольно при
любых температурах, так как оба фактора
способствуют протеканию процесса.
Пример такой реакции — гидролиз белка.
Наоборот, при ∆Hr> 0 и ∆Sr< 0 самопроизвольное
течение реакций всегда невозможно, так
как энергия Гиббса должна обязательно
возрастать. Оба фактора препятствуют
протеканию реакции. Пример — фотосинтез,
т. е. образование глюкозы и кислорода
из углекислого газа и воды.
Несогласованное
действие факторов наблюдается в двух
случаях:
1) ∆Hr> 0 и ∆Sr> 0 —
самопроизвольному протеканию реакции
способствует энтропийный фактор,
отрицательное значение изменения
энергии Гиббса возможно при соотношении
|∆Sr |> |∆Hr|, т. е. при достаточно высоких
температурах. Примером процессов этого
типа является тепловая денатурация
белков;
2) ∆Hr< О и ∆Sr< О —
благоприятствующим фактором является
энтальпийный, соотношение AGT< 0
наблюдается при |∆Hr| >|∆Sr |, т. е. при
достаточно низких температурах. Пример
процессов этого типа — гидратация
белков.
8
. Термодинамические условия равновесия.
Стандартная энергия Гиббса образования
вещества, стандартная энергия Гиббса
биологического окисления вещества.
Стандартная энергия Гиббса реакции.
Примеры экзергонических и эндергонических
процессов, протекающих в организме.
Принцип энергетического сопряжения.
Под
стандартной энергией Гиббса биологического
окисления ΔG°, понимают изменение энергии
Гиббса при реакции биологического
окисления 1 моль вещества, находящегося
в стандартном состоянии.Под стандартной
энергией Гиббса образования ΔG°, понимают
изменение энергии Гиббса при реакции
образования 1 моль вещества, находящегося
в стандартном состоянии
Принцип
энергетического сопряжения:
Сопряженные
реакции – это реакции, в которых
протекание одной реакции обусловлено
протеканием другой, невозможной в
отсутствии первой. Принцип энергетического
сопряжения заключается в том, что энергия
необходимая для протекания эндергонической
реакции поступает за счет осуществление
экзэргонической реакции , причем в двух
реакциях присутствует общее веществ-
интермедиан.
-
Химическое
равновесие. Обратимые и необратимые
по направлению реакции. Термодинамические
условия равновесия в изолированных и
закрытых системах. Константа химического
равновесия.

кинетика как основа для изучения
скоростей и механизмов биохимических
процессов. Скорость реакции, средняя
скорость реакции в интервале, истинная
скорость. Факторы, влияющие на скорость
реакции.
Химическая
кинетика
изучает скорости химических реакций,
их зависимость от различных факторов
и механизмы реакций. Последовательность
и характер стадий химических реакций
называют механизмом реакции.
Факторы
влияющие на протекание реакции
В
организме человека протекают тысячи
ферментативных реакций, проходящих в
живой клетке. Однако в многостадийной
цепи процессов достаточно велика разница
между скоростями отдельных реакций.
Так, синтезу в клетке молекул белка
предшествует, по крайней мере, еще две
стадии: синтез транспортной РНК и синтез
рибосом. Но время, за которое удваивается
концентрация молекул т-РНК, составляет
1,7 мин., молекулы белка — 17 мин., а рибосом
— 170 мин. Скорость суммарного процесса
медленной (лимитирующей) стадии, в нашем
примере — скорость синтеза рибосом.
Наличие лимитирующей реакции обеспечивает
высокую надежность и гибкость управления
тысячами реакций, происходящих в клетке.
Достаточно держать под наблюдением и
регулировать лишь наиболее медленные
из них. Такой способ регулирования
скорости многостадийного синтеза носит
название принципа
минимума. Он
позволяет существенно упростить и
сделать более надежной систему
авторегулирования в клетке.
Скорость
реакций в зависимости от молекулярности
будет выражаться уравнениями: а) V = к •
СА
— для мономолекулярной реакции; б) V = к
• СА
• Св
или в) V = к • С2А
— для бимолекулярной реакции; г) V = к •
С • Св
• С э
д) V = к • С2А
• Св
или е) V
= k
• С3А—
для тримолекулярной реакции.
12.
Классификации реакций, применяющиеся
в кинетике: реакции, гомогенные,
гетерогенные и микрогетерогенные;
реакции простые и сложные (параллельные,
последовательные, сопряженные, цепные).
Молекулярность элементарного акта
реакции. Кинетические уравнения. Порядок
реакции. Период полупревращения
Микрогетерогенные
реакции –
Молекулярность
реакции–
это количество молекул, которые принимают
участие единовременно в одном акте
столкновений.
Молекулярность
можно определить, лишь установив механизм
реакции. В зависимости от числа реагирующих
молекул (частиц), участвующих в элементарном
акте, различают одномолекулярные
(мономолекулярные), двухмолекулярные,
тримолекулярные реакции.
К одномолекулярнымреакциям
типа А→Р относятся процессы распада
молекулы на более простые составные
части и реакции изомеризации.
Двухмолекулярными называются
элементарные реакции вида: А+В→Р и 2А→Р
(Н2+J2=2HJ,HJ+HJ=H2+J2,CH3COOCH3+H2O=CH3COOH+CH3OHи
т.д.).
Значительно
реже встречаютсятрехмолекулярныереакции
А+2В→Р или 3А→Р. Во всех случаях вид и
количество образующихся продуктов
реакции не имеет значения, так как
молекулярность определяется только
числом молекул веществ, реагирующих в
элементарном акте.
Порядок
реакции
устанавливается экспериментально.
Молекулярность
и порядок реакции могут совпадать, а
могут и различаться.
Молекулярность
и порядок реакции совпадаюттолько
для простых реакций, протекающих только
в одну элементарную стадию без участия
посторонних молекул.
Молекулярность
и порядок реакции не совпадают в
трех основных случаях:
1) для
сложных реакций;
2) для
гетерогенных реакций;
3) для
реакций с избытком одного из реагирующих
веществ.
Период
полупревращения–
это время, в течение которого прореагирует
половина взятого вещества.
Кинетическое
уравнение
выражает зависимость скорости хим.
реакции от концентраций компонентов
реакционной смеси
Молекулярность-число
молекул, реагирующих в в одном элементарном
химическом акте.
Молекулярность
реакции определяется числом молекул,
вступающих в химическое взаимодействие
в элементарном акте реакции. По этому
признаку реакции разделяются на
мономолекулярные, бимолекулярные и
тримолекулярные.
Тогда
реакции типа А —>В будут являться
мономолекулярными, например:
а) С16Н34
(t°C)
—>CgH18
+ С8Н16
— реакция крекинга углеводородов;
б) CaC03
(t°C)
—>СаО + С02
— термическое разложение карбоната
кальция.
Реакции типа А + В —> С или
2А —> С — являются бимолекулярными,
например:
а) С + 02
-> С02;
б) 2Н202
-> 2Н20
+ 02
и т. д.
Тримолекулярные
реакции описываются общими уравнениями
типа:
а)
А + В + С Д; б) 2А + В Д; в) 3А Д.
Например:
а) 2Н2
+ 02
2Н20;
б) 2NO
+ Н2N20
+ Н20.
Скорость
реакций в зависимости от молекулярности
будет выражаться уравнениями: а) V = к •
СА
— для мономолекулярной реакции; б) V = к
• СА
• Св
или в) V = к • С2А
— для бимолекулярной реакции; г) V = к •
С • Св
• С э
д) V = к • С2А
• Св
или е) V
= k
• С3А—
для тримолекулярной реакции.
Нередко
молекулярность реакции трудно установить,
поэтому используют более формальный
признак — порядок
химической реакции.
Порядок
реакции равен сумме показателей степеней
концентраций в уравнении, выражающем
зависимость скорости реакции от
концентрации реагирующих веществ
(кинетическом уравнении).
Порядок
реакции чаще всего не совпадает с
молекулярностью ввиду того, что механизм
реакции, т. е. «элементарный акт»
реакции (см. определение признака
молекулярности), трудно установить.
Рассмотрим
ряд примеров, иллюстрирующих указанное
положение.
-
Скорость
растворения кристаллов описывается
уравнениями кинетики нулевого порядка,
несмотря на мономолекулярность реакции:
AgCl(TB)
—>Ag+
+ CI»,
V = k
• C(AgCl(TBp=
k’C(AgCl(ra})
— p
— плотности и является постоянной
величиной, т. е. скорость растворения
не зависит от количества (концентрации)
растворяемого вещества. -
Реакция
гидролиза сахарозы: СО + Н20
—> С6Н1206(глюкоза)
+ С6Н1206
(фруктоза)
является бимолекулярной реакцией, но
ее кинетика описывается кинетическим
уравнением первого порядка: V=k*Ccax,
так как в условиях опытов, в том числе
и в организме, концентрация воды есть
величина постоянная С(Н20)
— const. -
Реакция
разложения водородпероксида, протекающая
с участием катализаторов, как
неорганических ионов Fe3+,
Cu2+
металлической платины, так и биологических
— ферментов, например каталазы, имеет
общий вид:
2Н202
—> 2Н20
+ О э
т. е. является бимолекулярной.










![{displaystyle Delta _{text{comb}}H^{ominus }({text{CH}}_{4})=[Delta _{text{f}}H^{ominus }({text{CO}}_{2})+2Delta _{text{f}}H^{ominus }({text{H}}_{2}{text{O}})]-Delta _{text{f}}H^{ominus }({text{CH}}_{4}).}](https://wikimedia.org/api/rest_v1/media/math/render/svg/868ef759a6238c57f082b526d2599d6a04ae8c6a)
![{displaystyle Delta _{text{f}}H^{ominus }({text{CH}}_{4})=[Delta _{text{f}}H^{ominus }({text{CO}}_{2})+2Delta _{text{f}}H^{ominus }({text{H}}_{2}{text{O}})]-Delta _{text{comb}}H^{ominus }({text{CH}}_{4}).}](https://wikimedia.org/api/rest_v1/media/math/render/svg/eaa4ff8ecbdfc22efc596605a9e9c5b9fc178c70)

![{displaystyle Delta _{text{r}}H^{ominus }=[Delta _{text{f}}H^{ominus }({text{CO}}_{2})+2Delta _{text{f}}H^{ominus }({text{H}}_{2}{text{O}})]-Delta _{text{f}}H^{ominus }({text{CH}}_{4})+2Delta _{text{f}}H^{ominus }({text{O}}_{2})].}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d13e59b354921b5d0bcc0e9da48fd3e719de3e74)
![{displaystyle Delta _{text{r}}H^{ominus }=[Delta _{text{f}}H^{ominus }({text{CO}}_{2})+2Delta _{text{f}}H^{ominus }({text{H}}_{2}{text{O}})]-Delta _{text{f}}H^{ominus }({text{CH}}_{4}),}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2bb97407d417f1efde328dead9949da6b6d6d019)