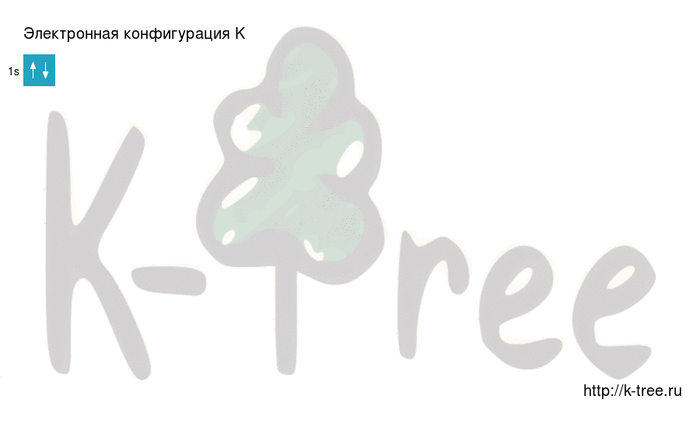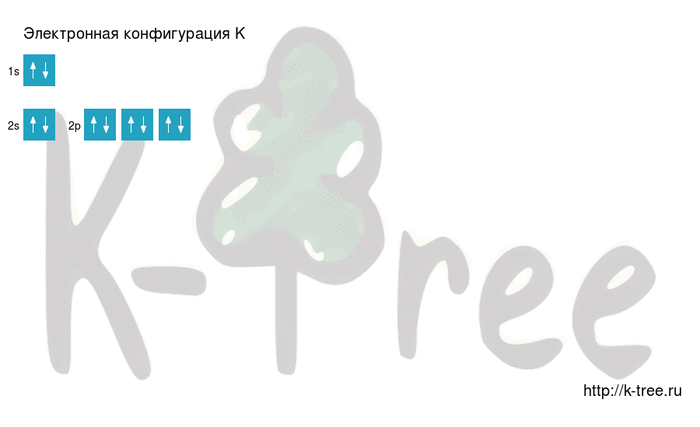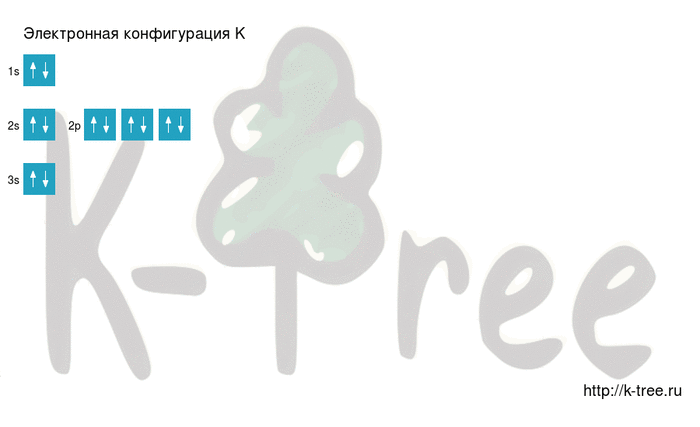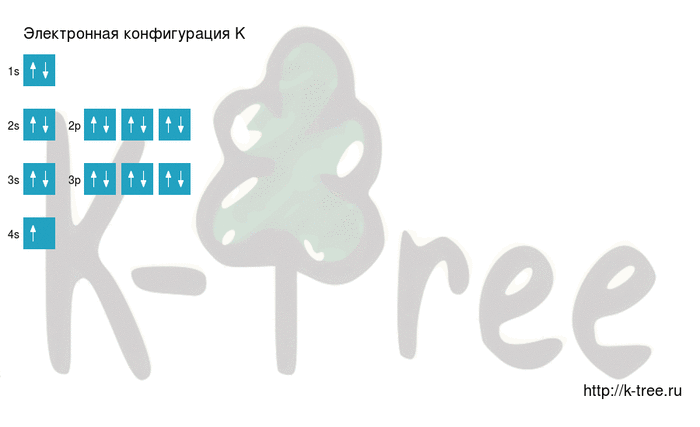K (калий) — элемент с прядковым номером 19 в периодической системе.
Находится в IV периоде. Температура плавления: 63.7 ℃. Плотность: 0.86 г/см3.
Электронная формула атома калия:
1s2 2s2 2p6 3s2 3p6 4s1
Сокращенная электронная конфигурация K:
[Ar] 4s1
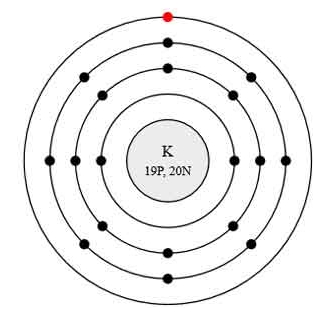
Ниже приведена электронно-графическая схема атома калия
Распределение электронов по энергетическим уровням в атоме K
1-й уровень (K): 2
2-й уровень (L): 8
3-й уровень (M): 8
4-й уровень (N): 1
Валентные электроны калия
Количество валентных электронов в атоме калия — 1.
Ниже приведены их квантовые числа (N — главное, L — орбитальное, M — магнитное, S — спин)
| Орбиталь | N | L | M | S |
|---|---|---|---|---|
| s | 4 | 0 | 0 | +1/2 |
Степени окисления, которые может проявлять калий: +1
поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,662 -
гуманитарные
33,654 -
юридические
17,917 -
школьный раздел
611,984 -
разное
16,905
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Электронное строение атома калия
Электронное строение нейтрального атома калия в основном состоянии.
Схема строения электронных оболочек
Распределение электронов по энергетическим уровням (или по электронным слоям) в атоме калия.
K
+19
2
8
8
1
Электронно-графическая схема
Распределение электронов по атомным орбиталям в атоме калия.
| 4 | ↑ | |||||
| 3 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ||
| 2 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ||
| 1 | ↑↓ | |||||
| s | p |
Валентные орбитали атома калия выделены фиолетовым цветом.
Электронная конфигурация
Полная электронная конфигурация атома калия.
19K 1s2 2s2 2p6 3s2 3p6 4s1
Сокращённая электронная конфигурация атома калия.
19K [Ar] 4s1
Квантовые числа валентных электронов
Главное (n), орбитальное (l), магнитное (m) и спиновое (s) квантовые числа валентных электронов атома калия.
| Орбиталь | Квантовое число | |||
|---|---|---|---|---|
| n | l | m | s | |
| 4s | 4 | 0 | 0 | +½ |
Калий в таблице менделеева занимает 19 место, в 4 периоде.
| Символ | K |
| Номер | 19 |
| Атомный вес | 39.0983000 |
| Латинское название | Kalium, Calium |
| Русское название | Калий |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема калия
K: 1s2 2s2 2p6 3s2 3p6 4s1
Короткая запись:
K: [Ar]4s1
Одинаковую электронную конфигурацию имеют
атом калия и
Cl-2, Sc+2, Ti+3, V+4, Mn+6
Порядок заполнения оболочек атома калия (K) электронами:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d →
5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на
‘d’ — до 10 и на ‘f’ до 14
Калий имеет 19 электронов,
заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
1 электрон на 4s-подуровне
Степень окисления калия
Атомы калия в соединениях имеют степени окисления 1, -1.
Степень окисления — это условный заряд атома в соединении: связь в молекуле
между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается
заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается,
то степень окисления положительная.
Ионы калия
Валентность K
Атомы калия в соединениях проявляют валентность I.
Валентность калия характеризует способность атома K к образованию хмических связей.
Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании
химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа K
Квантовые числа определяются последним электроном в конфигурации,
для атома K эти числа имеют значение N = 4, L = 0, Ml = 0, Ms = +½
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Чем ближе электрон к центру атома — тем больше энергии необходимо, что бы его оторвать.
Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo.
Если не указано иное, то энергия ионизации — это энергия отрыва первого электрона, также существуют энергии
ионизации для каждого последующего электрона.
Энергия ионизации K:
Eo = 419 кДж/моль
— Что такое ион читайте в статье.
Перейти к другим элементам таблицы менделеева
Где K в таблице менделеева?
Таблица Менделеева
Скачать таблицу менделеева в хорошем качестве
Содержание
- Строение атома калия
- Общие сведения о строении атома калия
- Электронное строение атома калия
- Примеры решения задач
- Калий K
- Электронная схема калия
- Степень окисления калия
- Ионы калия
- Валентность K
- Квантовые числа K
- Энергия ионизации
- Калий K
- Электронная схема калия
- Степень окисления калия
- Ионы калия
- Валентность K
- Квантовые числа K
- Энергия ионизации
- Электронная формула калия (элемент 19). Графическая схема
- Распределение в порядке заполнения орбиталей
- Видео
- Электронное строение атома калия
- Степень окисления калия
- Примеры распределения электронов по энергетическим уровням
- Многоэлектронные атомы
- Энергия ионизации
Строение атома калия
Общие сведения о строении атома калия
Относится к элементам s — семейства. Металл. Элементы-металлы, входящие в эту группу, носят общее название щелочных. Обозначение – K. Порядковый номер – 19. Относительная атомная масса – 39,102 а.е.м.
Электронное строение атома калия
Атом калия состоит из положительно заряженного ядра (+19), внутри которого есть 19 протонов и 20 нейтронов, а вокруг, по 4-м орбитам движутся 19 электронов.
Рис.1. Схематическое строение атома калия.
Распределение электронов по орбиталям выглядит следующим образом:
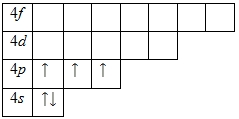
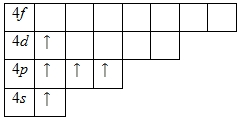
Внешний энергетический уровень атома калия содержит 1 электрон, который является валентным. Степень окисления калия равна +1. Энергетическая диаграмма основного состояния принимает следующий вид:
Возбужденного состояния, несмотря на наличие вакантных 3p— и 3d-орбиталей нет.
Примеры решения задач
| Задание | Атом элемента имеет следующую электронную конфигурацию 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 3 . Укажите: а) заряд ядра; б) число завершенных энергетических уровней в электронной оболочке этого атома; в) максимально возможную степень окисления; г) валентность атома в соединении с водородом. |
| Решение | Для того, чтобы ответить на поставленные вопросы, сначала нужно определить общее число электронов в атоме химического элемента. Это можно сделать, сложив все электроны, имеющиеся в атоме, не учитывая их распределения по энергетическим уровням: |
Это мышьяк (As). Теперь ответим на вопросы:
б) атом имеет четыре уровня, из которых завершенными являются три;
в) запишем энергетическую диаграмму для валентных электронов атома мышьяка в основном состоянии.
Мышьяк способен переходит в возбужденное состояние: электроны s-подуровня распариваются и один из них переходит на вакантную d-орбиталь.
Пять неспаренных электронов свидетельствуют о том, что максимально возможная степень окисления мышьяка равна +5;
г) Валентность мышьяка в соединении с водородом равна III (AsH3).
| Задание | Напишите электронные формулы атомов: а) третьегоp-элемента четвертого периода; б) второго s-элемента пятого периода; в) девятого d-элемента четвертого периода. |
| Ответ | а) Третийp-элемент четвертого периода – это мышьяк 33 As. |
б) Второй s-элемент пятого периода – это стронций 38 Sr.
в) Девятый d-элемент четвертого периода – это медь 29 Cu.
Источник
Калий K
Калий в таблице менделеева занимает 19 место, в 4 периоде.
| Символ | K |
| Номер | 19 |
| Атомный вес | 39.0983000 |
| Латинское название | Kalium, Calium |
| Русское название | Калий |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема калия
K: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1
Одинаковую электронную конфигурацию имеют атом калия и Cl -2 , Sc +2 , Ti +3 , V +4 , Mn +6
Порядок заполнения оболочек атома калия (K) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на ‘d’ — до 10 и на ‘f’ до 14
Калий имеет 19 электронов, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
1 электрон на 4s-подуровне
Степень окисления калия
Атомы калия в соединениях имеют степени окисления 1, -1.
Степень окисления — это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Ионы калия
Валентность K
Атомы калия в соединениях проявляют валентность I.
Валентность калия характеризует способность атома K к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа K
Квантовые числа определяются последним электроном в конфигурации, для атома K эти числа имеют значение N = 4, L = 0, Ml = 0, Ms = ½
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Чем ближе электрон к центру атома — тем больше энергии необходимо, что бы его оторвать. Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo. Если не указано иное, то энергия ионизации — это энергия отрыва первого электрона, также существуют энергии ионизации для каждого последующего электрона.
Перейти к другим элементам таблицы менделеева
Источник
Калий K
Калий в таблице менделеева занимает 19 место, в 4 периоде.
| Символ | K |
| Номер | 19 |
| Атомный вес | 39.0983000 |
| Латинское название | Kalium, Calium |
| Русское название | Калий |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема калия
K: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1
Одинаковую электронную конфигурацию имеют атом калия и Cl -2 , Sc +2 , Ti +3 , V +4 , Mn +6
Порядок заполнения оболочек атома калия (K) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на ‘d’ — до 10 и на ‘f’ до 14
Калий имеет 19 электронов, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
1 электрон на 4s-подуровне
Степень окисления калия
Атомы калия в соединениях имеют степени окисления 1, -1.
Степень окисления — это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Ионы калия
Валентность K
Атомы калия в соединениях проявляют валентность I.
Валентность калия характеризует способность атома K к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа K
Квантовые числа определяются последним электроном в конфигурации, для атома K эти числа имеют значение N = 4, L = 0, Ml = 0, Ms = ½
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Чем ближе электрон к центру атома — тем больше энергии необходимо, что бы его оторвать. Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo. Если не указано иное, то энергия ионизации — это энергия отрыва первого электрона, также существуют энергии ионизации для каждого последующего электрона.
Перейти к другим элементам таблицы менделеева
Источник
Электронная формула калия (элемент 19). Графическая схема
Распределение в порядке заполнения орбиталей
На вы также можете открыть распределение электронов по слоям (вторая таблица, расположенная ниже).
Электронные формулы атомов химических элементов (расположение слоев в порядке заполнения подуровней)
| № эл-та | Химический знак | Название элемента | Электронная формула |
| 1 | H | водород | 1s 1 |
| 2 | He | гелий | 1s 2 |
| II период | |||
| 3 | Li | литий | 1s 2 2s 1 |
| 4 | Be | бериллий | 1s 2 2s 2 |
| 5 | B | бор | 1s 2 2s 2 2p 1 |
| 6 | C | углерод | 1s 2 2s 2 2p 2 |
| 7 | N | азот | 1s 2 2s 2 2p 3 |
| 8 | O | кислород | 1s 2 2s 2 2p 4 |
| 9 | F | фтор | 1s 2 2s 2 2p 5 |
| 10 | Ne | неон | 1s 2 2s 2 2p 6 |
| III период | |||
| 11 | Na | натрий | 1s 2 2s 2 2p 6 3s 1 |
| 12 | Mg | магний | 1s 2 2s 2 2p 6 3s 2 |
| 13 | Al | алюминий | 1s 2 2s 2 2p 6 3s 2 3p 1 |
| 14 | Si | кремний | 1s 2 2s 2 2p 6 3s 2 3p 2 |
| 15 | P | фосфор | 1s 2 2s 2 2p 6 3s 2 3p 3 |
| 16 | S | сера | 1s 2 2s 2 2p 6 3s 2 3p 4 |
| 17 | Cl | хлор | 1s 2 2s 2 2p 6 3s 2 3p 5 |
| 18 | Ar | аргон | 1s 2 2s 2 2p 6 3s 2 3p 6 |
| IV период | |||
| 19 | K | калий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 |
| 20 | Ca | кальций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 |
| 21 | Sc | скандий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 1 |
| 22 | Ti | титан | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 2 |
| 23 | V | ванадий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 3 |
| 24 | Cr | хром | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 5 |
| 25 | Mn | марганец | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5 |
| 26 | Fe | железо | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6 |
| 27 | Co | кобальт | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 7 |
| 28 | Ni | никель | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 8 |
| 29 | Cu | медь | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 10 |
| 30 | Zn | цинк | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 |
| 31 | Ga | галлий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 1 |
| 32 | Ge | германий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 2 |
| 33 | As | мышьяк | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 3 |
| 34 | Se | селен | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 4 |
| 35 | Br | бром | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 5 |
| 36 | Kr | криптон | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 |
| V период | |||
| 37 | Rb | рубидий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 |
| 38 | Sr | стронций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 |
| 39 | Y | иттрий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 1 |
| 40 | Zr | цирконий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 2 |
| 41 | Nb | ниобий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 4d 4 |
| 42 | Mo | молибден | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 4d 5 |
| 43 | Tc | технеций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 5 |
| 44 | Ru | рутений | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 4d 7 |
| 45 | Rh | родий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 4d 8 |
| 46 | Pd | палладий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s4d 10 |
| 47 | Ag | серебро | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 4d 10 |
| 48 | Cd | кадмий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 |
| 49 | In | индий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 1 |
| 50 | Sn | олово | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 2 |
| 51 | Sb | сурьма | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 22 4d 10 5p 3 |
| 52 | Te | теллур | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 4 |
| 53 | I | йод | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 5 |
| 54 | Xe | ксенон | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 |
| VI период | |||
| 55 | Cs | цезий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 1 |
| 56 | Ba | барий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 |
| 57 | La | лантан | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 5d 1 |
| 58 | Ce | церий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 2 |
| 59 | Pr | празеодим | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 3 |
| 60 | Nd | неодим | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 4 |
| 61 | Pm | прометий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 5 |
| 62 | Sm | самарий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 6 |
| 63 | Eu | европий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 7 |
| 64 | Gd | гадолиний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 7 5d 1 |
| 65 | Tb | тербий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 9 |
| 66 | Dy | диспрозий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 10 |
| 67 | Ho | гольмий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 11 |
| 68 | Er | эрбий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 12 |
| 68 | Tm | тулий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 13 |
| 70 | Yb | иттербий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 |
| 71 | Lu | лютеций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 1 |
| 72 | Hf | гафний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 2 |
| 73 | Ta | тантал | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 3 |
| 74 | W | вольфрам | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 4 |
| 75 | Re | рений | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 5 |
| 76 | Os | осмий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 6 |
| 77 | Ir | иридий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 7 |
| 78 | Pt | платина | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 1 4f 14 5d 9 |
| 79 | Au | золото | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 1 4f 14 5d 10 |
| 80 | Hg | ртуть | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 |
| 81 | Tl | таллий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 1 |
| 82 | Pb | свинец | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 2 |
| 83 | Bi | висмут | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 3 |
| 84 | Po | полоний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 4 |
| 85 | At | астат | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 5 |
| 86 | Rn | радон | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 |
| VII период | |||
| 87 | Fr | франций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 1 |
| 88 | Ra | радий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 |
| 89 | Ac | актиний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 6d 1 |
| 90 | Th | торий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 6d 2 5f |
| 91 | Pa | протактиний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 2 6d 1 |
| 92 | U | уран | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 3 6d 1 |
| 93 | Np | нептуний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 4 6d 1 |
| 94 | Pu | плутоний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 5 6d 1 |
| 95 | Am | америций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 7 |
| 96 | Cm | кюрий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 7 6d 1 |
| 97 | Bk | берклий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 8 6d 1 |
| 98 | Cf | калифорний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 10 |
| 99 | Es | эйнштейний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 11 |
| 100 | Fm | фермий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 12 |
| 101 | Md | менделеевий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 13 |
| 102 | No | нобелий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 |
| 103 | Lr | лоуренсий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 1 |
| 104 | Rf | резерфордий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 2 |
| 105 | Db | дубний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 3 |
| 106 | Sg | сиборгий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 4 |
| 107 | Bh | борий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 5 |
| 108 | Hs | хассий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 6 |
| 109 | Mt | мейтнерий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 7 |
| Обозначения элементов: | |||
| s-элементы | p-элементы | d-элементы | f-элементы |
Видео
Электронное строение атома калия
Атом калия состоит из положительно заряженного ядра (+19), внутри которого есть 19 протонов и 20 нейтронов, а вокруг, по 4-м орбитам движутся 19 электронов.
Рис.1. Схематическое строение атома калия.
Распределение электронов по орбиталям выглядит следующим образом:
Внешний энергетический уровень атома калия содержит 1 электрон, который является валентным. Степень окисления калия равна +1. Энергетическая диаграмма основного состояния принимает следующий вид:
Возбужденного состояния, несмотря на наличие вакантных 3p— и 3d-орбиталей нет.
Степень окисления калия
Атомы калия в соединениях имеют степени окисления 1, -1.
Степень окисления — это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Примеры распределения электронов по энергетическим уровням
Прежде чем рассматривать, какова электронная конфигурация иона калия, приведем простые примеры. В атоме водорода ядро содержит один положительный протон. Вокруг ядра по орбите вращается один электрон. В основном состоянии электронная формула водорода имеет следующий вид: 1s. Рассмотрим особенности ориентации спина у этого электрона. Согласно правилу Хунда, он сонаправлен со спином ядра.
Для гелия, имеющего второй порядковый номер в таблице элементов, два электрона располагают на одной орбитали. Каждый из них обладает ½ спина, имеет разное направление вращения.
У элементов второго энергетического уровня появляется две оболочки, каждая обладает своим запасом энергии.
Калий является элементом четвертого периода системы элементов, поэтому у него четыре электронных уровня, каждый из которых содержит разные виды подуровней.
В нормальном состоянии атом этого щелочного металла имеет следующую конфигурацию: 1s22s22p63s23p64s1.
Электронная конфигурация иона калия имеет отличия от атома. На внешнем энергетическом уровне металла располагается один валентный электрон. Так как калий проявляет восстановительные свойства, во время взаимодействий с другими атомами он отдает валентный электрон, превращается в положительный ион (катион), имеющий следующую электронную конфигурацию: 1s22s22p63s23p64s0.
Многоэлектронные атомы
Электронная конфигурация калия записывается с учетом принципа запрета Паули. Учитывая особенности волновой природы электронов, он предположил, что каждая отрицательная частица располагается на «орбитали», то есть обладает определенным пространственным существованием. Что касается многоэлектронного атома, к которым относится калий, на каждой орбитали не может располагаться больше двух электронов. В результате было выделено четыре квантовых числа, характеризующих состояние электрона в рассматриваемый временной промежуток.
Энергия ионизации
Чем ближе электрон к центру атома — тем больше энергии необходимо, что бы его оторвать. Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo. Если не указано иное, то энергия ионизации — это энергия отрыва первого электрона, также существуют энергии ионизации для каждого последующего электрона.
Энергия ионизации K: Eo = 419 кДж/моль — Что такое ион читайте .
Источник