Fe (железо) — элемент с прядковым номером 26 в периодической системе.
Находится в IV периоде. Температура плавления: 1535 ℃. Плотность: 7.87 г/см3.
Электронная формула атома железа в порядке возрастания энергий орбиталей:
1s2 2s2 2p6 3s2 3p6 4s2 3d6
Электронная формула атома железа в порядке следования уровней:
1s2 2s2 2p6 3s2 3p6 3d6 4s2
Сокращенная электронная конфигурация Fe:
[Ar] 3d6 4s2
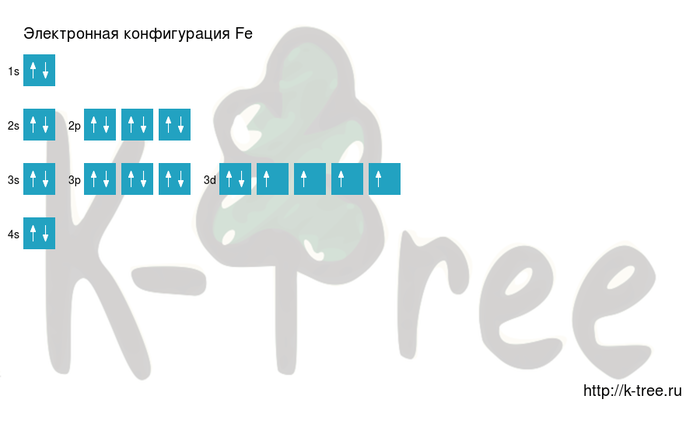
Ниже приведена электронно-графическая схема атома железа
Распределение электронов по энергетическим уровням в атоме Fe
1-й уровень (K): 2
2-й уровень (L): 8
3-й уровень (M): 14
4-й уровень (N): 2
Валентные электроны железа
Количество валентных электронов в атоме железа — 8.
Ниже приведены их квантовые числа (N — главное, L — орбитальное, M — магнитное, S — спин)
| Орбиталь | N | L | M | S |
|---|---|---|---|---|
| s | 4 | 0 | 0 | +1/2 |
| s | 4 | 0 | 0 | -1/2 |
| d | 3 | 2 | -2 | +1/2 |
| d | 3 | 2 | -1 | +1/2 |
| d | 3 | 2 | 0 | +1/2 |
| d | 3 | 2 | 1 | +1/2 |
| d | 3 | 2 | 2 | +1/2 |
| d | 3 | 2 | -2 | -1/2 |
Степени окисления, которые может проявлять железо: +1, +2, +3, +4, +5, +6
поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,662 -
гуманитарные
33,654 -
юридические
17,917 -
школьный раздел
611,978 -
разное
16,905
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Железо в таблице менделеева занимает 26 место, в 4 периоде.
| Символ | Fe |
| Номер | 26 |
| Атомный вес | 55.8450000 |
| Латинское название | Ferrum |
| Русское название | Железо |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема железа
Fe: 1s2 2s2 2p6 3s2 3p6 4s2 3d6
Короткая запись:
Fe: [Ar]4s2 3d6
Одинаковую электронную конфигурацию имеют
атом железа и
Mn-1, Co+1, Ni+2
Порядок заполнения оболочек атома железа (Fe) электронами:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d →
5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на
‘d’ — до 10 и на ‘f’ до 14
Железо имеет 26 электронов,
заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
6 электронов на 3d-подуровне
Степень окисления железа
Атомы железа в соединениях имеют степени окисления 6, 5, 4, 3, 2, 1, 0, -1, -2.
Степень окисления — это условный заряд атома в соединении: связь в молекуле
между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается
заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается,
то степень окисления положительная.
Ионы железа
Валентность Fe
Атомы железа в соединениях проявляют валентность VI, V, IV, III, II, I.
Валентность железа характеризует способность атома Fe к образованию хмических связей.
Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании
химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Fe
Квантовые числа определяются последним электроном в конфигурации,
для атома Fe эти числа имеют значение N = 3, L = 2, Ml = 3, Ms = -½
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Чем ближе электрон к центру атома — тем больше энергии необходимо, что бы его оторвать.
Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo.
Если не указано иное, то энергия ионизации — это энергия отрыва первого электрона, также существуют энергии
ионизации для каждого последующего электрона.
Энергия ионизации Fe:
Eo = 763 кДж/моль
— Что такое ион читайте в статье.
Перейти к другим элементам таблицы менделеева
Где Fe в таблице менделеева?
Таблица Менделеева
Скачать таблицу менделеева в хорошем качестве
III. Роль железа в жизни человека и растений
Биохимики открыли важную роль железа в жизни растений, животных и человека. Входя в состав чрезвычайно сложно построенного органического соединения, называемого гемоглобином, железо обусловливает красную окраску этого вещества, от которого в свою очередь, зависит цвет крови человека и животных. В организме взрослого человека содержится 3 г чистого железа, 75% которого входит в состав гемоглобина. Основная роль гемоглобина – перенос кислорода из легких к тканям, а в обратном направлении – CO2.
Железо необходимо и растениям. Оно входит в состав цитоплазмы, участвует в процессе фотосинтеза. Растения, выращенные на субстрате, не содержащем железа, имеют белые листья. Маленькая добавка железа к субстрату – и они приобретают зеленый цвет. Больше того, стоит белый лист смазать раствором соли, содержащей железо, и вскоре смазанное место зеленеет.
Так от одной и той же причины – наличия железа в соках и тканях – весело зеленеют листья растений и ярко румянятся щеки человека.
IV. Физические свойства железа
Железо – это серебристо-белый металл с температурой плавления 1539оС. Очень пластичный, поэтому легко обрабатывается, куется, прокатывается, штампуется. Железо обладает способностью намагничиваться и размагничиваться, поэтому применяется в качестве сердечников электромагнитов в различных электрических машинах и аппаратах. Ему можно придать большую прочность и твердость методами термического и механического воздействия, например, с помощью закалки и прокатки.
Различают химически чистое и технически чистое железо. Технически чистое железо, по сути, представляет собой низкоуглеродистую сталь, оно содержит 0,02-0,04% углерода, а кислорода, серы, азота и фосфора – еще меньше. Химически чистое железо содержит менее 0,01% примесей. Химически чистое железо – серебристо-серый, блестящий, по внешнему виду очень похожий на платину металл. Химически чистое железо устойчиво к коррозии и хорошо сопротивляется действию кислот. Однако ничтожные доли примесей лишают его этих драгоценный свойств.
V. Получение железа
Восстановлением из оксидов углём или оксидом углерода (II), а также водородом:
FeO + C = Fe + CO
Fe2O3 + 3CO = 2Fe + 3CO2
Fe2O3 + 3H2 = 2Fe + 3H2O
Опыт «Получение железа алюминотермией»
VI. Химические свойства железа
Как элемент побочной подгруппы железо может проявлять несколько степеней окисления. Мы рассмотрим только соединения, в которых железо проявляет степени окисления +2 и +3. Таким образом, можно говорить, что у железа имеется два ряда соединений, в которых оно двух- и трехвалентно.
1) На воздухе железо легко окисляется в присутствии влаги (ржавление):
4Fe + 3O2 + 6H2 O = 4Fe(OH)3
2) Накалённая железная проволока горит в кислороде, образуя окалину — оксид железа (II, III) — вещество чёрного цвета:
3Fe + 2O2 = Fe3O4
При пропускании кислорода через расплавленное железо возможно образование оксида железа (II):
2Fe+O2=2FeO
C кислородом во влажном воздухе образуется Fe2O3‧nH2O
Опыт «Горение железа в кислороде«
3) При высокой температуре (700–900°C) железо реагирует с парами воды:
3Fe + 4H2O =t˚C= Fe3O4 + 4H2
4) Железо реагирует с неметаллами при нагревании:
Железо реагирует с галогенами с образованием галогенидов. При этом активные неметаллы (фтор, хлор и бром) окисляют железо до степени окисления +3:
2Fe + 3Cl2 =t= 2FeCl3
Менее активный йод окисляет железо до степени окисления +2:
Fe + I2 =t= FeI2
Железо реагирует с серой с образованием сульфида железа (II):
Fe + S =t= FeS
Железо реагирует с фосфором. При этом образуется бинарное соединения – фосфид железа:
Fe + P =t= FeP
С азотом железо реагирует при нагревании с образованием нитрида:
6Fe + N2 =t= 2Fe3N
Железо реагирует с углеродом и кремнием с образованием карбида и силицида:
3Fe + C =t= Fe3C
5) Железо легко растворяется в соляной и разбавленной серной кислотах при обычных условиях:
Fe + 2HCl = FeCl2 + H2
Fe + H2SO4(разб.) = FeSO4 + H2
6) В концентрированных кислотах – окислителях железо растворяется только при нагревании
При обычных условиях железо не реагирует с концентрированной серной кислотой из-за пассивации – образования плотной оксидной пленки. При нагревании реакция идет, образуются оксид серы (IV), сульфат железа (III) и вода:
2Fe + 6H2SO4(конц.) =t= Fe2(SO4)3 + 3SO2 + 6H2O
Железо не реагирует при обычных условиях с концентрированной азотной кислотой также из-за пассивации. При нагревании реакция идет с образованием нитрата железа (III), оксида азота (IV) и воды:
Fe+6HNO3(конц.) =t= Fe(NO3)3+3NO2+3H2O
С разбавленной азотной кислотой железо реагирует с образованием оксида азота (II):
Fe+4HNO3(разб.гор.) =t= Fe(NO3)3+NO+2H2O
При взаимодействии железа с очень разбавленной азотной кислотой образуется нитрат аммония:
8Fe+30HNO3(оч. разб.) =t= 8Fe(NO3)3+3NH4NO3+9H2O
Опыт «Взаимодействие железа с концентрированными кислотами»
7) Железо вытесняет металлы, стоящие правее его в ряду напряжений из растворов их солей.
Fe + CuSO4 = FeSO4 + Cu

При взаимодействии железа с расплавом нитрата калия в присутствии гидроксида калия железо окисляется до феррата калия, а азот восстанавливается либо до нитрита калия, либо до аммиака:
Fe+2KOH+3KNO3=3KNO2+K2FeO4+H2O
9) Простое вещество железо восстанавливает железо до степени окисления +2 при взаимодействии с соединениями железа +3:
2Fe(NO3)3+Fe=3Fe(NO3)2
2FeCl3+Fe=3FeCl2
Fe2(SO4)3+Fe=3FeSO4
VII. Качественные реакции на
Железо (II)
Железо (III)
VIII. Применение железа
Основная часть получаемого в мире железа используется для получения чугуна и стали — сплавов железа с углеродом и другими металлами. Чугуны содержат около 4% углерода. Стали содержат углерода менее 1,4%.
Чугуны необходимы для производства различных отливок — станин тяжелых машин и т.п.
Изделия из чугуна
Стали используются для изготовления машин, различных строительных материалов, балок, листов, проката, рельсов, инструмента и множества других изделий. Для производства различных сортов сталей применяют так называемые легирующие добавки, которыми служат различные металлы: Мn, Сr, Мо и другие, улучшающие качество стали.
Изделия из стали
«Появление железа»
Это интересно
Электронное строение атома железа
Электронное строение нейтрального атома железа в основном состоянии.
Схема строения электронных оболочек
Распределение электронов по энергетическим уровням (или по электронным слоям) в атоме железа.
Fe
+26
2
8
14
2
Электронно-графическая схема
Распределение электронов по атомным орбиталям в атоме железа.
| 4 | ↑↓ | |||||||||||
| 3 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑ | ↑ | ↑ | ↑ | |||
| 2 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ||||||||
| 1 | ↑↓ | |||||||||||
| s | p | d |
Валентные орбитали атома железа выделены фиолетовым цветом.
Электронная конфигурация
Полная электронная конфигурация атома железа.
26Fe 1s2 2s2 2p6 3s2 3p6 3d6 4s2
Сокращённая электронная конфигурация атома железа.
26Fe [Ar] 3d6 4s2
Квантовые числа валентных электронов
Главное (n), орбитальное (l), магнитное (m) и спиновое (s) квантовые числа валентных электронов атома железа.
| Орбиталь | Квантовое число | |||
|---|---|---|---|---|
| n | l | m | s | |
| 3d | 3 | 2 | -2 | +½ |
| -½ | ||||
| 0 | +½ | |||
| 1 | +½ | |||
| 2 | +½ | |||
| 3 | +½ | |||
| 4s | 4 | 0 | 0 | +½ |
| -½ |