Загрузить PDF
Загрузить PDF
Энергия связи является важным понятием в химии. Она определяет количество энергии, которое необходимо для разрыва ковалентной связи между двумя атомами газа.[1]
Данное понятие неприменимо по отношению к ионным связям.[2]
Когда два атома соединяются в молекулу, можно определить, насколько крепка связь между ними — достаточно найти энергию, которую необходимо затратить для разрыва этой связи. Помните, что единичный атом не обладает энергией связи, эта энергия характеризует силу связи двух атомов в молекуле. Чтобы рассчитать энергию связи для какой-либо химической реакции, просто определите общее количество разорванных связей и вычтите из него количество образовавшихся связей.
-
1
Запишите уравнение для вычисления энергии связи. Согласно определению, энергия связи представляет собой сумму разорванных связей за вычетом суммы сформированных связей: ΔH = ∑H(разорванные связи) — ∑H(образовавшиеся связи). ΔH обозначает изменение энергии связи, которое называют также энтальпией связи, а ∑H соответствует сумме энергий связи для обеих частей уравнения химической реакции.[3]
- Данное равенство выражает закон Гесса.
- Энергия связи измеряется в килоджоулях на моль (кДж/моль).[4]
-
2
Запишите химическое уравнение и обозначьте все связи между отдельными элементами. Если дано уравнение реакции в виде химических символов и цифр, полезно переписать его и обозначить все связи между атомами. Такая наглядная запись позволит вам легко посчитать связи, которые разрываются и образуются в ходе данной реакции.
- Помните, что в левой части уравнения расположены реагенты, а в правой — продукты реакции.
- Одинарные, двойные и тройные связи обладают разной энергией, поэтому будьте внимательны и правильно обозначайте связи между различными элементами.[5]
- К примеру, рассмотрим следующую реакцию: H2(газ) + Br2(газ) —> 2 HBr(газ)
- H-H + Br-Br —> 2 H-Br
-
3
Изучите правила подсчета разорванных и образовавшихся связей. В большинстве случаев при расчетах используются средние значения энергии связи.[6]
Одна и та же связь может иметь немного разную энергию, в зависимости от конкретной молекулы, поэтому обычно используют средние значения энергии связи.[7]
.- Разрывы одинарной, двойной и тройной химической связи рассматриваются как одна разорванная связь. Хотя эти связи обладают разными энергиями, в каждом случае считается, что разрывается одна связь.
- То же самое относится и к образованию одинарной, двойной или тройной связи. Каждый такой случай рассматривается как формирование одной новой связи.
- В нашем примере все связи являются одинарными.
-
4
Определите, какие связи разрываются в левой части уравнения. Левая часть химического уравнения содержит реагирующие вещества, и в ней представлены все связи, которые разрываются в результате реакции. Это эндотермический процесс, то есть для разрыва химических связей необходимо затратить определенную энергию.[8]
- К нашем примере левая часть уравнения реакции содержит одну связь H-H и одну связь Br-Br.
-
5
Подсчитайте количество образовавшихся связей в правой части уравнения. Справа указаны продукты реакции. В этой части уравнения представлены все связи, которые образуются в результате химической реакции. Это экзотермический процесс, и он протекает с выделением энергии (обычно в виде тепла).[9]
- В нашем примере в правой части уравнения содержатся две связи H-Br.
Реклама
-
1
Найдите необходимые значения энергии связи. Есть множество таблиц, в которых приведены значения энергии связи для самых разных соединений. Такие таблицы можно найти в интернете или справочнике по химии. Следует помнить, что значения энергии связи всегда приводятся для молекул в газообразном состоянии.[10]
- Для нашего примера необходимо найти значения энергии связей H-H, Br-Br и H-Br.
- H-H = 436 кДж/моль; Br-Br = 193 кДж/моль; H-Br = 366 кДж/моль.[11]
- Чтобы вычислить энергию связи для молекул в жидком состоянии, необходимо также найти энтальпию испарения данной жидкости. Это количество энергии, которое необходимо для перевода вещества из жидкого в газообразное состояние.[12]
Данное значение прибавляется к общей энергии связи.- Например, в случае воды необходимо добавить в уравнение энтальпию испарения воды (+41 кДж).[13]
- Например, в случае воды необходимо добавить в уравнение энтальпию испарения воды (+41 кДж).[13]
-
2
Умножьте значения энергии связи на число разорванных связей. В ряде реакций одна связь может разрываться несколько раз.[14]
Например, если молекула состоит из 4 атомов водорода, то энергию связи водорода следует учесть 4 раза, то есть умножить на 4.- В нашем примере каждая молекула имеет по одной связи, поэтому значения энергии связи просто умножаются на 1.
- H-H = 436 x 1 = 436 кДж/моль
- Br-Br = 193 x 1 = 193 кДж/моль
-
3
Сложите все энергии разорванных связей. После того как вы умножите значения энергий связи на соответствующее количество связей в левой части уравнения, необходимо найти общую сумму.[15]
- Найдем суммарную энергию разорванных связей для нашего примера: H-H + Br-Br = 436 + 193 = 629 кДж/моль.
-
4
Умножьте значения энергии связи на количество образовавшихся связей. Как и в случае с разорванными связями в левой части уравнения, следует взять значения энергий связи в правой части уравнения и умножить их на соответствующее число этих связей.[16]
Например, если образуется четыре связи между атомами водорода, необходимо умножить энергию данной связи на 4.- В нашем примере образуется две связи H-Br, поэтому энергию связи H-Br (366 кДж/моль) следует умножить на 2: 366 x 2 = 732 кДж/моль.
-
5
Сложите все энергии образовавшихся связей. Как и в случае разорванных связей, следует сложить все энергии образовавшихся связей, которые представлены в правой части уравнения.[17]
Если в результате реакции образуется лишь одно вещество, данный шаг можно пропустить.- В нашем примере образуется одно вещество, поэтому энергия сформировавшихся связей равна удвоенной энергии связи H-Br, то есть 732 кДж/моль.
-
6
Вычтите энергию образовавшихся связей из энергии разорванных связей. После того как вы сложите все связи в левой и правой частях уравнения, просто отнимите от разорванных связей образовавшиеся связи. Вспомните приведенное выше уравнение: ΔH = ∑H(разорванные связи) — ∑H(образовавшиеся связи). Подставьте вычисленные значения и найдите разность.
- Для нашего примера имеем: ΔH = ∑H(разорванные связи) — ∑H(образовавшиеся связи) = 629 кДж/моль — 732 кДж/моль = -103 кДж/моль.
-
7
Определите, является ли реакция эндотермической или экзотермической. Последний шаг при вычислении энергии связи состоит в том, чтобы выяснить, поглощается или выделяется энергия в ходе данной реакции. При эндотермических реакциях энергия поглощается, и итоговая энергия связи имеет положительное значение, в то время как при экзотермических реакциях энергия выделяется, и энергия связи принимает отрицательные значения.[18]
- В нашем примере общая энергия связи отрицательна, то есть рассмотренная реакция является экзотермической.
Реклама
Об этой статье
Эту страницу просматривали 26 406 раз.
Была ли эта статья полезной?
Download Article
Download Article
Bond energy is an important concept in chemistry that defines the amount of energy needed to break a bond between a covalently bound gas.[1]
This type of bond energy does not apply to ionic bonds. When 2 atoms bind together to form a new molecule, it is possible to determine how strong the bond between atoms is by measuring the amount of energy needed to break that bond. Remember, a single atom does not have a bond energy; it is the bond between 2 atoms that has energy. To calculate the bond energy of a reaction, simply determine the total number of bonds broken and then subtract the total number of bonds formed.
-
1
Define the equation for calculating bond energy. Bond energy is defined by the sum of all of the bonds broken minus the sum of all of the bonds formed: ΔH = ∑H(bonds broken) — ∑H(bonds formed). ΔH is the change in bond energy, also referred to as the bond enthalpy and ∑H is the sum of the bond energies for each side of the equation.[2]
- This equation is a form of Hess’s Law.
- The unit for bond energy is kilojoules per mol or kJ/mol.[3]
-
2
Draw the chemical equation showing all of the bonds between molecules. When given a reaction equation simply written with chemical symbols and numbers, it is helpful to draw this equation out, illustrating all of the bonds formed between the various elements and molecules. This visual representation will allow you to easily count all of the bonds that break and form on the reactant and product sides of the equation.
- Remember, the left side of the equation is all of the reactants and the right side is all of the products.
- Single, double, and triple bonds have different bond energies, so be sure to draw your diagram with the correct bonds between elements.[4]
- For example, if you were to draw out the following equation for a reaction between 2 hydrogen and 2 bromine: H2(g) + Br2(g) —> 2 HBr(g), you would get: H-H + Br-Br —> 2 H-Br. The hyphens represent single bonds between the elements in the reactants and the products.
Advertisement
-
3
Know the rules for counting broken and formed bonds. In most cases, the bond energies you will be using for these calculations will be averages.[5]
The same bond can have a slightly different bond energy based on the molecule it is formed in; therefore, average bond energies are generally used.[6]
- A single, double, and triple bond are all treated as 1 break. They all have different bond energies, but count as only a single break.
- The same is true for the formation of a single, double, or triple bond. It will be counted as single formation.
- For our example, all of the bonds are single bonds.
-
4
Identify the bonds broken on the left side of the equation. The left side contains the reactants. These will represent all of the broken bonds in the equation. This is an endothermic process that requires the absorption of energy to break the bonds.[7]
- For our example, the left side has 1 H-H bond and 1 Br-Br bond.
-
5
Count the bonds formed on the right side of the equation. The right side contains all of the products. These are all of the bonds that will be formed. This is an exothermic process that releases energy, usually in the form of heat.[8]
- For our example, the right side has 2 H-Br bonds.
Advertisement
-
1
Look up the bond energies of the bonds in question. There are many tables that have information on the average bond energies for a specific bond. These tables can be found online or in a chemistry book. It is important to note that these bond energies are always for molecules in a gaseous state.[9]
- For our example, you need to find the bond energy for an H-H bond, a Br-Br bond, and an H-Br bond.
- H-H = 436 kJ/mol; Br-Br = 193 kJ/mol; H-Br = 366 kJ/mol.
- To calculate bond energy for molecules in a liquid state, you need to also look up the enthalpy change of vaporization for the liquid molecule. This is the amount of energy needed to convert the liquid into a gas.[10]
This number is added to the total bond energy.- For example: If you were given liquid water, you would need to add the enthalpy change of vaporization of water (+41 kJ) to the equation.[11]
- For example: If you were given liquid water, you would need to add the enthalpy change of vaporization of water (+41 kJ) to the equation.[11]
-
2
Multiply the bond energies by the number of bonds broken. In some equations, you may have the same bond broken multiple times.[12]
For example, if 4 atoms of hydrogen are in the molecule, then the bond energy of hydrogen must be counted 4 times, or multiplied by 4.- In our example, there is only 1 bond of each molecule, so the bond energies are simply multiplied by 1.
- H-H = 436 x 1 = 436 kJ/mol
- Br-Br = 193 x 1 = 193 kJ/mol
-
3
Add up all of the bond energies of the broken bonds. Once you have multiplied the bond energies by the number of the individual bonds, you need to then sum all of the bonds on the reactant side.[13]
- For our example, the sum of the bonds broken is H-H + Br-Br = 436 + 193 = 629 kJ/mol.
-
4
Multiply the bond energies by the number of bonds formed. Just as you did for the bonds broken on the reactant side, you will multiply the number of bonds formed by its respective bond energy.[14]
If you have 4 hydrogen bonds formed, you would need to multiply that bond energy by 4.- For our example we have 2 H-Br bonds formed, so the bond energy of H-Br (366 kJ/mol) will be multiplied by 2: 366 x 2 = 732 kJ/mol.
-
5
Add up all of the formed bond energies. Again, like you did with the bonds broken, you will add up all of the bonds formed on the product side.[15]
Sometimes you will only have 1 product formed and can skip this step.- In our example, there is only 1 product formed, so the energy of the bonds formed is simply the energy of the 2 H-Br bonds or 732 kJ/mol.
-
6
Subtract the formed bonds from the broken bonds. Once you have summed all of the bond energies for both sides, simply subtract the formed bonds from the broken bonds. Remember the equation: ΔH = ∑H(bonds broken) — ∑H(bonds formed). Plug in the calculated values and subtract.[16]
- For our example: ΔH = ∑H(bonds broken) — ∑H(bonds formed) = 629 kJ/mol — 732 kJ/mol = -103 kJ/mol.
-
7
Determine whether the entire reaction was endothermic or exothermic. The final step to calculating bond energy is to determine whether the reaction releases energy or consumes energy. An endothermic (one that consumes energy) will have a final bond energy that is positive, while an exothermic reaction (one that releases energy) will have a negative bond energy.[17]
- In our example, the final bond energy is negative, therefore, the reaction is exothermic.
Advertisement
Add New Question
-
Question
What is c-h, c-cl bond energy?
c-cl 339, c-h 413.
-
Question
How do I calculate energy released?
Energy released (exothermic reaction, when bonds are forming) is just the enthalpy of bond formation. So it is just ∑H(bonds formed).
-
Question
What is the bond energy of a water molecule?
There are two O-H bonds in water, each having about 463 kJ. 463(2) = about 1852 kJ.
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
References
About This Article
Article SummaryX
To calculate bond energy, start by looking up the bond energies you’re working with either online or in a chemistry book. Then, multiply those bond energies by the number of individual bonds being broken, then add up all the energies on the reactant side of the equation. Next, repeat the process on the other side, multiplying the bond energies by the number of bonds formed and adding them up. Finally, subtract the formed bonds from the broken bonds to get the bond energy. If your answer is positive, the bond is endothermic, and if your answer is negative, the bond is exothermic. For tips on calculating the bond energy for liquid molecules, read on!
Did this summary help you?
Thanks to all authors for creating a page that has been read 239,508 times.
Reader Success Stories
-
«This article really helped me get a better understanding and helped me pass my class.»
Did this article help you?
Home
/ Учебник ОБЩАЯ ХИМИЯ / Глава 4. Химическая связь / Энергия химической связи
Энергия химической связи

С точки зрения выигрыша в энергии, образование связи — это нечто вроде промежуточного процесса между присоединением электрона к нейтральному атому (измеренное сродство к электрону) и присоединением электрона к атому, заряд ядра которого увеличивается на 1 единицу.
Чтобы оценить энергию химической связи молекул, состоящих из многоэлектронных атомов, необходимо оценить:
- энергию связи связывающих электронов с ядрами,
- заряд ядра многоэлектронного атома,
- энергию межэлектронного отталкивания связывающих электронов от всех остальных электронов в молекуле.
Соотношение между энергией ионизации и зарядом ядра можно выразить следующим образом (см. раздел о энергии химической связи в атоме водорода):
EionZ = EionH Z2 , (4.3-1)
где EionZ и EionH — это энергия ионизации у водородоподобного атома и у атома с зарядом Z.
В случае с многоэлектронными атомами, значения зарядов ядер, используемые при вычислениях, не являются действительными зарядами ядер этих атомов. В таких вычислениях следует использовать так называемые эффективные заряды ядер (положительные заряды, которые действуют на связывающую электронную пару).
Аналогично уравнению (4.3-1), значение энергии межъядерного отталкивания, необходимое для оценки энергии молекулы, может быть также оценено с использованием эффективного заряда ядра с помощью выражения:
Erep eff = ErepH2 Zeff1 · Zeff2, (4.3-2)
где Erep eff — это эффективная энергия межъядерного отталкивания в молекуле, состоящей из двух атомов; ErepH2 — энергия отталкивания у молекулы H2; Zeff1 и Zeff2 — эффективные заряды ядер первого и второго атомов с учетом межядерного отталкивания.
Мы рассчитали энергию химической связи двухатомных молекул, состоящих из атомов и нескольких электронов как одноэлектронных атомов или водородоподобных атомов с зарядом ядра, равным эффективному заряду ядра этих молекул.
Для определения изменения электронной энергии при образовании молекулы из однотипных атомов, также как в случае с молекулой водорода, мы вычитаем энергию двух атомов от энергии молекулы и получаем, что эта энергия равна энергии связи в молекуле.
Рассмотрим раскладку сил в молекуле >>
Теперь мы можем вернуться объяснению энергии связи для группы D таблицы 4.4. >>
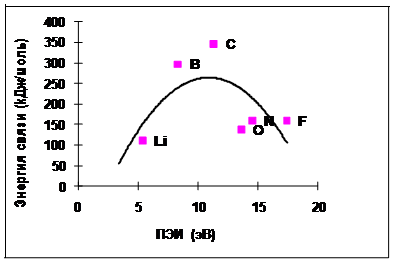
Рис. 4.3-2 Экспериментальные данные по зависимости энергии химической связи в молекуле Х-Х от ПЭИ атома Х для элементов второго периода
На рис. 4.3-2 и 4.3-3 показана зависимость энергии химической связи от ПЭИ атомов, составляющих эти молекулы.
Рис.4.3-3 Зависимость энергии химической связи в молекуле Х-Х от ПЭИ атома Х для элементов третьего периода (расчетные данные и экспериментальные).
Предполагалось, что энергия химической связи и ПЭИ (обе определяемые электростатическим взаимодействием) коррелируют между собой. Однако, расчетная зависимость энергии имеет форму параболы. То есть, когда ПЭИ увеличивается с 5 до 11 эВ [от лития (Li) к углероду (C)], увеличивается энергия химической связи, а при дальнейшем увеличении ПЭИ с 11 до 20 эВ, энергия связи уменьшается.
Согласно экспериментальным данным, энергия связи атомов также увеличивается на интервале с 5 до 11 эВ, но при дальнейшем увеличении ПЭИ от 11 до 16 падает до 0.
Очередное совпадение экспериментальной и расчетной зависимостей говорит о корректности объяснений природы химической связи.
Принципы образования связи в многоэлектронных атомах >>
Потенциал ионизации и энергия связи в двухатомных молекулах >>
Энергия химической связи
Длина связи >>
G-теория химической связи >>
Правило валентности >>
Донорно-акцепторная связь >>
Ван-дер-ваальсовая связь >>
Изомеризация. Динамическая связь >>
Основы стереохимии >>
Под
химической
связью
понимается совокупность взаимодействий,
обусловливающих устойчивое существование
различных частиц: молекул, ионов,
кристаллических и иных веществ.
К основным критериям
наличия химических связей следует
отнести:
а) снижение обшей
энергии многоатомных систем по сравнению
с суммарной энергией изолированных
частиц, из которых эта система образована;
б) перераспределение
электронной плотности химически
связанных частиц по сравнению с простым
наложением электронных плотностей
несвязанных атомов, приближение друг
к другу на расстояние связи.
По своей природе
химическая связь представляет собой
взаимодействие между положительно
заряженными ядрами и отрицательно
заряженными электронами, а также
электронов друг с другом.
Важными количественными
характеристиками химической связи
являются энергия и длина связи.
Энергия химической связи (d) – количество энергии, которое выделяется при образовании данной химической связи из атомов.
Для
многоатомных молекул с однотипными
связями за энергию связи принимается
среднее ее значение, рассчитанное
делением энергии образования соединения
из атомов на число связей. Так, поскольку
энергия, поглощаемая в процессе Н2О
= 2Н + О
равна 924 кДж/моль,
а в молекуле воды обе связи О
– Н химически
эквивалентны, то средняя энергия связи
D(O—H)
= Dдисс../2
= 924/2 = 462 кДж/моль.
Важной
характеристикой химической связи
является ее длина
l,
равная расстоянию между ядрами в
соединении. Она зависит от размеров
электронных оболочек и степени их
перекрывания. Для однотипных видов
связи имеется определенная корреляция
между длиной и энергией связи: с
уменьшением длины связи обычно растет
энергия связи и, соответственно,
устойчивость молекул. Например, для
молекул галогенводородов в ряду
l(НF)
< l(HCl)
< l(HBr)
< l(HI)
растет
длина связи и уменьшается ее энергия
D(H-F)
> D(HCl) > D(HBr) >D(HI).
Основными видами
химической связи являются ионная,
ковалентная и металлическая.
Ионная связьпредставляет собой электростатическое
взаимодействие отрицательно и положительно
заряженных ионов в химическом соединении.
Такая связь возникает в случае большого
различия электроотрицательности атомов,
участвующих в образовании связей.
Подобная ситуация имеет место при
образовании связей между катионамиs-элементов (металлов)
первой и второй групп периодической
системы и анионами неметалловVIиVIIгрупп (LiF,CsCl,K2Oи др.). Высокое различие в электроотрицательности
(ЭО) атомов обусловливает практически
полный переход электронов от атомов с
низкой ЭО к атомам с высокой ЭО и их
ионизацию. В результате доминирующий
вклад в энергию связывания вносит
кулоновское взаимодействие между
противоположно заряженными ионами.
Ковалентной
является химическая связь, образованная
путем обобществления пары электронов
двумя атомами. При сближении двух атомов,
например, атомов хлора, происходит
перекрывание их орбиталей.
Cl Cl
В результате электронная
плотность между ядрами их атомов
возрастает, и ядра притягиваются друг
к другу. При чрезмерном сближении
возрастает отталкивание ядер.
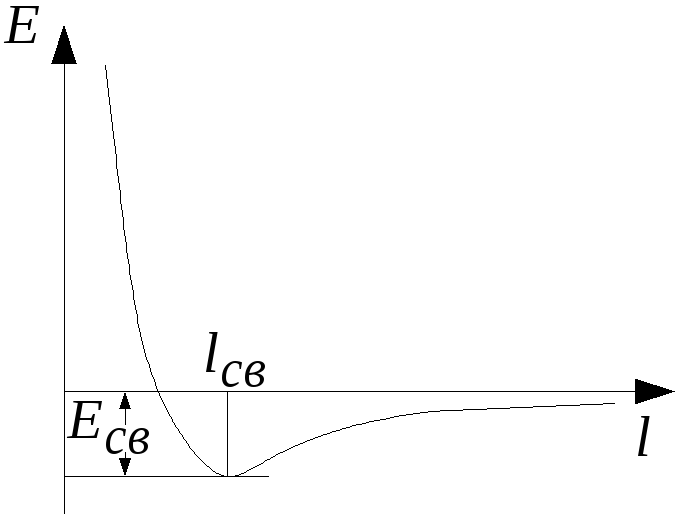
Противоборство этих двух сил обусловливает
энергетический минимум на потенциальной
кривой взаимодействия атомов, равный
энергии связи.
Этому минимуму
соответствует оптимальное расстояние
между ядрами, равное длине связи lсв.
Особенностями
ковалентной химической связи являются
ее направленность
и насыщаемость.Так
как атомные орбитали пространственно
ориентированы, то их перекрывание
происходит по определенным направлениям,
что и обусловливает направленность
ковалентной связи. Количественно
направленность выражается в виде
валентных углов между направлениями
химической связи в молекулах. Насыщаемость
ковалентной
связи обусловлена ограничением числа
электронов, участвующих в ее образовании.
Удобным
параметром для описания размера атома,
участвующего в образовании ковалентной
связи, является ковалентный радиус
rков.
Его определяют
для атома Х как половину длины типичной
простой гомоядерной связи Х–Х.
Если
ковалентная связь образуется одинаковыми
атомами, например Н–Н, О=О и др., то
обобществленные электроны равномерно
распределены между ними. Такая связь
называется ковалентной
неполярной
связью. Если же один из атомов обладает
большей электроотрицательностью по
сравнению с другим, то электронная пара
смещается в сторону более электроотрицательного
атома. В этом случае возникает ковалентная
полярная
связь. При этом чем больше разница в
электроотрицательности атомов, образующих
связь, тем больше полярность связи. В
результате смещения электронов от
одного атома к другому на одном из них
(более электроотрицательном) образуется
частичный отрицательной заряд (),
на другом – частичный положительный
заряд ().
В результате образуется диполь –
нейтральная система с двумя одинаковыми
по величине положительным и отрицательным
зарядами, находящимися друг от друга
на расстоянииlD,
называемым длиной
диполя. Мерой
полярности связи является электрический
момент диполя
,
равный произведению эффективного зарядана длину диполя
=
.
lD.
Полярную
ковалентную связь с
,
приближающимся к 1, можно считать ионной
связью. Однако даже у ионных соединенийниже
единицы. Поэтому любая ионная связь
имеет определенную долю ковалентности.
При описании
распределения электронов в молекулах
используют два основных метода расчета:
метод валентных связей (ВС)иметод
молекулярных орбиталей (МО).
Метод
валентных связей
Метод ВС основан
на следующих основных положениях:
а) химическая
связь между двумя атомами возникает
как результат перекрывания АО с
образованием электронных пар (обобщенных
двух электронов);
б) атомы, образующие
химическую связь, обмениваются между
собой электронами, которые образуют
связывающие пары. Энергия обмена
электронами между атомами (энергия
притяжения атомов) вносит свой вклад в
энергию химической связи. Дополнительный
вклад в энергию связи дают кулоновские
силы взаимодействия частиц;
в) в образовании
химической связи участвуют электроны
с антипараллельными спинами;
г) характеристики
химической связи (энергия, длина,
полярность и др.) определяется типом
перекрывания АО.
Электронная
структура молекулы значительно отличается
от электронной структуры образующих
ее атомов. Например, электронные орбитали
в молекуле водорода не имеют сферической
симметрии в отличие от АО атома водорода,
так как электронная пара принадлежит
двухцентровой молекулярной системе. В
то же время эта связывающая электронная
пара находится на более низком
энергетическом уровне, чем неспаренные
электроны атомов водорода.
В результате
образования молекул из атомов изменения
претерпевает лишь электронная структура
внешних и предвнешних оболочек атомов.
Поэтому в образовавшейся молекуле атомы
с исходной электронной структурой не
существуют. У атомов в молекуле сохраняются
лишь электронные конфигурации внутренних
электронных оболочек, не перекрывающихся
при образовании связей.
Способность
атома присоединять или замещать
определенное число других атомов с
образованием химических связей называется
валентностью. Согласно методу ВС,
каждый атом отдает на образование общей
электронной пары (ковалентной связи)
по одному неспаренному электрону.
Количественной мерой валентности в
обменном механизме метода ВС является
число неспаренных электронов у атома
в основном или возбужденном состоянии.
К ним относятся неспаренные электроны
внешних оболочек атомовs—ир-элементов, внешних и предвнешних
оболочекd—элементов.
При образовании
химической связи атом может переходить
в возбужденное состояние в результате
разъединения пары или пар электронов
и переходе одного (или нескольких
электронов, равных числу разъединенных
пар) на свободную орбиталь той же
оболочки. Например, электронная
конфигурация кальция в основном состоянии
записывается как 4s2.
В соответствии с обменным механизмом
метода ВС валентность его равна нулю,
т.е. дляСа (…4s2)валентность В=0. У атома кальция в
четвертой оболочке(п=4) имеются
вакантныер-орбитали. При возбуждении
атома происходит распаривание электронов
и один из4s—электронов
переходит на свободную4s—орбиталь.
Валентность кальция в возбужденном
состоянии равна двум, т.е. при распаривании
валентность увеличивается на две
единицы.
|
4s |
4p |
4s |
4p |
|||||||||||||
|
Ca |
↑↓ |
→ |
Ca* |
↑ |
↑ |
B*=2 |
В отличие от
кислорода и фтора, электронные пары
которых не могут разъединяться, т.к. на
втором уровне нет других вакантных
орбиталей, электронные пары серы и хлора
могут распариваться, т.к. на третьем
уровне есть вакантные 3d-орбитали.
Соответственно сера, кроме валентности
основного состоянияIи
II,
-
3s
3p
3d
↑↓
↑↓
↑
↑
имеет еще валентности IV и VI в
возбужденных состояниях:
-
3s
3p
3d
↑↓
↑
↑
↑
↑
↑
↑
↑
↑
↑
↑
Пространственная
структура молекул.
Как было показано
ранее, ковалентная химическая связь
характеризуется направленностью, что
обусловлено определенными ориентациями
АО в пространстве.
Связь,
образованная перекрыванием АО по линии,
соединяющей ядра соединяющихся атомов,
называется σ-связью.
Примерами образования σ-связей являются
перекрывания s-орбиталей,
s-
и p-орбиталей,
р-орбиталей, d-орбиталей,
а также d-
и s-орбиталей,
d-
и р-орбиталей и т.д. Некоторые из примеров
σ-связей приведены ниже.
Можно видеть,
что в случае σ-связей область максимальной
электронной плотности находится на
линии, соединяющей ядра атомов.
Связь,
образованная перекрыванием АО по обе
стороны от линии, соединяющей ядра
атомов (боковое перекрывание), называется
π-связью.
π-связь может образоваться при перекрывании
р-р, р-d,
f-p,
f-d
и f-f-орбиталей.
Ниже приведены примеры образования
π-связей.
Поскольку при
образовании π-связей степень перекрывания
орбиталей невелика по сравнению с
σ-связями, энергия этих связей существенно
ниже.
При наложении
π-связи на σ-связь образуется двойная
связь, например, в молекулах кислорода,
этилена, диоксида углерода:

С=С , О=С=О.
Энергия связи это средняя энтальпия связи или просто энтальпия связи. Это количество, которое дает представление о прочности химической связи.
Определение энергии связи IUPAC слова «энергия связи» может быть дано как » среднее значение, полученное из энтальпий диссоциации связи (в газовой фазе) всех химических связей определенного типа, которое задано в химическом соединении.
Таким образом, энергия связи химической связи в данном соединении визуализируется как среднее количество энергии, необходимое для разрыва одной такой химической связи.
Примечание: Энергия связи химической связи всегда прямо пропорциональна стабильности этой связи. Это означает, что чем больше энергия связи химической связи между двумя атомами, тем выше стабильность одной и той же химической связи.
Что такое энергия связи
Важно отметить, что энергия связи химической связи, присутствующая в соединении, представляет собой среднее значение всех энтальпий диссоциации отдельных связей химических связей.
Например, предположим, что энергия связи углерод-водородной связи в молекуле метана (CH4) равна средней энергии диссоциации связи каждой отдельной углерод-водородной связи.
Мы можем рассчитать это следующим образом:
-
- СН3 + BDE2 → СН2 + H
- CH4 + BDE1 → CH3 + H
- CH + BDE4 → C + H
- СН2 + BDE3 → СН + H
- BE(C-H) = (BDE1+ BDE2+ BDE3+ BDE4)/4
- Где BDE1 указывает энергию, необходимую для разрыва одной углерод-водородной связи, присутствующей в молекуле CH4,
- BDE2 указывает энергию, необходимую для разрыва одной углерод-водородной связи, присутствующей в молекуле СН3,
- BDE3 указывает энергию, необходимую для разрыва одной углерод-водородной связи, присутствующей в молекуле СН2, и
- BDE4 указывает энергию, необходимую для разрыва единственной углерод-водородной связи, присутствующей в молекуле CH.
Наконец, термин BE(C-H) указывает на энергию связи углерод-водород, присутствующую в молекуле метана.
Таким образом, энергия связи углерод-водородных связей, которая существует в молекуле метана могут быть визуализированы как изменение энтальпии (в общем, она обозначается Н), связанных сорвав одно CH4 молекуле четыре атома водорода и один атом углерода, и совершенно делится на четыре (так как есть четыре углерод-водородных связей как общая молекулы метана).
Сравнение энергии связи и энергии диссоциации связи
Энергия диссоциации связи химической связи (иногда сокращенно BDE) определяется как изменение энтальпии, связанное с разрывом химической связи посредством гомолитического расщепления.
Например, энергия диссоциации связи молекулы A-B-это количество энергии, необходимое для облегчения гомолитического расщепления связи, которое существует между A и B, что в дальнейшем приводит к образованию двух свободных радикалов.
Важно отметить, что энергия диссоциации связи химической связи полностью зависит от абсолютной температуры окружающей среды.
Таким образом, энергия диссоциации связи обычно рассчитывается при стандартных условиях (где температура примерно равна 298 Кельвинам).
С другой стороны, энергия связи химической связи, присутствующей в соединении, представляет собой среднее значение суммарных энтальпий диссоциации связи той же связи в молекуле.
Пример энергии связи и энергии диссоциации связи
Энергия диссоциации связи водородно-кислородной связи в молекуле воды может быть задана как:
H2O + BDE → OH + H
Следовательно, энергия диссоциации связи водородно-кислородной связи в молекуле воды может быть задана как энергия, необходимая для ее разделения на свободный радикал H и OH.
С другой стороны, энергия связи водородно-кислородной связи в молекуле воды может быть задана как:
OH + BDE2 → H + O
H2O + BDE1 → OH + H
BE(O-H) = Таким образом, энергия связи водородно-кислородной связи в молекуле воды определяется как количество энергии, необходимое для разделения всех водородно-кислородных связей в молекуле воды, разделенное полностью на два.
Факторы влияющие на энергию ионной связи
На энергию ионной связи влияют многие факторы. Важный из них приведен ниже.
Электроотрицательность двух атомов, соединяющихся вместе, влияет на энергию ионной связи. В общем, чем дальше от электроотрицательности 2 атома, тем сильнее связь.
Например, у фтора самый высокий показатель, а у цезия самый низкий. Они образуют самую сильную ионную связь (по крайней мере, единственную связь), предполагая, что связь углерод-фтор является самой сильной полярной ковалентной. И в основном ионные связи сильнее, чем у ковалентных связей.
При проверке при температурах плавления ковалентные соединения имеют низкие температуры плавления, а ионные соединения имеют высокие температуры плавления.
Часто задаваемые вопросы ответы о энергии связи?
Как предсказать прочность связи, используя радиус?
Ионный радиус, металлический радиус и ковалентный радиус каждого атома, присутствующего в молекуле, могут быть использованы для оценки прочности связи.
Предположим, что ковалентный радиус бора оценивается в 83,0 пм, тогда как длина связи B–B в B2Cl4 указана как 175 пм, что значительно больше.
Это показало бы, что связь между двумя атомами бора скорее является слабой одиночной связью.
В качестве другого примера металлический радиус рения может быть указан при 137,5 пм, с длиной связи Re-Re 224 пм, присутствующей в соединении Re2Cl8.
Используя эти данные, мы можем сделать вывод, что связь является либо очень сильной, либо четырехкратной. Этот метод определения полезен в основном для ковалентно связанных соединений.
Объясните Энергию Связи?
Энтальпию связи (иначе называемую энергией связи) можно описать как количество энергии, необходимое для разрыва одного моля указанной связи.
Объясните факторы, влияющие на энергию связи?
- Сродство атомов к электронам,
- Размер атомов, участвующих в связи,
- Разница в их электроотрицательности.
Что такое энергия связи?
Энергия связи равна минимальной работе, которую необходимо затратить, чтобы разложить систему на составляющие её частицы. Она характеризует стабильность системы: чем выше энергия связи, тем система стабильнее.
Как рассчитать энергию связи?
Запишите уравнение для вычисления энергии связи. Согласно определению, энергия связи представляет собой сумму разорванных связей за вычетом суммы сформированных связей: ΔH = ∑H (разорванные связи) — ∑H (образовавшиеся связи).
Какую роль играет энергия связи ядра?
Важнейшую роль в ядерной физике играет понятие энергии связи ядра. Энергия связи ядра равна минимальной энергии, которую необходимо затратить для полного расщепления ядра на отдельные частицы.
Из закона сохранения энергии следует, что энергия связи равна той энергии, которая выделяется при образовании ядра из отдельных частиц.