Молярная масса
О чем эта статья:
Что такое моль
Прежде чем говорить о том, как найти молярную массу вещества, определимся с понятием «моль». Его ввели как искусственную величину для упрощения расчетов. Это количество вещества, в котором содержится столько же мельчайших частиц, сколько в 12 г одного из изотопов углерода — C12.
Для всех химических веществ это количество одинаково и представляет собой число Авогадро 6,02 · 10 23 . Постоянная Авогадро обозначается NA, а измеряется в моль -1 .
Число Авогадро — это количество молекул, ионов или других мельчайших частиц в 1 моле вещества.
NA = 6,02 · 10 23 моль -1 .
Историческая справка
В 1811 году химик Амедео Авогадро предположил, что если взять два равных объема газов в равных значимых условиях (при одинаковой температуре и давлении), то количество молекул в этих объемах тоже будет одинаковым. Опираясь на свою гипотезу, он определил атомные и молекулярные массы многих веществ, а также рассчитал количество атомов в молекулах воды, оксидов азота и т. д. Однако в научных кругах гипотеза Авогадро долго не находила понимания. Общепринятой она стала только в 1860 году.
Что такое молярная масса
Молярная масса — это масса одного моля вещества, она измеряется в граммах деленных на моль (г/моль). Данная величина представляет собой отношение массы вещества к его количеству, которое измеряется в молях.
Как обозначается молярная масса: М.
, где — это масса вещества, а — количество вещества.
Единица измерения молярной массы: г/моль.
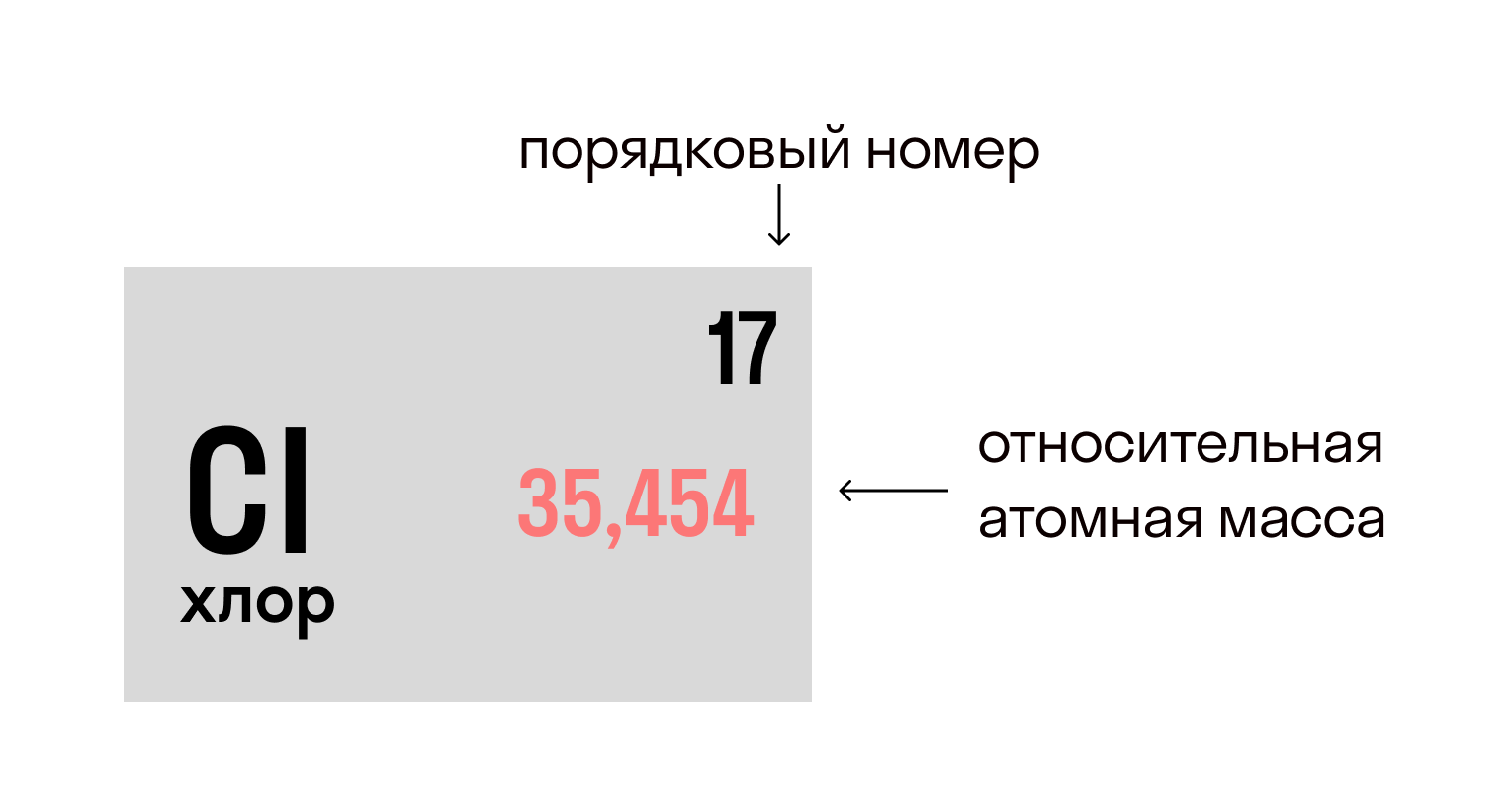
Несмотря на то, что в 1 моле любого химического вещества содержится одинаковое количество молекул (и оно равно числу Авогадро), молярные массы разных веществ отличаются. Все потому, что отличаются атомы, которые входят в состав этих молекул. В частности, разница между ними заключается в относительной атомной массе (Ar) — например, Ar(Mg) = 24, а Ar(Hg) = 200. Сейчас станет ясно, какое это имеет значение.
Как определить молярную массу
Данная величина тесно связана с такими понятиями, как относительные атомная и молекулярная массы. Именно относительные, потому что абсолютную массу молекулы или атома вещества в химии не используют для решения задач — это слишком малые величины.
Относительная атомная масса вещества (Ar) показывает, во сколько раз его атом больше 1/12 атома углерода. Это значение для каждого химического элемента можно увидеть в таблице Менделеева.
Относительная молекулярная масса (Mr) складывается из Ar каждого атома в молекуле вещества с учетом индексов. Она показывает, на сколько масса молекулы больше 1/12 атома углерода.
, где — это количество атомов.
Разберемся на примерах.
В молекуле хлорида натрия NaCl есть 1 атом натрия и 1 атом хлора, при этом Ar(Na) = 23, Ar (Cl) = 35,5.
Mr(NaCl) = 23 + 35,5 = 58,5.
В молекуле NaNO2 есть 1 атом натрия, 1 атом азота и 2 атома кислорода.
Собственно, для вычисления молярной массы больше ничего и не требуется.
Количество вещества
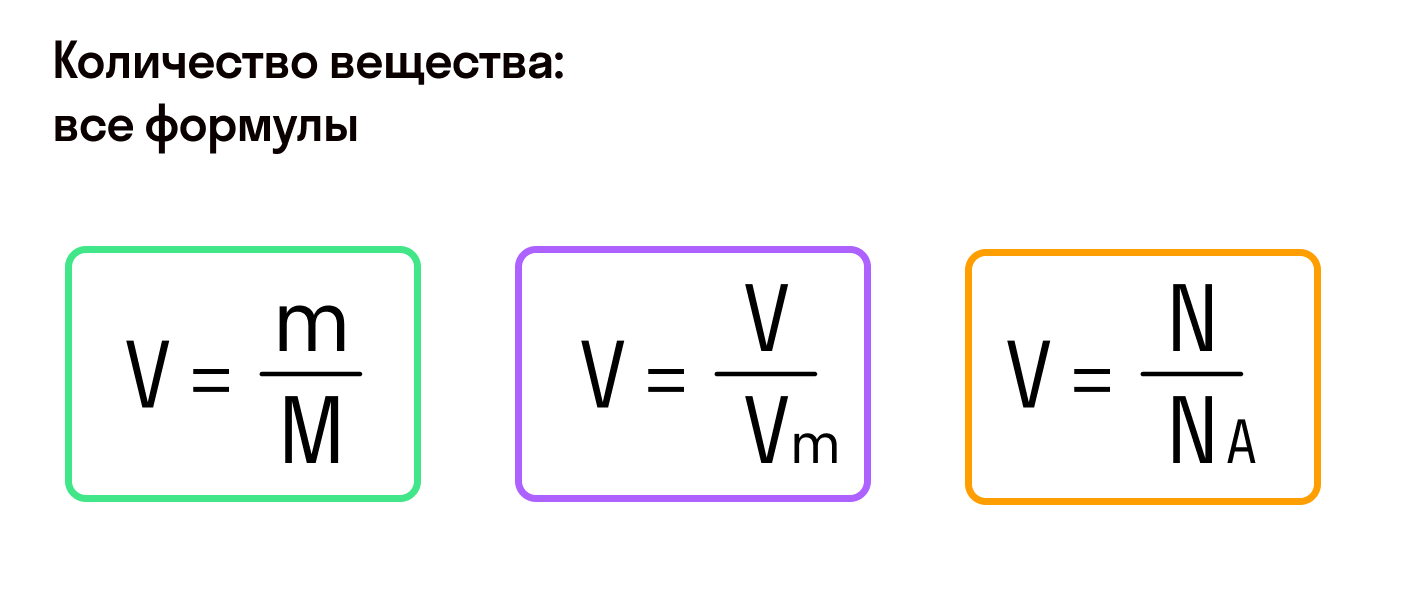
Из предыдущих формул понятно, что молярная масса и количество вещества тесно связаны. Рассмотрим эту связь подробнее. Начнем с того, что количество вещества может обозначаться как латинской буквой , так и греческой буквой (ню). Международное обозначение — , но не стоит удивляться, встретив в формулах любую из этих букв.
В формуле нахождения молярной массы мы обозначили количество вещества через :
Пользуясь этим, можно найти количество вещества (в молях), если нам известны его абсолютная и молярная масса.
Пример 1
Как определить, какое количество вещества включают 350 г сульфата бария BaSO4?
Мы помним, что M = Mr (значение молярной массы равно значению относительной молекулярной).
Подставим значение молярной массы в формулу:
Есть и еще одна формула количества вещества, которая позволяет найти его, если известно число молекул или других структурных единиц.
, где — число структурных единиц, — число Авогадро.
Пример 2
Допустим, некий объем CaCO3 содержит 3,01 · 10 23 молекул. Как найти количество вещества, соответствующее данному объему?
Воспользуемся формулой моль.
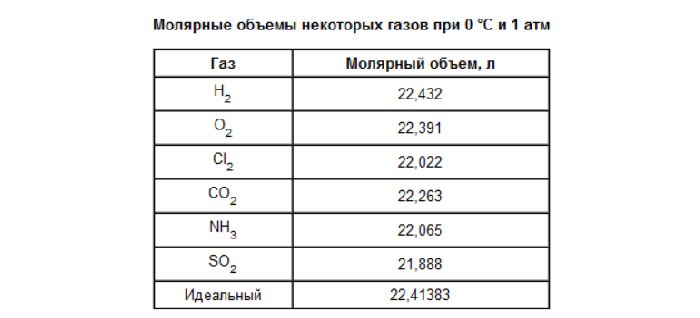
Молярный объем
Выше мы находили количество вещества через молярную массу, но для газов это можно сделать и через молярный объем. Согласно закону Авогадро количество любого газа, равное 1 моль, будет занимать один и тот же объем, если газы рассматриваются при одинаковой температуре и давлении.
При стандартных физических условиях — температуре 0°С и давлении 1 атм или 760 мм ртутного столба, 1 моль газа занимает объем 22,4 л.
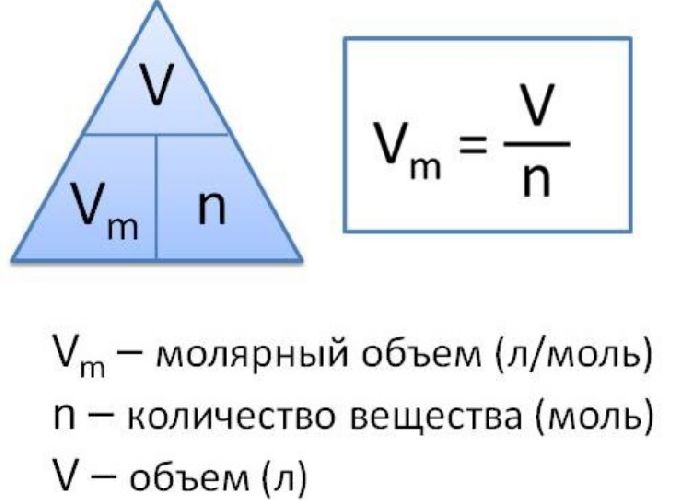
Молярный объем — это объем газа, взятого в количестве 1 моль. Он обозначается Vm.
При нормальных условиях Vm = 22,4 л/моль.
Значения молярного и фактического объема газа помогают найти количество вещества.
, где — фактический объем газа, а — молярный объем.
Пример 1
Сколько молей содержится в 120 литрах газа при нормальных условиях?
Рассчитаем по формуле моль.
Ответ: 120 литров любого газа при стандартных условиях содержат 5,36 моль.
Относительная плотность одного газа по другому
Иногда для решения задачи нужно знать, как найти молярную массу газа, о котором сообщается лишь его плотность по воздуху или по другому газу. Это возможно, если знать формулу относительной плотности, которая обозначается буквой D.
, где и — некие газы.
Пример 1
Как определить, во сколько раз угарный газ плотнее водорода?
Для начала найдем молярную массу CO и H2:
Ответ: угарный газ в 14 раз плотнее водорода.
Пример 2
Как посчитать молярную массу газа х, о котором известно, что он в 10 раз плотнее углекислого газа CO2?
Подсчитаем для начала молярную массу углекислого газа:
Ориентируясь на формулу относительной плотности, произведем расчет молярной массы искомого газа х.
М(х) = D(х/CO2) · M(CO2) = 10 · 44 = 440 г/моль.
Ответ: у данного газа молярная масса 440 г/моль.
Примеры задач
Итак, мы разобрались, как находить молярную массу жидкости, газа или твердого тела и как это понятие связано с количеством вещества, а также с относительной плотностью одного газа по другому. Чтобы закрепить знания, посмотрите, как эти сведения применяются в решении задач.
Задача 1
Известно, что 300 г неустановленного вещества содержат 12,04 · 10 23 молекул. Чему равна молярная масса данного вещества?
N(х) = 12,04 · 10 23 .
Найдем количество вещества моль.
Подставим количество вещества в формулу :
Ответ: молярная масса данного вещества 150 г/моль.
Задача 2
Какой объем займет водород в количестве 0,7 моль?
По формуле мы можем найти объем .
Зная, что молярный объем при обычных условиях составляет 22,4 л/моль, вычислим фактический объем водорода:
Ответ: объем водорода составляет 15,68 литров.
Задача 3
В порции оксида серы SO3 содержится 8,356 · 10 23 атомов кислорода. Какова масса этой порции?
N(O) = 8,356 · 10 23 .
Для решения задачи нам подходит формула , т. е. . Но для начала нужно найти количество вещества.
Мы знаем, что в одной молекуле SO3 есть 3 атома кислорода, исходя из этого можно вычислить количество молекул в порции оксида:
Зная количество молекул, рассчитаем количество вещества:
Теперь можно узнать молярную массу SO3:
M(SO3) = 32 + 16 · 3 = 80 г/моль.
Рассчитаем фактическую массу через молярную массу:
Ответ: абсолютная масса порции оксида серы 36,8 грамм.
Задача 4
Как рассчитать молярную массу простого вещества, о котором известно, что в порции 100 г содержится 15,05 · 10 23 молекул? Назовите это вещество.
N(x) = 15,05 · 10 23 .
В данном случае поможет вычислить молярную массу NA, с помощью которого мы сначала узнаем количество вещества:
Исходя из этого, рассчитаем молярную массу:
Ответ: согласно таблице Менделеева можно предположить, что это кальций Ca.
Задача 5
Определите, насколько сероводород H2S плотнее водорода H2?
Нам требуется вычислить относительную плотность сероводорода по водороду:
Для этого вычислим молярные массы H2S и H2:
М(H2S) = 1 · 2 + 32 = 34 г/моль.
М(H2) = 1 · 2 = 2 г/моль.
Подставим значения в формулу:
Ответ: сероводород в 17 раз плотнее водорода.
Вопросы для самопроверки
Что такое число Авогадро и чему оно равно?
В чем измеряется молярная масса?
Напишите формулу молярной массы вещества.
Какая формула связывает количество вещества и его объем?
Как узнать количество вещества, если известно число молекул в порции?
Моль — условное количество вещества
Химия — наука, изучающая взаимодействие веществ на атомном и молекулярном уровнях. Эти процессы значительно отличаются от привычного нам макроуровня и поэтому требуют специфических подходов, в том числе к «подсчету» и «взвешиванию». Школьный курс химии включает понятия «моль» и «молярная масса». Они кажутся сложными, но если разобраться, то вы без труда поймете сущность этих понятий и научитесь ими пользоваться при решении задач.
Моль
Понятие «моль» попытаемся разобрать и, самое главное, понять на примере всем знакомой реакции взаимодействия кислорода и водорода. Когда одна молекула O2 соединяется с двумя молекулами H2, получается две молекулы H2O:
То есть, чтобы максимально полно провести химическую реакцию, мы должны взять на каждую молекулу кислорода две молекулы водорода. Итак, у нас есть 100 г кислорода. Сколько понадобится водорода для протекания процесса? И тут возникает первый вопрос: сколько молекул в 100 г кислорода? Наверное, миллиарды или даже миллиарды миллиардов? И сколько их в 100 г водорода? Уж точно в не в 2 раза меньше. Как вообще подсчитать молекулы, ведь они бывают совершенно разными, «тяжелыми» и «легкими». Этими вопросами задавались и люди, закладывавшие основу современной химической науки.
Был найден простой выход, который помогает легко и изящно решить проблему. Химики решили взять за единицу измерения не одну молекулу, а определенное их количество, причем очень большое. Таким образом эта единица измерения приводит микроуровень к макроуровню. Она называется «моль».
Моль — это количество вещества из 6,02214076⋅10 23 атомов или молекул. Оно не имеет физического смысла и изначально было привязано к массе определенного количества (12 граммов) углерода-12, но позже переопределено, как и многие другие единицы системы СИ. В школьных расчетах количество структурных единиц в моле, которое также называется постоянной Авогадро, обычно округляют до 6,022⋅10 23 и обозначают NA.
С этой величиной связано другое химическое понятие — «количество вещества», то есть количество структурных единиц в определенной его порции. Оно обозначается буквой ν (ню).
Примеры
В стакане содержится 2 моль воды. Сколько молекул воды находится в стакане?
N = ν⋅ NA =2 ⋅ 6,022⋅10 23 = 12,044⋅10 23 молекул воды.
Также можно решить обратную задачу. Сколько молей вещества составляют 24,088⋅10 23 молекул воды?
ν⋅ = N / NA = 24,088⋅10 23 / 6,022⋅10 23 = 4 моля.
Моль и молярная масса: простое объяснение с примерами
Молярная масса
Итак, мы поняли, что моль — условное количество вещества, выбранное для удобства химиков. Это даже не миллиарды миллиардов, как мы предположили ранее, а миллиарды триллионов, что никак не облегчает задачу подсчета этих структурных единиц. Как же все-таки узнать, сколько атомов или молекул в 100 граммах того или иного вещества? Теперь хорошо бы связать количество вещества и его массу, ведь это не одно и то же. Нам поможет «молярная масса» — то есть масса 1 моль вещества или масса 6,022⋅10 23 структурных единиц этого вещества.
Итак, молярная масса равна массе порции вещества m к количеству молекул ν в его порции:
Вооружившись этим знанием, мы можем переводить граммы в число молекул и наоборот. При этом следует учесть, что молярная масса численно идентична молекулярной массе (то есть массе молекулы), выраженной в атомных единицах массы, и относительной молекулярной массе.
Пример
Найдем массу 5 моль воды.
Чтобы решить эту задачу, обратимся к формуле молярной массы и выразим из нее массу:
В этой формуле мы знаем количество вещества ν = 5 моль, а молярную массу сложной молекулы нужно определить, как сумму молярных масс составляющих ее химических элементов:
Моль и молярная масса: простое объяснение с примерами
Где взять молярные массы кислорода и водорода (в соединение входит два атома водорода, поэтому его молярную массу умножаем на 2)?
Для этого нам понадобится таблица Менделеева и значение «относительной атомной массы», которая, как мы уже знаем, идентична молекулярной. Это значение приведено для каждого химического элемента и для водорода равно 1,00797 (то есть близко к 1), для углерода — близко к 6, для кислорода — около 16. Подставим соответствующие значения в исходную формулу и получим:
M (H2O) = 2 ⋅M (H) + M (O) = 2 ⋅ 1 + 16 = 18 г/моль.
То есть масса 1 моль воды составляет 18 граммов. Теперь можем подсчитать массу 5 моль воды:
m = М ⋅ ν = 18 ⋅ 5 = 90 г.
Аналогичным образом мы можем подсчитать количество вещества, которое содержится в определенном образце заданной массы. Для примера возьмем оксид алюминия Al2O3 и узнаем, сколько моль в 400 граммах этого вещества. Для этого выразим количество вещества через молярную массу и подставим исходные данные:
ν = m / М = 400 / (2 ⋅ М (Al) + 3 ⋅ (O)) = 400 / (2 ⋅ 75 + 3 ⋅ 16) = 400 / (150 + 48) = 400 / 198 ≈ 2,02 моль.
Как решать задачи по химии. Расчет по уравнениям химических реакций.
Как решать задачи по химии? Как проводить простейшие расчеты по уравнениям химических реакций? Сколько выделяется газа, образуется воды, выпадает осадка или сколько получается конечного продукта реакций? Сейчас мы постараемся разобрать все нюансы и ответить на эти вопросы, которые очень часто возникают при изучении химии.
Решение задач в химии является неотъемлемой частью в изучении этой сложной, но очень интересной науки.
Алгоритм решения задач по химии
- Прочитать условия задачи (если они есть). Да, об этом все знают — как же решить задачу без условий — но все же, для полноты инструкции, мы не могли не указать этот пункт.
- Записать данные задачи. На этом пункте мы не будем заострять внимание, так как требования различных учебных заведений, учителей и преподавателей могут значительно отличаться.
- Записать уравнение реакции. Теперь начинается самое интересное! Здесь нужно быть внимательным! Обязательно необходимо верно расставить коэффициенты перед формулами веществ. Если вы забудете это сделать, то все наши усилия буду напрасны.
- Провести соответствующие расчеты по химическому уравнению. Далее рассмотрим, как же сделать эти самые расчеты.
Для этого у нас есть два пути, как решить задачу по химии. Условно, назовем их правильным (используя понятия количества вещества) и неправильным (используя пропорции). Конечно же, мы бы рекомендовали решать задачи правильным путем. Так как у неправильного пути имеется очень много противников. Как правило, учителя считают, что ученики, решающие задачи через пропорции, не понимают самой сути протекания процессов химических реакций и решают задачи просто математически.
Расчет по уравнениям химических реакций с использованием понятия количества вещества
Суть данного метода, состоит в том, что вещества реагируют друг с другом в строгом соотношении. И уравнение реакции, которое мы записали ранее, дает нам это соотношение. Коэффициенты перед формулами веществ дают нам нужные данные для расчетов.
Для примера, запишем простую реакцию нейтрализации серной кислоты и гидроксида натрия.
H_<2>SO_ <4>+ NaOH → Na_<2>SO_ <4>+ H_<2>O
H_<2>SO_ <4>+ 2NaOH → Na_<2>SO_ <4>+ 2H_<2>O
Исходя из этого уравнения, мы видим, что одна молекула серной кислоты взаимодействует с двумя молекулами гидроксида натрия. И в результате этой реакции получается одна молекула сульфата натрия и две молекулы воды.
Сейчас мы немного отступим от разбора задач, чтобы познакомиться с основными понятиями, которые пригодятся нам в решении задач по химии.
Рассчитывать количество молекул, например в 98 граммах серной кислоты — это не самое удобное занятие. Числа будут получаться огромными ( ≈ 6,022140857⋅10 23 молекул в 98 граммах серной кислоты) . Для этого в химии ввели понятие количества вещества (моль) и молярная масса.
1 Моль (единица измерения количества вещества) — это такое количество атомов, молекул или каких либо еще структурных единиц, которое содержится в 12 граммах изотопа углерода-12. Позднее выяснилось, что в 12 граммах вещества углерод-12 содержится 6,022140857⋅10 23 атомов. Соответственно, можно сказать, что 1 моль, это такая масса вещества, в которой содержится 6,022140857⋅10 23 атомов (или молекул) этого вещества.
Но ведь молекулы и атомы имеют различный состав и различное строение. Разные атомы содержат разное количество протонов и нейтронов. Соответственно 1 моль для разных веществ будет иметь разную массу, имея при это одинаковое количество молекул ( атомов). Эта масса называется молярной.
Молярная масса — это масса 1 моля вещества.
Используя данные понятия, можно сказать, что 1 моль серной кислоты реагирует с 2 молями гидроксида натрия, и в результате получается 1 моль сульфата натрия и 2 моль воды. Давайте запишем эти данные под уравнением реакции для наглядности.
beginH_<2>SO_ <4>& + & 2NaOH & → & Na_<2>SO_ <4>& + & 2H_<2>O \ 1 : моль & & 2 : моль & & 1 : моль & & 2 : моль end
Следом запишем молярные массы для этих веществ
begin H_<2>SO_ <4>& + & 2NaOH & → & Na_<2>SO_ <4>& + & 2H_<2>O \ 1 : моль & & 2 : моль & & 1 : моль & & 2 : моль \ 98 : г& & 40 : г & & 142 : г & & 18 : г end
Теперь, зная массу одного из веществ, мы можем рассчитать, сколько нам необходимо второго вещества для полного протекания реакции, и сколько образуется конечных продуктов.
Для примера, решим по этому же уравнению несколько задач.
Задача. Сколько грамм гидроксида натрия (NaOH) необходимо для того, чтобы 49 грамм серной кислоты (H2SO4) прореагировало полностью?
Итак, наши действия: записываем уравнение химической реакции, расставляем коэффициенты. Для наглядности, запишем данные задачи над уравнением реакции. Неизвестную величину примем за Х. Под уравнением записываем молярные массы, и количество молей веществ, согласно уравнению реакции:
begin49 : г & & X : г & & & & \ H_<2>SO_ <4>& + & 2NaOH & → & Na_<2>SO_ <4>& + & 2H_<2>O \ 1 : моль & & 2 : моль & & 1 : моль & & 2 : моль \ 98 : г& & 40 : г & & 142 : г & & 18 : г end
Записывать данные под каждым веществом — не обязательно. Достаточно это будет сделать для интересующих нас веществ, из условия задачи. Запись выше дана для примера.
Примерно так должны выглядеть данные, записанные по условиям задачи. Не претендуем на единственно правильное оформление, требования у всех разные. Но так, как нам кажется, смотрится все довольно наглядно и информативно.
Первое наше действие — пересчитываем массу известного вещества в моли. Для этого разделим известную массу вещества (49 грамм) на молярную массу:
4998=0,5 моль серной кислоты
Как уже упоминалось ранее, по уравнению реакции 1 моль серной кислоты реагирует с 2 моль гидроксида натрия. Соответственно с 0,5 моль серной кислоты прореагирует 1 моль гидроксида натрия.
n(NaOH)=0.5*2=1 моль гидроксида натрия
Найдем массу гидроксида натрия, умножив количество вещества на молярную массу:
1 моль * 40 г/моль = 40 грамм гидроксида натрия.
Ответ: 40 грамм NaOH
Как видите, в решении задачи по уравнению реакции нет ничего сложного. Задача решается в 2-3 действия, с которыми справятся ученики начальных классов. Вам необходимо всего лишь запомнить несколько понятий.
Решение задач по химии через пропорцию
Ну и расскажем про второй способ вычислений по уравнениям химических реакций — вычисления через пропорцию. Этот способ может показаться немного легче, так как в некоторых случаях можно пропустить стадию перевода массы вещества в его количество. Чтобы было более понятно, объясню на том же примере.
Так же, как и в прошлом примере, запишем уравнение реакции, расставим коэффициенты и запишем над уравнением и под уравнением известные данные.
Для этого способа, нам так же понадобится записать под уравнением реакции, следом за молярной массой, массу вещества, соответствующую его количеству по уравнению. Если проще, то просто перемножить две строки под уравнением реакции, количество моль и молярную массу. Должно получиться так:
begin49 : г & & X : г & & & & \ H_<2>SO_ <4>& + & 2NaOH & → & Na_<2>SO_ <4>& + & 2H_<2>O \ 1 : моль & & 2 : моль & & 1 : моль & & 2 : моль \ 98 : г& & 40 : г & & 142 : г & & 18 : г \ 98 : г & & 80 : г & & 142 : г & & 36 : г end
А теперь внимание, начинается магия! Нас интересует строка данных над уравнением, и самая нижняя строка под уравнением. Составим из этих данных пропорцию.
Далее находим неизвестное значение Х из пропорции и радуемся полученному значению:
Х=49*80/98=40 грамм
Как видим, получается тот же результат. Прежде всего, при решении задач в химии, главное все же — понимание химических процессов. Тогда решение задачи не станет для вас проблемой!
источники:
http://egevpare.ru/mol-i-moljarnaja-massa/
http://in-chemistry.ru/kak-reshat-zadachi-po-himii-raschet-po-uravneniyam-himicheskih-reaktsij
Как находить моль
Различные формулы помогут найти количество вещества, единицей измерения которого является моль. Также количество вещества можно найти по уравнению реакции, данной в задаче.

Инструкция
Имея массу и название вещества без труда можно найти количество вещества: n = m/M, где n — количество вещества (моль), m — масса вещества (г), M — молярная масса вещества(г/моль). Например, масса хлорида натрия равна 11,7 г, найти количество вещества. Чтобы подставить в формулу необходимые значения, нужно найти молярную массу хлорида натрия: M(NaCl) = 23+35,5 = 58,5 г/моль. Подставляем: n(NaCl) = 11,7/58,5 = 0,2 моль.
Если речь идет о газах, то имеет место такая формула: n = V/Vm, где n — количество вещества(моль), V — объем газа(л), Vm — молярный объем газа. При нормальных условиях(давлении 101 325 Па и температуре 273 К) молярный объем газа является величиной постоянной и равен 22,4 л/моль. Например, какое количество вещества будет иметь азот объемом 30л при нормальных условиях? n(N2) = 30/22,4 = 1,34 моль.
Еще одна формула: n = N/NA, где n — количество вещества(моль), N — число молекул, NA — постоянная Авогадро, равна 6,02*10 в 23 степени(1/моль).Например,какое количество вещества заключается в 1,204*10 в 23 степени? Решаем: n = 1,204*10 в 23 степени/6,02*10 в 23 степени = 0,2 моль.
По любому уравнению реакции можно найти количество веществ, вступивших в реакцию и образовавшихся в результате нее. 2AgNO3 + Na2S = Ag2S + 2NaNO3. Из этого уравнения видно, что 2 моль нитрата серебра провзаимодействовало с 1 моль сульфида натрия, в результате этого образовалось 1 моль сульфида серебра и 2 моль нитрата натрия. С помощью этих количеств веществ можно найти другие величины требующиеся в задачах.Рассмотрим на примере.
К раствору, содержащему нитрат серебра массой 25,5 г, прилили раствор, содержащий сульфид натрия. Какое количество вещества сульфида серебра образуется при этом?
Сначала находим количество вещества нитрата серебра, предварительно рассчитав его молярную массу. M(AgNO3) = 170 г/моль. n(AgNO3) = 25,5/170 = 0,15 моль. Уравнение реакции для этой задачи написано выше, из него следует, что из 2 моль нитрата серебра образуется 1 моль сульфида серебра. Определяем сколько моль сульфида серебра образуется из 0,15 моль нитрата серебра: n(Ag2S) = 0,15*1/2 = 0,075 моль.
Видео по теме
Обратите внимание
Если масса измеряется в кг, то количество вещества — в кмоль.
Источники:
- «Пособие по химии», Г.П. Хомченко, 2005.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Архив уроков › Основные законы химии
В уроке 5 «Моль и молярная масса» из курса «Химия для чайников» рассмотрим моль как единицу измерения количества вещества; дадим определение числу Авогадро, а также научимся определять молярную массу и решать задачи на количество вещества. Базой для данного урока послужат основы химии, изложенные в прошлых уроках, так что если вы изучаете химию с нуля, то рекомендую их просмотреть хотя бы мельком.
Единица измерения количества вещества
До этого урока мы обсуждали лишь индивидуальные молекулы и атомы, а их массы мы выражали в атомных единицах массы. В реальной жизни с индивидуальными молекулами работать невозможно, потому что они ничтожно малы. Для этого химики взвешивают вещества ни в а.е.м., а в граммах.
Чтобы перейти от молекулярной шкалы измерения масс в лабораторную шкалу, используют единицу измерения количества вещества под названием моль. 1 моль содержит 6,022·1023 частиц (атомов или молекул) и является безразмерной величиной. Число 6,022·1023 носит название Число Авогадро, которое определяется как число частиц, содержащихся в 12 г атомов углерода 12C. Важно понимать, что 1 моль любого вещества содержит всегда одно и то же число частиц (6,022·1023).
Как уже было сказано, термин «моль» применяется не только к молекулам, но также и к атомам. Например, если вы говорите о моле гелия (He), то это означает, что вы имеет количество равное 6,022·1023атомов. Точно так же, 1 моль воды (H2O) подразумевает количество равное 6,022·1023молекул. Однако чаще всего моль применяют именно к молекулам.
Расчёты в смеси
Задачу можно усложнить, попробовав посчитать этот показатель в смеси, где в разных пропорциях входят различные соединения. Идеальным примером для этого является воздух. В нем можно выделить следующие составляющие:
Искомый параметр будет вычисляться следующим образом: 0,23*32+0,76*28+0,01*40. Результат равен 29,04 г/моль (можно округлить до 29).
Конечно, в воздухе содержатся и другие вещества (углекислый и инертные газы, водород и т. д. ), но их масса составляет менее десятой процента, поэтому для простоты их допускается не учитывать.
Молярная масса вещества
Молярная масса – это масса 1 моля вещества, выраженная в граммах. Молярную массу одного моля любого химического элемента без труда находят из таблицы Менделеева, так как молярная масса численно равна атомной массе, но размерности у них разные (молярная масса имеет размерность г/моль). Запишите и запомните формулы для вычисления молярной массы, количества вещества и числа молекул:
- Молярная масса формула M=m/n
- Количество вещества формула n=m/M
- Число молекул формула N =NA·n
где m — масса вещества, n — количество вещества (число молей), М — молярная масса, N — число молекул, NA — число Авогадро. Благодаря молярной массе вещества химики могут вести подсчет атомов и молекул в лаборатории просто путем их взвешивания. Этим и удобно использование понятия моль.
На рисунке изображены четыре колбы с различными веществами, но в каждой из них всего 1 моль вещества. Можете перепроверить, используя формулы выше.
Определение в сложных веществах
Для простых веществ, состоящих из одного атома, параметр считается так же, как для элемента. Молярная масса углерода всегда равна 12. Этот показатель справедлив и для натрия. Как простое вещество, этот мягкий серебристо-белый металл содержит в себе 23 г/моль, а купрум (так на латинском обозначается медь) — 63,5 г/моль. Газ также может состоять из одного элемента, например, гелий, искомый параметр которого 4 г/моль.
Но существуют и газы, которые образованы двумя молекулами (водород, азот, кислород, хлор, фтор и другие) или тремя (озон). Для них нужно не забывать умножать атомную массу на число молекул. Для сложных веществ параметр можно рассчитать аналогичным образом:
- В H2O содержится два атома водорода и один кислорода, результат считается как 2 * 1 + 16. Итоговое значение молярной массы воды равно 18. Этот параметр для углекислого газа CO2 равен 44 (сумма массы углерода 12 и двух атомов кислорода 32), а для сернистого газа SO2 — 64 г/моль.
- Органическое вещество метан, формула которого CH4, состоит из одного атома углерода и четырёх водорода, следовательно, ему свойственно значение 16. А у этана, содержащего на одну группу CH2 больше, масса равняется 30 г/моль.
- В аммиаке NH3 — 17 г/моль.
- В соляной кислоте HCl содержится 36,5 г/моль (обычно атомную массу хлора считают как 35,5, тогда как для многих других элементов её чаще округляют до целого значения). В хорошо известной калиевой щёлочи KOH — 56 г/моль.
- В натриевой соли серной кислоты Na2SO4, как следует из химической формулы, находится 142 г/моль, а в алюминиевой (Al2 (SO4)3) — 342 г/моль. В азотнокислом серебре AgNO3 — 170 г/моль, в хлориде калия KCl — 74,5 г/моль.
- В молекуле сахара, как в быту называют сахарозу, содержится 12 атомов углерода, 22 водорода и 11 кислорода, а это значит, что его масса равна 342 г/моль. В глюкозе 6, 12 и 6 атомов углерода, водорода и кислорода соответственно, а параметр равен 180 г/моль.
Исходя из этого, формулу молярной массы можно вывести следующим образом: М (XxYy) = М (Хx) + М (Yy) = x * М (Х) + y * М (Y). Таким образом, вычислить этот параметр для любого органического или неорганического вещества совсем несложно.
Главное, иметь под рукой таблицу Менделеева, тогда никакие онлайн-калькуляторы не потребуются.
Как посчитать вес зная объем и плотность
Задача № 1. Найдите плотность молока, если 206 г молока занимают объем 200 см 3 ?
Задача № 2. Определите объем кирпича, если его масса 5 кг?
Задача № 3. Определите массу стальной детали объёмом 120 см 3
Задача № 4. Размеры двух прямоугольных плиток одинаковы. Какая из них имеет большую массу, если одна плитка чугунная, другая — стальная?
Решение: Из таблицы плотности веществ (см. в конце страницы) определим, что плотность чугуна (ρ2 = 7000 кг/м 3 ) меньше плотности стали (ρ1 = 7800 кг/м 3 ). Следовательно, в единице объема чугуна содержится меньшая масса, чем в единице объема стали, так как чем меньше плотность вещества, тем меньше его масса, если объемы тел одинаковы.
Задача № 5. Определите плотность мела, если масса его куска объемом 20 см 3 равна 48 г. Выразите эту плотность в кг/м 3 и в г/см 3 .
Ответ: Плотность мела 2,4 г/см 3 , или 2400 кг/м 3 .
Задача № 6. Какова масса дубовой балки длиной 5 м и площадью поперечного сечения 0,04 м 2 ?
ОТВЕТ: 160 кг.
РЕШЕНИЕ. Из формулы для плотности получаем m = p • V. С учетом того, что объем балки V = S • l , получаем: m = p • S • l.
Вычисляем: m = 800 кг/м 3 • 0,04 м 2 • 5 м = 160 кг.
Задача № 7. Брусок, масса которого 21,6 г, имеет размеры 4 х 2,5 х 0,8 см. Определить, из какого вещества он сделан.
ОТВЕТ: Брусок сделан из алюминия.
Задача № 8 (повышенной сложности). Полый медный куб с длиной ребра а = 6 см имеет массу m = 810 г. Какова толщина стенок куба?
ОТВЕТ: 5 мм.
РЕШЕНИЕ: Объем кубика VK = а 3 = 216 см 3 . Объем стенок VС можно вычислить, зная массу кубика mК и плотность меди р: VС = mК / р = 91 см 3 . Следовательно, объем полости VП = VK — VC = 125 см 3 . Поскольку 125 см 3 = (5 см) 3 , полость является кубом с длиной ребра b = 5 см. Отсюда следует, что толщина стенок куба равна (а — b)/2 = (6 – 5)/2 = 0,5 см.
Задача № 9 (олимпиадный уровень). Масса пробирки с водой составляет 50 г. Масса этой же пробирки, заполненной водой, но с куском металла в ней массой 12 г составляет 60,5 г. Определите плотность металла, помещенного в пробирку.
ОТВЕТ: 8000 кг/м 3
РЕШЕНИЕ: Если бы часть воды из пробирки не вылилась, то в этом случае общая масса пробирки, воды и куска металла в ней была бы равна 50 г + 12 г = 62 г. По условию задачи масса воды в пробирке с куском металла в ней равна 60,5 г. Следовательно, масса воды, вытесненной металлом, равна 1,5 г, т. е. составляет 1/8 массы куска металла. Таким образом, плотность металла в 8 раз больше плотности воды.
Задачи на плотность, массу и объем с решением. Таблица плотности веществ.
Справочный материал «Задачи на плотность, массу и объем»
Конспект урока «Задачи на плотность, массу и объем с решением».
Источник: uchitel.pro
Концентрации и доли. Как перевести одну концентрацию в другую.
При решении химических задач, при расчётах на работе, да и просто в жизни иногда приходится рассчитывать концентрации. Неважно, будет это школьная теоретическая задача, необходимость приготовить электролит для аккумулятора автомобиля, надобность узнать количество сахара для компота — все расчёты концентраций выполняются по известным формулам, которых не так много. Однако, с этим часто возникают трудности.
Прочитав эту статью, Вы научитесь легко рассчитывать концентрации веществ и при надобности играючи переводить одну концентрацию в другую. В статье приводятся примеры задач с решениями, а в конце приведём справочную табличку с формулами, которую можно распечатать и держать под рукой.
Массовая доля
Начнём с простого, но в то же время нужного способа выражения концентрации компонента в смеси — массовой доли.
Массовая доля есть отношение массы данного компонента к сумме масс всех компонентов. Обозначать её принято буквой w или ω (омега).
Рассчитывается массовая доля по формуле:
Large w_{i}=frac{m_{i}}{m}, ;;;;;(1)
где Large w_{i} — массовая доля компонента i в смеси,
Large m_{i} — масса этого компонента,
m — масса всей смеси.
И сразу разберём на примере:
Задача:
Зимой дороги посыпают песком с солью. Известно, что куча имеет массу 50 кг, и в неё всыпали 1 кг соли и перемешали. Найти массовую долю соли.
Решение:
Масса соли есть Large m_{i} по формуле выше. Масса всей смеси нам пока неизвестна, но найти её легко. Просуммируем массу песка и соли:
Large m = m_{п}+m_{с}= 50 кг + 1 кг = 51 кг
А теперь находим и массовую долю:
Large w_{с} = frac{m_{с}}{m} = 1 кг / 51 кг = 0.0196,
или умножаем на 100% и получаем 1.96%.
Ответ: 0.0196, или 1.96%.
Теперь решим что-то посложнее, и ближе к ЕГЭ.
Задача:
Смешали 200 г раствора глюкозы с массовой концентрацией 25% и 300 г раствора глюкозы с массовой концентрацией 10%. Найти массовую концентрацию полученного раствора, ответ округлить до целых.
Решение:
Обозначим первый и второй растворы соответственно Large m_{1} и Large m_{2}. Массу полученного после смешения раствора обозначим Large m и найдём:
Large m = m_{1} + m_{2} = 200 г + 300 г = 500 г
Массу самой глюкозы в первом и втором растворе обозначим Large m_{гл. 1} и Large m_{гл. 2}. По формуле (1) это будут наши массы компонентов. Массы растворов нам известны, их массовые концентрации тоже. Как найти массу компонента? Очень просто, находим неизвестное делимое умножением (и не забываем, что проценты — это сотые части):
Large m_{гл. 1} = w_{1}cdot m_{1} = 0.25 cdot 200 г = 50 г
Large m_{гл. 2} = w_{2}cdot m_{2} = 0.1 cdot 300 г = 30 г
Таким образом, общая масса глюкозы Large m_{гл}:
Large m_{гл} = m_{гл. 1} + m_{гл. 2} = 50 г + 30 г = 80 г.
Ответ: 80 г.
Задачи на смешение раствором с разными концентрациями одного вещества можно решать с помощью «конверта Пирсона».
Объёмная доля
Часто, когда мы имеем дело с жидкостями и газами, удобно оперировать их объёмами, а не массой. Поэтому, чтобы выражать долю какого-либо компонента в таких смесях (но и в твёрдых тоже вполне можно), пользуются понятием объёмной доли.
Объёмная доля компонента — отношение объёма компонента к сумме объёмов компонентов до смешивания. Объёмная доля измеряется в долях единицы или в процентах. Обычно обозначается греческой буквой φ (фи).
Рассчитывается объёмная доля по формуле:
Large phi_{B}=frac{V_{B}}{sum{V_{i}}}, ; ;;;; (2)
где Large phi_{B} — объёмная доля компонента B;
Large V_{B} — объём компонента B;
Large sum{V_{i}} — сумма объёмов всех компонентов.
Здесь важно понимать, что в формулу по возможности подставляем именно сумму объёмов всех компонентов, а не объём смеси, так как при смешивании некоторых жидкостей суммарный объём уменьшается. Так, если смешать литр воды и литр спирта, два литра аквавита мы не получим — будет примерно 1800 мл. В школьных задачах, как правило, это не так важно, но в уме держим и помним.
Задача:
Смешали 6 объёмов воды и 1 объём серной кислоты. Найти объёмную долю кислоты в полученном растворе.
Решение:
Так как объёмная доля — безразмерная величина, объёмы компонентов в условии задачи могут даваться в любых единицах — литрах, стаканах, баррелях, штофах, сексталях — главное, чтобы в одинаковых. Если не так — переводим одни в другие, если одинаковые — решаем. В нашем условии описаны просто некоторые «объёмы», их и подставляем.
Large phi_{H_{2}SO_{4}} = frac{V_{ H_{2}SO_{4} }} { V_{ H_{2}SO_{4}} + V_{H_{2}O}} = frac{1 : объём}{1 : объём + 6 : объёмов} = frac{1 : объём}{7 : объёмов} = 0.143, : или : 14.3%
Ответ: 14.3 %.
С газами всё обстоит немного интереснее — при не очень больших давлениях и температурах объёмная доля какого-либо газа в газовой смеси равна его мольной доле. (Ведь мы знаем, что молярный объём газов почти равен 22.4 л/моль).
Задача:
Мольная доля кислорода в сухом воздухе составляет 0.21. Найдите объёмную долю азота, если объёмная доля аргона составляет 1%.
Решение:
Внимательный читатель заметил, что мы написали о том, что объёмная и мольная доля для газов в смеси равны. Поэтому, объёмная доля кислорода равна также 0.21, или 21%. Найдём объёмную долю азота:
Large 100% — 21% — 1% = 78%.
Ответ: 78%.
Мольная доля
В тех случаях, когда нам известны количества веществ в смеси, мы можем выразить содержание того или иного компонента с помощью мольной доли.
Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы. ИЮПАК рекомендует обозначать мольную долю буквой x (а для газов — y).
Находят мольную долю по формуле:
Large x_{B} = frac{n_{B}}{sum{n_{i}}}, ;;;;;(3)
где Large x_{B} — мольная доля компонента B;
Large n_{B} — количество компонента B, моль;
Large sum{n_{i}} — сумма количеств всех компонентов.
Разберём на примере.
Задача:
При неизвестных условиях смешали 3 кг азота, 1 кг кислорода и 0.5 кг гелия. Найти мольную долю каждого компонента полученной газовой смеси.
Решение:
Сначала находим количество каждого из газов (моль):
Large n_{N_{2}} = frac{ m_{N_{2}}}{M_{N_{2}}} = frac {3000 : г}{28 : ^г/_{моль}} = 107.14 : моль
Large n_{O_{2}} = frac{ m_{O_{2}}}{M_{O_{2}}} = frac {1000 : г}{32 : ^г/_{моль}} = 31.25 : моль
Large n_{He} = frac{ m_{He}}{M_{He}} = frac {500 : г}{4 : ^г/_{моль}} = 125 : моль
Затем считаем сумму количеств:
Large sum {n} = 107.14 : моль + 31.25 : моль + 125 : моль = 263.39 : моль
И находим мольную долю каждого компонента:
Large y_{N_{2}} = frac {107.14 : моль}{263.39 : моль} = 0.4068, : или : 40.68 %;
Large y_{O_{2}} = frac {31.25 : моль}{263.39 : моль} = 0.1186, : или : 11.86 %;
Large y_{He} = frac {125 : моль}{263.39 : моль} = 0.4746, : или : 47.46 %;
Проверяем:
Large 40.68 % + 11.86 % + 47.46 % = 100%.
И радуемся правильному решению.
Ответ: 40.68%, 11.86% , 47.46%.
Молярность (молярная объёмная концентрация)
А сейчас рассмотрим, вероятно, самый часто встречающийся способ выражения концентрации — молярную концентрацию.
Молярная концентрация (молярность, мольность) — количество вещества (число молей) компонента в единице объёма смеси. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л.
Также иногда говорят просто «молярность», и обозначают буквой М. Это значит, что, например, обозначение «0.5 М раствор соляной кислоты» следует понимать как «полумолярный раствор соляной кислоты», или 0.5 моль/л.
Обозначают молярную концентрацию буквой c (латинская «цэ»), или заключают в квадратные скобки вещество, концентрация которого указывается. Например, [Na+] — концентрация катионов натрия в моль/л. Кстати, слово «моль» в обозначениях не склоняют — 5 моль/л, 3 моль/л.
Рассчитывается молярная концентрация по формуле:
Large c_{B} = frac{n_{B}}{V} ; ; ;;; (4)
где Large n_{B} — количество вещества компонента B, моль;
Large V — общий объём смеси, л.
Разберём на примере.
Задача:
В пивную кружку зачем-то насыпали 24 г сахара и до краёв заполнили кипятком. А нам зачем-то нужно найти молярную концентрацию сахарозы в полученном сиропе. И кстати, дело происходило в Британии.
Решение:
Молекулярная масса сахарозы равна 342 (посчитайте, может мы ошиблись — C12H22O11). Найдём количество вещества:
Large n_{сахарозы} = frac{24 : г}{342 : г/моль} = 0.0702 моль
Британская пинта (мера объёма такая) равна 0.568 л. Поэтому молярная концентрация находится так:
Large c_{сахарозы} = frac{0.0702 : моль}{0.568 : л} = 0.1236 моль/л
Ответ: 0.1236 моль/л.
Нормальная концентрация (молярная концентрация эквивалента, «нормальность»)
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре смеси. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов).
Обозначается нормальная концентрация как сн, сN, или даже c(feq B). Рассчитывается нормальная концентрация по формуле:
Large c_{N} = z cdot c_{B} = z cdot frac{n_{B}}{V}= frac{1}{f_{eq}} cdot frac {n_{B}}{V} ; ;;;; (5)
где Large n_{B} — количество вещества компонента В, моль;
V — общий объём смеси, л;
z — число эквивалентности (фактор эквивалентности Large f_{eq} = 1/z ).
Значение нормальной концентрации для растворов записывают как «н» или «N», а говорят «нормальность» или «нормальный». Например, раствор с концентрацией 0.25 н — четвертьнормальный раствор.
Разберём на примере.
Задача:
Рассчитать нормальность раствора объёмом 1 л, если в нём содержится 40 г перманганата калия. Раствор приготовили для последующего проведения реакции в нейтральной среде.
Решение:
В нейтральной среде перманганат калия восстанавливается до оксида марганца (IV). При этом в окислительно-восстановительной реакции 1 атом марганца принимает 3 электрона (проверьте на любой окислительно-восстановительной реакции перманганата калия с образованием оксида, расставив степени окисления), что означает, что число эквивалентности будет равно 3. Для расчёта концентрации по формуле (5) выше нам ещё не хватает количества вещества KMnO4. найдём его:
Large n_{KMnO_{4}}=frac{m _{KMnO_{4}}}{M _{KMnO_{4}} } = frac{40 : г}{158 г/моль}= 0.253 моль
Теперь считаем нормальную концентрацию:
Large c_{N_{KMnO_{4}}}= z cdot frac{n_{KMnO_{4}}}{V} = 3 cdot frac{0.253 : моль}{1 : л} = 0.759 моль-экв/л
Ответ: 0.759 моль-экв/л.
Таким образом, заметим важное на практике свойство — нормальная концентрация больше молярной в z раз.
Мы не будем рассматривать в данной статье особо экзотические способы выражения концентраций, о них вы можете почитать в литературе или интернете. Поэтому расскажем ещё об одном способе, и на нём остановимся — массовая концентрация.
Моляльная концентрация
Моляльная концентрация (моляльность, молярная весовая концентрация) — количество растворённого вещества (число моль) в 1000 г растворителя.
Измеряется моляльная концентрация в молях на кг. Как и с молярной концентрацией, иногда говорят «моляльность», то есть раствор с концентрацией 0.25 моль/кг можно назвать четвертьмоляльным.
Находится моляльная концентрация по формуле:
Large m_{B} = frac{n_{B}}{m_{A}}, ;;;;; (6)
где Large n_{B} — количество вещества компонента B, моль;
Large m_{A} — масса растворителя, кг.
Казалось бы, зачем нужна такая единица измерения для выражения концентрации? Так вот, у моляльной концентрации есть одно важное свойство — она не зависит от температуры, в отличие, например, от молярной. Подумайте, почему?
Ответ:
Потому что в формуле расчёта молярной концентрации участвует объём раствора, а жидкости, как известно, в большинстве своём расширяются с ростом температуры.
Массовая концентрация
Массовая концентрация — отношение массы растворённого вещества к объёму раствора. По рекомендации ИЮПАК, обозначается символом γ или ρ.
Находится массовая концентрация по формуле:
Large rho_{B}=frac{m_{B}}{V}, ;;;;; (7)
где Large m_{B} — масса растворенного вещества, г;
Large V — общий объём смеси, л.
В системе СИ выражается в кг/м3.
Разберём на примере.
Задача:
Рассчитать массовую концентрацию перманганата калия по условиям предыдущей задачи.
Решение:
Решение будет совсем простым. Считаем:
Large rho_{ KMnO_{4} }=frac{m_{ KMnO_{4} }}{V} =frac{40 : г}{1 : л} = 40 г/л.
Ответ: 40 г/л.
Также в аналитической химии пользуются понятием титра по растворенному веществу. Титр по растворенному веществу находится так же, как и массовая концентрация, но выражается в г/мл. Легко догадаться, что в задаче выше титр будет равен 0.04 г/мл (для этого надо умножить наш ответ на 0.001 мл/л, проверьте). Кстати, обозначается титр буквой Т.
А теперь, как обещали, табличка с формулами перевода одной концентрации в другую.
Таблица перевода одной концентрации в другую.
В таблице слева — ВО ЧТО переводим, сверху — ЧТО. Если стоит знак «=», то, естественно, эти величины равны.
| Массовая доля, large omega, % | Мольная доля, large x , % | Объёмная доля, large phi, % | Молярная концентрация, large c, моль/л | Нормальная концентрация, large c_{N} , моль-экв/л | Моляльная концентрация, large m, моль/кг | Массовая концентрация, large rho, г/л |
| Массовая доля, large omega, % | = | large omega_{B}=LARGE frac{x_{B} cdot M(B)}{sum x_{i} cdot M_{i}} | Для газов: omega = LARGE frac{phi_{A} cdot M(A)}{sum (M_{i} cdot phi_{i})} | large omega_{B}= LARGE frac{c_{B} cdot M(B)}{rho} | large omega_{B}=LARGE frac{c_{N} cdot M(B)}{rho cdot z} | large omega_{B}= LARGE frac{gamma_{B}}{rho} |
| Мольная доля, large x , % | large x_{B}=LARGE frac{frac{omega_{B}}{M(B)}}{sum frac{omega_{i}}{M_{i}}} | = | large x_{B}=LARGE frac{m_{B}}{m_{B}+frac{1}{M(A)}} | |||
| Объёмная доля, large phi, % | Для газов: large phi_{A}=LARGE frac{frac{omega_{A}}{M(A)}}{sum frac{omega_{i}}{M_{i}}} | = | ||||
| Молярная концентрация, large c, моль/л | large c_{B}=LARGE frac{rho cdot omega_{B}}{M(B)} | = | large c_{B}=Large frac{c_{N}}{z} | |||
| Нормальная концентрация, large c_{N} , моль-экв/л | large c_{N}=LARGE frac{rho cdot omega_{B} cdot z}{M(B)} | large c_{N}=c_{B} cdot z | = | |||
| Моляльная концентрация, large m, моль/кг | large m_{B}=Large frac{x_{B}}{M(A)(1-x_{B})} | = | ||||
| Массовая концентрация, large gamma, г/л | large gamma_{B}=rho cdot omega_{B} | = |
Таблица будет пополняться.
Похожие записи:
Теоретическая выкладка
Ещё в Древней Греции учёные знали формулу определения объема вещей в зависимости от массы и плотности. Так Архимед открыл закон, названный его именем. Почему же ведро с водой поднять заметно легче, чем с песком? Всё объясняется различной плотностью веществ. В единице объёма песка больше вещества, чем в воде, значит, он плотнее жидкой субстанции.
Структура практически всех окружающих субстанций неравномерна, а значит, и концентрация массы в единице веществ отличается, но незначительно. В задачах этой разницей пренебрегают.
Плотностью называется величина, получаемая вследствие разделения массы объекта на занимаемое им пространство. В физике имеет вид:
ρ = m/V, ρ – читается как «ро».
В системе СИ измеряется в кг/м³, на практике применяются кратные и дольные единицы измерения, например, см/кг3.
В физике существует несколько трактовок или типов плотностей:
- объёмная – рассматриваемая величина;
- поверхностная – отношение веса к площади;
- линейная – указывает на обратную пропорциональность массы к длине, применяется в двухмерных вычислениях;
- плотность электрического заряда.
Относительно к газам формула видоизменяется:
ρ = M / Vm, здесь, M и Vm – молярные масса с объёмом соответственно.
Молярный объем

4.2
Средняя оценка: 4.2
Всего получено оценок: 261.
4.2
Средняя оценка: 4.2
Всего получено оценок: 261.
При изучении химических веществ важными понятиями являются такие величины, как молярная масса, плотность вещества, молярный объем. Так, что же такое молярный объем, и в чем его отличие для веществ в разном агрегатном состоянии?
Молярный объем: общая информация
Чтобы вычислить молярный объем химического вещества необходимо молярную массу этого вещества разделить на его плотность. Таким образом, молярный объем вычисляется по формуле:
Vm=M/p,
где Vm – молярный объем вещества, М – молярная масса, p – плотность. В Международной системе СИ эта величина измеряется в кубический метр на моль (м 3 /моль).
Молярный объем газообразных веществ отличается от веществ, находящихся в жидком и твердом состоянии тем, что газообразный элемент количеством 1 моль всегда занимает одинаковый объем (если соблюдены одинаковые параметры).
Объем газа зависит от температуры и давления, поэтому при расчетах следует брать объем газа при нормальных условиях. Нормальными условиями считается температура 0 градусов и давление 101,325 кПа.
Молярный объем 1 моля газа при нормальных условиях всегда одинаков и равен 22,41 дм 3 /моль. Этот объем называется молярным объемом идеального газа. То есть, в 1 моле любого газа (кислород, водород, воздух) объем равен 22,41 дм 3 /м.
Молярный объем при нормальных условиях можно вывести, используя уравнение состояния для идеального газа, которое называется уравнением Клайперона-Менделеева:
P*V=n*R*T,
где R – универсальная газовая постоянная, R=8.314 Дж/моль*К=0,0821 л*атм/моль К
Объем одного моля газа V=RT/P=8.314*273.15/101.325=22.413 л/моль, где Т и Р – значение температуры (К) и давления при нормальных условиях.
Закон Авогадро
В 1811 году А. Авогадро выдвинул гипотезу, что в равных объемах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковой число молекул. Позже гипотеза подтвердилась и стала законом, носящим имя великого итальянского ученого.
Закон становится понятен, если вспомнить, что в газообразном виде расстояние между частицами несопоставимо больше, чем размеры самих частиц.
Таким образом, из закона Авогадро можно сделать следующие выводы:
- В равных объёмах любых газов, взятых при одной и той же температуре и при одном и том же давлении, содержится одно и то же число молекул.
- 1 моль совершенно различных газов при одинаковых условиях занимает одинаковый объем.
- Один моль любого газа при нормальных условиях занимает объем 22,41 л.
Следствие из закона Авогадро и понятие молярного объема основаны на том, что моль любого вещества содержит одинаковое число частиц (для газов – молекул), равное постоянной Авогадро.
Чтобы узнать число молей растворенного вещества содержится в одном литре раствора, необходимо определить молярную концентрацию вещества по формуле c=n/V, где n – количество растворенного вещества, выражаемое в молях, V – объем раствора, выражаемый в литрах С – молярность.
Что мы узнали?
В школьной программе по химии 8 класса изучается тема «Молярный объем». В одном моле газа всегда содержится одинаковый объем, равный 22,41 кубический метр/моль. Этот объем называется молярным объемом газа.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Александр Котков
10/10
-
Артак Саркисян
10/10
Оценка доклада
4.2
Средняя оценка: 4.2
Всего получено оценок: 261.
А какая ваша оценка?
Итак, количество вещества в химии обозначается греческой буквой «ню».
Помню, как в 9-м классе мой учитель физики Игорь Юрьевич учил меня правильно писать букву «ню». До этого она у меня получалась немного коряво.
Но поскольку на БВ не проходят греческие буквы, я буду обозначать количество вещества латинской буквой v. Латинская v очень похожа на греческую «ню».
Рассмотрим следующие случаи.
1) Если нам известно количество частиц вещества, то количество вещества можно найти по формуле:
v = n/NA
где
v — количество вещества;
n — количество частиц вещества. Это безразмерная величина, то есть это просто число. Правда, это число бывает очень большим, например, 5*(10^24).
NA — постоянная Авогадро. Постоянная Авогадро представляет собой универсальную константу. NA = 6,022*(10^23) моль^(–1).
2) Если нам известна масса вещества, то количество вещества находится по следующей формуле:
v = m/M
где
v — количество вещества;
m — масса вещества;
M — молярная масса вещества находится по химической формуле вещества, при помощи периодической системы Д. И. Менделеева, путём суммирования атомных масс всех входящих в молекулу атомов с учётом имеющихся индексов.
3) Если нам известен объём газообразного вещества, то мы можем найти количество вещества газа по такой формуле:
v = V/Vm
где
v — количество вещества;
V — объём газа;
Vm — молярный объём газов. Молярный объём газов — это универсальная константа. Vm = 22,414 л/моль = 22414 м3/моль.
Повторюсь, что формула v = V/Vm верна только для газов!
Наконец, рассмотрим Ваш случай.
Вам по условию даны объём и объёмная доля.
Я рискну предположить, что у Вас задача примерно такого рода:
«Объём газовой смеси составляет 240 л. Объёмная доля кислорода в смеси равна 45%. Вычислите количество вещества кислорода в смеси».
Такая задача решается в два действия.
1) Находим объём кислорода:
V (O2) = V0 * ф / 100 = 240 л * 45 / 100 = 108 л.
(Ф — это объёмная доля, она обозначается греческой буквой «фи». Вместо неё приходится писать русскую ф).
2) Находим количество вещества кислорода. Кислород — это газ, значит, мы имеем право воспользоваться формулой v = V/Vm.
v (O2) = V/Vm = 108 л : 22,414 л/моль = 4,818 моль. Округление произведено до тысячных.