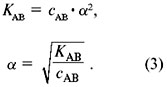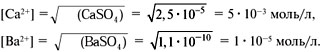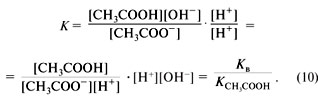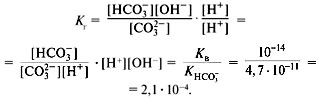Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Степень диссоциации
Классификация электролитов
Диссоциация электролитов
Константа диссоциации
Примеры решения задач
Задачи для самостоятельного решения
Степень диссоциации
Вещества, которые в растворах или расплавах полностью или частично распадаются на ионы, называются электролитами.
Степень диссоциации α — это отношение числа молекул, распавшихся на ионы N′ к общему числу растворенных молекул N:
α = N′/N
Степень диссоциации выражают в процентах или в долях единицы. Если α =0, то диссоциация отсутствует и вещество не является электролитом. В случае если α =1, то электролит полностью распадается на ионы.
Классификация электролитов
Согласно современным представлениям теории растворов все электролиты делятся на два класса: ассоциированные (слабые) и неассоциированные (сильные). Неассоциированные электролиты в разбавленных растворах практически полностью диссоциированы на ионы. Для этого класса электролитов a близко к единице (к 100 %). Неассоциированными электролитами являются, например, HCl, NaOH, K2SO4 в разбавленных водных растворах.
Ассоциированные электролиты подразделяются на три типа:
-
-
- Слабые электролиты существуют в растворах как в виде ионов, так и в виде недиссоциированных молекул. Примерами ассоциированных электролитов этой группы являются, в частности, Н2S, Н2SO3, СН3СOОН в водных растворах.
- Ионные ассоциатыобразуются в растворах путем ассоциации простых ионов за счет электростатического взаимодействия. Ионные ассоциаты возникают в концентрированных растворах хорошо растворимых электролитов. В результате в растворе находятся как простые ионы, так и ионные ассоциаты. Например, в концентрированном водном растворе КCl образуются простые ионы К+, Cl— , а также возможно образование ионных пар (К+Cl— ), ионных тройников (K2Cl+, KCl2— ) и ионных квадруполей (K2Cl2, KCl32- , K3Cl2+).
- Комплексные соединения(как ионные, так и молекулярные), внутренняя сфера которых ступенчато диссоциирует на ионные и (или) молекулярные частицы.
Примеры комплексных ионов: [Cu(NH3)4]2+, [Fe(CN)6]3+, [Cr(H2O)3Cl2]+.
-
При таком подходе один и тот же электролит может относиться к различным типам в зависимости от концентрации раствора, вида растворителя и температуры. Подтверждением этому являются данные, приведенные в таблице.
Таблица. Характеристика растворов KI в различных растворителях
| Концентрация электролита, С, моль/л | Температура
t,оС |
Растворитель | Тип электролита |
| 0,01 | 25 | Н2О | Неассоциированный (сильный) |
| 5 | 25 | Н2О | Ионный ассоциат |
| 0,001 | 25 | С6Н6 | Ассоциированный (слабый) |
Приближенно, для качественных рассуждений можно пользоваться устаревшим делением электролитов на сильные и слабые. Выделение группы электролитов “средней силы” не имеет смысла. Эти электролиты являются ассоциированными. К слабым электролитам обычно относят электролиты, степень диссоцииации которых мала α<<1.
Таким образом, к сильным электролитам относятся разбавленные водные растворы почти всех хорошо растворимых в воде солей, многие разбавленные водные растворы минеральных кислот (НСl, HBr, НNО3, НСlO4 и др.), разбавленные водные растворы гидроксидов щелочных металлов. К слабым электролитам принадлежат все органические кислоты в водных растворах, некоторые водные растворы неорганических кислот, например, H2S, HCN, H2CO3, HNO2, HСlO и др. К слабым электролитам относится и вода.
Диссоциация электролитов
Уравнение реакции диссоциации сильного электролита можно представить следующим образом. Между правой и левой частями уравнения реакции диссоциации сильного электролита ставится стрелка или знак равенства:
HCl → H+ + Cl—
Na2SO3 = 2Na+ + SO32-
Допускается также ставить знак обратимости, однако в этом случае указывается направление, в котором смещается равновесие диссоциации, или указывается, что α≈1. Например:
NaOH → Na+ + OH—
Диссоциация кислых и основных солей в разбавленных водных растворах протекает следующим образом:
NaHSO3 → Na+ + HSO3—
Анион кислой соли будет диссоциировать в незначительной степени, поскольку является ассоциированным электролитом:
HSO3— → H+ + SO32-
Аналогичным образом происходит диссоциация основных солей:
Mg(OH)Cl → MgOH+ + Cl—
Катион основной соли подвергается дальнейшей диссоциации как слабый электролит:
MgOH+ → Mg2+ + OH—
Двойные соли в разбавленных водных растворах рассматриваются как неассоциированные электролиты:
KAl(SO4)2 → K+ + Al3+ + 2SO42-
Комплексные соединения в разбавленных водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы:
K3[Fe(CN)6] → 3K+ + [Fe(CN)6]3-
В свою очередь, комплексный ион в незначительной степени подвергается дальнейшей диссоциации:
[Fe(CN)6]3- → Fe3+ + 6CN—
Константа диссоциации
При растворении слабого электролита КА в растворе установится равновесие:
КА ↔ К+ + А—
которое количественно описывается величиной константы равновесия Кд, называемой константой диссоциации:
Kд = [К+] · [А—] /[КА] (2)
Константа диссоциации характеризует способность электролита диссоциировать на ионы. Чем больше константа диссоциации, тем больше ионов в растворе слабого электролита. Например, в растворе азотистой кислоты HNO2 ионов Н+ больше, чем в растворе синильной кислоты HCN, поскольку К(HNO2) = 4,6·10— 4, а К(HCN) = 4,9·10— 10.
Для слабых I-I электролитов (HCN, HNO2, CH3COOH) величина константы диссоциации Кд связана со степенью диссоциации α и концентрацией электролита c уравнением Оствальда:
Кд = (α2·с)/(1-α) (3)
Для практических расчетов при условии, что α<<1 используется приближенное уравнение:
Кд = α2·с (4)
Поскольку процесс диссоциации слабого электролита обратим, то к нему применим принцип Ле Шателье. В частности, добавление CH3COONa к водному раствору CH3COOH вызовет подавление собственной диссоциации уксусной кислоты и уменьшение концентрации протонов. Таким образом, добавление в раствор ассоциированного электролита веществ, содержащих одноименные ионы, уменьшает его степень диссоциации.
Следует отметить, что константа диссоциации слабого электролита связана с изменением энергии Гиббса в процессе диссоциации этого электролита соотношением:
ΔGT0 = — RTlnKд (5)
Уравнение (5) используется для расчета констант диссоциации слабых электролитов по термодинамическим данным.
Примеры решения задач
Задача 1. Определите концентрацию ионов калия и фосфат-ионов в 0,025 М растворе K3PO4.
Решение. K3PO4 – сильный электролит и в водном растворе диссоциирует полностью:
K3PO4 → 3К+ + РО43-
Следовательно, концентрации ионов К+ и РО43- равны соответственно 0,075М и 0,025М.
Задача 2. Определите степень диссоциации αд и концентрацию ионов ОН— (моль/л) в 0,03 М растворе NH3·H2О при 298 К, если при указанной температуре Кд(NH3·H2О) = 1,76× 10— 5.
Решение. Уравнение диссоциации электролита:
NH3·H2О → NH4+ + OH—
Концентрации ионов: [NH4+] = αС ; [OH—] = αС , где С – исходная концентрация NH3·H2О моль/л. Следовательно:
Kд = αС · αС /(1 — αС)
Поскольку α << 1, то:
Кд ≈ α 2С
Константа диссоциации зависит от температуры и от природы растворителя, но не зависит от концентрации растворов NH3·H2О. Закон разбавления Оствальда выражает зависимость α слабого электролита от концентрации.
α = √(Кд / С) = √(1,76× 10— 5 / 0,03) = 0,024 или 2,4 %
[OH—] = αС, откуда [OH— ] = 2,4·10— 2·0,03 = 7,2·10-4 моль/л.
Задача 3. Определите константу диссоциации уксусной кислоты, если степень диссоциации CH3CОOH в 0,002 М растворе равна 9,4 %.
Решение. Уравнение диссоциации кислоты:
CH3CОOH → СН3СОО— + Н+.
α = [Н+] / Сисх(CH3CОOH)
откуда [Н+] = 9,4·10—2·0,002 = 1,88·10-4 М.
Так как [CH3CОO—] = [Н+] и [CH3CОOH] ≈ Сисх(CH3CОOH), то:
Kд = [Н+]2 / Сисх(CH3CОOH)
Константу диссоциации можно также найти по формуле: Кд ≈ α 2С.
Задача 4. Константа диссоциации HNO2 при 298К равна 4,6× 10— 4. Найдите концентрацию азотистой кислоты, при которой степень диссоциации HNO2 равна 5 %.
Решение.
Кд =α 2С , откуда получаем Сисх(HNO2) = 4,6·10— 4/(5·10— 2)2 = 0,184 М.
Задача 5. На основе справочных данных рассчитайте константу диссоциации муравьиной кислоты при 298 К.
Решение. Уравнение диссоциации муравьиной кислоты
НСООН →Н+ + СООН—
В “Кратком справочнике физико–химических величин” под редакцией А.А. Равделя и А.М. Пономаревой приведены значения энергий Гиббса образований ионов в растворе, а также гипотетически недиссоциированных молекул. Значения энергий Гиббса для муравьиной кислоты и ионов Н+ и СООН— в водном растворе приведены ниже:
| Вещество, ион | НСООН | Н+ | СООН— |
| ΔGT0, кДж/моль | — 373,0 | 0 | — 351,5 |
Изменение энергии Гиббса процесса диссоциации равно:
ΔGT0 = — 351,5- (- 373,0) = 21,5 кДж/моль.
Для расчета константы диссоциации используем уравнение (5). Из этого уравнения получаем:
lnKд = — Δ GT0/RT= — 21500/(8,31 298) = — 8,68
Откуда находим: Kд = 1,7× 10— 4.
Задачи для самостоятельного решения
1. К сильным электролитам в разбавленных водных растворах относятся:
- СН3СOOH
- Na3PO4
- NaCN
- NH3
- C2H5OH
- HNO2
- HNO3
13.2. К слабым электролитам в водных растворах относятся:
- KAl(SO4)2
- NaNO3
- HCN
- NH4Cl
- C2H5OH
- H2SO3
- H2SO4
3. Определите концентрацию ионов NH4+ в 0,03 М растворе (NH4)2Fe(SO4)2;
4. Определите концентрацию ионов водорода в 6 мас.% растворе H2SO4, плотность которого составляет 1,038 г/мл. Принять степень диссоциации кислоты по первой и второй ступеням равной 100 %.
5. Определите концентрацию гидроксид-ионов в 0,15 М растворе Ba(OH)2.
6. Степень диссоциации муравьиной кислоты в 0,1 М растворе равна 4 %. Рассчитайте Концентрацию ионов водорода в этом растворе и константу диссоциации НСООН.
7. Степень диссоциации муравьиной кислоты в водном растворе увеличится при:
а) уменьшении концентрации HCOOH;
б) увеличении концентрации HCOOH;
в) добавлении в раствор муравьиной кислоты HCOONa;
г) добавлении в раствор муравьиной кислоты НCl.
8. Константа диссоциации хлорноватистой кислоты равна 5× 10— 8. Определите концентрацию HClO, при которой степень диссоциации HClO равна 0,5 %, и концентрацию ионов Н+ в этом растворе.
9. Вычислите объем воды, который необходимо добавить к 50 мл 0,02 М раствора NH3·H2О, чтобы степень диссоциации NH3·H2О увеличилась в 10 раз, если Кд(NH4OH) = 1,76·10— 5.
10. Определите степень диссоциации азотистой кислоты в 0,25 М растворе при 298 К, если при указанной температуре Кд(HNO2) = 4,6× 10— 4.
-
Константа диссоциации
Кд
– константа диссоциации – это отношение
произведения концентрации диссоциированных
ионов к концентрации недиссоциированных
молекул электролита. Например,
К
Кд
– показывает во сколько раз скорость
диссоциации больше скорости ассоциации.
Чем больше Кд,
тем сильнее электролит. Кд
зависит от природы электролита и
растворителя, температуры и не зависит
от концентрации раствора.
-
Взаимосвязь степени диссоциации и константы диссоциации
Напомним,
что
степень
диссоциации α — отношение числа молекул,
распавшихся на ионы, к общему числу
молекул, тогда для уравнения
К
С∙
α – количество диссоциированных моль
электролита КА,
(С-(С∙
α)) — количество недиссоциированных
моль электролита КА.
Подставим
эти значения в формулу выражения Кд:
получим
.
Это
математическое выражение закона
разбавления В. Оствальда (1888 г). Выражение
можно упростить, если принять α→0.
Величиной α в знаменателе пренебрегают
и уравнение принимает вид:
≈ α2C,
или α ≈
Формулировка
закона разбавления В. Оствальда: «C
разбавлением раствора слабого электролита
степень диссоциации увеличивается».
-
Ионное произведение воды. Водородный показатель.
Согласно
протолитической теории Брэнстеда и
Лоури, вода не нейтральный растворитель.
Ее молекула может быть донором и
акцептором протонов, т.е. является
амфолитом. Явление, когда молекулы
одного и того же вещества одновременно
выступают в качестве кислоты и основания,
называются автопротолизом. Сокращенно
автопротолиз воды можно записать как
процесс ее диссоциации на ионы.
Н
Н++ОН—
Применяя
закон действующих масс, запишем константу
диссоциации воды, значение которой
можно вычислить по данным измерения
электрической проводимости воды.
Кд=
=1,8·10-16
(при 22ºС)
В
знаменателе дроби — концентрация
недиссоциированных молекул воды, которую
можно считать постоянной и определить
в 1 л, приняв массу 1л воды за 1000г.
[Н2О]==55,56
молей,
тогда
Кд==1,8·10-16
Или
[Н+]·[ОН—]=1·10-14
моль-ион/л (ионное произведение воды
или константа автопротолиза).
Ионное
произведение воды
— произведение равновесных концентраций
катионов водорода и гидроксид ионов,
величина постоянная и равна 10-14
моль-ион/л.
Таким
образом, ионное произведение воды
позволяет для любого водного раствора
найти концентрацию ОН—
по
известной концентрации Н+,
и наоборот.
Кислотность
растворов обычно выражают через
концентрацию ионов Н+.
В нейтральных растворах
[Н+]=[ОН—]=√10-14=10-7моль-ион/л.
В кислых растворах [Н+]>10-7моль-ион/л,
в щелочных [Н+]<10-7моль-ион/л.
Чтобы
не писать числа с показателем степени,
кислотность раствора выражают через
отрицательный логарифм концентрации
ионов водорода, называя эту величину
водородным
показателем
и обозначая ее рН.
рН=-lg[Н+],
рОН=-lg[ОН—],
рН+рОН=14
Величина
рН впервые была введена датским химиком
С. Серенсоном. Буква «р» — начальная от
датского слова potenz
(степень), «Н»- символ водорода.
В
кислых растворах рН <7, в нейтральных
=7, в щелочных >7.
В
обычной лабораторной практике рН
измеряют с погрешностью 0,02. По этой
причине не следует приводить значение
рН раствора более чем с двумя цифрами
после запятой.
В
растворах слабых кислот НА кислотно-основное
равновесие имеет вид
Н
Н3О++А—
или
Н
Н++А—
Константа
кислотной диссоциации (константа
кислотности)
Ка
равна:
Ка=[Н+]·
[А—]/[НА]
В
растворе слабых оснований В кислотно-основное
равновесие имеет вид
В
Н2О
ВН++ОН—
Где
В-основание, а ВН+
—
сопряженная В кислота. Константа
кислотно-основного равновесия в этом
случае в соответствии с законом
действующих масс равна:
Кb=[BН+]·
[ОН—]/[В]
Константу
Кb
называют константой диссоциации
основания В или константой
основности.
Величины
Ка
и
Кb
для
сопряженной кислотно-основной пары
связаны также простым соотношением.
Ка
Кb=10-14
или рКа+рКb=14,
рКb=14-рКа
Таким
образом, сила кислот и оснований может
быть выражена в общей шкале рКа,
подобно тому, как реакция среды
характеризуется водородным показателем
рН.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Как правильно рассчитать константу диссоциации слабого электролита
Задача 94.
Концентрация ионов Н+ в 0,1 М растворе СН3СООН равна 1,3 · 10–3 моль/дм3. Вычислите константу и степень диссоциации кислоты.
Решение:
СМ(СН3СООН) = 0,1 моль/дм3;
[H+] = 1,3 · 10–3 моль/дм3;
KD(CH3COOH) = ?
α = ?
1. Вычисление степень диссоциации уксусной кислоты
Для расчета будем использовать формулу: [H+] = СМ · α
Тогда
α = [H+]/CM(CH3COOH) = (1,3 · 10–3)/0,1 = 1,3 · 10–2 или 1,3%.
2. Вычисление константы диссоциации уксусной кислоты
В случае слабых электролитов константа диссоциации определяется по формуле:
KD = (αCM · αCM)/CM(1 — α) = α2CM/(1 — α).
Тогда
KD(СН3СООН) = [(α)2 · СМ(СН3СООН)]/(1 — α) = [(1,3 · 10–2)2 · 0,1]/(1 — 1,3 · 10–2) =
= 0,0000169/0,987 = 0,0000171 = 1,71 · 10–5.
Ответ: KD(СН3СООН) = 1,71 · 10–5; альфа = 1,3%.
Задача 95.
Вычислите константу диссоциации НСООН, если в растворе w% = 0,46% и она диссоциирована на 4,2%.
Решение:
М(НСООН) = 46 г/моль;
w% = 0,46%;
α = 4,2% или 0,042
KD(НСООН) = ?
1. Вычисление концентрацию муравьиной кислоты
Концентрацию кислоты находим из вычисления:
СМ(НСООН) = [(w% · 1000г)/100%]/M(НСООН); СМ(НСООН) = [(0,46% · 1000г)/100%]/46 г/моль = 0,1 моль/дм3.
2. Вычисление константы диссоциации НСООН
В случае слабых электролитов константа диссоциации определяется по формуле:
KD = (αCM · αCM)/CM(1 — α) = α2CM/(1 — α).
Тогда
KD(НСООН) = [(0,042)2 · 0,1]/(1 — 0,042) = 0,0001764/0,958 = 0,000184 или 1,84 · 10–4.
Ответ: KD(НСООН) = 1,84 · 10–4.
Задача 96.
Вычислите константу диссоциации диметиламина, если в 0,2 М растворе он диссоциирован на 7,42%.
Решение:
M[(CH3)2NH] = 45,08 г/моль;
CM[(CH3)2NH] = 0,2 М;
α = 7,42% или 0,0742.
1. Вычисление константы диссоциации (CH3)2NH
В случае слабых электролитов константа диссоциации определяется по формуле:
KD = (αCM · αCM)/CM(1 — α) = α2CM/(1 — α).
Тогда
KD[(CH3)2NH] = [(0,0742)2 · 0,2]/(1 — 0,0742) = 0,0011/0,9258 = 0,0012 или 1,20 · 10–3.
Ответ: KD[(CH3)2NH] = 1,20 · 10–3.
Задача 97.
Концентрация ионов Н+ в 0,2 М растворе C2H5COOH равна 1,2 · 10–2 моль/дм3. Вычислите константу и степень диссоциации кислоты.
Решение:
СМ(C2H5COOH) = 0,2 моль/дм3;
[H+] = 1,2 · 10–2 моль/дм3;
KD(C2H5COOH) = ?
α = ?
1. Вычисление степень диссоциации этановой кислоты
Для расчета будем использовать формулу: [H+] = СМ · α
Тогда
α = [H+]/CM(C2H5COOH) = (1,2 · 10–2)/0,2 = 6,0 · 10–2 или 6%.
2. Вычисление константы диссоциации этановой кислоты
В случае слабых электролитов константа диссоциации определяется по формуле:
KD = (αCM · αCM)/CM(1 — α) = α2CM/(1 — α).
Тогда
KD(C2H5COOH) = [(α)2 · СМ(СН3СООН)]/(1 — α) = [(6,0 · 10–2)2 · 0,2]/(1 — 6,0 · 10–2) = 0,00072/0,94 = 0,0000171 = 7,7 · 10-4.
Ответ: KD(C2H5COOH) = 7,7 · 10-4; α = 0,06%.
КУРСЫ ПОВЫШЕНИЯ
КВАЛИФИКАЦИИ
Л.С.ГУЗЕЙ
Фундаментальные понятия
общей химии в школьном курсе
Учебный план курса
| № газеты | Учебный материал |
|---|---|
| 17 | Лекция № 1. Стехиометрия |
| 18 | Лекция № 2. Элементы химической кинетики |
| 19 | Лекция № 3. Элементы химической термодинамики. Kонтрольная работа № 1. Стехиометрия. Закономерности протекания химических реакций(срок выполнения – до 15 ноября 2005 г.) |
| 20 | Лекция № 4. Химическое равновесие в растворах электролитов |
| 21 | Лекция № 5. Окислительно-восстановительные процессы.Kонтрольная работа № 2. Равновесия в растворах электролитов (срок выполнения – до 15 декабря 2005 г.) |
| 22 | Лекция № 6. Строение атома и химическая связь |
| 23 | Лекция № 7. Химическая связь и строение молекул |
| 24 | Лекция № 8. Строение вещества. Дисперсные системы |
| Итоговая работа. Разработка урока для основной или старшей профильной школы. Итоговые работы, сопровождаемые справками из учебного заведения, должны быть направлены в Педагогический университет не позднее 28 февраля 2006 г. |
ЛЕКЦИЯ № 4
Химическое равновесие
в растворах электролитов
Требования образовательного стандарта,
рассмотренные в лекции.
Основное образование (8–9-е классы).
Электролитическая диссоциация веществ в водных
растворах. Электролиты и неэлектролиты.
Электролитическая диссоциация кислот, щелочей и
солей. Реакции ионного обмена.
Среднее (полное) общее образование (10–11-е
классы). Базовый уровень. Среда водных
растворов: кислая, нейтральная, щелочная.
Водородный показатель (рН) раствора.
Профильный уровень. Сильные и слабые
электролиты. Константа диссоциации.
Произведение растворимости. Кислотно-основные
взаимодействия в растворах. Амфолиты. Ионное
произведение воды.
Электролиты и неэлектролиты
Электролитами называют вещества, проводящие
электрический ток за счет движения ионов (а не
электронов, как в проводниках-металлах).
Из этого определения видно, что
вещества-электролиты должны содержать ионы,
которые могут двигаться. Это могут быть твердые,
жидкие и даже газообразные вещества (правда, на
практике к газам, находящимся в таком состоянии
– состоянии плазмы, термин «электролит» обычно
не применяют).
Ионной проводимостью в твердом состоянии
обладают некоторые оксиды (например, ZrO2,
содержащий примесь СаО) при высоких (порядка
1000 °С) температурах (рис.). Примесь оксида
кальция создает кислородные вакансии (на рисунке
ионы кальция затемнены, а пустыми
прямоугольниками обозначены места, в которых
отсутствуют ионы кислорода) в кристаллической
решетке оксида циркония, по которым и может
происходить диффузия этих ионов. Высокая
температура обеспечивает их подвижность. Это так
называемые твердые электролиты, используемые,
например, в топливных элементах (см. следующие
лекции). (Обратитесь также к лекции № 1, рис. 2.)
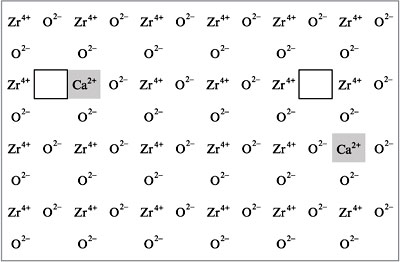 |
Рис.
|
Ионной проводимостью в жидком
состоянии обладают все расплавленные соли,
некоторые сорта стекла (как в твердом, так и в
жидком виде). Настоящая лекция посвящена
электролитам, представляющим водные растворы
кислот, оснований и солей.
1. Образование ионов в водных
растворах.
Электролитическая диссоциация
Свободные ионы, необходимые для создания
ионной проводимости, могут появиться в растворе
двумя способами.
Первый способ – разрушение
кристаллической решетки при растворении в воде
веществ, связь в которых по типу приближается к
ионной, и освобождение ионов.
Для протекания такого процесса необходимо
затратить значительную энергию. Например, для
разделения 1 моль кристаллического NaCl на
свободные ионы Na+ и Cl– необходимо
израсходовать 770 кДж энергии.
Но образующиеся ионы существуют в растворе не в
свободном виде, а вступают во взаимодействие с
молекулами растворителя – воды. Такое
взаимодействие носит название гидратации
ионов. При этом выделяется энергия, которая
компенсирует затраты на разрушение
кристаллической решетки. Для того же примера с NaCl
энергия гидратации иона Na+ составляет
398 кДж/моль, а иона Cl– – 377 кДж/моль.
В табл. 1 приведено еще несколько примеров.
Таблица 1
Теплоты гидратации некоторых ионов
(кДж/моль)
в зависимости от радиуса и заряда
| Kатион | Радиус, пм (1 пм = 10–12 м) |
Теплота гидра- тации |
Kатион | Радиус, пм | Теплота гидра- тации |
Kатион | Радиус, пм | Теплота гидра- тации |
|---|---|---|---|---|---|---|---|---|
| Li+ | 68 | 515 | Mg2+ | 74 | 1910 | Al3+ | 57 | 4640 |
| Na+ | 98 | 398 | Ca2+ | 104 | 1580 | Cr3+ | 62 | 4380 |
| K+ | 133 | 314 | Sr2+ | 120 | 1430 | Fe3+ | 67 | 4355 |
| Rb+ | 149 | 290 | Fe2+ | 80 | 2120 |
Кроме того, вода имеет большую
диэлектрическую проницаемость, что согласно
закону Кулона ослабляет притяжение растворенных
ионов друг к другу. Значение относительной
диэлектрической проницаемости для воды равно 78,
т.е. притяжение одинаковых зарядов, находящихся
на одном и том же расстоянии, в воде в 78 раз
слабее, чем в вакууме. Этот эффект дополнительно
облегчает отделение ионов друг от друга и распад
кристаллической решетки. Он также позволяет
ионам в растворе двигаться сравнительно
независимо друг от друга.
И наконец, при разрушении упорядоченной
кристаллической решетки энтропия системы,
очевидно, возрастает. Это также способствует
растворению ионных соединений.
Второй способ образования
электропроводящих растворов следующий. При
растворении многих веществ, которые сами по себе
не имеют ионного строения, происходит химическая
реакция с растворителем, в результате которой
опять-таки образуются ионы. Вот два примера:
HCl + H2O = H3O+ + Cl–,
NH3 + H2O
+ OH–.
Эти реакции представляют собой перенос протона
от одной молекулы к другой: от молекулы HCl к
молекуле воды в первом случае и от воды к NH3
во втором. Реакция с участием HCl необратима, а с NH3 –
обратима, причем ее равновесие довольно сильно
смещено влево.
Оба рассмотренных выше типа химических
реакций, вызывающих появление при растворении
подвижных ионов (распад на ионы и реакции с
водой), объединяются под названием электролитической
диссоциации1.
Из данного в начале главы определения понятия
«электролит» следует, что в принципе его
следовало бы применять к уже образовавшемуся
раствору, содержащему «свободные» (на самом деле
в водном растворе — гидратированные) ионы.
Однако по историческим причинам общепринята
другая терминология.
Электролитами принято называть вещества
(главным образом, кислоты, основания и соли),
которые при растворении в воде дают подвижные
ионы, т.е. растворы которых являются
электролитами в буквальном смысле слова. Поэтому
обсуждаемые в настоящей главе растворы принято
называть растворами электролитов, хотя по
существу правильнее было бы называть их
«растворы-электролиты».
Способность образовывать ионы является
свойством не вещества самого по себе, а пары
вещество–растворитель. Например, хлороводород,
являющийся одним из наиболее типичных и
привычных электролитов в воде, при растворении в
бензоле никаких ионов не образует.
Довольно часто продукты реакции с
растворителем могут вступать в дальнейшие
превращения, например:
H2SO4 + H2O = HSO4–
+ H3O+,
HSO4– + H2O H3O+ + SO42–.
В таких случаях говорят, что вещество (в данном
примере – серная кислота) диссоциирует
ступенчато. Обратите внимание, что первая
реакция, или, как принято говорить, диссоциация
по первой ступени, протекает необратимо, а во
второй – при диссоциации по второй
ступени – устанавливается равновесие. Это не
является общим правилом: при диссоциации молекул
угольной кислоты H2CO3 равновесие
устанавливается на обеих стадиях. Сама угольная
кислота, в свою очередь, образуется при
растворении CO2 в воде по обратимой реакции
(которая, естественно, не является диссоциацией):
CO2 + H2O H2CO3,
H2CO3 + H2O H3O+ + HCO3–,
HCO3– + H2O H3O+ + CO32–.
2. Сильные и слабые электролиты
Реакция образования ионов при взаимодействии
растворяемых веществ с водой, как и любая другая,
может протекать либо до исчезновения исходного
вещества, т.е. необратимо, либо до установления
химического равновесия. К приведенным выше
примерам можно добавить еще несколько:
NaOH = Na+ + OH–,
Fe(OH)3 Fe(OH)2+
+ OH– Fe(OH)2+
+ 2OH– Fe3+ + 3OH–,
CH3COOH + H2O CH3COO– + H3O+.
Ясно, что список можно продолжать. Как и ранее,
знак «=» использован для необратимой
диссоциации, а знак «» –
для обратимой.
Вещества, диссоциация которых протекает
необратимо, называют сильными электролитами.
К ним относятся в первую очередь вещества
ионного строения, при растворении которых
происходит освобождение ионов, а также вещества
молекулярного строения, реагирующие с водой до
конца. Основной особенностью сильных
электролитов является то, что в их растворах
полностью отсутствуют молекулы. Сильными
электролитами являются практически все соли
щелочных и щелочно-земельных металлов и их
гидроксиды, а также некоторые кислоты, число
которых невелико (в школьном курсе, во всяком
случае) и их следует запомнить: HCl, HBr, HI, HClO4, H2SO4,
HNO3, HMnO4, H2Cr2O7.
Вещества, при диссоциации которых
устанавливается химическое равновесие, называют
слабыми электролитами. В их растворах
содержатся как молекулы, так и ионы, являющиеся
продуктами их распада.
3. Константа диссоциации. Степень
диссоциации
Как и любое химическое равновесие, равновесие
диссоциации (если оно действительно
устанавливается) может быть описано
соответствующей константой диссоциации (см.
лекцию № 3). Например, для диссоциации уксусной
кислоты (см. выше) константа диссоциации имеет
вид:
Kд = .
Для равновесия осадок–насыщенный раствор
хлорида серебра
AgCl (кр.) Ag+
(р-р) + Cl– (р-р)
константа равновесия, называемая в этом случае
произведением растворимости, выражается так:
ПР(AgCl) = [Ag+][Cl–].
Обратите внимание, что в случае разбавленных
растворов (а только такие и рассматриваются в
расчетных задачах) концентрация растворителя
(как и других участников, реагирующих в виде
практически чистых веществ, например осадков) в
константу равновесия не входит, т.к. может
считаться постоянной величиной.
Ясно, что для сильных электролитов константы
диссоциации не существует, поскольку
концентрация недиссоциированных молекул равна
нулю.
Константы диссоциации для слабых или
малорастворимых электролитов имеются в
справочниках. Несколько значений мы приводим в
табл. 2 и 3 (цифры I, II и III означают 1-ю, 2-ю и 3-ю
ступени диссоциации).
Таблица 2
Константы диссоциации некоторых слабых
электролитов
| Kласс веществ | Формула | Kд |
|---|---|---|
| Kислоты | HF | 6,6•10–4 |
| H2S | (I) 6•10–8 (II) 1•10–14 |
|
| H3PO4 | (I) 1,6•10–3 (II) 6,3•10–7 (III) 1,3•10–12 |
|
| H2CO3 | (I) 4,5•10–7 (II) 4,7•10–11 |
|
| НСООН (муравьиная) | 1,8•10–4 | |
| СН3СООН (уксусная) | 1,8•10–5 | |
| (HOOCCH2)2C(OH)COOH (лимонная) |
(I) 7,5•10–4 (II) 1,7•10–5 (III) 4,0•10–7 |
|
| C6H5OH (фенол) | 1,0•10–10 | |
| (COOH)2 (щавелевая) | (I) 5,4•10–2 (II) 5,4•10–5 |
|
| H2SiO3 | (I) 2,2•10–10 (II) 1,6•10–12 |
|
| HAlO2 | 5•10–13 | |
| Основания | Mg(OH)2 | (II) 2,5•10–3 |
| Al(OH)3 | (III) 1,4•10–9 | |
| NH3 (NH4OH) | 1,8•10–5 | |
| CH3NH2 (метиламин) | 4,2•10–4 | |
| C6H5NH2 (анилин) |
3,8•10–10 | |
| Cr(OH)3 | (III) 1,0•10–9 | |
| Fe(OH)2 | (II) 1,3•10–4 | |
| Fe(OH)3 | (II) 1,8•10–11 (III) 1,4•10–12 |
|
| Cu(OH)2 | (II) 3,4•10–7 | |
| Zn(OH)2 | (II) 4•10–5 |
Знание константы диссоциации
позволяет вычислить концентрации ионов в
растворе слабого электролита известной
концентрации. Рассмотрим способ решения таких
задач.
Пусть концентрация раствора слабого
электролита AB равна cAB моль/л, а его
константа диссоциации — KAB.
Решение любой задачи, связанной с нахождением
концентраций частиц в системе, в которой
протекают обратимые химические реакции, следует
начинать с записи уравнения протекающей реакции
и выражения соответствующей константы
равновесия. В данном случае реакция диссоциации
имеет вид:
AB A+ + B–,
а ее константа — . (1)
Подчеркнем, что символы в квадратных скобках
обозначают равновесную (т.е. устанавливающуюся
после достижения системой равновесного
состояния) концентрацию соответствующих молекул
или ионов в моль/л. Не следует путать стоящую в
знаменателе равновесную концентрацию молекул [AB]
с общей концентрацией электролита cAB.
Последняя складывается из оставшейся в
молекулярном виде, а также диссоциировавшей
части вещества AB.
Константу диссоциации можно выразить через
общую концентрацию электролита cAB и степень
диссоциации ,
под которой будем понимать долю молекул, которая
распалась на ионы, от полного количества
вещества электролита. Например, если в реакцию
диссоциации вступила каждая вторая молекула,
степень диссоциации составляет 0,5, или 50%, если
одна из ста — 0,01 (1%), и т.д. Поскольку при
диссоциации каждой молекулы AB образуется по
одному иону каждого типа, их концентрации равны
[A] = [B] = •cAB,
а равновесная концентрация молекул равна
общей концентрации электролита за вычетом
концентрации продиссоциировавшей его части:
[AB] = cAB – •cAB = (1 –
)cAB.
Подставив эти соотношения в уравнение (1),
получим:
.
(2)
Поскольку cAB задана, а константа
диссоциации является характеристикой
электролита и может быть найдена в
соответствующих таблицах, из уравнения (2) можно
найти степень диссоциации. После приведения к
общему знаменателю получается квадратное
уравнение, которое можно решить обычным
способом. Рассчитав степень диссоциации, можно
вычислить концентрации всех частиц,
присутствующих в растворе.
В тех случаях, когда константа диссоциации
мала, а раствор не является очень разбавленным,
степень диссоциации также мала. Тогда выражение
(2) можно упростить, приняв (1– )
1:
Последнее выражение называется законом
разбавления2 Оствальда
(1888). Как правило, точность формулы (3) достаточна
для практических целей. Например, для 0,1М
раствора CH3COOH, имеющей Kд = 1,8•10–5,
приближенная формула (3) дает = 0,0134, в то время как полное
решение уравнения (2) дает = 0,0133.
В тех случаях, когда диссоциация идет по
ступеням, расчет концентраций присутствующих в
растворе частиц производится в принципе так же,
но технически усложняется.
С понятием степени диссоциации связано
альтернативное определение понятий сильных и
слабых электролитов. Оно было введено во времена
Аррениуса, но довольно часто встречается в
литературе (в частности, во многих школьных
учебниках) и до сих пор. Сильными называют
электролиты, степень диссоциации которых
превышает 0,3 (30%), слабыми – электролиты с = 0,03 (3%) и менее.
При этом для веществ, степень диссоциации
которых попадает в интервал от 0,03 до 0,3, вводится
новое понятие — «электролиты средней силы».
4. Равновесия растворов
электролитов с осадками. Произведение
растворимости
Рассмотрим реакцию растворения
малорастворимого вещества, являющегося в
растворе сильным электролитом (для конкретности
возьмем сульфат бария BaSO4). В его насыщенном
растворе устанавливается равновесие (не внутри
раствора, в котором молекул сульфата нет, ведь
это сильный электролит, а между осадком и
раствором):
BaSO4 (кр.)
Ba2+ (р-р) + SO42– (р-р).
Константа такого равновесия, называемая, как
уже говорилось выше, произведением
растворимости, имеет вид:
ПР = [Ba2+][SO42–].
(4)
Разумеется, в ее записи отсутствует
концентрация BaSO4, вступающего в реакцию в
виде индивидуального вещества, и константа
равновесия равна просто произведению
концентраций ионов в степенях, равных их
стехиометрическим коэффициентам.
Константа равновесия реакции растворения
малорастворимого сильного электролита, т. е.
произведение концентраций образующих его ионов
в степенях их стехиометрических коэффициентов в
насыщенном растворе, получила название произведения
растворимости и обозначается ПР.
Таблица 3
Произведения растворимости некоторых
малорастворимых электролитов при комнатной
температуре (18–25 °C)
| Вещество | ПР | Вещество | ПР |
|---|---|---|---|
| AgBr | 6•10–13 | Cu(OH)2 | 2,2•10–20 |
| AgCl | 1,8•10–10 | CuS | 6,3•10–36 |
| AgI | 8,3•10–17 | Fe(OH)2 | 8•10–16 |
| Al(OH)3 | 10–32 | Fe(OH)3 | 6,3•10–38 |
| BaSO4 | 1,1•10–10 | HgS | 1,6•10–52 |
| CaCO3 | 3,8•10–9 | KClO4 | 1,1•10–2 |
| Ca(OH)2 | 5,5•10–6 | Mg(OH)2 | 7,1•10–12 |
| CaSO4 | 2,5•10–5 | PbCl2 | 2•10–5 |
| Cr(OH)3 | 6,3•10–21 |
Условие малой растворимости
необходимо потому, что только в этом случае
запись константы равновесия имеет достаточно
простой вид. Если электролит не является сильным,
то помимо реакции растворения необходимо
учитывать и процессы образования в растворе
недиссоциированных молекул, что усложняет
описание. Впрочем, если вещество
малорастворимое, концентрация его насыщенного
раствора низка, а степень диссоциации согласно
закону разбавления Оствальда велика. Поэтому
присутствием недиссоциированных молекул в таких
растворах почти всегда можно пренебречь3.
Как и любая константа равновесия, произведение
растворимости не зависит от концентрации
веществ, присутствующих в растворе. Численные
значения произведения растворимости некоторых
малорастворимых электролитов приведены в табл. 3.
Ясно, что чем меньше численное значение ПР, тем
меньше растворимость. Однако непосредственно
судить о растворимости по величине ПР можно
только при аналогичных формулах веществ.
Например, сравнивая растворимость сульфатов
кальция и бария (по величине ПР), можно сразу
сказать, что первый растворим лучше второго.
Действительно, в насыщенных растворах этих
сульфатов:
В то же время, несмотря на практически
одинаковые ПР, растворимость CaSO4 (его
концентрация в насыщенном растворе – ) намного меньше, чем
С помощью понятия произведения растворимости
можно сформулировать условия образования или
растворения осадков малорастворимых
электролитов.
1. Если произведение концентраций
присутствующих в растворе ионов в степенях их
стехиометрических коэффициентов превышает ПР
малорастворимого вещества, при достижении
равновесия из раствора должен выпасть осадок
этого вещества.
2. Если произведение концентраций находящихся в
растворе ионов в степенях их стехиометрических
коэффициентов меньше, чем ПР малорастворимого
вещества, присутствующего в виде осадка, этот
осадок должен растворяться.
Рассмотрим примеры.
1. При смешении 0,002М растворов AgNO3 и KCl
концентрации ионов Ag+ и Cl– в
полученном растворе равны4 0,001
моль/л, а их произведение с(Ag+)•с(Cl–) =
0,001•0,001 = 1•10–6, что значительно
превышает ПР(AgCl) = 1,8•10–10. Поэтому после
смешения растворов будет выпадать осадок
хлорида серебра.
2. При смешении растворов той же концентрации,
что в предыдущем примере, но хлорида кальция и
сульфата натрия, получим:
с(Ca2+)•с(SO42–) =
0,001•0,001 = 1•10–6,
что меньше, чем ПР(CaSO4) = 2,58•10–5,
так что осадок не выпадет.
5. Кислоты и основания. Понятие
протолиза
Согласно обычному определению, предложенному в
1887 г. С.Аррениусом, кислотами называют
соединения, образующие при диссоциации ионы H+
(т.е. H3O+), а основаниями —
гидроксид-ионы OH–. Однако настоящие ионы
водорода, т.е. свободные протоны, в водных
растворах существовать не могут: константа
равновесия реакции присоединения протона к
молекуле воды
H+ + H2O = H3O+
(5)
равна примерно 10200. (В лекции № 3 мы приводили
число частиц в нашей Вселенной. Сравните с данным
числом.) Это значит, что протоны в водной среде
полностью связаны молекулами воды (или другими
частицами, если их сродство к протону еще больше).
Именно поэтому мы не стали писать в уравнении
реакции (5) знака обратимости реакции, хотя
формально говорим о равновесии. Таким образом,
реакция диссоциации кислот, а также реакция
нейтрализации, являющаяся важнейшей реакцией
кислот и оснований, представляют собой перенос
протона от одной частицы к другой.
В 1923 г. Й.Н.Брёнстед дал определение понятий
кислоты и основания, основанное на переносе
протона. Согласно определению, или, как иногда
говорят, теории, Бренстеда, кислотой называется
частица (молекула или ион), отдающая протон, а
основанием — частица, принимающая протон;
частица, способная как отдавать, так и
присоединять протон, называется амфолитом.
Обратите внимание, что в определениях
Аррениуса речь идет о веществах, а у Бренстеда о
частицах — ионах или молекулах в растворе.
Примеры кислот по Бренстеду: H3O+, NH4+,
HCl; оснований: OH–, CO32–,
NH3, FeOH2+; амфолитов: H2O, HCO3–.
Все реакции переноса протона носят общее
название протолиза. Реакция переноса протона
между двумя одинаковыми частицами (например,
между молекулами воды) называется автопротолизом
(см. ниже).
Электролиты, не являющиеся кислотами или
основаниями, называются солями. Это по Аррениусу.
А у Бренстеда соли отсутствуют.
6. Диссоциация воды. Понятие pH
Поскольку вода принадлежит к наиболее типичным
амфолитам, она вступает в реакцию автопротолиза:
H2O + H2O H3O+ + OH–.
Эта реакция протекает и в чистой воде, и в любых
водных растворах. Ее константа равновесия равна:
Kв = [H3O+][OH–]
(6)
(как всегда, концентрация воды, реагирующей в
виде чистого вещества, в запись константы
равновесия не входит). Эта константа обычно
называется ионным произведением воды.
Численное значение Kв зависит от
температуры (растет с ее повышением), но в
большинстве практических расчетов ее принимают
равной 1•10–14.
Ионное произведение воды не зависит от состава
раствора (пока этот раствор можно считать
разбавленным). Поэтому концентрации ионов H3O+
и OH– в водных растворах не произвольны, а
связаны уравнением (6), так что, зная одну из них,
можно найти другую.
Очевидно, что концентрация ионов H3O+
(на практике их часто обозначают просто H+ –
не забывая, конечно, о гидратации; мы тоже будем
так делать) может служить мерой кислотности
раствора.
В 1909 г. С.Сёренсен предложил для выражения
кислотности растворов указывать величину
отрицательного десятичного логарифма
концентрации ионов водорода, которая получила
обозначение5 pH:
pH = –lg [H+].
В чистой воде концентрации ионов H+ и OH–
одинаковы, поэтому [H+] = [OH–] = = 10–7, а
значение pH равно 7. При добавлении кислоты
концентрация ионов H+ увеличивается, а pH
соответственно уменьшается. И наоборот, при
добавлении сильного основания, увеличивающего
концентрацию ионов OH–, концентрация ионов
H+ в соответствии с соотношением (6)
уменьшается, а pH возрастает.
В табл. 4 приведены примеры растворов с
различными рН.
Таблица 4
Примеры рН растворов некоторых
веществ
| Вещество | pН < 7 | Вещество | pН |
|---|---|---|---|
| Промышленная концентрированная HCl (37%) |
–1,1 | Слезы | 7,0 |
| 1M раствор HCl | 0,0 | Kровь | 7,4 |
| Желудочный сок | 1,0–1,5 | Водопроводная вода | 7,5 |
| Лимонный сок | 2,1 | Морская вода | 8,0 |
| Томатный сок | 4,1 | Раствор пищевой соды NaHCO3 | 8,5 |
| Черный кофе | 5,0 | Известковая вода | 10,5 |
| Моча | 6,0 | Аммиак из аптечки | 11,9 |
| Человеческий пот | 4–6 | 1M раствор NaOH | 14 |
| Дождевая вода | 6,5 | Насыщенный раствор NaOH | ~15 |
| Слюна | 6,9 | ||
| Молоко | 6,9 |
7. Реакции ионного обмена
Реакции ионного обмена, т.е. реакции,
происходящие между веществами-электролитами,
как и все другие химические реакции, могут быть
обратимыми и необратимыми.
Очевидно, необратимыми являются реакции,
приводящие к образованию веществ, покидающих
раствор: газа, осадка или слабого электролита.
В этом определении имеются ключевые слова
«покидающих раствор». В лекции № 2 мы рассмотрели
примеры, когда абсолютизируются определения,
которые на самом деле являются субъективными.
Речь шла о реакциях соляной кислоты с цинком и
ионов серебра с ионами хлора. Аналогичный случай
имеет место с образованием слабого электролита.
Например, реакция ацетата натрия с соляной
кислотой (сокращенное ионное уравнение):
CH3COO– + H+ = CH3COOH.
(7)
Все знают, что соляная кислота намного сильнее
уксусной и вытесняет ее из растворов ее солей. Но
для уксусной кислоты существует константа
диссоциации, не равная нулю. Следовательно, и эту
реакцию можно рассматривать как обратимую.
Получается, что в растворах электролитов
истинно необратимых реакций нет. Есть практически
необратимые. И в зависимости от конкретных
решаемых задач мы называем реакцию обратимой или
необратимой.
8. Гидролиз солей
При растворении в воде солей слабых кислот или
слабых оснований появляется возможность
кислотно-основного взаимодействия с водой.
Например, при растворении ацетата натрия ион CH3COO–
может вступать во взаимодействие с водой как
основание-акцептор протона:
CH3COO– + H2O CH3COOH + OH–. (8)
Сравните эту реакцию с реакцией (7). В отличие от
реакции (7), которую на практике считают
необратимой, в реакции (8) имеются слабые
электролиты и слева, и справа.
Аналогично ион NH4+,
который представляет собой кислоту (по
Бренстеду), может вступать во взаимодействие с
водой:
NH4+ + H2O NH3 + H3O+.
(9)
Процессы кислотно-основного взаимодействия,
происходящие при растворении в воде солей слабых
кислот или (и) слабых оснований, носят название
гидролиза солей.
Как и всякое химическое равновесие, гидролиз
описывается соответствующей константой. Однако
эта константа не является независимой величиной
(и потому отсутствует в справочниках). Она может
быть рассчитана, если известна константа
диссоциации кислоты или основания и ионное
произведение воды. Не приводя общего вывода,
покажем способ такого расчета на примере
гидролиза ацетат-иона.
Константа равновесия реакции гидролиза (8)
равна:
.
Это выражение можно преобразовать, умножив
числитель и знаменатель на [H+]:
Таким образом, константа гидролиза равна
отношению ионного произведения воды к константе
диссоциации электролита, получающегося в
результате гидролиза. В данном примере
Kг = 10–14/(2•10–5) =
5•10–10,
т.е. равновесие гидролиза ацетат-иона сильно
сдвинуто влево. Тем не менее растворы ацетатов
щелочных металлов имеют заметно щелочную среду.
Вода является одним из самых слабых
электролитов. Поэтому константа гидролиза в
соответствии с уравнением (10) невелика.
Соответственно степень гидролиза, как правило,
мала (табл. 5).
Таблица 5
Степень гидролиза некоторых солей в 0,1М
растворе при 25 °С
| Соль | Степень гидролиза, % |
|---|---|
| CH3COONa | 0,008 |
| NH4Cl | 0,01 |
| KCN | 1,2 |
| Na2CO3 (1-я ступень) | 2,9 |
Вопросы и задания
1. Вычислите теплоту растворения хлорида
натрия в воде (необходимые данные – в тексте
лекции).
Ответ. При диссоциации 1 моль NaCl на
газообразные ионы затрачивается 770 кДж энергии.
При гидратации ионов Na+ и Cl–
выделяется 398 + 377 = 775 кДж/моль. Теплота
растворения, таким образом, составляет 775 – 770 = 5
кДж/моль.
2. Укажите катион с наибольшей энергией
гидратации (см. табл. 1). Почему именно этот катион
обладает наибольшей энергией гидратации?
Ответ. Это ион Al3+ – наименьший ион
среди самых высокозарядных ионов. Электрическое
поле иона тем интенсивнее, чем выше его заряд и
меньше радиус.
3. Классифицируйте следующие вещества (в
водных растворах) на сильные и слабые
электролиты: NaCl, CuCl2, BaSO4, Ba(OH)2,
Fe(OH)2, H3PO4.
Ответ. Сильные электролиты – NaCl, BaSO4,
Ba(OH)2. Иногда говорят, что сульфат бария —
слабый электролит. Но речь идет о состоянии в
растворе. В его растворе молекул BaSO4 нет,
т.е. его диссоциация необратима.
Слабые электролиты – CuCl2, Fe(OH)2, H3PO4.
В школьном курсе принято считать, что все соли –
сильные электролиты. На самом деле это не так.
Сильные электролиты – это только соли и
гидроксиды щелочных и щелочно-земельных (если не
относить к таковым бериллий и магний) металлов.
4. В табл. 2 выберите кислоты, в 0,001М растворах
которых концентрация ионов водорода наибольшая
и наименьшая.
Ответ. Наибольшая концентрация ионов
водорода в растворе щавелевой кислоты, имеющей
наибольшую первую константу диссоциации, и
наименьшая в растворе метаалюминиевой кислоты.
5. Какой раствор называется насыщенным?
Ответ. Насыщенным называется раствор,
находящийся в равновесии с растворенным
веществом. Поэтому насыщенным может быть только
такой раствор, который соприкасается с
растворенным веществом. Неправильно говорить,
что насыщенный раствор содержит максимально
возможное количество вещества при данных
условиях. Пересыщенный раствор содержит больше.
6. Чему равна молярная концентрация
насыщенных растворов: а) BaSO4; б) Fe(OH)2?
Ответ. а) В растворе имеем:
BaSO4 Ba2+
+ SO42–,
и молярная концентрация соли равна
концентрации любого из ионов, т.к. их
концентрации одинаковы:
б) В растворе имеем:
Fe(OH)2 Fe2+
+ 2OH–,
и молярная концентрация гидроксида равна
концентрации ионов железа [Fe2+]. Обозначим
ее через х, тогда [OH–] = 2x.
ПР(Fe(OH)2) = [Fe2+]•[OH–]2
= x•(2x)2 = 4x3 = 8•10–16.
Отсюда
7. Классифицируйте следующие частицы по
Бренстеду на кислоты, основания и амфолиты: H2SO4,
SO42–, HSO4–
, NH3, NH4+.
Ответ. Кислоты – H2SO4, NH4+;
основания – SO42–, NH3;
амфолит – HSO4–.
8. Вычислите концентрацию ионов водорода в
черном кофе. Какой концентрации соляной кислоты
(моль/л) это соответствует?
Ответ.
рН = 5, [H+] = 10–5, [HCl] = 10–5
моль/л.
9. Напишите уравнение реакции гидролиза
карбоната натрия по первой ступени и вычислите
ее константу.
Ответ. Растворение в воде соды (сильный
электролит) – необратимый процесс:
Na2CO3 = 2Na+ + CO32–.
А вот гидролиз соды по карбонат-иону –
обратимая реакция, в которой имеются слабые
электролиты как среди реагентов, так и среди
продуктов реакции:
CO32– + H2O HCO3–
+ OH–.
Константа равновесия этой реакции – константа
гидролиза:
Как видите, даже в случае очень слабой угольной
кислоты константа гидролиза невелика,
равновесие сильно смещено влево. Это общее
правило: равновесие смещено в сторону более
слабого электролита.
1 Название «диссоциация»,
означающее буквально «распад», «разложение»,
связано с тем, что раньше все вещества считали
состоящими из молекул, а появление ионов
трактовали как результат распада молекул при
растворении (С. Аррениус, 1887 г.).
2 Название закона связано с тем,
что в то время для выражения состава растворов
чаще пользовались не концентрацией (числом молей
растворенного вещества в 1 л раствора), а
«разбавлением» — объемом раствора,
содержащим 1 моль растворенного вещества.
3 Например, в насыщенном растворе
AgCl в виде молекул находится около 1%
растворенного вещества.
4 При смешении исходные
концентрации уменьшились в 2 раза.
5 Читается «пэ-аш». Происходит от
первых букв латинского выражения Pundus Hydrogenium –
вес водорода.