Загрузить PDF
Загрузить PDF
Протоны, нейтроны и электроны – основные частицы, из которых состоит атом. Протоны заряжены положительно, электроны – отрицательно, а нейтроны и вовсе не имеют заряда.[1]
Масса электронов очень мала, а масса протонов и нейтронов практически одинакова.[2]
На самом деле, найти в атоме количество протонов, нейтронов и электронов довольно просто, нужно только научиться ориентироваться по периодической таблице химических элементов Д.И.Менделеева.
-
1
Возьмите периодическую таблицу элементов. Это система, в которой элементы организованы в зависимости от их атомной структуры. Цветное одно- или двухбуквенное сокращение – это название элемента в сокращенном виде. В таблице также представлена информация об атомном номере элемента и атомной массе.[3]
- Таблицу Менделеева можно найти в учебнике по химии или в Интернете.
- Во время контрольных работ периодическую таблицу обычно предоставляют.
-
2
Найдите в таблице нужный вам элемент. Каждый элемент в таблице располагается под своим номером. Все элементы можно разделить на металлы, неметаллы и метоллоиды (полуметаллы). В этих группах элементы классифицируются еще на несколько групп: щелочные металлы, галогены, инертные газы.[4]
- Группы (столбцы) и периоды (строки) нужны для систематизации, по ним легко найти нужный вам элемент.
- Если вы ничего не знаете о нужном вам элементе, просто найдите его в таблице.
-
3
Найдите атомный номер элемента. Атомный номер обозначает число протонов в ядре атома.[5]
Атомный номер располагается над символом элемента, обычно в левом верхнем углу клетки. Он покажет вам, сколько протонов содержится в одном атоме элемента.- Например, Бор (В) обозначен в таблице под номером 5, поэтому у него 5 протонов.
-
4
Определите количество электронов. Протоны — это положительно заряженные частицы в ядре атома. Электроны представляют собой частицы, которые несут отрицательный заряд. Поэтому когда элемент находится в нейтральном состоянии, то есть его заряд будет равен нулю, число протонов и электронов будет равным.
- Например, Бор (В) обозначен в таблице под номером 5, поэтому можно смело утверждать, что у него 5 электронов и 5 протонов.
- Однако если элемент содержит отрицательный или положительный ион, то протоны и электроны не будут одинаковыми. Вам придется вычислить их. Число ионов выглядит как маленький, верхний индекс после элемента.
-
5
Найдите атомную массу элемента. Чтобы найти число нейтронов, вам сначала нужно вычислить атомную массу элемента. Атомная масса – это средняя масса атомов данного элемента, ее нужно рассчитывать. Имейте в виду, что у изотопов атомная масса отличается.[6]
. Атомная масса указана под символом элемента.- Округляйте атомную массу до ближайшего целого числа. Например, атомная масса бора = 10,811, соответственно, ее можно округлить до 11.
-
6
Вычтите из атомной массы атомный номер. Чтобы определить количество нейтронов, нужно вычесть атомный номер из атомной массы. Помните, что атомный номер — это число протонов, которое вы уже определили.[7]
- Возьмем наш пример с бором: 11 (атомная масса) – 5 (атомный номер) = 6 нейтронов.
Реклама
-
1
Определите число ионов. Ион — это атом, состоящий из положительно заряженного ядра, в котором находятся протоны и нейтроны, и отрицательно заряженных электронов. Атом несет нейтральный заряд, но заряд может быть положительным и отрицательным из-за электронов, которые атом может отдавать и принимать.[8]
Поэтому число протонов в атоме не меняется, а число электронов в ионе может меняться.- Электрон несет отрицательный заряд, поэтому если атом отдает электроны, то сам становится заряженным положительно. Когда атом принимает электроны, он становится отрицательно заряженным ионом.
- Например, у N3- заряд -3, а у Ca2+ заряд +2.
- Помните, если число ионов не указано в таблице, вам не нужно делать подобные вычисления.
-
2
Вычтите заряд из атомного номера. Если ион положительно заряжен, нужно вычесть из атомного номера заряд. Если у иона положительный заряд, значит, он отдал электроны. Чтобы подсчитать оставшееся число электронов, нужно вычесть заряд от атомного номера. Если ион заряжен положительно, значит, в нем больше протонов, чем электронов.
- Например, у Ca2+ заряд +2, поэтому можно сказать, что он отдал два электрона. Атомный номер кальция = 20, поэтому у его иона 18 электронов (20-2=18).
-
3
Если ион заряжен отрицательно, чтобы узнать число электронов, нужно добавить заряд к атомному номеру. Потому что ион стал отрицательным из-за того, что принял лишние электроны. Так что нужно просто прибавить заряд к атомному номеру, тогда вы получите число электронов. Разумеется, если ион заряжен отрицательно, то электронов в нем больше, чем протонов.
- Например, у N3- заряд -3, значит, азот получил три дополнительных электрона. Атомный номер азота 7, поэтому число электронов у азота = 10. (то есть 7+3=10).
Реклама
Об этой статье
Эту страницу просматривали 955 472 раза.
Была ли эта статья полезной?
Download Article
Download Article
Finding the number of protons, neutrons, and electrons in a given element isn’t as hard as it sounds. Oftentimes part of your answer will be right in front of you in the periodic table! Once you know where to look, finding the number of protons, neutrons, and electrons will be a breeze.
-
1
Get a periodic table of elements. The periodic table is a chart that organizes elements by their atomic structure. It is color-coded and assigns each element a unique 1 or 2-letter abbreviation. Other elemental information includes atomic weight and atomic number.[1]
- You can find a periodic table online or in a chemistry book.
- In tests, normally, a periodic table will be provided.
-
2
Find your element on the periodic table. The table orders elements by atomic number and separates them into three main groups: metals, non-metals, and metalloids (semi-metals). Further elemental groupings include alkali metals, halogens, and noble gases.[2]
- Using the group (columns) or period (rows) can make the element easier to locate on the table.
- You can also search the table for the symbol of the element if you don’t know any other properties.
Advertisement
-
3
Locate the element’s atomic number. The atomic number is located above the element symbol, in the upper left-hand corner of the square. The atomic number will tell you how many protons make up a single atom of an element.[3]
- For example, boron (B) has an atomic number of 5, therefore it has 5 protons.
-
4
Determine the number of electrons. Protons are particles in the nucleus of an atom that have a positive charge equal to +1. Electrons are particles that have a negative charge equal to -1. Therefore, an element in a neutral state will have the same number of protons and electrons.[4]
- For example, boron (B) has an atomic number of 5, therefore it has 5 protons and 5 electrons.
- However, if the element includes a negative or positive ion, then the protons and electrons will not be the same. You will have to calculate them. The ion number will appear as a small superscript after the element.
-
5
Look for the atomic mass of the element. To find the number of neutrons, you will first need to find the atomic mass. An element’s atomic mass (also known as the atomic weight) is the weighted average mass of atoms of an element.[5]
The atomic mass can be found underneath the symbol for the element.- Make sure that you round the atomic mass to the nearest whole number. For example, the atomic mass of boron is 10.811, but you can just round the atomic mass up to 11.
-
6
Subtract the atomic number from the atomic mass. To find the number of neutrons, you will need to subtract the atomic number from the atomic mass. Remember that the atomic number is the same as the number of protons, which you have already identified.[6]
- For our boron example, 11 (atomic mass) – 5 (atomic number) = 6 neutrons
Advertisement
-
1
Identify the net charge. The net charge of an ion will appear as a small superscript number following the element. An ion is an atom that has a positive or negative charge due to the addition or removal of electrons.[7]
Although the number of protons in the atom remains the same, the number of electrons is altered in an ion.- Because an electron has a negative charge, when you remove electrons, the ion becomes positive. When you add more electrons, the ion becomes negative.
- For example, N3- has a -3 charge while Ca2+ has a +2 charge.
- Keep in mind that you do not have to do this calculation if there is no superscripted ion number following the element.
-
2
Subtract the charge from the atomic number. When an ion has a positive charge, the atom has lost electrons. To calculate the remaining number of electrons, you subtract the amount of extra charge from the atomic number. In the case of a positive ion, there are more protons than electrons.[8]
- For example, Ca2+ has a +2 charge so it has lost 2 electrons from the neutral state. Calcium’s atomic number is 20, therefore the ion has 18 electrons.
-
3
Add the charge to the atomic number for negative ions. When an ion has a negative charge, the atom has gained electrons. To calculate the total number of present electrons, you simply add the amount of extra charge to the atomic number. In the case of a negative ion, there are fewer protons than electrons.[9]
- For example, N3- has a -3 charge; therefore, it has gained 3 electrons compared to the neutral state. Nitrogen’s atomic number is 7, therefore this ion has 10 electrons.
Advertisement
Add New Question
-
Question
How do I find the number of protons when an atom has a -ve or +ve charge?
Meredith Juncker is a PhD candidate in Biochemistry and Molecular Biology at Louisiana State University Health Sciences Center. Her studies are focused on proteins and neurodegenerative diseases.
Scientific Researcher
Expert Answer
The number of protons will never change. Atoms with negative or positive charges just indicate a gain or loss of electrons.
-
Question
How can I find the electron and proton numbers of actinium?
Meredith Juncker is a PhD candidate in Biochemistry and Molecular Biology at Louisiana State University Health Sciences Center. Her studies are focused on proteins and neurodegenerative diseases.
Scientific Researcher
Expert Answer
You will find actinium in group 3, period 7 of the periodic table. The atomic number of actinium is 89, which means there are 89 protons. Because there is no net charge, we know that # protons = # electrons, so there are 89 electrons as well.
-
Question
How do I find the number of protons are in a nucleus when given the atomic mass?
All the protons are present in the nucleus, or centre of an atom. You need the atomic number to find the amount of protons and/or electrons, unless you have the amount of neutrons and the atomic mass, in which case you can simply subtract the amount of neutrons from the atomic mass, leaving the amount of protons in the atom. The atomic number (number at the top) is the amount of protons and the amount of electrons. So if an element has an atomic number of 5, you know that it has 5 protons and 5 electrons. The atomic mass (number at the bottom) is the amount of protons and neutrons added together. Whichever you know, you subtract from the atomic mass.
See more answers
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
Video
About This Article
Article SummaryX
The easiest way to find the number of protons, neutrons, and electrons for
an element is to look at the element’s atomic number on the periodic table.
That number is equal to the number of protons. The number of protons is
equal to the number of electrons, unless there’s an ion superscript listed
after the element. To find the number of neutrons, subtract the element’s
atomic number from its atomic mass (the number listed underneath the
element).
Did this summary help you?
Thanks to all authors for creating a page that has been read 2,842,644 times.
Did this article help you?
Число протонов нейтронов электронов в атоме элемента (Таблица)
Число протонов нейтронов и электронов в атоме химического элемента (изотопа) можно определить, зная порядковый номер элемента в периодической таблице Менделеева и его атомную массу:
— Число протонов = число электронов = порядковый номер элемента
— Число нейтронов = атомная масса – число протонов
Вычислим число нейтронов в атоме на примере кислорода 16O:
16 — 8 = 8 (в кислороде 8 нейтронов)

Таблица число протонов нейтронов электронов в атоме химического элемента
Справочная таблица содержит список элементов (изотопов) и их число протонов, нейтронов и электронов, а также атомную массу изотопа.
| Элемент, изотоп | Число протонов (= электронов) | Число нейтронов | Атомная масса изотопа |
| 1H | 1 | 0 | 1,0078 |
| 2H | 1 | 1 | 2,0141 |
| 3He | 2 | 1 | 3,0160 |
| 4He | 2 | 2 | 4,0026 |
| 6Li | 3 | 3 | 6,0151 |
| 7Li | 3 | 4 | 7,0160 |
| 9Be | 4 | 5 | 9,0122 |
| 10B | 5 | 5 | 10,0129 |
| 11B | 5 | 6 | 11,0093 |
| 12C | 6 | 6 | 12,0000 |
| 13C | 6 | 7 | 13,0034 |
| 14N | 7 | 7 | 14,0031 |
| 15N | 7 | 8 | 15,0001 |
| 16O | 8 | 8 | 15,9949 |
| 17O | 8 | 9 | 16,9991 |
| 18O | 8 | 10 | 17,9992 |
| 19F | 9 | 10 | 18,9984 |
| 20Ne | 10 | 10 | 19,9924 |
| 21Ne | 10 | 11 | 20,9938 |
| 22Ne | 10 | 12 | 21,9914 |
| 23Na | 11 | 12 | 22,9898 |
| 24Mg | 12 | 12 | 23,9850 |
| 25Mg | 12 | 13 | 24,9858 |
| 26Mg | 12 | 14 | 25,9826 |
| 27Al | 13 | 14 | 26,9815 |
| 28Si | 14 | 14 | 27,9769 |
| 29Si | 14 | 15 | 28,9765 |
| 30Si | 14 | 16 | 29,9738 |
| 31P | 15 | 16 | 30,9738 |
| 32S | 16 | 16 | 31,9721 |
| 33S | 16 | 17 | 32,9715 |
| 34S | 16 | 18 | 33,9679 |
| 36S | 16 | 20 | 35,9671 |
| 35Cl | 17 | 18 | 34,9689 |
| 37Cl | 17 | 20 | 36,9659 |
| 36Ar | 18 | 18 | 35,9675 |
| 38Ar | 18 | 20 | 37,9627 |
| 40Ar | 18 | 22 | 39,9624 |
| 39K | 19 | 20 | 38,9637 |
| 40K* | 19 | 21 | 39,9640 |
| 41K | 19 | 22 | 40,9618 |
| 40Ca | 20 | 20 | 39,9626 |
| 42Ca | 20 | 22 | 41,9586 |
| 43Ca | 20 | 23 | 42,9588 |
| 44Ca | 20 | 24 | 43,9555 |
| 46Ca | 20 | 26 | 45,9537 |
| 48Ca* | 20 | 28 | 47,9525 |
| 45Sc | 21 | 24 | 44,9559 |
| 46Ti | 22 | 24 | 45,9526 |
| 47Ti | 22 | 25 | 46,9518 |
| 48Ti | 22 | 26 | 47,9479 |
| 49Ti | 22 | 27 | 48,9479 |
| 50Ti | 22 | 28 | 49,9448 |
| 50V* | 23 | 27 | 49,9472 |
| 51V | 23 | 28 | 50,9440 |
| 50Cr | 24 | 26 | 49,9460 |
| 52Cr | 24 | 28 | 51,9405 |
| 53Cr | 24 | 29 | 52,9406 |
| 54Cr | 24 | 30 | 53,9389 |
| 55Mn | 25 | 30 | 54,9380 |
| 54Fe | 26 | 28 | 53,9396 |
| 56Fe | 26 | 30 | 55,9349 |
| 57Fe | 26 | 31 | 56,9354 |
| 58Fe | 26 | 32 | 57,9333 |
| 59Co | 27 | 32 | 58,9332 |
| 58Ni | 28 | 30 | 57,9353 |
| 60Ni | 28 | 32 | 59,9308 |
| 61Ni | 28 | 33 | 60,9311 |
| 62Ni | 28 | 34 | 61,9283 |
| 64Ni | 28 | 36 | 63,9280 |
| 63Cu | 29 | 34 | 62,9296 |
| 65Cu | 29 | 36 | 64,9278 |
| 64Zn | 30 | 34 | 63,9291 |
| 66Zn | 30 | 36 | 65,9260 |
| 67Zn | 30 | 37 | 66,9271 |
| 68Zn | 30 | 38 | 67,9248 |
| 70Zn | 30 | 40 | 69,9253 |
| 69Ga | 31 | 38 | 68,9256 |
| 71Ga | 31 | 40 | 70,9247 |
| 70Ge | 32 | 38 | 69,9242 |
| 72Ge | 32 | 40 | 71,9221 |
| 73Ge | 32 | 41 | 72,9235 |
| 74Ge | 32 | 42 | 73,9212 |
| 75As | 33 | 42 | 74,9216 |
| 74Se | 34 | 40 | 73,9225 |
| 76Se | 34 | 42 | 75,9192 |
| 77Se | 34 | 43 | 76,9199 |
| 78Se | 34 | 44 | 77,9173 |
| 80Se | 34 | 46 | 79,9165 |
| 82Se * | 34 | 48 | 81,9167 |
| 79Br | 35 | 44 | 78,9183 |
| 81Br | 35 | 46 | 80,9163 |
| 78Kr * | 36 | 42 | 77,9204 |
| 80Kr | 36 | 44 | 79,9164 |
| 82Kr | 36 | 46 | 81,9135 |
| 83Kr | 36 | 47 | 82,9141 |
| 84Kr | 36 | 48 | 83,9115 |
| 86Kr | 36 | 50 | 85,9106 |
| 85Rb | 37 | 48 | 84,9118 |
| 87Rb* | 37 | 50 | 86,9092 |
| 84Sr | 38 | 46 | 83,9134 |
| 86Sr | 38 | 48 | 85,9093 |
| 87Sr | 38 | 49 | 86,9089 |
| 88Sr | 38 | 50 | 87,9056 |
| 89Y | 39 | 50 | 88,9058 |
| 90Zr | 40 | 50 | 89,9047 |
| 91Zr | 40 | 51 | 90,9056 |
| 92Zr | 40 | 52 | 91,9050 |
| 94Zr | 40 | 54 | 93,9063 |
| 93Nb | 41 | 52 | 92,9064 |
| 92Mo | 42 | 50 | 91,9068 |
| 94Mo | 42 | 52 | 93,9051 |
| 95Mo | 42 | 53 | 94,9058 |
| 96Mo | 42 | 54 | 95,9047 |
| 97Mo | 42 | 55 | 96,9060 |
| 98Mo | 42 | 56 | 97,9054 |
| 100Mo* | 42 | 58 | 99,9075 |
| 96Ru | 44 | 52 | 95,9076 |
| 98Ru | 44 | 54 | 97,9053 |
| 99Ru | 44 | 55 | 98,9059 |
| 100Ru | 44 | 56 | 99,9042 |
| 101Ru | 44 | 57 | 100,9056 |
| 102Ru | 44 | 58 | 101,9043 |
| 104Ru | 44 | 60 | 103,9054 |
| 103Rh | 45 | 58 | 102,9055 |
| 102Pd | 46 | 56 | 101,9056 |
| 104Pd | 46 | 58 | 103,9040 |
| 105Pd | 46 | 59 | 104,9051 |
| 106Pd | 46 | 60 | 105,9035 |
| 108Pd | 46 | 62 | 107,9039 |
| 110Pd | 46 | 64 | 109,9052 |
| 107Ag | 47 | 60 | 106,9051 |
| 109Ag | 47 | 62 | 108,9048 |
| 106Cd | 48 | 58 | 105,9065 |
| 108Cd | 48 | 60 | 107,9042 |
| 110Cd | 48 | 62 | 109,9030 |
| 111Cd | 48 | 63 | 110,9042 |
| 112Cd | 48 | 64 | 111,9028 |
| 113Cd* | 48 | 65 | 112,9044 |
| 114Cd | 48 | 66 | 113,9034 |
| 116Cd* | 48 | 68 | 115,9048 |
| 113In | 49 | 64 | 112,9041 |
| 115In* | 49 | 66 | 114,9039 |
| 112Sn | 50 | 62 | 111,9048 |
| 114Sn | 50 | 64 | 113,9028 |
| 115Sn | 50 | 65 | 114,9033 |
| 116Sn | 50 | 66 | 115,9017 |
| 117Sn | 50 | 67 | 116,9030 |
| 118Sn | 50 | 68 | 117,9016 |
| 119Sn | 50 | 69 | 118,9033 |
| 120Sn | 50 | 70 | 119,9022 |
| 122Sn | 50 | 72 | 121,9034 |
| 124Sn | 50 | 74 | 123,9053 |
| 121Sb | 51 | 70 | 120,9038 |
| 123Sb | 51 | 72 | 122,9042 |
| 120Te | 52 | 68 | 119,9040 |
| 122Te | 52 | 70 | 121,9030 |
| 123Te | 52 | 71 | 122,9043 |
| 124Te | 52 | 72 | 123,9028 |
| 125Te | 52 | 73 | 124,9044 |
| 126Te | 52 | 74 | 125,9033 |
| 128Te* | 52 | 76 | 127,9045 |
| 130Te* | 52 | 78 | 129,9062 |
| 127I | 53 | 74 | 126,9045 |
| 124Xe* | 54 | 70 | 123,9059 |
| 126Xe | 54 | 72 | 125,9043 |
| 128Xe | 54 | 74 | 127,9035 |
| 129Xe | 54 | 75 | 128,9048 |
| 130Xe | 54 | 76 | 129,9035 |
| 131Xe | 54 | 77 | 130,9051 |
| 132Xe | 54 | 78 | 131,9042 |
| 134Xe | 54 | 80 | 133,9054 |
| 136Xe* | 54 | 82 | 135,9072 |
| 133Cs | 55 | 78 | 132,9055 |
| 130Ba* | 56 | 74 | 129,9063 |
| 132Ba | 56 | 76 | 131,9051 |
| 134Ba | 56 | 78 | 133,9045 |
| 135Ba | 56 | 79 | 134,9057 |
| 136Ba | 56 | 80 | 135,9046 |
| 137Ba | 56 | 81 | 136,9058 |
| 138Ba | 56 | 82 | 137,9052 |
| 138La* | 57 | 81 | 137,9071 |
| 139La | 57 | 82 | 138,9064 |
| 136Ce | 58 | 78 | 135,9072 |
| 138Ce | 58 | 80 | 137,9060 |
| 140Ce | 58 | 82 | 139,9054 |
| 142Ce | 58 | 84 | 141,9092 |
| 141Pr | 59 | 82 | 140,9077 |
| 142Nd | 60 | 82 | 141,9077 |
| 143Nd | 60 | 83 | 142,9098 |
| 144Nd* | 60 | 84 | 143,9101 |
| 145Nd | 60 | 85 | 144,9126 |
| 146Nd | 60 | 86 | 145,9131 |
| 148Nd | 60 | 88 | 147,9169 |
| 150Nd* | 60 | 90 | 149,9209 |
| 144Sm | 62 | 82 | 143,9120 |
| 147Sm* | 62 | 85 | 146,9149 |
| 148Sm* | 62 | 86 | 147,9148 |
| 149Sm | 62 | 87 | 148,9172 |
| 150Sm | 62 | 88 | 149,9173 |
| 152Sm | 62 | 90 | 151,9197 |
| 154Sm | 62 | 92 | 153,9222 |
| 151Eu* | 63 | 88 | 150,9199 |
| 153Eu | 63 | 90 | 152,9212 |
| 152Gd* | 64 | 88 | 151,9198 |
| 154Gd | 64 | 90 | 153,9209 |
| 155Gd | 64 | 91 | 154,9226 |
| 156Gd | 64 | 92 | 155,9221 |
| 157Gd | 64 | 93 | 156,9240 |
| 158Gd | 64 | 94 | 157,9241 |
| 160Gd | 64 | 96 | 159,9271 |
| 159Tb | 65 | 94 | 158,9253 |
| 156Dy | 66 | 90 | 155,9243 |
| 158Dy | 66 | 92 | 157,9244 |
| 160Dy | 66 | 94 | 159,9252 |
| 161Dy | 66 | 95 | 160,9269 |
| 162Dy | 66 | 96 | 161,9268 |
| 163Dy | 66 | 97 | 162,9287 |
| 164Dy | 66 | 98 | 163,9292 |
| 165Ho | 67 | 98 | 164,9303 |
| 162Er | 68 | 94 | 161,9288 |
| 164Er | 68 | 96 | 163,9292 |
| 166Er | 68 | 98 | 165,9303 |
| 167Er | 68 | 99 | 166,9320 |
| 168Er | 68 | 100 | 167,9324 |
| 170Er | 68 | 102 | 169,9355 |
| 169Tm | 69 | 100 | 168,9342 |
| 168Yb | 70 | 98 | 167,9339 |
| 170Yb | 70 | 100 | 169,9348 |
| 171Yb | 70 | 101 | 170,9363 |
| 172Yb | 70 | 102 | 171,9364 |
| 173Yb | 70 | 103 | 172,9382 |
| 174Yb | 70 | 104 | 173,9389 |
| 176Yb | 70 | 106 | 175,9426 |
| 175Lu | 71 | 104 | 174,9408 |
| 176Lu* | 71 | 105 | 175,9427 |
| 174Hf* | 72 | 102 | 173,9400 |
| 176Hf | 72 | 104 | 175,9414 |
| 177Hf | 72 | 105 | 176,9432 |
| 178Hf | 72 | 106 | 177,9437 |
| 179Hf | 72 | 107 | 178,9458 |
| 180Hf | 72 | 108 | 179,9466 |
| 181Ta | 73 | 108 | 180,9480 |
| 180W* | 74 | 106 | 179,9467 |
| 182W | 74 | 108 | 181,9482 |
| 183W | 74 | 109 | 182,9502 |
| 184W | 74 | 110 | 183,9509 |
| 186W | 74 | 112 | 185,9544 |
| 185Re | 75 | 110 | 184,9530 |
| 187Re* | 75 | 112 | 186,9558 |
| 184Os | 76 | 108 | 183,9525 |
| 186Os* | 76 | 110 | 185,9538 |
| 187Os | 76 | 111 | 186,9558 |
| 188Os | 76 | 112 | 187,9558 |
| 189Os | 76 | 113 | 188,9581 |
| 190Os | 76 | 114 | 188,9581 |
| 192Os | 76 | 116 | 191,9615 |
| 191Ir | 77 | 114 | 190,9606 |
| 193Ir | 77 | 116 | 191,9626 |
| 190Pt* | 78 | 112 | 189,9599 |
| 192Pt | 78 | 114 | 191,9610 |
| 194Pt | 78 | 116 | 193,9627 |
| 195Pt | 78 | 117 | 194,9648 |
| 196Pt | 78 | 118 | 195,9650 |
| 198Pt | 78 | 120 | 197,9679 |
| 197Au | 79 | 118 | 196,9666 |
| 196Hg | 80 | 116 | 195,9658 |
| 198Hg | 80 | 118 | 197,9668 |
| 199Hg | 80 | 119 | 198,9683 |
| 200Hg | 80 | 120 | 199,9683 |
| 201Hg | 80 | 121 | 200,9703 |
| 202Hg | 80 | 122 | 201,9706 |
| 204Hg | 80 | 124 | 203,9735 |
| 203Tl | 81 | 122 | 202,9723 |
| 205Tl | 81 | 124 | 204,9744 |
| 204Pb | 82 | 122 | 203,9730 |
| 206Pb | 82 | 124 | 205,9745 |
| 207Pb | 82 | 125 | 206,9759 |
| 208Pb | 82 | 126 | 207,9767 |
| 209Bi* | 83 | 126 | 208,9804 |
| 232Th* | 90 | 142 | 232,0381 |
| 235U* | 92 | 143 | 235,0439 |
* это нестабильные изотопы и с большим периодом полураспада, который равняется возрасту Вселенной.
Химический элемент
Химический элемент — совокупность атомов с одним и тем же зарядом ядра, числом протонов в ядре и электронов
в электронной оболочке. Закономерную связь химических элементов отражает периодическая таблица Д.И. Менделеева.
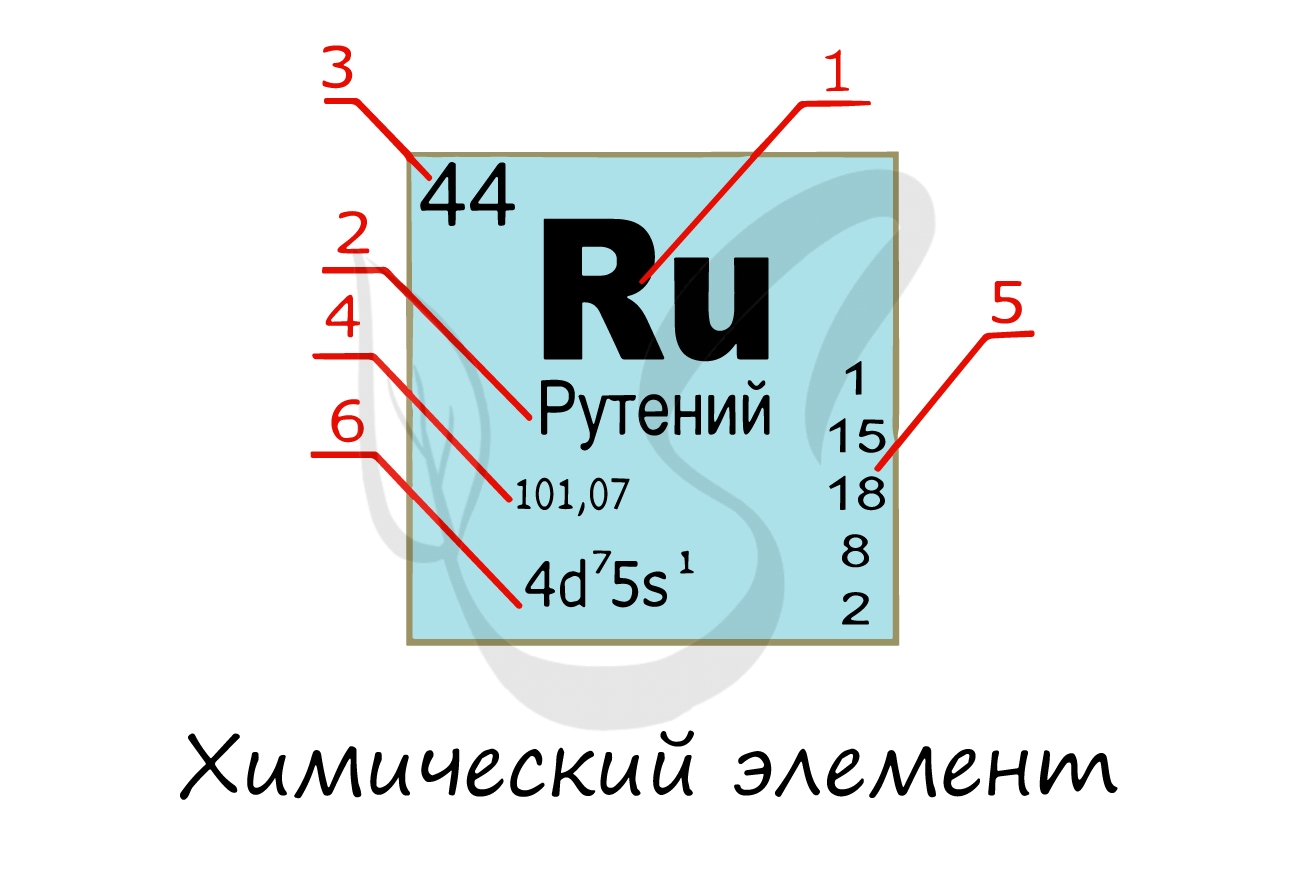
Изучая подобную карточку химического элемента, можно узнать о нем многое:
- Обозначение химического элемента
- Русское наименование
- Порядковый номер = заряд атома = число электронов = число протонов
- Атомная масса
- Распределение электронов по энергетическим уровням
- Электронная конфигурация внешнего уровня
Надо заметить, что на экзамене часто из карточки элемента скрывают распределение электронов и конфигурацию внешнего
уровня. Тем не менее, если вы успешно освоили предыдущую тему, то для вас не составит труда написать электронную
конфигурацию атома зная его порядковый номер в таблице Д.И. Менделеева (номер уж точно не тронут!))
Протоны, нейтроны и электроны
Вы уже знаете, что порядковый номер элемента в периодической таблице Д.И. Менделеева равен числу протонов, а число протонов
равно числу электронов.
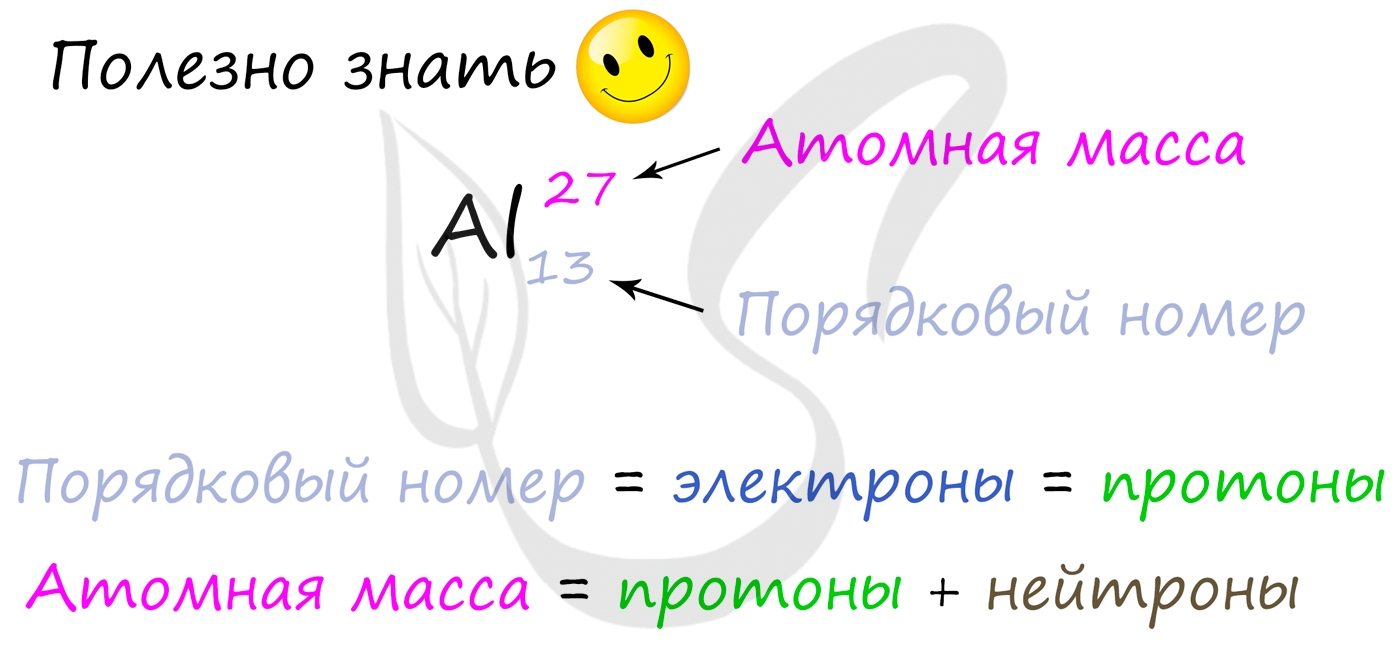
Для того чтобы найти число нейтронов в атоме алюминия, необходимо вычесть из атомной массы число протонов:
27 — 13 = 14
Получается, что в атоме алюминия 14 нейтронов. Посчитайте число нейтронов, электронов и протонов самостоятельно для атомов бериллия,
кислорода, меди. Решение вы найдете ниже.

Если вы поняли суть и научились считать протоны, нейтроны и электроны, самое время приступать к следующей теме.
Изотопы
Изотопы (греч. isos — одинаковый + topos — место) — общее название разновидностей одного и того же химического элемента,
имеющих одинаковый заряд ядра (число протонов), но разное число нейтронов.
Вероятно, вы не задумывались, но вся таблица Д.И. Менделеева и представленные в ней химические элементы — это самые распространенные
на земле изотопы.
Лучше всего объяснить, что такое изотопы наглядным примером. Широко известны три изотопа водорода: протий, дейтерий и тритий.
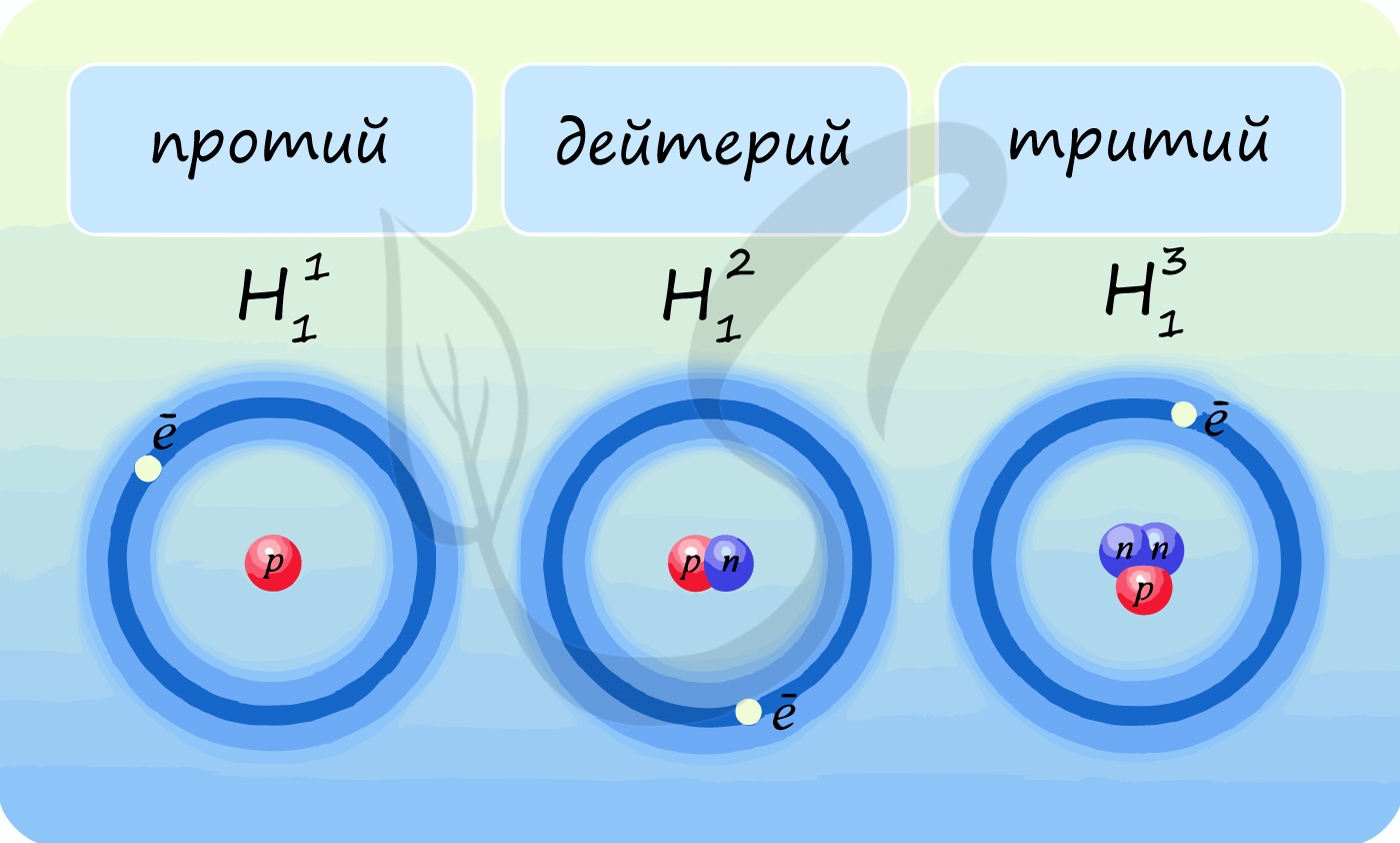
В таблице Д.И. Менделеева представлен самый распространенный из трех — протий. Он содержит 1 протон и 1 электрон, нейтроны отсутствуют. У
дейтерия 1 протон, 1 нейтрон и 1 электрон. У трития 1 протон, 2 нейтрона, 1 электрон.
Теперь очевидно, что изотопы — атомы одного и того же химического элемента, различающиеся числом нейтронов.
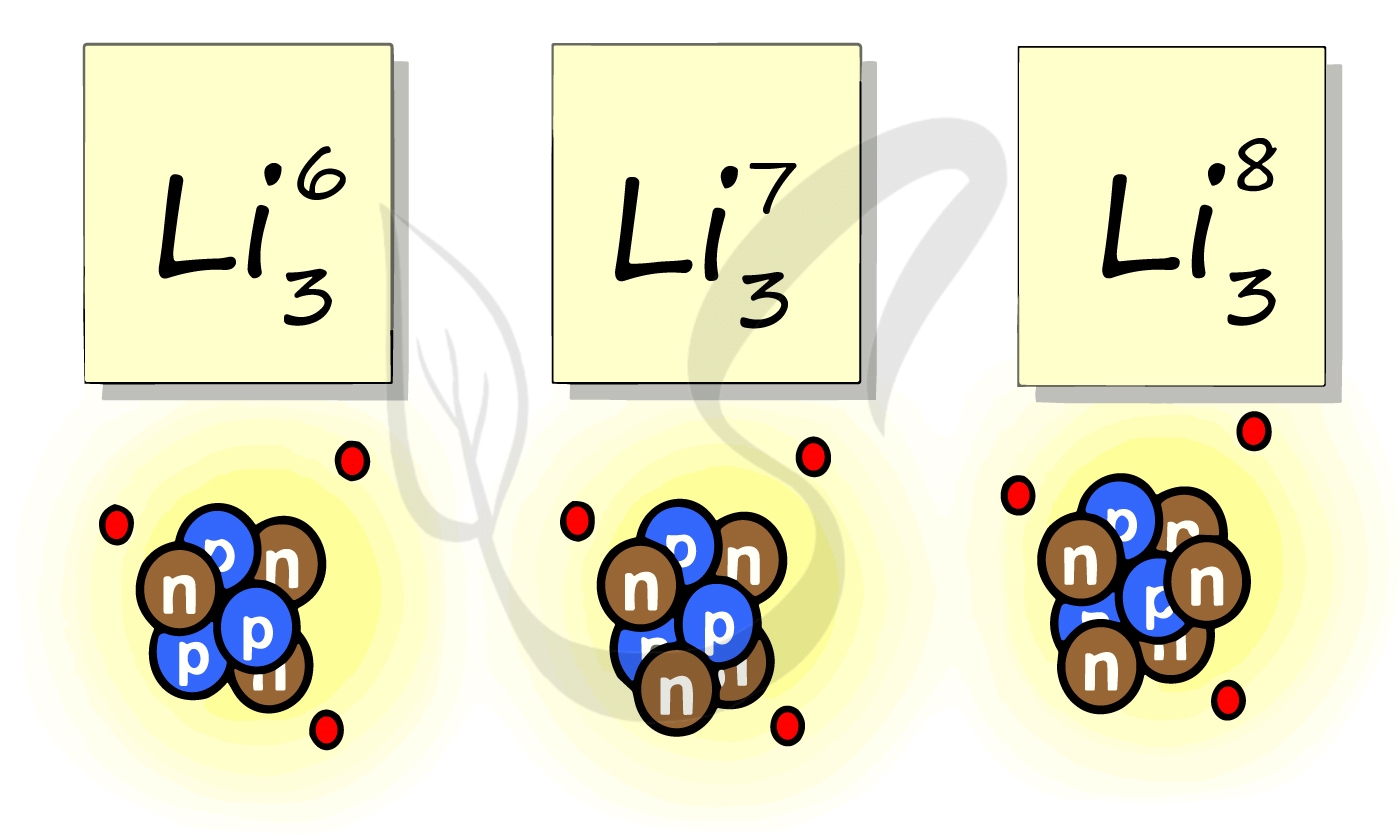
Рассмотрим пример с изотопами лития. Самостоятельно посчитайте количество нейтронов у каждого изотопа. Найдите тот, который
включен в таблицу Д.И. Менделеева.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Как Найти Протоны. Как найти протоны атом представляет собою как бы миниатюрную копию солнечной системы. Этот генератор позволял получить поток ускоренных протонов, кинетическая энергия.
Электрический заряд является одним из свойств элементарных частиц, таких как электроны, протоны и кварки (да, именно. Как только вы узнаете, где искать. Этот генератор позволял получить поток ускоренных протонов, кинетическая энергия.
Определить Количество Протонов, Нейтронов И Электронов В Данном Элементе Не Так Сложно, Как Кажется.
Как найти протоны атом представляет собою как бы миниатюрную копию солнечной системы. Так, мы должны выяснить массу нейтронов, а она равна их количеству, так как масса частиц ядра равна 1. Количество протонов в атоме совпадает с количеством электронов, поскольку атом электрически нейтрален, и совпадает с порядковым номером элемента в периодической таблице менделеева.
Протоны И Электроны Из Таблицы Менделеева = Порядковому Номеру Элемента.
Зная, сколько нейтронов содержится в конкретном атоме, вы сможете. Атомная масса алюминия составляет 26,98154 (значение округляется, поэтому 27). Количество протонов можно найти, зная заряд ядра атома, а также количество электронов в.
Очень Часто Мои Знакомые Спрашивают Меня, Как Посчитать Те Или Иные Части Химических Элементов.
Как и любого другого атома, у него есть ядро, в которое входят протоны и нейтроны, и электроны, которые вращаются вокруг ядра. Протоны равны массе заряда (р=13), так же и электроны (е=13). Посмотреть порядковый номер в таблице менделеева!
Часто Часть Вашего Ответа Будет Прямо Перед Вами В Таблице Менделеева!
Включите javascript для лучшей работы сайта Этот генератор позволял получить поток ускоренных протонов, кинетическая энергия. Он там под номером 6 с атомным весом 12.
Как Только Вы Узнаете, Где Искать.
Электрический заряд является одним из свойств элементарных частиц, таких как электроны, протоны и кварки (да, именно. Кокрофт и уолтон построили генератор, дававший разность потенциалов около 700000 в. Эта инструкция о том, как определить количество нейтронов, электронов и протонов в химическом элементе.




















