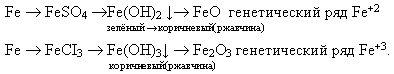ответы
ваш ответ
Можно ввести 4000 cимволов
отправить
дежурный
Нажимая кнопку «отправить», вы принимаете условия пользовательского соглашения
похожие темы
похожие вопросы 5
ПЛАН-КОНСПЕКТ УРОКА
Генетические
ряды железа Fe2+
и Fe3+
.
|
|
ФИО |
Овчинникова Светлана |
|
|
Место |
государственное |
|
|
Должность |
Учитель высшей |
|
|
Предмет |
Химия |
|
|
Класс |
9 |
|
|
Тема |
Неметаллы. № 19 |
|
|
Базовый |
Габриелян |
Цель урока:
-
Повторить
строение атома железа исходя из его
положения в Периодической Системе
Д.И.Менделеев. -
Познакомиться
с соединениями II и
III-валентного железа;
совершенствовать свои знания в умении
составлять уравнения реакций с участием
всех классов неорганических веществ.
Задачи:
Обучающие:
(формирование познавательных
УУД):
-
продолжить
формирование понятий ; -
продолжить
формирование умений и навыков при
работе с химическими реактивами.
Воспитательные:
(формирование коммуникативных
и личностных УУД)
-
содействовать
формированию у учащихся умения совместной
работе в группе при рациональном
разделении труда, умения внимательно
слушать учителя и друг друга; -
содействовать
формированию у учащихся умения осознавать
собственную учебную деятельность,
осуществлять самоконтроль; -
содействовать
формированию у учащихся устойчивого
интереса к изучению химии;
Развивающие:
(формирование регулятивных
УУД)
-
развитие
речи, -
коммуникативных
способностей, -
развитие
умения логически излагать свои мысли, -
развитие
познавательного интереса учащихся.
Тип
урока: Урок изучения нового
материала.
Формы работы учащихся
-
Индивидуальная
-
самостоятельная работа с текстом
учебника; -
сотрудничество с учителем
-
прохождение теста.
Необходимое техническое оборудование
ПСХЭ,
компьютер, мультимедийный проектор,
Коллекция «Минералы».
Эпиграфом
к нашему уроку будет высказывание
выдающегося писателя О.Генри:
Слайд 1.
« В
жизни есть некоторые вещи, которые
непременно должны существовать вместе».
Сегодня
на уроке мы должны:
-
Повторить
строение атома железа исходя из его
положения в Периодической Системе
Д.И.Менделеев. -
Познакомиться
с соединениями II и
III-валентного железа;
совершенствовать свои знания в умении
составлять уравнения реакций с участием
всех классов неорганических веществ.
На
сегодняшнем уроке мы продолжаем
рассматривать один из самых интересных
химических элементов,- железо, соединения
которого известны с глубокой древности.
Слайд 2.
Итак,
тема нашего урока:
«Железо
и его генетический ряд».
Удивительно,
что мы носим в себе горный хрусталь,
черный агат, серу спичечной коробки.
Удивительно, что в нас перемешаны крупицы
доломитовых гротов, пыль меловых гор и
что каждый из этих элементов – необходимая
составная часть нашего организма. Но
то, что мы носим в себе железо, настоящий
тяжелый металл, в таком количестве, из
которого можно сделать вязальную спицу,
и что из этих трех граммов железа зависит
наша возможность существования больше,
чем от всех машин, вместе взятых, что
без этой вязальной спицы в нашем теле
мы не сможем прожить ни одной секунды,
это — самое странное.
Итак,
железо.
Слайд 3.
-
Давайте
дадим общую характеристику железа на
основании его положения в П.С.
Д.И.Менделеева. -
Каково
же строение атома этого необыкновенного
элемента.
Слайд 4.
Железо элемент
побочной подгруппы VIII
группы и IV периода
Периодической
системы Д.И.Менделеева.
В отличие
от элементов главных подгрупп в атоме
железа заполняется не последний, а
предпоследний энергетический уровень.
При этом электроны добавляются на 3-й d
подуровень, поэтому атомы железа при
химических реакциях могут отдавать не
только 2 электрона с последнего уровня,
но и электрон с 3 d подуровня
проявляя при этом степень окисления
+3.
Проявляя
степень окисления +2 и +3 железо образует
два ряда соединений и по восстановительной
способности уступает многим другим
металлам.
Соединения
железа, а что они из себя представляют.
Слайд 5.
FeO(II)-твердое,
тугоплавкое вещество черного цвета,
растворяется в разбавленных кислотах
образуя соли железа двухвалентного, в
кислотах окислителях соли железа
трехвалентного.
Fe(OH)2-порошок
белого цвета, не растворяется в воде.
Окисляется в Fe(OH)3,
разлагается при нагревании.
Fe2O3
– порошок бурого цвета, не растворяется
в воде, проявляет амфотерные свойства.
Fe(OH)3– твердое вещество, красно-бурого
цвета, не растворим в воде, еще более
слабое основание, чем Fe(OH)2.
Амфотерен.
Можно
так рассматривать соединения железа,
а можно их систематизировать, и поможет
нам в этом Генетический ряд.
Слайд 6.
Что
такое генетический ряд?
Я обращаю
ваше внимание на генетический ряд
железа, с которым мы познакомимся.
Мы с
вами разобрали генетическую связь и на
слайдах и на схемах уравнений реакций.
А теперь вы должны будете схемы уравнений
реакций превратить в уравнения химических
реакций.
Обратите
внимание ребята на вещества, которые
остались за пределами генетического
ряда.
Как вы
думаете, что это за вещества? Ну конечно
же, это качественные реактивы на катионы
железа II и III
валентного.
Слайд 7.
Опыт.
Качественной
реакцией на катион железа II
является выпадение темно-синего осадка
турнбулевой синей под действием
гексацианоферрата калия красной кровяной
соли.
Реактивом
на катион железа III является
гексацианоферрат два калия- желтая
кровяная соль или растворы роданидов
аммония или калия. В первом случае
образуется темно-синий осадок берлинской
лазури, а во втором малодиссоциирующее
вещество
роданид
железа кроваво красного цвета.
А
генетический ряд Fe(III)
будет вашим домашним заданием, кроме
этого
Стр.
Обращаю
ваше внимание на дополнительную
литературу по данной теме.
1. Книга
1 «Химия жизни» В этой книге вы можете
прочитать
дальнейший
мой рассказ о влиянии железа на наш с
вами
организм.
2. Книга
№2 расскажет о минералах, о горных
породах в состав
которых
входит железо.
3. Железо
обнаружено на луне, причем в лунном
грунте оно
присутствует
в самородном состоянии, неокисленном
состоянии,
что объясняется отсутствие атмосферы,
об этом вы
можете прочитать
в книге № 3
Продолжим
нашу работу.
Как мы
выяснили, очень часто железо встречается
в виде соединений. Среди них большое
значение имеют такие минералы как;
Слайд 8.
Бурый железняк-
Fe(OH)3-наиболее доступной первобытным
людям железной рудой явился именно
бурый железняк, отлагающийся повсеместно
в болотах; отсюда и название этих
отложений: болотная руда.
Красный
железняк –Fe2O3;
Магнитный
железняк- Fe3O4-минерал,
несколько напоминающий по внешнему
виду самородное железо.Куски
природного магнитного железняка не
только притягиваются магнитом, но и
сами являются магнитами.
У вас
на столах образцы разных минералов,
найдите среди них минералы, содержащие
железо.
По каким
признакам вы их узнали?
Мы
сегодня с вами познакомились с соединениями
железа и напрашивается вопрос
А зачем,
с какой целью мы это изучаем?
Чтобы
узнать о применении соединений железа
в настоящее время.
-
Какие области
применения соединений железа вам
известны? -
Кто может
назвать? -
Откройте
учебник стр.____ абзац______
Дополните!
Слайд 9.
Железо
стимулирует функцию кроветворных
органов, входит в состав гемоглобина и
других сложных белков живых организмов.
Очень
широко применяется как конструкционный
материал.
Его
соединения использую в органическом
синтезе при очистке воды и окраске
тканей.
Крупинка
железа! Насколько она дороже для нас
всего золота и всех бриллиантов мира!
Золотое кольцо на пальце, сверкающий
бриллиант на шее…Сколько жизней
погублено, сколько людей принесено им
в жертву!
А наша
жизнь течет мириадами кровяных шариков
с железом по кровеносным сосудам, причем
в каждом шарике всего один гран железа,
а во всех вместе ( а их миллиарды!) всего
каких нибудь 3 грамма, нужных для одной
вязальной спицы, и все-таки эта кучка
железной пыли дороже и ценнее для нас,
чем все золото мира, чем алмазные копи
Сибири и Африки, потому что она дарит
нам кровь, дает дыхание, дает тепло и
радость жизни!
Общим
итогом нашей совместной работы являются
ваши оценки.
Я
благодарю вас за прекрасное общение,
вы мне очень понравились, вы очень
работоспособны.
Я желаю
вам успехов в изучении химии!
У нас
осталось с вами время, и мне хотелось
бы знать степень усвоения данного
материала.
Тесты.
Всего
вам доброго!
Цель урока: Актуализация и углубление знаний
учащихся о химических свойствах железа и его
соединений.
Задачи:
- Образовательные – на основании
полученных ранее знаний о строении атомов,
основных классах соединений, химических
свойствах веществ, составить генетические ряды
железа (II),(III). Научить определять опытным путем
катионы железа и совершенствовать умения
обучающихся, записывать химические реакции в
молекулярном, ионном видах; - Развивающие – продолжить развитие
логического мышление у учащихся, способность
самостоятельно мыслить и делать выводы,
формулировать гипотезы и проводить их опытную
проверку, опираясь на знания химии;
совершенствовать умения работать с лабораторным
оборудованием и реактивами; - Воспитательные – формирование
положительной мотивации учения и здорового
образа жизни; продолжить формирование научного
мировоззрения учащихся; воспитывать культуру
общения через работу в группах; воспитывать
наблюдательность, пытливость, инициативность,
стремление к самостоятельному поиску.
Тип урока: комбинированный
(системно-деятельностный подход)
Методы и методические приемы обучения:
проблемно-поисковый, исследовательский,
словесный.
Оборудование и реактивы:
- Лист – инструкция, карточки
- Пробирки, пластмассовые штативы.
- Растворы: FeSO4, FeCl3, NaOH, K3[Fe(CN)6],
K4[Fe(CN)6], KSCN.
Ход урока
1. Организационный момент. (слайд 1)
– заставка.
— Здравствуйте. Сегодня на уроке нам предстоит
открыть новые знания, и актуализировать
известное.
2. Актуализация полученных знаний
— Тему урока мы сформулируем вместе в процессе
работы. Я загадаю Вам загадку, а Вы должны
угадать, о чем пойдет речь на уроке.
“Загадка”: (слайд 2 )
Очень древний я металл,
Счёт столетьям потерял.
Был нескромным я не в меру,
Тысячи лет до нашей эры.
А за блеск, мерцавший холодом,
Люди там платили золотом!Я давно в названии века, (слайд 3 )
В организме человека.
Называют мной характер,
Из меня почти весь трактор.
Очень в яблоке полезно,
И зовут меня … (Железо)
Железо — атом химического элемента из ПСХЭ
Д.И. Менделеева.
3. Фронтальный опрос:
Какие формы существования характерные для
железа вы знаете? — (атомы или ионы); (слайд 4 )
- ион – это ?(заряженная частица);
- какую валентность в основном проявляет железо? —
(II, III); - а степень окисления? — (+2,+3).
В каком виде железо встречается в природе? -(в
виде соединений, в чистом виде – метеоритное
железо) (слайд 5).
Сегодня мы с вами проведём научное
исследование и узнаем много нового про железо-
жизненно важный элемент. А кто -нибудь из вас
сможет мне сказать почему я его назвала жизненно
важным. (ответы учащихся).
А как вы думаете в наших с вами организмах
железо в какой форме существует? (соединений,
ионной) (ответы учащихся)
Железо один из химических элементов, который
играет огромную роль, как в живой так и в неживой
природе.
В организме (слайд 6) каждого человека есть
кровь, в состав которой входят красные кровяные
тельца – (эритроциты), а их количество зависит от
количества гемоглобина – образованного ионом
железа (+2). Железо не синтезируется в нашем
организме, а поступает к нам с пищей. (слайд 7) Это
значит, что мы с вами должны правильно —
сбалансированно питаться. Чтобы количество
ионов железа поступающих в наш организм и
соответственно гемоглобина синтезирующегося в
организме было достаточным.
В неживой природе (слайд 8 ) мы с вами
сталкиваемся с различными соединениями железа,
которые находят применение в промышленности, а
следовательно в жизни каждого человека.
Наш Кузбасс (слайд 9 ) – промышленный регион, в
котором развита металлургическая
промышленность, Новокузнецк – город в котором
несколько крупнейших металлургических гигантов
Сибири.
Fe(OH)3 , Fe, Fe(OH)2 , FeCI3 , Fe2O3
, FeSO4 , FeO, Fe.
Вспомните, как называются соединения железа,
которые вы видите(слайд 10 ), у вас на столах в двух
стопках лежат карточки с формулами соединений
железа. Я вас попрошу распределить карточки на 2
группы и объяснить, какой признак вы брали за
основу. На доске необходимо выполнить, это
задание.
А как вы думаете, эти вещества как – то связаны
друг с другом? Сейчас попробуйте проследить эту
связь, и разместить соединения железа в
определённой последовательности. (слайд 11 )Кто
выполнит это задание на доске? Составление
цепочки веществ. Работа в парах. Что же вы сейчас
составили? Можно ли дать какую – то
характеристику данному ряду? (варианты ответов).
Подвести к понятию генетического ряда(генетика
– ген).
Вот мы с вами и сформулировали первую часть
темы нашего урока.
Генетические ряды железа Fe+2 и Fe+3 .
А как вы думаете, что мы ещё научимся делать на
уроке. Если есть Fe+2 и Fe+3, то мы должны
их как- то различить? Как мы можем это сделать?
Определить состав? Значит, провести реакции, с
помощью которых мы можем распознать ионы Fe+2 и
Fe+3, а такие реакции называются –
качественными. ответы учащихся.(слайд 12 )
Качественные реакции на катионы железа Fe+2 и
Fe+3. Вот мы с вами и сформулировали тему
урока. Запишите её в тетрадь.
Тема нашего урока: Генетические ряды железа
Fe+2 и Fe+3 .
Качественные реакции на катионы железа.
Вы самостоятельно составили генетические ряды
железа. Запишем их в тетрадь, составив уравнения
реакций к данным схемам превращения. (слайд 13 )
Заострить внимание на составе и цвете
осадков(качественное определение ионов).Химия
это наука – которая учит правильно использовать
вещества, обращаться с веществами. Сейчас мы с
вами вспомним, правила при работе с химическими
реактивами и оборудованием.(слайд 14) Вот и пришло
время, которое отличает химию от всех остальных
наук. Вы станете исследователями. Вы проведёте
химический эксперимент. Не забывая про технику
безопасности. Возьмите, пожалуйста, лист –
инструкцию (Приложение 1), к проведению
лабораторных опытов. (слайд 15)
Уважаемые, учёные — исследователи сформулируем
цель наших опытов, а теперь задачи, которые
помогут, осуществит данную цель.
Ваш первый опыт качественные реакции на
катионы железа.
4. Постановка проблемы.
Л.о. №1. Качественные реакции на катионы железа.
Используя химические реактивы, находящиеся у вас
на столах и пробирки, с растворами солей железа
вы сейчас проведёте качественные реакции на
катионы железа. Возьмите пробирку с хлоридом
железа (слайд 15 ). Не подписаны? Как нам быть?
Предложения учащихся. Значит, мы должны что-то
прилить в пробирки и наблюдать признаки
химических реакций, (слайд) позволяющие нам
качественно определить ионы, правильно
гидроксид натрия.
Приступаете к исследованию веществ в пробирках
в соответствии с инструкциями к данному опыту.
Уравнения реакции запишите в молекулярном виде.
Сделайте вывод. (слайд 16) Дома вы допишите в
ионных видах.
(слайд 17 ) Но данные реакции не единственные,
являющиеся качественными реакциями на катионы
железа. Для определения ионов железа используют
очень красочные реакции, вы сами в этом
убедитесь. Используя лист – инструкцию проведём
ещё реакции с помощью которых, можно доказать в
растворах наличие ионов железа. Не забываем про
технику безопасности. Сложность данных опытов в
том, что одно из реагирующих веществ, является
комплексным соединением, подробно изучать вы их
будете в старших классах. Такие названия как
:красная кровяная соль, жёлтая кровяная соль,
турнбулева синь, берлинская лазурь называются
историческими названиями, каждое из этих веществ
имеет ещё и химическое название. Осуществляем
реакции, записываем наблюдения, молекулярные
уравнения реакции у вас записаны ионные вы
составите дома, правильно это выполнить вам
поможет инструктивная карта на вашем листе.
Выполнение опытов. (слайд 18) Формулирование
вывода. Обсуждение качественных реакций. (слайд 19
) Наши исследования завершились. Где ваши знания,
умения и навыки могут пригодиться? (слайд 20)
Вот наш и заканчивается наш урок. (слайд 21 )
Запишите в дневники домашнее задание: параграф 14
читать, к молекулярным уравнениям л.р. составить
ионные, решить схемы превращений в тетради.
За работу на сегодняшнем уроке, мне очень
приятно поставить “отличные ” отметки …..(слайд
22 )
А сейчас я попрошу вас обратить внимание на
слайд, может быть кто – то продолжит, то
предложение, которое нравится.
Спасибо за урок. (слайд 23)
По вопросу презентации обращайтесь к автору.
Генетический ряд металла состоит из простого вещества, оксида, гидроксида и соли:
металл — основный оксид — основание — соль.
Все металлы можно разделить на две группы: активные и неактивные.
К активным относят металлы, реагирующие с водой при обычных условиях. Это (10) металлов: литий, натрий, калий, рубидий, цезий, франций, кальций, стронций, барий, радий. Их оксиды соединяются с водой с образованием растворимых гидроксидов — щелочей.
Остальные металлы менее активны. Их оксиды не реагируют с водой, а основания в воде не растворяются. Поэтому из оксида получить основание можно только через соль. Для неактивных металлов генетический ряд выглядит так:
металл — основный оксид — соль1 — основание — соль2.
1. Генетические ряды активных металлов:
Ряд лития:
Li→Li2O→LiOH→Li2SO4
.
Ряд кальция:
Ca→CaO→Ca(OH)2→CaCO3
.
Ряд бария:
Ba→BaO→Ba(OH)2→Ba3(PO4)2
.
Составим уравнения для генетического ряда бария:
.
Обрати внимание!
Превращение гидроксида бария в фосфат можно осуществить также с помощью кислотного оксида или растворимой соли:
,
.
2. Генетические ряды неактивных металлов:
Ряд магния:
Mg→MgO→MgCl2→Mg(OH)2→MgSO4
.
Ряд железа:
Fe→FeO→FeSO4→Fe(OH)2→Fe(NO3)2
.
Ряд меди:
Cu→CuO→Cu(NO3)2→Cu(OH)2→CuCl2
.
Составим уравнения реакций для ряда меди:
,
Обрати внимание!
В ряду неактивного металла получить соль из основания можно только с помощью кислоты.
9 класс Тема урока: Генетические ряды Fe²⁺ и Fe³⁺.
Цели урока: — ознакомить с соединениями железа (II и III);
— продолжить формирование умений делать опыты,
наблюдать, анализировать, выделять главное, делать
выводы;
— способствовать формированию научного
мировоззрения;
— воспитывать культуру труда, уверенность в своих
силах, самостоятельность, любознательность.
Задачи урока: — закрепить знания о железе – простейшем веществе
— рассмотреть генетические ряды железа со степенями
окисления +2 и+3
— ознакомиться с характеристиками оксидов и
На доске! идроксидов Fe² ⁺и Fe³⁺
— рассмотреть качественные реакции на ионы железа
Fe² ⁺и Fe³⁺
— ознакомиться с применением соединения железа
Оборудование: 2 штатива с пробирками, 2 спиртовки, спички, держатели,
пипетки, растворы FeCL₃, FeCl₂(или FeSO₄), NaOH (KOH),
K₃[Fe(CN)₆], NH₄NCS (KNCS).
Форма: исследовательский урок.
Ход урока
- Организационный момент: — подготовка к уроку
—тема урока
? – Как вы считаете каковы задачи нашего сегодняшнего урока.
! – Прочитать задачи урока.
Итак, прежде чем мы перейдем к новому материалу повторим то, что мы изучили на прошлом уроке.
II. Опрос по изученному материалу.
- Строение атома Fe, его физические свойства.
- Химические свойства Fe. У доски
- Задание №5
- Задание №6
Пока они готовятся, остальным предлагаю выполнить следующие
превращения по вариантам:
1-вариант: Fe → FeSO₄(или FeCl₂) → Fe(OH)₂ → FeO. (выделенное — опыты)
2-вариант: Fe → FeCL₃ → Fe(OH)₃ →Fe₂O₃. (выделенное — опыты)
Открыли тетради, записали сегодняшнее число, тему урока.
Перепишите цепочки и составьте уравнения реакций.
!! Кроме того, сегодня на уроке у нас будут работать два эксперта,
-1ый ученик !Сильные
-2ой ученик учащиеся
которые выполнят опыты по данным превращениям и сделают выводы по
своим наблюдениям.
!!! На работу 10 минут.
1.Проверяем домашнее задание.
Итак, в начале слушаем и дополняем тех, кто готовится у доски, а затем
проверим цепочки превращений.
III. 2. Проверяем цепочки (2-е учащиеся у доски) и слушаем
экспертов.
!!! Обратите ёщё раз внимание, чтобы получить FeCl₂ (хлорид железа II)
необходимо к Fe добавить кислоту HCl.
А чтобы получить FeCl₃ (хлорид железа III) Fe соединяем с CL₂.
Итак, как уже было сказано для железа характерны два ряда соединений: соединения железа (II) и железа (III).
Выполнив цепочки превращений мы рассмотрели не только их получение, но и характер их соединений (оксидов и гидроксидов железа II и III).
? Какой характер имеют оксиды и гидроксиды.
! Выводы делают учащиеся.
(Оксиды и гидроксиды имеют ярко выраженные основные свойства, гидроксиды — нерастворимые основания, которые при нагревании разлагаются на соответствующие оксиды).
Fe(OH)₂ приобретает болотно-зеленую окраску.
Fe(OH)₃ — бурая окраска.
! Следует отметить, что гидроксид железа (II) легко окисляется воздухом и превращается в гидроксид железа (III).
В ТЕТРАДЯХ: 4Fe(OH)₂ + 2H₂O +O₂ = 4Fe(OH)₃
А теперь ребята скажите вот две пробирки в одой FeCl₂, а в другой FeCl₃,
как их различить.
(добавить щелочь, по образующемуся гидроксиду – их окраске.
Кроме щелочи, в качестве определяющих реагентов можно использовать
для определения
Fe²⁺ K₃[Fe(CN)₆] красную кровяную соль.
Fe³⁺ K₄[Fe(CN)₆] желтую кровяную соль.
или KNCS роданид калия.
! Демонстрация опыта. FeSO₄ +K₃[Fe(CN)₆] осадок темно-синего цвета
FeCl₃ + KNCS красно-кровяной раствор
А теперь запишем эти реакции. Откройте учебник стр.66 – 67 (второй
абзац снизу).
Итак, мы рассмотрели сегодня железа: оксиды, гидроксиды, соли.
? Каково же их значение послушаем сообщение учащегося.
! Сообщение учащегося «Применение соединений железа человеком».
IV. А теперь вернемся к задачам нашего урока.
Что же мы выяснили и узнали сегодня на уроке.
!!! Вывод делают учащиеся.
- Что железо имеет 2 ряда соединений II и III (Fe² ⁺и Fe³⁺)
- Что оксиды и гидроксиды имеют основной характер и Fe(OH)₂ →
→Fe(OH)₃.
- Что на Fe² ⁺и Fe³⁺есть качественные реакции с помощью которых можно отличить их друг от друга.
V. Домашнее задание §17 №1, 2, 7 стр.123 – 124 учебник
О.С.Габриеляна «Химия 9», М.»Дрофа», 2013г.
Рекомендации к лабораторной работе.
Опыт №1. Получение гидроксида железа (III) (Fe(OH)₃).
Налейте в пробирку 2-3 мл. FeCl₃ или Fe₂(So₄)₃, затем добавляйте по каплям NaOH, встряхивая пробирку. Что свидетельствует о получении гидроксида железа (III)?
Опыт №2. Получение оксида железа (III) – (Fe₂O₃).
Закрепите в держателе пробирку с только что полученным остатком – гидроксидом железа (III) и нагрейте. Какие наблюдения подтверждают образование оксида железа (III).
Опыт №3. Качественная реакция на ион Fe³⁺.
Налейте в чистую пробирку 2 мл FeCl₃ или Fe₂(So₄)₃ и добавьте несколько капель роданида аммония NH₄NCS или KNCS. Какие изменения показывают о том, что качественная реакция прошла?
Рекомендации к лабораторной работе.
Опыт №1. Получение гидроксида железа (II) (Fe(OH)₂).
Налейте в пробирку 2-3 мл. FeCl₂ или FeSo₄, затем добавляйте по каплям NaOH, встряхивая пробирку. Что свидетельствует о получении гидроксида железа (II)?
Опыт №2. Получение оксида железа (II) – (FeO).
Закрепите в держателе пробирку с только что полученным остатком – гидроксидом железа (II). Какие наблюдения подтверждают образование оксида железа (II).
Опыт №3. Качественная реакция на ион Fe²⁺.
Налейте в чистую пробирку 2 мл FeCl₂ или FeSo₄ и добавьте несколько капель красной кровяной соли (K₃[Fe(CN)₆]. Какие изменения показывают о том, что реакция прошла?