хлороводород
Степень окисления Cl в HCl составляет -1 . Степень окисления H в HCl составляет +1 .
| Элемент | Число окисления (среднее) | Атомы | Count | Электроотрицательность |
|---|---|---|---|---|
| Cl | -1 | -1 (×1) | 1 | 3.2 |
| H | +1 | +1 (×1) | 1 | 2.2 |
Введите химическую формулу (вводится с учетом регистра), чтобы рассчитать степень окисления элементов.
Инструкции
Enter the formula of a chemical compound to find the oxidation number of each element.
A net ionic charge can be specified at the end of the compound between { and }. For example: ZnCl4{2-} or NH2NH3{+}.
Enter just an element symbol to show the common and uncommon oxidation states of the element.
- Используйте заглавные символы для начального знака элемента и строчные символы для второго знака. Примеры: Fe, Au, Co, Br, C, O, N, F.
- Вы можете использовать круглые () и квадратные скобки [].
Примеры
- (Co(NH3)6){3+}
- Ba(Cl2)
- Ca(C2O4)
- K2PtCl6
- NaCrO2
- BF3
- CH3CH3
- O3Br2
- NaOH*H3PO4
- Cu(NH2CH2COO)2
- CsHCO3
- Na2WO4*2H2O
|
§ 54 |
Валентность и степень окисления |
Вы знаете, что атомы различных химических элементов могут присоединять разное число других атомов, т. е. проявлять разную валентность. Валентность характеризует способность атомов соединяться с другими атомами. Теперь, изучив строение атома и виды химической связи, можно более подробно рассмотреть это понятие.
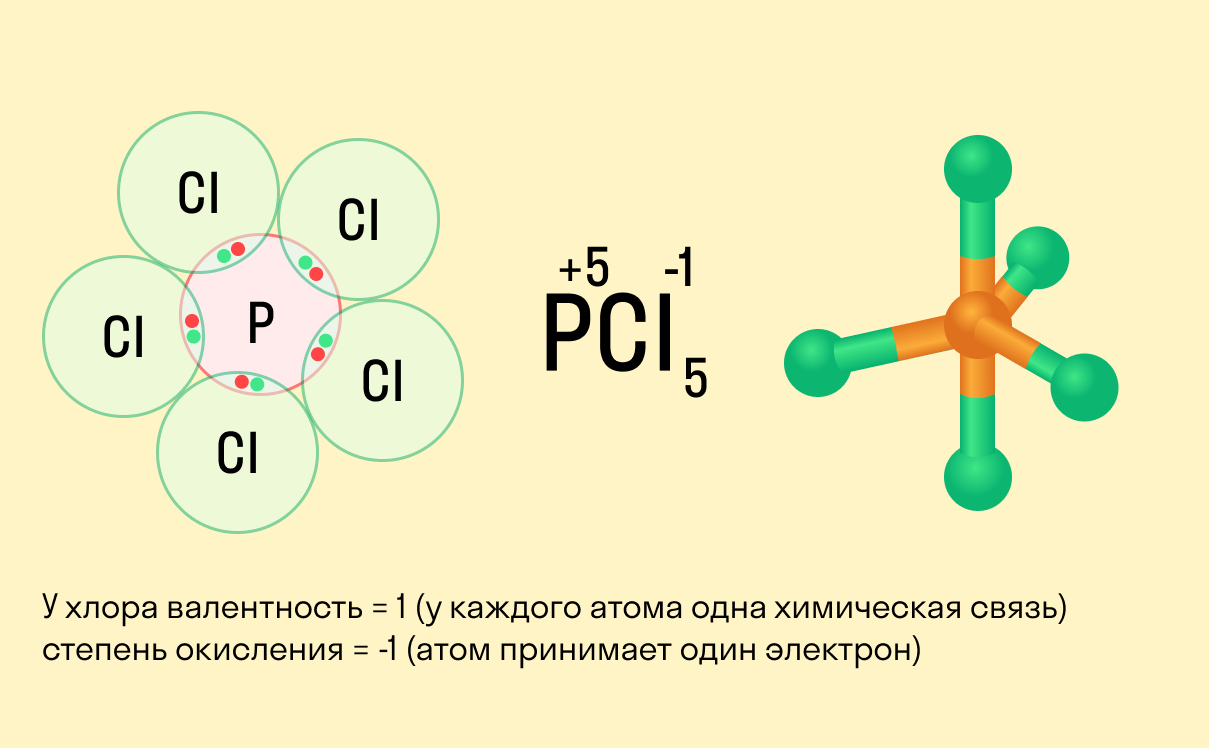
Валентностью называют число одинарных химических связей, которые атом образует с другими атомами в молекуле. Под числом химических связей понимают число общих электронных пар. Так как общие пары электронов образуются только в случае ковалентной связи, то валентность атомов можно определить только в ковалентных соединениях.
В структурной формуле молекулы химические связи изображают чёрточками. Число чёрточек, отходящих от символа данного элемента, и есть его валентность. Валентность всегда имеет положительное целое значение от I до VIII.
Как вы помните, высшая валентность химического элемента в оксиде обычно равна номеру группы, в которой он находится. Чтобы определить валентность неметалла в водородном соединении, нужно из 8 вычесть номер группы.
В простейших случаях валентность равна числу неспаренных электронов в атоме, поэтому, например, кислород (содержит два неспаренных электрона) имеет валентность II, а водород (содержит один неспаренный электрон) — I.
В ионных и металлических кристаллах нет общих пар электронов, поэтому для этих веществ понятие валентности как числа химических связей не имеет смысла. Для всех классов соединений, независимо от вида химических связей, применимо более универсальное понятие, которое называют степенью окисления.
Степень окисления — это условный заряд на атоме в молекуле или кристалле. Его вычисляют, полагая, что все ковалентные полярные связи имеют ионный характер.
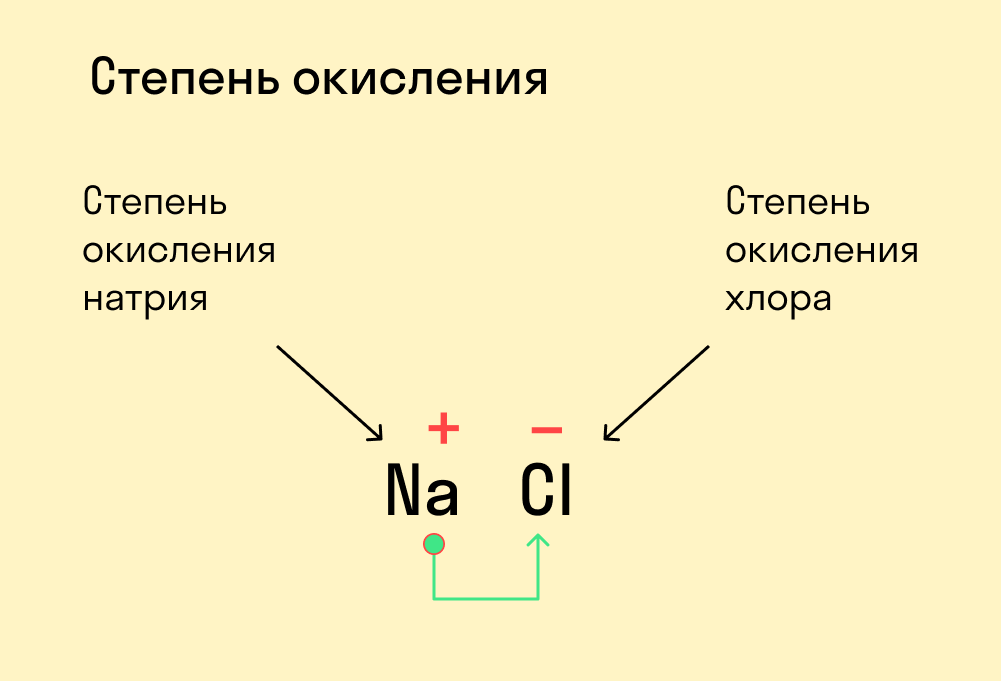
В отличие от валентности, степень окисления может быть положительной, отрицательной или равной нулю. В простейших ионных соединениях степени окисления совпадают с зарядами ионов. Например, в хлориде калия KCl (K+Cl–) калий имеет степень окисления +1, а хлор –1, в оксиде кальция CaO (Ca2+O2–) кальций проявляет степень окисления +2, а кислород –2. Это правило распространяется на все основные оксиды: в них степень окисления металла равна заряду иона металла (натрия +1, бария +2, алюминия +3), а степень окисления кислорода равна –2. Степень окисления обозначают арабской цифрой, которую ставят над символом элемента, подобно валентности:
Обратите внимание на то, что обозначение степени окисления немного отличается от обозначения заряда иона: записывая степень окисления, сначала указывают знак заряда (+ или –), а затем число, например: 
Хотя степень окисления и валентность — разные понятия, иногда их употребляют одно вместо другого. Так, если говорят о том, что валентность натрия в хлориде натрия равна I, то имеют в виду степень окисления натрия, равную +1. Металлы вообще редко образуют ковалентные связи, поэтому под валентностью металлов в соединениях понимают их степень окисления. Например, называя вещество оксидом железа(III), мы имеем в виду, что железо в этом соединении проявляет степень окисления +3.
Рис. 106. Реальные заряды и степени окисления атомов в молекуле хлороводорода
Степень окисления элемента в простом веществе принимают равной нулю:
Рассмотрим, как определяют степени окисления в ковалентных соединениях. Хлороводород HCl — вещество с полярной ковалентной связью. Общая электронная пара в молекуле HCl смещена к атому хлора, имеющему бо́́льшую электроотрицательность. Мысленно трансформируем связь H
Степень окисления и валентность — родственные понятия. Во многих ковалентных соединениях абсолютная величина степени окисления элементов равна их валентности. Существует, однако, несколько случаев, когда валентность отлична от степени окисления. Это характерно, например, для простых веществ, где степень окисления атомов равна нулю, а валентность — числу общих электронных пар:
O
Валентность кислорода равна II, а степень окисления 0.
В молекуле пероксида водорода
H


кислород двухвалентен, а водород одновалентен. В то же время степени окисления обоих элементов по абсолютной величине равны 1:
Рис. 107. Модели молекул метана CH4 и фторида углерода(IV) CF4. Полярность связей обозначена стрелками
Один и тот же элемент в разных соединениях может иметь как положительные, так и отрицательные степени окисления в зависимости от электроотрицательности связанных с ним атомов. Рассмотрим, например, два соединения углерода — метан CH4 и фторид углерода(IV) CF4.
Углерод более электроотрицателен, чем водород, поэтому в метане электронная плотность связей C
Любая молекула электронейтральна, поэтому сумма степеней окисления всех атомов равна нулю. Используя это правило, по известной степени окисления одного элемента в соединении можно определить степень окисления другого, не прибегая к рассуждениям о смещении электронов.
В качестве примера возьмём оксид хлора(I) Cl2O. Исходим из электронейтральности частицы. Вы уже знаете, что атом кислорода в оксидах имеет степень окисления –2, значит, оба атома хлора несут суммарный заряд +2. Отсюда следует, что на каждом из них заряд +1, т. е. хлор имеет степень окисления +1:
Рис. 108. Реальные заряды и степени окисления атомов в молекуле воды
Для того чтобы правильно расставить знаки степени окисления разных атомов, достаточно сравнить их электроотрицательности. Атом с большей электроотрицательностью будет иметь отрицательную степень окисления, а с меньшей — положительную. Согласно установленным правилам, символ наиболее электроотрицательного элемента записывают в формуле соединения на последнем месте:
Позднее вы узнаете, как можно использовать степень окисления для классификации соединений химических элементов и для определения коэффициентов в уравнениях реакций, однако всегда нужно помнить, что понятие это условное и часто не соответствует реальным зарядам на атомах в молекулах (рис. 108).
При определении степеней окисления элементов в соединениях соблюдают следующие правила.
• Степень окисления элемента в простом веществе равна нулю.
• Фтор — самый электроотрицательный химический элемент, поэтому степень окисления фтора во всех веществах, кроме F2, равна –1.
• Кислород — самый электроотрицательный элемент после фтора, поэтому степень окисления кислорода во всех соединениях, кроме фторидов, отрицательна: в большинстве случаев она равна –2, а в пероксиде водорода H2O2 –1.
• Степень окисления водорода равна +1 в соединениях с неметаллами, –1 в соединениях с металлами (гидридах); нулю в простом веществе H2.
• Степени окисления металлов в соединениях всегда положительны. Степень окисления металлов главных подгрупп, как правило, равна номеру группы. Металлы побочных подгрупп часто имеют несколько значений степени окисления.
• Максимально возможная положительная степень окисления химического элемента равна номеру группы (исключение — C
• Сумма степеней окисления всех атомов в молекуле равна нулю.
1.По структурной формуле определите валентности всех элементов в молекуле хлорметана CH3Cl:
2.Определите валентность серы в следующих соединениях по их структурным формулам:
3.Какая валентность наиболее характерна для атомов лития, бериллия и бора? Учтите возможность распаривания электронов внешнего уровня.
4.Определите степени окисления элементов в ионных соединениях: LiF, MgF2, AlF3, K2O, MgO, BaCl2, K3N, Ca3N2.
5.Определите степени окисления элементов в водородных соединениях: CH4, NH3, H2S, HCl.
6.Определите степени окисления неметаллов в оксидах: Cl2O, CO, N2O3, CO2, P2O5, SO3, Cl2O7.
7.Изобразите структурные формулы следующих молекул: O2, H2O, OF2, H2O2. Определите валентности и степени окисления кислорода в этих молекулах.
8.Определите валентности и степени окисления элементов в простых веществах по их формулам: H2, N2, Cl2, S8. Структурная формула молекулы S8:
9.Приведите формулы веществ, в которых степени окисления водорода и углерода равны их валентностям.
10.Приведите по две формулы веществ, в которых степени окисления азота и кислорода отличаются от их валентностей.
11.Приведите формулы соединений азота с положительной и отрицательной степенью окисления этого химического элемента.
12.Рассчитайте степени окисления углерода в соединениях: CH4, CH3Cl, CH2Cl2, CHCl3, CCl4, если степень окисления водорода равна +1, хлора –1. Углерод во всех этих молекулах четырёхвалентен.
Что такое степень окисления
Для начала давайте вспомним, как проходят химические связи в молекуле вещества. Взаимодействуя между собой, атомы могут притягивать или отдавать электроны для образования общей электронной пары. Атом с более высокой электроотрицательностью (ЭО) притягивает электроны и приобретает отрицательный заряд, а атом с меньшей ЭО, напротив, отдает электроны и обретает положительный заряд.
Степень окисления — это условный заряд, который предположительно обретет атом после перемещения электронов. Он вычисляется из предположения, что все свободные электроны полностью перемещаются от одного атома к другому и все образованные связи — ионные.
Почему в определении степени окисления мы говорим об условном заряде? Потому что в реальности он может быть другим, а химические связи атома в соединении не обязательно будут ионными. Но мы предполагаем, что все именно так, чтобы немного упростить расчеты. Это помогает в составлении формул и классификаций.
Запомните:
-
Численно степень окисления равна количеству электронов, которые перешли от одного атома к другому.
-
У атома с меньшей ЭО, который отдает электроны, — положительная степень окисления.
-
У атома с большей ЭО, который притягивает электроны, — отрицательная степень окисления.
-
Простые вещества, такие как Cl2, O2 и т. д., имеют степень окисления, равную 0, поскольку смещения электронов в данном случае не происходит.
Получай лайфхаки, статьи, видео и чек-листы по обучению на почту
Узнай, какие профессии будущего тебе подойдут
Пройди тест — и мы покажем, кем ты можешь стать, а ещё пришлём подробный гайд, как реализовать себя уже сейчас
Как рассчитать степень окисления
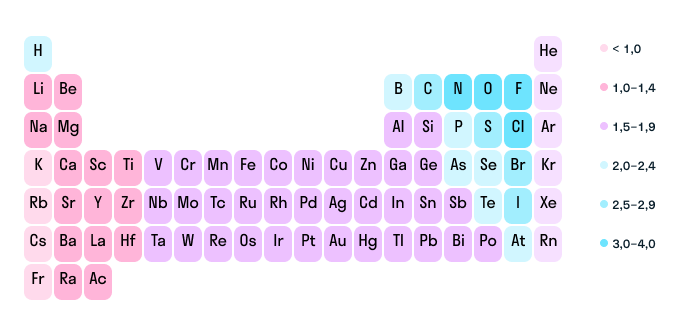
Как мы уже выяснили выше, определить степень окисления элемента (иначе говоря, окислительное число) помогает электроотрицательность. Значения ЭО легко узнать, пользуясь таблицей Менделеева или шкалой относительной электроотрицательности. Сравните, у какого химического элемента в соединении ЭО выше — этот элемент будет притягивать электроны и приобретет отрицательный заряд.
Шкала относительной электроотрицательности
Важно!
В нейтральной молекуле все окислительные числа в сумме образуют ноль. В ионе их сумма равна заряду иона.
Это правило поможет составить уравнение и посчитать степень окисления любого химического элемента в соединении, если известны данные по остальным элементам. Еще больше облегчат расчеты следующие закономерности:
-
у водорода в гидридах окислительное число −1, а во всех остальных веществах оно равно +1;
-
у кислорода степень окисления в оксидах равна −2, в пероксидах −1, в соединениях с фтором +2;
-
у неметаллов в соединениях с водородом и металлами окислительное число всегда отрицательное;
-
у металлов степень окисления всегда положительная.
Также есть элементы, которые во всех соединениях отдают или принимают одинаковое количество электронов, поэтому их окислительное число — постоянная величина.
Алгоритм действий
Итак, мы знаем основные закономерности. Давайте разберемся, как находить степени окисления на примерах. Предлагаем следующий алгоритм действий.
-
Посмотрите, является ли вещество элементарным. Если да — значит, оно находится в химически несвязанном состоянии и окислительное число равно 0. Это правило подходит как для веществ, образованных из отдельных атомов, так и для тех, что включают многоатомные молекулы одного и того же элемента.
-
Пример
Степень окисления Cl2, S8 равна 0.
-
Если это соединение, определите, состоит ли оно из ионов. В многоатомном ионе сумма всех степеней окисления равна его заряду. Узнайте эту сумму из таблицы растворимости и составьте уравнение с известными окислительными числами.
-
Если соединение — нейтральная молекула, составьте уравнение, учитывая, что все окислительные числа в сумме равны 0.
Пример
Допустим, нужно определить заряд азота в ионе аммония.
Согласно таблице растворимости заряд иона аммония NH4+ равен +1. Это значит, что сумма степеней окисления в этом соединении тоже будет равна +1.
Также известно, что водород всюду, кроме гидридов, имеет заряд +1. В данном случае есть 4 атома водорода, т. е. +1 × 4.
Составим формулу: х + (+1) × 4 = +1. Значит х = −3.
Окислительное число азота в ионе аммония равно −3, т. е. N-3H4+1.
Пример
Допустим, нужно определить степень окисления серы в соединении Na2SO4.
Мы знаем, что у щелочного металла Na постоянное окислительное число +1. Кислород, согласно вышеизложенным правилам, в оксидах имеет заряд −2.
Составим уравнение: (+1) × 2 + х + (−2) × 4 = 0. Значит х = +6.
Степень окисления серы равна +6, т. е. Na2+1S+6O4-2.
Как узнать степень окисления нескольких элементов
А как быть, если неизвестны окислительные числа двух и более элементов в соединении? В математике уравнения с двумя неизвестными не всегда имеют решение. Но в химии есть выход: можно разделить химическую формулу на несколько частей, которые имеют постоянные заряды.
Пример
Как вычислить степень окисления в сложном веществе (NH4)2SO4? Посмотрим на него как на соединение двух ионов с известными зарядами: NH4+ и SO42-.
Поскольку мы знаем окислительные числа водорода и кислорода, найти заряды азота и серы в каждом ионе не составит труда.
В ионе NH4+ формула для определения заряда азота будет следующей: х + (+1) × 4 = 1. Понятно, что х = −3, т. е. степень окисления азота −3.
В ионе SO42- формула для серы х + (−2) × 4 = −2. Следовательно, х = 6, т. е. заряд серы равен +6.
Получаем следующие окислительные числа: (N-3H4+1)2S+6O4-2.
Как определить высшую и низшую степень окисления
Выделяют высшую (или максимально положительную) и низшую (максимально отрицательную) степени окисления. В диапазоне между ними располагаются окислительные числа, которые могут принадлежать данному химическому элементу в различных соединениях. Для четных групп характерны четные числа в диапазоне, а для нечетных групп — нечетные.
Высшая степень окисления совпадает с номером группы элемента (для элементов в главной подгруппе) в короткой форме периодической системы.
Низшая степень окисления равна числу, которое получится, если от номера группы элемента отнять 8.
Исключения: фтор, железо, кобальт, родий, подгруппа никеля, кислород, благородные газы (помимо ксенона).
Проиллюстрируем на примере, как найти высшую и низшую степень окисления.
Хлор (Cl), согласно короткой периодической таблице, принадлежит к группе VII. Значит, его максимальное окислительное число будет +7. Такой условный заряд элемент приобретает в оксиде хлора Cl2O7 и хлорной кислоте HClO4. Минимальное число получаем следующим образом: 7 − 8 = −1 (характерно для хлороводорода HCl).
Картинка
По степени окисления можно понять, как поведет себя вещество в окислительно-восстановительных реакциях. Если в соединении главный действующий элемент имеет высшую степень окисления, оно является окислителем, а если он имеет низшую степень окисления — восстановителем.
Например, серная кислота является окислителем, поскольку у серы в данном случае заряд +6. А вот в сернистой кислоте у серы заряд всего +4, поэтому она может проявлять и окислительную способность, и восстановительную. В сероводороде заряд серы равен −2, и это минимальная степень окисления, а значит, данное вещество — восстановитель.
Как найти степень окисления в органическом соединении
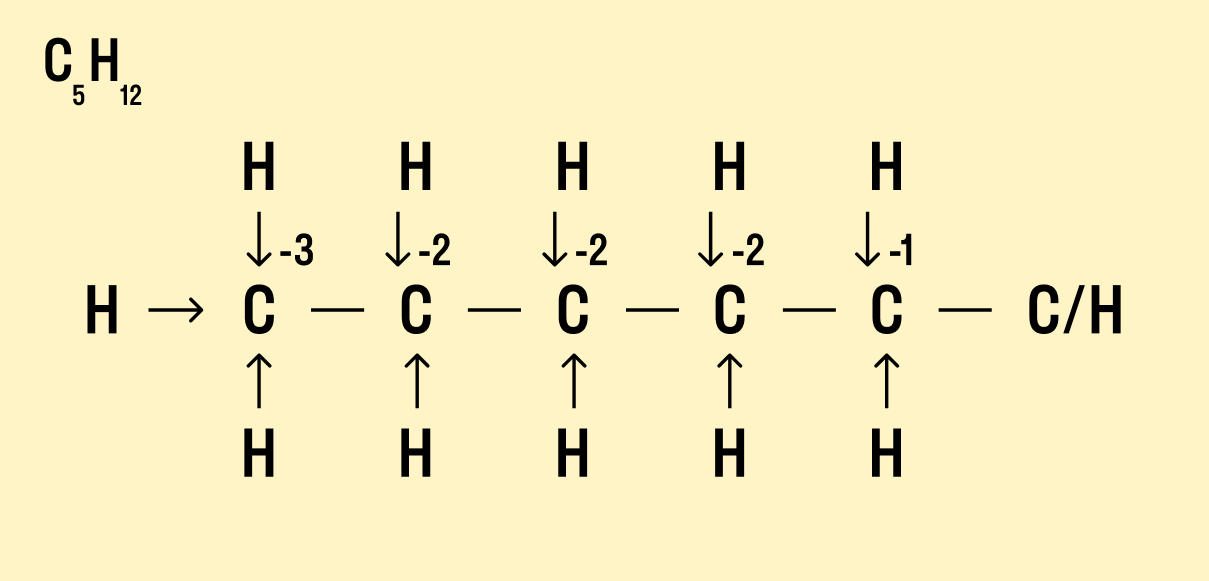
В органической химии определять окислительные числа элементов немного сложнее, поскольку все органические вещества включают углерод, известный большим количеством неполярных связей. Если у нас всего один атом углерода, можно использовать стандартный способ.
Пример
Рассчитайте степень окисления углерода в метаноле H3C−OH.
Мы знаем, что водород Н имеет окислительное число +1, а у кислорода в данном случае оно равно −2. Составим уравнение:
х + (+1) × 4 + (+2) × 1 = 0
х + 4 − 2 = 0
х = −2
Заряд углерода равен −2, т. е. C-2H4+1O-2.
Но что делать, если атомов углерода больше? Придется анализировать структурную формулу, чтобы понять, какие химические связи есть между элементами и сколько электронов они теряют/приобретают в результате. Такой вариант нахождения окислительного числа называют графическим.
Графический метод
-
Нарисуйте структурную формулу соединения.
-
Изобразите стрелками химические связи и смещение атомов (все связи между атомами углерода С−С считайте неполярными).
-
Посчитайте, сколько стрелок ведет к атому (это «−») и сколько от него (это «+»), а затем суммируйте «+» и «−», чтобы узнать степень окисления.
-
валентность не имеет знака, в то время как у окислительного числа он есть («+» или «−»);
-
валентность равна нулю только в том случае, если атом не имеет связей с другими частицами, а степень окисления может быть равна нулю и при наличии таких связей;
-
вычисляя степень окисления, мы предполагаем, что в соединении ионные связи, хотя на самым деле это может быть не так, а валентность всегда имеет реальный смысл.
-
Почему степень окисления называют формальным зарядом, условным?
-
Что отражает численная величина степени окисления?
-
Чему равна сумма всех окислительных чисел в ионе?
-
Как определить низшую степень окисления?
-
Как найти две неизвестных степени окисления в одном веществе?
-
Как определять степени окисления в органических веществах?
Валентность и степень окисления: в чем разница?
Школьники, которые только начали изучать данные разделы химии, нередко путают степень окисления и валентность. Численно эти показатели могут совпадать (но далеко не всегда), а вот по смыслу они в корне различаются.
Важно!
Валентность показывает, какое количество связей способен образовать один атом, а степень окисления — сколько электронов перемещается в результате этих связей.
Между этими двумя понятиями есть следующие отличия:
Поэтому отождествлять эти два понятия ни в коем случае не стоит. Более того, не нужно ориентироваться на валентность, пытаясь определить окислительное число.
Вопросы для самопроверки
frend551
Вопрос по химии:
Можете ли вы помочь, пожалуйста?
Вычислите степени окисления атомов химических элементов в следующих соединениях и запишите их под символом:
1) HCl, CuCl2, FeCl2, CuCl, HgCl2, PCl3, PCl5, SiO2, SO2;
2) SO3, P2O5, PbO, PbO2, N2O5, N2O3, NO2, NO, N2O, MnO, CrO3.
3) Cl2O7, ClO2, CO2, CO, Cr2O3, H2S, FeS, Алюминий и йод3, Al4C3, Al2S3.
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Какая степень окисления у hcl.
Если вам необходимо получить ответ на вопрос Какая степень окисления у hcl?, относящийся
к уровню подготовки учащихся 5 — 9 классов, вы открыли нужную страницу.
В категории Химия вы также найдете ответы на похожие вопросы по
интересующей теме, с помощью автоматического «умного» поиска. Если после
ознакомления со всеми вариантами ответа у вас остались сомнения, или
полученная информация не полностью освещает тематику, создайте свой вопрос с
помощью кнопки, которая находится вверху страницы, или обсудите вопрос с
посетителями этой страницы.