Оксидами называют сложные вещества, состоящие из двух химических элементов, одним из которых является кислород.
В оксидах химический элемент кислород находится в степени окисления (–2).
Оксиды — весьма распространённый в природе класс соединений. Они находятся в воздухе, распространены в гидросфере и литосфере.
Примеры оксидов:
— оксид водорода, или вода.
На Земле вода встречается во всех трёх агрегатных состояниях — газообразном (водяной пар), жидком и твёрдом (лёд, снег). На долю воды также приходится большая часть массы живых организмов.
 |
 |
 |
|
Рис. (1). Вода |
Рис. (2). Пар |
Рис. (3). Лёд |
— оксид углерода((IV)), двуокись углерода или углекислый газ.
Как вы уже знаете, углекислый газ нужен зелёным растениям для фотосинтеза.
Рис. (4). Фотосинтез
Оксид углерода((IV)), находящийся в твёрдом агрегатном состоянии, называют сухим льдом.
|
|
|
Рис. (5). Сухой лёд |
— оксид углерода((II)), угарный газ.
Примесь этого очень ядовитого вещества может содержаться в воздухе. Основным источником загрязнения является транспорт. Угарный газ образуется в результате неполного сгорания топлива. Этот же оксид образуется и во время пожаров.
 |
 |
|
Рис. (6). Горение газа |
Рис. (7). Выхлопные газы |
— оксид железа((III)).
В природе этот оксид встречается в виде минерала гематита. Он составляет основу руды, называемой красным железняком.
|
|
|
Рис. (8). Красный железняк |
— оксид кремния((IV)).
В природе встречается в виде кварцевого песка, кварца, горного хрусталя.
 |
 |
 |
|
Рис. (9). Песок |
Рис. (10). Кварц |
Рис. (11). Горный хрусталь |
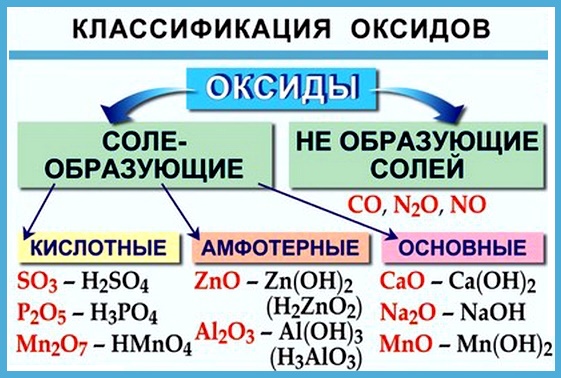
Оксиды принято группировать в зависимости от их способности реагировать с кислотами и основаниями. Различают три важнейшие группы оксидов: основные, кислотные и амфотерные. Их относят к солеобразующим оксидам. Существуют также оксиды, которые называют несолеобразующими.
- Основные оксиды.
Основными называют оксиды, которые реагируют с кислотами, образуя соль и воду.
Основные оксиды образуются химическими элементами — металлами. Как правило, степень окисления элемента, образующего основный оксид, является невысокой: (+1) или (+2).
Примеры основных оксидов:
оксид натрия
Na2O
, оксид меди((II))
CuO
.
- Кислотные оксиды.
Кислотными называют оксиды, которые реагируют с основаниями, образуя соль и воду.
Кислотные оксиды образуют элементы — неметаллы. Например, оксид серы((VI))
SO3
, оксид азота((IV))
NO2
.
Также кислотные оксиды могут быть образованы металлическими химическими элементами, в которых те проявляют степень окисления от (+5) до (+7). Например, оксид хрома((VI))
CrO3
и оксид марганца((VII))
Mn2O7
.
- Амфотерные оксиды.
Амфотерными называют оксиды, которые реагируют как с кислотами, так и с основаниями, образуя соли.
Амфотерные свойства проявляет оксид цинка
ZnO
, оксид алюминия
Al2O3
, оксид бериллия
BeO
.
Если металлический элемент имеет переменную валентность (проявляет несколько степеней окисления), то из всех образуемых им оксидов амфотерными свойствами обладают те, в которых этот элемент имеет промежуточную валентность (промежуточную степень окисления).
Например, хром может проявлять валентность равную двум, трём, шести.
Амфотерными свойствами обладает именно оксид хрома((III))
Cr2O3
.
- Несолеобразующие оксиды.
Несолеобразующие оксиды — оксиды, не реагирующие с кислотами или основаниями при обычных условиях.
К ним относятся: оксид углерода((II))
CO
, оксид кремния((II))
SiO
,оксид азота((I))
N2O
, оксид азота((II))
NO
.
Они не имеют кислотных гидроксидов, не вступают в реакции с образованием солей.
Номенклатура оксидов
В соответствии с номенклатурой ИЮПАК, оксиды называют словом «оксид», после которого следует наименование химического элемента в родительном падеже.
Например:
Na2O
— оксид натрия,
Al2O3
— оксид алюминия.
Если элемент, образующий оксид, имеет переменную степень окисления (или валентность), то в названии оксида указывается его степень окисления римской цифрой в скобках сразу после названия (без пробела).
Например:
Cu2O
— оксид меди((I)),
CuO
— оксид меди((II)),
FeO
— оксид железа((II)),
Fe2O3
— оксид железа((III)),
Cl2O7
— оксид хлора((VII)).
Часто используют и другие наименования оксидов по числу атомов кислорода: если оксид содержит только один атом кислорода, то его называют монооксидом, или моноокисью, если два — диоксидом, или двуокисью, если три — то триоксидом, или трёхокисью и т. д.
Например: монооксид углерода
CO
, диоксид углерода
CO2
, триоксид серы
SO3
.
Также распространены исторически сложившиеся (тривиальные) названия оксидов, например, угарный газ
CO
, серный ангидрид
SO3
и т. д.
Оксиды
(названия, классификация, получение)
Ключевые слова конспекта: оксиды, названия оксидов, классификация оксидов, получение оксидов, химические свойства, степень окисления.
Оксиды — сложные вещества, молекулы которых состоят из атомов двух химических элементов, один из которых — кислород. Атом кислорода в оксидах всегда имеет степень окисления –2. (Подробнее про степень окисления смотрите в конце статьи)
К примеру, оксидом является соединение P2O5. А вот РН3 и H3PO4 — не являются оксидами, потому что в состав РН3 не входит атом кислорода, а в состав H3PO4 входят атомы трёх химических элементов, а не двух.
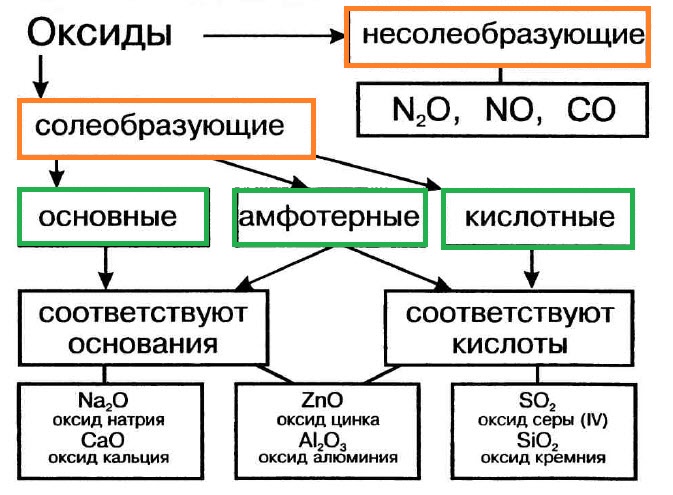
Оксиды подразделяют на солеобразующие (основные, кислотные, амфотерные) и несолеобразующие (безразличные). Особое положение у оксида «вода».
Названия оксидов
Названия оксидов состоят из двух слов: 1-е – «оксид», 2-е – название элемента в родительном падеже. Например, СаО – оксид кальция.
Если оксид образован химическим элементом с переменной валентностью, то после названия элемента, нужно указать его валентность. Например: Fe2О3 — оксид железа (III), FеО — оксид железа (II). Если у элемента постоянная валентность, то ее не обозначают в названии.
Некоторые оксиды имеют особые (тривиальные) названия: Н2О — вода, СО — угарный газ, СО2 — углекислый газ и др.
Если элемент образует оксиды в нескольких степенях окисления, то оксид с наименьшей валентностью – низший оксид, а с наибольшей – высший оксид. Так, оксид хрома (II) СгО – низший оксид, а оксид хрома (VI) СгO3 – высший оксид.
Часто используют и другие наименования оксидов. Например, по числу атомов кислорода (современная международная номенклатура): если оксид содержит только один атом кислорода, то его называют монооксидом (устаревшее — окись), если два — диоксидом (устаревшее — двуокись), если три — то триоксидом (устаревшее — триокись, трёхокись) и т. д.
Современная международная номенклатура оксидов состоит в использовании приставок по числу атомов в формульной единице оксида (моно-, ди-, три-, тетра-, пента-, гекса-, гепта-). Например: монооксид углерода CO, диоксид углерода СО2, триоксид серы SO3.
Про названия окись, закись и перекись смотрите в разделе «Степень окисления» (в конце статьи).
Классификация оксидов
Многие оксиды могут реагировать с кислотами или основаниями. Продуктами таких реакций являются соли. Поэтому такие оксиды называются солеобразующими.
Однако существует небольшая группа оксидов, которые к таким реакциям не способны. Такие оксиды называются несолеобразующими (безразличными): H2O, CO, N2O, NO, F2O. Безразличные оксиды образуются только неметаллами.
Примечание. Не во всех учебниках и литературе встречается такое систематическое название как несолеобразующие оксиды. Например, соединение F2O в одних учебниках называют оксидом фтора. По другой систематизации — окись фтора. Однако, по правилам IUPAC это соединение должно называться фторид кислорода (OF2), потому как так как атом фтора более электроотрицателен чем кислород.
Вот некоторые правила образования солеобразующих оксидов:
- неметаллы образуют только кислотные оксиды;
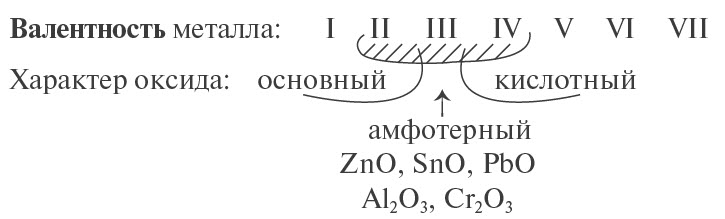
- металлы могут образовывать разные оксиды — основные, амфотерные, кислотные — в зависимости от валентности металла.
Предсказать свойства оксида металла может помочь эта схема.
Основные оксиды металлов от кислотных оксидов металлов отличить легко: малая валентность металла — основный оксид; большая — кислотный. Валентность металлов в амфотерных оксидах — III. Но есть и исключения. Поэтому желательно запомнить формулы наиболее часто встречающихся амфотерных оксидов.
Схема определения типа оксида:
- определить, не является ли данный оксид несолеобразующим;
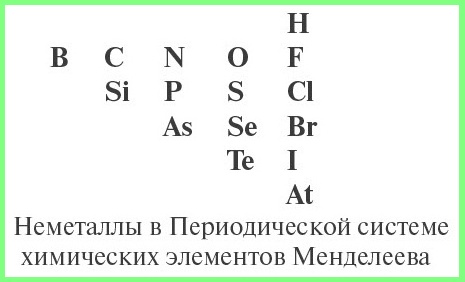
- определить, какой элемент входит в состав оксида: металл или неметалл, для чего нужно знать из таблицы Менделеева символы элементов — неметаллов.
- если в состав оксида входит атом неметалла — то оксид кислотный;
- для атома металла определить валентность, и по схеме определить характер оксида: основный, амфотерный или кислотный.
Например:
- Сг2О3 — амфотерный, так как хром — металл с низкой валентностью III;
- N2O3 — кислотный оксид, так как азот — неметалл;
- CrO3 — кислотный оксид, так как хром — металл с высокой валентностью VI.
Получение оксидов
Oксиды образуются при взаимодействии простых и сложных веществ с кислородом:
4Аl + 3O2 = 2Аl2O3; Si + O2 = SiO2;
SiH4 + 2O2 = SiO2 + 2Н2O; 2Н2S + 3O2 = 2SO2 + 2Н2O.
В реакциях с простыми веществами из одних оксидов могут получаться другие оксиды:
Fe2O3 + С = 2FeO + СО; 2CuO + Н2 = Сu2O + Н2O.
Oксиды образуются при разложении некоторых сложных веществ, обычно при нагревании:
СаСO3 = СаО + СO2; 2Аl(ОН)3 = Аl2O3 + 3Н2O.
Химические свойства оксидов
1. При разложении (при нагревании) неустойчивых оксидов – оксида серебра Ag2O и оксида ртути (II) HgO – образуется соответствующий металл и кислород:
2Ag2O = 4Ag + O2 ↑, 2HgO = 2Hg + O2 ↑.
2. Некоторые oксиды при нагревании образуют другие оксиды. Так, из красного оксида хрома (VI) получается зеленый оксид хрома (III): 4СrO3 = 2Сr2O3 + 3O2 ↑.
3. Некоторые oксиды металлов и неметаллов реагируют с водой:
СаО + Н2O = Са(ОН)2, SO3 + Н2O = Н2SO4.
4. Oксиды металлов обычно реагируют с оксидами неметаллов:
СаО + SO2 = CaSO3, MgO + СO2 = MgCO3.
Реакции оксидов с основаниями, кислотами и солями будут рассмотрены позже.
Оксиды (справочная таблица)
Степень окисления (закись, окись, перекись)
Степень окисления (окислительное число) — вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций. Она указывает на состояние окисления отдельного атома молекулы и представляет собой лишь удобный метод учёта переноса электронов: она не является истинным зарядом атома в молекуле. Понятие степень окисления часто используют в неорганической химии вместо понятия валентность.
Степень окисления атома любого элемента в свободном (несвязанном) состоянии (простое вещество) равна нулю, так, например, атомы в молекулах имеют нулевую степень окисления. Алгебраическая сумма степеней окисления всех атомов в формуле нейтрального соединения всегда равна нулю. Алгебраическая сумма степеней окисления всех атомов в комплексном ионе (катионе либо анионе) должна быть равна его общему заряду.
Степень окисления кислорода равна −2 во всех соединениях, где кислород не образует простой ковалентной связи O—O, то есть в подавляющем большинстве соединений — оксидах. Так, степень окисления кислорода в абсолютном большинстве случаев равна −2 (H2O, H2SO4, NO, CO2 и CH3OH), но в пероксиде водорода (H2O2 или HO—OH), она равна −1.
Закись — низшая степень окисления. Соединение элементов низкой степени окисления с кислородом. Пример: Cu2O — закись меди, оксид меди(I).
Окись — промежуточная степень окисления. Соединение элементов средней степени окисления с кислородом. Пример: СО — окись углерода (бытовое название: угарный газ), оксид углерода (II), монооксид углерода.
Перекись — высшая степень окисления вещества. Соединение элементов высокой степени окисления с кислородом. Пример: Н2О2 — перекись водорода, пероксид водорода (НЕ оксид !)
Пероксиды (перекиси) — соединения, содержащие атомы кислорода, соединённые между собой (O—O), называются пероксидами (перекисями) и супероксидами. Они не относятся к категории оксидов. Пероксиды легко выделяют кислород. Для неорганических веществ рекомендуется использовать термин пероксид, для органических веществ и сегодня в русском языке часто используют термин перекись. Пероксиды многих органических веществ взрывоопасны. Наиболее известна ПЕРЕКИСЬ ВОДОРОДА (HO—OH) — жидкость, состоящая из водорода и кислорода, обычно продается в водных растворах. Раствор перекиси водорода используется как отбеливающие и дезинфицирующие средство. Концентрированная перекись водорода — опасное взрывчатое вещество и используется как окислитель для ракетного топлива.
Вы смотрели конспект урока по химии «Оксиды (названия, классификация, получение, свойства)». Выберите дальнейшее действие:
- Перейти к Списку конспектов по химии (по классам)
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
- Перейти к следующей теме: «Свойства солеобразующих оксидов».
Оксиды — это сложные вещества, состоящие из атомов двух элементов, один из которых — кислород со степенью окисления -2. При этом кислород связан только с менее электроотрицательным элементом.
В зависимости от второго элемента оксиды проявляют разные химические свойства. В школьном курсе оксиды традиционно делят на солеобразующие и несолеобразующие. Некоторые оксиды относят к солеобразным (двойным).
Двойные оксиды — это некоторые оксиды , образованные элементом с разными степенями окисления.
Солеобразующие оксиды делят на основные, амфотерные и кислотные.
Основные оксиды — это оксиды, обладающие характерными основными свойствами. К ним относят оксиды, образованные атомами металлов со степень окисления +1 и +2.
Кислотные оксиды — это оксиды, характеризующиеся кислотными свойствами. К ним относят оксиды, образованные атомами металлов со степенью окисления +5, +6 и +7, а также атомами неметаллов.
Амфотерные оксиды — это оксиды, характеризующиеся и основными, и кислотными свойствами. Это оксиды металлов со степенью окисления +3 и +4, а также четыре оксида со степенью окисления +2: ZnO, PbO, SnO и BeO.
Несолеобразующие оксиды не проявляют характерных основных или кислотных свойств, им не соответствуют гидроксиды. К несолеобразующим относят четыре оксида: CO, NO, N2O и SiO.
Классификация оксидов
Тренировочные тесты по теме Классификация оксидов.
Получение оксидов
Общие способы получения оксидов:
1. Взаимодействие простых веществ с кислородом:
1.1. Окисление металлов: большинство металлов окисляются кислородом до оксидов с устойчивыми степенями окисления.
Например, алюминий взаимодействует с кислородом с образованием оксида:
4Al + 3O2 → 2Al2O3
Не взаимодействуют с кислородом золото, платина, палладий.
Натрий при окислении кислородом воздуха образует преимущественно пероксид Na2O2,
2Na + O2 → Na2O2
Калий, цезий, рубидий образуют преимущественно надпероксиды состава MeO2:
K + O2 → KO2
Примечания: металлы с переменной степенью окисления окисляются кислородом воздуха, как правило, до промежуточной степени окисления (+3):
4Fe + 3O2 → 2Fe2O3
4Cr + 3O2 → 2Cr2O3
Железо также горит с образованием железной окалины — оксида железа (II, III):
3Fe + 2O2 → Fe3O4
1.2. Окисление простых веществ-неметаллов.
Как правило, при окислении неметаллов образуется оксид неметалла с высшей степенью окисления, если кислород в избытке, или оксид неметалла с промежуточной степенью окисления, если кислород в недостатке.
Например, фосфор окисляется избытком кислорода до оксида фосфора (V), а под действием недостатка кислорода до оксида фосфора (III):
4P + 5O2(изб.) → 2P2O5
4P + 3O2(нед.) → 2P2O3
Но есть некоторые исключения.
Например, сера сгорает только до оксида серы (IV):
S + O2 → SO2
Оксид серы (VI) можно получить только окислением оксида серы (IV) в жестких условиях в присутствии катализатора:
2SO2 + O2 = 2SO3
Азот окисляется кислородом только при очень высокой температуре (около 2000оС), либо под действием электрического разряда, и только до оксида азота (II):
N2 + O2 = 2NO
Не окисляется кислородом фтор F2 (сам фтор окисляет кислород). Не взаимодействуют с кислородом прочие галогены (хлор Cl2, бром и др.), инертные газы (гелий He, неон, аргон, криптон).
2. Окисление сложных веществ (бинарных соединений): сульфидов, гидридов, фосфидов и т.д.
При окислении кислородом сложных веществ, состоящих, как правило, из двух элементов, образуется смесь оксидов этих элементов в устойчивых степенях окисления.
Например, при сжигании пирита FeS2 образуются оксид железа (III) и оксид серы (IV):
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
Сероводород горит с образованием оксида серы (IV) при избытке кислорода и с образованием серы при недостатке кислорода:
2H2S + 3O2(изб.) → 2H2O + 2SO2
2H2S + O2(нед.) → 2H2O + 2S
А вот аммиак горит с образованием простого вещества N2, т.к. азот реагирует с кислородом только в жестких условиях:
4NH3 + 3O2 →2N2 + 6H2O
А вот в присутствии катализатора аммиак окисляется кислородом до оксида азота (II):
4NH3 + 5O2 → 4NO + 6H2O
3. Разложение гидроксидов. Оксиды можно получить также из гидроксидов — кислот или оснований. Некоторые гидроксиды неустойчивы, и самопроизвольную распадаются на оксид и воду; для разложения некоторых других (как правило, нерастворимых в воде) гидроксидов необходимо их нагревать (прокаливать).
гидроксид → оксид + вода
Самопроизвольно разлагаются в водном растворе угольная кислота, сернистая кислота, гидроксид аммония, гидроксиды серебра (I), меди (I):
H2CO3 → H2O + CO2
H2SO3 → H2O + SO2
NH4OH → NH3 + H2O
2AgOH → Ag2O + H2O
2CuOH → Cu2O + H2O
При нагревании разлагаются на оксиды большинство нерастворимых гидроксидов — кремниевая кислота, гидроксиды тяжелых металлов — гидроксид железа (III) и др.:
H2SiO3 → H2O + SiO2
2Fe(OH)3 → Fe2O3 + 3H2O
4. Еще один способ получения оксидов — разложение сложных соединений — солей.
Например, нерастворимые карбонаты и карбонат лития при нагревании разлагаются на оксиды:
Li2CO3 → CO2 + Li2O
CaCO3 → CaO + CO2
Соли, образованные сильными кислотами-окислителями (нитраты, сульфаты, перхлораты и др.), при нагревании, как правило, разлагаются с с изменением степени окисления:
2Zn(NO3)2 → 2ZnO + 4NO2 + O2
Более подробно про разложение нитратов можно прочитать в статье Окислительно-восстановительные реакции.
Химические свойства оксидов
Значительная часть химических свойств оксидов описывается схемой взаимосвязи основных классов неорганических веществ.
Химические свойства основных оксидов
Подробно про химические свойства оксидов можно прочитать в соответствующих статьях:
Химические свойства основных оксидов.
Химические свойства кислотных оксидов.
Химические свойства амфотерных оксидов.
|
§ 17 |
Валентность. Составление формул оксидов |
Вы, наверное, обратили внимание на то, что оксиды различных химических элементов по составу отличаются друг от друга. Например, на один атом кислорода в воде H2O приходятся два атома водорода, а в оксиде магния MgO — один атом магния. Как это можно объяснить?
В XIX в. учёные предположили, что атомы разных элементов обладают различной способностью присоединять к себе другие атомы. Так, атом водорода может присоединить лишь один атом другого химического элемента, кислород — два атома, азот — три. В настоящее время известно, что атомы, входящие в состав молекул, соединены между собой химическими связями в определённой последовательности. Чтобы показать это, используют структурные формулы, выражающие не только число атомов, но и последовательность их соединения. Химические связи между атомами в молекулах принято обозначать чёрточками.
Число связей, которые данный атом образует с другими атомами, называют валентностью.
Слово «валентность» в переводе с латинского означает «сила, способность».
Изобразим структурную формулу воды:
Обратите внимание на то, что атомы водорода в молекуле воды не связаны друг с другом, а соединены только с атомом кислорода. Каждый атом водорода образует одну химическую связь (от символа H отходит одна чёрточка) — он одновалентен. Атом кислорода образует две связи — он двухвалентен. Число чёрточек, отходящих от символа химического элемента в структурной формуле, и есть валентность данного атома.
Установлено, что и в других соединениях водород всегда одновалентен, т. е. атомы водорода образуют лишь одну связь. Валентность кислорода всегда равна двум.
В молекуле углекислого газа CO2 атом углерода образует с каждым атомом кислорода две двойные связи, которые равноценны четырём одинарным (четыре чёрточки в структурной формуле), следовательно, углерод в этом веществе четырёхвалентен:
O

Зная валентность одного химического элемента в соединении, можно определить валентность другого. Так, хлор в хлороводороде HCl одновалентен, азот в аммиаке NH3 трёхвалентен, а валентность углерода в метане CH4 равна четырём:
Для обозначения валентности обычно используют римские цифры, которые ставят в формуле над символом химического элемента:
Чтобы подсчитать валентность, нет необходимости каждый раз рисовать структурные формулы. Легко заметить, что в соединении общее число единиц валентности всех атомов одного элемента всегда равно общему числу единиц валентности всех атомов другого элемента. Иными словами, произведение числа атомов одного элемента на его валентность равно произведению числа атомов второго элемента на его валентность.
Таблица 4
|
Последовательность действий |
Составление формулы |
|
|
Указать валентность кислорода |
|
|
|
Умножить число атомов кислорода на численное значение его валентности (II) |
3•2 = 6 |
2•2 = 4 |
|
Разделить полученное значение на индекс, показывающий число атомов другого элемента |
6 : 2 = 3 |
4 : 1 = 4 |
|
Записать значение валентности над символом этого элемента |
|
|
Например:

Для углерода (число атомов равно 1): IV•1 = 4;
для кислорода (число атомов равно 2): II•2 = 4.
Чтобы определить валентность элемента в оксиде по формуле, необходимо провести следующие математические вычисления (табл. 4).
Некоторые химические элементы проявляют в соединениях постоянную валентность (табл. 5), её надо запомнить, другие — переменную.
Химические элементы с постоянной валентностьюТаблица 5
|
Валентность |
Химические элементы |
|
I |
H, Na, K, Ag |
|
II |
O, Mg, Ca, Ba, Zn |
|
III |
Al |
Таблица 6
|
Последовательность действий |
Составление формулы |
|
|
Записываем символы химических элементов (кислород на втором месте) и указываем их валентность (кислород двухвалентен, валентность второго элемента либо дана в названии, либо постоянна и приведена в таблице 5) |
Оксид алюминия |
Оксид углерода(IV) |
|
Находим наименьшее общее кратное двух числовых значений валентности |
III и II ⇒ 6 |
IV и II ⇒ 4 |
|
Находим индексы, поделив наименьшее общее кратное на численные значения валентности данного элемента |
6 : 3 = 2 (Al) 6 : 2 = 3 (O) |
4 : 4 = 1 (C) 4 : 2 = 2 (O) |
|
Записываем индексы после знаков химических элементов |
Al2O3 |
CO2 |
Обратите внимание, что значения валентности многих металлов совпадают с номерами групп Периодической системы химических элементов Д. И. Менделеева, в которых они находятся.
Значение переменной валентности принято указывать в скобках в названии соединения, например: 

Рассмотрим, как можно составить формулу оксида по его названию (табл. 6).
Понятие о валентности возникло на заре современной химии, поэтому его использование в настоящее время вызывает много вопросов. Как, например, определить валентность атомов в простых веществах? В железе при комнатной температуре у каждого атома 8 ближайших соседей (см. рис. 23, а). Означает ли это, что железо восьмивалентно? Как быть с другими веществами немолекулярного строения? Так, оксиды металлов, как правило, не образуют молекул. Строение того же оксида алюминия Al2O3 лишь формально можно изобразить структурной формулой O



1.Дайте определение понятия «валентность».
2.Зная, что водород одновалентен, определите валентность химических элементов по формулам соединений: NaH, CaH2, AlH3, CH4, PH3, H2S, HF.
3.Определите валентность элементов по формулам оксидов и назовите вещества: P2O5, SO2, SO3, NO, Na2O, CaO, Mn2O7, SnO2, I2O5, H2O.
4.Напишите формулы следующих оксидов: оксида магния, оксида фосфора(III), оксида калия, оксида хлора(IV), оксида железа(III), оксида меди(II), оксида кремния(IV), оксида хлора(VII), оксида цинка, оксида алюминия, оксида водорода, оксида золота(III).
5.В соединениях с кислородом марганец проявляет валентности II, III, IV, VII. Составьте формулы этих оксидов и назовите их.
6.Хлор образует четыре оксида, в которых он проявляет валентности I, III, V и VII. Составьте формулы этих соединений и назовите их.
7.При горении магния, цинка и алюминия в кислороде образуются их оксиды. Составьте формулы этих соединений, напишите уравнения реакций.
В уроке 31 «Оксиды» из курса «Химия для чайников» познакомимся с оксидами их классификацией, а также узнаем где они встречаются в природе.
Все неорганические вещества делятся на несколько классов, важнейшими из которых являются оксиды, кислоты, основания и соли. Первоначальные сведения об этих веществах вы уже получили. Теперь вам предстоит познакомиться с ними более подробно и систематизировать свои знания.
Вы уже знаете, что самым распространенным элементом на Земле является кислород. Его атомы, соединяясь с атомами других элементов, образуют огромное количество сложных неорганических веществ, среди которых важное место занимают оксиды.
Состав оксидов
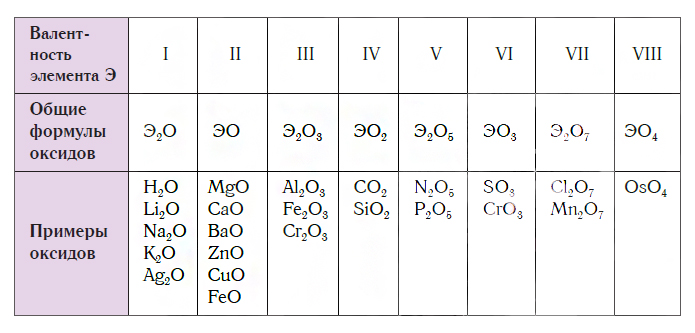
В состав любого оксида входят атомы двух химических элементов, один из которых — кислород, например: Н2О, Al2O3, Р2О5, CuO, Cl2O7. Всего известно около трехсот разных оксидов. Их общая химическая формула — ЭxOy, где буква Э обозначает символ химического элемента, образующего оксид, О — символ кислорода, а буквы x и y — индексы, обозначающие число атомов в молекулах или в формульных единицах оксидов.
Поскольку валентность атомов кислорода в оксидах всегда равна II, а валентность атомов других элементов принимает значения от I до VIII, состав оксидов выражается формулами, приведенными в следующей таблице.
Классификация оксидов
Поскольку оксидов известно очень много, возникает необходимость классификации этих веществ по их химическим свойствам, т. е. по способности превращаться в другие вещества.
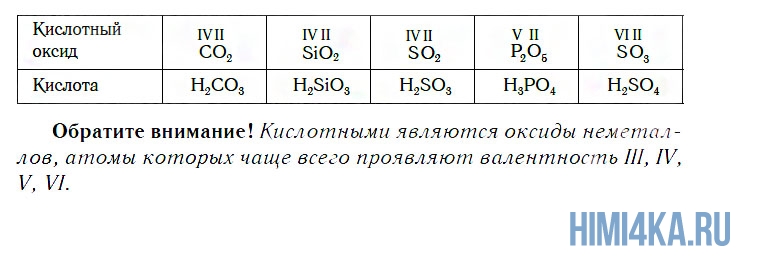
Вы уже знаете, что оксиды могут реагировать с водой, превращаясь при этом в соединения двух типов — кислоты и основания. Так, например, оксид фосфора(V) P2O5, присоединяя воду, превращается в кислоту H3PO4:
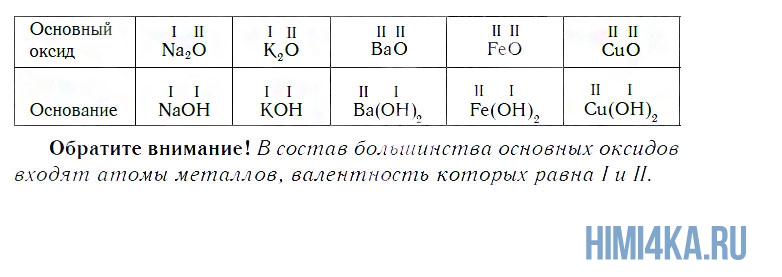
а оксид кальция CaO, взаимодействуя с водой, превращается в основание Ca(OH)2:
Иначе говоря, оксиду фосфора соответствует кислота, а оксиду кальция соответствует основание. Исходя из этого, оксиды можно разделить на две большие группы — кислотные и основные оксиды.
К кислотным относятся оксиды, которым соответствуют кислоты. Наряду с Р2О5, кислотными являются также оксиды: CO2, SiO2, SO2, N2O5, SO3 и некоторые другие. Всем им соответствуют кислоты.
К основным относятся оксиды, которым соответствуют основания. Кроме СaO, основными являются оксиды: Na2O, K2O, BaO, FeO, CuO и ряд других. Всем этим оксидам соответствуют основания.
Оксиды в природе
Оксиды содержатся в каждой из трех оболочек нашей планеты — в атмосфере, гидросфере, литосфере.
Самым распространенным оксидом в атмосфере и гидросфере является вода H2O, а в литосфере — оксид кремния(IV) SiO2, встречающийся в виде красивых кристаллов кварца (рис. 116) и кварцевого песка.
Краткие выводы урока:
- Оксиды делятся на кислотные и основные. Кислотным оксидам соответствуют кислоты, а основным — основания.
- Оксиды широко распространены в природе.
Надеюсь урок 31 «Оксиды» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.