Физические свойства
Оксид натрия Na2O — бинарное неорганическое вещество. Белое вещество, термически устойчивое, тугоплавкое.
Относительная молекулярная масса Mr = 61,98; относительная плотность для тв. и ж. состояния d = 2,36; tпл = 1132º C при избыточном давлении
Способ получения
1. Оксид натрия можно получить путем взаимодействия натрия и гидроксида натрия при 600º С, в результате образуется оксид натрия и водород:
2Na + 2NaOH = 2Na2O + H2
2. Оксид натрия получается при разложении пероксида натрия при температуре 400–675º C и вакууме. В результате разложения образуется оксид натрия и кислород:
2Na2O2 = 2Na2O + O2
3. Путем реакции между пероксидом натрия и натрием при 130–200º C в атмосфере аргона :
Na2O2 + 2Na = 2Na2O
Химические свойства
1. Оксид натрия может взаимодействовать с простыми веществами:
1.1. Оксид натрия взаимодействует с кислородом при 250–350º C и повышенном давлении с образованием пероксида натрия:
2Na2O + O2 = 2Na2O2
2. Оксид натрия взаимодействует со сложными веществами:
2.1. Оксид натрия реагирует с водой. Образуется гидроксид натрия:
Na2O + H2O = 2NaOH
2.2. Оксид натрия взаимодействует с кислотами. При этом образуются соль и вода.
Например, оксид натрия с соляной кислотой образует хлорид натрия и воду:
Na2O + 2HCl = 2NaCl + H2O.
2.3. При взаимодействии натрия с оксидами образуются соли.
2.3.1. Реагируя с углекислым газом при 450–550º C оксид натрия образует карбонат натрия:
Na2O + CO2 = Na2CO3
2.3.2. При 250º C, в результате взаимодействия оксида натрия, и оксидов азота образуется нитрат натрия:
Na2O + NO + NO2 = 2NaNO2
2.3.3. Оксид натрия взаимодействует с оксидом алюминия при 1200º С. При это образуется алюминат натрия:
Na2O + Al2O3 = 2NaAlO2

Онлайн калькуляторы
На нашем сайте собрано более 100 бесплатных онлайн калькуляторов по математике, геометрии и физике.

Справочник
Основные формулы, таблицы и теоремы для учащихся. Все что нужно, чтобы сделать домашнее задание!

Заказать решение
Не можете решить контрольную?!
Мы поможем! Более 20 000 авторов выполнят вашу работу от 100 руб!
Формула оксида натрия
Определение и формула оксида натрия
Химическая формула –
Молярная масса равна г/моль.
Физические свойства – белое термически устойчивое тугоплавкое твердое вещество.
Химические свойства оксида натрия
- При нагревании выше
разлагается на пероксид натрия и натрий:
- Энергично взаимодействует с водой с образованием сильнощелочного раствора:
- Поскольку является основным оксидом, то реагирует с кислотами и кислотными оксидами:
- При высокой температуре реагирует с оксидом алюминия:
Получение
Один из способов получения оксида натрия основан на разложение пероксида натрия при сильном нагревании:
Также оксид натрия образуется при взаимодействии натрия с гидроксидом натрия:
При термическом разложении карбоната натрия также образуется оксид натрия:
Применение
Оксид натрия, как правило, используется в качестве реактива для различных неорганических синтезов, а именно в основном для получения гидроксида натрия.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |
Оксид натрия, характеристика, свойства и получение, химические реакции.
Оксид натрия – неорганическое вещество, имеет химическую формулу Na2O.
Краткая характеристика оксида натрия
Физические свойства оксида натрия Иные свойства оксида натрия
Получение оксида натрия
Химические свойства оксида натрия
Химические реакции оксида натрия
Применение и использование оксида натрия
Краткая характеристика оксида натрия:
Оксид натрия – неорганическое вещество бесцветного либо белого цвета.
Так как валентность натрия равна одному, то оксид натрия содержит один атом кислорода и два атома натрия.
Химическая формула оксида натрия Na2O.
Оксид натрия в воде не растворяется, а вступает в реакцию с ней. Не растворяется в этаноле, вступает с ним в реакцию.
Оксид натрия относится к опасным веществам. Это едкое вещество, особенно опасен при смешивании с водой.
Физические свойства оксида натрия:
| Наименование параметра: | Значение: |
| Химическая формула | Na2O |
| Синонимы и названия иностранном языке | sodium oxide (англ.)
окись натрия (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | порошок белого цвета либо бесцветные кристаллы |
| Цвет | бесцветный, белый |
| Вкус | —* |
| Запах | — |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 2270 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 2,27 |
| Температура кипения, °C | 1950 |
| Температура плавления, °C | 1132 |
| Температура возгонки (сублимации), °C | 1275 |
| Температура разложения, °C | не имеет |
| Молярная масса, г/моль | 61,979 |
* Примечание:
— нет данных.
Получение оксида натрия:
Оксид натрия получается в результате следующих химических реакций:
- 1. из пероксида натрия:
При реакции натрия с кислородом образуется смесь, состоящая из 20 % оксида натрия и 80 % пероксида натрия.
6Na + 2О2 → Na2О2 + 2Na2О.
Затем пероксид натрия обогащают натрием.
Na2О2 + 2Na → 2Na2О.
- 2. путем нагревания нитрата (нитрита) натрия с металлическим натрием:
2NaNО3 + 10Na → 6Na2О + N2;
2NaNO2 + 6Na → 4Na2O + N2.
- 3. путем взаимодействия гидроксида натрия с металлическим натрием:
2NaOH + 2Na → 2Na2O + H2.
- 4. путем прокаливания карбоната натрия:
2Na2СO3 → Na2O + СО2 (t = 851 oC).
Химические свойства оксида натрия. Химические реакции оксида натрия:
Химически активное вещество.
Химические свойства оксида натрия аналогичны свойствам оксидов других щелочных металлов. Поэтому для него характерны следующие химические реакции:
- 1. реакция оксида натрия с кислородом:
2Na2O + O2 → 2Na2O2 (t = 250-350 oC, p).
В результате реакции образуется пероксид натрия.
- 2. реакция оксида натрия с водой:
Na2О + Н2О → 2NaОН.
Оксид натрия бурно реагирует с водой, образуя гидроксид натрия.
- 3. реакция оксида натрия с оксидом углерода (углекислым газом):
Na2О + СО2 → Na2СО3 (t = 450-550°C).
Оксид натрия реагирует с углекислым газом (являющийся кислотным оксидом), образуя соль – карбонат натрия.
- 4. реакция оксида натрия с оксидом серы:
Na2О + SО2 → Na2SО3;
Na2О + SО3 → Na2SО4.
Оксид серы также является кислотным оксидом. В результате реакции образуется соответственно соль – в первом случае – сульфит натрия, во втором случае – сульфат натрия.
- 5. реакция оксида натрия с оксидом кремния:
Na2О + SiО2 → Na2SiО3 (tо).
Оксид кремния также является кислотным оксидом. В результате реакции образуется соль – силикат натрия.
- 6. реакция оксида натрия с оксидом фосфора:
3Na2O + P2O5 → 2Na3PO4.
Оксид фосфора также является кислотным оксидом. В результате реакции образуется соль – ортофосфат натрия.
Аналогично проходят реакции оксида натрия и с другими кислотными оксидами.
- 7. реакция оксида натрия с оксидом алюминия:
Na2О + Al2O3 → 2NaAlО2 (t = 2000 °C).
Оксид алюминия является амфотерным оксидом. Это значит, что как амфотерный оксид оксид алюминия проявляет свойства как кислотных, так и основных соединений. В результате реакции образуется соль – алюминат натрия.
Аналогично проходят реакции оксида натрия и с другими амфотерными оксидами.
- 8. реакция оксида натрия с оксидом меди:
Na2О + CuO → 2Na2CuО2 (t = 800-1000 °C, O2).
В результате реакции образуется соль – купрат натрия.
- 9. реакция оксида натрия с оксидом железа:
5Na2О + Fe2O3 → 2Na5FeО4 (t = 450-500 °C).
В результате реакции образуется соль – феррат натрия.
- 10. реакция оксида натрия с оксидом свинца:
Na2О + PbO → 2Na2PbО2 (tо).
В результате реакции образуется соль – плюмбит натрия.
Аналогично проходят реакции оксида натрия и с другими оксидами.
- 11. реакция оксида натрия с оксидом азота (II) и оксидом азота (IV):
Na2О + NО + NО2 → NaNO3 + 2NaNO2 (t = 250 °C).
В результате реакции образуются соль нитрит натрия.
- 12. реакция оксида натрия с плавиковой кислотой:
Na2O + 2HF → 2NaF + H2O.
В результате химической реакции получается соль – фторид натрия и вода.
- 13. реакция оксида натрия с азотной кислотой:
Na2O + 2HNO3 → 2NaNO3 + H2O.
В результате химической реакции получается соль – нитрат натрия и вода.
Аналогично проходят реакции оксида натрия и с другими кислотами.
- 14. реакция оксида натрия с бромистым водородом (бромоводородом):
Na2O + 2HBr → 2NaBr + H2O.
В результате химической реакции получается соль – бромид натрия и вода.
- 15. реакция оксида натрия с йодоводородом:
Na2O + 2HI → 2NaI + H2O.
В результате химической реакции получается соль – йодид натрия и вода.
- 16. реакция оксида натрия с жидким аммиаком:
Na2O + NH3 → NaОН + NaNH2 (t = -50 oC).
В результате химической реакции получается гидроксид натрия и амид натрия.
- 17. реакция термического разложения оксида натрия:
2Na2O → Na2O2 + 2Na (t > 700 oC).
Оксид натрия в результате термического разложения разлагается на пероксид натрия и натрий.
Применение и использование оксида натрия:
Оксид натрия используется в качестве реактива для различных синтезов, для приготовления гидроксида натрия и других веществ.
Примечание: © Фото //www.pexels.com, //pixabay.com
оксид натрия реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие оксида натрия
реакции с оксидом натрия
Коэффициент востребованности
8 881
Как получить оксид натрия
Оксид натрия имеет химическую формулу Na2O, представляет собою бесцветные кристаллы. Характерный представитель оксидов щелочных металлов, обладает всеми их свойствами. Исключительно активен, поэтому хранить его рекомендуется в безводных органических растворителях. Как получить это вещество?

Инструкция
Казалось бы, самый простой и естественный способ – окисление кислородом металлического натрия! Однако тут есть своя специфика. Дело в том, что окисление щелочных металлов протекает так бурно и быстро, что при этом наряду с оксидами образуются перекиси. Например:
2Na + O2 = Na2O2 (перекись натрия).
Причем ее образуется гораздо больше, чем оксида натрия (в соотношении примерно 4:1). И для того, чтобы превратить перекись в оксид натрия, потребуется осторожный нагрев в присутствии металлического натрия. Реакция идет таким образом:
Na2O2 + 2Na = 2Na2O
Поэтому используют другие способы получения этого вещества. Например, путем реакции металлического натрия с натрием азотнокислым (нитратом натрия, натриевой селитрой). Она протекает так:
2NaNO3 + 10Na = 6Na2O + N2В ходе этой реакции металлический натрий восстанавливает азот, имеющий в нитрат-ионе степень окисления +5, до чистого азота.
Оксид натрия можно получить также путем прокаливания натрия углекислого (карбоната) при высоких температурах (не ниже 1000 градусов). Реакция идет следующим образом:
Na2CO3 = Na2O + CO2
Весьма экзотический и к тому же небезопасный, поэтому не рекомендуемый способ получения этого вещества: нагреванием смеси азид натрия – нитрат натрия в вакууме, при температуре не ниже 350 градусов. Реакция протекает так:
5NaN3 + NaNO3 = 8N2+3Na2O
Обратите внимание
Учитывая, что все азиды – взрывоопасные вещества, эту реакцию можно проводить, только имея большой опыт обращения с подобными соединениями! Но лучше воздержаться.
Полезный совет
Бурно реагирует с водой, образуя раствор гидроксида натрия (едкого натра):
Na2O + H2O = 2NaOH
Легко вступает в реакцию с кислотами, образуя соль и воду:
Na2O + H2SO4 = Na2SO4 + H2O
Реагирует с кислотными оксидами, образуя соль:
Na2O + CO2 = Na2CO3
Используется главным образом в лабораторной практике, для демонстрационных опытов, а также в качестве реактива. Иногда применяется в производстве масел, в качестве катализатора.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
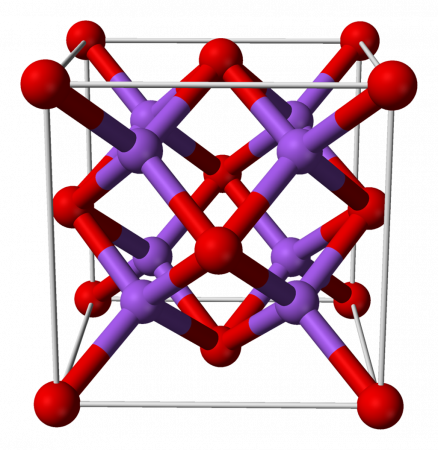
| Оксид натрия | |
|---|---|
 |
|
| Систематическое наименование |
Оксид натрия |
| Традиционные названия | Окись натрия |
| Хим. формула | Na2O |
| Рац. формула | Na2O |
| Состояние | твёрдое |
| Молярная масса | 61,979 г/моль |
| Плотность | 2,27 (20 °C) |
| Температура | |
| • плавления | 1132 °C |
| • кипения | 1950 °C |
| Энтальпия | |
| • образования | −416 кДж/моль |
| Рег. номер CAS | 1313-59-3 |
| PubChem | 73971 |
| Рег. номер EINECS | 215-208-9 |
| SMILES |
[O-2].[Na+].[Na+] |
| InChI |
1S/2Na.O/q2*+1;-2 KKCBUQHMOMHUOY-UHFFFAOYSA-N |
| Номер ООН | 1825 |
| ChemSpider | 66599 |
| Пиктограммы ECB | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Оксид натрия — бинарное неорганическое вещество, имеющее формулу Na2O и относящееся к классу основных оксидов.
Описание
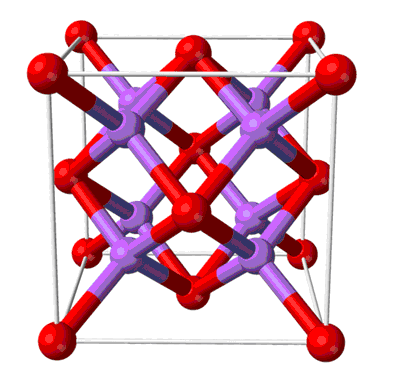
Оксид натрия представляет собой бесцветные кристаллы кубической сингонии. Хранить оксид натрия Na2O лучше всего в безводном бензоле.
Получение
1. Взаимодействие металлического натрия с кислородом:
-
- 4 Na + O2 ⟶ 2Na2O
Чистый оксид натрия получить непосредственным окислением натрия нельзя, так как образуется смесь, состоящая из 20 % оксида натрия и 80 % пероксида натрия:
-
- 6 Na + 2 O2 ⟶ 2Na2O + Na2O2
2. Взаимодействие металлического натрия с нитратом натрия:
-
- 10 Na + 2NaNO3 ⟶ 6Na2O + N2
3. Прокаливание пероксида натрия с избытком натрия:
-
- Na2O2 + 2 Na ⟶ 2Na2O
Химические свойства
1. Взаимодействие с водой с образованием щёлочи:
-
- Na2O + H2O ⟶ 2 NaOH
2. Взаимодействие с кислотными оксидами с образованием соли:
-
- Na2O + CO2 ⟶ Na2CO3
3. Взаимодействие с кислотами с образованием соли и воды:
-
- Na2O + 2 HCl ⟶ 2 NaCl + H2O
Применение
Оксид натрия применяется, в основном, в качестве реактива для различных синтезов, для приготовления гидроксида натрия и других веществ.
