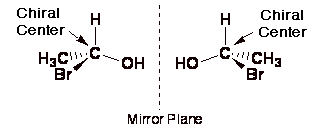
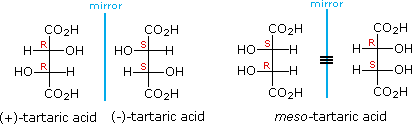A chiral centre is an atom that has four different groups bonded to it in such a manner that it has a nonsuperimposable mirror image.
The term «chiral centre» has been replaced by the term chirality centre.
In the molecule below, the carbon atom is a chirality centre.
It has four different groups attached, and the two structures are nonsuperimposable mirror images of each other.
Molecules with a single chirality centre are chiral.
Molecules with more than one chirality centre are usually chiral. The exceptions are meso compounds.
For example, tartaric acid has two chirality centres, so you would expect it to have #2^2 = 4# stereoisomers.
But there are only three isomers.
The (#S,R#) and (#R,S#) isomers are a single meso compound because they are superimposable on each other. They are achiral because they have an internal plane of symmetry.
The most common chirality centres in organic molecules are sp³ hybridized carbon atoms, because they can form four bonds.
Other types of chirality centre are
- quaternary N atoms
- tetravalent P atoms
Many nerve gases contain chiral P atoms.
- sulfoxides
In sulfoxides, the fourth group is a lone pair. Unlike in amines, the energy required to invert this stereocentre is high, so sulfoxides are optically stable.
Содержание
- Что такое киральный углерод
- Как определить хиральный углерод
- Почему важно определить хиральный углерод
Изомерия является одной из основных областей в органической химии, которая имеет широкий набор молекул, перечисленных под ним. Два типа изомерии — структурная изомерия и стереоизомерия. Концепция хиральности подпадает под стереоизомеризм, В отличие от структурной изомерии, стереоизомерия включает молекулы, имеющие одинаковое строение атомов, но различные пространственные расположения. хиральности является свойством молекулы, которая говорит, что ее зеркальное отображение не накладывается на молекулу. Хиральность определенной молекулы определяется хиральными центрами, присутствующими в этой молекуле. В органической химии хиральные центры называют хиральными углеродами.
Ключевые области покрыты
1. Что такое киральный углерод
– Определение, характеристики
2. Как определить хиральный углерод
– Методы идентификации хиральных углеродов в алифатической структуре и кольцевой структуре
3. Почему важно определить хиральный углерод
Ключевые слова: алифатическая структура, хиральность, хиральный углерод, хиральный центр, кольцевая структура, стереоизомерия
Что такое киральный углерод
Хиральный углерод представляет собой асимметричный углерод. Атом углерода может иметь максимум четыре связи. Хиральный углерод связан с четырьмя различными группами. Поэтому он асимметричный. Атом углерода всегда должен быть sp3 гибридизуется, чтобы стать хиральным углеродом. Обычно хиральная молекула содержит по меньшей мере один хиральный углерод.Гибридизированные атомы углерода sp или sp2 не могут быть хиральными, поскольку они не могут иметь вокруг себя четыре различные группы из-за наличия π-связей.
Молекулы, имеющие более одного хирального атома углерода, имеют два стереоизомера на один хиральный атом углерода. Следовательно, молекулы такого типа могут иметь более двух стереоизомеров. Например, молекула, имеющая два хиральных углерода, по существу имеет четыре стереоизомера, по два на каждый хиральный углерод.
Как определить хиральный углерод
Как определить хиральный углерод в алифатических структурах
Хиральный углерод, присутствующий в молекуле, может быть идентифицирован в два этапа следующим образом.
Шаг 1
Определите геометрию молекулы, взяв атом, который считается хиральным углеродом в центре.
— Если геометрия вокруг атома углерода является тетраэдрической, то это может быть хиральный углерод. Если геометрия не тетраэдрическая, то она ахиральная.
Шаг 2
Определите, отличаются ли четыре группы, связанные с этим атомом углерода, друг от друга.
— Если атом углерода с тетраэдрическим расположением присоединен к четырем различным группам, это хиральный углерод.
Рисунок 1: Хиральная молекула и ее зеркальное отображение
В приведенном выше примере молекула имеет тетраэдрическую геометрию, и центральный атом углерода присоединен к четырем различным атомам. Следовательно, этот углерод является хиральным углеродом.
Как определить хиральный углерод в кольцевых структурах
Для кольцевой структуры с замещениями хиральность атома углерода может быть определена следующим образом. Рассмотрим следующий пример.
Рисунок 2: Метилциклогексан
Шаг 1
Сначала определите, отличаются ли группы, присоединенные к атому углерода, друг от друга. Если они разные, мы можем догадаться, что это как хиральный углерод. На изображении выше молекула имеет атом водорода и метильную группу, присоединенную к одному и тому же атому углерода. Но две другие группы сформировали кольцо.
Шаг 2
Преобразуйте две группы в кольце в гипотетические группы, не входящие в кольцо. Самый простой способ сделать это — разорвать связь между атомом, который, как предполагается, является хиральным углеродом, и соседним атомом углерода с левой стороны и представить его как лиганд. Затем разорвите соседнюю связь с правой стороны и представьте ее как другой лиганд.
Шаг 3
Теперь мы можем определить, является ли предполагаемый хиральный атом углерода хиральным или ахиральным. При рассмотрении вышеуказанной молекулы оба гипотетических лиганда идентичны, поскольку в кольцевой структуре нет других замен. Следовательно, предполагаемый атом углерода является ахиральным.
Почему важно определить хиральный углерод
Идентификация хирального углерода объясняет, является ли молекула хиральной или ахиральной. Определение количества хиральных атомов углерода, присутствующих в молекуле, является ключом для определения количества стереоизомеров, которые она может иметь. Эти стереоизомеры не наложены друг на друга с молекулой. Следовательно, он дает информацию о различных молекулах, имеющих одинаковое строение.
Резюме
Эта статья объясняет, как идентифицировать хиральные атомы углерода в молекуле в алифатических или кольцевых структурах. Присутствие хирального углерода указывает на то, что он имеет стереоизомеры. Это очень важно при наблюдении за связями и реакциями молекул.
Рекомендации:
1. «Хиральный центр». ОЧЕМПАЛ. Н.п., н.д. Web.

Теперь рассмотрим: к каким точечным группам симметрии должна принадлежать молекула, чтобы она была хиральной? Другими словами, каков должен быть характер диссимметрии молекулы и какие элементы симметрии обязательно должны отсутствовать? Прежде всего всякому очевидно, что хиральна любая истинно асимметрическая молекула, относящаяся к группе C1,
не имеющая никаких элементов симметрии, кроме идентичности (и оси C1, так как C1 ≡ E). Очевидно также, что молекулы, имеющие плоскость симметрии (σ) или центр симметрии (i), ахи-
ральны, поскольку они состоят из двух одинаковых «половинок», и в зеркальном отображении левая и правая половинки преобразуются друг в друга или без поворотов (при наличии плоскости), или с поворотом на 180 ° (при наличии центра инверсии). Молекулы, имеющие зеркально-поворотные оси (Sn), также совмеща-
ются со своим зеркальным отображением, и поэтому ахиральны. Следовательно, хиральны только молекулы, относящиеся к аксиальным точечным группам Cn и Dn.
Таким образом, можно сформулировать следующий симметрийный критерий хиральности:
любая молекула, которая не имеет несобственной оси враще-
ния Sn, хиральна.
Старое определение оптической изомерии, а именно «у молекулы не должно быть ни плоскости, ни центра симметрии», недостаточно точно. Поскольку S1 ≡ σ и S2 ≡ i, если у молекулы нет несобственной оси вращения, то у нее не должно быть ни σ, ни i. Существуют молекулы, у которых нет ни i, ни σ, но есть ось Sn и которые поэтому ахиральны. Примером является моле-
кула 1,3,5,7-тетраметилциклооктатетраена (XI), у которой нет ни плоскости, ни центра симметрии, но есть зеркально-поворотная ось S4. Она оптически неактивна.
|
CH3 |
σ |
CH |
|||
|
CH3 |
3 |
||||
|
CH |
|||||
|
3 |
CH3 |
||||
|
CH |
отражение |
||||
|
3 |
|||||
|
в плоскости σ |
|||||
|
CH3 |
(XI) |
CH3 |
CH3 |
||
|
вращение |
CH3 (идентична XI) |
||||
|
вокруг оси на 90° |
CH3 |
||||
|
CH3 |
23
Впервые доказательство справедливости данного выше определения хиральных молекул получено при исследовании изомерных четвертичных аммонийных солей со спирановым атомом азота IV, V, VIII и IX. Изомеры IV и V асимметричны (группа C1), изомер VII диссимметричен (группа D2). Поэтому эти три изоме-
ра должны быть хиральными. И действительно, они были получены в оптически активной форме. Однако изомер VIII относится к группе S4, т.е. ахирален, и получить его в оптически актив-
ной форме нельзя.
8.2.2.в. ПРАВИЛА КЛАССИФИКАЦИИ МОЛЕКУЛ ПО СИММЕТРИИ
Структура молекул органических соединений бывает настолько сложной, что поиск возможных элементов симметрии часто представляет собой очень трудную задачу. Поэтому необходим какой-либо разумный практический метод последовательных действий при классификации молекул по точечным группам симметрии. Ниже описана схема метода, предложенного Ф.Коттоном в 1971 г.
1. Сначала необходимо определить, принадлежит ли молекула к одной из следующих групп: C∞V (симметрия конуса), D∞h (симметрия цилиндра), Ih, Oh, Td (тип 4, табл. 8.1). Эти группы условно назовем «особые». Отметим, что к группе C∞V или D∞h принадлежат только линейные молекулы, например H−C≡C−Cl (C∞V), H−C≡C−H, Cl−C≡C−Cl (D∞h) и т.п.
2.Если молекула не принадлежит к одной из особых групп,
необходимо поискать собственную ось вращения Cn. Обнаружив
такую ось, переходим к операции (3). Если собственной поворотной оси нет, необходимо искать центр симметрии i или зеркальную плоскость σ. Если у молекулы окажется центр инверсии,
она принадлежит к точечной группе Ci, а если окажется зеркальная плоскость — к точечной группе CS. Если у молекулы нет элементов симметрии (кроме E), она относится к группе C1.
3.Далее находим главную ось Cn, т.е. ось с наибольшим значением n. Определяем, есть ли зеркально-поворотная ось S2n, сов-
падающая с главной осью. Если она существует, а других элементов, за исключением, возможно, i, нет, молекула принадле-
жит к одной из групп Sn, где n — четное число. Если ось S2n есть, но имеются и другие элементы, или если элемент S2n отсутству-
ет, необходимо перейти к операции (4).
4.Ищем набор из n осей второго порядка, лежащих в плос-
кости, перпендикулярной Cn. Если такой набор обнаружен, молекула принадлежит к одной из групп Dn, Dnh или Dnd и тогда
переходим к операции (5). Если же таких осей нет, молекула
24

принадлежит к группе Cn, или Cnh, или CnV. В этом случае пере-
ходим к операции (6).
5.Если у молекулы есть плоскость симметрии σh, перпендикулярная главной оси, она принадлежит к группе Dnh. Если такого элемента нет, необходимо искать набор из n диагональных
плоскостей σd (т.е. плоскостей симметрии, в которых находится
главная ось, но не лежит ни одна из перпендикулярных осей вто-
рого порядка). Если отсутствуют и σd и σh, молекула принадлежит к группе Dn.
6.Если молекула имеет σh, она принадлежит к точечной группе
Сnh. Если σh отсутствует, нужно искать набор из n плоскостей σV
(проходящих через главную ось). Наличие таких плоскостей позволяет отнести молекулу к группе СnV. Если у молекулы нет ни σV, ни σh, она относится к точечной группе Сn.
Изложенный метод иллюстрируется диаграммой, приведенной на схеме 8.1.
С х е м а 8.1
Особые группы симметрии
Нет Да
|
Cn |
|||||||||||||||
|
Нет |
Есть |
C∞V |
D∞H Td Oh Ih |
||||||||||||
|
S2п (или S2п и только i), |
|||||||||||||||
|
σ |
|||||||||||||||
|
коллинеарная |
|||||||||||||||
|
Нет Есть |
с единственной осью |
||||||||||||||
|
i |
или с главной осью Сп |
||||||||||||||
|
Нет |
Есть |
CS |
Нет |
Есть |
|||||||||||
|
nC2 Cn |
Sn |
||||||||||||||
|
C1 |
Ci |
Нет |
Есть |
||||||||||||
|
σh |
σh |
||||||||||||||
|
Нет |
Есть |
Нет |
Есть |
||||||||||||
|
nσV |
nσd |
||||||||||||||
|
Нет |
Есть |
Cnh |
Нет |
Есть |
Dnh |
||||||||||
|
Cn |
CnV |
Dn |
Dnd |
25

8.2.2.г. ТИПЫ ХИРАЛЬНОСТИ
Молекулы, содержащие тетраэдрический атом, например углерода, с четырьмя разными заместителями, принадлежат к точечной группе С1. Они асимметричны, и центральный атом называется асимметрическим атомом, как в приведенном ниже примере α-бромпропионовой кислоты (XII):
|
CH3 |
CH3 |
|
|
C |
H |
|
|
H |
COOH |
COOH |
|
Br |
||
|
(XII) |
Br (XIII) |
Адамантаны, у третичных атомов углерода которых имеются четыре разных заместителя, хиральны и оптически активны; например, соединение XIII было разделено на энантиомеры. При сравнении формул XII и XIII нетрудно видеть, что симметрия обоих соединений очень похожа. Остов адамантана можно представить как тетраэдр с «изломанными ребрами», он имеет симметрию Td, которая переходит в С1, когда все четыре заместителя
у третичных атомов углерода разные. У производного адамантана XIII нет асимметрического атома углерода, как в α-бромпро-
пионовой кислоте, но есть центр, находящийся внутри молекулы (центр тяжести незамещенного адамантана).
Асимметрический центр — это частный случай более общего понятия хиральный центр. Хиральный центр могут иметь не только асимметрические молекулы, но и молекулы симметрии Cn или Dn. В приведенных ниже примерах хиральный центр поме-
чен звездочкой:
|
HN |
O |
C3 |
||
|
N |
||||
|
C2 |
||||
|
O |
NH |
S |
||
|
C2 |
S |
|||
|
C2 |
S |
|||
|
C3 |
||||
|
вид сверху: |
||||
|
(CH ) |
(CH ) |
C2 |
||
|
2 6 |
2 6 |
|||
|
D2 |
C2 |
26

Хиральный центр является лишь одним из возможных элементов хиральности. Молекулы, хиральность которых обусловлена наличием центра хиральности, безусловно, самые важные в органической химии. Однако кроме центрального существует еще и аксиальный, планарный и спиральный типы хиральности.
Аксиальной хиральностью обладают молекулы, имеющие хи-
ральную ось. Хиральную ось легко получить, мысленно «растягивая» центр хиральности:
|
хиральный центр |
хиральная ось |
Хиральную ось имеют такие классы молекул, как аллены и дифенилы. В алленах центральный атом углерода sp-типа имеет две взаимноперпендикулярные p-орбитали, каждая из которых перекрывается с p-орбиталью соседнего атома углерода, в результате
чего остающиеся связи концевых атомов углерода располагаются в перпендикулярных плоскостях. Сам аллен ахирален, так как имеет зеркально-поворотную ось S4, но несимметрично замещенные аллены типа abC=C=Cab хиральны:
HH
|
a |
b |
a |
|
|
C |
|||
|
C |
a |
b |
|
|
C |
b C2 |
|
H |
H |
a |
b |
|
|
хирален (C2) |
||||
Аллены хиральны только в том случае, если оба концевых атома углерода замещены несимметрично:
|
H3C |
H |
H3C |
H |
H3C |
H |
|||||||||||
|
C |
C |
C |
C |
C |
C |
C |
C |
C |
||||||||
|
H C |
H |
H |
H |
H |
CH3 |
|||||||||||
|
3 |
||||||||||||||||
|
ахирален |
ахирален |
хирален |
27

При любом нечетном числе кумулированных двойных связей четыре концевые группы располагаются уже не в разных, а в одной плоскости, например для 1,2,3-бутатриена:
Такие молекулы ахиральны, но для них наблюдается цис—транс—
изомерия.
При любом четном числе кумулированных двойных связей хиральность возможна. Так, соединение XIV было разделено на оптические изомеры:
|
(CH3)3C |
C(CH3)3 |
|||||||
|
C |
C |
C |
C |
C |
||||
|
Ar |
Ar |
(XIV) (Ar = n-ClC6H4)
Если одну или обе двойные связи симметрично замещенного аллена заменить на циклическую систему, то полученные молекулы будут тоже обладать аксиальной хиральностью, например:
|
H H |
H NH2 |
|
ахирален |
хирален |
В дифенилах, содержащих четыре объемистые группы в ортоположениях, свободное вращение вокруг центральной связи затруднено из-за стерических препятствий, и поэтому два бензольных кольца не лежат в одной плоскости. По аналогии с алленами, если одно или оба бензольных кольца замещены симметрично, молекула ахиральна; хиральны же молекулы только с двумя несимметрично замещенными кольцами, например:
28

|
NO2 |
COOH |
COOH COOH |
|||||||||
|
NO2 |
COOH |
O2N |
|
NO2 |
||
|
ахирален |
хирален |
Изомеры, которые можно разделить только благодаря тому, что вращение вокруг простой связи затруднено, называются атропо-
изомерами.
Иногда для предотвращения свободного вращения в дифенилах достаточно трех и даже двух объемистых заместителей в ортоположениях. Так, удалось разделить на энантиомеры дифенил-2, 2′-дисульфоновую кислоту (XV). В соединении XVI свободное вра-
щение полностью не заторможено, и, хотя его можно получить в оптически активной форме, при растворении в этаноле оно быстро рацемизируется (наполовину — за 9 мин при 25 °С):
|
SO3H3 |
NO2 |
||||||||
|
SO3H |
COOH OCH3 |
|
(XV) |
(XVI) |
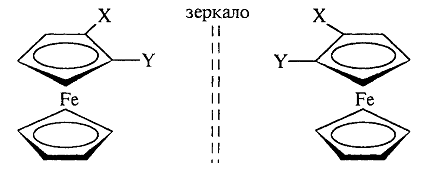
Для некоторых хиральных молекул определяющим структурным элементом является не центр, не ось, а плоскость. Простейшую модель планарной хиральности легко сконструировать из любой плоской фигуры, не имеющей оси симметрии, лежащей в этой плоскости, и отдельной точки вне плоскости. Наиболее изучены планарно-хиральные производные ферроцена (XVII). Другими примерами являются ареновые комплексы хромтрикарбонила (XVIII), а также соединения XIX и XX:
(XVII)
29
Хиральные молекулы обычно содержат по меньшей мере один атом углерода с четырьмя неидентичными заместителями. Такой атом углерода называют хиральным центром (или иногда стереогенным центром ), используя органический язык. Любая молекула, которая содержит хиральный центр, будет хиральной (за исключением мезосоединения). Например, показанное здесь соединение содержит атом углерода с четырьмя неидентичными заместителями; этот атом углерода является хиральным центром, а сама молекула является хиральной, поскольку она не накладывается на ее зеркальное отображение.
Хиральный центр.
Вы должны быть в состоянии быстро обнаружить хиральные центры в молекулах. Все атомы углерода алкильной группы с прямой цепью (звенья СН 3 или СН 2) не будут хиральными центрами, поскольку эти группы имеют две или более одинаковых групп (водородов), связанных с атомами углерода. Углероды на двойных или тройных связях также не будут хиральными центрами, потому что они не могут иметь связи с четырьмя различными группами. Когда вы смотрите на молекулу, ищите атомы углерода, которые замещены четырьмя различными группами. Посмотрите, например, можете ли вы обнаружить два хиральных центра в молекуле, показанной здесь.
Молекула с двумя хиральными центрами.
Поскольку группы CH 3 и CH 2 не могут быть хиральными центрами, эта молекула имеет только три атома углерода, которые могут быть хиральными центрами. Две крайние левые возможности, обозначенные на следующем рисунке, имеют четыре неидентичные группы и являются хиральными центрами, но крайняя правая имеет две идентичные метильные (CH 3) группы и поэтому не является хиральным центром.
Хиральные центры в длинной молекуле.
наталия Богдановна врецена
Эксперт по предмету «Химия»
Задать вопрос автору статьи
Основные типы хиральности. Центральная хиральность
К основным типам хиральности относятся:
- центральная хиральность;
- аксиальная хиральность;
- планарная хиральность;
- спиральная хиральность.
Хиральные центры могут быть образованы атомами углерода, кремния, четырехковалентного азота и фосфора, олова, в окисях третичных аминов и фосфинов и в четвертичных аммониевых солях.
Центральный атом в этих соединениях, как и асимметрический атом углерода, имеет тетраэдрическую конфигурацию. Хиральные центры, образованные атомами трехвалентного азота, мышьяка, фосфора, серы, сурьмы, четвертым заместителем в соединениях которых является неподеленная электронная пара, имеют пирамидальную конфигурацию.
Замечание 1
Так как в большинстве соединений азота наблюдается инверсия свободной электронной пары, они не будут хиральными.
Частным случаем хирального центра является асимметрический центр. Молекулы симметрии $C_n$ или $D_n$ также, как и асимметрические молекулы могут иметь хиральный центр (помечен звездочкой):
«Типы хиральности» 👇
Хиральный центр может находиться внутри молекулы и не быть привязанным к какому-то определенному атому.
Аксиальная хиральность
Молекулы имеющие хиральную ось обладают аксиальной хиральностью. Если хиральный центр мысленно растянуть, получится хиральная ось:
Аллены и дифенилы имеют хиральную ось. В алленах две взаимноперпендикулярные р-орбитали центрального атома углерода $sp$-типа перекрываются с $p$-орбиталью соседнего атома карбона. Оставшиеся связи концевых атомов углерода находятся в перпендикулярных плоскостях.
Пропадиен (аллен) ахирален, но несимметрично замещенные аллены $abC=C=Cab$ хиральны:
Ахирален Ахирален Хирален
Пример 1
Для 1,2,3-бутатриена четыре концевые группы располагаются в одной плоскости, что справедливо для соединений с нечетным числом кумулированных связей:
Молекула 1,2,3-бутатриена является ахиральной, для нее характерна цис-транс-изомерия.
Хиральность возможна при любом четном числе кумулированных связей.
Симметрично замещенный аллен будет обладать аксиальной хиральностью, если одну или две двойные связи заменить на циклическую систему:
Дифенилы в $o$-положениях содержат объемистые группы, поэтому свободное вращение вокруг центральной связи $C-C$ ограничено из-за стерических препятствий. В результате два бензольных кольца находятся в разных плоскостях. Пространственная изомерия, возникшая в результате отсутствия вращения вокруг простой связи называется атропоизомерией. Атропоизомерия – причина появления оптической активности:
Планарная хиральность
Когда определяющим структурным элементом в симметрии является плоскость, говорят о планарной хиральности. В плоскости можно выделить «верх» и «низ», а также стороны — «правую» и «левую».
Пример 2
Планарную хиральность имеют производные ферроцена, ареновые комплексы хромтрикарбонила
Спиральная хиларность
При спиральной форме молекулы наблюдается спиральная хиральность. Возможно наличие энантиомерных спиралей, возникновение которых обусловленно тем, в какую сторону – правую или левую — закручена спираль.
Пример 3
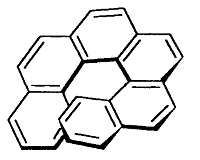
В молекуле гексагелицена $C_{26}H_{16}$ одна ее часть расположена над другой вследствие пространственных препятствий. Спираль молекулы имеет неполный поворот, при этом сохраняется и правая и левая ориентация.
Находи статьи и создавай свой список литературы по ГОСТу
Поиск по теме