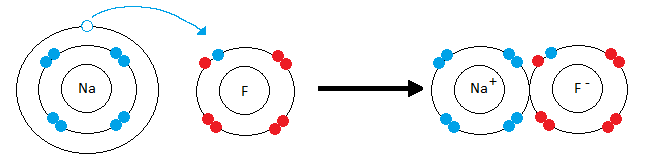
Представим, что встретились два атома: атом щелочного металла и атом галогена. У атома металла на внешнем энергетическом уровне — единственный электрон, а атому неметалла как раз не хватает одного электрона, чтобы завершить свой внешний уровень.
Атом металла легко отдаст свой слабо связанный с ядром валентный электрон атому неметалла, который предоставит ему свободное место на внешнем энергетическом уровне. Оба в результате получат заполненные внешние уровни.
Атом металла при этом приобретёт положительный заряд, а атом галогена превратится в отрицательно заряженную частицу. Такие частицы называются ионами.
Ионы — заряженные частицы, в которые превращаются атомы в результате отдачи или принятия электронов.
Образовавшиеся разноимённо заряженные ионы притягиваются друг к другу, и возникает химическая связь, которая называется ионной.
Ионная связь — связь между положительно и отрицательно заряженными ионами.
Рассмотрим механизм образования ионной связи на примере взаимодействия натрия и хлора.
Na0+Cl0→Na++Cl−→Na+Cl−
Такое превращение атомов в ионы происходит всегда при взаимодействии атомов типичных металлов и типичных неметаллов, электроотрицательности которых резко различаются.
Ионная связь образуется в сложных веществах, состоящих из атомов металлов и неметаллов.
Рассмотрим другие примеры образования ионной связи.
Пример:
Взаимодействие кальция и фтора
1. Кальций — элемент главной подгруппы второй группы. Ему легче отдать два внешних электрона, чем принять недостающие.
2. Фтор — элемент главной подгруппы седьмой группы. Ему легче принять один электрон, чем отдать семь.
3. Найдём наименьшее общее кратное между зарядами образующихся ионов. Оно равно (2). Определим число атомов фтора, которые примут два электрона от атома кальция: (2) (:) (1) (=) (2).
4. Составим схему образования ионной связи:
Пример:
Взаимодействие натрия и кислорода
1. Натрий — элемент главной подгруппы первой группы. Он легко отдаёт один внешний электрон.
2. Кислород — элемент главной подгруппы шестой группы. Ему легче принять два электрона, чем отдать шесть.
3. Найдём наименьшее общее кратное между зарядами образующихся ионов. Оно равно (2) (:) (1) (=) (2). Определим число атомов натрия, которые отдадут два электрона атому кислорода: (2).
4. Составим схему образования ионной связи:
С помощью ионной связи образуются также соединения, в которых имеются сложные ионы:
.
Значит, ионная связь существует также в солях и основаниях.
Обрати внимание!
Соли аммония
NH4NO3,NH4Cl,NH4SO42
не содержат металла, но образованы ионной связью.
Ионы создают вокруг себя электрическое поле, действующее во всех направлениях. Поэтому каждый ион окружён ионами противоположного знака. Такое соединение представляет собой огромную группу положительных и отрицательных частиц, расположенных в определённом порядке.
Рис. (1). Ионный кристалл
Притяжение между ионами довольно сильное, поэтому ионные вещества имеют высокие температуры кипения и плавления.
Обрати внимание!
Все ионные соединения при обычных условиях — твёрдые вещества.
Примеры веществ с ионной связью:
|
|
|
 |
|
Рис. (2). Питьевая сода |
Рис. (3). Железный купорос |
Рис. (4). Поваренная соль |
Источники:
Рис. 1. Ионный кристалл https://upload.wikimedia.org/wikipedia/commons/e/eb/Sodium_chloride_crystal.png
Рис. 2. Питьевая сода https://pixabay.com/images/id-768950/ 8.06.2021
Рис. 3. Железный купорос https://upload.wikimedia.org/wikipedia/commons/thumb/a/ab/Iron%28II%29-sulfate-heptahydrate-sample.jpg/1280px-Iron%28II%29-sulfate-heptahydrate-sample.jpg
Рис. 4. Поваренная соль https://upload.wikimedia.org/wikipedia/commons/9/93/Chlorid_sodn%C3%BD.JPG
Ионы – это атомы, потерявшие или получившие электроны и, как следствие, некоторый заряд. Для начала хотелось бы напомнить, что ионы бывают двух типов: катионы (положительный заряд ядра больше, чем количество электронов, несущих отрицательный заряд) и анионы (заряд ядра меньше количества электронов). Ионная связь образуется в результате взаимодействия двух ионов с разноименными зарядами.
Ионная и ковалентная связь
Данный тип связи является частным случаем ковалентной. Разность электроотрицательностей в данном случае столь велика (более чем 1,7 по Полингу), что общая пара электронов не частично смещается, а полностью переходит к атому с большей электроотрицательностью. Поэтому образование ионной связи является результатом возникновения сильного электростатического взаимодействия между ионами. Важно понимать, что не существует стопроцентно ионной связи. Данный термин применяется, если «ионные признаки» более выражены (т.е. электронная пара сильно смещена к более электроотрицательному атому).
Механизм ионной связи
Атомы, имеющие практически полную или практически пустую валентную (внешнюю) оболочку, наиболее охотно вступают в химические реакции. Чем меньше пустых орбиталей на валентной оболочке, тем выше шанс, что атом получит электроны извне. И наоборот – чем меньше электронов находится на внешней оболочке, тем вероятнее, что атом отдаст электрон.
Это способность атома притягивать к себе электроны, поэтому атомы с наиболее заполненными валентными оболочками более электроотрицательны.
Типичный металл охотно отдает электроны, тогда как типичный неметалл охотнее их забирает. Поэтому чаще всего ионную связь образуют металлы и неметаллы. Отдельно следует упомянуть другой тип ионной связи – молекулярную. Ее особенность в том, что в роли ионов выступают не отдельные атомы, а целые молекулы.
Схема ионной связи
На рисунке схематически изображено формирование фторида натрия. Натрий имеет низкую электроотрицательность и всего один электрон на валентной оболочке (ВО). Фтор – значительно более высокую электроотрицательность, ему не хватает всего одного электрона для заполнения ВО. Электрон с ВО натрия, переходит на ВО фтора, заполняя орбиталь, в следствии чего оба атома приобретают разноименные заряды и притягиваются друг к другу.
Свойства ионной связи
Ионная связь достаточно сильна – разрушить ее при помощи тепловой энергии крайне сложно, а потому вещества с ионной связью имеют высокую температуру плавления. В то же время радиус взаимодействия ионов достаточно низкий, что обуславливает ломкость подобных соединений. Важнейшими ее свойствами являются ненаправленность и ненасыщаемость. Ненаправленность происходит из формы электрического поля иона, которое представляет собой сферу и способно взаимодействовать с катионами или анионами во всех направлениях. При этом поля двух ионов не компенсируются полностью, вследствие чего они вынуждены притягивать к себе дополнительные ионы, образуя кристалл, – это и есть явление, называемое ненасыщаемостью. В ионных кристаллах нет молекул, а отдельные катионы и анионы окружены множеством ионов противоположного знака, количество которых зависит в основном от положения атомов в пространстве.
Кристаллы поваренной соли (NaCl) – типичный пример ионной связи.
Таблица веществ с ионной связью
| Название | Формула | Применение и свойства |
|---|---|---|
| Бромид серебра | AgBr | Ионная связь в молекуле разрывается под воздействием фотонов (фотолиз), что широко применяется в фотографии и оптике. |
| Хлорводород | HCl | Как следует из формулы, ионная связь тут образуется между хлором и водородом, а потому водный раствор HCl (соляная кислота), широко применяется для получения различных хлоридов. |
| Оксид кальция | CaO | Негашеная известь. Широко применяется при производстве кирпича. |
| Фторид натрия | NaF | Применяется для укрепления зубной эмали, в производстве керамики. |
Тест по теме «Ионная связь»
МБОУ «Открытая сменная общеобразовательная
школа №1
г. Улан-Удэ»
Технологическая карта
Тема урока «Ионная химическая связь»
Выполнила учитель химии Сампилова Ж.М.
Технологическая карта урока по химии «Ионная
связь»
(технология проблемного обучения)
УМК: Г.Е. Рудзитис, Ф.Г. Фельдман
Предметная
область: химия
Класс: 8
Тема
урока — «Ионная
связь».
Цель: познакомить учащихся с ионами, ионной
связью, механизмом её образования
|
Деятельность учителя |
Деятельность учащихся |
|
Этап I. Создание проблемной ситуации и постановка проблемы |
|
|
Актуализация прежних знаний с помощью вопросов: 1.Укажите 2. 3.Сколько 4. 5. Формулируется проблемный вопрос: «Каков Подведение учащихся к формулировке темы урока (задается второй 1.Что 2.Как |
Отвечают на вопросы учителя, формулируют понятие заряженных частиц – Отвечают на вопрос и формулируют тему урока, затем записывают её в |
|
Этап II. Выдвижение гипотез, предположений о возможных путях решения проблемы, |
|
|
Для Учитель подводит учащихся к выдвижению гипотезы: «Ионная химическая Представим, Атом Атом металла Ионы — заряженные частицы, в которые превращаются атомы в Образовавшиеся |
Учащиеся записывают схемы превращения атомов металла и неметалла в 1. Кальций — элемент главной подгруппы второй группы. 2. Фтор — элемент главной подгруппы седьмой группы. Ему 3. Найдём наименьшее общее кратное между зарядами 4. Составим схему образования ионной связи: Ca0+2F0→Ca2+F−2. Пример: Взаимодействие натрия и кислорода 1. Натрий — элемент главной подгруппы первой 2. Кислород — элемент главной подгруппы шестой 3. Найдём наименьшее общее кратное между зарядами 4. Составим схему образования ионной связи: 2Na0+O0→Na+2O2−. С помощью ионной связи образуются также NH+4,NO−3,OH−,SO2−4,PO3−4,CO2−3. Значит, |
|
Этап III. Опытная проверка принятых гипотез |
|
|
Учитель Учитель показывает действие магнитиков |
Учащиеся 1) Ca0-2ē→ Ca2+ 2) F0+1ē→ F— 3) Ca0+ 2F0→ Ca2++ 2F—→Ca2+ F—2 Учащиеся делают выводы о механизме возникновения ионной химической |
|
Этап IV. Обобщение результатов, закрепление и применение их в теории и практике |
|
|
Используя 1. В каком ряду находятся вещества только с ионной А) K2O Б) MgO В) H2SO4 2. Напишите схему образования химической связи в молекуле Акцентирует результатах |
Выполняют Называют |
|
Этап V. Рефлексия |
|
|
На листах Самым сложным Больше всего мне На будущее мне Мне осталось |
Оформление листов |
|
Этап VI. Включение новых знаний и умений в уже освоенную систему личностных, |
|
|
В развитие развитие развитие умения |
|
|
Подведение итогов |
Прежде,
чем узнать, что такое ионная связь и как она образуется, побываем в одной
удивительной стране.
Народ
этой страны был беден, но беспечен. Хотя в карманах у большинства из них не
было ни одной свободной монеты (а «валюта» в этой стране называлась электронами),
никто не горевал по этому поводу. Напротив, если у них заводился хоть один
лишний электрон, то характер их портился, они становились агрессивными и даже
опасными, потому скорее хотели от него избавиться, чтобы стать опять добрыми и
веселыми.
Надо
сказать, что «высшая знать» этой страны отличалась от простых граждан своей
скупостью. Свою «электронную валюту» они неохотно одалживали, и, наоборот, при
малейшей возможности стремились забрать еще.
Давайте
теперь разберёмся, кто же такие были «простые жители», а кем бала «знать».
Речь
в истории шла об элементах металлах и неметаллах. Разберёмся почему.
У
атомов металлов на внешнем уровне всегда мало
электронов (от одного до трех), естественно, что им легче отдать
электроны для завершения энергетического уровня, а для неметаллов, у
которых более трех электронов, легче присоединить электроны для
завершения энергетического уровня.
Главной
характеристикой атома является заряд его ядра, от которого зависит и радиус
атома. Чтобы определить число электронов на внешнем уровне достаточно знать
номер группы.
Теперь,
составим логическую цепочку: радиус атома зависит от заряда ядра, числа
электронов на внешнем уровне, числа электронных слоев.
Рассмотрим,
как изменяются металлические и неметаллические свойства по периодам и
группам периодической системы.
В
периодах слева направо увеличивается заряд ядра, радиус
атома постепенно уменьшается, увеличивается число электронов на внешнем уровне,
которые сильнее притягиваются к положительно заряженному ядру, и атомам
становится легче присоединить электроны до завершения уровня, чем отдать их,
поэтому металлические свойства ослабевают, а увеличиваются неметаллические.
В
Периодической таблице каждый период начинается металлом IA
группы
(это типичные металлы) и заканчивается неметаллом, в VIIA
группе
уже находятся типичные неметаллы.
В
пределах одной группы главной подгруппы, сверху вниз
увеличивается заряд ядра атома, увеличиваются радиусы атомов, число электронов
на внешнем уровне остается постоянным, но увеличивается число энергетических
уровней, и электроны будут удаляться от ядра, поэтому атомам их легче отдать,
чем присоединить до завершения внешнего уровня, следовательно, металлические
свойства будут увеличиваться, а неметаллические ослабевать. Поэтому атомы
элементов, расположенные внизу в пределах одной группы, будут проявлять более
металлические свойства, нежели которые находятся вверху.
Элементы
VIIIА группы
называют благородными или инертными газами. У всех этих атомов завершен
энергетический уровень, для любого атома – это устойчивое состояние.
Поэтому они не отдают и не присоединяют электроны. Они практически не
соединяются с другими атомами и друг с другом, т.е. они инертны.
Представьте
себе, встречается элемент IA
группы, у которого 1 электрон, и элемент VIIA
группы, у которого 7 электронов. Пусть это будут Na
и Cl. У натрия один
единственный электрон, а хлору как раз не хватает одного электрона для
завершения внешнего уровня. Если натрий отдаст свой электрон, то он
приобретет положительный заряд, а когда атом хлора заберет этот
электрон, он превратится в отрицательно заряженную частицу. Эти заряженные
частицы, называются ионами. Из курса физики известно, что разноименные
заряды притягиваются, поэтому ион натрия и хлора соединятся и между
ними возникнет химическая связь. Эта связь и будет называться ионной.
В результате этого взаимодействия образуется ионное соединение. Для
выражения этих ионных соединений пользуются формульными единицами, т.е.
говорят не молекула NaCl, а формульная
единица NaCl.
Ионная
связь образуется между типичным металлом и типичным неметаллом.
Схема
образования ионной связи между атомами кальция и хлора
Кальций
расположен во IIA группе, значит, на
внешнем энергетическом уровне у него два электрона, которые легче отдать, чем
присоединить шесть до завершения энергетического уровня. После чего он
становится положительным ионом.
Са0
— 2ē → Са2+
Атому
хлора, у которого на внешнем уровне 7 электронов, легче присоединить 1 электрон
до завершения уровня, чем отдать 7 электронов. После присоединения 1 электрона,
атом хлора становится отрицательным ионом.
Cl0
+ 1ē → Cl—
Найдём
наименьшее общее кратное между образовавшимися ионами. Оно равно двум.
Следовательно, нужно взять 1 атом кальция и 2 атома хлора. Это схематично можно
показать так:
Ca0
+ 2Cl0
→ Ca2+Cl2—.
Цифра
2, стоящая перед атомом хлора, называется коэффициентом. Коэффициент
обычно показывает число атомов, молекул или формульных единиц, а цифра 2
после иона хлора, называется индексом. Индекс показывает число атомов
в молекуле или ионов в формульной единице.
Возвращаясь
истории, нетрудно догадаться теперь, почему «простыми» жителями были металлы, а
«знатью» неметаллы.
to continue to Google Sites
Not your computer? Use Guest mode to sign in privately. Learn more