Эта тема входит в бесплатную часть моего курса по биохимии.
Белки — это полимерные молекулы, которые состоят из молекул поменьше — мономеров. Этими мономерами будут аминокислоты. Если упростить, то белок — это большой кирпичный дом. Где кирпичики — это аминокислоты. В этой статье мы посмотрим на эти кирпичики: какие они бывают, сколько их и какие у них свойства. Потом соединим аминокислоты вместе — синтезируем пептид. Подробно поговорим о пептидной связи, удерживающей аминокислоты вместе. А в конце небольшой подарок — торсионные углы.
Строение аминокислот
По названию понятно, что в аминокислоте должны быть две вещи: аминогруппа и карбоксильная группа. Аминокислот довольно много, но в белках встречаются только такие:
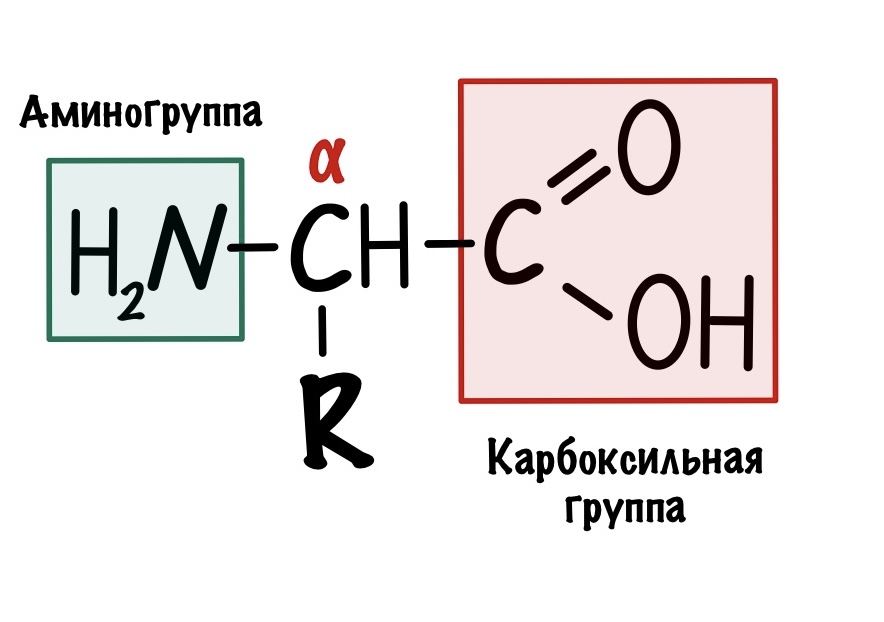
Это альфа-аминокислоты. В них есть центральный атом углерода, который связан с четырьмя заместителями: водородом, аминогруппой, карбоксильной группой и радикалом. Над этим атомом стоит греческая буква — альфа, почему? Это способ нумерации атомов углерода, входящих в органическое соединение. Для нумерации используют буквы греческого алфавита: альфа, бета, гамма, дельта и так далее. Нумерацию начинают с атома углерода, который следует после карбоксильной группы.
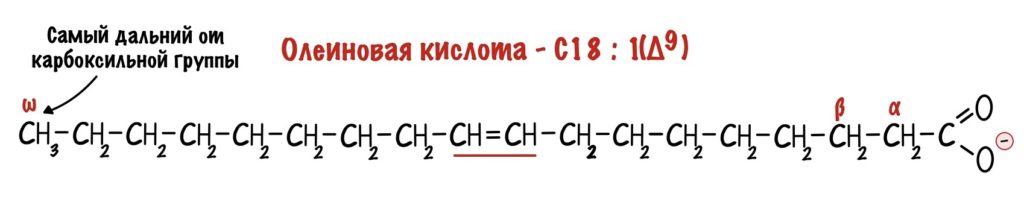
Альфа-углерод связан с четырьмя разными заместителями. Ещё разок повторим, что это — водород, аминогруппа, карбоксильная группа и радикал. Такие атомы называются хиральными центрами. Если в молекуле есть хиральный центр, то она хиральна. Что это значит? Это значит, что у молекулы есть изомер — он является её зеркальным отражением. Две этих молекулы будут несопоставимы в пространстве — они разные! Самый простой пример хиральности — левая и правая рука. Руки являются зеркальным отражением друг друга, но у нас не получится идеально сопоставить их в пространстве. Для этого пришлось бы превратить правую руку в левую. Или левую в правую.
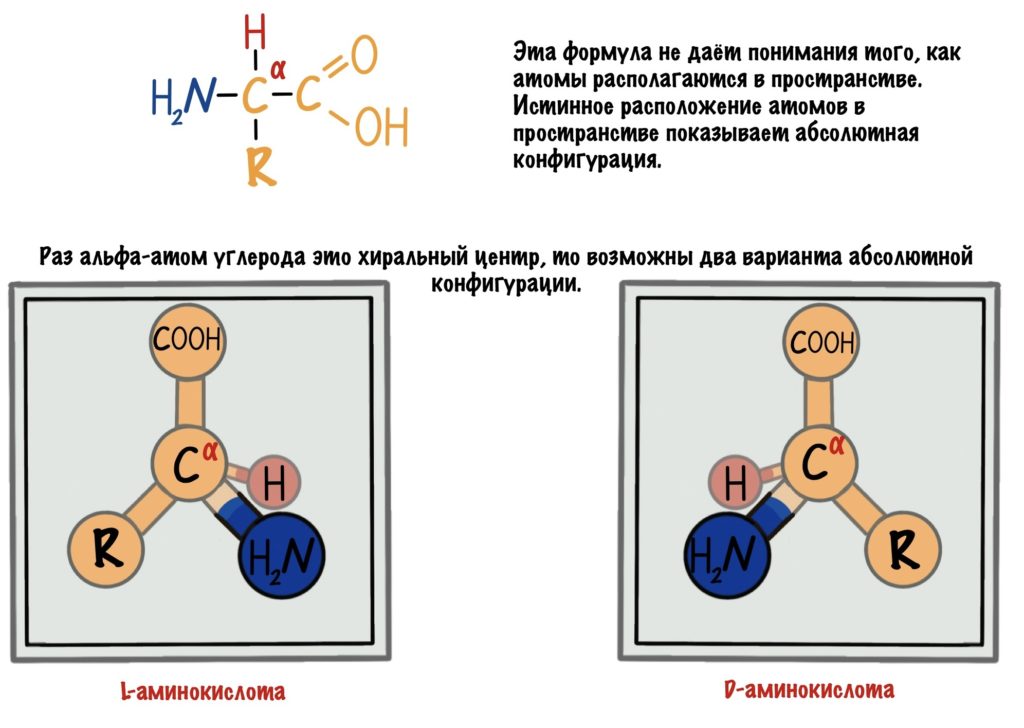
Живые организмы используют и синтезируют только L-аминокислоты.
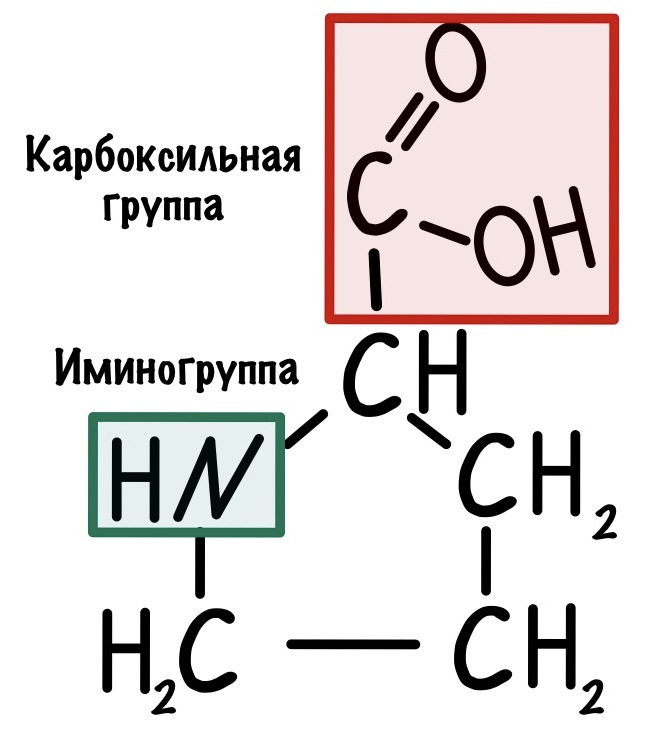
Альфа-аминокислоты будут различаться по своим радикалам. Всего нам нужно запомнить 20 аминокислот. Одна из них будет иметь особое строение — правильнее было бы назвать её иминокислотой. Вот наша легенда — пролин.
Вернемся к различиям между аминокислотами. Есть несколько классификаций радикалов, но мы возьмем самую полезную для нас — по полярности. А если говорить простыми словами, то по растворимости радикала в воде. Радикалы делятся на неполярные и полярные. Первые не растворимы в воде, а вторые растворимы. Когда будем говорить о строении белка, то поймем почему нас интересует именно эта классификация.
Неполярные радикалы аминокислот
У этих ребят нет групп, которые могут образовать водородные связи с водой, поэтому они нерастворимы. Вместо этого у них есть алифатические и ароматические группы. Радикалы выделены фиолетовым цветом.
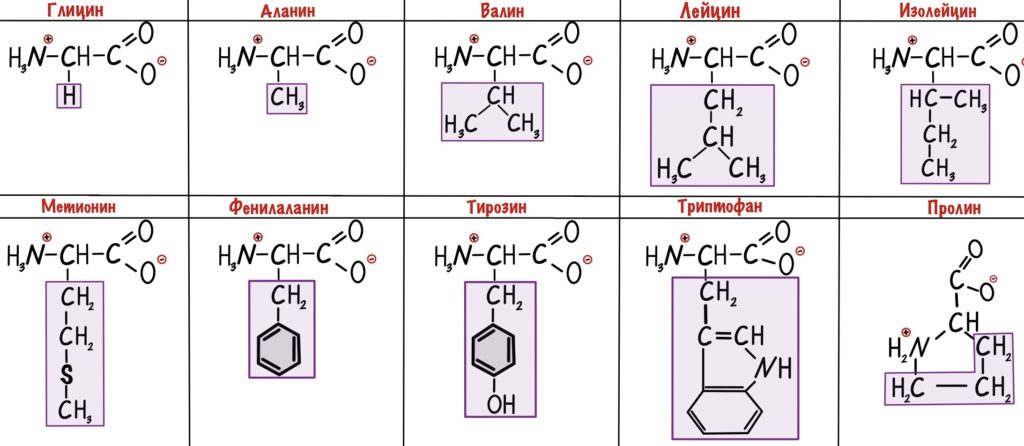
У глицина радикал — атом водорода. Выходит, что у его альфа-атома углерода два одинаковых заместителя — он не является хиральным атомом.
Полярные радикалы аминокислот
Перед этим остановимся на одной вещичке. Я писал формулы аминокислот так, как будто они не находятся в растворе. Но если мы заглянем в клетку, pH в цитоплазме которой 7 и 0, то увидим такую картину.
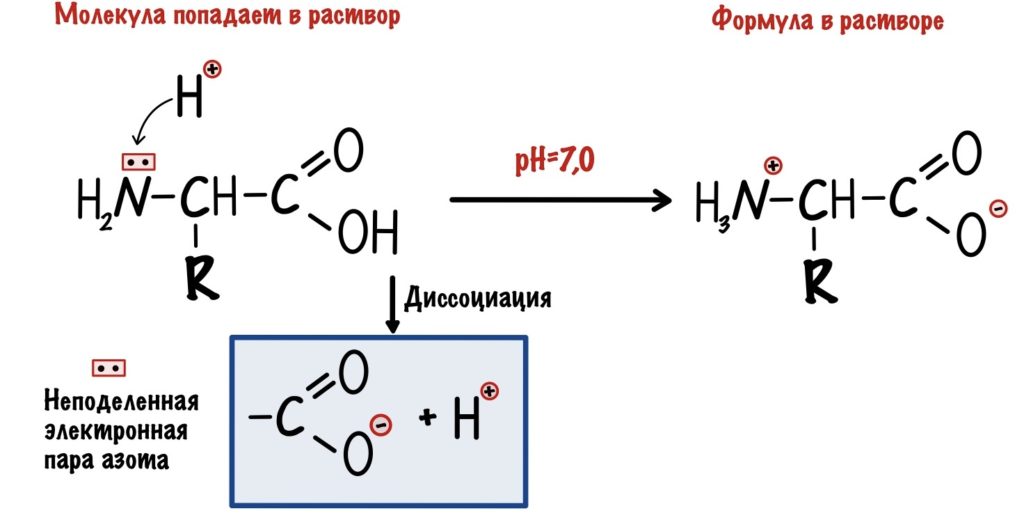
Еще разок, в цитоплазме клетки pH 7,0, то есть в в ней равное количество H+ и OH—. Так как у азота есть неподеленная электронная пара, то он может присоединить протон водорода по донорно-акцепторному механизму. А остаток кислоты диссоциирует с образованием протона. Понятное дело, что радикалы подчиняются таким же правилам.
Полярные радикалы можно разделить на две группы: полярные незаряженные и полярные заряженные.
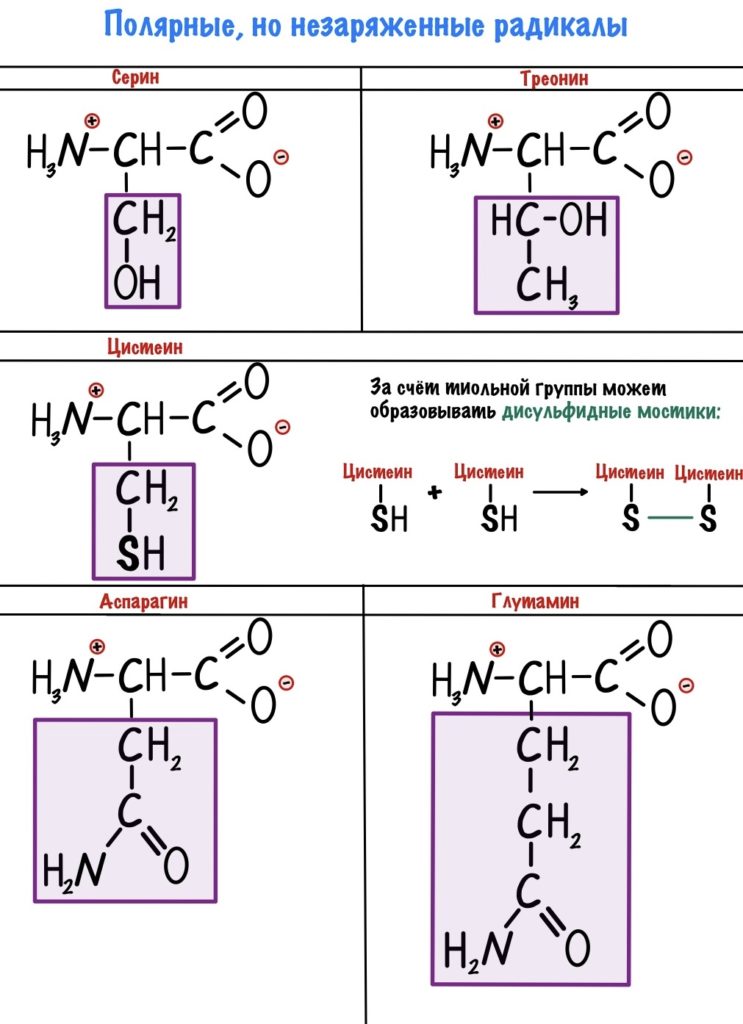
В этих аминокислотах есть сильно электроотрицательные атомы — азот, кислород и сера. С их помощью молекулы образуют водородные связи и растворяются в воде. Но заряда у них нет.
Заряд у радикала может быть положительным или отрицательным, поэтому здесь небольшое деление.
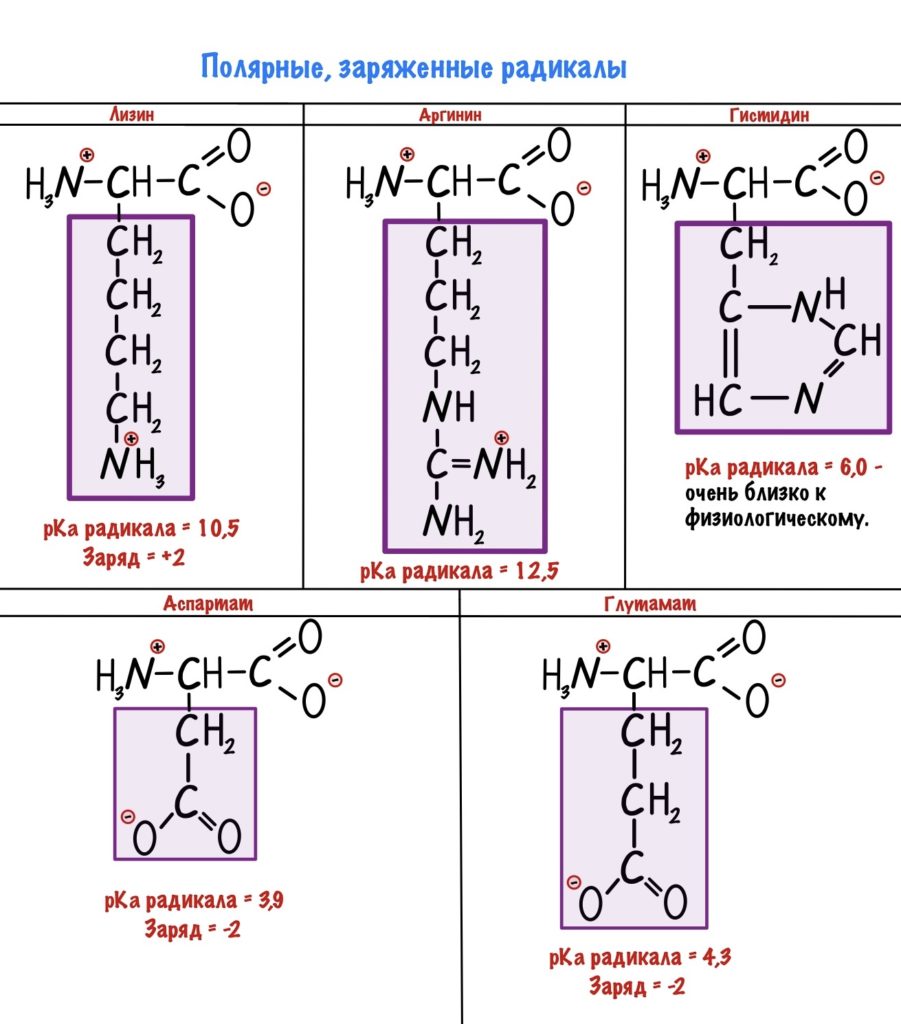
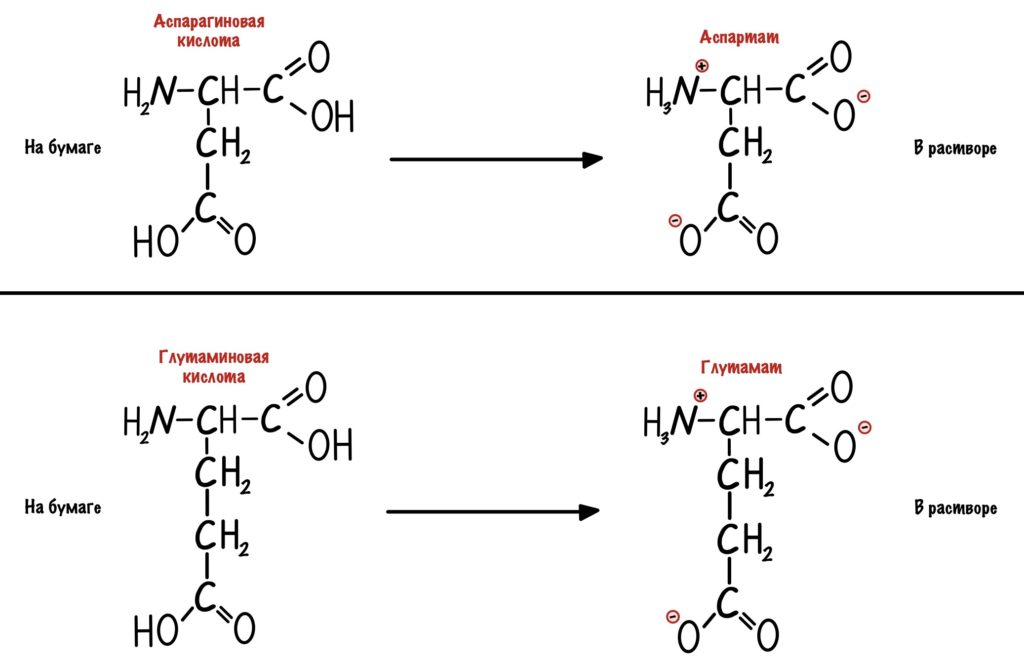
Кстати, лучше растворимы в воде заряженные радикалы. Но разница между полярными заряженными и незаряженными не слишком большая. И еще одно — аспартат и глутамат это название аспарагиновой и глутаминовой кислот в растворе.
Аминокислоты делятся на полярные и неполярные. Полярные аминокислоты могут быть заряженными или незаряженными.
Аминокислоты называли по месту их выделения или физическим свойствам, поэтому у них такие странные названия. Гликос с греческого — сладкий, вот и глицин сладковат. Так что придется зазубрить это.
Изоэлектрическая точка
Вы уже заметили, что у аминокислот есть положительная и отрицательная части. Не так много молекул имеют такую особенность. Так что аминокислоты — это такой гибрид, поэтому их так и назвали — гибридные ионы. Правда на немецком…. А звучит это так: «Цвиттер-ион». Но как всегда есть один нюанс — у гибридного иона общий заряд молекулы равен нулю.
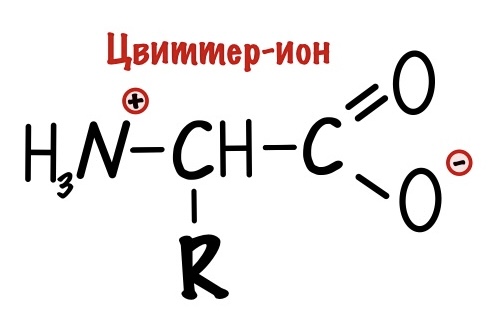
И вы уже смекнули, что не у всех аминокислот будет общий заряд равен нулю. Для неполярных и полярных незаряженных аминокислот это верно, но че делать с заряженными? До этого мы разбирали заряд аминокислот в клетке, то есть при нейтральном pH. Но что будет с ними, если поместить их в другие значения среды, например, в сильнощелочную или кислотную? Аминокислоты будут менять свой заряд и сейчас посмотрим как.
Для начала возьмем что-нибудь простенькое — пусть это будет глицин. Нужно понять, что мы берём раствор — у него будет определённая кислотность среды (pH) равная 7,0. В этом растворе будет множество молекул глицина. Добавляем в этот раствор кислоту. Прямо по капле. Сначала ничего не меняется, но при значении pH=2,34 половина карбоксильных групп глицина присоединит к себе протон водорода. Продолжим уменьшать pH (добавлять кислоту) — всё большее количество глицина присоединяет протон. Что же получается? При снижении pH менее 2,34 большая часть карбоксильных групп глицина присоединит к себе протон. Заряд молекул глицина изменится — теперь он равен +1. Начнем добавлять к этому же раствору щелочь по капле. Дойдем до pH равного 9,6 и от половины аминогрупп глицинов отлетит водород. Заряд молекулы будет -1. Чуть дальше будет хорошая картинка, на которой можно будет проследить за всеми изменениями.
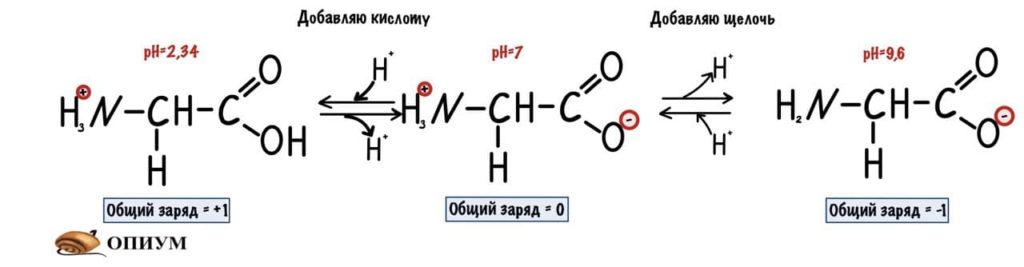
Как же назвать pH при котором происходит переход из одной формы в другую? Очень просто, показатель константы диссоциации или pKa. Константа диссоциации показывает при каком pH среды половина функциональных групп связана с протоном, а другая половина не связана. Получается, что в молекуле глицина pKa карбоксильной группы = 2,34, а pKa аминогруппы = 9,6. Я написал про молекулу глицина, потому что в остальных аминокислотах значения немного отличаются.
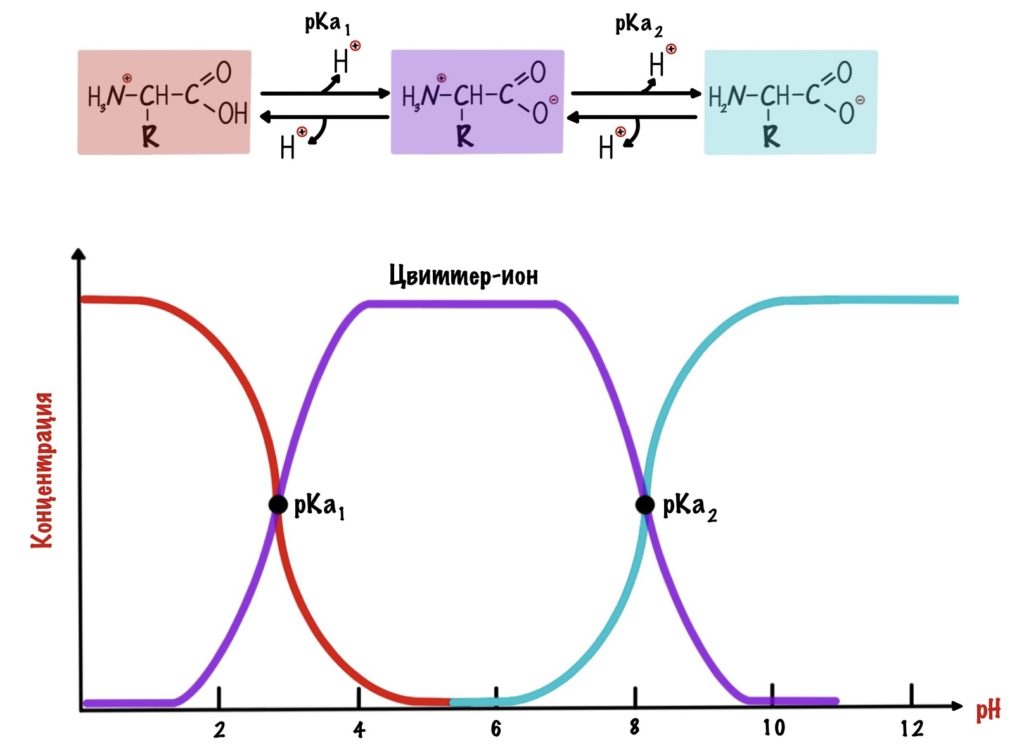
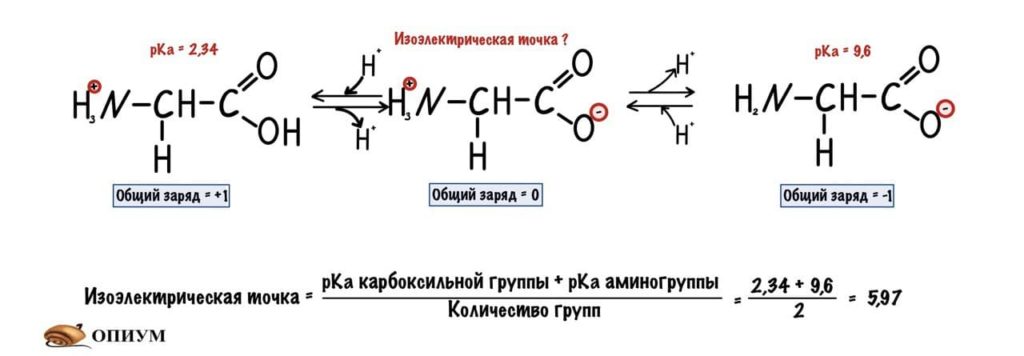
А теперь о том, ради чего все это затевалось — изоэлектрическая точка.
Изоэлектрическая точка — это pH среды, при которой заряд молекулы равен нулю. Да, вот так вот просто. Ее, кстати, можно посчитать — для этого нужно сложить pKa двух ближних функциональных групп и поделить на их количество. А их количество — две.
Сделаем тоже самое с молекулами посложнее, начнем с гистидина.
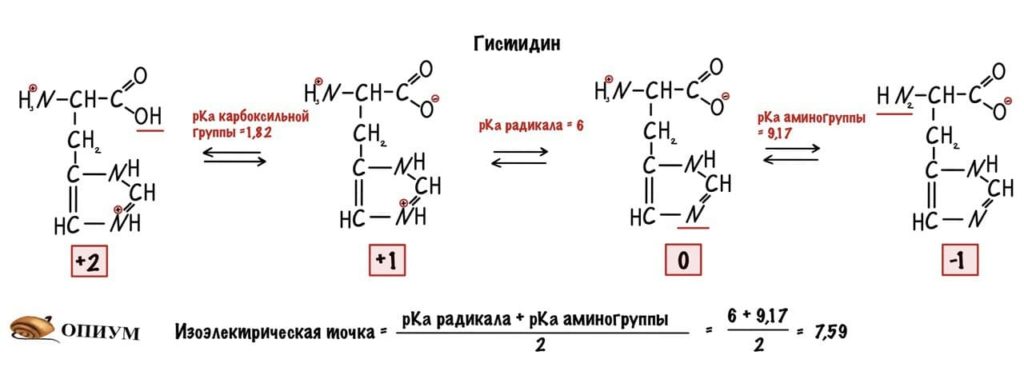
У гистидина есть заряженная группа, поэтому у него побольше вариантов заряда, чем у глицина. Мы видим, что у гистидина карбоксильная группа присоединяет водород при pH =1,82, а аминогруппа отдает протон водорода при pH=9,17. Вот про эти отличия я и говорил до этого, но так-то они не слишком большие. Радикал же отдает протон водорода при pH=6.
Сделаем тоже самое с глутаматом.
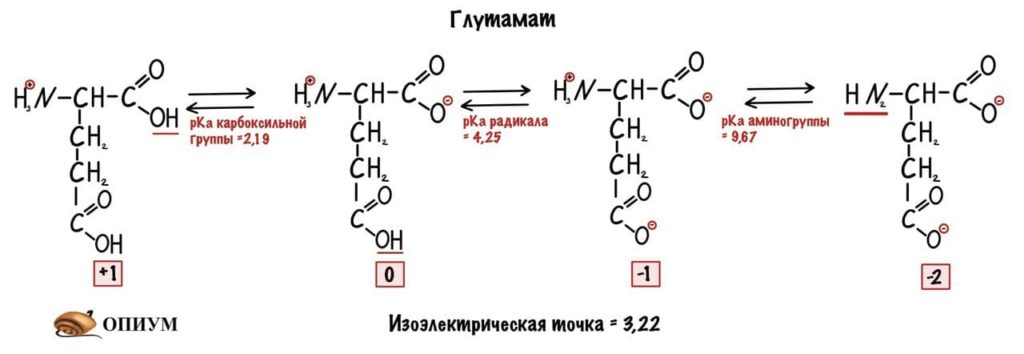
Думаю, что смысл понятен. У каждой аминокислоты своя собственная изоэлектрическая точка. Точки уже давно подсчитаны — достаточно найти их в интернете.
Сделаем красивый вывод:
Любая аминокислота цвиттер-ион, но только в изоэлектрической точке
Зачем это нужно? Ну давайте посмотрим. Мы знаем, что каждая аминокислота несет определенный заряд, но этот заряд меняется от pH среды. Если мы поместим аминокислоты в нейтральную среду и закинем туда катод и анод, то положительно заряженные аминокислоты направятся к аноду, а отрицательные к катоду. Остальные аминокислоты можно будет разделить с помощью изменения pH среды, ведь в изоэлектрической точке у аминокислоты не будет заряда. Нет заряда — нет движения к катоду или аноду, аминокислота стоит на месте. Вот мы и разделили аминокислоты в растворе, можно их изучить.
Образование пептидов
Теперь давайте соединим между собой парочку аминокислот, пусть это будет глицин и аланин. Соединяем их с помощью реакции дегидратации — отщепляем молекулу воды и получаем пептид.
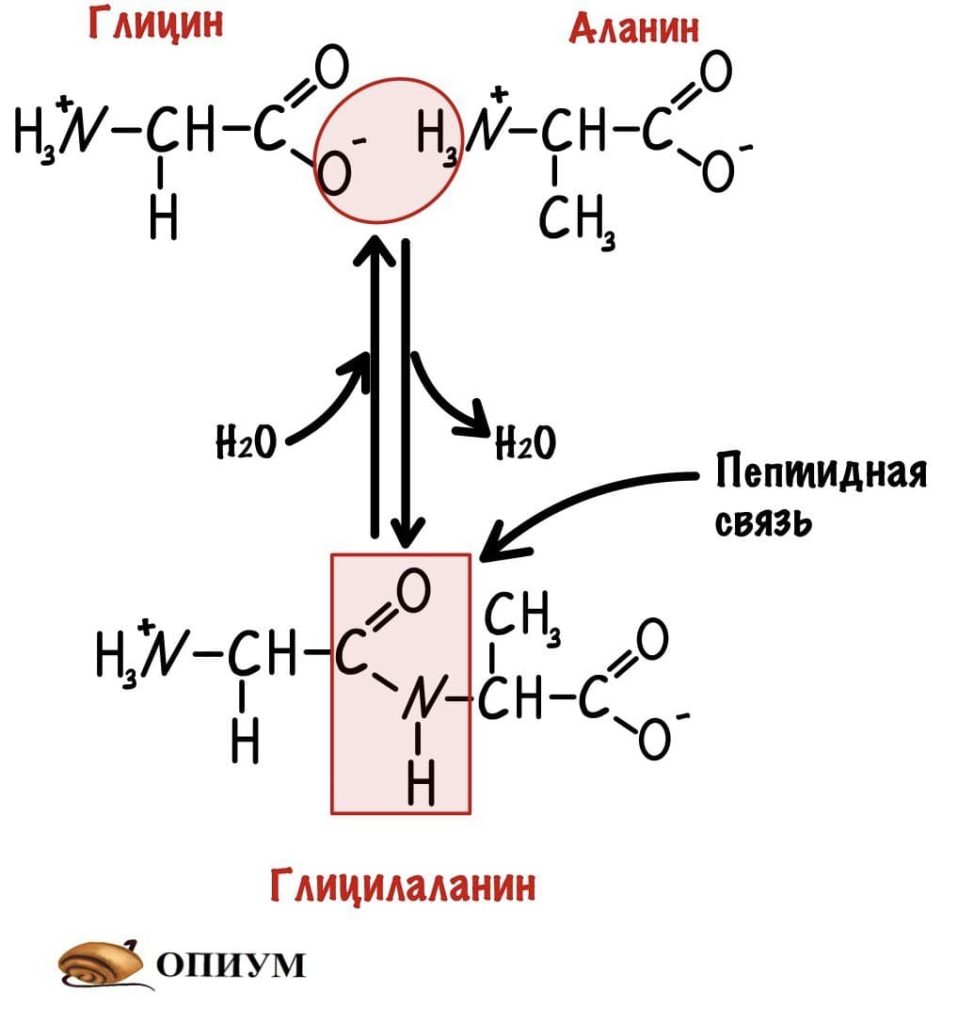
Какие группы вступали в реакцию? Да, аминогруппа и карбоксильная группа. Получается, что пептидная связь — это связь между аминогруппой одной аминокислоты с карбоксильной группой другой аминокислоты. Так как соединены две аминокислоты, то название молекулы — дипептид. Ничего не мешает мне присоединить еще одну.
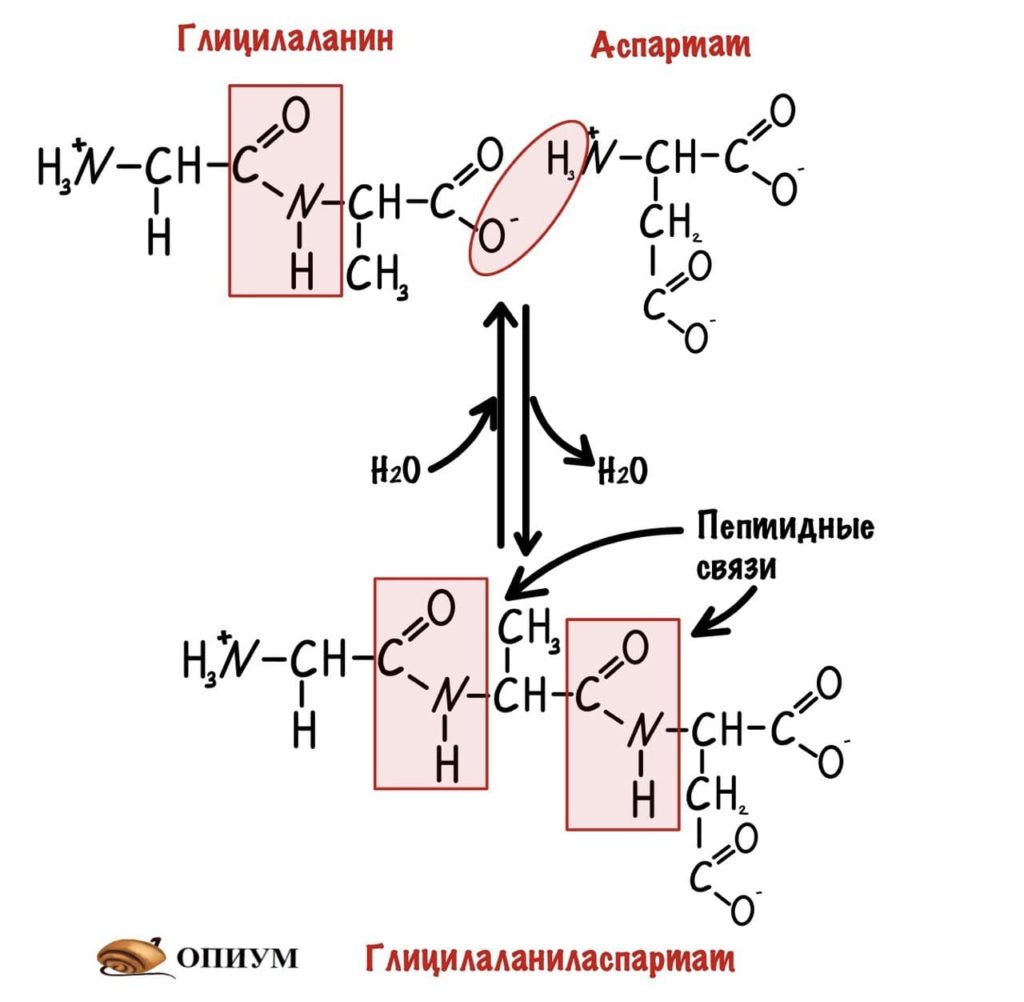
И это уже трипептид. Если соединены до 10 пептидов, то это олигопептид. От 10 до 50 — полипептид, ну а если больше 50, то это белок. Как видите реакция обратима, можно провести гидратацию по пептидной связи и пептид разрушится. На самом деле реакция гидратации идет намного лучше, а вот для дегидратации нужен источник энергии — АТФ, и рибосомальная РНК. Так что для синтеза пептидов/белков организм неплохо так тратится.
Ну и вы заметили, что я располагаю радикалы с разных сторон — то сверху, а то снизу. Это транс положение, оно более устойчиво, но можете писать как хотите.
Белок — это пептид, который содержит более 50 остатков аминокислот
Пептидная связь
У пептидной связи есть свои секретики, но мы не дадим ей хранить их просто так. Главный секрет в том, что двойная связь находится не у кислорода, а у азота… Хотя это не совсем двойная связь, но близка к ней. Как же это происходит? У азота есть неподеленная электронная пара, электроны могут перейти от азота к кислороду, а двойная связь перейдет от кислорода к азоту — неплохой такой обменчик. Это явление называется резонанс пептидной связи, именно из-за него во всех учебниках пишут про «частично-двойной характер пептидной связи».
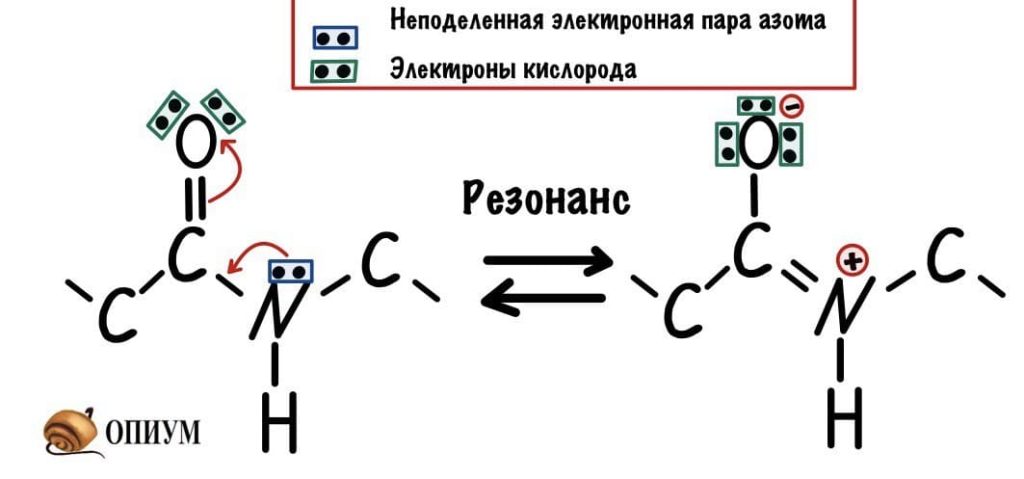
Пойдем еще немного дальше, о чем нам говорит двойная связь? Правильно, о гибридизации углерода — она здесь sp2. А значит угол между связями углерода 120 градусов, здесь они не прямо 120 градусов, но близки к этому. Идем дальше. Азот здесь тоже в sp2 гибридизации, понятно какие углы и у него. Но к чему я это все? Ах да, как будет выглядеть молекула?
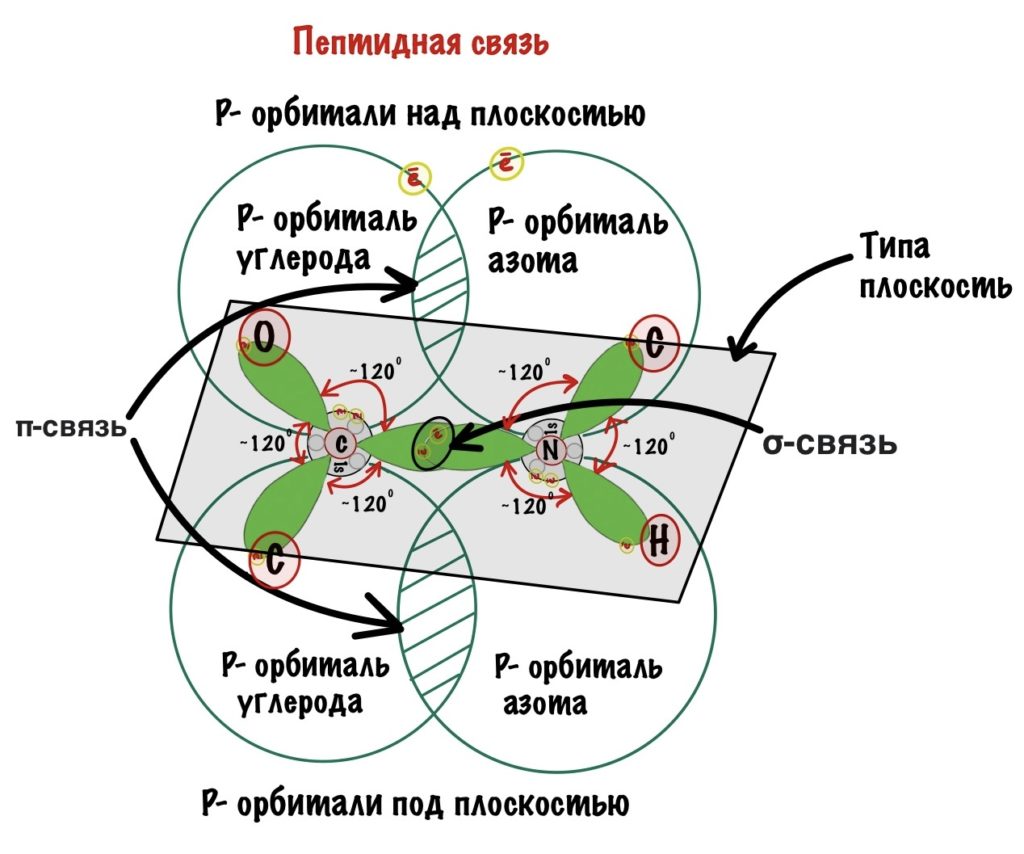
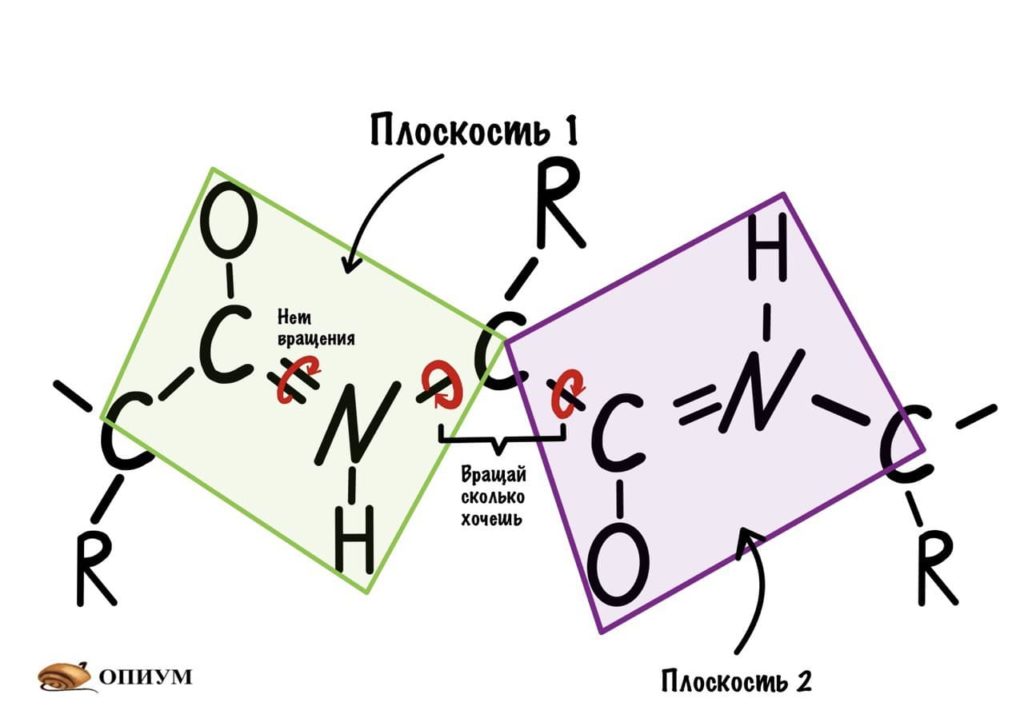
Так как все углы по 120 градусов, то все 6 атомов — 3 углерода, азот, водород и кислород, лежат в одной плоскости, как будто на ладошке. За счет того, что углерод и азот образуют две связи — одну пи и одну сигму, вращение вокруг этих связей практически невозможно. Но об этом чуть позже, сейчас давайте упростим эту схему.
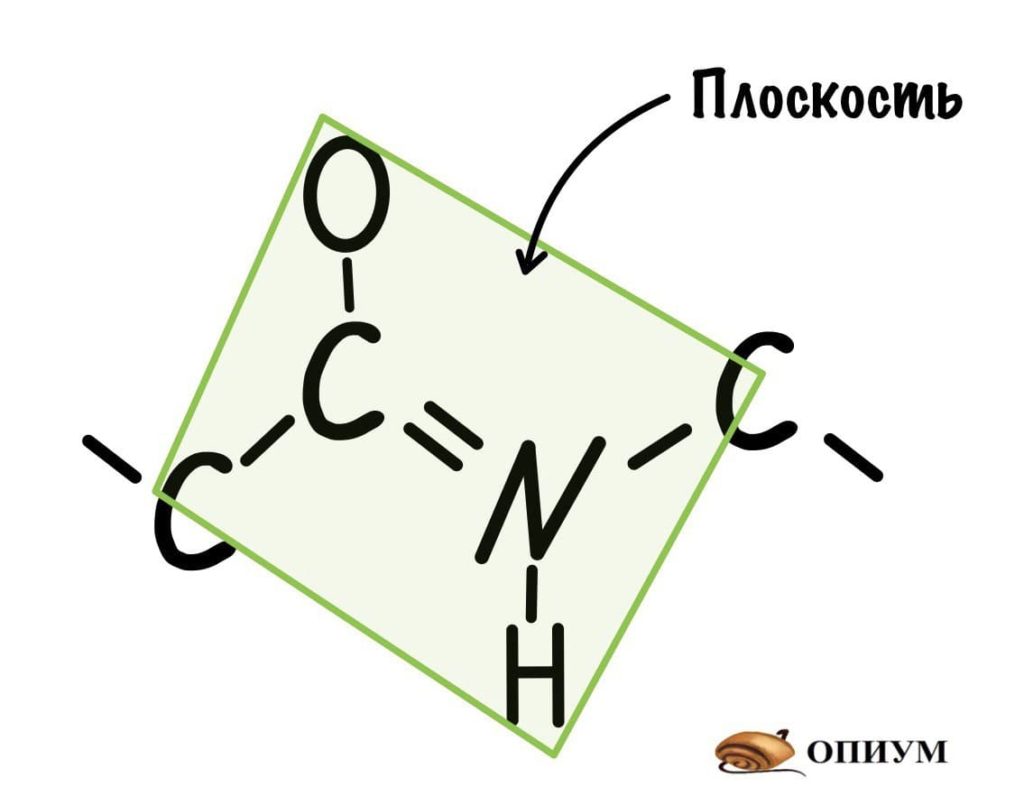
Это мы сделали только с одной пептидной связью, но что если добавить вторую? Получится кое что интересненькое…
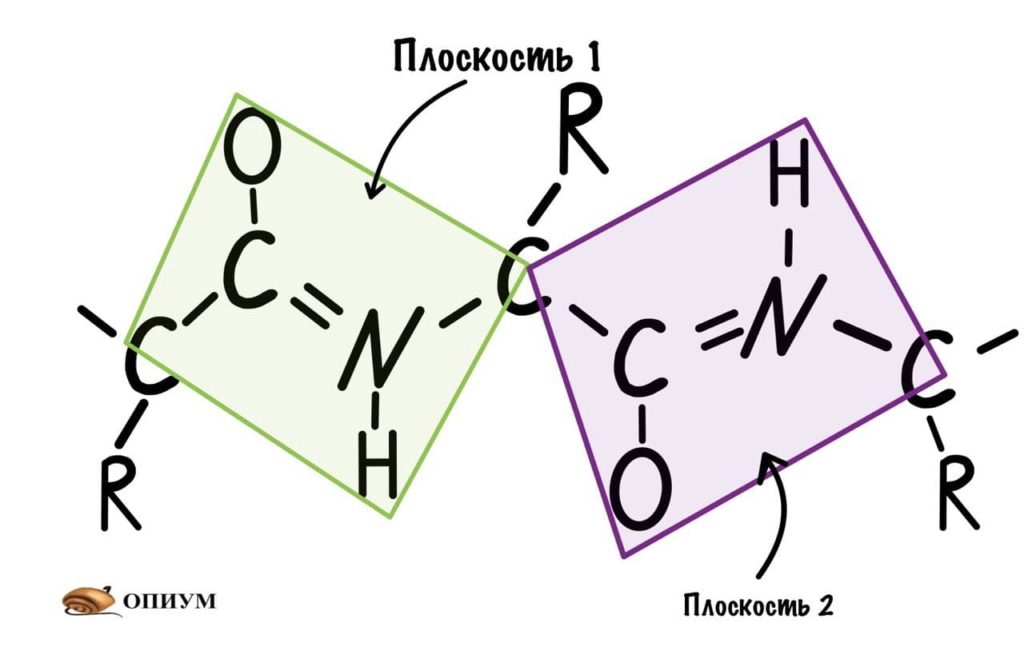
Следующая пептидная связь такая же, как и предыдущая. Получается, что опять 6 атомов лежат в одной плоскости, вы видите, что один атом углерода принадлежит сразу к двум плоскостям и это удивительно! Можно даже подумать, что все эти пептидные связи будут лежать в одной и той же плоскости, но это не так, а виной этому — вращение вокруг связей.
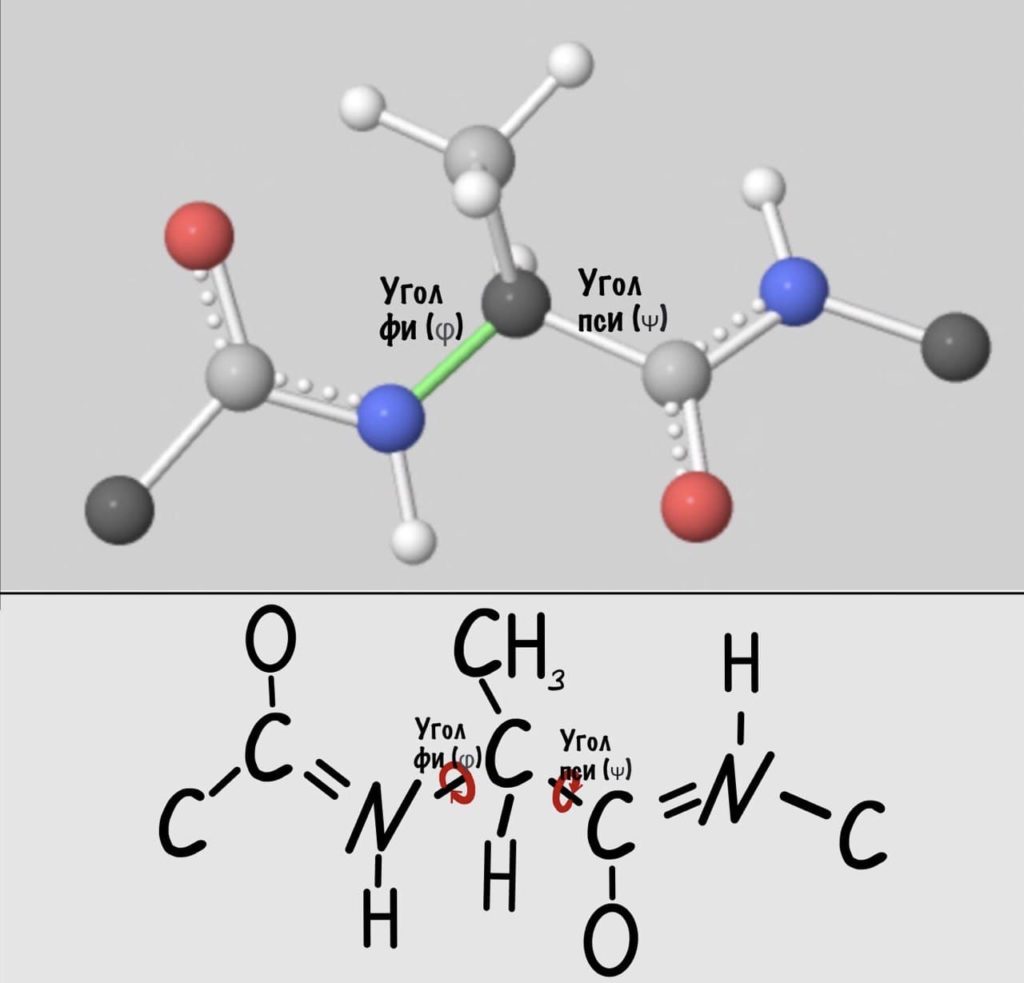
Диэдральные или торсионные углы
Название пугающее, но сейчас как устроим этим углам! Так, мы уже говорили о том, что вокруг пептидной связи не повращаться из-за того, что она частично двойная. Но ведь есть и другие связи, вокруг которых можно устроить веселуху.
Понимаю, что представить это не так уж и легко, но можно попробовать сделать! Получится конечно не совсем так, но принцип поймем. Возьмем ручку и два колпачка, засунем бумажку под каждый колпачок и начнем крутить. Условимся, что мои пальцы — альфа-углеродный атом, то есть место пересечения двух плоскостей.
Теперь мы поняли, как происходит вращение, но это еще не все. Существуют определенные углы между плоскостями и всего их два. Представьте, что нам захочется найти угол между углеродами, у которых карбоксильная группа, двух плоскостей. Или угол между двумя атомами азота, опять же, двух разных плоскостей. Задачка кажется сложной… Но перед этим, а зачем я вообще мучаю вас этим? Дело в том, что когда мы дойдем до конформации белковых молекул, то благодаря этим углам мы поймем: как и почему образуется альфа-спираль, тоже самое с бета-складчатостью. Так что потерпите немного!
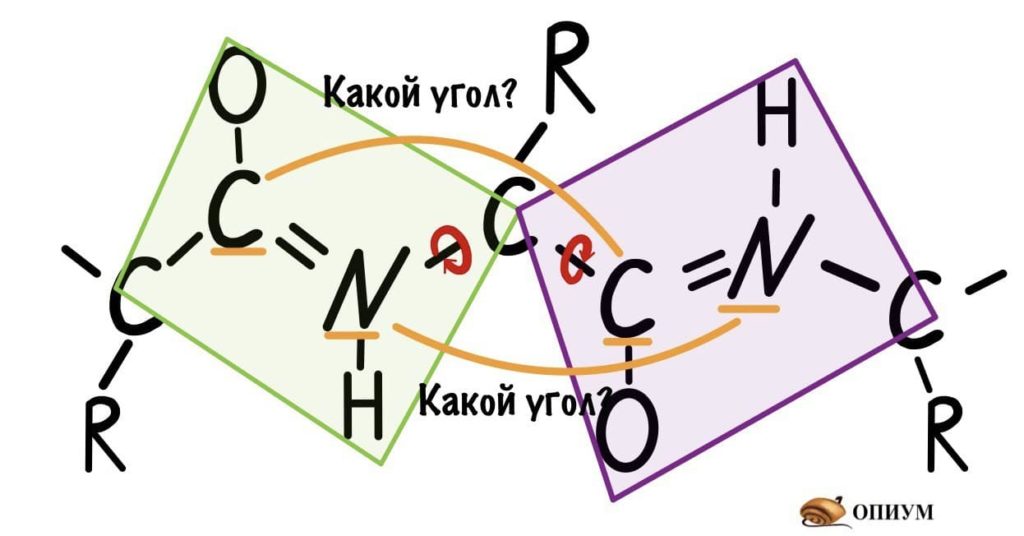
Если посмотреть на эту схему, то можно кое-что прикинуть: если мы будем вращать связь между N и C, то углерод с карбоксильной группой изменит положение относительно углерода другой плоскости, а вот азот останется на том же месте — угол между двумя азотами не изменится. А вот если начнем вращать связь между C и C, то все будет наоборот: угол между азотами изменится, но вот углероды с карбоксильной группой останутся на месте. Сложновато, но чуть дальше я дам пространственную картинку. Пока что мы пришли к выводу, что связь между N и C влияет на угол между углеродами — этот угол называется фи. А вот связь между C и C влияет на угол между атомами азота — угол пси.
Теперь можно и добавить атомы водорода в схему, они скоро нам понадобятся.
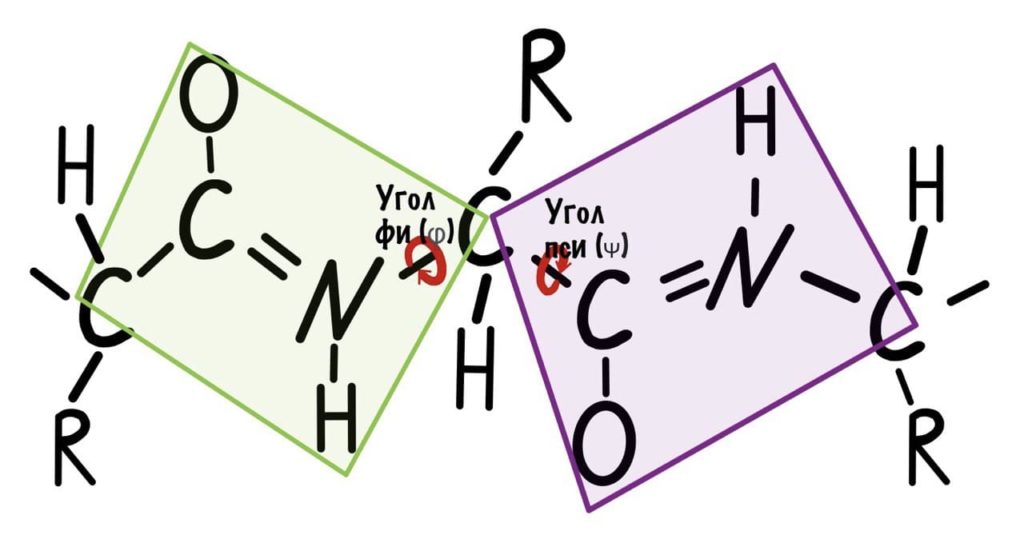
Добавим реалистичности, центральным радикалом у нас будет -CH3, а остальные радикалы уберем.
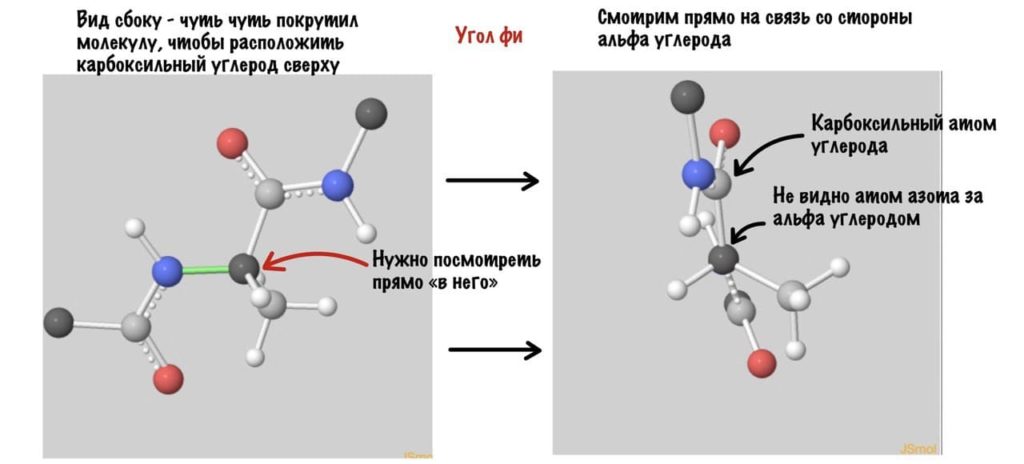
А теперь главный вопрос — как измерить эти углы? Хорошо, что уже это придумали… И мы можем сделать это вместе — заходите сюда и поехали! Первым делом нам нужно перевернуть молекулу так, чтобы расположить атом углерода с карбоксильной группой сверху. Зачем такие выкрутасы? Расскажу позже. А теперь посмотрим прямо в альфа атом углерода, да так что за ним спрятался азот. Как-то это странно звучит, но давайте попробуем.
Еще это можно посмотреть графически с помощью проекций Ньюмана.
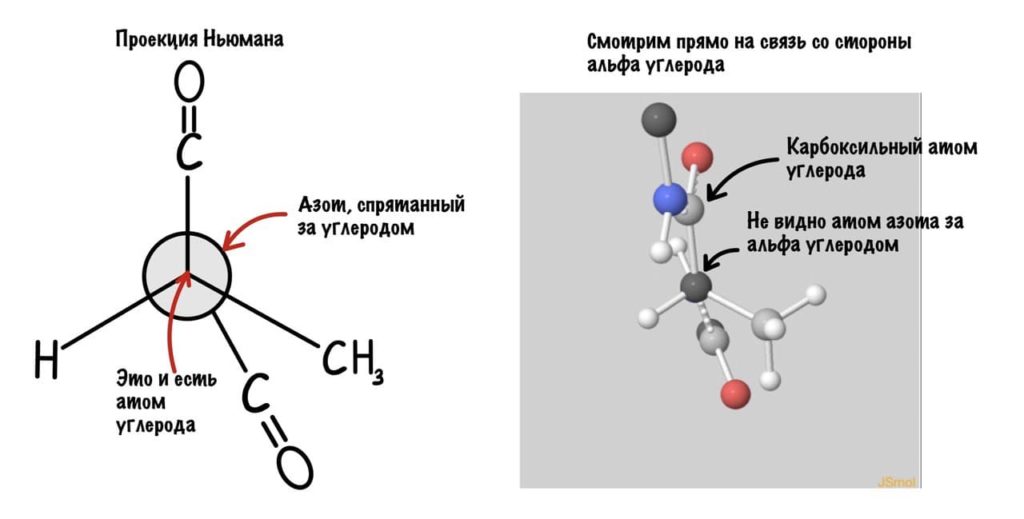
Так, повторим что такое угол фи — это угол между двумя карбоксильными атомами углерода. На рисунке уже их видно.
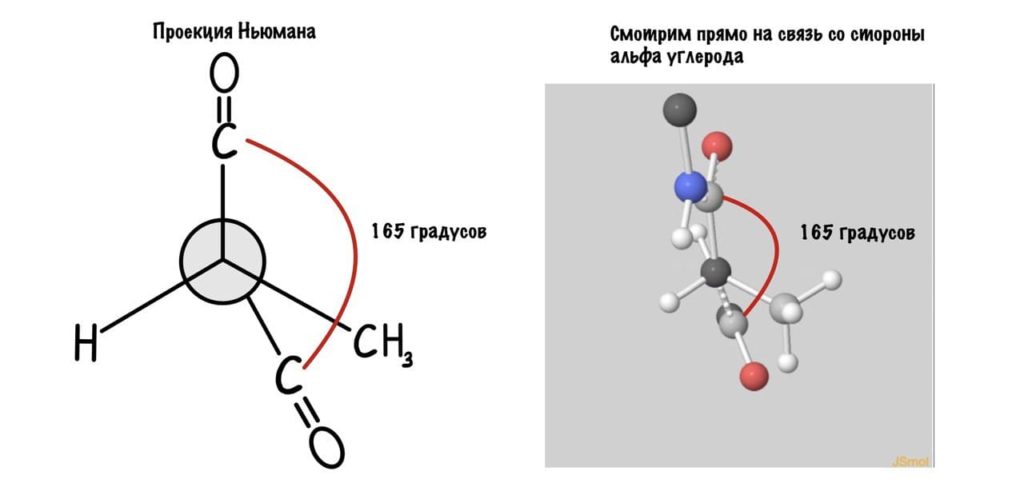
Поняли зачем так крутили молекулу? Да, просто так нам удобнее смотреть угол. А теперь начнем вращать и посмотрим как меняются углы.
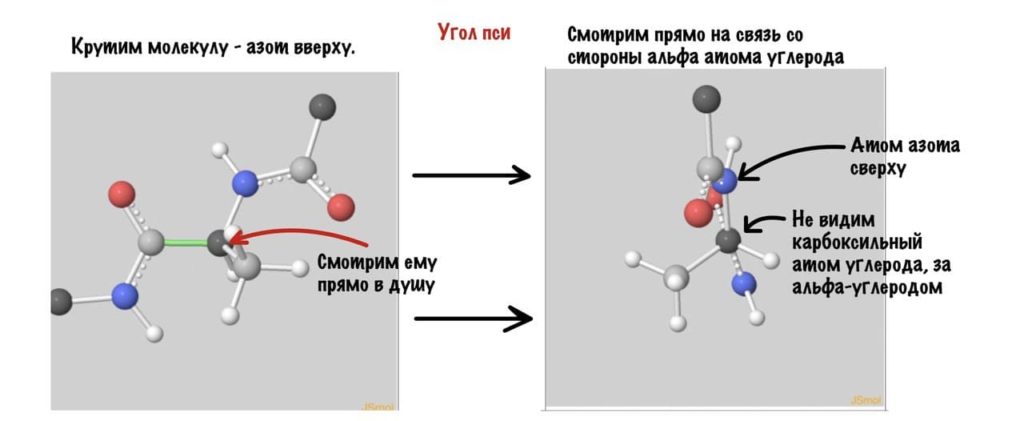
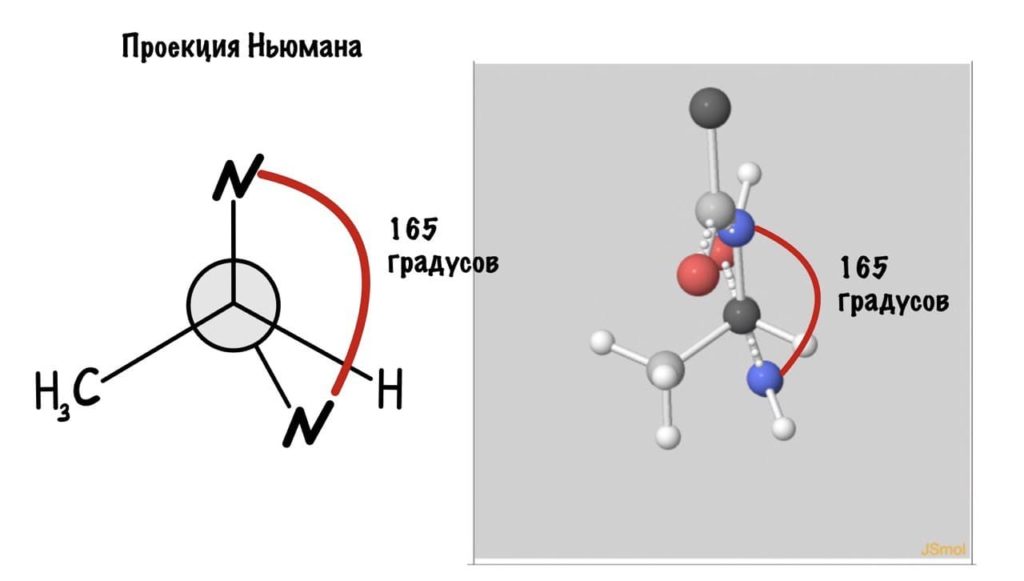
Угол пси по такой же логике. Крутим молекулу, чтобы атом азота оказался сверху и смотрим прямо в альфа атом углерода.
Еще разок построим проекцию Ньюмана, она немного отличается, и сразу же отметим углы.
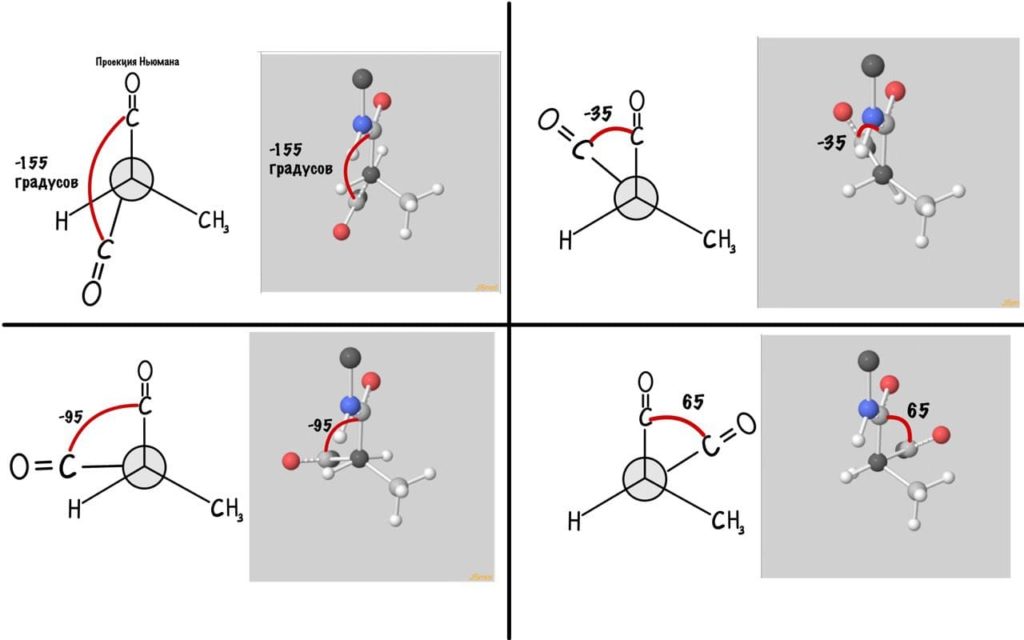
Думаю, что принцип понятен. Дальше можете покрутить сами, правильно? Я не сказал про одно большое «НО» — не каждый угол возможен, так как у атомов есть электронные оболочки, которые заряжены отрицательно. Если электронные оболочки подходят слишком близко, то они отталкиваются и угол меняется. Какие углы возможны? Для этого еще разок зайдите сюда и включите на панельке справа силы Ван-дер-Вальса и show clashes.
Подробнее о влиянии этих углов в следующей статье.
Peptides are short polymer fragments composed from amino acids. Each peptide has a certain amino acid sequence denoted with a three letter or one letter code; for example the amino acid alanine is abbreviated as “Ala” or “A.” The charge of the peptides in the solution depends upon the solution acidity. The isoelectric point (pI) refers to the solution acidity value at which the peptide molecule has the net charge of zero. The solubility of the peptide is minimal at the isoelectric point. Use available web servers to calculate the pI value for a peptide amino acid sequence.
Write the peptide sequence using the one-letter code. For example, if a peptide has an amino acid sequence Ala-Ser-Glu-Leu-Pro (Alanine—Serin—Glumatic acid—Leucine—Proline), then the one letter sequence is «ASELP.» If necessary consult the three letter to one letter conversion table given in Resources.
Use any web browser, Internet Explorer or Firefox, for example, to navigate to a server that calculates the peptide isoelectric point (pI); see Resources.
Enter the peptide one-letter sequence—»ASELP» in our example—in the box, and click on «Compute.»
Read the isoelectric point (pI) value given in the line «Theoretical pI/Mw.» In our example, the pI is 4.00. Note the server also calculates the molecular weight (Mw) of the peptide.
Смотреть видео:
#химия #химияпросто #неорганика #егэпохимии #эксперименты #химик #егэхимия #опыты #химияегэ
Свежая информация для ЕГЭ и ОГЭ по Химии (листай):
С этим видео ученики смотрят следующие ролики:

Задача на определение формулы трипептида. Биохимия.
День знаний

Движение пептидов в электрофоретическом поле при разных рН. Биохимия.
День знаний

Степень окисления. Определение степеней окисления. Часть 1
Your system education

Олимпиадная задача на определение состава смеси органических веществ.
День знаний
Облегчи жизнь другим ученикам — поделись! (плюс тебе в карму):
10.12.2021
Пептиды представляют собой короткие полимерные фрагменты, состоящие из аминокислот. Каждый пептид имеет определенную аминокислотную последовательность, обозначенную трехбуквенным или однобуквенным кодом; например, аминокислота аланин сокращенно обозначается как «Ala» или «A.». Заряд пептидов в растворе зависит от кислотности раствора. Изоэлектрическая точка (pI) относится к значению кислотности раствора, при котором пептидная молекула имеет суммарный заряд, равный нулю. Растворимость пептида минимальна в изоэлектрической точке. Используйте доступные веб-серверы для расчета значения pI для пептидной аминокислотной последовательности.
Напишите пептидную последовательность, используя однобуквенный код. Например, если пептид имеет аминокислотную последовательность Ala-Ser-Glu-Leu-Pro (аланин-серин-глюкозная кислота-лейцин-пролин), то последовательность из одной буквы «ASELP». При необходимости обратитесь к таблице перевода из трех букв в одну, приведенную в разделе «Ресурсы».
Используйте любой веб-браузер, Internet Explorer или Firefox, например, чтобы перейти на сервер, который вычисляет изоэлектрическую точку пептида (pI); см. Ресурсы.
Введите пептидную однобуквенную последовательность — «ASELP» в нашем примере — в поле и нажмите «Compute».
Считайте значение изоэлектрической точки (pI), указанное в строке «Теоретическое значение pI / Mw». В нашем примере pI составляет 4, 00. Обратите внимание, что сервер также рассчитывает молекулярную массу (Mw) пептида.
Строение полипептидной цепи и пептидной связи
Мономеры аминокислот,
входящие в состав полипептидов, называют
аминокислотными
остатками.
Аминокислотный остаток, имеющий свободную
аминогруппу, называют N-концевым
и записывают слева пептидной цепи, а
имеющий свободную α-карбо-ксильную
группу – С-концевым, и записывают справа.
Цепь повто-ряющихся атомов –СН – СО – NH–
в полипетидной цепи называется пептидным
остовом.
Полипептидная
цепь имеет следующий общий вид:
где R1,
R2,
R3,
… Rn
– радикалы аминокислот, образующие
боковую цепь.
В проявлении
биологических функций пептидов и белков
большую роль играет электронное и
пространственное строение пептидной
группы:
Наличие р-π-сопряжения
в пептидной группе приводит к частичной
двоесвязанности связи С – N.
Длина пептидной связи
С – N
равна 0,132 нм, а длина связи N – Сα
составляет 0,147 нм. Одинарная связь С – N
в пептидах примерно на 40% имеет характер
двойной связи, а двойная связь С = О
приблизительно на 40% является одинарной.
Это обстоятельство приводит к двум
важным последствиям:
1) иминогруппа
(– NH –)
пептидной связи не обладает заметно
выраженной способностью отщеплять или
присоединять протон;
2) свободное
вращение вокруг связи C – N
отсутствует.
Частичая
двоесвязанность связи С – N
означает, что пептидная группа представляет
собой плоский участок пептидной цепи.
Плоскости пептидных групп расположены
под углом друг к другу:
Вокруг связей
С – Сα
и N – Сα
возможно вращение, хотя и ограниченное
размерами и характером радикалов, что
позволяет полипептидной цепи принимать
различные конфигурации.
Пептидная связь
является единственной ковалентной
связью, при помощи которой аминокислотные
остатки соединяются друг с другом,
образуя остов белковой молекулы.
Пептидные связи
обычно расположены в транс-конфигурации,
т.е. α-углеродные атомы располагаются
по разные стороны от пептидной связи.
В результате боковые радикалы аминокислот
находятся в пространстве на наиболее
удаленном расстоянии друг от друга.
Hоменклатура пептидов
При названии
полипептида к названию всех аминокислотных
остатков, кроме последнего, добавляют
суффикс —ил,
концевая аминокислота имеет окончание
—ин.
Например, пептид мет-асп-вал-про имеет
полное название метиониласпарагилвалилпролин.
Кислотно-основные свойства пептидов
Многие короткие
пептиды были получены в чистом
кристал-лическом виде. Высокие температуры
их плавления указывают на то, что из
нейтральных растворов пептиды
кристаллизуются в виде диполярных
ионов. Поскольку ни одна из α-карбоксильных
групп и ни одна из α-аминогрупп, участвующих
в образовании пептидных связей, не может
ионизироваться в интервале рН от 0 до
14, кислотно-основные свойства пептидов
определяются свободной NH2
группой N-концевого
остатка и свободной карбоксильной
группой
С-концевого остатка пептида
и теми R-группами,
которые способны к ионизации. В длинных
пептидных цепях число ионизированных
R-групп
обычно велико по сравнению с двумя
ионизированными группами концевых
остатков пептида. Поэтому для характеристики
кислотно-основных свойств пептидов мы
будем рассматривать короткие пептиды.
Свободная
α-аминогруппа и свободная концевая
карбоксильная группа в пептидах разделены
значительно большим расстоянием, чем
в простых аминокислотах, и поэтому
электростатические взаимо-действия
между ними ослаблены. Величины рK
для концевых карбоксильных групп в
пептидах несколько выше, а для концевых
α-аминогрупп несколько ниже, чем в
соответствующих свободных аминокислотах.
У R-групп
в коротких пептидах и в соответствующих
свободных аминокислотах величины рK
заметно не различаются.
Для определения
области рН, в которой может находиться
изоэлектрическая точка исследуемого
короткого пептида, достаточно сравнить
число свободных аминогрупп и число
свободных карбоксильных групп, включая
N-
и С-концевые группы. Если число аминогрупп
превышает число карбоксильных групп,
изоэлектри-ческая точка пептида будет
лежать в щелочной области рН, так как
для предотвращения протонирования
аминогрупп необходима щелочь. Если
число карбоксильных групп превышает
число аминогрупп, изоэлектрическая
точка будет находиться в кислой области
рН, так как кислая среда подавляет
диссоциацию карбоксильных групп.
Соседние файлы в папке Амины, аминокислоты
- #
- #