Иногда вас просят рассчитать pOH, а не pH. Вот обзор определения pOH и пример расчета.
Содержание
- Ключевые выводы: как рассчитать pOH
- Кислоты, основания, pH и pOH
- Как определить pOH с помощью расчетов
- Примеры проблем с pOH
- Понять, почему pH + pOH = 14
Ключевые выводы: как рассчитать pOH
- pH – это показатель кислотности или концентрации ионов водорода, а pOH – показатель щелочности или концентрации гидроксид-ионов.
- Если вы знаете pH, это легко для расчета pOH, потому что pH + pOH = 14.
- Иногда вам нужно рассчитать pOH из концентрации гидроксид-иона [OH – ]. Здесь вам понадобится калькулятор, использующий уравнение pOH = -log [OH-].
Кислоты, основания, pH и pOH
Есть несколько способов определить кислоты и основания, но pH и pOH относятся к концентрации ионов водорода и концентрации гидроксид-иона соответственно. «P» в pH и pOH означает «отрицательный логарифм» и используется для облегчения работы с очень большими или малыми значениями. pH и pOH имеют значение только при нанесении на водные (водные) растворы. Когда вода диссоциирует, она дает ион водорода и гидроксид.
H 2 O ⇆ H + + OH –
При вычислении pOH помните, что [] относится к молярности, M.
K w = [H + ] [OH – ] = 1×10 -14 при 25 ° C
для чистой воды [H + ] = [OH – ] = 1×10 -7
Кислотный раствор: [H + ]> 1×10 -7
Базовое решение: [H + ] -7
Как определить pOH с помощью расчетов
Есть несколько различных формул, которые вы можете использовать для расчета pOH, концентрации гидроксид-иона или pH (если вы знаете pOH):
pOH = -log 10 [OH – ]
[OH – ] = 10 -pOH
pOH + pH = 14 для любого водного раствора
Примеры проблем с pOH
Найдите [OH – ] с учетом pH или pOH. Вам дано, что pH = 4,5.
pOH + pH = 14
pOH + 4,5 = 14
pOH = 14 – 4,5
pOH = 9,5
[OH – ] = 10 -pOH
[OH – ] = 10 -9,5
[OH – ] = 3,2 x 10 -10 M
Найдите ион гидроксида концентрация раствора с pOH 5,90.
pOH = -log [OH – ]
5.90 = -log [OH – ]
Поскольку вы работаете с журналом, вы можете переписать уравнение, чтобы найти концентрацию гидроксид-иона:
[OH – ] = 10 -5.90
Чтобы решить эту проблему, воспользуйтесь научным калькулятором и введите 5,90 и используйте кнопку +/-, чтобы сделать его отрицательным, а затем нажмите клавишу 10 x . На некоторых калькуляторах вы можете просто взять обратный логарифм -5,90.
[OH – ] = 1. 25 x 10 -6 M
Найдите pOH химического раствора, если концентрация гидроксид-иона составляет 4,22 x 10 -5 M.
pOH = -log [OH – ]
pOH = -log [4,22 x 10 -5 ]
Чтобы найдите это на научном калькуляторе, введите 4,22 x 5 (сделайте отрицательным с помощью клавиши +/-), нажмите клавишу 10 x и нажмите равно, чтобы получить число в экспоненциальном представлении. Теперь нажмите журнал. Помните, что ваш ответ – отрицательное значение (-) этого числа.
pOH = – (-4,37)
pOH = 4,37
Понять, почему pH + pOH = 14
Вода, сама по себе или в составе водного раствора, подвергается самоионизации, что может быть представлено уравнением:
2 H 2 O ⇆ H 3 O + + OH –
Формы равновесия между неионизированной водой и гидрокарбонием (H 3 O + ) и гидроксид (OH – ) ионы. Выражение для константы равновесия Kw:
K w = [H 3 O + ] [OH – ]
Строго говоря, это отношение действительно только для водных растворов при 25 ° C, потому что тогда значение K w равно 1 x 10 -14 . Если взять журнал обеих сторон уравнения:
log (1 x 10 -14 ) = log [ H 3 O + ] + log [OH – ]
(Помните, что при умножении чисел добавляются их журналы.)
log (1 x 10 -14 ) = – 14
– 14 = журнал [H 3 O + ] + журнал [OH – ]
Умножение обеих частей уравнения на -1:
14 = – журнал [H 3 O + ] – журнал [OH – ]
pH определяется как – log [H 3 O + ], а pOH определяется как -log [OH – ], поэтому соотношение становится:
14 = pH – (-pOH)
14 = pH + pOH
В
чистой воде при 25 °C концентрации
ионов водорода ([H+])
и гидроксид-ионов
([OH−])
одинаковы и составляют 10−7
моль/л, это напрямую следует из определения
ионного
произведения воды,
которое равно [H+] · [OH−]
и составляет 10−14
моль²/л² (при 25 °C).
Когда
концентрации обоих видов ионов в
растворе одинаковы, говорят, что раствор
имеет нейтральную
реакцию. При добавлении к воде кислоты
концентрация ионов водорода увеличивается,
а концентрация гидроксид-ионов
соответственно уменьшается, при
добавлении основания —
наоборот, повышается содержание
гидроксид-ионов, а концентрация ионов
водорода падает. Когда [H+] > [OH−]
говорят, что раствор является кислым,
а при [OH−] > [H+] —
щелочным.
Для
удобства представления, чтобы избавиться
от отрицательного показателя степени,
вместо концентраций ионов водорода
пользуются их десятичным логарифмом,
взятым с обратным знаком, который
собственно и является водородным
показателем — pH.
pOH
Несколько
меньшее распространение получила
обратная pH величина — показатель
основности раствора, pOH, равная
отрицательному десятичному логарифму
концентрации в растворе ионов OH−:
как
в любом водном растворе при 25 °C [H
+
][OH −
] = 1,0×10
− 14,
очевидно, что при этой температуре:
22. Гидролиз солей. Факторы, влияющие на процессы гидролиза солей.
1)
Гидро́лиз
(от др.-греч.
ὕδωρ —
вода и λύσις —
разложение) — один из видов химических
реакций сольволиза,
где при взаимодействии веществ с водой
происходит разложение исходной молекулы
с образованием новых соединений.
Гидролизу подвергаются соединения
различных классов: соли,
углеводы,
белки,
сложные
эфиры,
жиры
и др.
Гидролиз
солей
Взаимодействие
ионов
соли с водой, приводящее к образованию
молекул слабого электролита,
называют гидролизом
солей.
Различают
несколько вариантов гидролиза солей:
-
1.
Гидролиз соли слабой кислоты и сильного
основания:
Na2CO3
+ Н2О
= NaHCO3
+ NaOH
CO32−
+ H2O
= HCO3−
+ OH−
(раствор
имеет щелочную реакцию, реакция протекает
обратимо)
-
2.
Гидролиз соли сильной кислоты и слабого
основания:
CuCl2
+ Н2О
= CuOHCl + HCl
Cu2+
+ Н2О
= CuOH+
+ Н+
(раствор
имеет кислую реакцию, реакция протекает
обратимо)
-
3.
Гидролиз соли слабой кислоты и слабого
основания:
Al2S3
+ 6H2O
= 2Al(OH)3
+ 3H2S
2Al3+
+ 3S2−
+ 6Н2О
= 2Al(OH)3(осадок)
+ ЗН2S(газ)
(Гидролиз
в этом случае протекает практически
полностью,
так как оба продукта гидролиза уходят
из сферы реакции в виде осадка или
газа).
Соль
сильной кислоты и сильного основания
не подвергается гидролизу, и раствор
нейтрален
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Автор:
Monica Porter
Дата создания:
22 Март 2021
Дата обновления:
26 Май 2023
Содержание
- TL; DR (слишком долго; не читал)
- Значение pH и pOH
- Расчет рН
- Расчет pOH
- Добавление pH и pOH
Будучи студентом-химиком, вы узнаете, как рассчитать pH и pOH кислот и оснований. Концепции и расчеты не сложны, если вы знакомы с логарифмами и концентрацией решений.
TL; DR (слишком долго; не читал)
Для расчета pH = — log (H3O+ концентрация ионов). Расчет для pOH is — log (OH— концентрация ионов).
Для кислот и оснований концентрация раствора включает в себя числа, которые могут изменяться в широком диапазоне значений — от миллиона до одного. В отличие от большинства единиц, которые являются линейными, pH и pOH основаны на общем (основание 10) логарифме, что позволяет выражать значения в одну или две цифры, которые в противном случае охватывали бы многие порядки величины. Хотя это требует привыкания, компактность единиц pH и pOH удобна и экономит время и путаницу. Единица pH указывает на кислотность, где меньшие числа означают более высокие концентрации H3O+ (гидрония) ионы, и варьируются от более 14 (очень щелочные) до отрицательных чисел (очень кислотные; эти отрицательные числа используются в основном в научных целях). По этой шкале рН деионизированной воды равен 7. Шкала рОН очень похожа на рН, но обращена. Он использует ту же систему нумерации, что и pH, но измеряет OH— ионов. В этом масштабе вода имеет то же значение (7), но вы найдете основания на нижнем уровне и кислоты на верхнем уровне.
Расчет рН
Чтобы рассчитать pH по молярной концентрации кислоты, возьмите общий логарифм H3O+ концентрация ионов, а затем умножить на -1: pH = — log (H3O+). Например, каков pH 0,1 М раствора соляной кислоты (HCl), если предположить, что кислота полностью диссоциирована на ионы в растворе? Концентрация H3O+ количество ионов составляет 0,1 моль на литр. pH = — log (.1) = — (- 1) = 1.
Расчет pOH
Расчет для pOH следует тем же правилам, что и для pH, но использует концентрацию OH— ионы: рОН = — log (OH—). Например, найти pOH 0,02 М раствора гидроксида натрия (KOH). Концентрация ОН— количество ионов составляет 0,02 моль на литр. рОН = — log (.02) = — (- 1,7) = 1,7.
Добавление pH и pOH
Когда вы вычисляете как pH, так и pOH для данного раствора, цифры всегда складываются до 14. Например, pH и pOH воды равны 7, а 7 + 7 = 14. 0,02 М раствор гидроксида натрия в примере. выше будет иметь рН 12,3. Это означает, что если вы знаете pH, вы можете вычесть его из 14, чтобы найти pOH, и наоборот.
Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований
В практике аналитической химии широко используются кислотно-основные реакции для разделения, растворения, определения ионов, создания условий для взаимодействия частиц в растворе и др. Поэтому необходимо научиться рассчитывать равновесные концентрации ионов ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-581.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-582.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-583.png)
Константа автопротолиза растворителя ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-585.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-586.png)
для воды ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-587.png)
для метанола
Учитывая, что активность чистого растворителя (стандартное состояние вещества) равна 1, справедливы выражения:
(в чистой воде ионная сила I мала, близки к 1);
При расчетах, связанных с кислотно-основным равновесием и кислотно-основными взаимодействиями в растворах слабых протолитов, считают табличные термодинамические значения констант ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-592.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-593.png)
В качестве характеристик кислотности используются отрицательные десятичные логарифмы активности (при приближенных расчетах без учета ионной силы — логарифмы концентрации) ионов лиония и лиата (для воды ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-594.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-595.png)
Для воды:
Соответственно: ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-598.png)
В чистой воде, нейтральном водном растворе:
Для метанола (см. также пример 3.7):
и нейтральному раствору в метаноле соответствует pH = 8,35.
Эти соотношения используют для вычисления равновесной концентрации одного из ионов растворителя, если концентрация другого известна.
При описании поведения сильных и слабых кислот и оснований следует помнить о том, что сильные протолиты в водных растворах диссоциируют практически полностью, степень диссоциации (ионизации) ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-602.png)
или (в упрощенном виде):
Из реакций следует, что для одноосновных протолитов в воде справедливо:
Если НА и В — кислотно-основная сопряженная пара и В соответствует ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-608.png)
а для растворителя
При растворении в воде солей, в состав которых входит анион слабой кислоты (![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-611.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-612.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-613.png)
Реакция гидролиза характеризуется константой равновесия, соответствующей протолитыческому поведению гидролизующейся частицы ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-614.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-615.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-616.png)
Например, для соли ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-617.png)
Для соли с катионом слабого основания, например ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-620.png)
(поскольку для сопряженных протолитов в воде ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-622.png)
Для соли, в которой и катион, и анион — ионы слабых протолитов, например
(протекает гидролиз “по катиону» и “по аниону”, среда зависит от ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-625.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-626.png)
Для кислой соли с катионом сильного основания, например ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-628.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-629.png)
(упрощенно: 2) ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-631.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-632.png)
Для реакции 1)
для реакции 2)
От соотношения ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-635.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-636.png)
Заменяя концентрации компонентов в правой части уравнения через соответствующие константы, ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-638.png)
Решая последнее уравнение относительно ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-640.png)
Формула (3.7) упрощается при пренебрежении малыми величинами и при допущении
Например, если ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-643.png)
Для приближенных расчетов разных случаев кислотно-основного равновесия можно воспользоваться формулами таблицы 3.1. Значения ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-645.png)
В случаях, когда нельзя считать равновесную концентрацию ионизирующегося вещества равной его аналитической концентрации (не соблюдается условие ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-646.png)
Пример 3.1.
Рассчитайте ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-647.png)
0,10 М раствора ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-648.png)
Решение:
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-648.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-649.png)
Проверка условия ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-651.png)
Таблица 3.1
Формулы для приближенного расчета ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-653.png)
Пример 3.2.
Рассчитайте ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-655.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-656.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-657.png)
Решение:
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-657.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-658.png)
Поскольку ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-660.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-661.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-661.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-661.png)
откуда:
Решаем квадратное уравнение относительно ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-661.png)
Пример 3.3.
Рассчитайте pH 0,010 М раствора муравьиной кислоты в присутствии 0,010 М ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-665.png)
Решение:
Отношение ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-666.png)
С учетом соотношения (2.11) термодинамической и реальной констант:
Пример 3.4.
Рассчитайте ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-822.png)
Решение:
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-824.png)
Запишем уравнение электронейтральности:
Тогда:
откуда: ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-836.png)
Без учета автопротолиза воды:
pH = 7, расчет менее точен.
Подобный подход необходим и при расчете pH очень разбавленных ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-840.png)
Пример 3.5.
Рассчитайте ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-842.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-843.png)
Решение:
Определяем тип гидролизующейся соли (тип протолита).
Гидролиз протекает по аниону, т. е. ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-845.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-846.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-847.png)
Поскольку ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-851.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-853.png)
отсюда:
Решаем квадратное уравнение:
Находим степень гидролиза ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-858.png)
Пример 3.6.
К 50 мл 0,10 М раствора ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-860.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-861.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-863.png)
Решение:
После смешивания двух растворов получаем:
В результате взаимодействия протолитов в растворе образуется кислая соль (амфолит) согласно уравнению реакции:
Для угольной кислоты ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-866.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-868.png)
Пример 3.7.*
К 20 мл 0,20 М раствора соли аммония в безводном метаноле добавили 10 мл 0,20 М раствора метилата натрия в безводном метаноле. Определите: а) pH исходного раствора соли; в) pH полученного раствора, если для метанола ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-871.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-873.png)
Решение:
а) в метанольном растворе протекает протолитическая реакция:
Откуда
б) протолитическая реакция взаимодействия при сливании двух растворов:
Значение константы равновесия реакции:
указывает на ее практическую необратимость и возможность приближенных расчетов. Используя эту константу или формулу для расчета pH в растворе, содержащем кислотно-основную сопряженную пару (3.11), можно вычислить pH полученного раствора:
откуда
Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы:
Шкала рН представляет собой метод для представления, насколько кислотным или основным является вещество. На первый взгляд шкала кажется нелогичной, но она широко используется в биологии, химии, геологии и других физических науках. Коммуникация в этих областях требует понимания концепции pH. Однажды понятая, шкала рН является полезным показателем для передачи информации о критических физических свойствах веществ.
Определение
pH, который всегда пишется строчными буквами «p», представляет собой шкалу того, сколько ионного водорода содержится в веществе. Шкала работает от 0 до 14. Полностью чистая вода имеет рН 7, который является нейтральным. Чем ниже число на шкале, тем более кислым является вещество. Чем выше число на шкале, тем более щелочное или щелочное вещество. Вещества, которые являются чрезвычайно кислыми или основными, имеют тенденцию вызывать коррозию или вызывать ожоги. Шкала логарифмическая, что означает, что она основана на десятках. Таким образом, вещество с рН 4 в 10 раз более кислое, чем вещество с рН 5.
Расчет рН
Математически pH означает отрицательный логарифм концентрации ионов водорода в веществе. Это берет концентрацию ионов водорода в веществе и преобразует ее в значение на шкале рН, где это может быть лучше понято. Концентрация водорода находится в форме молярности, или молей на литр. Затем берется отрицательный логарифм концентрации. Таким образом, pH в химии — это упрощенный способ представления количества ионов водорода в данном веществе.
Пример
Например, если образец составляет 1 л и содержит 0, 02 г водорода, вы можете рассчитать его pH. Вы должны сначала определить его молярность. Поскольку моль водорода составляет примерно 1 г, 0, 02 г / л равно 0, 02 моль / л, что дает молярность 0, 02. В научной нотации это будет 2 х 10 ^ -2. Таким образом, отрицательный логарифм этого числа будет показателем степени с отрицательным знаком перед ним (—2 = 2). Таким образом, pH этого образца будет 2.
Нахождение pH через pOH
Вы также можете использовать косвенный способ измерения pH. Если вы знаете pOH, вы можете рассчитать pH. POH является отрицательным логарифмом гидроксидного или OH-группы иона. Из-за того, как водород и гидроксид взаимодействуют, рОН по существу является обратным рН. Итак, если вы знаете концентрацию гидроксида, вы можете рассчитать pH с помощью уравнения 14 — pOH = pH. Например, если вещество имеет pOH 12, оно будет иметь pH 2. Вы можете применить тот же принцип в обратном порядке, чтобы найти pOH по pH, используя формулу 14 — pH = pOH.

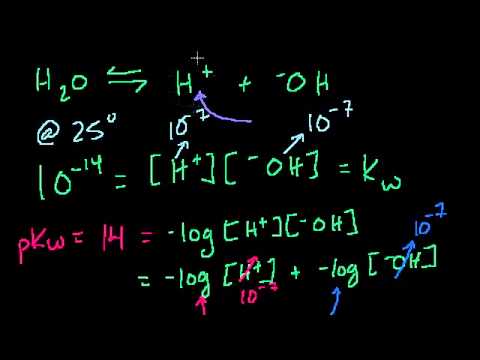

![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-584.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-588.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-589.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-590.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-591.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-596.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-597.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-599.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-600.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-601.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-603.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-604.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-605.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-606.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-607.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-609.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-610.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-618.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-619.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-621.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-623.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-624.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-627.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-630.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-633.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-634.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-637.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-639.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-641.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-642.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-644.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-650.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-652.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-654.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-659.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-662.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-663.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-664.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-667.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-668.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-821.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-825.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-833.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-835.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-838.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-839.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-844.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-848.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-850.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-855.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-856.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-857.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-859.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-864.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-865.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-870.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-875.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-877.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-878.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-879.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-881.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-882.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-884.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-885.png)
