: 7 окт 2017 , Россия Делает Сама , том 75,
№4
Что на роду написано, того не миновать?
Редактирование генома в терапии наследственных заболеваний
Наследственность – это своего рода фатализм нашего времени. Расшифровка последовательности ДНК сродни предсказанию судьбы человека. Нам говорят, что гены определяют все: от цвета глаз до склонности к девиантному поведению. Добавьте к этому болезни, передающиеся по наследству, и мутации, связанные с риском развития таких болезней, как рак. Но можно ли пойти наперекор зловещему року и изменить судьбу, записанную на «скрижалях» ДНК? Да, это возможно, и если не сегодня, то в недалеком будущем. Генетическая инженерия занимается этими проблемами уже несколько десятков лет, однако в последние годы вокруг редактирования геномов возник особый ажиотаж. Что же изменилось? Ответ на этот вопрос – аббревиатура CRISPR/Cas
Все началось в 1987 г., когда в бактериальной ДНК были обнаружены странные нуклеотидные повторы, разделенные небольшими участками уникальных последовательностей. Спустя десять лет было показано, что эти повторенные последовательности, названные CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats), являются системой адаптивного иммунитета бактерий – способом защиты против чужеродной ДНК, в частности, против бактериальных вирусов (бактериофагов).
Но какое отношение имеет это к наследственным болезням человека? Все дело в механизме действия системы CRISPR. Бактериофаги впрыскивают в клетку бактерии свою ДНК, которая многократно копируется и упаковывается в белковую оболочку за счет «хозяина» – таким образом на свет появляются новые бактериофаги. Защитная система бактерии, включающая белок-«ножницы» Cas, распознает чужую ДНК в случае, если она уже встречалась с ней раньше, и разрезает ее. Захватчики побеждены.
Узнавание мишени происходит по знаменитому принципу комплементарности, по которому образуются пары нуклеотидов в двуспиральной структуре ДНК. Этот принцип работает во всех живых организмах на нашей планете, включая клетки человека. Поэтому главное в механизме CRISPR/Cas – его простота и универсальность.
Знаковое событие случилось в 2012 г., когда была опубликована совместная работа француженки Э. Шарпентье и американки Д. Дудна, где было показано, что бактериальная система CRISPR/Cas может быть использована для внесения разрывов в последовательность любой ДНК, что свидетельствовало об ее огромном потенциале для редактирования геномов (Jinek et al., 2012). Ведь, зная нуклеотидную последовательность, можно внести разрыв в точно выбранное место любой ДНК.
Так в руках ученых оказался простой и эффективный инструмент, позволяющий направленно вносить изменения в ДНК живой клетки, т. е. переписывать те самые «скрижали». С тех пор вышли сотни научных статей, свидетельствующих о том, что эта система работает в самых различных видах организмов, позволяет вносить разрывы в любые последовательности генов, в том числе несущие мутации, вызывающие наследственные болезни (Немудрый, 2014).
Ремонтируем ДНК направленно
Но вот ДНК разрезана – что дальше? Дальше идет «ремонт» (репарация). Вообще разрывы в ДНК не такая уж и редкость: ежесуточно в каждой клетке человека под действием активных форм кислорода их возникает около 10 тысяч, и клетка их тщательно «штопает», восстанавливая целостность ДНК (Helbock et al., 1998). Но эти разрывы случайны, в отличие от действия CRISPR/Cas.
Существуют «терапевтические» мутации, предотвращающие развитие заболеваний. Например, мутации в гене CCR 5 предотвращают заражение клеток ВИЧ (Genovese et al., 2014, Liu et al., 1996), а мутация A673T в гене APP – развитие болезни Альцгеймера (Jonsson et al., 2012). С помощью системы CRISPR/Cas можно внести в геном необходимые изменения, «сломав» целевые гены либо внеся целевые замены (Cox et al., 2015)
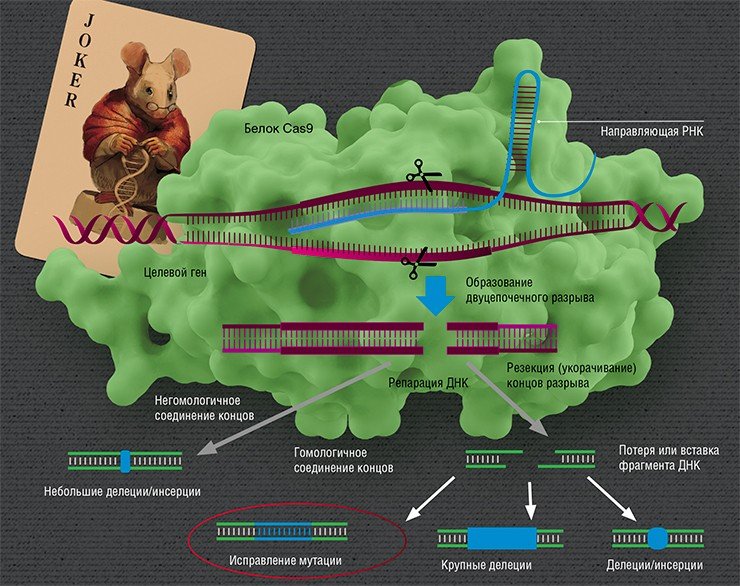
Направленные разрывы, внесенные CRISPR/Cas, могут быть репарированы по-разному: существует несколько способов, отличающихся механизмом, точностью и т. п. В зависимости от пути репарации можно получить следующие результаты. Во-первых, «сломать» ген, если при репарации ДНК произойдет мутация. Такого эффекта можно добиться, если репарация произойдет, например, по механизму соединения негомологичных концов, для которого характерна неточность. Также возможно добиться крупной делеции (утраты фрагмента ДНК) и удалить участок либо целый ген.
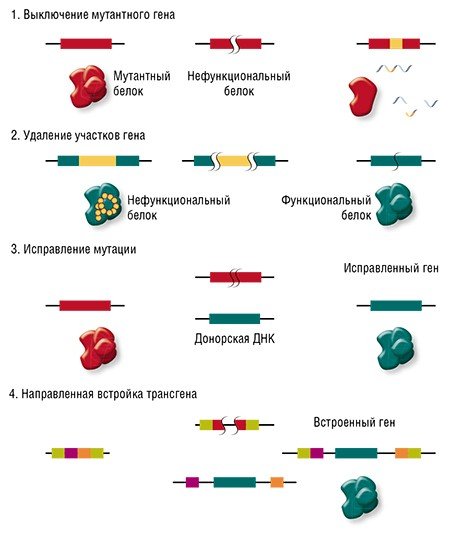
Сестринская хромосома присутствует в клетке в единичном экземпляре, а копий «донорной» ДНК можно доставить множество, что дает искусственной ДНК конкурентное преимущество, пусть она и отличается немного от поврежденного участка. Таким образом можно «исправить», к примеру, мутацию, или вставить небольшой новый фрагмент ДНК.
И вот здесь мы вплотную подходим к терапии генетических заболеваний. Начнем с того, что все такие патологии отличаются друг от друга: они вызваны мутациями в разных генах, да и сами мутации могут иметь различную природу и давать разный эффект в одном и том же гене. Соответственно, есть разные варианты применения геномного редактирования: ген можно «сломать» или просто удалить мутантный участок, «исправить» мутацию или, напротив, добавить в геном полезные «терапевтические» мутации или даже новый дополнительный трансген.
В теории все это выглядит прекрасно, но вот в чем вопрос: в организме взрослого человека имеются десятки триллионов клеток, и в каждой из них содержится мутантный ген. Как эти подходы применить на практике? Как лечить реального пациента?
Работаем «в пробирке» и в организме
На самом деле в большинстве случаев нет нужды исправлять мутацию в каждой клетке организма. Например, серповидноклеточная анемия вызвана мутациями в гене, кодирующем субъединицу гемоглобина, что приводит к дисфункции только клеток крови – эритроцитов. А наследственные нейродегенеративные заболевания, например боковой амиотрофический склероз, связаны с гибелью нейронов определенных типов. Таким образом, мишенями для терапии многих генетических заболеваний могут быть клетки лишь определенных органов или тканей, где специфично синтезируются/не синтезируются продукты мутантных генов.
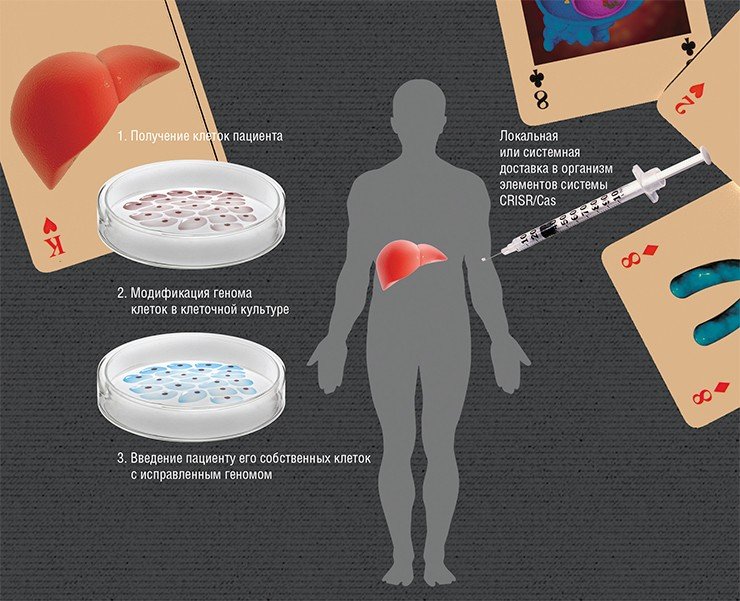
Суть редактирования геномов ex vivo («вне живого») заключается во введении в организм «здоровых» клеток, в которых, к примеру, будет синтезироваться нужный белок. Но если вводить клетки, взятые даже от здорового донора, то организм пациента с большой вероятностью их отторгнет. Поэтому нужно взять клетки самого пациента и изменить в них мутантный ген, а потом ввести их обратно. Наиболее разработан этот подход для заболеваний крови, поскольку забор и пересадка костного мозга, где идет кроветворение, практикуется с 1959 г.
Но что делать в случае, если «дефектные» клетки не так просто получить? Например, если болезнь проявляется в головном мозге? Вдобавок не все типы клеток способны пережить все процедуры в чашке Петри вне организма. Здесь на помощь приходит другая крайне перспективная технология нашего времени, связанная с получением так называемых индуцированных плюрипотентных стволовых клеток (ИПСК).
Плюрипотентные стволовые клетки бессмертны: теоретически они могут делиться бесконечно и при действии определенных стимулов образовывать любые клетки тканей и органов взрослого организма. Используя необходимый набор стимулов, можно направить развитие стволовых клеток в определенный тип клеток, например, в нейроны. Этот процесс называют направленной дифференцировкой
Относительно простой и эффективный способ получения стволовых клеток из клеток кожи в результате репрограммирования был изобретен в 2006 г. японскими исследователями К. Такахаси и С. Яманака (Takahashi & Yamanaka, 2006). Таким образом, появился метод вернуть практически любую клетку организма (крови, кожи, жировой ткани и т. д.) в состояние стволовой.
Возможность использования ИПСК для клеточной терапии наследственных заболеваний была впервые продемонстрирована на модели серповидноклеточной анемии (Hanna et al., 2007). В геном лабораторных мышей были встроены мутантные гены человека, приводящие к развитию этой болезни.
Из клеток кожи этих животных были получены индуцированные плюрипотентные стволовые клетки, в которых мутация была исправлена с помощью гомологичной рекомбинации. Путем направленной дифференцировки из этих клеток были получены стволовые предшественницы клеток крови, которые трансплантировали в организм животных. Последние не только прижились, но и превратились в здоровые эритроциты. Лечение оказалось успешным.
С тех пор cписок наследственных болезней, для которых успешно был опробован этот подход, пополнился десятками наименований и продолжает расти.
Но зачем тратить время и деньги на извлечение и культивирование клеток, если можно все сделать прямо «на месте»? Ведь система CRISR/Cas в силу своей универсальности теоретически способна работать непосредственно в клетках живого организма. Главная проблема – это эффективно и безопасно доставить элементы этой системы в нужное место.
Сегодня наиболее часто для доставки генов CRISPR/Cas в организм используются вирусные частицы. В качестве таких носителей обычно выступают аденоассоциированные вирусы – дефектные вирусы, способные размножаться только в присутствии «помощников»-аденовирусов. Эти вирусы эффективно заражают клетки человека, но не вызывают у него никаких патологий. А вирусные частицы, в геном которых встроены гены CRISPR/Сas, после заражения уже не могут размножаться. При этом разные серотипы этих вирусов имеют «склонность» к разным тканям. Например, серотип AAV8 предпочитает ткани печени, а уже сегодня можно создать искусственные серотипы, нацеленные на любой орган.
Активно развиваются и невирусные способы доставки, например, упаковка готовых молекулярных комплексов РНК-белок в липосомы (липидные пузырьки) или полимерные частицы. Это более безопасно, а также обеспечивает более строгий контроль над дозой.
Это все здорово, но…
Всегда есть это «но». Технология CRISPR/Cas начала применяться для редактирования геномов млекопитающих пять лет назад. На сегодня получено колоссальное количество данных, достигнут огромный прогресс на пути к клиническому применению, но все же остается ряд вопросов, которые необходимо будет решить для каждого конкретного генетического заболевания. Например, какая доставка будет оптимальна? Приживутся ли введенные клетки? Какова будет эффективность и безопасность лечения? И etc. …
Возьмем для примера пару вопросов из этого списка и посмотрим, какие конкретные ответы на них уже получены в научном сообществе. Одна из проблем использования CRISPR/Cas связана с возможностью нецелевых эффектов: система может вносить разрывы в участки, отличающиеся от целевого на несколько «букв» – нуклеотидов, что чревато риском возникновения нежданных мутаций. Особенно остро вопрос безопасности стоит при редактировании геномов in vivo, когда проверить результат предварительно невозможно.
Для решения этой проблемы лидирующие группы ученых под руководством Д. Дудны, Ф. Чжана и К. Джуна независимо друг от друга создали мутантные «улучшенные» варианты белка Cas9 с повышенной специфичностью, частота нецелевых эффектов которых упала на несколько порядков.
С помощью технологии геномного редактирования можно не только лечить наследственные заболевания, но и создавать «дизайнерских» детей. Ведь если можно исправить ген, вызывающий болезнь, то почему бы не изменить ген, регулирующий цвет глаз, продолжительность жизни, наконец, интеллект? Уже сегодня в Китае с помощью CRISPR/Cas выведены собаки породы бигль, у которых «выключен» ген, кодирующий миостатин – фактор, подавляющий рост мышечной ткани. В результате эти животные отличаются повышенной мускулистостью. А что мешает «выключить» этот ген в эмбрионе человека?
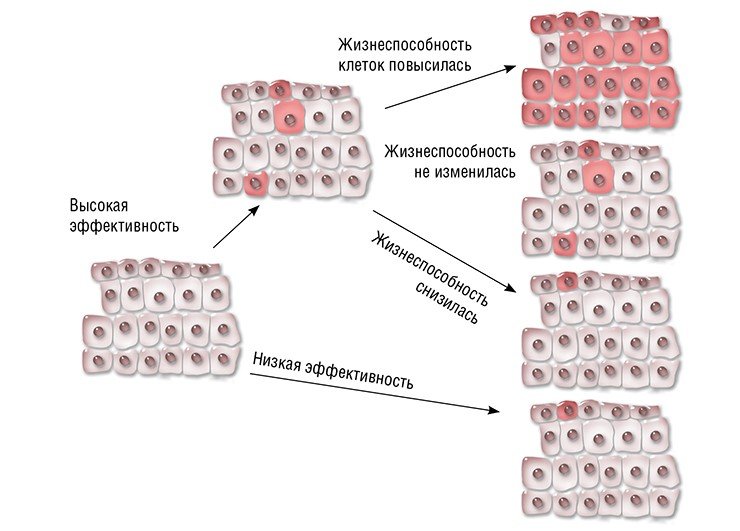
Что касается эффективности терапии, то все зависит от особенностей самого заболевания и мутации, его вызывающей. Возможны три варианта: после исправления мутации жизнеспособность клеток увеличится, не изменится или ухудшится. В первом случае исправленные клетки получают конкурентное преимущество и могут постепенно заместить мутантные. Например, на линии мышей с наследственным заболеванием печени – тирозинемией I типа – было показано, что при системной доставке CRISPR/Cas непосредственно в организм животного мутация «исправляется» в 6 % клеток печени. Даже такого небольшого количества клеток достаточно, чтобы предотвратить падение веса и привести в норму биохимические показатели печени животных. А более жизнеспособные клетки с исправленной мутацией начинают «обживать» печень.
Но, к примеру, в случае гемофилии B жизнеспособность клеток после исправления мутации не повышается. Тем не менее уже 3—7 % клеток печени, продуцирующих нормальный фактор свертывания крови, достаточно для устойчивого терапевтического эффекта (Ohmori et al., 2017).
Что же касается исправления мутаций в онкогенах, то жизнеспособность и скорость пролиферации таких клеток будет снижаться относительно раковых, поэтому эффективность подобной терапии вызывает сомнения.
Тем не менее пример гемофилии B показывает, что если заболевание связано с отсутствием какого-то фермента или гормона, то небольшого числа клеток, его продуцирующих, может хватить, по крайней мере, для перевода болезни в более мягкую форму, а в некоторых случаях и для полного восстановления утраченных функций.
Классическими же модельными заболеваниями в исследованиях по терапии с помощью геномного редактирования являются гемоглобинопатии и мышечная дистрофия Дюшенна. Именно на этих заболеваниях была подтверждена работоспособность концепций такого лечения, показано, что клетки с исправленной мутацией демонстрируют «здоровый» фенотип. В случае мышечной дистрофии Дюшенна такие клетки не только успешно встраивались в мышечную ткань взрослых мышей, но и улучшали функциональные показатели всей мышцы в целом.
Система CRISPR/Cas9 открывает перед человечеством большие перспективы, но нужно понимать, что это не волшебная палочка для решения всех проблем, а инструмент, такой, как, например, молоток. И нужно учиться применять этот инструмент для каждой конкретной задачи.
Главный шаг, который уже был сделан в этой области, – это выход за пределы лабораторий. Уже существует ряд компаний, занимающихся внедрением технологии CRISPR/Cas в практику, и не только медицинскую. Этот подход, к примеру, используется сегодня для получения модифицированных микробов для нужд биотехнологии и модифицированных растений.
Можно ожидать, что уже в ближайшее десятилетие новая технология найдет и клиническое применение. Так, в 2016 г. в Китае стартовали первые клинические испытания нового метода иммунотерапии метастазирующего немелкоклеточного рака легкого, в котором используются T-лимфоциты с «отредактированным» геномом.
С. М. ЗАКИЯН: «НАМ БЫЛ БРОШЕН ВЫЗОВ, И МЫ ДОЛЖНЫ НА НЕГО ОТВЕТИТЬ!» Исследования по применению системы CRISPR/Cas для терапии наследственных заболеваний начались в лаборатории эпигенетики развития ИЦиГ СО РАН под руководством С. М. Закияна в 2013 г., буквально сразу после выхода первых публикаций на эту тему.
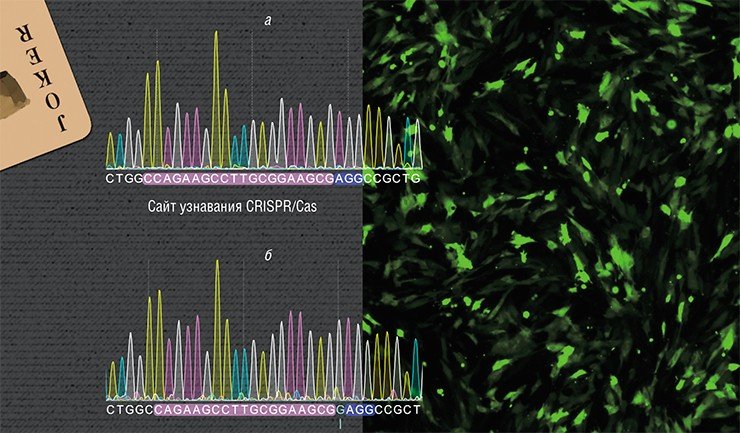
Исследования ведутся на лабораторных крысах линии Brattleboro – модели генетически детерминированного заболевания, при котором наблюдается дефицит гормона аргинин-вазопрессина. В результате у животных развивается наследственный несахарный диабет с характерным для него чрезмерным потреблением жидкости. На сегодня уже получена линия клеток с исправленной мутацией в гене, кодирующем этот гормон.
В данном случае задача усложнялась тем, что ген вазопрессина по последовательности нуклеотидов схож с геном другого гормона – окситоцина. Более того, на участке, в котором возникла мутация у крыс Brattleboro, эти гены практически идентичны. Тем не менее удалось добиться специфичного действия CRISPR/Cas в гене вазопрессина без нецелевых двунитевых разрывов ДНК в гене окситоцина. На следующем этапе предполагается вводить исправленные клетки в организм животных для оценки терапевтического эффекта
Возможности, которые дает нам технология CRISPR/Cas, пугающие и захватывающие одновременно. Сначала китайские исследователи, а затем их коллеги из США смогли внести изменения в эмбрионы человека. Недавно группа американских ученых под руководством Ш. Миталипова «исправила» в человеческом эмбрионе мутацию, вызывающую гипертрофическую кардиомиопатию (Ma et al., 2017). Эти эмбрионы были получены специально в результате искусственного оплодотворения, для которого были использованы здоровая яйцеклетка и сперматозоиды носителя мутации. Согласно современным нормам, зародыши были выведены из эксперимента на стадии бластоцисты. Однако с помощью современных репродуктивных технологий уже сегодня можно было бы имплантировать такие эмбрионы суррогатным матерям.
И здесь возникает очень серьезный этический вопрос: имеем ли мы право вмешиваться в ДНК человека? Или, наоборот, этично ли бездействовать, обрекая будущего ребенка на страдания?
Генетические изменения, внесенные в эмбрионы, сохранятся во всех клетках взрослого организма, и, соответственно, будут передаваться по наследству. Какой эффект окажет распространение таких модифицированных генов на человеческую популяцию в эволюционном аспекте, не говоря уже о риске возникновения новых евгенических движений?
Именно поэтому Д. Дудна, имеющая колоссальный авторитет в научном мире, призывает своих коллег не торопиться с применением этой технологии на эмбрионах человека, пока не будут разработаны международные этические и законодательные нормы для ее регулирования. В наши дни по всему миру проходят встречи, конференции, конгрессы и симпозиумы, на которых обсуждается будущее CRISPR/Cas. Возможно, от решений, которые будут приняты на них сейчас, зависят судьба человечества и то, как будет выглядеть наш мир в будущем.
В сентябре 2018 г. в новосибирском Академгородке также планируется провести международный конгресс по современным технологиям редактирования геномов, на котором будет обсуждаться технология CRISPR/Cas и, в частности, ее будущее в Российской Федерации.
Литература
Немудрый А. А., Валетдинова К. Р., Медведев С. П. и др. Системы редактирования геномов TALEN и CRISPR/Cas – инструменты открытий // Acta Naturae. 2014. Т. 6. № 3(22). С. 20—42.
Cox D. B., Platt R. J., Zhang F. Therapeutic genome editing: prospects and challenges // Nat Med. 2015. V. 21. N. 2. P. 121—131.
Jinek M., Chylinski K., Fonfara I. et al. A Programmable Dual-RNA-Guided DNA Endonuclease in Adaptive Bacterial Immunity // Science. 2012. V. 337. N. 6096. P. 816—821.
Ma H., Marti-Gutierrez N., Park S. W. et al. Correction of a pathogenic gene mutation in human embryos // Nature. 2017. V. 548. N. 7668. P. 413—419.
: 7 окт 2017 , Россия Делает Сама , том 75,
№4
Успешное применение CRISPR/Cas9 системы для редактирования генома эмбриона
Генетические анализы в настоящее время направлены на предупреждение наследственного заболевания или своевременное вмешательство для снижения или предотвращения негативного эффекта заболевания. Это связано с тем, что развитие инструментов для фактического исправления мутации в гене, вызывающем наследственное заболевание, отстает от методов диагностики.
В чем же сложность исправления мутации в гене? У человека примерно 30 000 генов, взрослый человек состоит в среднем из 4 триллионов клеток, некоторые из них ежедневно обновляются. Для полного «исцеления» нужно исправить мутацию в каждой клетке организма и при этом не «испортить» другие гены. Тут и начинаются сложности.
Первая задача – это сам механизм исправления гена. Для исправления генетической «ошибки», приводящей к заболеванию, нужны весьма специфические инструменты – молекулярные «ножницы», которые разрежут ДНК в строго указанном месте, и «пинцет», который вместо вырезанного фрагмента с ошибкой вставит правильный кусок ДНК. Вся система клетки направлена на сохранение генетической информации в неизменном виде. ДНК, которая является материальным носителем этой информации, сама по себе в клетке не работает – это инструкция по построению разных функциональных молекул и их применению. Это значит, что любая попытка внести изменения в ДНК воспринимается клеткой как нападение, от которого она может защищаться разными способами. Некоторые вирусы научились встраиваться в ДНК человека в обход этой защиты. Их инструменты можно использовать для привнесения в ДНК клетки здорового гена целиком, с которого будет синтезироваться правильно работающий белок. Однако вирусы не заботятся о том, чтобы не испортить другие гены в чужом геноме при встройке, поэтому такой метод исправления мутаций может быть опасен нарушением других, здоровых генов.
Также есть специальные системы внутри клетки, которые помогают разным белкам, работающим с ДНК, находить нужные гены, следят за цельностью длинных молекул ДНК и т.д. Эти белки умеют распознавать определенную последовательность нуклеотидов, то есть их можно настроить так, чтобы они работали с высокой точностью только с тем участком, который нужно исправить. Однако проблема таких молекулярных ножниц заключается в том, что они очень большие и доставить их в клетки организма человека очень сложно.
Самая остроумная и многообещающая идея направляемых «молекулярных ножниц» основана на использовании свойств защитной системы бактерий. Еще в 1987 году в ДНК бактерий нашли необычные последовательности, которые позже назовут CRISPR-кассетами. Однако на тот момент разобрать их структуру и понять функцию не удалось. До 2006 года эти последовательности активно использовали для классификации бактерий, так как они значительно различаются не только между видами, но даже между штаммами – они были своеобразными генетическими карточками каждого бактериального штамма. Но в 2006 году, объединив данные о структуре CRISPR-кассет и ассоциированных с ними белков cas, исследователи поняли функцию всей этой системы, а также механизм ее работы. CRISPR/Cas система бактерий – это защитный механизм, предохраняющий одноклеточный организм от проникновения чужой ДНК. В ДНК CRISPR-кассеты хранится информация о вирусах, которые раньше попадались этой бактерии или ее предкам, в виде небольших фрагментов ДНК этих вирусов. С помощью этих фрагментов клетка вырабатывает сигнальные РНК, распознающие проникшую вирусную ДНК и направляющие к ней cas-белки, которые разрежут ее на небольшие безопасные для клетки куски. Получается, что эта система позволяет разрезать ДНК, но только в определенном месте в соответствии с тем, где укажут небольшие молекулы РНК. При использовании этого механизма для исправления мутации в клетку человека нужно доставить лишь небольшой (по сравнению с описанными выше собственными белками клетки) белок cas9 и «руководящую» РНК, которая укажет место мутации.
Второй задачей «починки» гена является доставка инструментов до всех клеток, чтобы исправить ошибку в каждой клетке организма. К этой задаче подходят с двух сторон. С одной стороны, в каждом типе клеток каждого органа работают разные гены. Это значит, что исправлять ген нужно не во всех клетках организма, а только в тех, в которых этот ген необходим для полноценного выполнения функций ткани или органа. Такой подход значительно ограничивает количество клеток, в которые нужно доставить инструментарий и позволяет подобрать наиболее эффективный способ в зависимости от особенностей этих клеток, тканей, органов. С другой стороны, наш организм изначально развивается из одной клетки и на ранних этапах развития эмбрион состоит всего из нескольких клеток. И если внести изменение на таком этапе, то с высокой эффективностью можно получить эмбрион с исправленной мутацией во всех клетках, а значит из него вырастет здоровый человек.
Несмотря на кажущуюся простоту идеи использовать систему CRISPR/Cas9 для исправления мутации на стадии зиготы (оплодотворенной яйцеклетки, из которой развивается эмбрион), такая процедура была успешно проведена только недавно. Исследователи из Китая представили результаты работы, в которой описали применение CRISPR/Cas9 для исправления точечной мутации в гене HBB, вызывающей β-талассемию, и мутации в гене G6PD, связанной с развитием дефицита глюкозо-6-фосфатдегидрогеназы, на самой ранней стадии развития эмбриона – в зиготе.
Процедура по исправлению мутации на стадии зиготы проводилась при искусственном оплодотворении. В более ранних исследованиях оценивали эффективность редактирования генома с помощью системы CRISPR/Cas9 на нежизнеспособных зиготах с тремя пронуклеусами (результат некорректоного оплодотворения). Он оказался не слишком впечатляющим – исправление мутации наблюдали только 20% случаев.
В последней же работе провели процедуру редактирования генома на нормальных зиготах. При этом оказалось, что для мутации в гене HBB в 50% и для гена G6PD в 100% случаев мутация была исправлена. Это говорит о том, что система работает на потенциально жизнеспособных зиготах и может быть эффективна.
Важно понимать, что у этой работы есть как технические ограничения: малое количество образцов, отсутствие проверки на способность имплантироваться и нормально развиваться во время беременности, так и этические. В настоящее время эту систему планируют использовать для исследования влияния разных генов и мутаций в них на ранние стадии развития эмбриона, выявления функции разных генов в процессе имплантации эмбриона, что, возможно, позволит повысить эффективность процедур ЭКО.
Авторы: Вероника Юрьева, стажер
Светлана Жикривецкая, биолог-исследователь
Научные статьи-источники:
Bianconi E et al. An estimation of the number of cells in the human body. Ann Hum Biol, 2013
Tang L et al. CRISPR/Cas9-mediated gene editing in human zygotes using Cas9 protein. Mol Genet Genomics, 2017
На сегодняшний день нам известно множество болезней, вызываемых бактериями или вирусами. На этом фоне наследственные, т.н. генные болезни, стоят особняком – их не так уж много, но добиться успеха в их лечении чрезвычайно сложно.
Неправильные копии гена с нарушенной функцией белка вызывают самые разные патологии – например, серповидно-клеточную анемию, трисомии или муковисцидоз. Мы уже понимаем, какие именно изменения в конкретных генах «несут ответственность» за моногенные болезни – но все еще практически бессильны что-либо изменить. Генные болезни, в отличие, скажем, от бактериальных инфекций, не поддаются лечению антибиотиками – и непонятно, как улучшить состояние организма при нарушениях, произошедших на самом глубинном уровне. Однако в последнее время ситуация, еще вчера казавшаяся безнадежной, начинает меняться к лучшему.
Технология редактирования генома CRISPR/Cas9
Новый подход к лечению генных заболеваний называется геномной медициной. Максимально упрощая, можно сказать, что его суть – в замене «плохих» копий генов и их последовательностей на «хорошие», соответствующие норме. Если удастся это сделать – болезнь исчезнет, ведь сама ее причина будет устранена.
Самый оптимальный вариант – исправить «генетическую опечатку» еще на стадии зачатия: гораздо проще и удобней работать с одной клеткой, чем с триллионами, из которых состоит уже сформированный организм.
Перспективный метод, позволяющий проводить подобное генетическое редактирование, появился совсем недавно и основан на использовании технологии CRISPR/Cas.
Лавры первооткрывателей этой технологии ученые делят с…. бактериями! Именно их «опыт» борьбы с вирусами, полученный за миллионы лет эволюции, лег в основу CRISPR/Cas. Бактерии «знают» как распознать генетический материал вируса, вступая с ним во взаимодополняющее (на научном языке – комплементарное) взаимодействие.
Можно сказать, что вся наша жизнь основана на таких взаимодополнениях: ночь дополняет день, «инь» дополняет «янь», и так далее. Применительно к нашей теме, основа комплементарности – двойная цепочка ДНК, несущая информацию в виде последовательности нуклеотидов. Они дополняют друг друга – и, если разделить эти цепочки, то можно по одной из них построить недостающую.
Как пользуются этой комплементарностью бактерии – и основанная на их поведении технология CRISPR/Cas? Бактерии на одной короткой молекуле нуклеиновой кислоты (РНК) с невероятной точностью «узнают» участок ДНК-вируса и с помощью специальных белков разрушают его.
В точности та же схема успешно действует и в клетках организма человека. Мы вводим в клетку белок Cas и одновременно в ту же самую клетку при помощи специальных технологий вводим очень короткую РНК, рибонуклеиновую кислоту. Последовательность этой РНК точно соответствует последовательности участка – пусть и самого маленького – аномальной копии гена. В это момент происходит «узнавание», и они вступают комплементарное взаимодействие. В копию аномально функционирующего гена вносится двунитевый разрыв, и молекула ДНК расщепляется на две части. Эта схема работает чрезвычайно точно – по крайней мере в случае бактерий.
Какую практическую пользу мы можем извлечь из умения расщепить ДНК? Дело в том, что каждый организм содержит два набора генов, переданных родителями. Допустим, что папин ген поврежден и в нем есть мутация, способная привести к тяжелому заболеванию. В то же время мамин ген функционирует абсолютно нормально. В этом случае мы расщепляем папину аномальную копию именно на том участке, где произошла мутация – и дальше все происходит уже без нашего участия. Клетка сама восстанавливает образовавшийся разрыв, используя оставшуюся, здоровую материнскую копию.
Удивительно, что эта схема, при помощи которой бактерии противодействуют вирусам, работает в клетках организма человека и других высших млекопитающих.
Первые эксперименты по генетической коррекции клеток высших организмов с использованием технологии CRISPR/Cas были проведены в 2013 году – а спустя всего два года ученые предприняли попытку повторить эти опыты на эмбрионе человека. Конечно, именно в этом и состоит цель и смысл геномной медицины: мы должны научиться предотвращать развитие наследственных заболеваний за счет генетического редактирования.
Что касается результатов предпринятой попытки, они оказались неоднозначными. В оплодотворенную яйцеклетку с двумя копиями аномального гена, чья мутация вызывает бета-талассемию, заболевание крови от которого в мире ежегодно умирают десятки тысяч людей, исследователи ввели белок Cas. После этого, эмбрионы выросли до небольшого сгустка клеток – и, после проверки их состояния, оказалось, что в 5-10% произошло излечение. Конечно, это низкий процент – но эту технологию можно и нужно совершенствовать.
Главной неприятной новостью стало то, что в результате применения технологии CRISPR/Cas произошли изменения не только в тех местах генома, в которых планировались – но и в других его участках. И пока мы не знаем, как можно решить эту проблему, связанную с самой природой взаимодействий, происходящих на макромолекулярном уровне.
Небольшие участки ДНК длиной 20 нуклеотидов вступают в правильное, прочное взаимодействие с РНК. Но в каждой клетке существует 60 таких вариантов — очень похожих на те, что ученые пытаются редактировать, но все-же – немного других.
Каждая из этих последовательностей – а всего таких вариантов в каждой клетке 3600 – будет взаимодействовать с «мишенью» слегка неправильно, но при этом, складываясь вместе, они в значительной мере обесценивают эффект технологии CRISPR/Cas и в подавляющем большинстве случаев нужный белок будет оказываться совсем не там, где надо. Этого, хотя и короткого и непрочного, взаимодействия достаточно для того, чтобы разрыв ДНК произошел в неправильном месте и был запущен процесс мутации генов.
Пока для ученых эта проблема оказывается нерешаемой. Мы пытаемся использовать компьютерные модели, создаваемые специалистами в биоинформатике, чтобы найти уникальные позиции в геноме, но, к сожалению, остается множество участков, к которым подобраться с использованием технологии CRISPR/Cas очень сложно.
Кроме того, у этого метода есть еще несколько ограничений, связанных с невозможностью запустить процесс правильного «узнавания» и начать редактирование генома.
В целом, можно сказать, что технология CRISPR/Cas, как и любой новый метод, пока несовершенна – но у нее уже есть своя область применения, которая, возможно, будет со временем расширяться.
Автор статьи: Константин Северинов, доктор биологических наук, профессор Сколковского института науки и технологий, профессор Университета Ратгерса (США), заведующий лабораторией молекулярной, экологической и прикладной микробиологии СПбПУ Петра Великого
По материалам сайта ПостНаука
Редактирование генома является одним из видов генной инженерии, в котором может быть проведено включение, удаление или перемещение фрагментов ДНК в геноме организма, с использованием специфически спроектированных эндонуклеаз, или «молекулярных ножниц». Эти нуклеазы создают сайт-специфичные двухцепочечные разрывы в ДНК в определённом участке генома. Индуцированные двухцепочечные разрывы репарируются в процессе рекомбинации, что позволяет получать направленные мутации.
В этом методе используются 4 типа нуклеаз: мегануклеазы, нуклеазы с цинковыми пальцами (zinc fingers), нуклеазы TALEN, и система CRISPR-Cas[1][2].
Ещё один метод основан на использовании искусственно созданных непатогенных вирусов для доставки генетического материала внутрь клеток[3].
Редактирование генома было признано методом года в 2011 году[4].
В ноябре 2017 года в Калифорнии (США) прошла первая в мире процедура по «редактированию» генома взрослого человека прямо внутри его тела. Пациентом стал мужчина с мукополисахаридозом II типа (синдромом Хантера)[5][6].
В январе 2019 года власти Китая подтвердили рождение в Шэньчжэне первых в мире генно-модифицированных людей, а также то, что в отношении биолога Хэ Цзянькуя начато расследование.
См. такжеПравить
- Молекулярная хирургия
- Синтетическая биология
ПримечанияПравить
- ↑ Kevin M. Esvelt, Harris H. Wang. Genome-scale engineering for systems and synthetic biology (англ.) // Molecular Systems Biology. — 2013-01-01. — Vol. 9. — P. 641. — ISSN 1744-4292. — doi:10.1038/msb.2012.66. Архивировано 9 июня 2016 года.
- ↑ Wenfang Spring Tan, Daniel F. Carlson, Mark W. Walton, Scott C. Fahrenkrug, Perry B. Hackett. Precision editing of large animal genomes (англ.) // Advances in Genetics. — 2012-01-01. — Vol. 80. — P. 37—97. — ISSN 0065-2660. — doi:10.1016/B978-0-12-404742-6.00002-8. Архивировано 5 марта 2016 года.
- ↑ Виталий Лейбин Поколение генетически неуязвимых // Эксперт, 2021, № 36. — с. 42-47
- ↑ Method of the Year 2011 (англ.) // Nature Methods. — 2012-01-01. — Vol. 9, iss. 1. — P. 1. — ISSN 1548-7105. Архивировано 6 декабря 2017 года.
- ↑ Ольга Страховская. В США впервые отредактировали гены прямо в теле человека. Чего можно добиться с помощью новой технологии? (рус.), Истории, Meduza (17 ноября 2017). Архивировано 25 ноября 2017 года. Дата обращения: 17 ноября 2017.
- ↑ Ученые США сделали умопомрачительный опыт на живом человеке (рус.), Вести (17 ноября 2017). Архивировано 26 ноября 2017 года. Дата обращения: 17 ноября 2017.
СсылкиПравить
- Customized Human Genes Scientific American articles
- Connor, Steve. Scientific split — the human genome breakthrough dividing former colleagues, The Independent (25 April 2014). Дата обращения: 11 февраля 2016.
- What is genome editing? (англ.). yourgenome.org. Дата обращения: 13 апреля 2018.
- Interesting Genetics: «Genetically Modified»Butterflies
Введение
Актуальность данной работы обусловлена стремительным развитием молекулярной генетики и созданных ею генетических технологий. Расширились возможности генной терапии заболеваний, появились методы редактирования геномов, в том числе генома человека [1, 2]. Современные геномные технологии позволили лечить заболевания, считавшиеся ранее неизлечимыми, способствовали развитию персонализированного подхода к диагностике заболевания и лечению пациента с учетом индивидуальных характеристик его генома [3].
Методы генной инженерии
Генная инженерия позволила создавать определенные геномные конструкции бактерий, но испытывала нехватку методов при работе с геномами высших организмов. Подходы к редактированию генома человека появились лишь в конце прошлого века. С целью обеспечения адресной доставки гена в клетки-мишени стали использовать рекомбинантные носители (векторы), чаще всего сконструированные на основе вирусов, подвергшихся специальной модификации с целью повышения их безопасности для человека. Чаще всего применяются рекомбинантные аденовирусы, ретровирусы, аденоассоциированные вирусы, лентивирусы и ряд других [4–7].
Путем введения модификаций в геном ретровируса, т. е. вставки измененных человеческих генов, можно добиться внедрения в геном хозяина таких элементов. Однако отсутствие специфичности встраивания являлось существенным недостатком. Поэтому находкой стал разработанный в 2012–2013 гг. метод редактирования генома CRISPR/Cas, в основе которого лежит способ защиты бактерий от вирусов-бактериофагов, выражающийся в избирательном расщеплении его ДНК, своеобразный «иммунитет» бактерий [8, 9]. В 2020 г. Д. Дудна и Э. Шарпантье за разработку данного метода в применении к клеткам человека удостоены Нобелевской премии по химии. Сначала на бактерии Streptococcus pyogenes они установили, как работает белок Cas9, а позднее показали, что с помощью этого механизма можно разрезать в адресной точке любую молекулу ДНК, в том числе и ДНК человека [8].
Создание системы CRISPR/Cas немедленно явилось мощным стимулом ее использования в России. Внедрение новой технологии произвело революцию в области генетической терапии, поскольку она позволяет намного более точно редактировать ген, чем ранее описанные инструменты, проверить ее на животных моделях и вплотную подступить к лечению генетических заболеваний у людей [7]. В настоящее время подробно описан механизм CRISPR/Cas9, включая его биохимические и структурные последствия, выделены последние улучшения в системе CRISPR/Cas9, особенно модификации белка Cas9 для настройки, рассмотрены современные приложения, в которых использовалась универсальная система CRISPR/Cas9 для редактирования генома, эпигенома или РНК различных организмов [3, 9]. С помощью CRISPR/Cas можно вносить точечные мутации, встраивать в определенные места новые гены или, наоборот, удалять участки нуклеотидных последовательностей, исправлять или заменять фрагменты генов. В современных обзорах представлено изучение технических аспектов, областей применения и перспектив этой технологии в различных областях [3, 7, 9].
Другие способы модификаций генома связаны с технологиями ZFN и TALEN [1], основанными на природных свойствах определенных белков, называемых нуклеазами. Эти ферменты умеют проводить специфическое вырезание участка исходного генома и встраивание в место разреза привнесенного с собой фрагмента исправленной ДНК. Такой способ позволяет проводить целевую модификацию нарушенных генов, гораздо более точную, чем просто ретровирусная. Отличие ZFN и TALEN заключается в использовании разных видов ферментов, но итог их работы примерно одинаков. ZFN и TALEN не нашли массового применения в медицине, прежде всего из-за трудоемкости метода. Для редактирования же генома с помощью системы CRISPR/Cas9 используется единственный белок Cas9, вносящий разрыв в ДНК, а РНК-гид, узнающую мишень на простом принципе комплементарного узнавания нуклеиновых кислот, можно создать за короткое время. Это новый уровень редактирования, более дешевый и точный. В первую очередь с помощью CRISPR/Cas9 можно лечить моногенные генетические заболевания: гемофилию, муковисцидоз, лейкемию. В этих случаях понятно, какие именно гены нужно отредактировать, но существуют заболевания с высокой наследуемостью, генетическая природа которых очень сложна. Такие многофакторные болезни — сложный результат взаимодействия разных генов и их вариантов, для лечения потребуются комплексные подходы [10].
Разделяют два способа воздействия генных конструкций на клетки-мишени — in vivo и ex vivo [11]. В первом случае — непосредственно на тканях живого организма с использованием адресной доставки нуклеиновых кислот и преодолением сложных проблем, связанных с быстрой деградацией чужеродного биологического материала. Во втором случае воздействие основано на генотерапевтической модификации вне организма стволовых клеток, клеток крови, костного мозга и др. с последующим их возвратом в системный кровоток или пораженный орган. Используя систему CRISPR/Cas9, можно было бы получить образец костного мозга пациента и вылечить его собственные кроветворные стволовые клетки и затем ввести их в организм, предварительно устранив с помощью облучения собственные пораженные кроветворные клетки. Они начнут делиться и производить здоровые кровяные клетки. Если же речь идет о редактировании, например, генов клеток опухоли печени, все гораздо сложнее. Нужно будет решить проблему доставки компонентов CRISPR/Cas9-системы именно к пораженным клеткам. Хотя многие исследования показали, что технология CRISPR/Cas9 является более эффективной, специфичной и управляемой, чем предыдущие поколения инструментов редактирования генов, ее можно еще улучшить, повысив ее общую эффективность при более высокой частоте модификаций генома и уменьшив ее нецелевые эффекты. Уже рассматривается развитие технологии CRISPR/Cas9 с особым вниманием к повышению специфичности его последовательности, уменьшению нецелевых эффектов и систем доставки [12]. В данном обзоре представлены примеры недавнего успешного применения технологии CRISPR/Cas9 в лабораторных и клинических исследованиях.
Открытие возможности перепрограммирования зрелых клеток человека и разработка инженерных эндонуклеаз для улучшения редактирования генома являются двумя наиболее впечатляющими и эффективными технологическими достижениями в современной медицине и науке [13]. У индуцированных плюрипотентных стволовых клетках человека (ИПСК) есть потенциал для создания новых модельных систем для изучения биологии развития человека, механизмов заболеваний и тестирования лекарственных препаратов. Коррекция генов в специфических для пациента ИПСК может стать новым источником для заместительной клеточной терапии [14]. Инструменты редактирования генома уже произвели революцию в биомедицинских исследованиях, в настоящее время ожидается их применение в клинике. Тем не менее широкое использование данных методов в исследованиях выявило большую непредсказуемость эффектов, необходимость обширной проверки моделей, молекулярного обоснования соотношения риска и пользы. Проблемы эти широко обсуждаются [15].
Другие наиболее часто применяемые методы генной терапии — использование антисмысловых нуклеотидов как в эксперименте, так и в клинике, метод генного «глушения», или генный сайленсинг, метод выключения генов, основанный на РНК-интерференции, использование для модуляции экспрессии генов микроРНК [16, 17]. Развивается применение оптогенетической геномной инженерии для создания животных моделей, в частности для получения генетически модифицированных мышей для биомедицинских исследований [18]. Высокоэффективная технология обеспечивает эффективную рекомбинацию ДНК, которая активируется при освещении синим светом с пространственно-временной точностью. Создана фотоактивируемая модель мыши с нокаутированной рекомбиназой Cre-loxP (мыши TRE-PA-Cre) с использованием системы CRISPR/Cas9. Модель обещает быть полезной для оптогенетической инженерии генома неинвазивным и специфичным для типа клеток методом in vivo. Особое место среди методов генной терапии занимает ДНК-вакцинация, по сравнению с традиционными вакцинами она дает возможность индукции как гуморального, так и клеточного иммунного ответа, отличается низкой эффективной дозой, а также отсутствием вирулентности, простотой и быстротой получения высоких доз вакцины, высокой устойчивостью и удобством хранения [2].
Применение технологий в клинической практике
Нейромышечные заболевания
Удалось показать, что внутривенная генная терапия с помощью вектора AAV9 может остановить спинальную мышечную атрофию 1 типа (SMA1) — прогрессирующее моногенное заболевание двигательных нейронов, которое возникает в младенчестве, что приводит к неспособности к движению и смерти или необходимости искусственной вентиляции легких в возрасте до 2 лет. Ученым удалось осуществить функциональную замену мутантного гена фактора выживаемости мотонейронов-1 (SMN1). В ноябре 2017 г. межнациональная группа специалистов и компания AveXis сообщили о том, что однократное внутривенное введение аденоассоциированного вирусного вектора, содержащего ДНК, кодирующую SMN, пациентам с SMA1 обусловило более длительное выживание и лучшую моторную функцию, чем в контрольных когортах [19].
Крупным прорывом в области генной терапии стало сообщение о том, что ученые-клиницисты сохранили жизнь девочке, родившейся с фатальным наследственным нейромышечным заболеванием SMA1, путем введения отсутствующего гена в ее спинальные нейроны. В 8 нед. она прошла курс генной терапии, который дал ее организму критически недостающий белок. Результаты испытания, в котором участвовала маленькая пациентка, явились одним из самых впечатляющих успехов в некогда проблемной области, поскольку исследователи впервые провели новый ген через гематоэнцефалический барьер [20]. Успешный клинический исход эксперимента позволил надеяться на применение генной терапии в лечении других нейрозаболеваний путем доставки генов в таргетные клетки с помощью векторов на основе аденоассоциированного вируса.
Мышечная дистрофия Дюшенна является одним из наиболее распространенных наследственных генетических заболеваний и вызвана мутациями в гене DMD, который кодирует белок дистрофин. Недавние успехи в редактировании генома и генной терапии дают надежду на развитие потенциальной терапии. Укороченные версии гена DMD могут доставляться в пораженные ткани с вирусными векторами и уже продемонстрировали многообещающие результаты на различных моделях животных. Редактирование генома с помощью системы CRISPR/Cas9 было использовано для восстановления экспрессии дистрофина путем делеций одного или нескольких экзонов гена DMD в клетках пациента и на мышиной модели. Более подробно применяемые технологии и их развитие рассмотрены в обзорах, где представлены последние достижения и перспективы по трем основным подгруппам терапии дистрофии Дюшенна, включая генную терапию, клеточную терапию и фармакологическую терапию [21–23].
Онкологические заболевания
Опухоли остаются проблемой для здоровья во всем мире, и генная терапия является серьезным подходом к их лечению. В онкологии легкость и универсальность CRISPR/Cas9 позволили идентифицировать новые гены-мишени и раскрыть некоторые механизмы устойчивости к терапии [24]. До сих пор большинство исследований проводилось на опухолях у взрослых. В последние годы технология CRISPR/Cas9 применяется в лечении редких детских злокачественных новообразований, сарком мягких тканей, в отношении которых этот подход представляется многообещающим [25]. Достигнуты успехи генной терапии в лечении отдельных видов рака [26–28], появились новые подходы к поиску критически важных генов в раковом геноме [29]. Саркомы относятся к наиболее агрессивным опухолям и обычно плохо реагируют на химиотерапию. В последние годы было показано, что специфическое слияние / мутации генов или избыточная экспрессия/активация генов участвуют в патогенезе развития саркомы. РНК-направляемая нуклеаза CRISPR/Cas9 является удобной и универсальной платформой для сайт-специфического редактирования генома и эпигеном-направленной модуляции. В настоящее время обсуждаются механизмы применения редактирования генома в случае саркомы, будущие направления исследований и проблемы, с которыми сталкиваются при реализации этих подходов [30]. Подход ex vivo к редактированию очень эффективен для многих болезненных состояний, включая рак и серповидноклеточную анемию, но в идеале редактирование генома также следует применять к заболеваниям, которые требуют модификации клеток in vivo. Однако использование технологий CRISPR in vivo может быть затруднено такими проблемами, как нецелевое редактирование, неэффективная или нецелевая доставка и стимуляция контрпродуктивных иммунных реакций. Исследования, направленные на решение этих проблем, могут заложить научную основу клинических испытаний с участием ZFN, TALEN и редактирования генома на основе CRISPR с учетом известных ограничений использования CRISPR у людей [31].
Иммунологические расстройства
Хроническая гранулематозная болезнь (ХГБ) является редким наследственным заболеванием фагоцитарных клеток. Имеются сообщения о первоначальных результатах, полученных у 9 пациентов с тяжелой формой ХГБ, которые получали ex vivo аутологичную генную терапию на основе CD34 и гемопоэтических стволовых клеток. Выжившие пациенты не имели новых инфекций, связанных с ХГБ, и 6 человек смогли прекратить антибиотикопрофилактику. Первичная цель была достигнута у 6 из 9 пациентов через 12 мес. наблюдения, что позволило считать ауто-
логичную генную терапию перспективным подходом для пациентов с ХГБ [32].
Атаксия-телеангиэктазия (AT) и синдром Айкарди — Гутьерес (САГ) являются наследственными нарушениями иммунитета с преобладающим неврологическим фенотипом. Доступные методы лечения лишь частично эффективны, прогноз при их применении неблагоприятный. ИПСК получают путем перепрограммирования соматических клеток пациента, сохраняя индивидуальное генетическое наследие донора и создавая модели заболевания конкретного пациента, полезные для исследования патогенеза, эффектов лекарств и разработки методов лечения. Исследовали цитотоксичность панели иммуномодуляторов с использованием ИПСК пациентов с AT или различными формами САГ [34]. Цитотоксические эффекты двух препаратов, предложенных для лечения соответственно AT и САГ (дексаметазон и мепакрин), были оценены после 72-часового воздействия. Данные были получены также для других иммуномодулирующих препаратов (тиогуанин, меркаптопурин, талидомид и леналидомид). Была проанализирована относительная экспрессия генов, участвующих в тестируемых лекарственных путях, и предложена инновационная модель in vitro, полезная для исследования механизмов лекарственных средств, потенциально эффективных при вышеуказанных заболеваниях [34].
Заболевания органов зрения и слуха
В последнее время генная терапия рассматривается как потенциально эффективное средство лечения заболеваний дегенерации сетчатки. Система CRISPR/Cas9 и ее комбинации с плюрипотентными стволовыми клетками уже используются в качестве мощного инструмента редактирования генома в офтальмологических исследованиях с учетом ее преимуществ и проблем [35]. Очерчены клинические пути для лечения наследственных заболеваний глаз на основе CRISPR и дан обзор важных этических последствий редактирования генов [36].
Примером может служить изучение ретинопатии у недоношенных детей [37]. Длинная некодирующая РНК (lncRNA) регулирует пролиферацию и миграцию эндотелиальных клеток сетчатки человека, а также неоваскуляризацию сетчатки при диабетической ретинопатии. Основываясь на сходстве патогенезов ретинопатии у недоношенных детей и диабетической ретинопатии, сделали вывод о сходной роли lncRNA в патогенезе двух видов ретинопатии и разработали модель на животных (мыши) для изучения патогенеза у детей. Установили, что различно экспрессируемые lncRNA могут регулировать патогенез ретинопатии у мышей через микроРНК и множественные сигнальные пути, и предложили потенциальные терапевтические мишени для генной терапии.
Потеря слуха является одним из наиболее распространенных сенсорных расстройств, затрагивающих примерно 1 из 500 новорожденных без лечения. Мутации генов внутреннего уха способствуют большей части генетической глухоты. С технологией CRISPR/Cas9 функции генов внутреннего уха могут быть эффективно изучены путем нарушения нормальных аллелей гена. Что касается генетической потери слуха, то CRISPR/Cas9 может восстанавливать измененные мутациями гены с помощью гомологичной репарации. Показали, что CRISPR/Cas9-опосредованное редактирование генома может эффективно выполняться во внутреннем ухе млекопитающих in vivo. В настоящее время обсуждаются вопросы, касающиеся применения CRISPR/Cas9 в слуховых системах, связанных с генетической потерей слуха у человека [38].
Синдром Ашера является частой причиной потери слуха и зрения у людей. Были определены три клинических подтипа, на данный момент идентифицировано 10 генов USH. Охарактеризованы несколько моделей мышей Usher, которые точно воспроизводят слуховой фенотип, связанный с синдромом Ашера, и вестибулярный фенотип, связанный с некоторыми мутациями в генах USH. За последние 10 лет появились новые методы лечения синдрома Ашера, основанные на недавнем прогрессе в передаче генов и новых инструментах редактирования генов [39]. Многообещающий успех, демонстрирующий восстановление функций слуха и равновесия, достигнут с помощью различных терапевтических стратегий на моделях животных. Однако перенос метода в клинику требует его дальнейших улучшений.
Гематологические заболевания
Гемоглобинопатии — это группа наследственных заболеваний, обусловленных генетическими нарушениями, приводящими к абберантной экспрессии гемоглобина или изменениям его структуры, что приводит к тяжелым нарушениям здоровья и смерти. Серповидноклеточная анемия и β-талассемия, наиболее распространенные формы гемоглобинопатий, обычно лечатся с помощью переливаний и фармакологических препаратов. Современная терапия гемоглобинопатий основана на трансплантации аллогенных стволовых клеток от здоровых доноров, однако она может применяться только у ограниченного числа пациентов. Новым лечебным подходом является коррекция генов с помощью нуклеазы, которая включает применение инструментов точного редактирования генома для исправления вызывающей болезнь мутации. В настоящее время представлены приложения для инженерии генома с использованием CRISPR/Cas9 и рассмотрены проблемы и перспективы применения системы CRISPR/Cas9 в качестве варианта лечения серповидноклеточной анемии [40].
Гемофилия вызывается различными мутациями в генах фактора свертывания крови, включая фактор VIII (FVIII) и фактор IX (FIX), которые кодируют ключевые белки в пути свертывания крови. Выходя за рамки культивируемых клеточных систем, исследователи сейчас вступают в эпоху прямой генной коррекции in vivo с использованием различных инструментов доставки. Уже описано текущее состояние технологии редактирования генома in vivo и ex vivo, связанной с возможной коррекцией гена гемофилии, и важные вопросы, связанные с применением технологии редактирования генов гемопоэтических стволовых клеток у пациентов с гематологическими заболеваниями [41–43].
Другие наследственные заболевания
Муковисцидоз — хроническое прогрессирующее аутосомно-рецессивное заболевание, связанное с нарушением функций секреторных эпителиальных клеток и приводящее, в частности, к обструкции дыхательных путей и протоков поджелудочной железы. Установлено, что болезнь вызывается мутацией в гене CFTR, что позволило бороться с фатальным исходом заболевания. В настоящее время обсуждаются возможности использования технологий геномного редактирования применительно к лечению муковисцидоза. Установлено, что именно система CRISPR/Cas9 смогла обеспечить более простой, быстрый и доступный по цене метод редактирования, чем применение ранее открытых нуклеаз ZFN и TALLEN [44].
Успешной оказалась попытка применения генотерапии в лечении буллезного эпидермолиза, проявляющегося при повреждении гена LAMB3 образованием пузырей и эрозий кожи при любом незначительном воздействии. Ребенку с тяжелой формой заболевания успешно трансплантировали трансгенный эпидермис. Его получали, выращивая культуры клеток эпидермиса пациента и обрабатывая их ретровирусами, несущими нормальную копию LAMB3. Опыт оказался успешным, прежних симптомов не наблюдается в течение 2 лет [45]. В последние годы предприняты попытки изучения с помощью генной терапии нейродегенеративных заболеваний — болезни Паркинсона и болезни Альцгеймера [46, 47].
Заключение
Следует отметить, что хотя система CRISPR/Cas9 обеспечивает удобное редактирование генома, сопровождаемое многими преимуществами, она поднимает существенные этические проблемы. В Китае уже сделаны первые шаги в клинических испытаниях технологий редактирования генома, основанных на CRISPR/Cas9. Использовали эмбрионы человека с мутантным геном, приводящим к β-талассемии. В результате эксперимента в 5–10% эмбрионов мутация, ответственная за возникновение болезни у взрослых людей, действительно была исправлена. Однако во всех клетках редактируемых эмбрионов возникло большое количество незапланированных и, возможно, опасных мутаций. Очевидно, что технология нуждается в значительной доработке, прежде всего в улучшении специфичности белка Cas9. Несмотря на интерес к проблеме, два главных научных журнала — Nature и Science отказались публиковать результаты китайских ученых. Возникло множество этических вопросов, которые пока так и не получили единого решения в мире по поводу того, когда же можно, а когда нельзя применять редактирование генома. Пока каждая из стран решает это по-своему. Так, в Великобритании официально разрешены первые опыты по геномному редактированию эмбрионов человека. В Китае запрещено использование преимплантационной генетической диагностики для выбора пола будущего ребенка, но такая процедура не запрещена в США. Несомненно, исследования в этом направлении будут продолжаться, а правовые нормы — разрабатываться. В России генетическим технологиям уделено особое внимание в рамках национальных проектов.