Muriatic acid is a common name for hydrochloric acid, a highly corrosive chemical substance. This compound has numerous industrial and domestic uses, ranging from food, metals and polymer processing to swimming pool water disinfection. Even in dilute form, muriatic acid can irritate the eyes and skin and cause respiratory problems. In concentrated amounts, it can cause severe chemical burns and even death. You must neutralize any spillage by mixing it with a mild base before you clean up the spill.
TL;DR (Too Long; Didn’t Read)
You can neutralize muriatic acid by mixing it with a mild base such as sodium bicarbonate (baking soda). Always wear protective clothing such as goggles and thick rubber gloves when working with muriatic acid.
Chemical Reactions
Neutralization of an acid occurs when it is combined with a base to produce a salt and water. Muriatic acid consists of positively charged hydrogen ions and negatively charged chlorine ions. A basic liquid such as caustic soda (sodium hydroxide) consists of positively charged sodium ions and negatively charged hydroxyl ions. During the reaction, the hydrogen and hydroxyl ions combine to form water while the chlorine and sodium ions combine to produce sodium chloride, known as table salt. Weaker basic substances such as baking soda (sodium bicarbonate), soda ash (sodium carbonate) and lime (calcium carbonate) break down into positive sodium or calcium ions and negative carbonate ions in the acid. Hydrogen and carbonate ions combine to produce carbon dioxide gas in a fizzing effect together with water. The metal and chloride ions combine to produce sodium or calcium chloride salt.
Heat from Chemical Reaction
Acid neutralization is a highly exothermic reaction, meaning that it produces large amounts of heat that can vaporize any water produced. Any carbon dioxide that is produced in a small neutralization reaction can irritate your eyes and throat, although it will not be in large enough volumes to be lethal. To minimize heat and carbon dioxide, add the base material slowly and gradually to the muriatic acid.
Protective Clothing
Eye and skin protection should be worn with acid-compatible gloves — such as those made of neoprene or nitrile — as latex gloves dissolve in acid. Any source of flame or ignition should be switched off.
Small Spills
Baking soda, soda ash and lime are the safest and most economic methods of neutralizing small or domestic spills of muriatic acid. Sprinkled the neutralizer slowly around the edges of the spill and then toward the center to minimize any carbon dioxide foaming. Once you have neutralized the spill, cover it with dry sand, soil or another inert material — such as vermiculite — and place it in a special container for chemical waste and disposed.
Large Spills
Limestone and dolomite (calcium magnesium carbonate) are common neutralizing agents for large-scale muriatic and other acid spills in natural water courses and coal mine water flows. Both materials react with the acid over a period of about 15 minutes to produce salts in a sludge that can be easily handled and removed. Limestone is the superior reactant of the two.
Нейтрализация соляной кислоты. Очень нужен ответ
-
salenaja
- Сообщения: 1
- Зарегистрирован: Ср июн 20, 2012 6:19 pm
Нейтрализация соляной кислоты. Очень нужен ответ
Почему каустическая сода NaOH лучше подходит для нейтрализации соляной кислоты, чем известь CaO.
В пятницу я защищаю диплом и вероятность получить такой вопрос 100 %, хочется получить развернутый ответ. Спасибо большое за помощь )) Для любознательных — заканчиваю строительный факультет
-
amik
- Сообщения: 23125
- Зарегистрирован: Вс мар 05, 2006 9:32 pm
Re: Нейтрализация соляной кислоты. Очень нужен ответ
Сообщение
amik » Ср июн 20, 2012 6:47 pm
Патамучто растворимость разная.
Бог на стороне не больших батальонов, а тех, кто лучше стреляет (приписывается Вольтеру)
-
Iskander
- Сообщения: 3168
- Зарегистрирован: Чт июн 30, 2005 6:45 pm
Re: Нейтрализация соляной кислоты. Очень нужен ответ
Сообщение
Iskander » Ср июн 20, 2012 6:52 pm
С точки зрения химии — одинаково.
С точки зрения технологии — NaOH хорошо растворима, а CaO — плохо. Удобнее проводить гомогенные реакции.
-
Polychemist
- Сообщения: 9336
- Зарегистрирован: Вт дек 21, 2004 11:42 am
Re: Нейтрализация соляной кислоты. Очень нужен ответ
Сообщение
Polychemist » Чт июн 21, 2012 12:30 am
Вопрос не однозначен. Что значит лучше? CaO, как двухосновная, загасит больше солянки.
-
Polychemist
- Сообщения: 9336
- Зарегистрирован: Вт дек 21, 2004 11:42 am
Re: Нейтрализация соляной кислоты. Очень нужен ответ
Сообщение
Polychemist » Чт июн 21, 2012 4:59 am
И, ещё. Если речь о чём-то промышленном — что предпочтительней для стоков — NaCl или CaCl2?
-
Phobos
- Сообщения: 6270
- Зарегистрирован: Чт авг 12, 2004 9:24 am
Re: Нейтрализация соляной кислоты. Очень нужен ответ
Сообщение
Phobos » Чт июн 21, 2012 7:50 am
Что значит «лучше», по каким критериям? На производстве, где есть опасность утечки соляной кислоты, ее как раз будут нейтрализовать Ca(OH)2. Меньше тепловой эффект, избыток гидроксида легче убрать, окружающая среда не загрязняется сильной щелочью (что ничуть не лучше кислоты). Если речь идет о реакции нейтрализации с точки зрения аналитики, то тут требования другие — гомогнность раствора, легкость определения конечной точки…Вы расскажите сперва, по каким критериям оценка производится.
Wodka trinkt man pur und kalt, das macht hundert Jahre alt!
-
Smol
- Дон Кихот
- Сообщения: 15816
- Зарегистрирован: Вс фев 01, 2009 5:07 pm
Re: Нейтрализация соляной кислоты. Очень нужен ответ
Сообщение
Smol » Чт июн 21, 2012 8:59 am
У хлористого натрия растворимость в воде выше, чем у хлористого кальция, кроме того, с продажным товарным 30% раствором едкого натра работать удобнее, чем с сухим CaO или с известковым молоком (его еще и готовить надо, если, конечно, его нет готового где-то поблизости), поэтому и используют обычно натриевую щелочь.
Соляную кислоту и едкий натр обычно в промышленности получают путем электролиза раствора NaCl, так что логично в случае необходимости осуществить как бы обратный процесс
-
Phobos
- Сообщения: 6270
- Зарегистрирован: Чт авг 12, 2004 9:24 am
Re: Нейтрализация соляной кислоты. Очень нужен ответ
Сообщение
Phobos » Чт июн 21, 2012 9:42 am
Электролиз дает хлор, а не соляную к-ту, так что процесс явно не обратный:)
Wodka trinkt man pur und kalt, das macht hundert Jahre alt!
-
avor
- Сообщения: 12650
- Зарегистрирован: Пн янв 24, 2005 1:13 pm
Re: Нейтрализация соляной кислоты. Очень нужен ответ
Сообщение
avor » Чт июн 21, 2012 11:19 am
Phobos писал(а):Электролиз дает хлор, а не соляную к-ту, так что процесс явно не обратный:)
Ну вообще то синтетичку обычно из электролизного же хлора и водорода получают. хотя конечно это не туда сюда обратно
-
amge
- Сообщения: 1957
- Зарегистрирован: Вт июл 31, 2007 11:42 am
Re: Нейтрализация соляной кислоты. Очень нужен ответ
Сообщение
amge » Чт июн 21, 2012 12:14 pm
Smol писал(а):У хлористого натрия растворимость в воде выше, чем у хлористого кальция
Однако, наоборот . У первого 35.9, у второго 74.5 г на 100 г воды пр 20 град. А если еше на хлор пронормировать…
-
stallker
- Сообщения: 2121
- Зарегистрирован: Чт дек 03, 2009 12:08 am
Re: Нейтрализация соляной кислоты. Очень нужен ответ
Сообщение
stallker » Чт июн 21, 2012 10:23 pm
salenaja писал(а):Почему каустическая сода NaOH лучше подходит для нейтрализации соляной кислоты, чем известь CaO.
По скорости нейтрализации.
Сократ мне друг, но истина дороже.
-
MONSTA
- Сообщения: 2010
- Зарегистрирован: Вт фев 20, 2007 11:36 am
Re: Нейтрализация соляной кислоты. Очень нужен ответ
Сообщение
MONSTA » Пт июн 22, 2012 11:46 am
Один выпускник нашего химфака, попавший после его окончания в многотиражку Ижорского завода (еще в социалистические времена), рассказывал такой случай. Скопились на производстве отходы серной кислоты, которую использовали для снятия окалины. В количестве цистерны, железнодорожной. Каустик или соду чего-то пожалели на нейтрализацию, кто-то предложил гашеную известь. Вот вбухали туда сколько нужно, растворчик стал зело мутным. Но был уже вечер пятницы, все торопились домой, разбираться никто не захотел, и все ушли, оставив раствор в цистерне. Схватившийся гипс из этой цистерны потом целую неделю выбивали с помощью отбойных молотков и какой-то матери.
-
Phobos
- Сообщения: 6270
- Зарегистрирован: Чт авг 12, 2004 9:24 am
Re: Нейтрализация соляной кислоты. Очень нужен ответ
Сообщение
Phobos » Пт июн 22, 2012 11:56 pm
Мне кажется, что если бы в эту цистерну перед уходом вбухали несколько центнеров соды и закрыли бы крышку, то результаты были бы более плачевными и впечатляющими.
Wodka trinkt man pur und kalt, das macht hundert Jahre alt!
-
GreenWorld
- Сообщения: 1044
- Зарегистрирован: Вт апр 27, 2010 4:40 pm
Re: Нейтрализация соляной кислоты. Очень нужен ответ
Сообщение
GreenWorld » Сб июн 23, 2012 6:10 pm
А если бы вбухали NaOH в соответствующем к-ве, то и крышку закрыть не успели бы и убежать тоже.
Так что кальций рулит
singurdessa gippiget kessarkeddey
andarroy sso ettiget scintillata ssey
-
Hedgehog
- химик ежовый
- Сообщения: 13401
- Зарегистрирован: Ср янв 19, 2005 7:41 pm
Re: Нейтрализация соляной кислоты. Очень нужен ответ
Сообщение
Hedgehog » Ср июн 27, 2012 11:48 am
CaO дешевле, что в промышленных масштбах играет определяющую роль
bacco, tabacco e Venere
При строгом соблюдении техники безопасности при хранении и транспортировке кислот и щелочей, а также при работе с ними, вероятность аварийной ситуации крайне мала. Тем не менее, знать, как действовать в случае ее возникновения, надо обязательно. Это может спасти чье-то здоровье или даже жизнь!
Чем опасны кислоты и щелочи
Контакт с кислотами и щелочами может вызвать химические ожоги; 
Все сотрудники лабораторий, имеющих дело с едкими реактивами, обязаны уметь оказывать первую помощь при химических ожогах; знать, где расположены аптечка, нейтрализующие растворы, песок и опилки. По технике безопасности в аптечке должны находиться по 1 л раствора борной или лимонной кислоты и раствора соды, или комплект PLUM с нейтрализующими растворами.
Приготовление нейтрализующего раствора
Для приготовления нейтрализующего раствора берут 1 литр воды и 10 г реактива (лимонной кислоты, борной кислоты, соды). Размешивают до полного растворения всех твердых частиц и переливают в пластиковые сосуды подходящего размера. Потом на них наклеивается этикетка с хорошо читаемым указанием названия, концентрации и назначения («нейтрализующий раствор для кислоты», «нейтрализующий раствор для щелочи»).
Приготовленные растворы должны храниться в аптечке или рядом с ней.
Что делать при химических ожогах
Место поражения щелочью обильно поливают 1%-ным раствором лимонной или борной кислоты.
Для химических ожогов специально предназначена нейтрализующая жидкость из комплекта PLUM (выливается весь флакон).
• Если кислота или щелочь попали в глаза, то они промываются нейтрализующим раствором, разведенным вдвое.
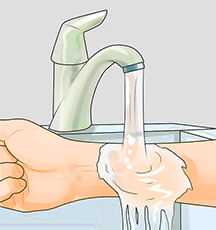
• После этого место ожога промывают водой, мылом и снова водой. Промывание водой должно длиться не менее 15 минут.
• Пострадавшего должен осмотреть врач для определения дальнейшего лечения. При необходимости вызывают «Скорую помощь».
Что делать при разливах
При разливе едкого хим. реактива крайне важно знать характер 
После того, как вся жидкость впиталась, песок или опилки сметают и утилизируют (захоранивают или передают на утилизацию сертифицированным организациям). Место пролива заливают нейтрализующим раствором (раствором соды или лимонной, борной кислоты), промывают водой и вытирают насухо.
Что делать при пожарах
Сами кислоты и щелочи, как правило, относятся к негорючим веществам, но они могут разлагаться при нагревании или вступать в реакции с металлами или органическими материалами, выделяя токсичные и горючие газы и вещества.
Если в зоне пожара оказались кислоты или щелочи, то все участвующие в тушении должны быть об этом проинформированы. Следует принять меры предосторожности, необходимые при контакте с кислотами или щелочами; использовать резиновую обувь, перчатки и респираторы, очки.
Пожар, в зоне которого оказались кислоты или щелочи, тушат песком, химической пеной, углекислым газом, мелкораспыленной водой.
Содержание
- Соляная кислота смыть водой
- Чем отмыть соляную кислоту
- Меры предосторожности
- Как избавиться от засоров?
- Другое применение кислоты в быту
- Избавление от накипи в чайнике
- Вывод
- Причины появления засоров
- Способы устранения
- Использование обычной соли и соды
- Применение соляной кислоты
- Важно
- Пошаговая инструкция
- Видеообзор:
Соляная кислота смыть водой
Соляная кислота — это общее название для соляной кислоты, очень агрессивного химического вещества. Это соединение имеет многочисленные промышленные и бытовые применения, начиная от обработки продуктов питания, металлов и полимеров и заканчивая обеззараживанием воды в бассейне. Даже в разбавленной форме соляная кислота может раздражать глаза и кожу и вызывать проблемы с дыханием. В концентрированных количествах это может вызвать серьезные химические ожоги и даже смерть. Вы должны нейтрализовать любой разлив, смешивая его с мягкой основой, прежде чем очистить разлив.
Химические реакции
Нейтрализация кислоты происходит, когда она объединяется с основанием для производства соли и воды. Соляная кислота состоит из положительно заряженных ионов водорода и отрицательно заряженных ионов хлора. Основная жидкость, такая как едкий натр (гидроксид натрия), состоит из положительно заряженных ионов натрия и отрицательно заряженных гидроксильных ионов. Во время реакции ионы водорода и гидроксила объединяются, образуя воду, в то время как ионы хлора и натрия объединяются, образуя хлорид натрия, известный как поваренная соль. Более слабые основные вещества, такие как пищевая сода (бикарбонат натрия), кальцинированная сода (карбонат натрия) и известь (карбонат кальция) распадаются на положительные ионы натрия или кальция и отрицательные ионы карбоната в кислоте. Водород и карбонат-ионы объединяются, чтобы произвести газ углекислого газа в эффекте шипения вместе с водой. Ионы металла и хлорида объединяются, чтобы произвести соль хлорида натрия или кальция.
Тепло от химической реакции
Кислотная нейтрализация является сильно экзотермической реакцией, что означает, что она производит большое количество тепла, которое может испарять любую произведенную воду. Любой углекислый газ, который образуется в результате небольшой реакции нейтрализации, может раздражать ваши глаза и горло, хотя он не будет в достаточно больших объемах, чтобы быть смертельным. Чтобы свести к минимуму тепло и углекислый газ, медленно и постепенно добавляйте базовый материал в соляную кислоту.
Защитная одежда
Для защиты глаз и кожи следует использовать совместимые с кислотой перчатки — например, из неопрена или нитрила — так как латексные перчатки растворяются в кислоте. Любой источник пламени или воспламенения должен быть выключен.
Небольшие разливы
Пищевая сода, кальцинированная сода и известь являются наиболее безопасными и экономичными методами нейтрализации небольших или бытовых разливов соляной кислоты. Медленно разбрызгивайте нейтрализатор по краям разлива, а затем по направлению к центру, чтобы свести к минимуму пенообразование углекислого газа. После того, как вы нейтрализовали разлив, покройте его сухим песком, почвой или другим инертным материалом — таким как вермикулит — и поместите его в специальный контейнер для химических отходов и утилизируйте.
Большие разливы
Известняк и доломит (карбонат кальция-магния) являются распространенными нейтрализующими агентами для крупных разливов соляной кислоты и других кислот в естественных водоемах и в потоках воды из угольных шахт. Оба материала реагируют с кислотой в течение примерно 15 минут с образованием солей в шламе, с которыми легко обращаться и удалять. Известняк является лучшим реагентом из двух.
Источник
Чем отмыть соляную кислоту
Соляная кислота – это однородная бесцветная жидкость с резким запахом. Является очень едким веществом, взаимодействующим с большинством металлов. Благодаря этим свойствам материал широко применяется не только в промышленности, но и в быту.
Реагент входит в состав различных средств для избавления от канализационных засоров, но его можно использовать для этой цели и самостоятельно, предварительно разбавив водой в нужных пропорциях.
Этим применение кислотного раствора в доме не ограничивается: материал используют для очистки сантехники от ржавчины и известкового налета, устранения трудновыводимых пятен с тканей и даже для удаления накипи в чайнике.
Меры предосторожности
Так как реагент имеет сильную разъедающую способность и при взаимодействии с воздухом выделяет токсичные пары, при работе с ним очень важно использовать защитные средства.
При попадании на кожные покровы и слизистые оболочки материал вызывает химические ожоги, а при продолжительном нахождении в атмосфере HCl происходит разрушение зубов, развитие катара дыхательных путей и изъязвление слизистой оболочки носа.
В целях защиты необходимо использовать противогаз, прорезиненный фартук, очки и резиновые перчатки. Работы проводить только в хорошо проветриваемых помещениях. При попадании реагента на кожу или слизистые промыть пораженный участок большим количеством проточной воды и обратиться за медицинской помощью.
Как избавиться от засоров?
Для жесткой и целенаправленной очистки канализации от органических отложений (жиров, остатков еды, волос, моющих средств и пр.) следует использовать разбавленную соляную кислоту. Этот способ не подходит для стальных, железных и пластмассовых труб, так как соединение может привести к их коррозии и даже образованию сквозных дыр.
Перед началом проведения процедуры нужно закрыть сливные отверстия в другой сантехнике и обеспечить приток воздуха в помещение. Этот шаг необходим, так как в процессе работы кислота начнет активно вырабатывать токсичные газы.
Рекомендуется развести состав водой до достижения 3-10 % концентрации, после чего залить непосредственно в канализацию и оставить на 1-2 часа. Затем нужно промыть трубы большим количеством воды и при необходимости провести процедуру повторно.
Важный момент! Не следует смешивать реагент с другими средствами для прочистки канализации, особенно на основе щелочей. В противном случае реакция этих соединений приведет к сильному повреждению труб.
Другое применение кислоты в быту
Кислотным составом можно легко очистить сантехнику из фаянса от известкового налета и ржавчины, удалить мочевой камень и другие загрязнения. Для большего эффекта к средству добавляют ингибитор (например, уротропин), замедляющий химическую реакцию.
Процедуру проводят следующим образом: кислоту разбавляют водой до достижения 5 %-ной концентрации и добавляют ингибитор из расчета 0,5 г на 1 л жидкости. Полученным составом обрабатывают поверхность и оставляют на 30-40 минут (в зависимости от степени загрязнения), после чего промывают водой.
Слабый кислотный раствор также используется для удаления пятен от ягод, чернил или ржавчины с тканей. Для этого материал замачивают в составе на некоторое время, после чего тщательно ополаскивают и стирают в обычном режиме.
Избавление от накипи в чайнике
Для этой цели используют 3-5 %-ный раствор соляной кислоты, который наливают в чайник и нагревают до 60-80°С в течение 1-2 часов или до тех пор, пока накипные отложения не распадутся. После этого накипь становится рыхлой и легко удаляется деревянной лопаточкой.
Эффективность метода обусловлена тем, что реагент вступает в реакцию с карбонатами магния и кальция и превращает их в растворимые соли. Выделяющийся при этом углекислый газ разрушает слой накипи и придает ему рыхлость. После удаления солевых отложений посуду тщательно моют чистой водой.
Важный момент! Этот способ не подходит для удаления накипи в эмалированных или алюминиевых чайниках со сколами и трещинами: это приведет к коррозии металла и его сильному повреждению.
Вывод
При соблюдении мер предосторожности и правил безопасности соляная кислота станет незаменимым помощником в быту. А приобрести ее по самым доступным ценам можно в нашей компании.
К примеру есть 20и литровые стеклянные бутылки, в которых хранилась кислота. Можно ли отмыть так, чтобы потом выстаивать в этой таре вино?
Поверьте химику с 50-летним стажем. Стеклянную тару из-под неорганических кислот (серной, азотной, соляной, фосфорной, а также органических — уксусной или муравьиной) можно помыть просто водой. Для этого совсем не требуется, как тут советуют некоторые, полностью заливать их водой, не нужна и пачка соли. Например, 20-литровую бутыль достаточно два-три раза ополоснуть 2-3 литрами воды, , т.е всего потребуется около 6-10 л воды. Для надежности, при втором ополаскивании можно добавить 10-20 г кальцинированной или пищевой соды. Кислот, которые не отмываются от стекла не существует. Иногда может быть ситуация, что в бутыль с остатками серной или азотной кислоты попало какое-то органическое вещество, прореагировало (обуглилось или осмолилось), и пристало к стенкам в виде черной (бурой, или иного цвета грязи). Вот такую бутыль использовать не стоит.
система выбрала этот ответ лучшим
6 месяцев назад
Емкости от кислот конечно можно отмыть и удалить остатки содержимого. Начать нужно с того, что изначально тщательно сполоснуть водой, а затем, вспомнив взаимоотношение кислот с щелоком, просто в емкость добавить пищевой соды. Кислота вступить в реакцию и нейтрализуется.
Остается после химической реакции удалить все её «последствия», промыв чистой водой с добавлением чистящих средств.
По завершении всех этих манипуляций, емкость нужно сполоснуть чистой теплой водой и дать ей полностью стечь.
Считаю, что после такой очистки, емкость полностью будет пригодна для хранения или транспортировки различных жидкостей или веществ, без последствий воздействия кислотной среды.
Когда работал в автотранспортном предприятии, к нам в аппаратную поставлялись бутыли с серной кислотой, именно двадцатилитровые. Вопрос «Чем отмыть стеклянную тару от различных кислот?» вообще ни кого не парил. После того как заканчивалась бутыль, слесаря промывали ее обычной водопроводной водой с содой, ополаскивали чистой, и использовали их под выстаивания браги. Ни кто не умер.. ) Еще и в очереди за ними стояли, из-за удобства горлышка — перчатку натянуть удобно.
Сейчас тоже самое делают на нашей ТЭЦ, так же эти же бутыли моют и снова «в оборот» под пищевые продукты повышенной градусности..)
Мыть нужно чайной содой. Залейте в ваши 20 литровые бутыли воды из крана и насыпьте по пакету чайной соды. Разболтайте и дайте сутки постоять! Потом вылейте и пять семь раз промойте водой. Этого будет вполне достаточно.
6 месяцев назад
Обычная питьевая сода — отличный нейтрализатор для остатков кислоты, так еще и не обладающий особо стойким вкусом / запахом, хорошо растворяющийся в обычной воде, не содержащий примесей. В общем, я бы несколько раз промыл такую бутыль раствором пищевой соды, а потом еще несколько раз — просто теплой водой, первый раз можно с кусочками обычной бумаги, для удаления любых частичек на стенках бутыли. И использовал бы себе эти бутыли без опаски. Для домашнего вина что-то лучше вообще сложно себе представить, ИМХО.
6 месяцев назад
Следует хорошо промыть бутыли. Если есть длинный тонкий шланг, то можно поместить его конец внутрь, так, чтобы вода вытеснялась снизу вверх. Другой способ — наливать воду, чуть взбалтывать ее, выливать. Так повторить
Но надо быть осторожным, когда льете воду в бутыль с остатком серной кислоты. Есть опасность выброса смеси. Поэтому надо убедиться в том, что серная кислота вся извлечена, и защищать щитком глаза, и тело спецодеждой.
В конце хорошо прополоскать бутыль водой с содой, пищевой или кальцинированной.
Бутылки из-под кислот можно промыть водой из крана раза два — три, затем ополоснуть водой с питьевой содой хотя бы один — два раза и еще два — три раза промыть чистой водой. Все должно отмыться нормально. На самом деле, например серная кислота в небольшой концентрации в вине почти всегда образуется при брожении.
6 месяцев назад
Стекло тара это такой носитель, который не пропитывается кислотой, а потому кислоту, можно смыть со стенок стеклянной тары где она хранилась, просто за счет обычной воды комнатной температуры. Сильно горячую воду не лейте, а то стекло может просто лопнуть.
6 месяцев назад
Для того чтобы отмыть стеклянную тару от различного рода кислот можно использовать пищевую соду. Дело в том, что кислота довольно хорошо смывается проточной водой, поэтому обработки содой и тщательной промывки водой будет вполне достаточно.
Кислота, в отличии от щёлочи отлично выполаскивается водой. Конечно можно прополоскать с питьевой содой, но соду вымыть намного труднее чем кислоту. Так что не имеет смысла «нейтрализовать» следы кислоты.
Среди множества вариантов, соляная кислота для чистки канализации выделяется кардинальным и жестким способом действия. Обычно, такой метод используют в крайних случаях, когда другие средства не помогли. Сторонники и противники этого способа ведут бесконечные споры о целесообразности подобных экспериментов.
Основные аргументы сторон противоречат друг другу, а реальность не подтверждает ни те, ни другие доводы. Однако, правильное применение этого способа способно решать возникающие проблемы. Рассмотрим технологию подобной прочистки канализации внимательнее.
Причины появления засоров
Канализационная система
перемещает сточные воды с большим содержанием органики и жиров. Они налипают на
стенки тонким слоем, который постепенно нарастает и превращается в полноценный засор. Как правило, он
располагается неподалеку от сливного отверстия кухонных раковин или других
сантехнических приборов. Чаще всего от жировых наслоений страдает сифон, изгиб
которого активно собирает на себя липкие и вязкие компоненты сточных вод.
Кроме этого, частой причиной
становятся посторонние предметы, попадающие в канализацию. Здесь могут
оказаться волосы, бумага, строительный мусор (песок, остатки клеевых
растворов), женские прокладки и другие нежелательные компоненты. Они застревают
в участках изгиба или сужения труб, становятся причиной образования постоянного
засора. Никакие методы, кроме механической прочистки, результатов не дают.
На чугунных трубах встречаются
случаи отслоения окалины с внутренней поверхности стенок. Она остается внутри и
быстро обрастает жиром, задерживает мелкие частицы органики. Решением проблемы
также станет механическая чистка
труб.
Способы устранения
К наиболее
эффективным способам относят механическую чистку. Она проста и доступна для
самостоятельного выполнения. Используется сантехнический тросик, который вводя
в трубу и вращательными движениями проталкивают внутрь.
При появлении контакта с засором, наконечник тросика
разрушает пробку. После этого внутреннюю полость трубопроводов промывают
сильной струей воды.
Есть
гидродинамическая прочистка. Она производится с помощью специальной техники.
Суть метода заключается в погружении тонкого шланга со специальным
наконечником, из которого бьет струя воды под сильным давлением. Эффективность
этого метода выше, чем у альтернативных видов чистки.
Использование химических средств,
как правило, производится только для очистки внутренних участков системы. В продаже есть много
составов, содержащих щелочные или кислотные компоненты. Иногда применяется прочистка канализации соляной
кислотой. Это крайне сомнительный и опасный способ, который может принести
больше вреда, чем пользы.
Использование обычной соли и соды
Если под рукой никаких средств не
оказалось, часто используют соль
для чистки канализации. Ее обильно засыпают в сливное отверстие и
выдерживают некоторое время. Соль
разъедает жировые наслоения, делает их рыхлыми. Через некоторое время сифон промывают сильной струей
воды, удаляя частицы органики.
Для усиления эффекта делают смесь
соды с солью. Пропорции бывают разными, но эффект обычно одинаковый. Необходимо
учесть, что обычная пищевая сода не годится. Нужен каустик, способный
эффективно взаимодействовать с жирами. Кроме этого, каустическая сода способна
растворять более сложные засоры. Например, волосы, которые плохо
взаимодействуют с большинством химических средств.
Однако, такой способ годится
только для засоров, расположенных поблизости от слива. Если проблемный участок
трубы находится дальше, нужны более радикальные средства.
Применение соляной кислоты
Соляная кислота является надежным растворителем жиров. В то же время, это
опасный и агрессивный химический состав. Он способен нанести немалый вред
трубопроводам и людям, производящим прочистку.
Многие пользователи сомневаются, можно ли прочистить канализацию
соляной кислотой. Их опасения вполне разумны:
- состав способен разъедать чугунные трубы. Для жителей многоквартирных домов это вполне реальная опасность, так как в подвале канализация почти везде чугунная;
- пары кислоты отрицательно воздействуют на органы зрения, дыхания, на кожу человека. Требуется использование средств защиты и усиленная вентиляция помещения;
- чистка канализации кислотой производится вслепую. Владелец квартиры просто наливает в сливное отверстие большое количество кислоты и ждет результата. Повлиять каким-либо образом на качество или эффективность процесса он не может;
- Вместо прочистки и устранения засора можно получить протечки в чугунных участках системы, что потребует серьезного ремонта. При этом, изначальная проблема останется.
Некоторые источники рекомендуют
использовать соляную кислоту с концентрацией не более 3-10 %. По их мнению, это
поможет защитить чугунные трубы от контакта с агрессивным химикатом. Однако,
растворить жировые наслоения многолетней давности таким способом явно не
удастся.
Важно
Есть еще один важный момент.
Кислоту заливают в сливное отверстие сантехники. Если в сифоне стоит вода, то
концентрация резко упадет и ожидаемого результата получить не удастся. Если перед
тем, как промыть
канализацию соляной кислотой, воду удалить, состав пройдет только по
нижней части трубопроводов. Никакого воздействия на верхнюю часть просвета труб
не будет оказано. Налить в систему такое количество химиката, чтобы полностью
покрыть сечение, нереально. Отсюда возникает сомнение в эффективности методики.
Сторонники чистки канализации
подобными методами исходят из общих представлений о свойствах материалов. Они
не принимают во внимание множественных факторов, снижающих эффективность
действия состава. Соляная
кислота для прочистки канализации дает нужный эффект только при довольно
высокой концентрации. Однако, плотность раствора сложно сохранить в нужном
состоянии. Остатки воды в трубах заметно снижают концентрацию состава.
Единственным узлом системы, получающим достаточно полный контакт с кислотой,
становится сифон.
Однако, его проще разобрать и
произвести механическую чистку.
Это займет гораздо меньше времени и не потребует заметных усилий.
Как прочистить канализацию и устранить засор своими руками
Очистка канализационных колодцев: способы и методы
Пошаговая инструкция
Перед тем, как прочистить канализацию
соляной кислотой, необходимо подготовить средства индивидуальной защиты.
Кроме этого, надо организовать усиленную вентиляцию помещения. Порядок
действий:
- заливают в сливное отверстие химический состав. Соляная кислота в канализацию подается аккуратно, тонкой струей, чтобы не разбрызгать по сторонам. Ее должно быть достаточно, чтобы раствор как можно дальше прошел по трубе;
- выдерживают определенное время. Сливное отверстие рекомендует прикрыть крышкой, тряпкой или иным предметом. Выдерживать состав следует как можно дольше и не менее получаса;
- пускают сильную струю воды и хорошо промывают полость труб.
Иногда вместо соляной используется серная кислота для прочистки канализации. Прочищать систему таким способом еще опаснее, так как пары серной кислоты имеют высокую концентрацию. Кроме этого, она эффективна только в больших концентрациях, что делает использование неоправданно опасным.
Видеообзор:
Источник
Соляная кислота – это общее название для соляной кислоты, очень агрессивного химического вещества. Это соединение имеет многочисленные промышленные и бытовые применения, начиная от обработки продуктов питания, металлов и полимеров и заканчивая обеззараживанием воды в бассейне. Даже в разбавленной форме соляная кислота может раздражать глаза и кожу и вызывать проблемы с дыханием. В концентрированных количествах это может вызвать серьезные химические ожоги и даже смерть. Вы должны нейтрализовать любой разлив, смешивая его с мягкой основой, прежде чем очистить разлив.
Химические реакции
Нейтрализация кислоты происходит, когда она объединяется с основанием для производства соли и воды. Соляная кислота состоит из положительно заряженных ионов водорода и отрицательно заряженных ионов хлора. Основная жидкость, такая как едкий натр (гидроксид натрия), состоит из положительно заряженных ионов натрия и отрицательно заряженных гидроксильных ионов. Во время реакции ионы водорода и гидроксила объединяются, образуя воду, в то время как ионы хлора и натрия объединяются, образуя хлорид натрия, известный как поваренная соль. Более слабые основные вещества, такие как пищевая сода (бикарбонат натрия), кальцинированная сода (карбонат натрия) и известь (карбонат кальция) распадаются на положительные ионы натрия или кальция и отрицательные ионы карбоната в кислоте. Водород и карбонат-ионы объединяются, чтобы произвести газ углекислого газа в эффекте шипения вместе с водой. Ионы металла и хлорида объединяются, чтобы произвести соль хлорида натрия или кальция.
Тепло от химической реакции
Кислотная нейтрализация является сильно экзотермической реакцией, что означает, что она производит большое количество тепла, которое может испарять любую произведенную воду. Любой углекислый газ, который образуется в результате небольшой реакции нейтрализации, может раздражать ваши глаза и горло, хотя он не будет в достаточно больших объемах, чтобы быть смертельным. Чтобы свести к минимуму тепло и углекислый газ, медленно и постепенно добавляйте базовый материал в соляную кислоту.
Защитная одежда
Для защиты глаз и кожи следует использовать совместимые с кислотой перчатки – например, из неопрена или нитрила – так как латексные перчатки растворяются в кислоте. Любой источник пламени или воспламенения должен быть выключен.
Небольшие разливы
Пищевая сода, кальцинированная сода и известь являются наиболее безопасными и экономичными методами нейтрализации небольших или бытовых разливов соляной кислоты. Медленно разбрызгивайте нейтрализатор по краям разлива, а затем по направлению к центру, чтобы свести к минимуму пенообразование углекислого газа. После того, как вы нейтрализовали разлив, покройте его сухим песком, почвой или другим инертным материалом – таким как вермикулит – и поместите его в специальный контейнер для химических отходов и утилизируйте.
Большие разливы
Известняк и доломит (карбонат кальция-магния) являются распространенными нейтрализующими агентами для крупных разливов соляной кислоты и других кислот в естественных водоемах и в потоках воды из угольных шахт. Оба материала реагируют с кислотой в течение примерно 15 минут с образованием солей в шламе, с которыми легко обращаться и удалять. Известняк является лучшим реагентом из двух.
H2SO4 – вещество, способное растворяться в воде и выделять при этом большое количество тепла. Его 100-процентная концентрация при температуре больше +10 С затвердевает и становится кристаллической массой. Раствор используют в фармакологии и медицине, для диагностики желудочных заболеваний.
Элементарные правила безопасности
Все щелочные растворы должны находиться там, где до них не сможет добраться ребенок. Достаточно часто опасными реагентами случайно обливаются дети, которые пытались открыть интересные для них бутылочки с жидкостью. При этом недостаточно того, чтобы емкости были закрытыми, так как ребенок вполне может их разбить.
При работе с щелочными средствами следует надевать резиновые перчатки. Если вещество имеет резкий запах, то нужна защитная маска. Ведь даже вдыхание паров некоторых реагентов может вызвать отравление.
Альгинаты
Альгинаты – это полисахариды, которые после употребления образуют на поверхности желудочного сока пленку, которая не позволяет кислоте поступать в пищевод и вызывать чувство изжоги. Как и антациды, они действуют быстро и, помимо прочего, не имеют противопоказаний.
Кроме того, они способы абсорбировать кислоту, таким образом уменьшая ее концентрацию в желудке. Специальный состав альгинатов оказывает благотворное влияние на слизистую желудка, защищая его от эрозий – практически неизбежного явления для желудка с повышенным уровнем кислотности. Благодаря такому местному улучшению иммунитета организм может справляться с проблемой, пока кислотность не будет нормализована правильным питанием или устранением факторов, вызывающих ее.
Найти альгинаты (препараты, нейтрализующие кислоту желудке) в аптеке можно под следующими названиями:
- «Гевискон»;
- «Ламиналь».
Таким образом, лучший способ избавиться от повышенного уровня кислотности желудка – устранить причину патологии и применить правильно выбранную симптоматическую терапию в виде медицинского препарата с доказанной эффективностью и безопасностью.
Антациды
Антациды – препараты, нейтрализующие кислоту в желудке за счет увеличения количества вырабатываемой слизи. Слизь защищает стенки желудка, уменьшает кислотность, и человек мгновенно чувствует облегчение. Кроме того, антациды способны абсорбировать все вредные вещества.
Антациды можно подразделить на две группы: «всасывающиеся» и «невсасывающиеся» — это термин обозначает, попадет ли препарат из желудка в кровоток или нет. Разумеется, процесс всасывания антацида в желудок крайне нежелателен. Поэтому использовать такие препараты нужно, как и соду, только в случае крайней необходимости. В качестве таких примеров можно привести:
- «Ренни»;
- «Тамс»;
- «Викаин»;
- «Викаир».
Невсасывающиеся антациды – более современные и безопасные препараты. Они быстро и мягко снижают уровень кислотности в желудке и выводятся из организма с калом, не вызывая впоследствии еще более выраженного подъема кислоты, как это зачастую происходит после приема соды.
К таким препаратам относятся:
- «Релцер»;
- «Гастрацид»;
- «Гевискон»;
- «Маалокс»;
- «Рутоцид»;
- «Альмагель»;
- «Магалфил»;
- «Фосфалюгель»;
- «Топалкан».
Зачем необходимо нейтрализовать
Полезное вещество добавляют в лекарства, краски, удобрения, взрывчатку – и это ещё не весь список. Но, соприкасаясь с H2SO4, человек может получить ожоги, случайно выпить её или облить на себя. Также необходимость нейтрализовать возникает после проведения опыта с использованием данного компонента. Способов это сделать несколько:
- С помощью металлов, таких как цинк, медь.
- Оксидами металлов.
- Щёлочь, гидроксид натрия и сода как наиболее яркий пример.
- Гидроксидом аммиака.
Если на кожу попала кислота, её промывают под проточной водой и нейтрализуют опасное вещество, прикладывая повязку, промоченную 2% раствором соды. Необходимость использования вышеперечисленных веществ возникает не только при экстренных ситуациях: H2SO4 быстро испаряется, так что в воздухе оказывается 300 мг на 1м 2 . А потому отработанный материал оставлять крайне опасно.
Этапы утилизации кислот
Последовательность промышленной утилизации:
- Упаковка в тару, которая отвечает техническим требованиям.
- Транспортировка в специальном транспорте к месту утилизации ー оборудованному помещению компании, которая имеет разрешение и лицензию на утилизацию опасных веществ.
- Очистка вещества от твердых примесей при помощи фильтров.
- Утилизация отфильтрованной жидкости методом нейтрализации или регенерации.
- Утилизация твердых примесей и осадка. Если нейтрализовать эти отходы или использовать повторно нельзя, они подлежат захоронению на специальных полигонах.
- Переработка оставшейся жидкости или уничтожение.
- Поступление восстановленного реагента и побочных веществ в повторное производство.
Как правильно утилизировать кислоты?
Хранить агрессивные реагенты на предприятии можно только с соблюдением следующих мер:
- герметичность тары, в которой хранится вещество, производить такую тару могут только предприятия, получившие лицензию, к каждой партии прилагается сертификат качества, все емкости маркируются;
- тара изготовлена из материала, который не вступает в реакции с химикатом, так предотвращается разрушение контейнера под воздействием содержимого, например, полимерные материалы;
- смешивание разных веществ недопустимо, они хранятся и транспортируются отдельно;
- помещение для хранения веществ оснащено вытяжной вентиляцией достаточной мощности с системой фильтров;
- перевозка осуществляется специализированным транспортом, оборудованным для избежания утечки химикатов.
Реакция нейтрализации
Сама реакция представляет собой взаимодействие основания и кислоты. Обязательным условием является образование воды и кислотной соли. Чем менее сильная кислота, тем больше воды выделяется.
Нейтрализацию часто используют в лабораториях, чтобы выяснить объём жидкости, нужный для реакции. То есть, если известна концентрация раствора, необходимо провести реакцию, постепенно добавляя второй компонент.
Предельное количество добавляемого компонента, при котором будет проходить реакция используют для проведения расчётов.
Действует такая формула: кислоту нейтрализуют щёлочью и наоборот. Ионное уравнение часто будет выглядеть подобным образом:
Каждая реакция нейтрализации может быть обратимой или необратимой в зависимости от компонентов – распадаются ли они при реакции. Необратимым считается взаимодействие сильных кислот и оснований, но остальные сочетания веществ будут распадаться.
Сода – слабая щёлочь, а это обуславливает обратимость реакции независимо от того, насколько концентрированной будет H2SO4. Когда же возникает необходимость нейтрализовать это агрессивное вещество?
Утилизация других кислот
Для нейтрализации ортофосфорной кислоты применяются растворы щелочи. В результате этого образуются фосфатные соли, которые применяются для изготовления минеральных удобрений, медикаментов, моющих средств и в других сферах.
Для утилизации азотной кислоты ее предварительно разбавляют водой, затем обрабатывают оксидом кальция. В результате такой реакции получается вода и нитрат кальция, который потом используется в производстве удобрений, бетона, стеклопластика и взрывчатки.
Препараты
Таким образом, становится очевидным, что лучший способ справиться с повышенной кислотностью – правильное питание. Но если рассматривать симптоматическое лечение, то можно использовать медикаментозные средства для решения проблемы. Несмотря на то что щелочь нейтрализует кислоту и сода кажется единственным логически обоснованным методом уменьшения количества в желудке, необходимо помнить о том, что современная фармацевтическая промышленность прекрасно справляется с задачей, создавая препараты, эффективность которых напрямую коррелирует с их безопасностью.
Для того чтобы уменьшить выработку лишней кислоты в желудке, традиционно используются препараты:
- «Пантопразол»;
- «Эзомепразол»;
- «Омепразол».
Чтобы нейтрализовать уже присутствующую повышенную кислотность, используются две группы препаратов: антациды и альгинаты. Для того чтобы понять, какой препарат выбрать, необходимо рассмотреть обе группы средств. Но в любом случае назначать препарат должен лечащий врач, а данная информация поспособствует пониманию процессов и важности соблюдение лечения.
Итак, работа желудка выглядит следующим образом:
- клетки желудка выделяют соляную кислоту, которая перерабатывает пищу и обеззараживает ее;
- другие клетки выделают пепсин, перерабатывающий белки пищевой массы;
- железы стимулируют моторику и контролируют процесс выделения кислот;
- избыток кислот нейтрализуется вырабатываемой слизью.
Если количество кислоты в желудке увеличено, следовательно, какой-то из описанных механизмов проходит неправильно.
Лечение диетой
Самый простой и безопасный способ лечения повышенной кислотности желудка – нормализация режима питания. Есть необходимо небольшими порциями, примерно пять раз в день.
В первую очередь, для того чтобы нормализовать кислотность, нужно полностью исключить следующие продукты:
- острые закуски, копченые блюда, консервы;
- жирные мясные блюда;
- жирные кисломолочные продукты;
- кофе;
- газированные напитки;
- квашеные овощи;
- сладости натощак;
- острые корнеплоды.
Перечень можно дополнить любыми блюдами, на которые возникают неприятные ощущения в желудке. Необходимо составить свой индивидуальный список и строго его придерживаться.
Основу рациона должны составлять продукты, которые понижают уровень кислотности в желудочном соке:
- нежирные йогурты;
- каши на молоке (особенно гречка);
- обычная питьевая вода (несколько глотков);
- запеканки из творога и фруктов;
- овощные соки (морковный, свекольный, картофельный) натощак;
- мед.
Правильно составленное меню часто позволяет избавиться от проблемы без лекарств.
Важность правильной утилизации
В процессе производства кожаных изделий, красящих веществ, пластмасс, азотных удобрений используются кислоты. Остатки неиспользованных веществ и побочные продукты в виде испарений, солей тяжелых металлов попадают в атмосферу и сточные воды из-за неправильной обработки.
Пары химикатов конденсируются в атмосфере и выпадают в виде кислотных осадков, тумана. Так эти вещества попадают в воду, отравляя озера и реки, осаживаются на полях и оказываются на нашем столе вместе с едой.
Так, если неправильно утилизировать серную кислоту, можно спровоцировать отравление как работников своего предприятия, так и жителей близлежащих населенных пунктов.
Что будет, если выпить щелочь?
У выпившего щелочь человека наблюдается следующая симптоматика:
- Ожог рта. Мягкие ткани отекают и приобретают красный цвет. Человек страдает от сильной боли. Постепенно отеки преобразуются в язвы;
- Появляется жажда. Во рту долго стоит металлический привкус;
- Боль в области груди. Ее интенсивность зависит от концентрации выпитой щелочи;
- Сильная рвота с вкраплениями крови. Связано это с тем, что щелочь повреждает внутренние сосуды;
- Риск асфиксии из-за интенсивной рвоты или деформированных пищеводных тканей;
- Состояние шока. Если концентрация щелочи высока, то болевой симптом приводит к исступлению человека, он перестает разумно мыслить и порой даже не в состоянии вызвать медиков;
- Спустя какое-то время после первичных симптомов наступает кровавый понос.
Анализируя случаи отравления щелочью, врачи пришли к выводу, что желудок может вовсе не пострадать. Ведь при взаимодействии выпитой щелочи с кислотной средой желудка происходит нейтрализация первой.
Но если концентрация вещества достаточно высока, то есть вероятность перфорации пищевода, то есть образования в нем отверстия.
Даже употребление небольших доз щелочных растворов чревато осложнениями, хотя поначалу человек может отделаться слабовыраженными симптомами. Поэтому никакого самолечения, только оперативное обращение к врачу.
Также специалисту нужно сообщить название вещества, ставшее причиной отправления. Это поможет сразу подобрать курс лечения и не тратить время на дополнительные обследования.
Часто впавшие в шоковое состояние пострадавшие совершают ряд опасных ошибок:
- Вызывают рвоту. Она в несколько раз повышает риск повреждения пищевода. Ведь щелочная жидкость из желудка вновь пойдет назад по тому же пути, что попала внутрь;
- Употребляют слабительные. Только врач может решить, насколько целесообразен тот или иной метод детоксикации;
- Пьют раствор лимонной кислоты. Эта ошибка связана с тем, что люди имеют общие представления о нейтрализации щелочи кислотой. Но то, что актуально для бытового применения, никак не поможет при отравлениях. Кислотный раствор может дать лишь дополнительную нагрузку на отравленный организм.
Чем опасна высокая кислотность?
В норме кислота в ЖКТ нейтрализуется таким образом, что не причиняет никакой опасности человеку. Но если ее слишком много, она способна повредить слизистую желудка. На ней начнут образовываться эрозии, а позже – даже язвы. Известно, что таким заболеваниям, как гастрит, язва, эрозия, часто предшествует хронический повышенный уровень кислотности желудка.
Высокий уровень кислоты уменьшает количество щелочи в желудке, а значит, пища не может перевариваться правильно. Это влияет на функционирование ЖКТ и на состояние человека в целом, ведь питание – поступление витаминов, полезных и питательных веществ, то есть основа жизни организма.
Отсюда следует, что необходимо знать, как распознать такую проблему и чем можно нейтрализовать кислоту.
Причины образования пробки
Устройств уха разрешает ему самоочищаться от ушной серы во время жевания либо разговора. Для типичной гигиены ушей абсолютно довольно их мытья во время душа и вытирания полотенцем. Изредка люди чистят уши ватными палками, усердствуя максимально прочистить слуховой проход, тем самым утрамбовывая серу глубже и провоцируя образование пробки. Также серная пробка может возникнуть в ушной раковине с крепко тесным и изогнутым слуховым проходом, обусловленным генетическим строением.При частом образовании пробок нужно скрупулезно соблюдать гигиену ушей и периодично посещать отоларинголога.Происхождение серных пробок зачастую обуславливается непомерной выработкой ушной серы, которая накапливается в слуховом проходе и дословно закупоривает его, невидимо ослабляя слух и вызывая шум в ушах, сопровождающийся ощущением давления на внутренние ушные стенки. Не менее авторитетными факторами являются вязкость серы, разные воспалительные процессы в наружном органе слуха и низкая влажность воздуха в помещении, при которой сухие серные пробки образовываются почаще каждого.






