Атомы совсем крошечные, очень и очень маленькие. Вы наверняка знаете, что материя состоит из них, но вы никогда их не видели и не увидите, потому что атом невозможно разглядеть невооруженным (и даже иногда хорошо вооруженным) глазом. Стоит ли принимать на слово то, что все в нашем мире построено из этих крошечных «кирпичиков»?
Стоит. Даже самые скептически настроенные люди не смогут усомниться в существующих доказательствах. Так как же ученые открыли для науки атомы? И, что гораздо важнее, как они смогли доказать существование этих крошечных частиц?
В чем сложность?
Казалось бы, что проще, чем рассмотреть атомы в микроскоп. Но не все так элементарно, как сами частицы. Даже самый мощный микроскоп не в состоянии различить отдельный атом. Все потому, что размер атома гораздо меньше размера световой волны, и свет просто не может отражаться от крохотных частиц, тем самым превращая их в невидимые даже вооруженному глазу.
История открытия
Еще в конце XVIII века ученые стали замечать необъяснимое явление – ничем не обусловленное движение мелких частиц, например мельчайшей пыли над поверхностью воды. В середине XIX века шотландский ботаник Роберт Броун провел ряд экспериментов, в ходе которых он наблюдал движение мельчайших частиц каменной пыли. Через десятки лет частная теория относительности Эйнштейна путем математической формулы объяснила то, что в физике до тех пор называлось «броуновское движение».
К 1908 году все эксперименты, наблюдения и математические расчеты сводились к тому, что атомы реальны, и именно из них состоит любая окружающая нас материя. Однако не прошло и десятилетия, как наука ступила еще дальше и заставила ученых задуматься над тем, из чего же состоят сами атомы.
Структура атома
То, что атом не является единым целым, может показаться неожиданностью, особенно учитывая происхождение термина, который с греческого языка переводится как «неделимый». Однако физике давно известен факт сравнительно сложной и изменчивой структуры атомов. Проще всего сравнить строение «элементарных» частиц с солнечной системой.
Обычный атом составляют три компонента: протоны, нейтроны и электроны. Протоны и нейтроны образуют своеобразное «ядро» атома, поэтому в физике их часто называют нуклонами. Электроны же кружат вокруг ядра, как планеты вокруг солнца. Так же как солнце составляет 99,9% массы солнечной системы, так и атомное ядро практически полностью занимает массу атома.
Электрон
Если атомы невероятно малы, то их составляющие частицы еще меньше. Удивительно, что первым из трех элементов атомной структуры был обнаружен самый маленький по размеру – электрон. Для того чтобы понять, насколько электрон меньше атомного ядра, легче всего представить себе шмеля, летающего вокруг воздушного шара. Так каким же образом такие невообразимо малые частицы материи были обнаружены? Все дело в том, что несмотря на размер, электроны обладают огромной энергией, достаточной для создания видимых световых излучений.
Именно благодаря этим излучениям их впервые обнаружил британский физик Джозеф Джон Томсон, который создал своеобразный прототип ускорителя элементарных частиц. В изогнутую стеклянную трубку, в которой предварительно был создан вакуум, Томсон с одного края пустил отрицательный заряд тока. В результате заряда электроны, которые сами по себе обладают отрицательным зарядом, смогли отделиться от ядра и направиться к противоположному краю трубки. При столкновении с поверхностью стекла отрицательно заряженные частицы создали удивительное желто-зеленое сияние.
Протон
Открытие электрона заставило ученых задуматься над тем, что атом не так прост, как кажется. Большинство атомов обладают нейтральным зарядом, и чтобы удержать в своей структуре отрицательно заряженные частицы, им нужен положительный заряд. Так, в фокус ученых попал нуклеус, или атомное ядро. В начале XX века было проведено несколько экспериментов, в результате которых ученые доказали существование протонов и, кроме этого, строение атома, напоминающее структуру солнечной системы.
Британский физик Эрнест Резерфорд провел эксперимент по рассеиванию частиц через тонкую золотую фольгу. Сам ученый признался, что не ожидал многого от эксперимента. Он направил на фольгу поток радиоактивных альфа-лучей, то есть радиацию с положительным зарядом. Большая часть радиации прошла прямо сквозь фольгу, но некоторые частицы отталкивались от золотой поверхности под достаточно большими углами, что указывало на положительно заряженные частицы внутри атомов. Причем частицы эти – достаточно большие и очень плотные, что позволило Резерфорду первым создать планетарную модель строения атома.
Нейтрон
Казалось бы, и строение и поведение атомов были подробно изучены и изложены в многочисленных трудах, но у науки возникла очередная проблема. Как только ученые смогли измерить атомную массу, появился вопрос: почему масса ядра в два раза больше, чем должны весить положительно заряженные протоны? С самого начала ученые предполагали наличие равного по количеству и массе числа нуклонов, не имеющих электрического заряда. Их даже заведомо назвали нейтронами, но никто не мог доказать их существование.
Ученый-физик из Кембриджского университета Джеймс Чедвик совершил прорыв в области ядерной физики, когда не поверил в то, что атомы бериллия излучают гамма-радиацию. На тот момент, гамма-лучи были еще очень свежим открытием, однако Чедвик не поверил большинству ученых и решил провести собственный эксперимент в 1932 году.
Он направил «радиацию», излучаемую бериллием, на материю, богатую протонами. Протоны были вытолкнуты, словно бильярдные шары; так, будто их отодвинули частицы с такой же массой. Такую реакцию невозможно объяснить гамма-радиацией, поэтому частицы были признаны нейтронами. Таким образом, все основные частицы атома были найдены, однако история его изучения на этом не заканчивается.
Нашли нарушение? Пожаловаться на содержание
Как увидели атомы? Описание, фото и видео
На чтение 2 мин Опубликовано 08.08.2010 Обновлено 04.02.2020
Хотя ученые в принципе давно знают, что атомы существуют, все же тень сомнения оставалась, потому что увидеть атомы глазами никому не удавалось.
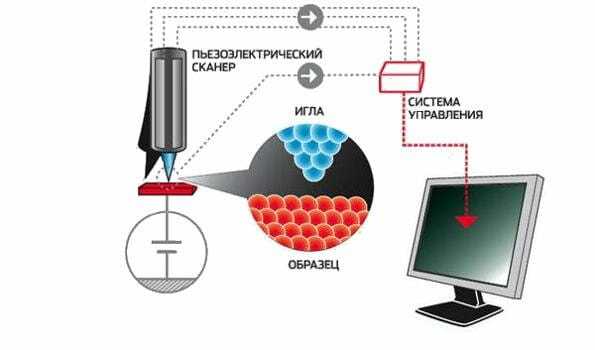
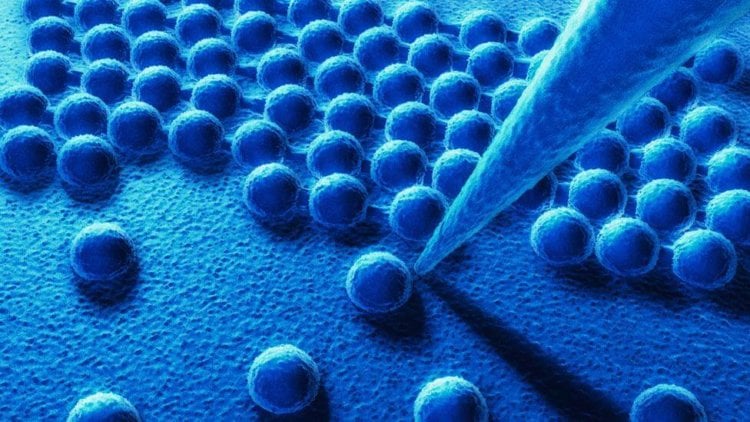
Теперь ученые могут получать изображения атомов на экране компьютера, передвигать атомы по поверхности, используя специальный инструмент — сканирующий туннельный микроскоп (СТМ).
Атомы и обычные измерительные приборы
Увидеть атомы в обычном микроскопе нельзя из-за малых размеров последних — от четырех до шестнадцати миллиардных долей сантиметра в диаметре. Волосок на руке в миллион раз толще. Использовать обычный свет, чтобы осветить атом, нельзя, потому что волна видимого света в две — пять тысяч раз больше диаметра атома.
Сканирующий туннельный микроскоп
СТМ — это не оптический прибор с окуляром, куда можно заглянуть глазом. Это компьютеризированный инструмент со специальным наконечником, который можно располагать очень близко к исследуемой поверхности. При движении наконечника электроны проскакивают промежуток между наконечником и материалом поверхности. В результате можно зарегистрировать электрический ток. При малейшем изменении расстояния между поверхностью и наконечником – электродом меняется сила электрического тока.
Как увидели атомы
Поверхность, которая кажется нам идеально гладкой, на атомном уровне является весьма и весьма бугристой. Электрод регистрирует каждое возвышение, даже если оно не превышает размерами атом. Компьютер рисует объемную карту поверхности, учитывая каждый ее атом. В результате мы можем «видеть» атомы.
С помощью СТМ ученые научились манипулировать атомами. Сначала атомы охлаждаются до минус 270 градусов Цельсия, что очень близко к абсолютному нулю температур, при такой низкой температуре атомы становятся практически неподвижными.
Используя при этом электрод СТМ, можно с помощью магнитного поля перемещать атомы по своему усмотрению и даже писать ими слова на поверхности вещества. Эти слова написаны так же, как слова в книгах для слепых шрифтом Брайля. Прочитать эти атомные письмена можно только с помощью СТМ.
Как увидеть атомы – интересное видео
Если Вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Научный консультант редакции сайта «Как и Почему». Свидетельство о регистрации средства массовой информации ЭЛ № ФС 77 — 76533. Издание «Как и Почему» kipmu.ru входит в список социально значимых ресурсов РФ (определяет Министерство цифрового развития, связи и массовых коммуникаций Российской Федерации).
Оцените автора
( 1 оценка, среднее 5 из 5 )
Элементарные частицы невозможно рассмотреть из-за их размера, который в несколько раз меньше длины световой волны. Перед тем как увидеть атом, учёным пришлось создать множество научных теорий и специальное оборудование — сканирующий туннельный микроскоп. Этот прибор помогает человеку заглянуть за грань неизвестности.
Становление атомной теории
Древнегреческий учёный Демокрит (460- 370 гг. до н. э.) впервые задумался над вопросом о существовании неделимых материальных частиц. Он назвал их атомы, что в переводе означает неделимые. К сожалению, позже эта теория проиграла другой популярной, но ошибочной концепции о строении физического мира. Суть её заключалась в утверждении, что всё во вселенной состоит из четырёх стихий: огня, воды, земли и воздуха. Человечество вновь вернулось к идее об атоме лишь на закате средневековья.
Известный английский учёный Джон Дальтон (1766−1844) стал первым сторонником атомной концепции строения вещества. Основные заслуги:
- выдвинул основные постулаты атомной теории вещества;
- впервые вычислил атомные массы некоторых химических элементов;
- создал первую в мире таблицу относительных атомных масс;
- ввёл понятие атомного веса.
Этот выдающийся деятель науки в начале XVII века доказал существование неделимых материальных частиц. Российским сторонником корпускулярной теории был известнейший учёный Михаил Васильевич Ломоносов (1711−1765). Он утверждал, что все вещества состоят из корпускул (молекул), а наблюдаемое людьми тело — движение этих частиц.
В сентябре 1860 года проходит Международный съезд химиков в германском городе Карлсруэ. В этой конференции участвовало более 120 учёных из разных стран. Горячо обсуждалась возможность познания неделимой частицы. Чётко разграничились определения и понятия атома, молекулы и эквивалента. Общим итогом стало безусловное утверждение атомно-молекулярной теории в научном сообществе.
Открытие Дальтона стало основой для создания периодического закона и таблицы химических элементов Дмитрия Менделеева. На тот момент стало понятно, что атомы различных веществ отличаются друг от друга по массе и свойствам. Однако, так как частица считалась неделимой, а увидеть её не было возможности, оставалось непонятным, как это происходит.
В физике того времени была принята абстрактная модель атома в виде шара, невероятно маленького размера. Мысль о том, что неделимая частица может состоять из каких-либо составляющих, большинством учёных считалась противоречивой и абсурдной.
Открытие и дальнейшее изучение электричества поставило перед физиками ряд вопросов. Было непонятно, как оно передаётся и благодаря чему это происходит. Учёные, проводя исследование катодных лучей, определили, что атом состоит из положительных и отрицательных частей — протонов и электронов.
Радиоактивность и планетарная концепция
Антуан Анри Беккерель впервые обнаружил радиоактивность. Случайно завернув соль урана в фотобумагу, учёный увидел на ней засвеченные следы неизвестного излучения. Позже выяснилось, что эти загадочные лучи состоят из ядер гелия (альфа-частицы), электронов (бета) и очень коротких радиоволн (гамма).
Огромный вклад в открытие новых радиоактивных элементов внесли супруги Мария и Пьер Кюри. За свой вклад в науку они были удостоены Нобелевской премии. В начале XX века Джозеф Джон Томсон (1856−1940) выдвинул пудинговую модель. Она описал атом как положительную частицу с вкраплением отрицательных электронов, словно изюм в пудинге. Эта модель стала первой концепцией, ставящей под сомнение неделимость атома.
Выдающийся физик Эрнест Резерфорд работал над созданием другой модели, для этого он провёл очень интересный эксперимент:
- Радиоактивный источник излучает направленный пучок альфа-частиц на специальный экран.
- Между источником и экраном располагается лист золотой фольги.
- При помощи микроскопа регистрируются места попадания частиц на экран.
В случае подтверждения пудинговой модели ожидалось увидеть равномерное рассеивание частиц по всей плоскости экрана. Однако результаты потрясли учёных. Бо́льшая часть альфа-излучения прошла сквозь золото без каких-либо изменений. Но отдельные частицы очень сильно отклонялись или отбрасывались назад, словно натыкаясь на что-то непреодолимое и очень тяжёлое.
В результате была создана планетарная модель. Она предполагала наличие в центре компактного и тяжёлого ядра с положительным зарядом. В центре была сосредоточена основная масса атома. По круговым орбитам, словно планеты вокруг солнца, вращаются отрицательные электроны. Планетарная концепция атома имела один существенный недостаток: оставалось непонятным, благодаря чему электроны вращаются вокруг ядра. Согласно законам физики, они должны были упасть на положительно заряженный центр.
Квантовая модель
Первые шаги в создании квантовой теории сделал известный физик Нильс Бор (1865−1962). В своей книге «Строение атома» он рассказал, что электроны непохожи на планеты, вращающиеся вокруг солнца. Отрицательно заряженные частицы создают облака, занимающие определённое пространство вокруг ядра. Вращаясь на стационарной орбите, электрон не теряет энергию и не может упасть на ядро. Скачок с одного уровня на другой сопровождается излучением или поглощением определённой порции энергии — кванта.
Таким образом, был сделан рывок к современному видению структуры атома. Однако модель имела существенные недостатки:
- интенсивность линий спектра осталась не объяснённой;
- подходит только для атомов водорода;
- в основе лежит противоречие между квантовой и классической физикой.
В 1932 году физик сэр Джеймс Чедвик совершает открытие ещё одной составляющей ядра — нейтрона, который не несёт заряда, благодаря этому он может вплотную приблизиться к ядру атома и стать причиной его распада. Это открытие стало началом ядерной эры человечества. Позже советский учёный Дмитрий Иваненко (1904−1994) создаёт протон — нейтронную модель ядра. Первое масштабное применение энергии, выделяющейся при распаде ядра, произошло в 1945 году при бомбардировке японского города Хиросима.
Современная модель атома:
- Электрон является материальной частицей, имеющей массу и электрический заряд, но двигаясь, он ведёт себя как волна, длина которой зависит от скорости его перемещения.
- К электрону применим принцип неопределённости. Нельзя одновременно узнать его местоположение в трёхмерном пространстве и измерить скорость движения.
- Не существует чётких орбит для электронов. Фактически, отрицательно заряженная частица может находиться в любой точке пространства вокруг ядра.
- Орбиталь — это область пространства, в которой наблюдается наибольшая вероятность нахождения электрона.
- Атомные ядра построены из нуклонов двух видов — протонов и нейтронов.
Номер химического элемента в таблице Менделеева соответствует количеству нейтронов в ядре. Масса элемента рассчитывается из общей суммы нуклонов. Поведение элементарных частиц в атоме описывается при помощи нового раздела физики — квантовой механики.
Увидеть атомы по отдельности
Сегодня каждый школьник знает о существовании атомов. Учёными создано множество теорий, описывающих поведение элементарных частиц. Существуют формулы и уравнения, позволяющие вычислить массу, размер и скорость протонов, нейтронов и электронов. Но как можно всё это увидеть своими глазами?
Человеческий глаз способен различать объекты не менее 0,05 мм, но атом намного меньше. Если увеличить его до размеров клубники, то ягода будет своим размером превосходить Землю. Выходит, что увидеть элементарные частицы можно только в микроскоп. Бывают следующие типы приборов:
- Оптический. Чтобы увидеть объект в такой микроскоп, его необходимо осветить. Длина волны видимого спектра намного превышает размер атома. Из-за этого она огибает его либо отражается, не передавая структуру поверхности.
- Электронный микроскоп для освещения использует поток отрицательно заряженных частиц. Длина волны такого излучения в тысячу раз меньше, чем у обычного света. Выходит, что дифракционный предел такого прибора позволяет разглядеть отдельные атомы и молекулы.
- Сканирующий зондовый микроскоп. Он состоит из микроскопической иглы с заострённым концом. Тончайшее остриё движется вдоль исследуемой поверхности и взаимодействует с каждым её атомом, словно ощупывая его. Информация обрабатывается компьютером и создаётся достоверное изображение.
С помощью зондовых микроскопов можно рассмотреть не только отдельные атомы, но даже форму электронных облаков. Первым человеком, увидевшим атомы, стал создатель электронного микроскопа Эрвин Мюллер, это произошло в середине прошлого столетия.
Как были обнаружены первые атомы во Вселенной
Время на прочтение
7 мин
Количество просмотров 19K
Мы не знаем, как появляется звезда, но хотим узнать, как появляются 10 миллиардов звёзд
— Карлос Френк
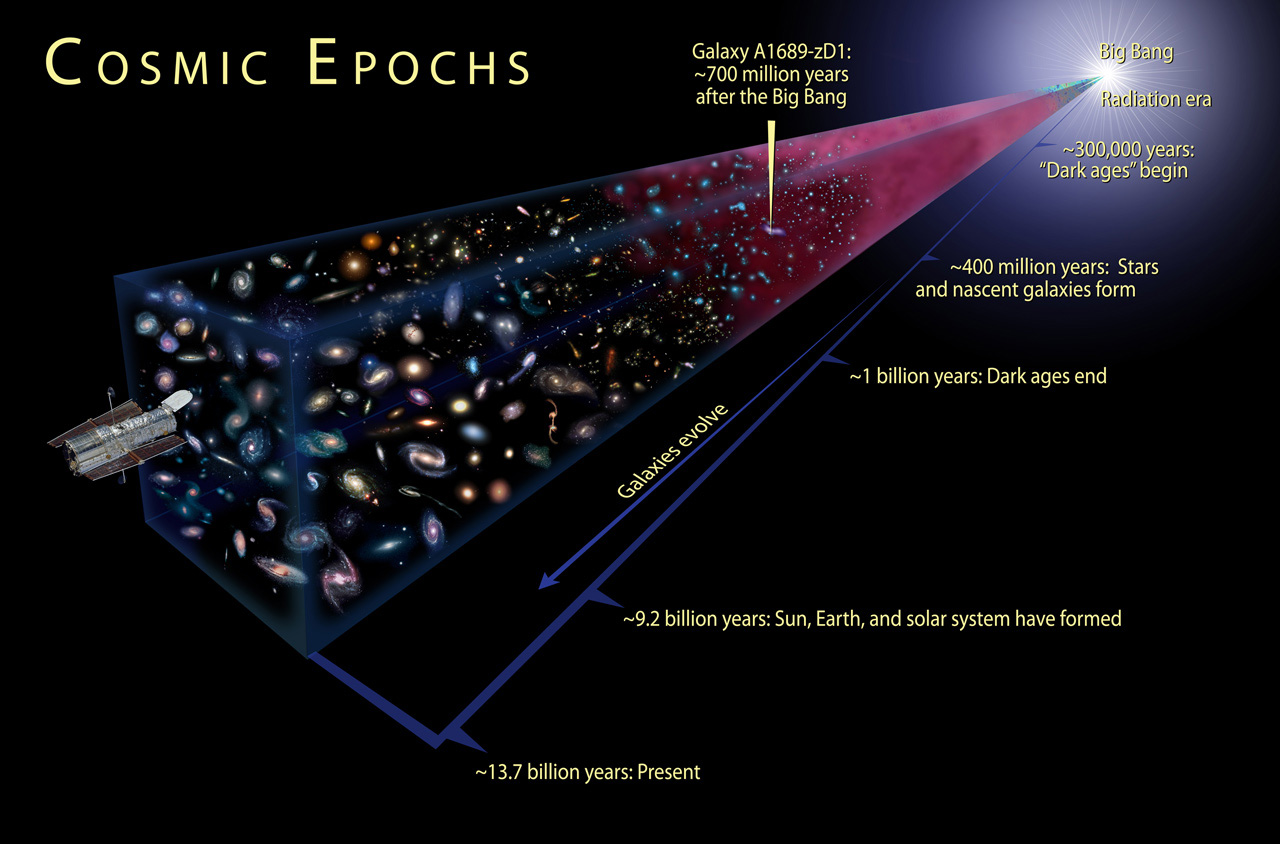
Заглядывая в удалённые части Вселенной, мы смотрим в её прошлое. Чем дальше объект, тем дольше его свет шёл до наших глаз. И каждый раз, когда нам удаётся заглянуть дальше, чем получалось раньше, мы заглядываем в более глубокое прошлое – всё ближе к Большому взрыву.
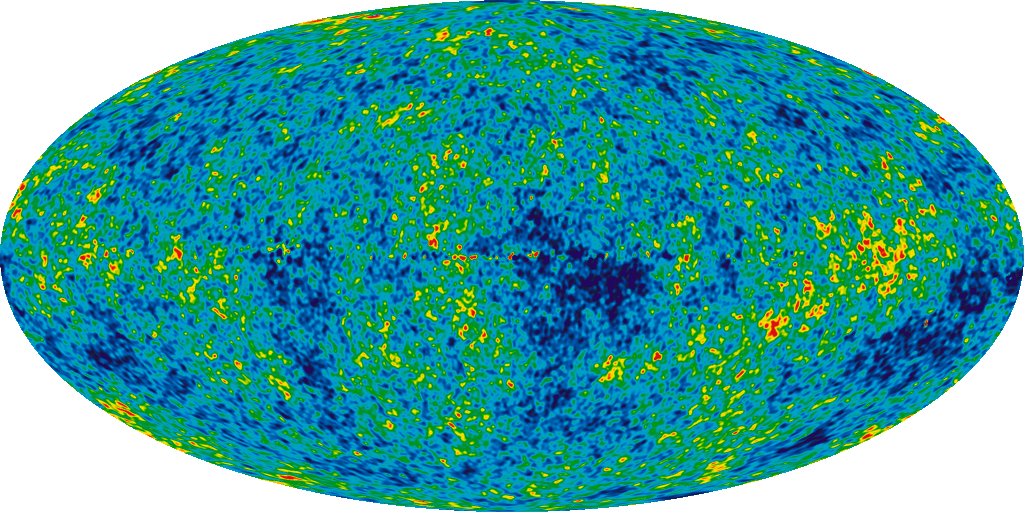
Самое раннее из увиденного нами – это, конечно, реликтовое излучение, остаточное свечение от Большого взрыва. Когда мы наблюдаем это фоновое излучение, испущенное в то время, когда Вселенная окончательно остыла до температур, позволяющих формироваться атомам, мы получаем снимок Вселенной в возрасте 380 000 лет!
Но существует теоретическое предсказание, касающееся Большого взрыва, происходящее из даже более ранних времён. Это, возможно, самое раннее из всех предсказаний, которое можно проверить! Большой взрыв не только говорит о том, когда атомы должны были сформироваться впервые, но и о том, какие это должны были быть атомы.
Каким же это образом? Перенесёмся к самым ранним этапам, о которых мы можем рассуждать, и на которых мы ещё на 100% уверены в правильности физики.
Вспомните, что Вселенная расширяется и охлаждается, что означает, что она была горячее и плотнее в прошлом! Конечно, когда Вселенной было меньше 380 000 лет, она была слишком горячей для нейтральных атомов, но что, если мы пойдём ещё дальше?
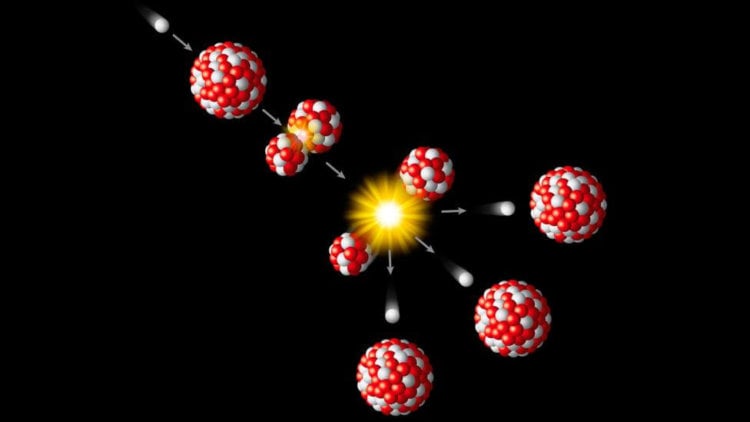
В какой-то момент она была слишком горячей и плотной даже для ядер, а ещё раньше – слишком энергичной для существования протонов и нейтронов! Когда возраст Вселенной не превышал малой доли секунды, у нас было лишь море кварков, глюонов, лептонов, антилептонов и сверхгорячего излучения, и всё это плавало в первичном супе ранней Вселенной!
В таком состоянии всё сталкивается чрезвычайно быстро и находится в тепловом равновесии. Создание и аннигиляция пар частиц/античастиц происходит очень быстро. Однако, почти все частицы нестабильны. С расширением и охлаждением Вселенной тяжёлые лептоны и кварки распадаются, лишняя материя и антиматерия встречаются и аннигилируют, и оставшиеся кварки (верхние и нижние в примерно равных количествах) остывают достаточно для того, чтобы сконденсироваться в отдельные протоны и нейтроны. К тому времени, когда возраст Вселенной достигает 10 микросекунд, протонов и нейтронов оказывается примерно равное количество.
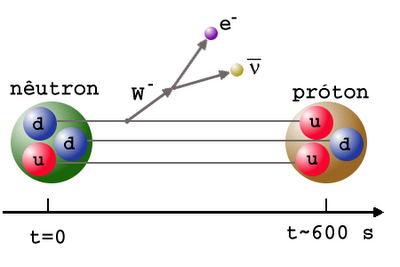
Однако Вселенная также наполнена электронами и антиэлектронами, более известными, как позитроны. Каждый раз, когда протон сталкивается с достаточно энергичным электроном, рождается нейтрон (и нейтрино), а каждый раз, когда нейтрон сталкивается с достаточно энергичным позитроном, рождается протон (и антинейтрино). Изначально эти реакции идут примерно с одной скоростью, и мы получаем Вселенную с нормальной материей, на 50% состоящей из протонов и на 50% из нейтронов.
Но из-за того, что протоны легче нейтронов, становится более выгодно энергетически увеличить число протонов и уменьшить число нейтронов. К тому времени, когда возраст Вселенной составляет 3 секунды и все превращения практически остановились, во Вселенной уже 85% протонов и 15% нейтронов. И в это время она всё ещё достаточно горячая и плотная для того, чтобы протоны и нейтроны попытались запустить ядерный синтез дейтерия, первого тяжёлого изотопа водорода!
Но во Вселенной больше миллиарда фотонов на каждый протон или нейтрон, и температура пока ещё слишком высока для того, чтобы полученный дейтерий не был сразу же уничтожен. Так что мы ждём, ждём, и ждём, пока Вселенная не охладится до того, чтобы создавать дейтерий и не разбивать его сразу же. А пока что неприятность состоит в том, что нейтрон нестабилен, и некоторые нейтроны распадаются на протоны, электроны и антинейтрино.
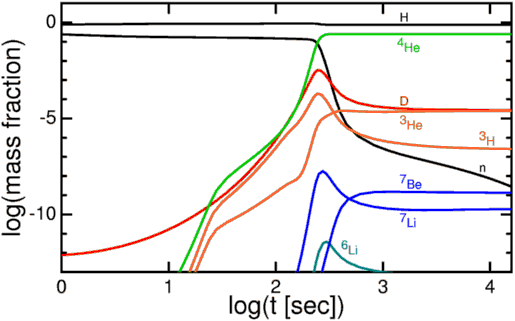
Наконец, между 3 и 4 минутой существования Вселенной, фотоны охлаждаются достаточно для того, чтобы не разбивать дейтерий быстрее, чем его могут создавать протоны и нейтроны. Вселенная проходит через узкое место, связанное с дейтерием. В этот момент, благодаря распадам, во Вселенной есть 88% протонов и 12% нейтронов.
Когда у Вселенной начинает получаться дейтерий, она без промедления добавляет к нему протоны и/или нейтроны, взбираясь по лестнице элементов до трития или гелия-3, а после этого – до крайне стабильного гелия-4!
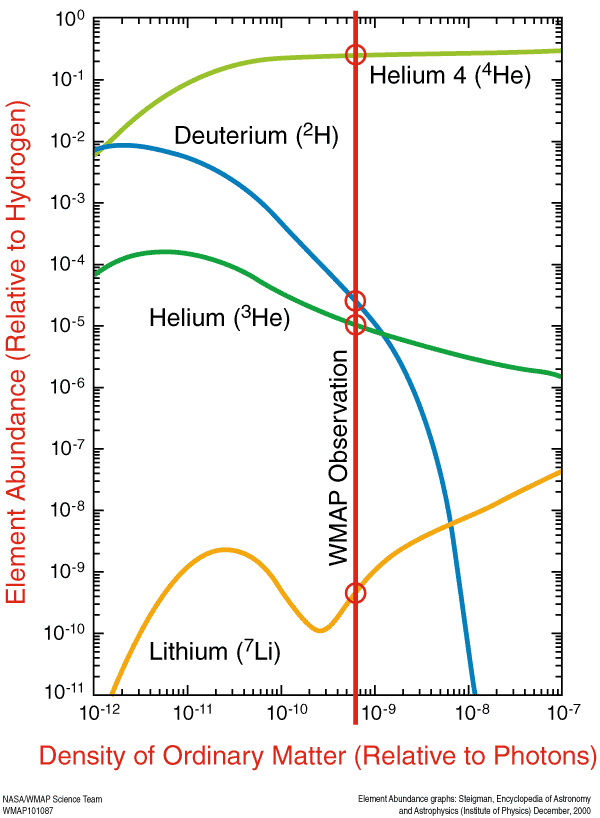
Почти все нейтроны оказались в атомах гелия-4, составляющего 24% от всех атомов по массе после этого нуклеосинтеза. Ядра водорода – просто отдельные протоны – составляли оставшиеся 76%. Также существовала малая доля (от 0,001% до 0,01%) гелия-3, трития (распадающегося до гелия-3) и дейтерия, и ещё меньшая доля разных форм лития и бериллия, появившихся в результате нуклеосинтеза с ядром гелия-4.
Но из-за комбинации факторов – недостатка стабильных ядер массой 5 или 8, сравнительно низкой температуры и плотности Вселенной к этому времени, и сильного электрического отталкивания тяжёлых изотопов – не сформировалось ничего более тяжёлого.
И вот такие элементы были предсказаны теорией Большого взрыва. С нашими знаниями о реликтовом излучении мы можем определить – с невероятной точностью – сколько конкретно гелия-4, гелия-3, дейтерия и лития-7 должно быть в наши дни. Это предсказание – изначальное изобилие лёгких элементов – одно из величайших предсказаний, появившихся из модели Большого взрыва.
После этого Вселенная просто расширяется и охлаждается, а нестабильные изотопы (типа трития) распадаются на стабильные, пока эти атомные ядра – созданные в ядерной топке Большого взрыва – не поймают электроны и не превратятся в нейтральные атомы.
Конечно, увидеть эти атомы и измерить их изобилие – особо трудная задача. Почему? Давайте посмотрим на то, что можно увидеть, если заглянуть в раннюю Вселенную.
Мы хотим увидеть самые первые атомы: те, что существовали в тёмные времена космоса. Но это чрезвычайно трудно.
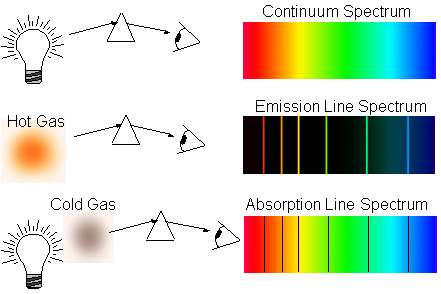
Мы определяем наличие элементов во Вселенной из их атомных переходов. Они либо демонстрируют линии испускания, если атомы достаточно горячие, и их возбуждённые электроны перемещаются на более низкое энергетическое состояние, либо линии поглощения, если атомы находятся в холодном состоянии с малой энергией, но за ними есть горячий источник, фотоны которого на нужном уровне энергии поглощаются атомами.
Проблема, конечно же, в том, что эти атомы «тёмных веков» сами по себе слишком холодны, чтобы выдавать линии испускания, а излучение, находящееся за ними, слишком маломощное, чтобы вызывать линии поглощения! Поэтому нам приходится ждать, пока гравитация не сделает своё дело и не притянет достаточное их количество в одно место, чтобы мы могли использовать что-то достаточно энергичное для того, чтобы вызывать у них линии поглощения!
После достаточно сильного гравитационного коллапса Вселенная местами становится достаточно плотной для того, чтобы впервые сформировать звёзды! Регионы, быстрее других становящиеся плотными, формируют звёзды первыми – через 50-150 млн лет после Большого взрыва – а другие регионы остаются нейтральными, свободными от звёзд и нетронутыми.
Первая проблема в том, что когда эти первые звёзды создаются, свет от них блокируется нейтральными атомами, точно так же, как звёздный свет блокируется плотным облаком межзвёздного газа.
Поэтому нам нужно, если мы хотим увидеть свет этих звёзд (или любого источника света), избавиться от этих нейтральных атомов. Для этого необходимо сформировать во Вселенной достаточно звёзд для того, чтобы реионизировать большую часть (99%+) нейтральных атомов. К счастью, Вселенная делает это самостоятельно, и меньше чем за миллиард лет.
Другая проблема в том, что когда происходит гравитационный коллапс, и появляются первые звёзды, они не только засоряют Вселенную создаваемыми ими тяжёлыми элементами, но и уничтожают эти скудные лёгкие элементы – дейтерий, литий, гелий-3 – которые мы хотим измерить!
Так что вы можете подумать, что здесь работает уловка-22. Как мы можем измерить эти первые, нетронутые атомы, если мы можем измерить их только через миллиард лет, когда всё происходящее загрязнит атомы Вселенной?
Но надежда есть.
Во Вселенной существуют – хотя их и трудно найти – изолированные галактики ультрамалой массы, такие, как карликовая галактика Насос (из созвездия Насос), изображённая выше.
Теоретически, чрезвычайно изолированные куски материи, чья масса составляет примерно 0,0001% от массы нашей Галактики Млечный путь, могли выжить, не сформировав вообще никаких звёзд, и не загрязниться находившейся рядом с ними постзвёздной массой, в течение более миллиарда лет. Но чтобы найти такой кусок, нам должно было очень повезти.
Ну что же, нам повезло именно так, как мы надеялись.
Самые яркие и светлые объекты, видимые на дальних окраинах Вселенной, это квазары, большая часть которых видима на самом последнем этапе реионизации – когда материя становится прозрачной для света – во Вселенной. Счастливый случай позволил, после 58 лет спектроскопического исследования квазаров, указанной команде Фумагали, Омеара и Прочаска обнаружить два облака нетронутого, незагрязнённого газа, сохранившихся с Большого взрыва, в спектрах из квазаров!
На верхней части изображения, взятого из работы Фумагали и других, изображён спектр квазара. Провал на зигзагообразном графике – это признак линии поглощения! В данном случае, линии поглощения показывают характеристики облака нейтрального водородного газа с красным смещением немногим больше 3, то есть, по времени где-то через 2 млрд лет после Большого взрыва (и примерно через 1 млрд лет после того, как первый свет покинул этот квазар). Однако обычно присутствующих признаков жизнедеятельности предыдущих звёзд – таких «загрязняющих» элементов, как углерод, кислород, кремний, и т.п. – не просто мало, а очень мало, меньше 0,01% от количества, содержащегося в нашем Солнце. Это если учесть что следующее по «чистоте» облако, обнаруженное нами во Вселенной содержит уже больше 0,1% от количества тяжёлых элементов, находящихся в Солнце.
Так что, это не только наименее загрязнённый и наиболее нетронутый набор из найденных нами атомов, это также наилучший из всех тестов того, что изобилие легких элементов – судя по силе их спектральных линий поглощения – совпадает с предсказаниями теории Большого взрыва!
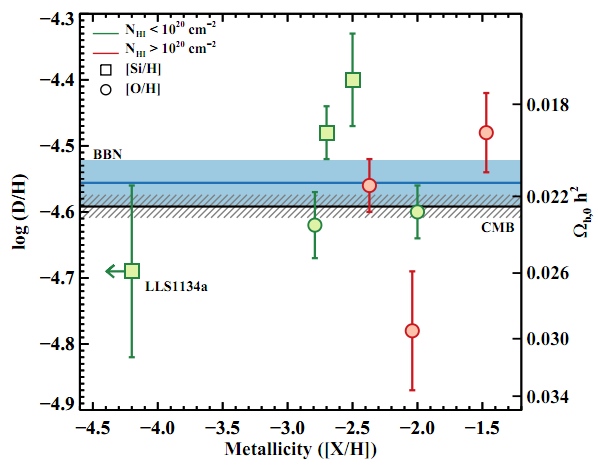
Каковы же результаты? Взгляните на самую нетронутую, самую левую точку на графике; это самые достоверные данные, когда-либо полученные нами по этой теме!
В работе написано:
На линии видимости квазаров, измеренный log(D/H) = −4.55 ± 0.03 пересчитывается в Ωb,0h2(BBN) = 0.0213 ± 0.0010, что полностью совпадает с количеством, следующим из спектра мощности реликтового излучения, Ωb,0h2 (CMB) = 0.02249 ± 0.00057. Это прекрасное совпадение между двумя независимыми экспериментами отмечает триумф теории Большого взрыва.
А что лучше всего – если мы захотим лучше измерить элементы, найденные в этих облаках газа, нам нужно просто изучать их чуть больше времени! Да, нам может повезти и мы можем найти ещё больше этих нетронутых газовых облаков (эмпирическое правило гласит, что один случай – случайность, а два – уже возможная закономерность), но даже если мы их не найдём, нам нужно просто дольше и внимательнее смотреть на эти квазары, и мы сможем ещё лучше уточнить количество элементов, находящихся в них!
Вот так мы и обнаружили самые первые атомы Вселенной, и то, как они доказали правильность ещё одного предсказания теории Большого взрыва.
Горы, звезды, люди — все, что мы видим вокруг, состоит из крошечных атомов. Атомы маленькие. Очень и очень. С детства мы знаем, что все вещество состоит из скоплений этих крошечных штучек. Также мы знаем, что их нельзя увидеть невооруженным глазом. Мы вынуждены слепо верить этим заявлениям, не имея возможности проверить. Атомы взаимодействуют друг с другом и по кирпичикам составляют наш мир. Откуда мы это знаем? Многие не любят принимать утверждения ученых за чистую монету. Давайте вместе с наукой пройдем путь от осознания атомов до непосредственного доказательства их существования.
Может показаться, что есть простой способ доказать существование атомов: засунуть их под микроскоп. Но этот подход не сработает. Даже самые мощные микроскопы, фокусирующие свет, не могут визуализировать один атом. Объект становится видимым, поскольку отражает световые волны. Атомы настолько меньше длины волны видимого света, что они вовсе не взаимодействуют. Иными словами, атомы невидимы даже для света. Однако атомы все же оказывают наблюдаемые эффекты на некоторые вещи, которые мы можем увидеть.
Сотни лет назад, в 1785 году, голландский ученый Ян Ингенхауж изучал странное явление, которое не мог понять. Мельчайшие частицы угольной пыли шныряли на поверхности какого-то спирта в его лаборатории.
50 лет спустя, в 1827 году, шотландский ботаник Роберт Броун описал нечто удивительно похожее. Изучая пыльцевые гранулы под микроскопом, Броун обнаружил, что некоторые гранулы испускают крошечные частицы — которые затем удалялись от пыльцы в случайном нервном танце.
Сначала Броун подумал, что частицы были каким-то неизвестным организмом. Он повторил эксперимент с другими субстанциями, вроде каменной пыли, которая явно была неживой, и снова увидел странное движение.
Все самые свежие новости из мира высоких технологий вы также можете найти в Google News.
Потребовалось почти сто лет, чтобы наука нашла объяснение. Пришел Эйнштейн и разработал математическую формулу, которая предсказывала тот самый особенный тип движения — тогда названный броуновским движением, в честь Роберта Броуна. Теория Эйнштейна заключалась в том, что частицы пыльцевых гранул постоянно перемещались, поскольку в них врезались миллионы крошечных молекул воды — молекул, состоящих из атомов.
«Он объяснил, что это нервное движение, которое вы наблюдаете, на самом деле вызывалось воздействием отдельных молекул воды на частички пыли или что там у вас есть», — объясняет Гарри Клифф из Кембриджского университета, также куратор Музея науки в Лондоне.
К 1908 году наблюдения, подкрепленные расчетами, показали, что атомы реальны. За десять лет физики существенно продвинулись вперед. Растягивая отдельные атомы, они начали понимать их внутреннюю структуру.
Сюрпризом стало то, что атомы можно разделить — особенно в свете того, что само название «атом» вышло из греческого «атомос», означающего «неделимый». Но физики теперь знают, что атомы далеко не базовые кирпичи. Они состоят из трех основных частей: протонов, нейтронов и электронов. Представьте, что протоны и нейтроны вместе образуют «солнце», или ядро, в центре системы. Электроны находятся на орбите этого ядра, подобно планетам.
Если атомы невообразимо малы, то эти субатомные частицы и вовсе. Забавно, но первой обнаружили самую малую частицу из трех — электрон. Чтобы понять разницу размеров, имейте в виду, что протоны в ядре в 1830 раз больше электрона. Представьте себе чупа-чупс на орбите воздушного шара — несоответствие будет примерно таким.
Но как мы узнали, что эти частицы там? Ответ в том, что они хоть и маленькие, но имеют большое влияние. Британский физик Томсон, открывший электроны, использовал прекрасный метод, чтобы доказать их существование в 1897 году.
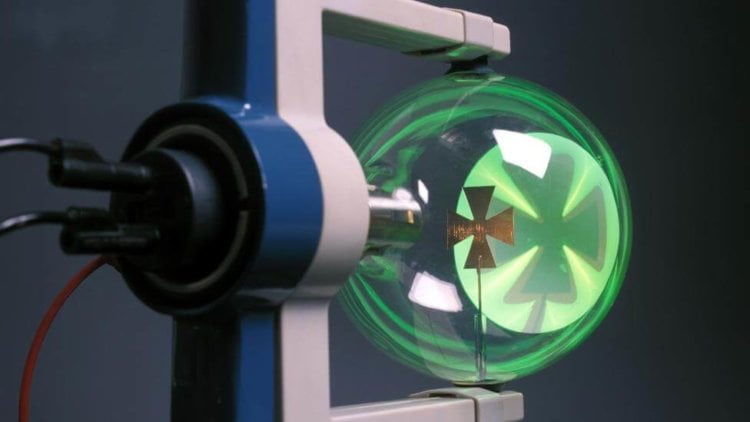
У него была трубка Крукса — кусок стекла смешной формы, из которого машиной был высосан почти весь воздух. К одному концу трубки подводили отрицательный электрический заряд. Этого заряда было достаточно, чтобы выбить у молекул оставшегося в трубке газа часть электронов. Электроны заряжены отрицательно, поэтому летели к другому концу трубки. Благодаря частичному вакууму, электроны пролетали через трубку, не встречая на своем пути крупные атомы.
Электрический заряд приводил к тому, что электроны двигались очень быстро — порядка 59 500 километров в секунду — пока не врезались в стекло на дальнем конце, выбивая еще больше электронов, которые прятались в его атомах. Удивительно, но столкновение между этими умопомрачительно крошечными частицами производило столько энергии, что порождало фантастическое зелено-желтое свечение.
«Это был в некотором смысле один из первых ускорителей частиц, — говорит Клифф. — Он ускоряет электроны на одном конце трубки к другому, и они врезаются в экран на другом конце, производя фосфоресцирующее свечение».
Поскольку Томсон обнаружил, что может управлять пучками электронов с помощью магнитов и электрических полей, он знал, что это были не просто странные лучи света, — это были заряженные частицы.
Заходите в наш специальный Telegram-чат. Там всегда есть с кем обсудить новости из мира высоких технологий.
И если вам интересно, как эти электроны могут летать независимо от своих атомов, то это благодаря процессу ионизации, в котором — в данном случае — электрический заряд меняет структуру атома, выбивая электроны в пространство поблизости.
В частности, благодаря тому что электронами так просто манипулировать и двигать, стали возможны электрические схемы. Электроны в медном проводе движутся подобно поезду от одного атома меди к другому — потому-то провод передается по проводу. Атомы, как мы уже сказали, это не цельные кусочки вещества, а системы, которые можно модифицировать или разобрать на структурные элементы.
Открытие электрона показало, что нужно узнать об атомах побольше. Работа Томсона показала, что электроны отрицательно заряжены — но он знал, что атомы сами по себе не имеют общего заряда. Он предположил, что они должны содержать загадочные положительно заряженные частицы, чтобы компенсировать отрицательно заряженные электроны.
Эксперименты начала 20 века выявили эти положительно заряженные частицы и в то же время раскрыли внутреннюю структуру атома — похожую на солнечную систему.
Эрнест Резерфорд и его коллеги взяли очень тонкую металлическую фольгу и поставили ее под луч положительно заряженного излучения — поток крошечных частиц. Большая часть мощного излучения прошла насквозь, как и полагал Резерфорд, учитывая толщину фольги. Но, к удивлению ученых, часть его отскочила.
Резерфорд предположил, что атомы в металлической фольге должны содержать небольшие плотные области с положительным зарядом — ничто иное не обладало бы достаточным потенциалом, чтобы отразить такое мощное излучение. Он обнаружил положительные заряды в атоме — и одновременное доказал, что все они связаны в плотной массе, в отличие от электронов. Другими словами, он продемонстрировал существование плотного ядра в атоме.
Оставалась проблема. К тому моменту уже могли рассчитать массу атома. Но учитывая данные о том, какими тяжелыми должны были быть частицы ядра, идея того, что все они положительно заряжены, не имела смысла.
«Углерод имеет шесть электронов и шесть протонов в ядре — шесть положительных зарядов и шесть отрицательных зарядов, — объясняет Клифф. — Но ядро углерода не весит шесть протонов, оно весит эквиваленту 12 протонов».
Сначала предположили, что в ядре есть шесть других ядерных частиц с массой протона, но заряженных отрицательно: нейтроны. Но никто не смог это доказать. На самом деле, нейтроны не могли найти до 1930-х годов.
Кембриджский физик Джеймс Чедвик отчаянно пытался открыть нейтрон. Он работал над этой теорией много лет. В 1932 году ему удалось осуществить прорыв.
За несколько лет до этого другие физики экспериментировали с радиацией. Они запускали положительно заряженное излучение — того типа, который использовал Резерфорд в поисках ядра — в атомы бериллия. Бериллий испускал собственную радиацию: излучение, которое не было заряжено положительно или отрицательно и могло проникать глубоко в материал.
К этому времени другие выяснили, что гамма-излучение было нейтральным и проникало глубоко, поэтому физики считали, что именно его испускают атомы бериллия. Но Чедвик так не считал.
Он самостоятельно произвел новое излучения и направил его на вещество, которое, как он знал, было богатым на протоны. Неожиданно оказалось, что протоны были выбиты из материала словно бы частицами с идентичной массой — будто шарики для бильярда другими шариками.
Гамма-излучение не может отражать протоны таким образом, поэтому Чедвик решил, что искомые частицы должны иметь массу протона, но другой электрический заряд: и это нейтроны.
Все основные частицы атома были найдены, но на этом история не заканчивается.
Хотя мы узнали об атомах много больше, чем знали раньше, их было трудно визуализировать. В 1930-х годах никто не располагал их снимками — и многие люди хотели их увидеть, чтобы принять их существование.
Важно отметить, впрочем, что методы, используемые учеными вроде Томсона, Резерфорда и Чедвика, проложили путь к новому оборудованию, которое в конце концов помогло нам произвести эти снимки. Пучки электронов, которые Томсон генерировал в своем эксперименте с трубкой Крукса, оказались особенно полезными.
Сегодня подобные пучки генерируются электронными микроскопами, и самый мощный из таких микроскопов может на самом деле делать снимки отдельных атомов. Это потому, что электронный пучок обладает длиной волны в тысячи раз короче пучка света — настолько короткой, по сути, что волны электронов могут отражаться от крошечных атомов и выдавать картинку, чего не могут световые пучки.
Подписывайтесь на наш канал в Яндекс Дзен. Там можно найти много всего интересного, чего нет даже на нашем сайте.
Нил Скиппер из Университетского колледжа в Лондоне говорит, что такие изображения полезны для людей, которые хотят изучать атомную структуру специальных веществ — вроде тех, что используются в производстве батарей для электромобилей, к примеру. Чем больше мы знаем об их атомной структуре, тем лучше нам удается проектировать батареи, делать их эффективными и надежными.
Можно также понять, как выглядят атомы, просто тыкнув в них. Так, по сути, работает атомно-силовая микроскопия.
Идея в том, чтобы поднести кончик чрезвычайно малого зонда к поверхности молекулы или вещества. При достаточной близости зонд будет чувствителен к химической структуре того, на что указывает, и изменение сопротивления по мере движения зонда позволит ученым произвести снимки, к примеру, отдельной молекулы.
Недавно ученые опубликовали прекрасные снимки молекулы до и после химической реакции с помощью этого метода.
Скиппер добавляет, что многие атомные ученые исследуют, как структура вещей меняется при воздействии высокого давления или температуры. Большинство людей знает, что когда вещество нагревается, оно часто расширяется. Теперь можно обнаружить атомные изменения, которые происходят при этом, что зачастую оказывается полезным.
«При нагревании жидкости можно заметить, как ее атомы принимают неупорядоченную конфигурацию, — говорит Скиппер. — Вы можете увидеть это непосредственно из структурной карты».
Скиппер и другие физики также могут работать с атомами, используя нейтронные пучки, впервые обнаруженые Чедвиком в 1930-х.
«Мы запускаем много пучков нейтронов в образцы материалов, и из возникающего паттерна рассеяния можно понять, что вы рассеиваете нейтроны в ядрах, — говорит он. — Можно грубо прикинуть массу и размер объекта, который просвечивался».
Но атомы не всегда просто находятся там, в стабильном состоянии, ожидая, пока их изучат. Иногда они распадаются — то есть являются радиоактивными.
Существует множество естественных радиоактивных элементов. Этот процесс генерирует энергию, которая легла в основу ядерной энергетики — и ядерных бомб. Физики-ядерщики, как правило, пытаются лучше понять реакции, при которых ядро проходит через фундаментальные изменения вроде этих.
Лаура Харкнесс-Бреннан из Ливерпульского университета специализируется на изучении гамма-лучей — типа излучения, испускаемого распадающимися атомами. Радиоактивный атом определенного типа испускает особую форму гамма-луча. Это значит, вы можете идентифицировать атомы, только регистрируя энергию гамма-лучей — этим, собственно, Харкнесс-Бреннан и занимается в своей лаборатории.
«Типы детекторов, которые вы должны использовать, представлены детекторами, которые позволят вам измерять одновременно присутствие излучения и энергии радиации, которая была отложена, — говорит она. — Все потому, что у всех ядер есть особый отпечаток».
Поскольку в области, где была обнаружена радиация, могут присутствовать все типы атомов, особенно после крупной ядерной реакции, важно точно знать, какие радиоактивные изотопы присутствуют. Такое обнаружение обычно проводится на ядерных станциях или в зонах, где произошла ядерная катастрофа.
Заходите в наш специальный Telegram-чат. Там всегда есть с кем обсудить новости из мира высоких технологий.
Харкнесс-Бреннан и ее коллеги сейчас работают над системами обнаружения, которые можно разместить в таких местах, чтобы показать в трех измерениях, где может присутствовать радиация в конкретном помещении. «Вам нужны техники и инструменты, которые позволят составить трехмерную карту пространства и подскажут, где в этой комнате, в этой трубе радиация», — говорит она.
Также можно визуализировать излучение в «камере Вильсона». В рамках этого специального эксперимента охлажденный до -40 градусов по Цельсию спиртовый пар распыляется облаком над радиоактивным источником. Заряженные частицы радиации, летящие от источника излучения, выбивают электроны из молекул спирта. Спирт конденсируется в жидкость рядом с дорожкой излучаемых частиц. Результаты такого типа обнаружения впечатляют.
Мы мало работали непосредственно с атомами — разве что поняли, что это прекрасные сложные структуры, которые могут претерпевать удивительные изменения, многие из которых происходят в природе. Изучая атомы таким образом, мы улучшаем собственные технологии, извлекаем энергию из ядерных реакций и лучше понимаем природный мир вокруг нас. Мы также получили возможность защищать себя от радиации и изучать, как меняются вещества в экстремальных условиях.
«Учитывая, насколько мал атом, просто невероятно, как много физики мы можем извлечь из него», — метко подмечает Харкнесс-Бреннан. Все, что мы видим вокруг себя, состоит из этих мельчайших частиц. И хорошо знать, что они там есть, поскольку именно благодаря им все вокруг стало возможным.
По материалам BBC