Ацетилен, получение, свойства, химические реакции.
Ацетилен, C2H2 – органическое вещество класса алкинов, непредельный углеводород.
Ацетилен, формула, газ, характеристики
Физические свойства ацетилена
Химические свойства ацетилена
Получение ацетилена в промышленности и лаборатории
Химические реакции – уравнения получения ацетилена
Применение и использование ацетилена
Взрывоопасность ацетилена и безопасность при обращении с ним
Ацетилен, формула, газ, характеристики:
Ацетилен (также – этин) – органическое вещество класса алкинов, непредельный углеводород, состоящий из двух атомов углерода и двух атомов водорода.
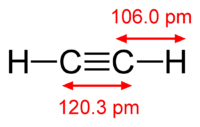
Химическая формула ацетилена C2H2. Структурная формула ацетилена СH≡CH. Изомеров не имеет.
Строение молекулы ацетилена:
Ацетилен имеет тройную связь между атомами углерода.
Ацетилен – бесцветный газ, без вкуса и запаха. Однако технический ацетилен содержит примеси – фосфористый водород, сероводород и пр., которые придают ему резкий запах.
Легче воздуха. Плотность по сравнению с плотностью воздуха 0,9.
Очень горючий газ. Пожаро- и взрывоопасен.
Ацетилен относится к числу немногих соединений, горение и взрыв которых возможны в отсутствии кислорода или других окислителей.
Смеси ацетилена с воздухом взрывоопасны в очень широком диапазоне концентраций. Взрывоопасность уменьшается при разбавлении ацетилена другими газами, например азотом, метаном или пропаном.
Ацетилен требует большой осторожности при обращении. Может взрываться от удара, при нагреве до 500 °C или при сжатии выше 0,2 МПа при комнатной температуре. Струя ацетилена, выпущенная на открытый воздух, может загореться от малейшей искры, в том числе от разряда статического электричества с пальца руки. Для хранения ацетилена используются специальные баллоны, заполненные пористым материалом, пропитанным ацетоном. В них ацетилен хранится в виде раствора с ацетоном.
Малорастворим в воде. Очень хорошо растворяется в ацетоне. Хорошо растворяется в других органических веществах (бензине, бензоле и пр.)
Ацетилен обладает незначительным токсическим действием.
Физические свойства ацетилена:
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | без запаха |
| Вкус | без вкуса |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность (при 20 °C и атмосферном давлении 1 атм.), кг/м3 | 1,0896 |
| Плотность (при 0 °C и атмосферном давлении 1 атм.), кг/м3 | 1,173 |
| Температура плавления, °C | -80,8 |
| Температура кипения, °C | -80,55 |
| Тройная точка, °C | 335 |
| Температура самовоспламенения, °C | 335 |
| Давление самовоспламенения, МПа | 0,14-0,16 |
| Критическая температура*, °C | 35,94 |
| Критическое давление, МПа | 6,26 |
| Взрывоопасные концентрации смеси газа с воздухом, % объёмных | от 2,1 до 100 |
| Удельная теплота сгорания, МДж/кг | 56,9 |
| Температура пламени, °C | 3150-3200 |
| Молярная масса, г/моль | 26,038 |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
Химические свойства ацетилена:
Химические свойства ацетилена аналогичны свойствам других представителей ряда алкинов. Поэтому для него характерны следующие химические реакции:
- 1. галогенирование ацетилена:
СH≡CH + Br2 → CHBr=CHBr (1,2-дибромэтен);
CHBr=CHBr + Br2 → CHBr2-CHBr2 (1,1,2,2-тетрабромэтан).
Реакция протекает стадийно с образованием производных алканов.
В ходе данной реакции ацетилен обесцвечивает бромную воду.
- 2. гидрогалогенирование ацетилена:
СH≡CH + HBr → CH2=CHBr (бромэтен).
- 3. гидратация ацетилена (реакция Михаила Григорьевича Кучерова, 1881 г.):
CH≡CH + H2O → [CH2=CH-OH] (енол) → CH3-CH=O (уксусный альдегид ) (kat = HgSO4, Hg(NO3)2).
- 4. тримеризация ацетилена (реакция Николая Дмитриевича Зелинского, 1927 г.):
3СH≡CH → C6H6 (бензол) (kat = активированный уголь, to = 450-500 оС).
Реакция тримеризации ацетилена является частным случаем реакции полимеризации ацетилена и происходит при пропускании ацетилена над активированным углем при температуре 450-500 оС.
- 5. димеризация ацетилена:
СH≡CH + СH≡CH → CH2=CH-С≡CH (винилацетилен) (kat = водный раствор CuCl и NH4Cl).
Реакция димеризации ацетилена является частным случаем реакции полимеризации ацетилена.
- 6. горение ацетилена:
2СH≡CH + 5О2 → 4CО2 + 2H2О.
Ацетилен горит белым ярким пламенем.
- 7. окисление ацетилена.
Протекание реакции и её продукты определяются средой, в которой она протекает.
- 8. восстановления ацетилена:
СH≡CH + Н2 → C2H4 (этилен) (kat = Ni, Pd или Pt, повышенная to);
СH≡CH + 2Н2 → C2H6 (этан) (kat = Ni, Pd или Pt, повышенная to).
Получение ацетилена в промышленности и лаборатории. Химические реакции – уравнения получения ацетилена:
Ацетилен в лабораторных условиях получается в результате следующих химических реакций:
- 1. действия воды на карбид кальция:
CаС2 + H2О → Cа(ОH)2 + C2H2.
- 2. дегидрирования метана:
2CH4 → C2H2 + 3H2 (при to > 1500 оС).
- 3. дегидрирования этилена:
CH2=CH2→ СH≡CH +H2 (kat = Pt, Ni, Al2O3, Cr2O3, to = 400-600 °C).
Ацетилен в промышленности получают следующими способами и методами:
- 4. карбидным методом:
Сначала получают известь из карбоната кальция.
CаСО3 → CаО + CO2. (to = 900-1200 оС).
Затем получают карбид кальция, сплавляя оксид кальция и кокс в электропечах при температуре 2500-3000 °С.
CаО + 3С → CаС2 + CO. (to = 2500-3000 оС).
Далее карбид кальция обрабатывают водой по известной реакции.
CаС2 + H2О → Cа(ОH)2 + C2H2.
В итоге получается ацетилен высокой чистоты – 99,9 %.
- 5. высокотемпературным крекингом метана:
Высокотемпературный крекинг метана осуществляется по известной реакции дегидирования метана в электродуговых печах при температуре 2000-3000 °С и напряжении между электродами 1000 В. Выход ацетилена составляет 50 %.
- 6. различными способами пиролиза метана:
Разновидностью высокотемпературного крекинга метана являются регенеративный пиролиз (Вульф-процесс), окислительный пиролиз (Заксе-процесс или BASF-процесс), гомогенный пиролиз, пиролиз в среде низкотемпературной плазмы.
Так, в ходе регенеративного пиролиза сначала сжигают метан и разогревают насадку печи до 1350-1400 °С. Затем через разогретую насадку на доли секунды пропускают метан, в результате образуется ацетилен.
В ходе окислительного пиролиза метан смешивают с кислородом и сжигают. Образующееся тепло служит для нагрева остатка метана до 1600 °С, который дегидрирует в ацетилен. Выход ацетилена составляет 30-32 %.
В ходе гомогенного пиролиза метан и кислород сжигают в печи при температуре 2000 °С. Затем предварительно нагретый до 600 °С остаток метана пропускают через печь, в результате образуется ацетилен.
При пиролизе в среде низкотемпературной плазмы метан нагревают струей ионизированного газа (аргона или водорода).
Применение и использование ацетилена:
– как сырье в химической промышленности для производства уксусной кислоты, этилового спирта, растворителей, пластических масс, синтетических каучуков, ароматических углеводородов,
– для газовой сварки и резки металлов,
– для получения технического углерода,
– как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды.
Взрывоопасность ацетилена и безопасность при обращении с ним:
Ацетилен обладает взрывоопасными свойствами.
Поэтому обращение с ацетиленом требует строгого соблюдения правил техники безопасности.
Ацетилен горит и взрывается даже в отсутствии кислорода и других окислителей.
Смеси ацетилена с воздухом взрывоопасны в очень широком диапазоне концентраций.
Струя ацетилена, выпущенная на открытый воздух, может загореться от малейшей искры, в том числе от разряда статического электричества с пальца руки.
Взрываемость ацетилена зависит от множества факторов: давления, температуры, чистоты ацетилена, содержания в нем влаги, наличия катализаторов и пр. веществ и ряда других причин.
Температура самовоспламенения ацетилена при нормальном – атмосферном давлении колеблется в пределах 500-600 °C. При повышении давления существенно уменьшается температура самовоспламенения ацетилена. Так, при давлении 2 кгс/см2 (0,2 МПа, 1,935682 атм.) температура самовоспламенения ацетилена равна 630 °C. А при давлении 22 кгс/см2 (2,2 МПа, 21,292502 атм.) температура самовоспламенения ацетилена равна 350 °С.
Присутствие в ацетилене частиц различных веществ увеличивают поверхность его контакта и тем самым снижает температуру самовоспламенения при атмосферном давлении. Например, активированный уголь снижает температуру самовоспламенения ацетилена до 400 °С, гидрат оксида железа (ржавчина) – до 280-300 °С, железная стружка – до 520 °С, латунная стружка – до 500-520 °С, карбид кальция – до 500 °С, оксид алюминия – до 490 °С, медная стружка – 460 °С, оксид железа – 280 °С, оксид меди – до 250 °С.
Взрывоопасность ацетилена уменьшается при разбавлении ацетилена другими газами, например азотом, метаном или пропаном.
При определенных условиях ацетилен реагирует с медью, серебром и ртутью образуя взрывоопасные соединения. Поэтому при изготовлении ацетиленового оборудования (например, вентилей баллонов) запрещается применять сплавы, содержащие более 70 % Cu.
Для хранения и перевозки ацетилена используются специальные стальные баллоны белого цвета (с красной надписью «А»), заполненные инертным пористым материалом (например, древесным углём). При этом ацетилен хранится и перевозится в указанных баллонах в виде раствора ацетилена в ацетоне под давлением 1,5-2,5 МПа.
Примечание: © Фото //www.pexels.com, //pixabay.com
как получить ацетилен реакция ацетилен этен 1 2 вещество кислород водород связь является углекислый газ бромная вода
уравнение реакции масса объем полное сгорание моль молекула смесь превращение горение получение ацетилена
напишите уравнение реакций ацетилен
Коэффициент востребованности
27 760
Содержание
- Ацетилен
- Характеристики и физические свойства ацетилена
- Получение ацетилена
- Химические свойства ацетилена
- Применение ацетилена
- Примеры решения задач
- Получение алкинов
- Получение алкинов
- 1. Дегидрирование алканов
- 2. Пиролиз метана
- 3. Гидролиз карбида кальция
- 4. Дегидрогалогенирование дигалогеналканов
- 5. Алкилирование соединений алкинов с металлами
- Добавить комментарий Отменить ответ
- Ацетилен
- Получение ацетилена
- Электрический крекинг
- Пиролиз окислительный
- Преимущества
- Формула ацетилена
- Химические и физические свойства
- Некоторые химические свойства
- Физические свойства
- Технология и режимы сварки
- Выбор параметров режима
- Виды ацетилена
- Газообразный
- Жидкий
- Реакции ацетилена
- Использование ацетилена
- Стандарты
- Газ в баллоне
Ацетилен
Характеристики и физические свойства ацетилена
Мало растворим в воде и очень хорошо в ацетоне. В виде ацетонового раствора его хранят в стальных баллонах, заполненных каким-нибудь инертным пористым материалом. Смеси ацетилена с воздухом взрывоопасны.
Рис. 1. Строение молекулы ацетилена.
Таблица 1. Физические свойства ацетилена.
Молярная масса, г/моль
Температура плавления, o С
Температура кипения, o С
Получение ацетилена
Выделяют промышленные и лабораторные способы получения ацетилена. Так, в промышленности ацетилен получают путем высокотемпературного крекинга метана:
В лаборатории ацетилен получают гидролизом карбида кальция:
Кроме вышеперечисленных реакций, для получения ацетилена используют реакции дегидрирования алканов и алкенов:
Химические свойства ацетилена
Ацетилен вступает в реакции присоединения, протекающие по нуклеофильному механизму, такие как:
Кроме этого ацетилен способен образовывать соли при взаимодействии с активными металлами (1) и оксидом серебра (2):
2СH≡CH +2Na→2 СH≡C-Na + H2 (1);
Он способен тримеризоваться:
Применение ацетилена
Ацетилен является исходным продуктом для многих важнейших химических производств. Например, из ацетилена получают различные галогенпроизводные, такие как тетрахлорэтан и трихлорэтилен, являющиеся хорошими растворителями, а также винилхлорид, служащий мономером для получения поливинилхлорида. Кроме этого ацетилен используется для получения синтетических каучуков.
Примеры решения задач
| Задание | Эквимолекулярная смесь ацетилена и формальдегида полностью реагирует с 69,6 г Ag2O, растворенного в аммиаке. Определите состав исходной смеси. |
| Решение | Запишем уравнения реакций, указанных в условии задачи: |
Рассчитаем количество вещества оксида серебра (I):
n(Ag2O) = 69,6 / 232 = 0,3 моль.
По уравнению (2) количество вещества формальдегида будет равно 0,1 моль. По условию задачи смесь эквимолекулярна, следовательно, ацетилена тоже будет 0,1 моль.
Найдем массы веществ, составляющих смесь:
M(HC≡CH) = 26 г/моль;
M(H-C(O)H) = 30 г/моль;
m(HC≡CH) = 0,1 × 26 = 2,6 г;
m(H-C(O)H) = 0,1 × 30 = 3 г.
Ответ Масса ацетилена равна 2,6 г, формальдегида – 3 г.
| Задание | При пропускании смеси пропана и ацетилена через склянку с бромной водой масса склянки увеличилась на 1,3 г. При полном сгорании такого же количества исходной смеси углеводородов выделилось 14 л (н.у.) оксида углерода (IV). Определите массовую долю пропана в исходной смеси. |
| Решение | При пропускании смеси пропана и ацетилена через склянку с бромной водой происходит поглощение ацетилена. Запишем уравнение химической реакции, соответствующее этому процессу: |
Таким образом, значение, на которое увеличилась масса склянки (1,3 г) представляет собой массу ацетилена. Найдем количество вещества ацетилена (молярная масса – 26 г/моль):
Запишем уравнение реакции сгоранияацетилена:
Согласно уравнению реакции, в неё вступило 2 моль ацетилена, однако, известно, что 0,05 моль из этого количества поглотилось бромной водой. Т.е. выделилось:
Найдем общее количество оксида углерода (IV):
Запишем уравнение реакции сгорания пропана:
Учитывая, что в реакции сгорания ацетилена выделилось 0,1 моль оксида углерода (IV), количество вещества оксида углерода (IV), выделившееся в ходе сгорания пропана равно:
0,625 — 0,1 = 0,525 моль СО2.
Найдем количество вещества пропана, вступившего в реакцию горения. Согласно уравнению реакции n(CO2) : n(С3Н8) = 3 : 1, т.е.
Вычислим массу пропана (молярная масса 44 г/моль):
Тогда, общая масса смеси углеводородов составит:
Источник
Получение алкинов
Алкины – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна тройная связь между атомами углерода С≡С.
Остановимся на свойствах, способах получения и особенностях строения алкинов.
Получение алкинов
1. Дегидрирование алканов
При дегидрировании алканов, содержащих от двух до трех атомов углерода в молекуле, образуются двойные и тройные связи.
Например, при дегидрировании этана может образоваться этилен или ацетилен:
Пиролиз метана – это промышленный способ получения ацетилена.
Реакцию проводят, очень быстро пропуская метан между электродами (электродуговой способ) — примерно 0,1-0,01 секунды при температуре 1500 о С.
Если процесс проводить дольше, то метан разлагается на углерод и водород:
3. Гидролиз карбида кальция
Лабораторный способ получения ацетилена – водный или кислотный гидролиз карбида кальция CaC2.
В кислой среде образуется ацетилен и соответствующая соль:
Карбид кальция можно получить, нагревая оксид кальция с углеродом:
СаО + 3С (изб) → СаС2 + СО
4. Дегидрогалогенирование дигалогеналканов
Дигалогеналканы, в молекулах которых два атома галогена расположены у одного, либо у соседних атомов углерода, реагируют с избытком спиртового раствора щелочей с образованием алкинов.
Например, 1,2-дихлорпропан реагирует со спиртовым раствором гидроксида натрия
1,1-дихлорпропан реагирует со спиртовым раствором щелочи с образованием пропина.
Ацетилениды, пропиниды и прочие соединения алкинов с металлами реагируют с галогеналканами с образованием гомологов алкинов. При этом происходит удлиннение исходной молекулы алкина.
Например, пропинид натрия реагирует с бромэтаном с образованием пентина-2
Добавить комментарий Отменить ответ
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.
Источник
Ацетилен
Бесцветный газ, слаборастворимый в воде, несколько легче атмосферного воздуха, относящийся к классу алкинов и представляющий собой ненасыщенный углерод называют ацетиленом. В его структуре все атомы имеют между собой тройную связь. Это вещество закипает при температуре — 830 °С. Формула ацетилена говорит о том, что в его состав входят только углерод и водород.
Ацетилен – это опасное вещество, которое при неаккуратном обращении с ним может взорваться. Именно поэтому для хранения этого вещества используют специально оснащенные емкости. Газ при соединении с кислородом горит, и температура может достигать 3150 °С.
Получение ацетилена
Ацетилен можно получить в лабораторных и промышленных условиях. Для получения ацетилена в лаборатории достаточно на карбид кальция (это его формула — СаС2) капнуть небольшое количество воды. после этого начинается бурная реакция выделения ацетилена. Для ее замедления допустимо использовать поваренную соль (формула NaCl).
В промышленных условиях все несколько сложнее. Для производства ацетилена применяют пиролиз метана, а так же пропана, бутана. В последнем случае формула ацетилена будет содержать большое количество примесей.
Карбидный способ производства ацетилена обеспечивает производство чистого газа. Но, такой метод получения продукта должен быть обеспечен большим количеством электроэнергии.
Пиролиз не требует большого количества электричества, все дело в том, что для производства газа, необходимо выполнить нагрев реактора и для этого используют газ, циркулирующий в первом контуре реактора. Но в потоке, который там перемещается, концентрация газа довольно мала.
Выделение ацетилена с чистой формулой во втором случае не самая простая задача и ее решение обходится довольно дорого. Существует несколько способов производства формулы ацетилена в промышленных условиях.
Электрический крекинг
Превращение метана в ацетилен происходит в электродуговой печи, при этом ее нагревают до температуры в 2000-3000 °С. При этом, напряжение на электродах достигает 1 кВ. Метан разогревают до 1600 °С. Для получения одной тонны ацетилена необходимо затратить 13 000 кВт×ч. Это существенный недостаток производства формулы ацетилена.
Технологическая схема крекинга
Пиролиз окислительный
Этот способ основан на перемешивании метана и кислорода. После производства смеси, часть ее отправляют на сжигание и полученное тепло отправляют на нагревание сырья до температуры в 16000 °С. Такой процесс отличается непрерывностью и довольно скромными затратами электрической энергии. На сегодня этот метод чаще всего можно встретить на предприятиях по производству ацетилена.
Технологическая схема процесса окислительного пиролиза
Кроме перечисленных технологий производства формулы ацетилена применяют такие как — гомогенный пиролиз, низкотемпературную плазму. Все они отличаются количеством энергетических затрат и в итоге разными характеристиками получаемого газа и его формулой.
Преимущества
Упоминание о газовой сварке моментально наводит на мысли об ацетилене. Действительно для этого процесса чаще всего применяют этот газ. Он в сочетании с кислородом обеспечивает самую высокую температуру горения пламени. Но в последние годы из-за развития различных видов сварки использование этого вида соединения металлов несколько снизилось. Более того, в некоторых отраслях произошел полный отказ от применения этих технологий. Но для выполнения определенного вида ремонтных работ она до сих пор остается незаменима.
Применение ацетилена позволяет получить следующие преимущества:
- максимальная температура пламени;
- существует возможность генерации ацетилена непосредственно на рабочем месте или приобретения его в специальных емкостях;
- довольно низкая стоимость, в сравнении с другими горючими газами.
Вместе с тем, у ацетилена есть и определенные недостатки, которые ограничивают его использование. Самый главный — это взрывоопасность. При работе с этим газом необходимо строго соблюдать меры безопасности. В частности, работы должны выполняться в хорошо проветриваемом помещении. При нарушении режимов работы возможно появление некоторых дефектов, например, пережогов.
Формула ацетилена
Строение молекулы ацетилена
Ацетилен имеет простую формулу — С2Н2. Относительно дешевый способ его получения путем перемешивания воды и карбида кальция сделал его самым применяемым газом для соединения металлов. Температура с которой горит смесь кислорода и ацетилена вынуждает выделяться твердые частицы углерода.
Ацетилен можно доставить к месту выполнения работ в специальных емкостях (газовых баллонах), а можно получить его непосредственно на рабочем месте используя для этого специально сконструированный реактор. Где происходит смешивание воды и карбида кальция.
Химические и физические свойства
Некоторые химические свойства
Свойства ацетилена во многом определены его формулой. То есть наличием атомов углерода и водорода связанных между собой.
Смешивание ацетилена с водой, при добавлении катализаторов типа солей ртути, приводит к получению уксусного альдегида. Тройная связь атомов, содержащихся в молекуле ацетилена приводит к тому, что при сгорании она выделяет 14 000 ккал/куб. м. В процессе сгорания температура поднимается до 3000 °C.
Этот газ, при соблюдении определенных условий, может превращаться в бензол. Для этого необходимо разогреть его до 4000 °С и добавить графит.
Водород, содержащийся в молекулах показывает кислотные свойства. То есть они довольно легко отрываются от молекулы в виде протонов. Ацетилен в состоянии обесцвечивает воду содержащую бром и раствор «марганцовки».
Молярная масса ацетилена составляет 26,04 г/моль. Плотность ацетилена 1,1 кг/м³.
Физические свойства
В стандартных условиях ацетилен представляет собой бесцветный газ, который практически не растворяется в воде. Он начинает кипеть в -830 °С. При сжимании он начинает разлагаться с выделением большого количества энергии. Поэтому для его хранения применяют стальные баллоны способные хранить газ под высоким давлением.
Этот газ недопустимо выпускать в атмосферу. Его формула может отрицательно сказываться на окружающей среде.
Технология и режимы сварки
Ацетилено — кислородные смеси применяют для соединения деталей из углеродистых и низколегированных сталей. Например, этот метод широко применяют для создания неразъемных соединений трубопроводов. Например, труб диаметром 159 мм с толщиной стенок не более 8 мм. Но существуют и некоторые ограничения, так соединение таким методом сталей марок 12×2M1, 12×2МФСР недопустимо.
Выбор параметров режима
Для приготовления смеси необходимой для соединения металлов используют формулу 1/1,2. При обработке заготовок из легированных сталей сварщик должен отслеживать состояние пламени. В частности, нельзя допускать переизбытка ацетилена.
Расход смеси с формулой кислород/ацетилен составляет 100-130 дм 3 /час на 1 мм толщины. Мощность пламени регулируют с помощью горелки, которые подбирают в зависимости от используемого материала, его характеристик, толщины и пр
Для выполнения сварки при помощи ацетилена применяют сварочную проволоку. Ее марка должна соответствовать марке сталей свариваемых деталей. Диаметр проволоки определяют в зависимости от толщины свариваемого металла.
Для удобства технологов и непосредственно сварщиков существует множество таблиц, на основании которых можно довольно легко выбрать сварочный режим. Для этого необходимо знать следующие параметры:
- толщину стенки свариваемых заготовок;
- вид сварки — левый, правый;
На основании этого можно определить диаметр присадочной проволоки и подобрать расход ацетилена. К примеру, толщина составляет 5-6 мм, для выполнения работ будет использован наконечник № 4. То есть на основании табличных данных диаметр проволоки будет составлять для левой сварки 3,5 мм, для правой 3. Расход ацетилена в таком случае будет составлять при левом способе 60 -780 дм 3 /час, при правом 650-750 дм 3 /час.
Сварку выполняют небольшими участками по 10-15 мм. Работа производится в следующей последовательности. На первом этапе выполняют оплавление кромок. После этого выполняют наложение корня шва. По окончании формирования корня, можно продолжать сварку далее. Если толщина заготовок составляет 4 мм то сварку допустимо выполнять в один слой. Если толщина превышает указанную, то необходимо наложить второй. Его укладывают только после того, как выполнен корень шва по всей заданной длине.
Для улучшения качества сварки допускается выполнение предварительного нагрева. То есть будущий сварной стык прогревают с помощью горелки. Если принят за основу такой способ, то прогрев надо выполнять после каждой остановки заново.
Выполнение швов газом может выполняться в любом пространственном положении. Например, при выполнении вертикального шва существуют свои особенности. Так, вертикальный шов должен исполняться снизу вверх.
При выполнении сварочных работ перерывы в работе недопустимы, по крайней мере до окончания всей разделки шва. При остановке в работе горелку необходимо отводить медленно, в противном случае, могут возникнуть дефекты шва — раковины и поры. Интересная особенность существует при сварке трубопроводов, в ней не допустим сквозняк и поэтому концы труб необходимо заглушать.
Виды ацетилена
Промышленность выпускает два вида ацетилена — твердый и в виде газа.
Газообразный
Ацетилен обладает резким запахом и это дает определённые преимущества при его утечке. По своей массе он близок к атмосферному воздуху.
Жидкий
Жидкий ацетилен не обладает ни каким цветом. У него есть одна особенность он преломляет цвет. Ацетилен и жидкий, и газообразный, представляет собой опасное вещество. То есть при нарушении правил обращения с ним взрыв может произойти в любую секунду, даже при комнатной температуре. Для повышения безопасности при обращении с ним, применяют так называемую флегматизацией. То есть в ёмкости, предназначенной для хранения ацетилена размещают пористое вещество. Которое снижает его опасность
Реакции ацетилена
Ацетилен вступает в реакцию с различными соединениями, например, солями меди и серебра. В результате таких взаимодействий получают вещества под названием ацетилениды. Их отличительная черта — взрывоопасность.
Использование ацетилена
Кроме сварки ацетилен применяют в следующих случаях:
- для получения яркого света в автономных источниках света (карбидная лампа);
- при изготовлении взрывчатых веществ, это уже упоминавшиеся ацетилениды;
- получения некоторых химических веществ, например, уксуса, спирта, полимеров и пр;
- кроме этого, ацетилен нашел свое применение и в ракетной технике, в качестве компонента топлива.
Стандарты
Производители ацетилена руководствуются при его получении требованиями ГОСТ 5457-75. В нем определены требования к газообразному и жидкому ацетилену.
Газ в баллоне
Для хранения и транспортировки ацетилена применяют газовые баллоны. Для изготовления этого устройства применяют бесшовную трубу, которую производят на основании ГОСТ 949-73. В нижней части корпуса устанавливают специальную опору, которая позволяет его устанавливать в вертикальное положение. В верхней части баллона устанавливают вентиль, через который выполняют заправку/отдачу газа. Эти вентили выпускают под маркой ВБА-1 или BA-I. Их применение допустимо только на баллонах предназначенном для хранения этого газа.
Ацетилен в баллонах
На поверхности баллона должны быть выбиты следующие данные:
Товарный знак производителя, дата производства, параметры давления и некоторые другие, которые характеризуют это изделие.
На поверхность баллонов наносят краску белого цвета. Кроме этого, в обязательном порядке должны быть нанесена надпись АЦЕТИЛЕН. При этом высота шрифта не должна быть менее 6 см.
Баллон заполняют пористым наполнителем. Его задача более равномерное распределение газа внутри баллон, другая задача заключается в предохранении газа от распада.
Источник
Бесцветный газ, слаборастворимый в воде, несколько легче атмосферного воздуха, относящийся к классу алкинов и представляющий собой ненасыщенный углерод называют ацетиленом. В его структуре все атомы имеют между собой тройную связь. Это вещество закипает при температуре — 830 °С.
Формула ацетилена говорит о том, что в его состав входят только углерод и водород.
Ацетилен – это опасное вещество, которое при неаккуратном обращении с ним может взорваться. Именно поэтому для хранения этого вещества используют специально оснащенные емкости. Газ при соединении с кислородом горит, и температура может достигать 3150 °С.
Получение ацетилена
Ацетилен можно получить в лабораторных и промышленных условиях. Для получения ацетилена в лаборатории достаточно на карбид кальция (это его формула — СаС2) капнуть небольшое количество воды. после этого начинается бурная реакция выделения ацетилена. Для ее замедления допустимо использовать поваренную соль (формула NaCl).
В промышленных условиях все несколько сложнее. Для производства ацетилена применяют пиролиз метана, а так же пропана, бутана. В последнем случае формула ацетилена будет содержать большое количество примесей. Карбидный способ производства ацетилена обеспечивает производство чистого газа. Но, такой метод получения продукта должен быть обеспечен большим количеством электроэнергии. Пиролиз не требует большого количества электричества, все дело в том, что для производства газа, необходимо выполнить нагрев реактора и для этого используют газ, циркулирующий в первом контуре реактора. Но в потоке, который там перемещается, концентрация газа довольно мала. Выделение ацетилена с чистой формулой во втором случае не самая простая задача и ее решение обходится довольно дорого. Существует несколько способов производства формулы ацетилена в промышленных условиях.
Электрический крекинг
Превращение метана в ацетилен происходит в электродуговой печи, при этом ее нагревают до температуры в 2000-3000 °С. При этом, напряжение на электродах достигает 1 кВ. Метан разогревают до 1600 °С. Для получения одной тонны ацетилена необходимо затратить 13 000 кВт×ч. Это существенный недостаток производства формулы ацетилена.
Пиролиз окислительный
Этот способ основан на перемешивании метана и кислорода. После производства смеси, часть ее отправляют на сжигание и полученное тепло отправляют на нагревание сырья до температуры в 16000 °С. Такой процесс отличается непрерывностью и довольно скромными затратами электрической энергии. На сегодня этот метод чаще всего можно встретить на предприятиях по производству ацетилена. 
Преимущества
Упоминание о газовой сварке моментально наводит на мысли об ацетилене. Действительно для этого процесса чаще всего применяют этот газ. Он в сочетании с кислородом обеспечивает самую высокую температуру горения пламени. Но в последние годы из-за развития различных видов сварки использование этого вида соединения металлов несколько снизилось. Более того, в некоторых отраслях произошел полный отказ от применения этих технологий. Но для выполнения определенного вида ремонтных работ она до сих пор остается незаменима. Применение ацетилена позволяет получить следующие преимущества:
- максимальная температура пламени;
- существует возможность генерации ацетилена непосредственно на рабочем месте или приобретения его в специальных емкостях;
- довольно низкая стоимость, в сравнении с другими горючими газами.
Вместе с тем, у ацетилена есть и определенные недостатки, которые ограничивают его использование. Самый главный — это взрывоопасность. При работе с этим газом необходимо строго соблюдать меры безопасности. В частности, работы должны выполняться в хорошо проветриваемом помещении. При нарушении режимов работы возможно появление некоторых дефектов, например, пережогов.
Формула ацетилена

Химические и физические свойства
Некоторые химические свойства
Свойства ацетилена во многом определены его формулой. То есть наличием атомов углерода и водорода связанных между собой. Смешивание ацетилена с водой, при добавлении катализаторов типа солей ртути, приводит к получению уксусного альдегида. Тройная связь атомов, содержащихся в молекуле ацетилена приводит к тому, что при сгорании она выделяет 14 000 ккал/куб. м. В процессе сгорания температура поднимается до 3000 °C. Этот газ, при соблюдении определенных условий, может превращаться в бензол. Для этого необходимо разогреть его до 4000 °С и добавить графит.
Водород, содержащийся в молекулах показывает кислотные свойства. То есть они довольно легко отрываются от молекулы в виде протонов. Ацетилен в состоянии обесцвечивает воду содержащую бром и раствор «марганцовки». Молярная масса ацетилена составляет 26,04 г/моль. Плотность ацетилена 1,1 кг/м³.
Физические свойства
В стандартных условиях ацетилен представляет собой бесцветный газ, который практически не растворяется в воде. Он начинает кипеть в -830 °С. При сжимании он начинает разлагаться с выделением большого количества энергии. Поэтому для его хранения применяют стальные баллоны способные хранить газ под высоким давлением.
Этот газ недопустимо выпускать в атмосферу. Его формула может отрицательно сказываться на окружающей среде.
Технология и режимы сварки
Ацетилено — кислородные смеси применяют для соединения деталей из углеродистых и низколегированных сталей. Например, этот метод широко применяют для создания неразъемных соединений трубопроводов. Например, труб диаметром 159 мм с толщиной стенок не более 8 мм. Но существуют и некоторые ограничения, так соединение таким методом сталей марок 12×2M1, 12×2МФСР недопустимо.
Выбор параметров режима
Для приготовления смеси необходимой для соединения металлов используют формулу 1/1,2. При обработке заготовок из легированных сталей сварщик должен отслеживать состояние пламени. В частности, нельзя допускать переизбытка ацетилена. Расход смеси с формулой кислород/ацетилен составляет 100-130 дм3/час на 1 мм толщины. Мощность пламени регулируют с помощью горелки, которые подбирают в зависимости от используемого материала, его характеристик, толщины и пр Для выполнения сварки при помощи ацетилена применяют сварочную проволоку. Ее марка должна соответствовать марке сталей свариваемых деталей. Диаметр проволоки определяют в зависимости от толщины свариваемого металла. Для удобства технологов и непосредственно сварщиков существует множество таблиц, на основании которых можно довольно легко выбрать сварочный режим. Для этого необходимо знать следующие параметры:
- толщину стенки свариваемых заготовок;
- вид сварки — левый, правый;
На основании этого можно определить диаметр присадочной проволоки и подобрать расход ацетилена. К примеру, толщина составляет 5-6 мм, для выполнения работ будет использован наконечник № 4. То есть на основании табличных данных диаметр проволоки будет составлять для левой сварки 3,5 мм, для правой 3. Расход ацетилена в таком случае будет составлять при левом способе 60 -780 дм3/час, при правом 650-750 дм3/час. Сварку выполняют небольшими участками по 10-15 мм. Работа производится в следующей последовательности. На первом этапе выполняют оплавление кромок. После этого выполняют наложение корня шва. По окончании формирования корня, можно продолжать сварку далее. Если толщина заготовок составляет 4 мм то сварку допустимо выполнять в один слой. Если толщина превышает указанную, то необходимо наложить второй. Его укладывают только после того, как выполнен корень шва по всей заданной длине. Для улучшения качества сварки допускается выполнение предварительного нагрева. То есть будущий сварной стык прогревают с помощью горелки. Если принят за основу такой способ, то прогрев надо выполнять после каждой остановки заново.
Выполнение швов газом может выполняться в любом пространственном положении. Например, при выполнении вертикального шва существуют свои особенности. Так, вертикальный шов должен исполняться снизу вверх. При выполнении сварочных работ перерывы в работе недопустимы, по крайней мере до окончания всей разделки шва. При остановке в работе горелку необходимо отводить медленно, в противном случае, могут возникнуть дефекты шва — раковины и поры. Интересная особенность существует при сварке трубопроводов, в ней не допустим сквозняк и поэтому концы труб необходимо заглушать.
Виды ацетилена
Промышленность выпускает два вида ацетилена — твердый и в виде газа.
Газообразный
Ацетилен обладает резким запахом и это дает определённые преимущества при его утечке. По своей массе он близок к атмосферному воздуху.
Жидкий
Жидкий ацетилен не обладает ни каким цветом. У него есть одна особенность он преломляет цвет. Ацетилен и жидкий, и газообразный, представляет собой опасное вещество. То есть при нарушении правил обращения с ним взрыв может произойти в любую секунду, даже при комнатной температуре. Для повышения безопасности при обращении с ним, применяют так называемую флегматизацией. То есть в ёмкости, предназначенной для хранения ацетилена размещают пористое вещество. Которое снижает его опасность
Реакции ацетилена
Ацетилен вступает в реакцию с различными соединениями, например, солями меди и серебра. В результате таких взаимодействий получают вещества под названием ацетилениды. Их отличительная черта — взрывоопасность.
Использование ацетилена
Кроме сварки ацетилен применяют в следующих случаях:
- для получения яркого света в автономных источниках света (карбидная лампа);
- при изготовлении взрывчатых веществ, это уже упоминавшиеся ацетилениды;
- получения некоторых химических веществ, например, уксуса, спирта, полимеров и пр;
- кроме этого, ацетилен нашел свое применение и в ракетной технике, в качестве компонента топлива.
Стандарты
Производители ацетилена руководствуются при его получении требованиями ГОСТ 5457-75. В нем определены требования к газообразному и жидкому ацетилену.
Скачать ГОСТ 5457-75
Газ в баллоне
Для хранения и транспортировки ацетилена применяют газовые баллоны. Для изготовления этого устройства применяют бесшовную трубу, которую производят на основании ГОСТ 949-73. В нижней части корпуса устанавливают специальную опору, которая позволяет его устанавливать в вертикальное положение. В верхней части баллона устанавливают вентиль, через который выполняют заправку/отдачу газа. Эти вентили выпускают под маркой ВБА-1 или BA-I. Их применение допустимо только на баллонах предназначенном для хранения этого газа. 
From Wikipedia, the free encyclopedia
«ethyne» redirects here. Not to be confused with ethane or ethene.

|
|

|
|

|
|
| Names | |
|---|---|
| Preferred IUPAC name
Acetylene[1] |
|
| Systematic IUPAC name
Ethyne[2] |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
|
Beilstein Reference |
906677 |
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| ECHA InfoCard | 100.000.743 |
| EC Number |
|
|
Gmelin Reference |
210 |
| KEGG |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
| UN number | 1001 (dissolved) 3138 (in mixture with ethylene and propylene) |
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
C2H2 |
| Molar mass | 26.038 g·mol−1 |
| Appearance | Colorless gas |
| Odor | Odorless |
| Density | 1.1772 g/L = 1.1772 kg/m3 (0 °C, 101.3 kPa)[3] |
| Melting point | −80.8 °C (−113.4 °F; 192.3 K) Triple point at 1.27 atm |
|
Sublimation |
−84 °C; −119 °F; 189 K (1 atm) |
|
Solubility in water |
slightly soluble |
| Solubility | slightly soluble in alcohol soluble in acetone, benzene |
| Vapor pressure | 44.2 atm (20 °C)[4] |
| Acidity (pKa) | 25[5] |
| Conjugate acid | Ethynium |
|
Magnetic susceptibility (χ) |
−20.8×10−6 cm3/mol [6] |
| Thermal conductivity | 21.4 mW·m−1·K−1 (300 K) [6] |
| Structure | |
|
Molecular shape |
Linear |
| Thermochemistry[6] | |
|
Heat capacity (C) |
44.036 J·mol−1·K−1 |
|
Std molar |
200.927 J·mol−1·K−1 |
|
Std enthalpy of |
227.400 kJ·mol−1 |
|
Gibbs free energy (ΔfG⦵) |
209.879 kJ·mol−1 |
|
Std enthalpy of |
1300 kJ·mol−1 |
| Hazards | |
| GHS labelling: | |
|
Pictograms |
 
|
|
Signal word |
Danger |
|
Hazard statements |
H220, H336 |
|
Precautionary statements |
P202, P210, P233, P261, P271, P304, P312, P340, P377, P381, P403, P405, P501 |
| NFPA 704 (fire diamond) |
1 4 3 |
|
Autoignition |
300 °C (572 °F; 573 K) |
| Explosive limits | 2.5–100% |
| NIOSH (US health exposure limits): | |
|
PEL (Permissible) |
none[4] |
|
REL (Recommended) |
C 2500 ppm (2662 mg/m3)[4] |
|
IDLH (Immediate danger) |
N.D.[4] |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Acetylene (systematic name: ethyne) is the chemical compound with the formula C2H2 and structure H−C≡C−H. It is a hydrocarbon and the simplest alkyne.[7] This colorless gas is widely used as a fuel and a chemical building block. It is unstable in its pure form and thus is usually handled as a solution.[8] Pure acetylene is odorless, but commercial grades usually have a marked odor due to impurities such as divinyl sulfide and phosphine.[8][9]
As an alkyne, acetylene is unsaturated because its two carbon atoms are bonded together in a triple bond. The carbon–carbon triple bond places all four atoms in the same straight line, with CCH bond angles of 180°.[10]
Discovery[edit]
Acetylene was discovered in 1836 by Edmund Davy, who identified it as a «new carburet of hydrogen».[11][12] It was an accidental discovery while attempting to isolate potassium metal. By heating potassium carbonate with carbon at very high temperatures, he produced a residue of what is now known as potassium carbide, (K2C2), which reacted with water to release the new gas. It was rediscovered in 1860 by French chemist Marcellin Berthelot, who coined the name acétylène.[13] Berthelot’s empirical formula for acetylene (C4H2), as well as the alternative name «quadricarbure d’hydrogène» (hydrogen quadricarbide), were incorrect because many chemists at that time used the wrong atomic mass for carbon (6 instead of 12).[14] Berthelot was able to prepare this gas by passing vapours of organic compounds (methanol, ethanol, etc.) through a red hot tube and collecting the effluent. He also found that acetylene was formed by sparking electricity through mixed cyanogen and hydrogen gases. Berthelot later obtained acetylene directly by passing hydrogen between the poles of a carbon arc.[15][16]
Preparation[edit]
Since the 1950s, acetylene has mainly been manufactured by the partial combustion of methane.[8][17][18] It is a recovered side product in production of ethylene by cracking of hydrocarbons. Approximately 400,000 tonnes were produced by this method in 1983.[8] Its presence in ethylene is usually undesirable because of its explosive character and its ability to poison Ziegler–Natta catalysts. It is selectively hydrogenated into ethylene, usually using Pd–Ag catalysts.[19]
Acetylene factory with annual capacity of 90,000 tons, commissioned in 2020 by BASF.
Until the 1950s, when oil supplanted coal as the chief source of reduced carbon, acetylene (and the aromatic fraction from coal tar) was the main source of organic chemicals in the chemical industry. It was prepared by the hydrolysis of calcium carbide, a reaction discovered by Friedrich Wöhler in 1862[20] and still familiar to students:
Calcium carbide production requires extremely high temperatures, ~2000 °C, necessitating the use of an electric arc furnace. In the US, this process was an important part of the late-19th century revolution in chemistry enabled by the massive hydroelectric power project at Niagara Falls.[21]
Bonding[edit]
In terms of valence bond theory, in each carbon atom the 2s orbital hybridizes with one 2p orbital thus forming an sp hybrid. The other two 2p orbitals remain unhybridized. The two ends of the two sp hybrid orbital overlap to form a strong σ valence bond between the carbons, while on each of the other two ends hydrogen atoms attach also by σ bonds. The two unchanged 2p orbitals form a pair of weaker π bonds.[22]
Since acetylene is a linear symmetrical molecule, it possesses the D∞h point group.[23]
Physical properties[edit]
Changes of state[edit]
At atmospheric pressure, acetylene cannot exist as a liquid and does not have a melting point. The triple point on the phase diagram corresponds to the melting point (−80.8 °C) at the minimal pressure at which liquid acetylene can exist (1.27 atm). At temperatures below the triple point, solid acetylene can change directly to the vapour (gas) by sublimation. The sublimation point at atmospheric pressure is −84.0 °C.[24]
Other[edit]
At room temperature, the solubility of acetylene in acetone is 27.9 g per kg. For the same amount of dimethylformamide (DMF), the solubility is 51 g. At
20.26 bar, the solubility increases to 689.0 and 628.0 g for acetone and DMF, respectively. These solvents are used in pressurized gas cylinders.[25]
Applications[edit]
Welding[edit]
Approximately 20% of acetylene is supplied by the industrial gases industry for oxyacetylene gas welding and cutting due to the high temperature of the flame. Combustion of acetylene with oxygen produces a flame of over 3,600 K (3,330 °C; 6,020 °F), releasing 11.8 kJ/g. Oxyacetylene is the hottest burning common fuel gas.[26] Acetylene is the third-hottest natural chemical flame after dicyanoacetylene’s 5,260 K (4,990 °C; 9,010 °F) and cyanogen at 4,798 K (4,525 °C; 8,177 °F). Oxy-acetylene welding was a popular welding process in previous decades. The development and advantages of arc-based welding processes have made oxy-fuel welding nearly extinct for many applications. Acetylene usage for welding has dropped significantly. On the other hand, oxy-acetylene welding equipment is quite versatile – not only because the torch is preferred for some sorts of iron or steel welding (as in certain artistic applications), but also because it lends itself easily to brazing, braze-welding, metal heating (for annealing or tempering, bending or forming), the loosening of corroded nuts and bolts, and other applications. Bell Canada cable-repair technicians still use portable acetylene-fuelled torch kits as a soldering tool for sealing lead sleeve splices in manholes and in some aerial locations. Oxyacetylene welding may also be used in areas where electricity is not readily accessible. Oxyacetylene cutting is used in many metal fabrication shops. For use in welding and cutting, the working pressures must be controlled by a regulator, since above 15 psi (100 kPa), if subjected to a shockwave (caused, for example, by a flashback), acetylene decomposes explosively into hydrogen and carbon.[27]
Acetylene fuel container/burner as used in the island of Bali
Portable lighting[edit]
Acetylene combustion produces a strong, bright light and the ubiquity of carbide lamps drove much acetylene commercialization in the early 20th century. Common applications included coastal lighthouses,[28] street lights,[29] and automobile[30] and mining headlamps.[31] In most of these applications, direct combustion is a fire hazard, and so acetylene has been replaced, first by incandescent lighting and many years later by low-power/high-lumen LEDs. Nevertheless, acetylene lamps remain in limited use in remote or otherwise inaccessible areas and in countries with a weak or unreliable central electric grid.[31]
Plastics and acrylic acid derivatives[edit]
Acetylene can be semihydrogenated to ethylene, providing a feedstock for a variety of polyethylene plastics. Another major application of acetylene, especially in China is its conversion to acrylic acid derivatives.[8] These derivatives form products such as acrylic fibers, glasses, paints, resins, and polymers.[32]
Except in China, use of acetylene as a chemical feedstock has declined by 70% from 1965 to 2007 owing to cost and environmental considerations.
Niche applications[edit]
In 1881, the Russian chemist Mikhail Kucherov[33] described the hydration of acetylene to acetaldehyde using catalysts such as mercury(II) bromide. Before the advent of the Wacker process, this reaction was conducted on an industrial scale.[34]
The polymerization of acetylene with Ziegler–Natta catalysts produces polyacetylene films. Polyacetylene, a chain of CH centres with alternating single and double bonds, was one of the first discovered organic semiconductors. Its reaction with iodine produces a highly electrically conducting material. Although such materials are not useful, these discoveries led to the developments of organic semiconductors, as recognized by the Nobel Prize in Chemistry in 2000 to Alan J. Heeger, Alan G MacDiarmid, and Hideki Shirakawa.[8]
In the 1920s, pure acetylene was experimentally used as an inhalation anesthetic.[35]
Acetylene is sometimes used for carburization (that is, hardening) of steel when the object is too large to fit into a furnace.[36]
Acetylene is used to volatilize carbon in radiocarbon dating. The carbonaceous material in an archeological sample is treated with lithium metal in a small specialized research furnace to form lithium carbide (also known as lithium acetylide). The carbide can then be reacted with water, as usual, to form acetylene gas to feed into a mass spectrometer to measure the isotopic ratio of carbon-14 to carbon-12.[37]
Natural occurrence[edit]
The energy richness of the C≡C triple bond and the rather high solubility of acetylene in water make it a suitable substrate for bacteria, provided an adequate source is available.[38] A number of bacteria living on acetylene have been identified. The enzyme acetylene hydratase catalyzes the hydration of acetylene to give acetaldehyde:[39]
Acetylene is a moderately common chemical in the universe, often associated with the atmospheres of gas giants.[40] One curious discovery of acetylene is on Enceladus, a moon of Saturn. Natural acetylene is believed to form from catalytic decomposition of long-chain hydrocarbons at temperatures of 1,700 K (1,430 °C; 2,600 °F) and above. Since such temperatures are highly unlikely on such a small distant body, this discovery is potentially suggestive of catalytic reactions within that moon, making it a promising site to search for prebiotic chemistry.[41][42]
Reactions[edit]
Vinylation reactions[edit]
In vinylation reactions, H−X compounds add across the triple bond. Alcohols and phenols add to acetylene to give vinyl ethers. Thiols give vinyl thioethers. Similarly, vinylpyrrolidone and vinylcarbazole are produced industrially by vinylation of 2-pyrrolidone and carbazole.[25][8]
The hydration of acetylene is a vinylation reaction, but the resulting vinyl alcohol isomerizes to acetaldehyde. The reaction is catalyzed by mercury salts. This reaction once was the dominant technology for acetaldehyde production, but it has been displaced by the Wacker process, which affords acetaldehyde by oxidation of ethylene, a cheaper feedstock. A similar situation applies to the conversion of acetylene to the valuable vinyl chloride by hydrochlorination vs the oxychlorination of ethylene.
Vinyl acetate is used instead of acetylene for some vinylations, which are more accurately described as transvinylations.[43] Higher esters of vinyl acetate have been used in the synthesis of vinyl formate.
Ethynylation[edit]
Acetylene adds to aldehydes and ketones to form α-ethynyl alcohols:[8]
The reaction with formaldehyde is used industrially in the production of butynediol, forming propargyl alcohol as the by-product. Copper acetylide is used as the catalyst.[44][45]
Because halogens add across the triple bond, the substituted acetylenes difluoroacetylene, dichloroacetylene, dibromoacetylene, and diiodoacetylene cannot be made directly from acetylene. A common workaround is to dehydrate vinyl dihaloethenols.[46]
Carbonylation[edit]
Walter Reppe discovered that in the presence of catalysts, acetylene reacts to give a wide range of industrially significant chemicals.[8][47][48]
With carbon monoxide, acetylene reacts to give acrylic acid, or acrylic esters, which can be used to produce acrylic glass.[32]
Organometallic chemistry[edit]
Acetylene and its derivatives (2-butyne, diphenylacetylene, etc.) form complexes with transition metals. Its bonding to the metal is somewhat similar to that of ethylene complexes. These complexes are intermediates in many catalytic reactions such as alkyne trimerisation to benzene, tetramerization to cyclooctatetraene,[8] and carbonylation to hydroquinone:[47]
at basic conditions (50–80 °C, 20–25 atm).
In the presence of certain transition metals, alkynes undergo alkyne metathesis.
Metal acetylides, species of the formula LnM−C2R, are also common. Copper(I) acetylide and silver acetylide can be formed in aqueous solutions with ease due to a poor solubility equilibrium.[49]
Acid-base reactions[edit]
Acetylene has a pKa of 25, acetylene can be deprotonated by a superbase to form an acetylide:[49]
Various organometallic[50] and inorganic[51] reagents are effective.
Safety and handling[edit]
Acetylene is not especially toxic, but when generated from calcium carbide, it can contain toxic impurities such as traces of phosphine and arsine, which give it a distinct garlic-like smell. It is also highly flammable, as are most light hydrocarbons, hence its use in welding. Its most singular hazard is associated with its intrinsic instability, especially when it is pressurized: under certain conditions acetylene can react in an exothermic addition-type reaction to form a number of products, typically benzene and/or vinylacetylene, possibly in addition to carbon and hydrogen.[citation needed] Consequently, acetylene, if initiated by intense heat or a shockwave, can decompose explosively if the absolute pressure of the gas exceeds about 200 kilopascals (29 psi). Most regulators and pressure gauges on equipment report gauge pressure, and the safe limit for acetylene therefore is 101 kPagage, or 15 psig.[52][53] It is therefore supplied and stored dissolved in acetone or dimethylformamide (DMF),[53][54][55] contained in a gas cylinder with a porous filling (Agamassan), which renders it safe to transport and use, given proper handling. Acetylene cylinders should be used in the upright position to avoid withdrawing acetone during use.[56]
Information on safe storage of acetylene in upright cylinders is provided by the OSHA,[57][58] Compressed Gas Association,[53] United States Mine Safety and Health Administration (MSHA),[59] EIGA,[56] and other agencies.
Copper catalyses the decomposition of acetylene, and as a result acetylene should not be transported in copper pipes.[60]
Cylinders should be stored in an area segregated from oxidizers to avoid exacerbated reaction in case of fire/leakage.[53][58] Acetylene cylinders should not be stored in confined spaces, enclosed vehicles, garages, and buildings, to avoid unintended leakage leading to explosive atmosphere.[53][58] In the US, National Electric Code (NEC) requires consideration for hazardous areas including those where acetylene may be released during accidents or leaks.[61] Consideration may include electrical classification and use of listed Group A electrical components in US.[61] Further information on determining the areas requiring special consideration is in NFPA 497.[62] In Europe, ATEX also requires consideration for hazardous areas where flammable gases may be released during accidents or leaks.[56]
References[edit]
- ^ Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. p. 375. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
The name acetylene is retained for the compound HC≡CH. It is the preferred IUPAC name, but substitution of any kind is not allowed; however, in general nomenclature, substitution is allowed, for example fluoroacetylene [fluoroethyne (PIN)], but not by alkyl groups or any other group that extends the carbon chain, nor by characteristic groups expressed by suffixes.
- ^ Acyclic Hydrocarbons. Rule A-3. Unsaturated Compounds and Univalent Radicals Archived 10 October 2000 at the Wayback Machine, IUPAC Nomenclature of Organic Chemistry
- ^ Record of Acetylene in the GESTIS Substance Database of the Institute for Occupational Safety and Health
- ^ a b c d NIOSH Pocket Guide to Chemical Hazards. «#0008». National Institute for Occupational Safety and Health (NIOSH).
- ^ «Acetylene – Gas Encyclopedia Air Liquide». Air Liquide. Archived from the original on 4 May 2022. Retrieved 27 September 2018.
- ^ a b c CRC handbook of chemistry and physics : a ready-reference book of chemical and physical data. William M. Haynes, David R. Lide, Thomas J. Bruno (2016-2017, 97th ed.). Boca Raton, Florida. 2016. ISBN 978-1-4987-5428-6. OCLC 930681942. Archived from the original on 4 May 2022. Retrieved 4 May 2022.
{{cite book}}: CS1 maint: others (link) - ^ R. H. Petrucci; W. S. Harwood; F. G. Herring (2002). General Chemistry (8th ed.). Prentice-Hall. p. 1072.
- ^ a b c d e f g h i j Pässler, Peter; Hefner, Werner; Buckl, Klaus; Meinass, Helmut; Meiswinkel, Andreas; Wernicke, Hans-Jürgen; Ebersberg, Günter; Müller, Richard; Bässler (2008). «Acetylene Chemistry». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a01_097.pub3.
- ^ Compressed Gas Association (1995) Material Safety and Data Sheet – Acetylene Archived 11 July 2012 at the Wayback Machine
- ^ Whitten K. W., Gailey K. D. and Davis R. E. General Chemistry (4th ed., Saunders College Publishing 1992), pp. 328–329, 1046. ISBN 0-03-072373-6.
- ^ Edmund Davy (August 1836) «Notice of a new gaseous bicarburet of hydrogen» Archived 6 May 2016 at the Wayback Machine, Report of the Sixth Meeting of the British Association for the Advancement of Science …, 5: 62–63.
- ^ Miller, S. A. (1965). Acetylene: Its Properties, Manufacture and Uses. Vol. 1. Academic Press Inc. Archived from the original on 15 April 2021. Retrieved 16 July 2021.
- ^ Bertholet (1860) «Note sur une nouvelle série de composés organiques, le quadricarbure d’hydrogène et ses dérivés» Archived 13 July 2015 at the Wayback Machine (Note on a new series of organic compounds, tetra-carbon hydride and its derivatives), Comptes rendus, series 3, 50: 805–808.
- ^ Ihde, Aaron J. (1961). «The Karlsruhe Congress: A centennial retrospective». Journal of Chemical Education. 38 (2): 83. Bibcode:1961JChEd..38…83I. doi:10.1021/ed038p83. Archived from the original on 30 December 2021. Retrieved 29 December 2021.
Atomic weights of 6 and 12 were both in use for carbon.
- ^ Berthelot (1862) «Synthèse de l’acétylène par la combinaison directe du carbone avec l’hydrogène» Archived 14 August 2020 at the Wayback Machine (Synthesis of acetylene by the direct combination of carbon with hydrogen), Comptes rendus, series 3, 54: 640–644.
- ^ Acetylene Archived 28 January 2012 at the Wayback Machine.
- ^ Habil, Phil; Sachsse, Hans (1954). «Herstellung von Acetylen durch unvollständige Verbrennung von Kohlenwasserstoffen mit Sauerstoff (Production of acetylene by incomplete combustion of hydrocarbons with oxygen)». Chemie Ingenieur Technik. 26 (5): 245–253. doi:10.1002/cite.330260502.
- ^ Habil, Phil; Bartholoméa, E. (1954). «Probleme großtechnischer Anlagen zur Erzeugung von Acetylen nach dem Sauerstoff-Verfahren (Problems of large-scale plants for the production of acetylene by the oxygen method)». Chemie Ingenieur Technik. 26 (5): 253–258. doi:10.1002/cite.330260503.
- ^ Acetylene: How Products are Made Archived 20 January 2007 at the Wayback Machine
- ^ Wohler (1862) «Bildung des Acetylens durch Kohlenstoffcalcium» Archived 12 May 2016 at the Wayback Machine (Formation of actylene by calcium carbide), Annalen der Chemie und Pharmacie, 124: 220.
- ^ Freeman, Horace (1919). «Manufacture of Cyanamide». The Chemical News and the Journal of Physical Science. 117: 232. Archived from the original on 15 April 2021. Retrieved 23 December 2013.
- ^ Organic Chemistry 7th ed. by J. McMurry, Thomson 2008
- ^ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3rd ed.). Prentice Hall. pp. 94–95. ISBN 978-0-13-175553-6.
- ^ Handbook of Chemistry and Physics (60th ed., CRC Press 1979–80), p. C-303 in Table Physical Constants of Organic Compounds (listed as ethyne).
- ^ a b Harreus, Albrecht Ludwig; Backes, R.; Eichler, J.-O.; Feuerhake, R.; Jäkel, C.; Mahn, U.; Pinkos, R.; Vogelsang»2-Pyrrolidone, R. (2011). Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a22_457.pub2.
- ^ «Acetylene». Products and Supply > Fuel Gases. Linde. Archived from the original on 12 January 2018. Retrieved 30 November 2013.
- ^ ESAB Oxy-acetylene welding handbook – Acetylene properties Archived 10 May 2020 at the Wayback Machine.
- ^ «Lighthouse Lamps Through Time by Thomas Tag | US Lighthouse Society». uslhs.org. Archived from the original on 25 February 2017. Retrieved 24 February 2017.
- ^ Myers, Richard L. (2007). The 100 Most Important Chemical Compounds: A Reference Guide. ABC-CLIO. ISBN 978-0-313-33758-1. Archived from the original on 17 June 2016. Retrieved 21 November 2015.
- ^ Grainger, D., (2001). By cars’ early light: A short history of the headlamp: 1900s lights bore port and starboard red and green lenses. National Post. [Toronto Edition] DT7.
- ^ a b Thorpe, Dave (2005). Carbide Light: The Last Flame in American Mines. Bergamot Publishing. ISBN 978-0976090526.
- ^ a b Takashi Ohara; Takahisa Sato; Noboru Shimizu; Günter Prescher; Helmut Schwind; Otto Weiberg; Klaus Marten; Helmut Greim (2003). «Acrylic Acid and Derivatives». Ullmann’s Encyclopedia of Industrial Chemistry: 7. doi:10.1002/14356007.a01_161.pub2. ISBN 3527306730.
- ^ Kutscheroff, M. (1881). «Ueber eine neue Methode direkter Addition von Wasser (Hydratation) an die Kohlenwasserstoffe der Acetylenreihe». Berichte der Deutschen Chemischen Gesellschaft. 14: 1540–1542. doi:10.1002/cber.188101401320. Archived from the original on 2 December 2020. Retrieved 9 September 2019.
- ^ Dmitry A. Ponomarev; Sergey M. Shevchenko (2007). «Hydration of Acetylene: A 125th Anniversary» (PDF). J. Chem. Educ. 84 (10): 1725. Bibcode:2007JChEd..84.1725P. doi:10.1021/ed084p1725. Archived (PDF) from the original on 11 June 2011. Retrieved 18 February 2009.
- ^ William Stanley Sykes (1930). «Acetylene in medicine». Encyclopaedia Britannica. Vol. 1 (14 ed.). p. 119.
- ^ «Acetylene». Products and Services. BOC. Archived from the original on 17 May 2006.
- ^ Geyh, Mebus (1990). «Radiocarbon dating problems using acetylene as counting gas». Radiocarbon. 32 (3): 321–324. doi:10.2458/azu_js_rc.32.1278. Archived from the original on 26 December 2013. Retrieved 26 December 2013.
- ^ Akob, Denise (August 2018). «Acetylenotrophy: a hidden but ubiquitous microbial metabolism?». FEMS Microbiology Ecology. 94 (8). doi:10.1093/femsec/fiy103. PMC 7190893. PMID 29933435. Retrieved 28 July 2022.
- ^ ten Brink, Felix (2014). «Chapter 2. Living on acetylene. A Primordial Energy Source». In Peter M. H. Kroneck and Martha E. Sosa Torres (ed.). The Metal-Driven Biogeochemistry of Gaseous Compounds in the Environment. Metal Ions in Life Sciences. Vol. 14. Springer. pp. 15–35. doi:10.1007/978-94-017-9269-1_2. PMID 25416389.
- ^ «Precursor to Proteins and DNA found in Stellar Disk» (Press release). W. M. Keck Observatory. 20 December 2005. Archived from the original on 23 February 2007.
- ^ Emily Lakdawalla (17 March 2006). «LPSC: Wednesday afternoon: Cassini at Enceladus». The Planetary Society. Archived from the original on 20 February 2012.
- ^ John Spencer; David Grinspoon (25 January 2007). «Planetary science: Inside Enceladus». Nature. 445 (7126): 376–377. Bibcode:2007Natur.445..376S. doi:10.1038/445376b. PMID 17251967. S2CID 4427890.
- ^ Manchand, Percy S. (2001). «Vinyl Acetate». Encyclopedia of Reagents for Organic Synthesis. doi:10.1002/047084289X.rv008. ISBN 0471936235.
- ^ Gräfje, Heinz; Körnig, Wolfgang; Weitz, Hans-Martin; Reiß, Wolfgang; Steffan, Guido; Diehl, Herbert; Bosche, Horst; Schneider, Kurt; Kieczka, Heinz (15 June 2000), «Butanediols, Butenediol, and Butynediol», in Wiley-VCH Verlag GmbH & Co. KGaA (ed.), Ullmann’s Encyclopedia of Industrial Chemistry, Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA, pp. a04_455, doi:10.1002/14356007.a04_455, ISBN 978-3-527-30673-2, S2CID 178601434, archived from the original on 19 March 2022, retrieved 3 March 2022
- ^ Falbe, Jürgen; Bahrmann, Helmut; Lipps, Wolfgang; Mayer, Dieter (15 June 2000), «Alcohols, Aliphatic», in Wiley-VCH Verlag GmbH & Co. KGaA (ed.), Ullmann’s Encyclopedia of Industrial Chemistry, Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA, pp. a01_279, doi:10.1002/14356007.a01_279, ISBN 978-3-527-30673-2, archived from the original on 9 March 2022, retrieved 3 March 2022
- ^ Kloster-Jenson, Else (1971). «Preparation and physical characterization of pure hetero and homo dihaloacetylenes». Tetrahedron. 27 (1): 33–49. doi:10.1016/S0040-4020(01)92395-6.
- ^ a b Reppe, Walter; Kutepow, N; Magin, A (1969). «Cyclization of Acetylenic Compounds». Angewandte Chemie International Edition in English. 8 (10): 727–733. doi:10.1002/anie.196907271.
- ^ Trotuş, Ioan-Teodor; Zimmermann, Tobias; Schüth, Ferdi (14 November 2013). «Catalytic Reactions of Acetylene: A Feedstock for the Chemical Industry Revisited». Chemical Reviews. 114 (3): 1761–1782. doi:10.1021/cr400357r. PMID 24228942.
- ^ a b Viehe, Heinz Günter (1969). Chemistry of Acetylenes (1st ed.). New York: Marcel Dekker, inc. pp. 170–179 & 225–241. ISBN 978-0824716752.
- ^ Midland, M. M.; McLoughlin, J. I.; Werley, Ralph T. (Jr.) (1990). «Preparation and Use of Lithium Acetylide: 1-Methyl-2-ethynyl-endo-3,3-dimethyl-2-norbornanol». Organic Syntheses. 68: 14. doi:10.15227/orgsyn.068.0014.
- ^ Coffman, Donald D. (1940). «Dimethylethhynylcarbinol». Organic Syntheses. 40: 20. doi:10.15227/orgsyn.020.0040.
- ^ «Acetylene Specification». CFC StarTec LLC. Archived from the original on 11 March 2014. Retrieved 2 May 2012.
- ^ a b c d e «law.resource.org CGA g-1 2009 (incorporated by reference)» (PDF). Archived (PDF) from the original on 10 October 2016. Retrieved 30 November 2016.
- ^ Downie, N. A. (1997). Industrial Gases. London; New York: Blackie Academic & Professional. ISBN 978-0-7514-0352-7.
- ^ Korzun, Mikołaj (1986). 1000 słów o materiałach wybuchowych i wybuchu. Warszawa: Wydawnictwo Ministerstwa Obrony Narodowej. ISBN 83-11-07044-X. OCLC 69535236.
- ^ a b c «EIGA Code of Practice: Acetylene» (PDF). Archived from the original (PDF) on 1 December 2016. Retrieved 30 November 2016.
- ^ «OSHA 29 CFR 1910.102 Acetylene». Archived from the original on 1 December 2016. Retrieved 30 November 2016.
- ^ a b c «OSHA 29 CFR 1926.350 Gas Welding and cutting». Archived from the original on 1 December 2016. Retrieved 30 November 2016.
- ^ Special Hazards of Acetylene Archived 24 March 2016 at the Wayback Machine UNITED STATES DEPARTMENT OF LABOR Mine Safety and Health Administration – MSHA.
- ^ Daniel_Sarachick (16 October 2003). «ACETYLENE SAFETY ALERT» (PDF). Office of Environmental Health & Safety (EHS). Archived (PDF) from the original on 13 July 2018. Retrieved 27 September 2018.
- ^ a b «NFPA free access to 2017 edition of NFPA 70 (NEC)». Archived from the original on 1 December 2016. Retrieved 30 November 2016.
- ^ «NFPA Free Access to NFPA 497 – Recommended Practice for the Classification of Flammable Liquids, Gases, or Vapors and of Hazardous (Classified) Locations for Electrical Installations in Chemical Process Areas». Archived from the original on 1 December 2016. Retrieved 30 November 2016.
External links[edit]
Wikiquote has quotations related to Acetylene.
Wikimedia Commons has media related to Acetylene.
- Acetylene Production Plant and Detailed Process Archived 11 April 2015 at the Wayback Machine
- Acetylene at Chemistry Comes Alive!
- Acetylene, the Principles of Its Generation and Use at Project Gutenberg
- Movie explaining acetylene formation from calcium carbide and the explosive limits forming fire hazards
- Calcium Carbide & Acetylene at The Periodic Table of Videos (University of Nottingham)
- CDC – NIOSH Pocket Guide to Chemical Hazards – Acetylene
Фото: 66.RU от партнеров
В статье расскажем о том, в каких формах встречается ацетилен, как его получают и где используют.
Ацетилен или этин — органическое соединение (обозначается как C2H2), относящееся к алкинам. В нормальных условиях — бесцветный газ с резким запахом и повышенными показателями горючести. Ацетилен технический широко применяют в металлургии при сварке или резке металлов.
Физические и химические свойства ацетилена
По своему агрегатному состоянию вещество может быть:
- Жидким — обладает высокой степенью взрыво- и пожароопасности.
- Газообразным — узнаваемый запах дает преимущество перед O2 или N2, потому что легче определить утечку.
Соединение углерода и водорода обеспечивает несколько основных химических свойств:
- При добавлении воды, а также определенных катализаторов (например, солей ртути) можно производить уксусный альдегид.
- С изменением количества содержащегося водорода, варьируются важные кислотные параметры.
- При значительном повышении температуры и добавлении графита смесь полимеризуется в бензол.
С точки зрения физических свойств можно выделить температуру кипения −83,8 °C, достаточно слабую растворимость в воде, способность к выделению энергии при сжатии.
Способы получения и преимущества вещества
При промышленных масштабах производства ведущая технология — это пиролиз углеводородов. В частности, пропан-бутана или метана. Альтернатива — карбидный метод для получения чистого ацетилена. Но он значительно более энергоемок.
Популярность ацетилена для проведения сварочных работ обусловлена несколькими преимуществами:
- умеренная стоимость;
- повышенная температура пламени;
- возможность создания газа прямо на месте его применения.
Важное ограничение — взрывоопасность при работе с высококонцентрированным веществом. Надо наладить эффективное проветривание, контролировать состояние тары.
Сферы применения и безопасное хранение
Кроме металлургических техпроцессов, ацетилен используют при производстве:
- взрывчатки;
- топлива для ракетных двигателей;
- карбидных ламп;
- различных химических веществ — растворителей, каучука, этилового спирта и т. д.

Фото: 66.RU от партнеров
Для обеспечения безопасного хранения баллонов необходимо регулярно мониторить их состояние. Освидетельствование — обязательная процедура, которая позволяет своевременно выявить повреждения — коррозию, вмятины.
В складском помещении необходима постоянная вентиляция, а тара — надежно зафиксирована во избежание давления или ударов. Категорически запрещено расположение в непосредственной близости обогревательных приборов или других источников тепла.
Чтобы не сомневаться в приобретаемой продукции, обращайтесь в проверенные компании с постоянным контролем качества налаженной системой транспортировки.
Источник: https://tantal-d.ru/spravochnaya-informaciya/acetilen-svojstva-kak-poluchayut-gde-primenyayut/