Download Article
Download Article
Ammonia is a colorless gas and is commonly used in cleaning products and fertilizers. Even though it is found in the household, it can be harmful to your health. If you smell a pungent odor or suffer irritation, there may be ammonia present. To determine if ammonia is in the air or water, you can use test strips or an ammonia detector.
-
1
Purchase a container of ammonia test strips. These strips can be purchased at big box pet stores since they are used mostly to test levels in aquariums.[1]
They can also be purchased from many online retailers.- While 5-in-1 strips will test for nitrite, which is a byproduct of ammonia, they do not check ammonia levels. An ammonia test is conducted differently and you’ll need to purchase separate strips for that.
- Prices for ammonia strips can range from $9 to $25.
-
2
Dip the padded end of the test strip in the water for 30 seconds. This will ensure the pad absorbs enough water to get an accurate read of the ammonia levels. Move it in an up and down motion so water covers the entirety of the pad.[2]
- Shake off any excess water when you remove the strip so it does not drip.
Advertisement
-
3
Hold the strip flat with the padded side up for 30 seconds. During this step, the ammonia from the water is converting into gas. The end of the test strip at this time will start to change colors dependent on the level of ammonia present.[3]
-
4
Compare the color at the end of the strip to the scale on the container. Match the color of the strip as best as you can to the scale provided on the test strip packaging.[4]
The colors will vary depending on which brand of test strips that you’ve purchased, but many of the kits go from yellow (low levels of ammonia) to blue (high levels of ammonia).- If the result shows that the water has a high level of ammonia, you should take steps to remove it immediately.
Advertisement
-
1
Use an infrared (IR) sensor for long-term stability. IR sensors use infrared radiation to find the levels of ammonia in an area and can be purchased through online retailers. They do not need to be reset or calibrated as often and they do not degrade from large amounts of ammonia exposure, though they are large and need to be protected from changes in temperature.[5]
- Optical filters use infrared light to sense the ammonia levels.[6]
- ”Photo-acoustic” detectors use a small microphone to measure the changes in pressure to detect the ammonia molecules.[7]
- Optical filters use infrared light to sense the ammonia levels.[6]
-
2
Install a chemisorption (MOS) sensor to detect contaminants. A MOS sensor uses electricity to determine if there is ammonia present. This type of sensor is popular to use due to their extended operational life and being durable to high ammonia concentrations.[8]
MOS sensors can be purchased through online stores.- MOS sensors will detect other contaminants, such as carbon monoxide or hydrogen, so you may have false alarms if you are only trying to determine the ammonia levels.[9]
- MOS sensors will detect other contaminants, such as carbon monoxide or hydrogen, so you may have false alarms if you are only trying to determine the ammonia levels.[9]
-
3
Use a charge carrier injection (CI) sensor in humid conditions. CI sensors absorb ammonia molecules to detect the specific concentration. They are known to work for 5 years or more and are suitable in conditions where humidity often changes, and they can be purchased online.[10]
- CI sensors should only be used to detect high concentrations of ammonia and may not detect lower amounts.[11]
- CI sensors should only be used to detect high concentrations of ammonia and may not detect lower amounts.[11]
-
4
Install the sensor 1 to 3 feet (.3 to .9 meters) from the ceiling. Ammonia is lighter than air, so it will be more concentrated near the ceiling. Install the ammonia sensor near the ceiling for more accurate detection.[12]
- The maximum radius of a sensor is around 50 feet (15.24 meters), so use multiple if a large area needs to be covered.[13]
- The maximum radius of a sensor is around 50 feet (15.24 meters), so use multiple if a large area needs to be covered.[13]
Advertisement
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
-
Another option for detecting ammonia is through colorimetric tubes that trap and test the air.[14]
-
To avoid build-up of ammonia, be sure to properly ventilate rooms cleaned with ammonia-based products.
-
Always waft odors that you are unfamiliar with. Gently move the gas with your hand towards your nose rather than inhaling deeply.
Advertisement
-
Ammonia is toxic, even in small doses. If you believe there is a large amount of ammonia nearby, ventilate or evacuate the area.
-
Do not ingest ammonia solution. It can result in corrosive damage to your mouth and interior organs.
-
If you suspect ammonia is present, do not use any form of bleach. Bleach will combine with ammonia to make toxic gases called chloramines.[15]
Advertisement
References
About This Article
Thanks to all authors for creating a page that has been read 19,760 times.
Did this article help you?
Аммиак
Строение молекулы и физические свойства
В молекуле аммиака NH3 атом азота соединен тремя одинарными ковалентными полярными связями с атомами водорода:
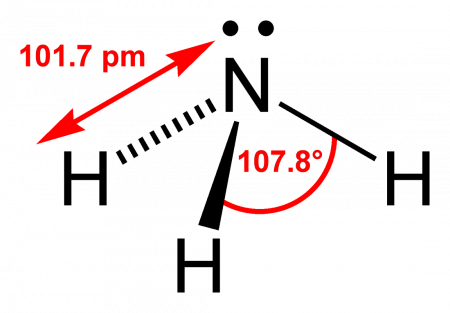
Геометрическая форма молекулы аммиака — правильная треугольная пирамида. Валентный угол H-N-H составляет 107,3о:
У атома азота в аммиаке на внешнем энергетическом уровне остается одна неподеленная электронная пара. Эта электронная пара оказывает значительное влиение на свойства аммиака, а также на его структуру. Электронная структура аммиака — тетраэдр , с атомом азота в центре:
Аммиак – бесцветный газ с резким характерным запахом. Ядовит. Весит меньше воздуха. Связь N-H — сильно полярная, поэтому между молекулами аммиака в жидкой фазе возникают водородные связи. При этом аммиак очень хорошо растворим в воде, т.к. молекулы аммиака образуют водородные связи с молекулами воды.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поскольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например, аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
2NH4Cl + Са(OH)2 → CaCl2 + 2NH3 + 2Н2O
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например, гидролиз нитрида кальция:
Ca3N2 + 6H2O → ЗСа(OH)2 + 2NH3
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
N2 + 3Н2 ⇄ 2NH3
Процесс проводят при температуре 500-550оС и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Химические свойства аммиака
1. В водном растворе аммиак проявляет основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H+), он превращается в ион аммония. Реакция может протекать и в водном растворе, и в газовой фазе:
:NH3 + H2O ⇄ NH4+ + OH–
Таким образом, среда водного раствора аммиака – щелочная. Однако аммиак – слабое основание. При 20 градусах один объем воды поглощает до 700 объемов аммиака.
Видеоопыт растворения аммиака в воде можно посмотреть здесь.
2. Как основание, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония.
Например, аммиак реагирует с серной кислотой с образованием либо кислой соли – гидросульфата аммония (при избытке кислоты), либо средней соли – сульфата аммония (при избытке аммиака):
NH3 + H2SO4 → NH4HSO4
2NH3 + H2SO4 → (NH4)2SO4
Еще один пример: аммиак взаимодействует с водным раствором углекислого газа с образованием карбонатов или гидрокарбонатов аммония:
NH3 + H2O + CO2 → NH4HCO3
2NH3 + H2O + CO2 → (NH4)2CO3
Видеоопыт взаимодействия аммиака с концентрированными кислотами – азотной, серной и и соляной можно посмотреть здесь.
В газовой фазе аммиак реагирует с летучим хлороводородом. При этом образуется густой белый дым – это выделяется хлорид аммония.
NH3 + HCl → NH4Cl
Видеоопыт взаимодействия аммиака с хлороводородом в газовой фазе (дым без огня) можно посмотреть здесь.
3. В качестве основания, водный раствор аммиака реагирует с растворами солей тяжелых металлов, образуя нерастворимые гидроксиды.
Например, водный раствор аммиака реагирует с сульфатом железа (II) с образованием сульфата аммония и гидроксида железа (II):
FeSO4 + 2NH3 + 2H2O → Fe(OH)2 + (NH4)2SO4
4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – аминокомплексы.
Например, хлорид меди (II) реагирует с избытком аммиака с образованием хлорида тетрамминомеди (II):
4NH3 + CuCl2 → [Cu(NH3)4]Cl2
Гидроксид меди (II) растворяется в избытке аммиака:
4NH3 + Cu(OH)2 → [Cu(NH3)4](OH)2
5. Аммиак горит на воздухе, образуя азот и воду:
4NH3 + 3O2 → 2N2 + 6H2O
Если реакцию проводить в присутствии катализатора (Pt), то азот окисляется до NO:
4NH3 + 5O2 → 4NO + 6H2O
6. За счет атомов водорода в степени окисления +1 аммиак может выступать в роли окислителя, например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием. С металлами реагирует только жидкий аммиак.
Например, жидкий аммиак реагирует с натрием с образованием амида натрия:
2NH3 + 2Na → 2NaNH2 + H2
Также возможно образование Na2NH, Na3N.
При взаимодействии аммиака с алюминием образуется нитрид алюминия:
2NH3 + 2Al → 2AlN + 3H2
7. За счет азота в степени окисления -3 аммиак проявляет восстановительные свойства. Может взаимодействовать с сильными окислителями — хлором, бромом, пероксидом водорода, пероксидами и оксидами некоторых металлов. При этом азот окисляется, как правило, до простого вещества.
Например, аммиак окисляется хлором до молекулярного азота:
2NH3 + 3Cl2 → N2 + 6HCl
Пероксид водорода также окисляет аммиак до азота:
2NH3 + 3H2O2 → N2 + 6H2O
Оксиды металлов, которые в электрохимическом ряду напряжений металлов расположены справа — сильные окислители. Поэтому они также окисляют аммиак до азота.
Например, оксид меди (II) окисляет аммиак:
2NH3 + 3CuO → 3Cu + N2 + 3H2O
| Аммиак | ||
|---|---|---|
|
||
| Хим. формула | NH3 | |
| Состояние | газ | |
| Молярная масса | 17.0306 г/моль | |
| Плотность | 0.7723 (н.у.) | |
| Энергия ионизации | 10,18 ± 0,01 эВ | |
| Температура | ||
| • плавления | -77.73 °C | |
| • кипения | -33.34 °C | |
| • самовоспламенения | 651 ± 1 °C | |
| Пределы взрываемости | 15 ± 1 об.% | |
| Критическая точка | 132.25 °C | |
| Энтальпия | ||
| • образования | -45.94 кДж/моль | |
| Давление пара | 8,5 ± 0,1 атм | |
| Константа диссоциации кислоты pKa | 9,21 ± 0,01 | |
| Растворимость | ||
| • в воде | 89.9 (при 0 °C) | |
| ГОСТ | ГОСТ 3760-79 ГОСТ 6221-90 ГОСТ 33045-2014 | |
| Рег. номер CAS | [7664-41-7] | |
| PubChem | 222 | |
| Рег. номер EINECS | 231-635-3 | |
| SMILES |
N |
|
| InChI |
1S/H3N/h1H3 QGZKDVFQNNGYKY-UHFFFAOYSA-N |
|
| RTECS | BO0875000 | |
| ChEBI | 16134 | |
| Номер ООН | 1005 | |
| ChemSpider | 217 | |
| Токсичность | токсичен, обладает удушающим действием | |
| Пиктограммы ECB |  |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Аммиак (нитрид водорода) — химическое соединение азота и водорода с формулой NH3, при нормальных условиях — бесцветный газ с резким характерным запахом.
Плотность аммиака почти вдвое меньше, чем у воздуха, ПДКр.з. 20 мг/м3 — IV класс опасности (малоопасные вещества) по ГОСТ 12.1.007. Растворимость NH3 в воде чрезвычайно велика — около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме воды. В холодильной технике носит название R717, где R — Refrigerant (хладагент), 7 — тип хладагента (неорганическое соединение), 17 — молекулярная масса.
Аммиак относится к числу важнейших продуктов химической промышленности, ежегодное его мировое производство превышает 180 млн тонн.
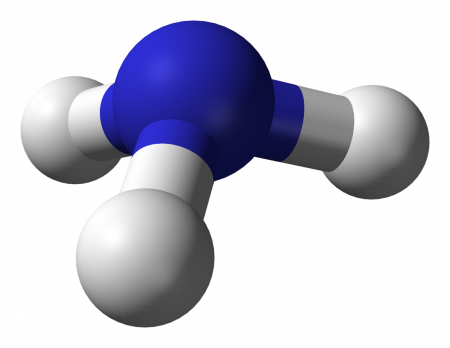
Молекула аммиака имеет форму треугольной пирамиды с атомом азота в вершине. Три неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N − H), четвёртая пара внешних электронов является неподелённой, она может образовать ковалентную связь по донорно-акцепторному механизму с ионом водорода, образуя ион аммония NH4+. Несвязывающее двухэлектронное облако строго ориентировано в пространстве, поэтому молекула аммиака обладает высокой полярностью, что приводит к его хорошей растворимости в воде.
В жидком аммиаке молекулы связаны между собой водородными связями. Сравнение физических свойств жидкого аммиака с водой показывает, что аммиак имеет более низкие температуры кипения (tкип −33,35 °C) и плавления (tпл −77,70 °C), а также меньшие плотность, вязкость (в 7 раз меньше вязкости воды), проводимость (почти не проводит электрический ток) и диэлектрическую проницаемость. Это в некоторой степени объясняется тем, что прочность водородных связей в жидком аммиаке существенно ниже, чем у воды; а также тем, что в молекуле аммиака имеется лишь одна пара неподелённых электронов, в отличие от двух пар в молекуле воды, что не даёт возможность образовывать разветвлённую сеть водородных связей между несколькими молекулами. Аммиак легко переходит в бесцветную жидкость с плотностью 681,4 кг/м³, сильно преломляющую свет. Подобно воде, жидкий аммиак сильно ассоциирован, главным образом за счёт образования водородных связей. Жидкий аммиак — хороший растворитель для очень большого числа органических, а также для многих неорганических соединений. Твёрдый аммиак — кубические кристаллы.
Содержание
- 1 Химические свойства
- 2 История
- 3 Происхождение названия
- 4 Жидкий аммиак
- 5 Комплексообразование
- 6 Биологическая роль
- 7 Физиологическое действие
- 8 Применение
- 9 Получение
- 9.1 Расходные нормы на тонну аммиака
- 10 Аммиак в медицине
- 11 Производители аммиака
- 12 Интересные факты
Химические свойства
- Благодаря наличию неподелённой электронной пары во многих реакциях аммиак выступает как основание Бренстеда или комплексообразователь (не следует путать понятия «нуклеофил» и «основание Бренстеда». Нуклеофильность определяется сродством к положительно заряженной частице. Основание имеет сродство к протону. Понятие «основание» является частным случаем понятия «нуклеофил»). Так, он присоединяет протон, образуя ион аммония:
-
- NH3 + H+ ⟶ NH4+.
- Водный раствор аммиака («нашатырный спирт») имеет слабощелочную реакцию из-за протекания процесса:
-
- NH3 + H2O ⟶ NH4+ + OH− , Ko=1,8⋅10−5.
- Взаимодействуя с кислотами, даёт соответствующие соли аммония:
-
- NH3 + HNO3 ⟶ NH4NO3.
- Аммиак также является очень слабой кислотой (в 10 000 000 000 раз более слабой, чем вода), способен образовывать с металлами соли — амиды, имиды и нитриды. Соединения, содержащие ионы NH2−, называются амидами, NH2− — имидами, а N3− — нитридами. Амиды щелочных металлов получают, действуя на них аммиаком:
-
- 2NH3 + 2K ⟶ 2KNH2 + H2.
Амиды, имиды и нитриды ряда металлов образуются в результате некоторых реакций в среде жидкого аммиака. Нитриды можно получить нагреванием металлов в атмосфере азота.
Амиды металлов являются аналогами гидроксидов. Эта аналогия усиливается тем, что ионы OH− и NH2−, а также молекулы H2O и NH3 изоэлектронны. Амиды являются более сильными основаниями, чем гидроксиды, а следовательно, подвергаются в водных растворах необратимому гидролизу:
-
- NaNH2 + H2O ⟶ NaOH + NH3.
и в спиртах:
-
- KNH2 + C2H5OH ⟶ C2H5OK + NH3.
Подобно водным растворам щелочей, аммиачные растворы амидов хорошо проводят электрический ток, что обусловлено диссоциацией:
-
- KNH2 ⇄ K+ + NH2− .
Фенолфталеин в этих растворах окрашивается в малиновый цвет, при добавлении кислот происходит их нейтрализация. Растворимость амидов изменяется в такой же последовательности, что и растворимость гидроксидов: LiNH2 — нерастворим, NaNH2 — малорастворим, KNH2, RbNH2 и CsNH2 — хорошо растворимы.
- При нагревании аммиак разлагается, проявляет восстановительные свойства. Так, он горит в атмосфере кислорода, образуя воду и азот. Окисление аммиака воздухом на платиновом катализаторе даёт оксиды азота, что используется в промышленности для получения азотной кислоты:
-
- 2NH3 →1200—1300∘C N2 + 3H2 (реакция обратима),
- 4NH3 + 3O2 ⟶ 2N2 + 6H2O (без катализатора, при повышенной температуре),
- 4NH3 + 5O2 ⟶ 4NO + 6H2O (в присутствии катализатора, при повышенной температуре).
На восстановительной способности NH3 основано применение нашатыря NH4Cl для очистки поверхности металла от оксидов при их пайке:
-
- 3CuO + 2NH4Cl ⟶ 3Cu + 3H2O + 2HCl + N2.
Окисляя аммиак гипохлоритом натрия в присутствии желатина, получают гидразин:
-
- 2NH3 + NaOCl ⟶ N2H4 + NaCl + H2O.
- Галогены (хлор, йод) образуют с аммиаком опасные взрывчатые вещества — галогениды азота (хлористый азот, иодистый азот).
- С галогеноалканами аммиак вступает в реакцию нуклеофильного присоединения, образуя замещённый ион аммония (способ получения аминов):
-
- NH3 + CH3Cl ⟶ [CH3NH3]Cl (гидрохлорид метиламмония).
- С карбоновыми кислотами, их ангидридами, галогенангидридами, эфирами и другими производными даёт амиды. С альдегидами и кетонами — основания Шиффа, которые возможно восстановить до соответствующих аминов (восстановительное аминирование).
- При 1000 °C аммиак реагирует с углём, образуя синильную кислоту HCN и частично разлагаясь на азот и водород. Также он может реагировать с метаном, образуя ту же самую синильную кислоту:
-
- 2CH4 + 2NH3 + 3O2 ⟶ 2HCN + 6H2O,
- NH4OH ⟶ NH3 + H2O.
- C солями меди и с серебром образует комплексные соли-аммиакаты
-
- Cu(NO3)2 + 4NH3 ⟶ [Cu(NH3)4](NO3)2,
- Cu3(PO4)2 + 12NH3 ⟶ [Cu(NH3)4]3(PO4)2,
- Cu(CH3COO)2 + 4NH3 ⟶ [Cu(NH3)4](CH3COO)2,
- AgNO3 + 2NH3 ⟶ [Ag(NH3)2]NO3.
Колонна синтеза аммиака, построенная в 1921 году BASF в Оппау, ныне расположена при университете Карлсруэ.
История
Аммиак был впервые выделен в чистом виде Дж. Пристли в 1774 году, который назвал его «щелочной воздух» (англ. alkaline air). Через одиннадцать лет, в 1785 году К. Бертолле установил точный химический состав аммиака. С того времени в мире начались исследования по получению аммиака из азота и водорода. Аммиак был очень нужен для синтеза соединений азота, поскольку получение их из чилийской селитры ограничивалось постепенным истощением запасов последней. Проблема уменьшения запасов селитры обострилась к концу XIX века. Только в начале XX века удалось изобрести процесс синтеза аммиака, пригодный для промышленности. Это осуществил Ф. Габер, начавший трудиться над этой задачей в 1904 году и к 1909 году создавший небольшой контактный аппарат, в котором использовал повышенное давление (в соответствии с принципом Ле-Шателье) и катализатор из осмия. 2 июля 1909 года Габер устроил испытания аппарата в присутствии К. Боша и А. Митташа, оба — от Баденского анилинового и содового завода (BASF), и получил аммиак. К. Бош к 1911 году создал крупномасштабную версию аппарата для BASF, а затем был построен и 9 сентября 1913 года вступил в строй первый в мире завод по синтезу аммиака, который был расположен в Оппау (ныне район в черте города Людвигсхафен-на-Рейне) и принадлежал BASF. В 1918 году Ф. Габер стал лауреатом Нобелевской премии по химии «за синтез аммиака из составляющих его элементов». В России и СССР первая партия синтетического аммиака была получена в 1928 году на Чернореченском химическом комбинате.
Происхождение названия
Аммиак (в европейских языках его название звучит как «аммониак») своим названием обязан оазису Аммона в Северной Африке, расположенному на перекрёстке караванных путей. В жарком климате мочевина (NH2)2CO, содержащаяся в продуктах жизнедеятельности животных, разлагается особенно быстро. Одним из продуктов разложения и является аммиак. По другим сведениям, аммиак получил своё название от древнеегипетского слова амониан. Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали минерал нашатырь (NH4Cl), который при нагревании испаряет аммиак.
Жидкий аммиак
Жидкий аммиак, хотя и в незначительной степени, диссоциирует на ионы (автопротолиз), в чём проявляется его сходство с водой:
-
- 2NH3 ⟶ NH4+ + NH2−.
Константа самоионизации жидкого аммиака при −50 °C составляет примерно 10−33 (моль/л)².
Жидкий аммиак, как и вода, является сильным ионизирующим растворителем, в котором растворяется ряд активных металлов: щелочные, щёлочноземельные, Mg, Al, а также Eu и Yb. В отличие от воды с жидким аммиаком данные металлы не реагируют, а именно растворяются и могут быть выделены в исходном виде при испарении растворителя. Растворимость щелочных металлов в жидком NH3 составляет несколько десятков процентов. В жидком аммиаке NH3 также растворяются некоторые интерметаллиды, содержащие щелочные металлы, например, Na4Pb9.
Разбавленные растворы металлов в жидком аммиаке окрашены в синий цвет, концентрированные растворы имеют металлический блеск и похожи на бронзу. При испарении аммиака щелочные металлы выделяются в чистом виде, а щелочноземельные — в виде комплексов с аммиаком [Э(NH3)6], обладающих металлической проводимостью. При слабом нагревании эти комплексы разлагаются на металл и NH3.
Растворённый в NH3 металл постепенно реагирует с образованием амида:
-
- 2Na + 2NH3 ⟶ 2NaNH2 + H2 .
Получающиеся в результате реакции с аммиаком амиды металлов содержат отрицательный ион NH2−, который также образуется при самоионизации аммиака. Таким образом, амиды металлов являются аналогами гидроксидов. Скорость реакции возрастает при переходе от Li к Cs. Реакция значительно ускоряется в присутствии даже небольших примесей H2O.
Металлоаммиачные растворы обладают металлической проводимостью, в них происходит распад атомов металла на положительные ионы и сольватированные электроны, окружённые молекулами NH3. Металлоаммиачные растворы, в которых содержатся свободные электроны, являются сильнейшими восстановителями.
Комплексообразование
Благодаря своим электронодонорным свойствам молекулы NH3 могут входить в качестве лиганда в комплексные соединения. Так, введение избытка аммиака в растворы солей d-металлов приводит к образованию их аминокомплексов:
-
- CuSO4 + 4NH3 ⟶ [Cu(NH3)4]SO4.
- Ni(NO3)2 + 6NH3 ⟶ [Ni(NH3)6](NO3)2.
Комплексообразование обычно сопровождается изменением окраски раствора. Так, в первой реакции голубой цвет (CuSO4) переходит в тёмно-синий (окраска комплекса), а во второй реакции окраска изменяется из зелёной ( Ni(NO3)2 ) в сине-фиолетовую. Наиболее прочные комплексы с NH3 образуют хром и кобальт в степени окисления +3.
Биологическая роль
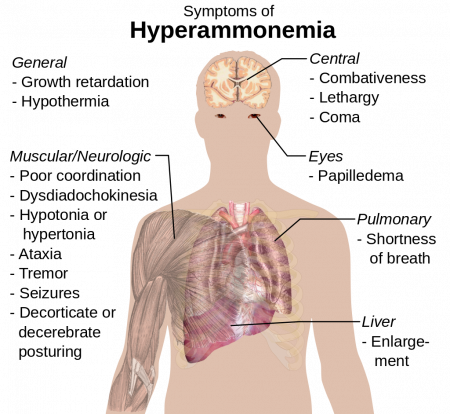
Основные симптомы гипераммониемии (повышения уровня эндогенного аммиака до токсических концентраций).
Аммиак является важным источником азота для живых организмов. Несмотря на высокое содержание свободного азота в атмосфере (более 75 %), очень мало живых существ способны использовать свободный, нейтральный двухатомный азот атмосферы, газ N2. Поэтому для включения азота атмосферы в биологический оборот, в частности в синтез аминокислот и нуклеотидов, необходим процесс, который называется «азотфиксацией». Некоторые растения зависят от доступности аммиака и других нитрогенных соединений, образующихся в почве в результате разложения органических (растительных и животных) остатков. Другие, такие как бобовые, используют преимущества симбиоза с азотфиксирующими бактериями (ризобиями), которые способны синтезировать аммиак из атмосферного азота с помощью ферментов, называемых нитрогеназами. И хотя маловероятно, что когда-либо будут изобретены биомиметические методы, способные конкурировать по производительности с химическими методами производства аммиака из азота, тем не менее, учёные прилагают большие усилия к тому, чтобы как можно лучше понять механизмы биологической фиксации азота. Научный интерес к этой проблеме отчасти мотивируется необычной структурой активного каталитического центра азотфиксирующего фермента (нитрогеназы), которая содержит необычный биметаллический молекулярный ансамбль Fe7MoS9.
Аммиак является также конечным побочным продуктом метаболизма аминокислот, а именно продуктом их дезаминирования, катализируемого такими ферментами, как глутамат-дегидрогеназа. Экскреция аммиака в неизменённом виде является обычным путём детоксикации аммиака у водных существ (рыбы, водные беспозвоночные, отчасти амфибии). У млекопитающих, включая человека, аммиак обычно быстро превращается в мочевину, которая гораздо менее токсична и, в частности, имеет менее щелочную реакцию и меньшую реакционную способность в качестве восстановителя. Мочевина является основным компонентом сухого остатка мочи. Большинство птиц, пресмыкающихся, насекомых, паукообразных, однако, выделяют в качестве основного нитрогенного остатка не мочевину, а мочевую кислоту.
Аммиак также играет важную роль как в нормальной, так и в патологической физиологии животных. Аммиак производится в процессе нормального метаболизма аминокислот, однако весьма токсичен в высоких концентрациях. Печень животных преобразует аммиак в мочевину с помощью серии последовательных реакций, известных как цикл мочевины. Нарушение функции печени, такое, например, какое наблюдается при циррозе печени, может приводить к нарушению способности печени обезвреживать аммиак и образовывать из него мочевину, и, как следствие, к повышению уровня аммиака в крови, состоянию, называемому гипераммониемия. К аналогичному результату — повышению уровня свободного аммиака в крови и развитию гипераммониемии — приводит наличие врождённых генетических дефектов в ферментах цикла мочевины, таких, например, как орнитин-карбамилтрансфераза. К тому же результату может приводить нарушение выделительной функции почек при тяжёлой почечной недостаточности и уремии: вследствие задержки выделения мочевины её уровень в крови возрастает настолько, что «цикл мочевины» начинает работать «в обратную сторону» — избыток мочевины гидролизуется обратно почками в аммиак и углекислый газ, и, как следствие, уровень аммиака в крови возрастает. Гипераммониемия привносит свой вклад в нарушения сознания и развитие сопорозных и коматозных состояний при печёночной энцефалопатии и уремии, а также в развитие неврологических нарушений, часто наблюдаемых у больных с врождёнными дефектами ферментов цикла мочевины или с органическими ацидуриями.
Менее выраженная, однако клинически существенная, гипераммониемия может наблюдаться при любых процессах, при которых наблюдается повышенный катаболизм белков, например, при обширных ожогах, синдроме сдавления или размозжения тканей, обширных гнойно-некротических процессах, гангрене конечностей, сепсисе и т. д., а также при некоторых эндокринных нарушениях, таких, как сахарный диабет, тяжёлый тиреотоксикоз. Особенно высока вероятность возникновения гипераммониемии при этих патологических состояниях в тех случаях, когда патологическое состояние, помимо повышенного катаболизма белков, вызывает также выраженное нарушение детоксицирующей функции печени или выделительной функции почек.
Аммиак важен для поддержания нормального кислотно-щелочного баланса крови. После образования аммиака из глютамина, альфа-кетоглутарат может быть далее расщеплён с образованием двух молекул гидрокарбоната, которые затем могут использоваться как буфер для нейтрализации кислот, поступающих с пищей. Полученный из глютамина аммиак затем выделяется с мочой (как непосредственно, так и в виде мочевины), что, с учётом образования двух молекул бикарбоната из кетоглутарата, приводит в сумме к потере кислот и сдвигу pH крови в щелочную сторону. Кроме того, аммиак может диффундировать через почечные канальцы, соединяться с ионом водорода и экскретироваться совместно с ним ( NH3 + H+ ⟶ NH4+ ), и тем самым ещё больше способствовать выведению кислот из организма.
Аммиак и ионы аммония являются токсическим побочным продуктом метаболизма у животных. У рыб и водных беспозвоночных аммиак выделяется непосредственно в воду. У млекопитающих (включая водных млекопитающих), земноводных и у акул аммиак в цикле мочевины преобразуется в мочевину, поскольку мочевина гораздо менее токсична, менее химически реакционноспособна и может более эффективно «храниться» в организме до момента возможности её выделения. У птиц и пресмыкающихся (рептилий) аммиак, образовавшийся в процессе метаболизма, преобразуется в мочевую кислоту, которая является твёрдым остатком и может быть выделена с минимальными потерями воды.
Физиологическое действие

Аммиак токсичен. По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Аммиак обладает как местным, так и резорбтивным действием.
Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это человек и воспринимает как резкий запах. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюнктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи. При соприкосновении сжиженного аммиака и его растворов с кожей возникает жжение, возможен химический ожог с пузырями, изъязвлениями. Кроме того, сжиженный аммиак при испарении поглощает тепло, и при соприкосновении с кожей возникает обморожение различной степени. Запах аммиака ощущается при концентрации 37 мг/м³.
Предельно допустимая концентрация в воздухе рабочей зоны производственного помещения (ПДКр.з.) составляет 20 мг/м³. В атмосферном воздухе населённых пунктов и в жилых помещениях среднесуточная концентрация аммиака (ПДКс.с.) не должна превышать 0,04 мг/м³. Максимальная разовая концентрация в атмосфере — 0,2 мг/м³. Таким образом, ощущение запаха аммиака свидетельствует о превышении допустимых норм.
Раздражение зева проявляется при содержании аммиака в воздухе 280 мг/м³, глаз — 490 мг/м³. При действии в очень высоких концентрациях аммиак вызывает поражение кожи: 7—14 г/м³ — эритематозный, 21 г/м³ и более — буллёзный дерматит. Токсический отёк лёгких развивается при воздействии аммиака в течение часа с концентрацией 1,5 г/м³. Кратковременное воздействие аммиака в концентрации 3,5 г/м³ и более быстро приводит к развитию общетоксических эффектов.
В мире максимальная концентрация аммиака в атмосфере (больше 1 мг/м³) наблюдается на Индо-Гангской равнине, в Центральной долине США и в Туркестанской (ранее — Южно-Казахстанской) области Казахстана.
Применение
В основном используется для производства азотных удобрений (нитрат и сульфат аммония, мочевина), взрывчатых веществ и полимеров, азотной кислоты, соды (по аммиачному методу) и других продуктов химической промышленности. Жидкий аммиак используют в качестве растворителя.
В холодильной технике используется в качестве холодильного агента (R717) (см. Аммиачная холодильная установка).
В медицине 10 % раствор аммиака, чаще называемый нашатырным спиртом, применяется при обморочных состояниях (для возбуждения дыхания), для стимуляции рвоты, а также наружно — невралгии, миозиты, укусах насекомых, для обработки рук хирурга. При неправильном применении может вызвать ожоги пищевода и желудка (в случае приёма неразведённого раствора), рефлекторную остановку дыхания (при вдыхании в высокой концентрации).
Применяют местно, ингаляционно и внутрь. Для возбуждения дыхания и выведения больного из обморочного состояния осторожно подносят небольшой кусок марли или ваты, смоченный нашатырным спиртом, к носу больного (на 0,5—1 с). Внутрь (только в разведении) для индукции рвоты. При укусах насекомых — в виде примочек; при невралгиях и миозитах — растирания аммиачным линиментом. В хирургической практике разводят в тёплой кипячёной воде и моют руки.
Поскольку аммиак является слабым основанием, при взаимодействии с кислотами он их нейтрализует.
Физиологическое действие нашатырного спирта обусловлено резким запахом аммиака, который раздражает специфические рецепторы слизистой оболочки носа и способствует возбуждению дыхательного и сосудодвигательного центров мозга, вызывая учащение дыхания и повышение артериального давления.
Противоморозная добавка для сухих строительных растворов, относящаяся к ускорителям. Рекомендуемая дозировка — 2…8 % массы компонентов сухой смеси в зависимости от температуры применения. Аммиачная вода NH3 ⋅ H2O — продукт, представляющий собой газообразный аммиак NH3, растворённый в воде.
Получение
Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота:
-
- N2 + 3H2 ⇄ 2NH3 + 91,84 кДж.
Это так называемый процесс Габера (немецкий физик, разработал физико-химические основы метода).
Реакция происходит с выделением тепла и понижением объёма. Следовательно, исходя из принципа Ле-Шателье, реакцию следует проводить при возможно низких температурах и при высоких давлениях — тогда равновесие будет смещено вправо. Однако скорость реакции при низких температурах ничтожно мала, а при высоких увеличивается скорость обратной реакции. Проведение реакции при очень высоких давлениях требует создания специального, выдерживающего высокое давление оборудования, а значит, и больших капиталовложений. Кроме того, равновесие реакции даже при 700 °C устанавливается слишком медленно для практического её использования.
Выход аммиака (в объёмных процентах) за один проход катализатора при различных температурах и давлении имеет следующие значения:
| 100 ат | 300 ат | 1000 ат | 1500 ат | 2000 ат | 3500 ат | |
|---|---|---|---|---|---|---|
| 400 °C | 25,12 | 47,00 | 79,82 | 88,54 | 93,07 | 97,73 |
| 450 °C | 16,43 | 35,82 | 69,69 | 84,07 | 89,83 | 97,18 |
| 500 °C | 10,61 | 26,44 | 57,47 | Нет данных | ||
| 550 °C | 6,82 | 19,13 | 41,16 |
Применение катализатора (пористое железо с примесями Al2O3 и K2O) позволило ускорить достижение равновесного состояния. Интересно, что при поиске катализатора на эту роль пробовали более 20 тысяч различных веществ.
Учитывая все вышеприведённые факторы, процесс получения аммиака проводят при следующих условиях: температура 500 °C, давление 350 атмосфер, катализатор. Выход аммиака при таких условиях составляет около 30 %. В промышленных условиях использован принцип циркуляции — аммиак удаляют охлаждением, а непрореагировавшие азот и водород возвращают в колонну синтеза. Это оказывается более экономичным, чем достижение более высокого выхода реакции за счёт повышения давления.
Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония:
-
- NH4Cl + NaOH ⟶ NH3↑ + NaCl + H2O.
Обычно лабораторным способом аммиак получают слабым нагреванием смеси хлорида аммония с гашёной известью.
-
- 2NH4Cl + Ca(OH)2 ⟶ CaCl2 + 2NH3↑ + 2H2O.
Для осушения аммиака его пропускают через смесь извести с едким натром.
Очень сухой аммиак можно получить, растворяя в нём металлический натрий и впоследствии перегоняя. Это лучше делать в системе, изготовленной из металла под вакуумом. Система должна выдерживать высокое давление (при комнатной температуре давление насыщенных паров аммиака около 10 атмосфер). В промышленности аммиак осушают в абсорбционных колоннах.
Расходные нормы на тонну аммиака
На производство одной тонны аммиака в России расходуется в среднем 1200 н.м³ природного газа, в Европе — 900 н.м³.
Белорусский «Гродно Азот» расходует 1200 н.м³ природного газа на тонну аммиака, после модернизации ожидается снижение расхода до 876 н.м³.
Украинские производители потребляют от 750 н.м³ до 1170 н.м³ природного газа на тонну аммиака.
По технологии UHDE заявляется потребление 6,7—7,4 Гкал энергоресурсов на тонну аммиака.
Аммиак в медицине
При укусах насекомых аммиак применяют наружно в виде примочек. 10 % водный раствор аммиака известен как нашатырный спирт.
Возможны побочные действия: при продолжительной экспозиции (ингаляционное применение) аммиак может вызвать рефлекторную остановку дыхания.
Местное применение противопоказано при дерматитах, экземах, других кожных заболеваниях, а также при открытых травматических повреждениях кожных покровов.
При случайном поражении аммиаком слизистой оболочки глаза, промыть глаза водой (по 15 раз через каждые 10 мин) или 5 % раствором борной кислоты, не растирая глаза. Масла и мази не применяют. При поражении носа и глотки — 0,5 % раствор лимонной кислоты или натуральные соки. В случае приёма внутрь пить воду, фруктовый сок, молоко, лучше — 0,5 % раствор лимонной кислоты или 1 % раствор уксусной кислоты до полной нейтрализации содержимого желудка.
Взаимодействие с другими лекарственными средствами неизвестно.
Производители аммиака
Производители аммиака в России
| Компания | 2006, тыс. т | 2007, тыс. т |
|---|---|---|
| ОАО «Тольяттиазот» | 2 634 | 2 403,3 |
| ОАО НАК «Азот» | 1 526 | 1 514,8 |
| ОАО «Акрон» | 1 526 | 1 114,2 |
| ОАО «Невинномысский азот», г. Невинномысск | 1 065 | 1 087,2 |
| ОАО «Минудобрения» (г. Россошь) | 959 | 986,2 |
| ОАО «АЗОТ» г. Кемерово | 854 | 957,3 |
| ОАО «Азот» | 869 | 920,1 |
| ОАО «ЗМУ КЧХК» | 956 | 881,1 |
| ОАО Череповецкий «Азот» | 936,1 | 790,6 |
| ЗАО «Куйбышевазот» | 506 | 570,4 |
| ОАО «Газпром Нефтехим Салават» | 492 | 512,8 |
| «Минеральные удобрения» (г. Пермь) | 437 | 474,6 |
| ОАО «Дорогобуж» | 444 | 473,9 |
| ОАО «Воскресенские минеральные удобрения» | 175 | 205,3 |
| ОАО «Щекиноазот» | 58 | 61,1 |
| АО «Аммоний» (г. Менделеевск) | — | — |
| Итого | 13 437,1 | 12 952,9 |
На долю России приходится около 9 % мирового выпуска аммиака. Россия — один из крупнейших мировых экспортёров аммиака. На экспорт поставляется около 25 % от общего объёма производства аммиака, что составляет около 16 % мирового экспорта.
По итогам 2014 года в России было произведено 14,8 млн тонн аммиака (+2 % к 2013 году) (по данным Росстата). Производство аммиака в России сконцентрировано в Приволжском федеральном округе (46 % по итогам 2014 года). Далее следуют Центральный федеральный округ (23 %) и Северо-Западный федеральный округ (16 %).
Порядка 25 % российского производства аммиака отправляется на экспорт. Так, в 2014 году объём российского экспорта аммиака (по данным ФТС) составил составил 3,6 млн тонн (+6 % к 2013 году) на сумму 1,6 млрд долл. США.
Ключевыми странами-получателями в 2014 году стали Украина, Финляндия и Литва.
Производители аммиака на Украине
| Компания | 2008 |
|---|---|
| ПАО «Концерн Стирол» | 1 331 |
| Одесский припортовый завод | 1 128 |
| Северодонецкое объединение Азот | 1 015 |
| «Азот» (Черкассы) | 778 |
| «Днепроазот» | 515 |
| «Ровноазот» | 382 |
| Итого | 5 149 |
Интересные факты
- Пары нашатырного спирта способны изменять окраску цветов. Например, голубые и синие лепестки становятся зелёными, ярко-красные — чёрными.
- Облака Юпитера состоят из аммиака.
- Некоторые цветы, не имеющие запаха от природы, после обработки аммиаком начинают благоухать. Например, приятный аромат приобретают астры.
- Нашатырный спирт реагирует с йодом с образованием крайне нестабильного аддукта (йодистый азот) в сухом кристаллическом состоянии, что используется как эффектный химический опыт.
Содержание
- Аммиак: получение и свойства
- Аммиак
- Строение молекулы и физические свойства
- Способы получения аммиака
- Химические свойства аммиака
- Как распознать аммиак тремя способами
- Урок-лекция по теме «Аммиак»
- 1. Состав молекулы аммиака
- 2. Строение молекулы аммиака
- 3. Водородная связь
- 4. Физические свойства аммиака
- 5. Химические свойства аммиака
- 6. Получение аммиака
- 7. Применение аммиака
- 8. Закрепление.
- 9. Домашнее задание
Аммиак: получение и свойства
Аммиак
Строение молекулы и физические свойства
В молекуле аммиака NH3 атом азота соединен тремя одинарными ковалентными полярными связями с атомами водорода:
Геометрическая форма молекулы аммиака — правильная треугольная пирамида. Валентный угол H-N-H составляет 107,3 о :
У атома азота в аммиаке на внешнем энергетическом уровне остается одна неподеленная электронная пара. Эта электронная пара оказывает значительное влиение на свойства аммиака, а также на его структуру. Электронная структура аммиака — тетраэдр , с атомом азота в центре:
Аммиак – бесцветный газ с резким характерным запахом. Ядовит. Весит меньше воздуха. Связь N-H — сильно полярная, поэтому между молекулами аммиака в жидкой фазе возникают водородные связи. При этом аммиак очень хорошо растворим в воде, т.к. молекулы аммиака образуют водородные связи с молекулами воды.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например , аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например , гидролиз нитрида кальция:
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Химические свойства аммиака
1. В водном растворе аммиак проявляет основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион аммония. Реакция может протекать и в водном растворе, и в газовой фазе:
Таким образом, среда водного раствора аммиака – щелочная. Однако аммиак – слабое основание . При 20 градусах один объем воды поглощает до 700 объемов аммиака.
Видеоопыт растворения аммиака в воде можно посмотреть здесь.
2. Как основание, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония.
Например , аммиак реагирует с серной кислотой с образованием либо кислой соли – гидросульфата аммония (при избытке кислоты), либо средней соли – сульфата аммония (при избытке аммиака):
Еще один пример : аммиак взаимодействует с водным раствором углекислого газа с образованием карбонатов или гидрокарбонатов аммония:
Видеоопыт взаимодействия аммиака с концентрированными кислотами – азотной, серной и и соляной можно посмотреть здесь.
В газовой фазе аммиак реагирует с летучим хлороводородом. При этом образуется густой белый дым – это выделяется хлорид аммония.
NH3 + HCl → NH4Cl
Видеоопыт взаимодействия аммиака с хлороводородом в газовой фазе (дым без огня) можно посмотреть здесь.
3. В качестве основания, водный раствор аммиака реагирует с растворами солей тяжелых металлов , образуя нерастворимые гидроксиды.
Например , водный раствор аммиака реагирует с сульфатом железа (II) с образованием сульфата аммония и гидроксида железа (II):
4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – аминокомплексы.
Например , хлорид меди (II) реагирует с избытком аммиака с образованием хлорида тетрамминомеди (II):
Гидроксид меди (II) растворяется в избытке аммиака:
5. Аммиак горит на воздухе , образуя азот и воду:
Если реакцию проводить в присутствии катализатора (Pt), то азот окисляется до NO:
6. За счет атомов водорода в степени окисления +1 аммиак может выступать в роли окислителя , например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием . С металлами реагирует только жидкий аммиак.
Например , жидкий аммиак реагирует с натрием с образованием амида натрия:
Также возможно образование Na2NH, Na3N.
При взаимодействии аммиака с алюминием образуется нитрид алюминия:
2NH3 + 2Al → 2AlN + 3H2
7. За счет азота в степени окисления -3 аммиак проявляет восстановительные свойства. Может взаимодействовать с сильными окислителями — хлором, бромом, пероксидом водорода, пероксидами и оксидами некоторых металлов. При этом азот окисляется, как правило, до простого вещества.
Например , аммиак окисляется хлором до молекулярного азота:
Пероксид водорода также окисляет аммиак до азота:
Оксиды металлов , которые в электрохимическом ряду напряжений металлов расположены справа — сильные окислители. Поэтому они также окисляют аммиак до азота.
Например , оксид меди (II) окисляет аммиак:
2NH3 + 3CuO → 3Cu + N2 + 3H2O
Источник
Как распознать аммиак тремя способами
Часть I
1. Строение молекулы.
2. Физические свойства: газ без цвета с резким запахом.
3. Водородная связь – это межмолекулярные или внутримолекулярные связи между атомом водорода и атомом сильно ЭО атомом.
4. Получение, собирание и распознавание NH3.
1) Напишите уравнение получения аммиака в лаборатории в молекулярной и ионной формах:
2) Получение в промышленности:
Укажите верный способ собирания аммиака, ответ поясните.
б, т.к. NH3 легче воздуха, он будет собираться в пробирке в верхней части.
3) Как можно тремя разными способами распознать аммиак?
а) запах
б) посинение влажной лакмусовой бумаги
в) белый дым на палочке над HCl.
5. Химические свойства.
1) Является сильным восстановителем, потому что N -3 может только отдавать электроны.
Восстановительные свойства проявляет по отношению (запишите уравнения реакций и рассмотрите с позиций окисления-восстановления):
— к кислороду:
— к оксидам металлов:
2) Взаимодействует с водой, образуя непрочное основание – гидрат аммиака NH3*H2O, который, как слабый электролит, незначительно диссоциирует:
3) Взаимодействует с кислотами, образуя соли аммония по донорно-акцепторному механизму:
Различают два механизма образования ковалентной связи:
1) обменный;
2) донорно-акцепторный.
Часть II
1. Заполните схему «Применение аммиака».
2. Зарисуйте схему промышленного синтеза аммиака, укажите сырьё и происходящие процессы.
3. Заполните схему «Типы химических связей».
4. Предложите три молекулярных уравнения, отражающих качественную реакцию на ион аммония:
5. Заполните таблицу.
6. Какой объём аммиака образуется при взаимодействии 535 г 20-%-го раствора аммония с щёлочью?
7. Запишите уравнения реакций для следующих переходов:
Источник
Урок-лекция по теме «Аммиак»
Разделы: Химия
Цели: формирование общеучебных умений и навыков.
образовательные: изучить строение и свойства аммиака; изучить новый вид связи – водородную; рассмотреть донорно-акцепторный механизм образования химической связи; развить умения по составлению окислительно-восстановительного баланса уравнений реакций, уравнивание МЭБ.
воспитательные: формирование умений работать с учебной и дополнительной литературой по составлению конспекта; провести профориентационную информацию.
познавательные: развивать интерес к предмету, умение высказывать свои мысли, логически рассуждать, соблюдать технику безопасности при встрече с аммиаком в быту.
Технологическая карта урока на столах учащихся (Приложение № 1); оборудование для химического эксперимента (аммиачная вода, кристаллические хлорид аммония и гидроксид кальция, фенолфталеин, лакмусовая бумажка, прибор для получения газов, стеклянные палочки, соляная кислота конц.); компьютерная презентация (Приложение № 2).
1. Организационный момент.
Вначале урока необходимо настроить учащихся на наиболее сложный тип урока-лекцию. Объяснить, что урок проходит строго по плану на столах учащихся и требует от них большой концентрации. Все вопросы, которые необходимо рассмотреть зафиксированы в технологической карте, и в ходе лекции они всегда будут перед глазами и не требуют запоминания. Для лучшего усвоения составляется конспект в технологической карте. В ходе лекции используются различные формы: компьютерная презентация, работа с учебной литературой, демонстрационные опыты.
2. Изучение нового материала.
План лекции (слайд № 2)
1. Состав молекулы аммиака
2. Строение молекулы аммиака
3. Водородная связь
4. Физические свойства аммиака
5. Химические свойства аммиака
6. Получение аммиака
7. Применение аммиака
9. Домашнее задание
1. Состав молекулы аммиака
Учитель начинает свой рассказ об аммиаке с обращения внимания на несоответствие написания химической формулы аммиака принятым правилам степени окисления.
- запишите молекулярную формулу аммиака;
- укажите степень окисления элементов;
- дайте химически верное название и запись формулы аммиака.
NH3 = H3 +1 N -3 нитрид водорода (слайд № 3)
2. Строение молекулы аммиака
Учащиеся самостоятельно определяют тип химической связи в молекуле аммиака. Представляют схему образования химической связи в молекуле.
- запишите молекулярную, электронную, структурную формулы молекулы аммиака.
- укажите вид химической связи в молекуле и способы образования,
- укажите смещение электронной плотности к более электроотрицательному элементу.
NH3 — молекулярная формула
ковалентная полярная связь, одинарная, по обменному механизму.

3. Водородная связь
Учитель акцентирует внимание ребят на неподеленной электронной паре атома азота, сдвиге электронной плотности в сторону гораздо более электроотрицательного атома азота и возникновении в молекуле аммиака на атоме азота частично отрицательного заряда, а на атоме водорода частично положительного.

Учитель знакомит учащихся с новым для них видом химической связи – водородной связью, которая возникает между молекулами аммиака.
Отметьте особенности водородной связи:
1) между какими атомами возникает связь;
2) силу связи по сравнению с другими видами связи;
3) условное обозначению водородной связи;
4) следствие образования водородной связи в соединении.
Водородной называется связь между атомами водорода и атомами очень ЭО элементов, имеющих свободные электронные пары;
- слабее ковалентной связи в 10 – 20 раз;
- условно обозначается тремя точками;
- вещества с водородной связью обладают хорошей растворимостью в воде, повышается их температура кипения и плавления. (слайд № 6)
4. Физические свойства аммиака
С физическими свойствами аммиака учитель предлагает познакомиться учащимся самостоятельно по учебнику.
- изучите физические свойства аммиака по учебнику;
- рассчитайте его плотность по воздуху Dвозд = 29/МNН3;
- предложите способ собирания газа в лабораторных условиях.
NH3 – газ без цвета, с резким запахом, почти в два раза легче воздуха, при охлаждении до -33,6 о С он сжижается, а при температуре -77,8 о С превращается в твердое белое вещество, хорошо растворим в воде. (слайд № 7)
Учитель разъясняет ребятам, что поскольку аммиак легче воздуха, то при выделении он будет улетать вверх. Поэтому, для того чтобы собрать аммиак, пробирку необходимо держать перевернутой дном. (слайд № 
Учащиеся делают вывод, что при растворении аммиака в воде образовалась щелочь, т.к. фенолфталеин окрасился в малиновый цвет.
Учитель демонстрирует учащимся аммиачную воду (25% раствор аммиака) и нашатырный спирт (10% раствор аммиака). Напоминает, как правильно обращаться с растворами сильно пахнущих веществ.
5. Химические свойства аммиака
Особое внимание уделяется химическим свойствам аммиака:
а) аммиак – комплексообразователь
необходимо рассказать об особом ионе – ионе аммония NH4 +. Отметить его уникальность: ион, образованный только неметаллами, играет роль металла. Разъяснить, что ион аммония, так же как ионы металлов образует свои соли. (слайд № 10)
• Запишите уравнение реакции взаимодействия аммиака с соляной кислотой:
аммиак + соляная кислота = хлорид аммония,
• Рассмотрите механизм реакции.
• Отметьте образование ковалентной полярной связи по донорно-акцепторному механизму (по учебнику)
Аммиак – комплексообразователь. (слайд № 11)
б) Аммиак – восстановитель (в реакциях окисления).
• Запишите уравнение реакции горение аммиака:
аммиак + кислород = азот + вода
• Составьте электронный баланс к этому уравнению.
1) Окисление аммиака без катализатора. (слайд № 12)
2) Окисление аммиака в присутствии катализатора
• Запишите уравнение реакции каталитического окисления аммиака:
аммиак + кислород = оксид азота (II) + вода.
Составьте электронный баланс к этому уравнению. (слайд № 13)
6. Получение аммиака
В промышленности аммиак получают прямым синтезом из простых веществ – азота и водорода. Реакция идет только в присутствии катализатора, при температуре 500 о и повышенном давлении.
• Запишите уравнение реакции получение аммиака:
а) в промышленности (дайте классификацию реакции по всем известным признакам и предложите оптимальные условия проведения реакции);
б) в лаборатории (отметьте способы распознавания аммиака).
а) в промышленности
Р соединения, экзотермическая, гомогенная, обратимая, окислительно-восстановительная, каталитическая. (слайд № 14)
б) в лаборатории получают действием щелочей на соли аммония
Собирание — в перевернутую кверху дном пробирку. (слайды № 15, 16)
б) по посинению влажной лакмусовой бумажки
в) по появлению белого дыма от поднесенной стеклянной палочки, смоченной HCl (конц.) (слайд № 17)
7. Применение аммиака
Учитель предлагает учащимся самостоятельно ознакомиться с применением аммиака по схеме в учебнике.
1) в холодильных установках;
2) в медицине и быту;
3) для производства азотной кислоты, солей аммония;
4) как удобрение (слайд № 18)
Профориентационная информация. Растворы аммиака довольно широко используются в медицине. Разведенный раствор аммиака, издавна называемый нашатырным спиртом, дают нюхать при обморочных состояниях и алкогольном опьянении; при этом происходит рефлекторное возбуждение сердечной деятельности и центра дыхания. При тяжелом алкогольном отравлении практикуют прием внутрь слабых растворов аммиака (3 капли на полстакана).
Более слабые растворы аммиака дают отхаркивающий эффект (нашатырно-анисовые капли).
Местнораздражающее действие аммиака используют для приготовления препаратов, применяемых как отвлекающие средства (при артритах, невралгиях и т.п.).
Хлористый аммоний – белый кристаллический порошок. Слегка гигроскопичен. Имеет солоноватый вкус, легко растворим в воде. Применяется в качестве диуретического и отхаркивающего средства.
8. Закрепление.
Для закрепления предлагается решить фронтально ряд задач:
1) При синтезе аммиака промышленном способом азот объемом 56 л. (н.у.) прореагировал с водородом взятом в избытке. Массовая доля выхода аммиака составила 50%. Рассчитайте объем и массу полученного аммиака.
2) Какая масса хлорида аммония получится при взаимодействии 3 моль аммиака с соляной кислотой?
3) Какой объем кислорода потребуется для сжигания 34 г. аммиака? (слайд № 19)
9. Домашнее задание
П. 25, упр. 1-6 (устно), 7-8 (письменно), повторить конспект (слайд № 20)
1. Габриелян О.С. Настольная книга учителя химии 9 класс, М., 2001, “Блик и К о ”.
2. Горковенко М.Ю. Поурочные разработки по химии , М., 2004, “Вако”.
3. Габриелян О.С., учебник химии 9 класс, М., Дрофа, 2008 г.
4. Виртуальная школа Кирилла и Мефодия, ООО “Нью Медиа Дженерейшн”.
Источник
Как распознать аммиак
Аммиак и особенно его насыщенный раствор может представлять для здоровья человека немалую опасность, хотя при этом достаточно широко используется в промышленности и различных отраслях человеческого хозяйства. Поэтому важно знать, по каким признакам можно определить это вещество, чтобы исключить любую возможность несчастных случаев и производственных травм.

Инструкция
Поставьте емкость с жидкостью, которая может оказаться раствором аммиака, на некоторое расстояние перед собой, так, чтобы она находилась как можно ближе к вашему лицу. Аммиак бесцветен, поэтому его раствор может казаться обыкновенной водой — не пытайтесь делать выводы, исходя из его цвета. Узнать искомое вещество возможно по другим признакам, которые у него выражены гораздо более сильно.
Постарайтесь ощутить запах вещества, не забывая о том, как нужно вдыхать пары неизвестных вам химических соединений. Для этого, не держа голову прямо над жидкостью, а чуть отстранив емкость от себя, быстро помашите над ней рукой. Тем самым вы направите пары аммиака в сторону своих дыхательных путей, однако на таком расстоянии они успеют достаточно смешаться с кислородом и утратить опасную для вашего здоровья концентрацию.
Оцените запах того вещества, которое вы принимаете за аммиак — если он достаточно резкий и от него перехватывает дыхание, значит, скорее всего, вы не ошиблись. Эффект, который оказывает аммиак на вдыхающего его, хорошо известен благодаря нашатырному спирту, то есть водному раствору того же аммиака. Его дают понюхать при потере сознания или обмороке, если необходимо привести человека в чувства — концентрация аммиачного раствора при этом совсем невысокая.
Пригласите еще кого-нибудь и повторите опыт, чтобы окончательно убедиться в том, что вы имеете дело именно с аммиаком. При этом принимайте те же меры предосторожности, что и в ходе первого эксперимента — вдыхать концентрированные пары аммиака нельзя. Если ваш компаньон испытает те же ощущения, что и вы, значит на вопрос о химической природе жидкости можно уже отвечать утвердительно — перед вами аммиак, щелочь из азота и водорода.
Обратите внимание
Имея дело с водным раствором аммиака, помните, что длительное вдыхание его паров может привести к смерти!
Источники:
- Аммиак (Химическая энциклопедия)
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.