Из данной статьи вы узнаете, что зачем нужен азот, где он используется и как его получить
Азот: что это такое и где он используется?
Мало, кто знает, что азот по важности для человека занимает третье место, после кислорода и водорода. Во-первых, потому что газ является главной составляющей атмосферного воздуха (в пределах 75% всего объема). И во-вторых, азот широко используется во многих сферах деятельности человека, начиная от медицины и заканчивая производством взрывчатых устройств. Не случайно в 1992 году авторитетное издание Science присудило оксиду азота (NO) почетную премию «Молекула года».
Чтобы иметь неограниченный источник его получения и обеспечить непрерывность технологических процессов, используют специальное оборудование – генераторы азота, которые позволяют получать данный газ требуемой чистоты.
Что такое азот?
Азот или Nitrogenium – это инертный двухатомный газ без цвета, вкуса и запаха: его невозможно увидеть, если газ не заморожен и не сжижен. Первооткрыватели азота поначалу называли вещество, как «удушливый», «испорченный или флогистированный воздух», «атмосферный мофетт». Эти и другие названия употреблялись вплоть до выхода новой химической номенклатуры, авторы которой решили остановиться на слове «азот», которое, по их мнению, полностью отображало основное свойство вещества — непригодность для дыхания и жизни.
Применение азота
В отличие от кислорода азот не вступает в реакции с другими газообразными веществами. Его атомы сложнее разрываются: им требуется больше энергии для разрушения и взаимодействия с другими веществами, за счет чего обеспечивается инертная среда, необходимая для многих процессов. Благодаря этому качеству, азот применяют в областях, где необходимо исключить реакции быстрого и медленного окисления. Например, при изготовлении электронных плат и полупроводников могут возникать процессы окисления и проявляться в виде коррозии. Другим примером медленного окисления является производство напитков и продуктов питания. В этом случае азот применяют для сохранности внешнего вида продуктов и увеличения сроков их хранения.
Примером быстрого окисления является процесс горения. Как известно, для распространения огня требуется кислород. Чтобы исключить вероятность возникновения пожароопасных ситуаций из резервуаров на промышленных предприятиях удаляют кислород с помощью азота, а также используют его для транспортировки взрывоопасных соединений. Стационарные или мобильные генераторы азота позволяют получать данный газ объемом от 5 до 5 тыс.нм.куб в час при чистоте до 99,95% и эффективно тушить пожары.
Источники получения азота
Физико-химические свойства азота обуславливают его широкое применение во многих отраслях жизнедеятельности человека. Для непрерывного протекания технологических процессов требуется постоянное наличие инертного газа требуемой степени чистоты. С это целью используют три основных источника его получения:
- собственное производство газа в генераторных установках;
- аренда емкости и подача азота на месте;
- приобретение баллонов с жидким азотом.
Самостоятельная генерация азота для промышленных нужд – к такому решению приходят многие компании, в технологических процессах которых требуется постоянное применение данного газа. Получение азота посредством работы собственных генераторов является наиболее экономически выгодным способом, так как:
- инертный газ получается требуемой чистоты,
- отсутствуют транспортные расходы на его доставку,
- исключаются отходы, вызванные испарением при замене баллонов,
- использовать собственное оборудование гораздо безопаснее, чем баллоны под высоким давлением,
- постоянный источник азота в требуемом объеме,
- обеспечивается непрерывность технологических процессов, и исключаются простои.
Существует два типа генераторных установок для получения азота:
- оборудование, использующее метод адсорбции при переменном давлении. Получаемый азот имеет очень высокую степень чистоты до 99,999%
- генераторы мембранного типа – степень очистки менее 90%.
Генераторы грязного азота

Генераторы сверхчистого азота

Каждый из данных способов получения газа имеет свои преимущества, поэтому выбор генераторов азота осуществляется в зависимости от нужд конкретного предприятия.
Какие существуют варианты практического применения газообразного азота по отраслям?
- Медицина и фармацевтика.Наибольшее применение инертного газа в медицине получило для проведения операций (удаление новообразований на коже, рубцов), процедур омоложения, хранения биоматериала, проведения научных опытов, транспортировки медицинских препаратов. В медицине и фармакологии хранят азот в специальных сосудах – баллонах Дьюара.
- Горно-добывающая промышленность. Для тушения пожаров в шахтах и глубинных туннелях, создания инертной «подушки» и поддержания внутрипластового давления в процессе добычи полезных ископаемых применяют азот.
- Лазерная резка металлов. Для получения ровного и точного среза и защиты материалов от окисления используют лазерную резку с использованием азота. Данный метод исключает перегрев материалов и оборудования, появление окалины на материалах, а сама скорость выполнения операции намного превосходит скорость применения других видов резки. С помощью азота выполняют резку керамики, титана, пластика, алюминия, различных типов стали.
- Нефтегазовая и химическая промышленность. Данный газ широко применяют во многих технологических процессах на химических предприятиях, например, для синтеза аммиака, создания инертной среды при проведении химических реакций, переработки высокооктановых компонент, конверсии метана. В металлургии он необходим в процессах спекания порошковым металлом, нейтральной закалки, цементации, для защиты черных и цветных металлов во время отжига.
Азот незаменим при освоении скважин для быстрого и безопасного снижения давления, обеспечения требуемого уровня фонтанирования полезных ископаемых, быстрого опорожнения скважин, при гашении пожаров, для поддержания требуемого давления в цистернах с газом или нефтью, очистки технологических резервуаров, охлаждения электродов и тд. - Целлюлозно-бумажная промышленность. Инертный газ используют для полимеризации лаковых покрытий, в процессах обработки картона и бумаги, повышения качества обработки сырья. Его применение позволяет снизить уровень выбросов летучих соединений в атмосферу, снизить расходы на применение фотоинициаторов.
- Пищевое производство. Азот применяется в процессах упаковки пищевых продуктов, розлива негазированных напитков, растительных масел, защиты жиросодержащих продуктов от быстрого окисления, для создания инертной среды внутри тары и увеличения сроков хранения. В овощехранилищах с его помощью создают модифицированную атмосферу с целью исключения порчи, развития болезнетворных микроорганизмов, для длительного хранения продуктов.
- СТО. В автосервисах газ применяют для закачки в автошины. Данный метод позволяет увеличить срок эксплуатации и улучшить работу шин, предотвратить появление коррозии на металлических элементах, исключить самовозгорание шин, снизить потребность в подкачке, контролировать давление внутри шин.
- Электроника. Данный инертный газ применяют для защиты сложных компонентов, микросхем и оборудования от окисления, для снижения температуры воздуха в производственных процессах, продувки и очистки трубопроводов и систем технологического оборудования, для пайки и производства печатных плат.
- Агропромышленный сектор. Азот участвует в производстве ценного балластного удобрения для растений – карбамида, который также используют в качестве компонента для животноводческих кормов. Газ применяют для производства аммиака и продуктов на его основе, калиевой селитры.
| Азот | |
|---|---|
| при н. у. — газ без цвета, вкуса и запаха | |

Жидкий азот |
|
| Название, символ, номер | Азот / Nitrogenium (N), 7 |
| Атомная масса (молярная масса) |
[14,00643; 14,00728] а. е. м. (г/моль) |
| Электронная конфигурация | [He] 2s2 2p3 |
| Радиус атома | 92 пм |
| Ковалентный радиус | 75 пм |
| Радиус иона | 13 (+5e) 171 (−3e) пм |
| Электроотрицательность | 3,04 (шкала Полинга) |
| Степени окисления | 5, 4, 3, 2, 1, 0, −1, −2, −3 |
| Энергия ионизации (первый электрон) |
1401,5 (14,53) кДж/моль (эВ) |
| Плотность (при н. у.) | 0,808 г/см³ (-195,8 °C); 1,1649 кг/м³ в стандартных условиях по ГОСТ 2939-63; при н. у. 0,001251 г/см³ |
| Температура плавления | 63,29 K (−209,86 °C) |
| Температура кипения | 77,4 K (−195,75 °C) |
| Уд. теплота плавления | (N2) 0,720 кДж/моль |
| Уд. теплота испарения | (N2) 5,57 кДж/моль |
| Молярная теплоёмкость | 29,125 (газ N2) Дж/(K·моль) |
| Молярный объём | 17,3 см³/моль |
| Структура решётки | кубическая |
| Параметры решётки | 5,661 Å |
| Теплопроводность | (300 K) 0,026 Вт/(м·К) |
| Номер CAS | 7727-37-9 |
Азот (N, лат. nitrogenium) — химический элемент 15-й группы (по устаревшей короткой форме периодической системы принадлежит к главной подгруппе V группы, или к группе VA), второго периода периодической системы с атомным номером 7.
Относится к пниктогенам.
Как простое вещество представляет собой двухатомный газ без цвета, вкуса и запаха.
Один из самых распространённых элементов на Земле.
Химически весьма инертен, однако реагирует с комплексными соединениями переходных металлов.
Основной компонент воздуха (78,09 % объёма), разделением которого получают промышленный азот (более ¾ идёт на синтез аммиака).
Применяется как инертная среда для множества технологических процессов; жидкий азот — хладагент.
Азот — один из основных биогенных элементов, входящих в состав белков и нуклеиновых кислот.
Содержание
- 1 История открытия
- 2 Происхождение названия
- 3 Азот в природе
- 3.1 Изотопы
- 3.2 Распространённость
- 3.3 Биологическая роль
- 3.4 Круговорот азота в природе
- 3.5 Токсикология азота и его соединений
- 4 Получение
- 4.1 Разложение нитрита аммония
- 4.2 Нагревание дихромата калия с сульфатом аммония
- 4.3 Разложение азидов
- 4.4 Реакция воздуха с раскалённым коксом
- 4.5 Перегонка воздуха
- 4.6 Пропускание аммиака над оксидом меди (II)
- 5 Свойства
- 5.1 Физические свойства
- 5.2 Фазовая диаграмма
- 5.3 Химические свойства, строение молекулы
- 5.3.1 Промышленное связывание атмосферного азота
- 6 Соединения азота
- 7 Применение
- 7.1 Газообразный азот
- 7.2 Жидкий азот
- 8 Маркировка баллонов
- 9 Опасность для здоровья
История открытия
В 1772 году Генри Кавендиш провёл опыт: он многократно пропускал воздух над раскалённым углём, затем обрабатывал его щёлочью, в результате получался остаток, который Кавендиш назвал удушливым (или мефитическим) воздухом. С позиций современной химии ясно, что в реакции с раскалённым углём кислород воздуха связывался в углекислый газ, который затем поглощался щёлочью. При этом остаток газа представлял собой по большей части азот. Таким образом, Кавендиш выделил азот, но не сумел понять, что это новое простое вещество (химический элемент), и описал его как мефитический воздух (от английского mephitic — ‘вредный’). В том же году Кавендиш сообщил об этом опыте Джозефу Пристли.
Интересен тот факт, что он сумел связать азот с кислородом при помощи разрядов электрического тока, а после поглощения оксидов азота в остатке получил небольшое количество газа, абсолютно инертного, хотя, как и в случае с азотом, не смог понять, что выделил новый химический элемент — инертный газ аргон.
Джозеф Пристли в это время проводил серию экспериментов, в которых также связывал кислород воздуха и удалял полученный углекислый газ, то есть также получал азот, однако, будучи сторонником господствующей в те времена теории флогистона, также неверно истолковал полученные результаты — он решил, что выделил флогистированный воздух (т. е. насыщенный флогистоном).
В сентябре 1772 года шотландский химик Даниэль Резерфорд опубликовал магистерскую диссертацию «О так называемом фиксируемом и мефитическом воздухе», в которой описал азот как вредный, ядовитый воздух и предположил, что это новый химический элемент, а также описал основные свойства азота (не реагирует со щелочами, не поддерживает горения, непригоден для дыхания). Резерфорд также был сторонником флогистонной теории, поэтому также не смог понять, что же он выделил. Таким образом, чётко определить первооткрывателя азота невозможно.
В то же время азот выделил Карл Шееле: летом 1772 года он получил азот по методу Кавендиша и исследовал его в течение пяти лет, затем опубликовал результаты своих исследований. В этой публикации Шееле первым описал воздух как смесь отдельных газов: «огненного воздуха» (кислорода) и «грязного воздуха» (азота). Из-за того, что Шееле задержался с публикацией своих исследований, до сих пор идут споры о первооткрывателе азота.
Происхождение названия
Название «азо́т» (фр. azote, по наиболее распространённой версии, от др.-греч. ἄζωτος — безжизненный), вместо предыдущих названий («флогистированный», «мефитический» и «испорченный» воздух) предложил в 1787 году Антуан Лавуазье, который в то время в составе группы других французских учёных разрабатывал принципы химической номенклатуры, в том же году это предложение опубликовано в труде «Метод химической номенклатуры. Как показано выше, в то время уже было известно, что азот не поддерживает ни горения, ни дыхания. Это свойство и сочли наиболее важным. Хотя впоследствии выяснилось, что азот, наоборот, крайне необходим для всех живых существ, название сохранилось во французском и русском языках. Окончательно в русском языке этот вариант названия закрепился после выхода в свет книги Германа Гесса «Основания чистой химии» в 1831 году.
Само слово «азот» (без связи с газом) известно с древности и употреблялось философами и алхимиками средневековья для обозначения «первичной материи металлов», так называемого «меркурия» у философов, «двойного меркурия» у алхимиков. «Первичную материю металлов» алхимики считали «альфой и омегой» всего сущего. И слово для её обозначения составили из начальных и конечных букв алфавитов трёх языков, считавшихся священными, — латинского, греческого и древнееврейского: а, альфа, алеф и зет, омега, тов — AAAZOT. Инициатор создания новой химической номенклатуры Гитон де Морво отмечал в своей «Методической энциклопедии» (1786 год) алхимическое значение термина.
Многие современники Лавуазье считали название элемента неудачным, в частности, Жан-Антуан Шапталь предложил название фр. nitrogène — «рождающий селитру» (и использовал это название в своей книге «Элементы химии»). Поныне соединения азота называют «нитраты», «нитриты» и «нитриды».
Во французском языке название «нитроген» не прижилось, зато в английском, испанском, венгерском и норвежском используется производное от этого слова. В немецком языке используется название нем. Stickstoff, что означает «удушающее вещество», аналогично в нидерландском; схожие по значению названия используются в некоторых славянских языках, например, хорватское и словенское dušik (пр. «душик»).
Название «азот», помимо французского и русского, принято в итальянском, турецком и ряде славянских языков, а также во многих языках народов бывшего СССР.
До принятия символа N в России, Франции и других странах использовался символ Az, который можно видеть, например, в статье А. М. Бутлерова об аминах 1864 года.
Азот в природе
Изотопы
Основная статья: Изотопы азота
Природный азот состоит из двух стабильных изотопов 14N — 99,635 % и 15N — 0,365 %.
Искусственно получены четырнадцать радиоактивных изотопов азота с массовыми числами от 10 до 13 и от 16 до 25. Все они являются очень короткоживущими изотопами. Самый стабильный из них 13N имеет период полураспада 10 мин.
Спин ядер стабильных изотопов азота: 14N — 1; 15N — 1/2.
Распространённость
Азот — один из самых распространённых элементов на Земле. Вне пределов Земли азот обнаружен в газовых туманностях, солнечной атмосфере, на Уране, Нептуне, в межзвёздном пространстве и др. Атмосферы таких планет-спутников как Титан, Тритон, а также карликовой планеты Плутон в основном состоят из азота. Азот — четвёртый по распространённости элемент Солнечной системы (после водорода, гелия и кислорода).
Азот в форме двухатомных молекул N2 составляет большую часть атмосферы Земли, где его содержание составляет 75,6 % (по массе) или 78,084 % (по объёму), то есть около 3,87⋅1015 т.
Содержание азота в земной коре, по данным разных авторов, составляет (0,7—1,5)⋅1015 т (причём в гумусе — порядка 6⋅1010 т), а в мантии Земли — 1,3⋅1016 т. Такое соотношение масс заставляет предположить, что главным источником азота служит верхняя часть мантии, откуда он поступает в другие оболочки Земли с извержениями вулканов.
Масса растворённого в гидросфере азота, учитывая, что одновременно происходят процессы растворения азота атмосферы в воде и выделения его в атмосферу, составляет около 2⋅1013 т, кроме того, примерно 7⋅1011 т азота содержатся в гидросфере в виде соединений.
Биологическая роль
Азот является химическим элементом, необходимым для существования животных и растений, он входит в состав белков (16—18 % по массе), аминокислот, нуклеиновых кислот, нуклеопротеидов, хлорофилла, гемоглобина и др. В составе живых клеток по числу атомов азота около 2 %, по массовой доле — около 2,5 % (четвёртое место после водорода, углерода и кислорода). В связи с этим значительное количество связанного азота содержится в живых организмах, «мёртвой органике» и дисперсном веществе морей и океанов. Это количество оценивается примерно в 1,9⋅1011 т. В результате процессов гниения и разложения азотсодержащей органики, при условии благоприятных факторов окружающей среды, могут образоваться природные залежи полезных ископаемых, содержащие азот, например, «чилийская селитра» (нитрат натрия с примесями других соединений), норвежская, индийская селитры.
Химия гидридов азота при давлениях порядка 800 ГПа (около 8 миллионов атмосфер) более разнообразна, чем химия углеводородов при нормальных условиях. Отсюда появилась гипотеза, что азот может быть основой пока неоткрытой жизни на таких планетах, как Уран и Нептун.
Круговорот азота в природе
Основная статья: Круговорот азота
Фиксация атмосферного азота в природе происходит по двум основным направлениям — абиогенному и биогенному. Первый путь включает главным образом реакции азота с кислородом. Так как азот химически весьма инертен, для окисления требуются большие количества энергии (высокие температуры). Эти условия достигаются при разрядах молний, когда температура достигает 25000 °C и более. При этом происходит образование различных оксидов азота. Существует также вероятность, что абиотическая фиксация происходит в результате фотокаталитических реакций на поверхности полупроводников или широкополосных диэлектриков (песок пустынь).
Однако основная часть молекулярного азота (около 1,4⋅108 т/год) фиксируется биотическим путём. Долгое время считалось, что связывать молекулярный азот могут только небольшое количество видов микроорганизмов (хотя и широко распространённых на поверхности Земли): бактерии Azotobacter и Clostridium, клубеньковые бактерии бобовых растений Rhizobium, цианобактерии Anabaena, Nostoc и др. Сейчас известно, что этой способностью обладают многие другие организмы в воде и почве, например, актиномицеты в клубеньках ольхи и других деревьев (всего 160 видов). Все они превращают молекулярный азот в соединения аммония (NH4+). Этот процесс требует значительных затрат энергии (для фиксации 1 г атмосферного азота бактерии в клубеньках бобовых расходуют порядка 167,5 кДж, то есть окисляют примерно 10 г глюкозы). Таким образом, видна взаимная польза от симбиоза растений и азотфиксирующих бактерий — первые предоставляют вторым «место для проживания» и снабжают полученным в результате фотосинтеза «топливом» — глюкозой, вторые обеспечивают необходимый растениям азот в усваиваемой ими форме.
Азот в форме аммиака и соединений аммония, получающийся в процессах биогенной азотфиксации, быстро окисляется до нитратов и нитритов (этот процесс носит название нитрификации). Последние, не связанные тканями растений (и далее по пищевой цепи травоядными и хищниками), недолго остаются в почве. Большинство нитратов и нитритов хорошо растворимы, поэтому они смываются водой и, в конце концов, попадают в мировой океан (этот поток оценивается в 2,5—8⋅107 т/год).
Азот, включённый в ткани растений и животных, после их гибели подвергается аммонификации (разложению содержащих азот сложных соединений с выделением аммиака и ионов аммония) и денитрификации, то есть выделению атомарного азота, а также его оксидов. Эти процессы целиком происходят благодаря деятельности микроорганизмов в аэробных и анаэробных условиях.
В отсутствие деятельности человека процессы связывания азота и нитрификации практически полностью уравновешены противоположными реакциями денитрификации. Часть азота поступает в атмосферу из мантии с извержениями вулканов, часть прочно фиксируется в почвах и глинистых минералах, кроме того, постоянно идёт утечка азота из верхних слоёв атмосферы в межпланетное пространство.
Токсикология азота и его соединений
Сам по себе атмосферный азот достаточно инертен, чтобы оказывать непосредственное влияние на организм человека и млекопитающих. Тем не менее, при повышенном давлении он вызывает наркоз, опьянение или удушье (при недостатке кислорода); при быстром снижении давления азот вызывает кессонную болезнь.
Многие соединения азота очень активны и нередко токсичны.
Получение
Разложение нитрита аммония
В лабораториях его можно получать по реакции разложения нитрита аммония:
- NH4NO2 ⟶ N2↑ + 2H2O
Реакция экзотермическая, идёт с выделением 80 ккал (335 кДж), поэтому требуется охлаждение сосуда при её протекании (хотя для начала реакции требуется нагревание нитрита аммония).
Практически эту реакцию выполняют, добавляя по каплям насыщенный раствор нитрита натрия в нагретый насыщенный раствор сульфата аммония, при этом образующийся в результате обменной реакции нитрит аммония мгновенно разлагается.
Выделяющийся при этом газ загрязнён аммиаком, оксидом азота (I) и кислородом, от которых его очищают, последовательно пропуская через растворы серной кислоты, сульфата железа (II) и над раскалённой медью. Затем азот осушают.
Нагревание дихромата калия с сульфатом аммония
Ещё один лабораторный способ получения азота — нагревание смеси дихромата калия и сульфата аммония (в соотношении 2:1 по массе). Реакция идёт по уравнениям:
- K2Cr2O7 + (NH4)2SO4 ⟶ (NH4)2Cr2O7 + K2SO4
- (NH4)2Cr2O7 ⟶ N2↑ + Cr2O3 + 4H2O
Разложение азидов
Наиболее чистый азот можно получить разложением азидов металлов:
- 2NaN3 →∘t 2Na + 3N2↑
Реакция воздуха с раскалённым коксом
Так называемый «воздушный», или «атмосферный» азот, то есть смесь азота с благородными газами, получают путём реакции воздуха с раскалённым коксом, при этом образуется так называемый «генераторный», или «воздушный», газ — сырьё для химических синтезов и топливо. При необходимости из него можно выделить азот, поглотив монооксид углерода.
Перегонка воздуха
Молекулярный азот в промышленности получают фракционной перегонкой жидкого воздуха. Этим методом можно получить и «атмосферный азот». Также широко применяются азотные установки и станции, в которых используется метод адсорбционного и мембранного газоразделения.
Пропускание аммиака над оксидом меди (II)
Один из лабораторных способов — пропускание аммиака над оксидом меди (II) при температуре ~700 °C:
- 3CuO + 2NH3 ⟶ N2↑ + 3Cu + 3H2O
Аммиак берут из его насыщенного раствора при нагревании. Количество CuO в 2 раза больше расчётного. Непосредственно перед применением азот очищают от примеси кислорода и аммиака пропусканием над медью и её оксидом (II) (тоже ~700 °C), затем сушат концентрированной серной кислотой и сухой щёлочью. Процесс происходит довольно медленно, но он того стоит: газ получается весьма чистый.
Свойства
Физические свойства
Оптический эмиссионный спектр азота
При нормальных условиях азот — это бесцветный газ, не имеет запаха, мало растворим в воде (2,3 мл/100 г при 0 °C, 1,5 мл/100 г при 20 °C, 1,1 мл/100 г при 40 °C, 0,5 мл/100 г при 80 °C), плотность 1,2506 кг/м³ (при н. у.).
В жидком состоянии (темп. кипения -195,8 °C) — бесцветная, подвижная, как вода, жидкость. Плотность жидкого азота 808 кг/м³. При контакте с воздухом поглощает из него кислород.
При -209,86 °C азот переходит в твёрдое состояние в виде снегоподобной массы или больших белоснежных кристаллов. При контакте с воздухом поглощает из него кислород, при этом плавится, образуя раствор кислорода в азоте.
Известны три кристаллические модификации твёрдого азота. В интервале 36,61 — 63,29 К существует фаза β-N2 с гексагональной плотной упаковкой, пространственная группа P63/mmc, параметры решётки a=3,93 Å и c=6,50 Å. При температуре ниже 36,61 К устойчива фаза α-N2 с кубической решёткой, имеющая пространственную группу Pa3 или P213 и период a=5,660 Å. Под давлением более 3500 атмосфер и температуре ниже 83 K образуется гексагональная фаза γ-N2.
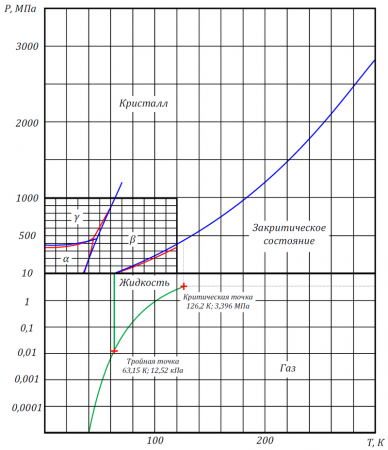
Фазовая диаграмма
Фазовая диаграмма азота показана на рисунке.
Химические свойства, строение молекулы
Азот в свободном состоянии существует в форме двухатомных молекул N2, электронная конфигурация которых описывается формулой σs²σs*2πx, y4σz², что соответствует тройной связи между атомами азота N≡N (длина связи dN≡N = 0,1095 нм). Вследствие этого молекула азота крайне прочна, для реакции диссоциации N2 ↔ 2 N изменение энтальпии в реакции ΔH°298 = 945 кДж/моль, константа скорости реакции К298 = 10−120, то есть диссоциация молекул азота при нормальных условиях практически не происходит (равновесие практически полностью сдвинуто влево). Молекула азота неполярна и слабо поляризуется, силы взаимодействия между молекулами очень слабые, поэтому в обычных условиях азот газообразен.
Даже при 3000 °C степень термической диссоциации N2 составляет всего 0,1 %, и лишь при температуре около 5000 °C достигает нескольких процентов (при нормальном давлении). В высоких слоях атмосферы происходит фотохимическая диссоциация молекул N2. В лабораторных условиях можно получить атомарный азот, пропуская газообразный N2 при сильном разрежении через поле высокочастотного электрического разряда. Атомарный азот намного активнее молекулярного: в частности, при обычной температуре он реагирует с серой, фосфором, мышьяком и с рядом металлов, например, со ртутью.
Вследствие большой прочности молекулы азота некоторые его соединения эндотермичны (многие галогениды, азиды, оксиды), то есть энтальпия их образования положительна, а соединения азота термически малоустойчивы и довольно легко разлагаются при нагревании. Именно поэтому азот на Земле находится по большей части в свободном состоянии.
Ввиду своей значительной инертности азот при обычных условиях реагирует только с литием:
- 6Li + N2 ⟶ 2Li3N
при нагревании он реагирует с некоторыми другими металлами и неметаллами, также образуя нитриды:
- 3Mg + N2 ⟶ Mg3N2
- 2B + N2 ⟶ 2BN
Наибольшее практическое значение имеет нитрид водорода (аммиак) NH3, получаемый взаимодействием водорода с азотом (см. ниже).
В электрическом разряде реагирует с кислородом, образуя оксид азота (II) NO.
Описано несколько десятков комплексов с молекулярным азотом.
Промышленное связывание атмосферного азота
Соединения азота чрезвычайно широко используются в химии, невозможно даже перечислить все области, где находят применение вещества, содержащие азот: это индустрия удобрений, взрывчатых веществ, красителей, медикаментов и проч. Хотя колоссальные количества азота доступны в прямом смысле слова «из воздуха», из-за описанной выше прочности молекулы азота N2 долгое время оставалась нерешённой задача получения соединений, содержащих азот, из воздуха; большая часть соединений азота добывалась из его минералов, таких, как чилийская селитра. Однако сокращение запасов этих полезных ископаемых, а также рост потребности в соединениях азота заставил форсировать работы по промышленному связыванию атмосферного азота.
Наиболее распространён аммиачный способ связывания атмосферного азота. Обратимая реакция синтеза аммиака:
- N2 + 3H2 ⟷ 2NH3
экзотермическая (тепловой эффект 92 кДж) и идёт с уменьшением объёма, поэтому для сдвига равновесия вправо в соответствии с принципом Ле Шателье — Брауна необходимо охлаждение смеси и высокие давления. Однако с кинетической точки зрения снижение температуры невыгодно, так как при этом сильно снижается скорость реакции — уже при 700 °C скорость реакции слишком мала для её практического использования.
В таких случаях используется катализ, так как подходящий катализатор позволяет увеличить скорость реакции без сдвига равновесия. В процессе поиска подходящего катализатора было испробовано около двадцати тысяч различных соединений. По совокупности свойств (каталитическая активность, стойкость к отравлению, дешевизна) наибольшее применение получил катализатор на основе металлического железа с примесями оксидов алюминия и калия. Процесс ведут при температуре 400—600 °C и давлениях 10—1000 атмосфер.
Следует отметить, что при давлениях выше 2000 атмосфер синтез аммиака из смеси водорода и азота идёт с высокой скоростью и без катализатора. Например, при 850 °C и 4500 атмосфер выход продукта составляет 97 %.
Существует и ещё один, менее распространённый способ промышленного связывания атмосферного азота — цианамидный метод, основанный на реакции карбида кальция с азотом при 1000 °C. Реакция происходит по уравнению:
- CaC2 + N2 ⟶ CaCN2 + C
Реакция экзотермична, её тепловой эффект 293 кДж.
Ежегодно из атмосферы Земли промышленным путём отбирается примерно 1⋅106 т азота.
Соединения азота
Степени окисления азота в соединениях −3, −2, −1, 0, +1, +2, +3, +4, +5.
- Соединения азота в степени окисления −3 представлены нитридами, из которых практически наиболее важен аммиак;
- Соединения азота в степени окисления −2 менее характерны, представлены пернитридами, из которых самый важный пернитрид водорода N2H4, или гидразин (существует также крайне неустойчивый пернитрид водорода N2H2, диимид);
- Соединения азота в степени окисления −1: NH2OH (гидроксиламин) — неустойчивое основание, применяющееся, наряду с солями гидроксиламмония, в органическом синтезе;
- Соединения азота в степени окисления +1: оксид азота (I) N2O (закись азота, веселящий газ), азотноватистая кислота;
- Соединения азота в степени окисления +2: оксид азота (II) NO (монооксид азота), азотноватая кислота;
- Соединения азота в степени окисления +3: оксид азота (III) N2O3 (сесквиоксид азота, триоксид диазота), азотистая кислота, производные аниона NO2−, трифторид азота (NF3);
- Соединения азота в степени окисления +4: оксид азота (IV) NO2 (диоксид азота, бурый газ);
- Соединения азота в степени окисления +5: оксид азота (V) N2O5 (пентаоксид диазота), азотная кислота, её соли — нитраты и другие производные, а также тетрафтораммоний NF4+ и его соли.
Применение
Газообразный азот
Промышленное применение газообразного азота обусловлено его инертными свойствами. Газообразный азот пожаро- и взрывобезопасен, препятствует окислению, гниению. В нефтедобывающей промышленности газообразный азот применяется для обеспечения безопасного бурения, используется в процессе капитального и текущего ремонта скважин. Кроме того, газообразный азот высокого давления используют в газовых методах повышения нефтеотдачи пласта. В нефтехимии азот применяется для продувки резервуаров и трубопроводов, проверки работы трубопроводов под давлением, увеличения выработки месторождений. В горнодобывающем деле азот может использоваться для создания в шахтах взрывобезопасной среды, для распирания пластов породы, тушения эндогенных пожаров. В производстве электроники азот применяется для продувки областей, не допускающих наличия окисляющего кислорода. Если в процессе, традиционно проходящем с использованием воздуха, окисление или гниение являются негативными факторами — азот может успешно заместить воздух.
Газообразным азотом заполняют камеры шин шасси летательных аппаратов. Кроме того, в последнее время заполнение шин азотом стало популярно и среди автолюбителей, хотя однозначных доказательств эффективности использования азота вместо воздуха для наполнения автомобильных шин нет.
Жидкий азот
Слабокипящий жидкий азот в металлическом стакане
Жидкий азот применяется как хладагент и для криотерапии.
Важной областью применения азота является его использование для дальнейшего синтеза самых разнообразных соединений, содержащих азот, таких, как аммиак, азотные удобрения, взрывчатые вещества, красители и т. п. Более 3/4 промышленного азота идёт на синтез аммиака.
Большие количества азота используются в коксовом производстве («сухое тушение кокса») при выгрузке кокса из коксовых батарей, а также для «передавливания» топлива в ракетах из баков в насосы или двигатели.
В пищевой промышленности азот зарегистрирован в качестве пищевой добавки E941, как газовая среда для упаковки и хранения, хладагент, а жидкий азот применяется при разливе масел и негазированных напитков для создания избыточного давления и инертной среды в мягкой таре.
Жидкий азот нередко демонстрируется в кинофильмах в качестве вещества, способного мгновенно заморозить достаточно крупные объекты. Это широко распространённое заблуждение. Даже для замораживания цветка необходимо достаточно продолжительное время. Это связано отчасти с весьма низкой теплоёмкостью азота. По этой же причине весьма затруднительно охлаждать, скажем, замки до −196 °C и раскалывать их одним ударом.
Литр жидкого азота, испаряясь и нагреваясь до 20 °C, образует примерно 700 литров газа. По этой причине жидкий азот хранят в специальных сосудах Дьюара с вакуумной изоляцией открытого типа или криогенных ёмкостях под давлением. На этом же факте основан принцип тушения пожаров жидким азотом. Испаряясь, азот вытесняет кислород, необходимый для горения, и пожар прекращается. Так как азот, в отличие от воды, пены или порошка, просто испаряется и выветривается, азотное пожаротушение — самый эффективный с точки зрения сохранности ценностей механизм тушения пожаров.
Заморозка жидким азотом живых существ с возможностью последующей их разморозки проблематична. Проблема заключается в невозможности заморозить (и разморозить) существо достаточно быстро, чтобы неоднородность заморозки не сказалась на его жизненных функциях. Станислав Лем, фантазируя на эту тему в книге «Фиаско», придумал экстренную систему заморозки азотом, в которой шланг с азотом, выбивая зубы, вонзался в рот астронавта и внутрь его подавался обильный поток азота.
В качестве легирующей добавки к кремнию, образует высокопрочное соединение (керамику) нитрид кремния, обладающее высокой вязкостью и прочностью.
Маркировка баллонов
Основная статья: Окраска и маркировка баллонов с газами
Выпущенные в России баллоны с азотом, согласно требованиям ПБ 03-576-03, должны быть окрашены в чёрный цвет с коричневой полосой и надписью жёлтого цвета. ГОСТ 26460-85 не требует полосы, но надпись должна содержать сведения о чистоте азота (особой чистоты, высокой чистоты, повышенной чистоты).
Опасность для здоровья
В обычных условиях азот не токсичен, однако при повышенном атмосферном давлении способен вызывать азотное отравление. Большинство соединений азота представляют сильную опасность для здоровья.
Азот относится ко 2-му классу опасности. Рейтинг NFPA 704: Опасность для здоровья: 3, огнеопасность: 0, реакционная способность: 0.
|
Периодическая система химических элементов Д. И. Менделеева |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|

В 1772 г. Д. Резерфорд установил, что воздух, оставшийся под колпаком, где жила мышь, после сжигания в нем фосфора не поддерживает горения и дыхания. Этот газ он назвал «ядовитым воздухом». В этом же году Д. Пристли, получив «ядовитый воздух» иным путем, назвал его «флогистированным воздухом». В 1773 г. К. Шееле, шведский аптекарь из города Штральзунда, установил, что воздух состоит из двух газов, и назвал газ, не поддерживающий горения и дыхания, «дурным или испорченным воздухом». В 1776 г. известный французский ученый А. Лавуазье, подробно исследуя «ядовитый», «флогистированный» и «дурной» воздух, установил тождество между ними. И лет спустя, будучи членом комиссии по выработке новой химической номенклатуры, он предложил назвать эту часть воздуха азотом (от греческих слов «а» — означающего отрицание, и «zoos» — жизнь). Латинское название азота происходит от слова «нитрогениум», что значит «рождающий селитру» («селитрообразователь»). Этот термин введен в науку в 1790 г. Ж. Шапталом.
Нахождение в природе.
Азот вслед за водородом, гелием и кислородом является четвертым по распространенности элементом Солнечной системы. Азот обнаружен в спектрах звезд, в том числе в фотосфере Солнца, в метеоритах, кометах, солнечном ветре и в межзвездных облаках газа. Молекулярный азот наблюдается в атмосферах Венеры и Марса, а аммиак характерен для Юпитера и Сатурна. Во всех космических объектах азот встречается только в восстановленном состоянии.
В земной коре по распространенности азот занимает 20-е место. Подавляющая его часть сосредоточена в следующих основных резервуарах: атмосфере (3,86*1015 т), литосфере (1,7*1015 т), гидросфере (2,2 *1013 т) и биосфере (~ 1010 т). В атмосфере свободный азот в виде молекулярного N2 составляет 78,09% по объему (или 75,6% по массе), не считая незначительных примесей его в виде аммиака и оксидов.
В литосфере среднее содержание азота составляет 6*10-3 вес. %. Основная масса азота в силикатах находится в химически связанном состоянии в виде NH4+, изоморфно замещающего ион калия в силикатной решетке. Кроме того, в природе встречаются и азотные минералы: нашатырь (NH4C1), выделяющийся из вулканов в довольно больших количествах, баддингтонит (NH4AlSi3O8- *0,5 Н2O) единственный найденный аммониевый алюмосиликат с цеолитной водой. В самых приповерхностных областях литосферы обнаружен ряд минералов, состоящих в основном из нитратных солей. Среди них широко известная селитра (NaNO3), крупные скопления которой характерны для сухого пустынного климата (Чили, Средняя Азия). Долгое время селитра была главным источником связанного азота. (Сейчас основное значение имеет промышленный синтез аммиака из азота воздуха и водорода.) По сравнению с силикатными минералами ископаемое органическое вещество существенно обогащено азотом. Нефть содержит от 0,01 до 2% азота, а каменный уголь — от 0,2 до 3%. Как правило, повышенное содержание азота имеют алмазы (до 0,2%).
В гидросфере среднее содержание азота составляет 1,6- *10-3 вес. %. Основную часть этого азота составляет молекулярный азот, растворенный в воде; химически связанный азот, которого примерно в 25 раз меньше, представлен нитратной и органической формами. В меньших количествах в воде содержится аммиачный и нитритный азот. Концентрация связанного азота в океане примерно в 104 раз меньше, чем в почвах, пригодных для сельскохозяйственного производства.
Хотя название азота означает «не поддерживающий жизни», на самом деле это необходимый для жизнедеятельности элемент. В растительных организмах его содержится в среднем 3%, в живых организмах до 10% от сухого веса. Азот накапливается в почвах (в среднем 0,2 вес.%). В белке животных и человека среднее содержание азота составляет 16%.
Между атмосферой, литосферой и биосферой происходит непрерывный обмен, с которым связана и смена химических форм азота. Этот обмен и определяет круговорот азота в природе. Обмен азота между атмосферой и биосферой получил название биохимического цикла азота. Основным процессом движения азота в биосфере является его переход из одной химической формы в другую в замкнутом цикле. Постоянная смена химических форм азота является источником жизни для многих организмов начиная от микроорганизмов и кончая высокоорганизованными формами жизни. Накопленные в почве запасы связанного азота служат источником питания высших растений, откуда связанный азот может поступать и в организмы животных. Растения и животные, отмирая, дают начало органическому азоту, находящемуся главным образом в аминокислотах. В процессе аммонификации органических остатков азот органических соединений переходит в аммонийную (аммиачную) форму. Последняя с помощью микроорганизмов переходит в нитритную форму. При этом выделяется около 70 ккал/молъ. Другая группа микроорганизмов завершает окисление аммиака до нитрата. Полученный в процессе нитрификации нитрат усваивается растениями, и цикл движения азота в биосфере замыкается.
Главными неорганическими соединениями азота в почвах являются нитрат, аммоний и в редко встречающихся в природных условиях нитрит. Поведение первых двух компонентов в почве совершенно различно. Если нитрат является легкоподвижным соединением, не сорбируется минералами почвы и остается в растворенном в воде состоянии, то аммоний легко хемосорбируется глинистыми минералами, хотя это не мешает ему в определенных условиях легко окисляться до нитрата. Такое различие в подвижности нитрата и аммония предопределяет источники азотного питания растений. С энергетических позиций аммонийная форма азота более предпочтительна, так как валентность азота в ней одинакова с валентностью азота в аминокислотах.
Нитратная форма служит основным источником азотного питания растительности в силу своей подвижности, несмотря на необходимость траты дополнительной энергии, связанной с восстановлением нитрата растением.
Неиспользованные живым веществом запасы химически связанного азота под действием микроорганизмов непрерывно преобразовываются в формы, доступные для азотного питания растений. Так, фиксированный глинистыми минералами аммоний окисляется до нитратов. В определенных условиях при отсутствии свободного кислорода и наличии неиспользованного живым веществом нитрата может происходить обусловленное процессом денитрификации восстановление азота до молекулярного с уходом последнего в атмосферу.
Количества азота, выведенные денитрифицирующими бактериями из биосферы, компенсируются процессами фиксации азота из атмосферы азотфиксирующими бактериями. Последние подразделяются на две группы: живущие самостоятельно и живущие в симбиозе с высшими растениями или с насекомыми. Первая группа бактерий фиксирует примерно 10 кг/га. Симбионты высших растений фиксируют значительно большие количества азота. Так, симбионты бобовых культур фиксируют до 350 кг/га. С осадками выпадает азота порядка нескольких килограммов на гектар.
В балансе фиксируемого азота все большее значение приобретает искусственно синтезированный аммиак, причем его количество удваивается каждые 6 лет. Уже в ближайшее время это может вызвать дисбаланс между процессами фиксации и денитрификации в биосфере.
Следует отметить подцикл круговорота аммиака и окислов азота через атмосферу, особенно если учесть, что этот подцикл регулирует масштабы развития биосферы. Источниками атмосферного аммиака служат биохимические процессы в почве и, в первую очередь, аммонификация. Окисляясь, аммиак дает основную массу окислов азота в атмосфере. Получающаяся в процессе денитрификации закись азота ответственна за содержание окислов азота в стратосфере, которые каталитически разрушают озон, защищающий живое вещество биосферы от губительного действия жесткого ультрафиолетового излучения. Таким образом в природе установились определенные пределы развития биосферы.
Деятельность человека грозит нарушить установившееся равновесие. Так, подсчет показал, что количества окиси азота, выделившиеся при планируемых полетах сверхзвуковых самолетов в стратосфере, будут сравнимы с поступлениями ее из природных источников.Таким образом, завершается цикл движения молекулярного азота через биосферу. В этом геохимическом цикле само существование азотной атмосферы Земли определяется скоростями процессов фиксации и денитрификации. При резком разбалансе этих скоростей азотная атмосфера Земли может исчезнуть всего за несколько десятков миллионов лет.
Помимо атмосферы, биосфера определяет существование и другого крупного резервуара азота в земной коре — литосферы, так как именно взаимодействие живого вещества с молекулярным азотом играет главную роль в процессе круговорота поверхностного азота через земную кору. Небольшая часть накопленного в биосфере связанного азота вместе с осадками увлекается вглубь земной коры. В резко восстановительных условиях из осадочных пород исчезает нитратная форма азота. С увеличением температуры и давления и выходом за границы биосферы реакции превращения органического вещества становятся односторонними и сдвигаются в сторону разрушения органической формы азота. Основной формой связанного азота становится ион аммония. С увеличением степени метаморфизма осадочных пород начинает разрушаться и уходить из пород и аммонийный азот. На высоких ступенях метаморфизма этот процесс практически заканчивается, а с ним заканчивается цикл обращения поверхностного азота в земной коре. Время жизни азота в этом цикле составляет около 1 млрд. лет.
Изотопы азота.
Азот — единственный элемент на Земле, у которого наиболее распространенными являются ядра изотопа 14N нечетно-нечетного типа (7 протонов, 7 нейтронов). Содержание 14N и 15N в воздухе составляет 99,634 и 0,366% соответственно.
В верхних слоях атмосферы под действием нейтронов космического излучения 14N превращается в радиоактивный изотоп 14С, на чем основана геохронологическая датировка геологических образцов, содержащих «древний» углерод.
В настоящее время возможно получение химических соединений азота, искусственно обогащенных тяжелым изотопом 15N до 99,9 атомн.%. Обогащенные по 15N образцы используются при исследованиях в биохимии, биологии, медицине, химии и физической химии, физике, в сельском хозяйстве, в технологии и химическом машиностроении, в аналитической химии и т. д.
Наша химическая лаборатория выполняет работы в сфере исследования полимерных материалов, анализа полимеров проводит анализ резин. Стоимость работ по химическому анализу полимеров и анализу резин договорная. Все работы осуществляются командой профессионалов, имеющих многолетний опыт работы . В случае если у Вас возникли вопросы по анализу полимеров, резинотехнических изделий . Вы всегда можете обратиться в наш справочный центр лаборатории по по телефонам +7(903)572-88-14 ; 8-800-600-62-40; (495)969-35-06; или воспользоваться формой обратной связи .
Источник: www.chemanalytica.ru
www.chemanalytica.ru лаборатория химического анализа растворов и электролитов , анализ химических реактивов, анализ накипи в котлах г.Москва.
Азот — газ, простое химическое вещество, неметалл, элемент 
Название «азот» и созвучные ему используются во многих странах: во Франции, Италии, России, Турции, в некоторых восточнославянских и в странах бывшего СССР. По основной версии, название «азот» происходит от греческого слова azoos — «безжизненный», так как не пригоден для дыхания.
Азот в основном встречается как газ — в воздухе его около 78% (по объему). Месторождения полезных ископаемых, а которых он содержится — например, чилийской селитры (нитрат натрия), индийской селитры (нитрат калия) большей частью уже истощены, поэтому в промышленных масштабах реактив добывают химическим синтезом прямо из атмосферы.
Свойства
В нормальных условиях N2 — газ без вкуса, цвета и запаха. Не горит, пожаро- и взрывобезопасен, плохо растворяется в воде, спиртах, не токсичен. Плохо проводит тепло и электричество. При температуре ниже -196 °С становится сначала жидким, потом твердым. Жидкий азот — прозрачная, подвижная жидкость.

Элемент крайне важен для жизни всего живого. Он является неотъемлемой частью белков, нуклеиновых кислот, гемоглобина, хлорофилла и многих других биологически важных соединений. Играет основную роль в обмене веществ живых клеток и организмов.
Азот выпускается в виде сжатого при 150 атмосфер газа, поставляется в баллонах черного цвета с крупной и четкой надписью желтого цвета. Жидкий реагент хранят в сосудах Дьюара (термос с двойными стенками, с серебрением изнутри и вакуумом между стенок).
Опасность азота
В обычных условиях азот не вреден для человека и животных, но при повышенном давлении вызывает наркотическое опьянение, а при нехватке кислорода — удушье. С азотом и его воздействием на кровь человека при резком снижении давления связана очень опасная кессонная болезнь.
Это интересно
Вероятно, все хотя бы однажды видели в фильмах или сериалах, 
Азот относится к пниктогенам — химическим элементам той же подгруппы таблицы Менделеева, что и он сам. Кроме азота к пниктогенам относят фосфор, мышьяк, сурьму, висмут и искусственно полученный московий.
Жидкий азот — идеальный материал для тушения пожаров, особенно с ценными объектами. После тушения азотом не остается ни воды, ни пены, ни порошка, а газ просто выветривается.
Применение
— Три четверти всего выпускаемого в мире азота идет на производство аммиака, из которого, в свою очередь, производят широко использующуюся в разных сферах промышленности азотную кислоту.
— В сельском хозяйстве соединения азота используются как удобрения, а сам азот — для лучшей сохранности овощей в овощехранилищах.
— Для производства взрывчатых веществ, детонаторов, топлива для космических аппаратов (гидразина).
— Для изготовления красителей, медикаментов.
— При перекачке горючих веществ по трубам, в шахтах, в электронных приборах.
— Для тушения кокса в металлургии, для создания нейтральной атмосферы в промышленных процессах.
— Для продувки труб и резервуаров; распирания пластов в горнодобыче; прокачки топлива в ракетах.
— Для закачки в самолетные шины, иногда — в автомобильные.
— Для производства особой керамики — нитрида кремния, обладающего повышенной механической, термической, химической стойкостью и многими другими полезными характеристиками.
— Пищевую добавку Е941 используют для создания в упаковках консервирующей среды, исключающей окисление и развитие микроорганизмов. Жидкий азот используют при разливе напитков и масел.
Жидкий азот применяется как:
— Хладагент в криостатах, вакуумных установках и т. п.
— В криогенной терапии в косметологии и медицине, для проведения некоторых видов диагностики, для хранения образцов биоматериалов, спермы, яйцеклеток.
— В криогенной резке.
— Для тушения пожаров. Испаряясь, реагент образует массу газа в 700 раз большую, чем объем жидкости. Этот газ оттесняет кислород от пламени, и оно тухнет.
1. Положение азота в периодической системе химических элементов
2. Строение атома азота
3. Физические свойства и нахождение в природе
4. Строение молекулы
5. Соединения азота
6. Способы получения
7. Химические свойства
7.1. Взаимодействие с простыми веществами
7.1.1. Взаимодействие с галогенами
7.1.2. Взаимодействие с серой и кремнием
7.1.3. Взаимодействие с водородом и фосфором
7.1.4. Взаимодействие с азотом
7.1.5. Взаимодействие с активными металлами
Аммиак
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Взаимодействие с серной кислотой
3.2. Взаимодействие с азотной кислотой
3.3. Взаимодействие с солями
Соли аммония
Способы получения солей аммония
Химические свойства солей аммония
Оксиды азота
1. Оксид азота (I)
2. Оксид азота (II)
3. Оксид азота (III)
4. Оксид азота (IV)
5. Оксид азота (V)
Азотная кислота
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Диссоциация азотной кислоты
2.3. Взаимодействие с основными и амфотерными оксидами и гидроксидами
2.4. Вытеснение более слабых кислот из солей
2.5. Взаимодействие с металлами
2.6. Взаимодействие с неметаллами
2.7. Окисление сложных веществ
2.8. Взаимодействие с белками
Азотистая кислота
Соли азотной кислоты — нитраты
Соли азотистой кислоты — нитриты
Азот
Положение в периодической системе химических элементов
Азот расположен в главной подгруппе V группы (или в 15 группе в современной форме ПСХЭ) и во втором периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение азота
Электронная конфигурация азота в основном состоянии:
Атом азота содержит на внешнем энергетическом уровне 3 неспаренных электрона и одну неподеленную электронную пару в основном энергетическом состоянии. Следовательно, атом азота может образовать 3 связи по обменному механизму и 1 связь по донорно-акцепторному механизму. Таким образом, максимальная валентность азота в соединениях равна IV. Также характерная валентность азота в соединениях — III.
Степени окисления атома азота – от -3 до +5. Характерные степени окисления азота -3, 0, +1, +2, +3, +4, +5.
Физические свойства и нахождение в природе
Азот в природе существует в виде простого вещества газа N2. Нет цвета, запаха и вкуса. Молекула N2 неполярная, следовательно, в воде азот практически нерастворим.
Азот – это основной компонент воздуха (79% по массе). В земной коре азот встречается в основном в виде нитратов. Входит в состав белков, аминокислот и нуклеиновых кислот в живых организмах.
Строение молекулы
Связь между атомами в молекуле азота – тройная, т.к. у каждого атома в молекуле по 3 неспаренных электрона. Одна σ-связь (сигма-связь) и две — π-связи.
Структурная формула молекулы азота:
Структурно-графическая формула молекулы азота: N≡N.
Схема перекрывания электронных облаков при образовании молекулы азота:
Соединения азота
Типичные соединения азота:
| Степень окисления | Типичные соединения |
| +5 | оксид азота (V) N2O5
азотная кислота HNO3 нитраты MeNO3 |
| +4 | оксид азота (IV) NO2 |
| +3 | оксид азота (III)
азотистая кислота нитриты MeNO2 |
| +2 | оксид азота (II) NO |
| +1 | оксид азота (I) |
| -3 | аммиак NH3
нитриды металлов MeN бинарные соединения азота с неметаллами |
Способы получения азота
1. Азот в лаборатории получают при взаимодействии насыщенных растворов хлорида аммония и нитрита натрия. Образующийся в результате реакции обмена нитрит аммония легко разлагается с образованием азота и воды. В колбу наливают раствор хлорида аммония, а капельную воронку раствор нитрита натрия. При приливании нитрита натрия в колбу начинается выделение азота. Собирают выделяющийся азот в цилиндр. Горящая лучинка в атмосфере азота гаснет.
NaNO2 + NH4Cl → NH4NO2 + NaCl
NH4NO2 → N2 + 2H2O
Суммарное уравнение процесса:
NaNO2 + NH4Cl → N2 + NaCl + 2H2O
Видеоопыт взаимодействия нитрита натрия с хлоридом аммония можно посмотреть здесь.
Азот также образуется при горении аммиака:
4NH3 + 3O2 → 2N2 + 6H2O
2. Наиболее чистый азот получают разложением азидов щелочных металлов.
Например, разложением азида натрия:
2NaN3 → 2Na + 3N2
3. Еще один лабораторный способ получения азота — восстановление оксида меди (II) аммиаком при температуре ~700 °C:
3CuO + 2NH3 → 3Cu + N2 + 3H2O
В промышленности азот получают, буквально, из воздуха. При промышленном производстве очень важно, чтобы сырье было дешевым и доступным. Воздуха много и он пока бесплатный.
Используются различные способы выделения азота из воздуха — адсорбционная технология, мембранная и криогенная технологии.
Адсорбционные методы разделения воздуха на компоненты основаны на разделения газовых сред в азотных установках лежит явление связывания твёрдым веществом, называемым адсорбентом, отдельных компонентов газовой смеси.
Основным принципом работы мембранных систем является разница в скорости проникновения компонентов газа через вещество мембраны. Движущей силой разделения газов является разница парциальных давлений на различных сторонах мембраны.
В основе работы криогенных установок разделения воздуха лежит метод разделения газовых смеси, основанный на разности температур кипения компонентов воздуха и различии составов находящихся в равновесии жидких и паровых смесей.
Химические свойства азота
При нормальных условиях азот химически малоактивен.
1. Азот проявляет свойства окислителя (с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому азот реагирует с металлами и неметаллами.
1.1. Молекулярный азот при обычных условиях с кислородом не реагирует. Реагирует с кислородом только при высокой температуре (2000оС), на электрической дуге (в природе – во время грозы):
N2 + O2 ⇄ 2NO – Q
Процесс эндотермический, т.е. протекает с поглощением теплоты.
1.2. При сильном нагревании (3000оС-5000оС или действие электрического разряда) образуется атомарный азот, который реагирует с серой, фосфором, мышьяком, углеродом с образованием бинарных соединений:
2С + N2 → N≡C–C≡N
Молекулярный азот, таким образом, не реагирует с серой, фосфором, мышьяком, углеродом.
1.3. Азот взаимодействует с водородом при высоком давлении и высокой температуре, в присутствии катализатора. При этом образуется аммиак:
N2 + ЗН2 ⇄ 2NH3
Этот процесс экзотермический, т.е. протекает с выделением теплоты.
1.4. Азот реагирует с активными металлами: с литием при комнатной температуре, кальцием, натрием и магнием при нагревании. При этом образуются бинарные соединения-нитриды.
Например, литий реагирует с азотом с образованием нитрида лития:
N2 + 6Li → 2Li3N
2. Со сложными веществами азот практически не реагирует из-за крайне низкой реакционной способности.
Взаимодействие возможно только в жестких условиях с активными веществами, например, сильными восстановителями.
Например, азот окисляет гидрид лития:
N2 + 3LiH → Li3N + NH3
Аммиак
Строение молекулы и физические свойства
В молекуле аммиака NH3 атом азота соединен тремя одинарными ковалентными полярными связями с атомами водорода:
Геометрическая форма молекулы аммиака — правильная треугольная пирамида. Валентный угол H-N-H составляет 107,3о:
У атома азота в аммиаке на внешнем энергетическом уровне остается одна неподеленная электронная пара. Эта электронная пара оказывает значительное влиение на свойства аммиака, а также на его структуру. Электронная структура аммиака — тетраэдр , с атомом азота в центре:
Аммиак – бесцветный газ с резким характерным запахом. Ядовит. Весит меньше воздуха. Связь N-H — сильно полярная, поэтому между молекулами аммиака в жидкой фазе возникают водородные связи. При этом аммиак очень хорошо растворим в воде, т.к. молекулы аммиака образуют водородные связи с молекулами воды.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск
ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например, аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
2NH4Cl + Са(OH)2 → CaCl2 + 2NH3 + 2Н2O
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например, гидролиз нитрида кальция:
Ca3N2 + 6H2O → ЗСа(OH)2 + 2NH3
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
N2 + 3Н2 ⇄ 2NH3
Процесс проводят при температуре 500-550оС и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Химические свойства аммиака
1. В водном растворе аммиак проявляет основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H+), он превращается в ион аммония. Реакция может протекать и в водном растворе, и в газовой фазе:
:NH3 + H2O ⇄ NH4+ + OH–
Таким образом, среда водного раствора аммиака – щелочная. Однако аммиак – слабое основание. При 20 градусах один объем воды поглощает до 700 объемов аммиака.
Видеоопыт растворения аммиака в воде можно посмотреть здесь.
2. Как основание, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония.
Например, аммиак реагирует с серной кислотой с образованием либо кислой соли – гидросульфата аммония (при избытке кислоты), либо средней соли – сульфата аммония (при избытке аммиака):
NH3 + H2SO4 → NH4HSO4
2NH3 + H2SO4 → (NH4)2SO4
Еще один пример: аммиак взаимодействует с водным раствором углекислого газа с образованием карбонатов или гидрокарбонатов аммония:
NH3 + H2O + CO2 → NH4HCO3
2NH3 + H2O + CO2 → (NH4)2CO3
Видеоопыт взаимодействия аммиака с концентрированными кислотами – азотной, серной и и соляной можно посмотреть здесь.
В газовой фазе аммиак реагирует с летучим хлороводородом. При этом образуется густой белый дым – это выделяется хлорид аммония.
NH3 + HCl → NH4Cl
Видеоопыт взаимодействия аммиака с хлороводородом в газовой фазе (дым без огня) можно посмотреть здесь.
3. В качестве основания, водный раствор аммиака реагирует с растворами солей тяжелых металлов, образуя нерастворимые гидроксиды.
Например, водный раствор аммиака реагирует с сульфатом железа (II) с образованием сульфата аммония и гидроксида железа (II):
FeSO4 + 2NH3 + 2H2O → Fe(OH)2 + (NH4)2SO4
4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – амминокомплексы.
Например, хлорид меди (II) реагирует с избытком аммиака с образованием хлорида тетрамминомеди (II):
4NH3 + CuCl2 → [Cu(NH3)4]Cl2
Гидроксид меди (II) растворяется в избытке аммиака:
4NH3 + Cu(OH)2 → [Cu(NH3)4](OH)2
5. Аммиак горит на воздухе, образуя азот и воду:
4NH3 + 3O2 → 2N2 + 6H2O
Если реакцию проводить в присутствии катализатора (Pt), то азот окисляется до NO:
4NH3 + 5O2 → 4NO + 6H2O
6. За счет атомов водорода в степени окисления +1 аммиак может выступать в роли окислителя, например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием. С металлами реагирует только жидкий аммиак.
Например, жидкий аммиак реагирует с натрием с образованием амида натрия:
2NH3 + 2Na → 2NaNH2 + H2
Также возможно образование Na2NH, Na3N.
При взаимодействии аммиака с алюминием образуется нитрид алюминия:
2NH3 + 2Al → 2AlN + 3H2
7. За счет азота в степени окисления -3 аммиак проявляет восстановительные свойства. Может взаимодействовать с сильными окислителями — хлором, бромом, пероксидом водорода, пероксидами и оксидами некоторых металлов. При этом азот окисляется, как правило, до простого вещества.
Например, аммиак окисляется хлором до молекулярного азота:
2NH3 + 3Cl2 → N2 + 6HCl
Пероксид водорода также окисляет аммиак до азота:
2NH3 + 3H2O2 → N2 + 6H2O
Оксиды металлов, которые в электрохимическом ряду напряжений металлов расположены справа — сильные окислители. Поэтому они также окисляют аммиак до азота.
Например, оксид меди (II) окисляет аммиак:
2NH3 + 3CuO → 3Cu + N2 + 3H2O
Соли аммония
Соли аммония – это соли, состоящие из катиона аммония и аниона кислотного остатка.
Способы получения солей аммония
1. Соли аммония можно получить взаимодействием аммиака с кислотами. Реакции подробно описаны выше.
2. Соли аммония также получают в обменных реакциях между солями аммония и другими солями.
Например, хлорид аммония реагирует с нитратом серебра:
NH4Cl + AgNO3 → AgCl + NH4NO3
3. Средние соли аммония можно получить из кислых солей аммония. При добавлении аммиака кислая соль переходит в среднюю.
Например, гидрокарбонат аммония реагирует с аммиаком с образованием карбоната аммония:
NH4НCO3 + NH3 → (NH4)2CO3
Химические свойства солей аммония
1. Все соли аммония – сильные электролиты, почти полностью диссоциируют на ионы в водных растворах:
NH4Cl ⇄ NH4+ + Cl–
2. Соли аммония проявляют свойства обычных растворимых солей –вступают в реакции обмена с щелочами, кислотами и растворимыми солями, если в продуктах образуется газ, осадок или образуется слабый электролит.
Например, карбонат аммония реагирует с соляной кислотой. При этом выделяется углекислый газ:
(NH4)2CO3 + 2НCl → 2NH4Cl + Н2O + CO2
Соли аммония реагируют с щелочами с образованием аммиака.
Например, хлорид аммония реагирует с гидроксидом калия:
NH4Cl + KOH → KCl + NH3 + H2O
Взаимодействие с щелочами — качественная реакция на ионы аммония. Выделяющийся аммиак можно обнаружить по характерному резкому запаху и посинению лакмусовой бумажки.
3. Соли аммония подвергаются гидролизу по катиону, т.к. гидроксид аммония — слабое основание:
NH4Cl + Н2O ↔ NH3 ∙ H2O + HCl
NH4+ + HOH ↔ NH3 ∙ H2O + H+
4. При нагревании соли аммония разлагаются. При этом если соль не содержит анион-окислителя, то разложение проходит без изменения степени окисления атома азота. Так разлагаются хлорид, карбонат, сульфат, сульфид и фосфат аммония:
NH4Cl → NH3 + HCl
NH4HCO3 → NH3 + CO2 + H2O
(NH4)2SO4 → NH4HSO4 + NH3
NH4HS → NH3 + H2S
Если соль содержит анион-окислитель, то разложение сопровождается изменением степени окисления атома азота иона аммония. Так протекает разложение нитрата, нитрита и дихромата аммония:
NH4NO2 → N2 + 2H2O
190 – 245° C:
NH4NO3 → N2O + 2H2O
При температуре 250 – 300°C:
2NH4NO3 → 2NO + 4H2O
При температуре выше 300°C:
2NH4NO3 → 2N2 + O2 + 4H2O
Разложение бихромата аммония («вулканчик»). Оранжевые кристаллы дихромата аммония под действием горящей лучинки бурно реагируют. Дихромат аммония – особенная соль, в ее составе – окислитель и восстановитель. Поэтому «внутри» этой соли может пройти окислительно-восстановительная реакция (внутримолекулярная ОВР):
(NH4)2Cr2O7 → Cr2O3 + N2 + 4H2O
Окислитель – хром (VI) превращается в хром (III), образуется зеленый оксид хрома. Восстановитель – азот, входящий в состав иона аммония, превращается в газообразный азот. Итак, дихромат аммония превращается в зеленый оксид хрома, газообразный азот и воду. Реакция начинается от горящей лучинки, но не прекращается, если лучинку убрать, а становится еще интенсивней, так как в процессе реакции выделяется теплота, и, начавшись от лучинки, процесс лавинообразно развивается. Оксид хрома (III) – очень твердое, тугоплавкое вещество зеленого цвета, его используют как абразив. Температура плавления – почти 2300 градусов. Оксид хрома – очень устойчивое вещество, не растворяется даже в кислотах. Благодаря устойчивости и интенсивной окраске окись хрома используется при изготовлении масляных красок.
Видеоопыт разложения дихромата аммония можно посмотреть здесь.
Оксиды азота
| Оксиды азота | Цвет | Фаза | Характер оксида |
| N2O Оксид азота (I), закись азота, «веселящий газ» | бесцветный | газ | несолеобразующий |
| NO Оксид азота (II) | бесцветный | газ | несолеобразующий |
| N2O3 Оксид азота (III), азотистый ангидрид | синий | жидкость | кислотный |
| NO2 Оксид азота (IV), диоксид азота, «лисий хвост» | бурый | газ | кислотный (соответствуют две кислоты) |
| N2O5 Оксид азота (V), азотный ангидрид | бесцветный | твердый | кислотный |
Оксид азота (I)
Оксид азота (I) – это несолеобразующий оксид. Малые концентрации закиси азота вызывают лёгкое опьянение (отсюда название — «веселящий газ»). При вдыхании чистого газа быстро развиваются состояние опьянения и сонливость. Закись азота обладает слабой наркотической активностью, в связи с чем в медицине её применяют в больших концентрациях. В смеси с кислородом при правильном дозировании (до 80 % закиси азота) вызывает хирургический наркоз.
Строение молекулы оксида азота (I) нельзя описать методом валентных связей. Так как оксид азота (I) состоит из двух, так называемых резонансных структур, которые переходят одна в другую:
Общую формулу в таком случае можно задать, обозначая изменяющиеся связи в резонансных структурах пунктиром:
Получить оксид азота (I) в лаборатории можно разложением нитрата аммония:
NH4NO3 → N2O + 2H2O
Химические свойства оксида азота (I):
1. При нормальных условиях оксид азота (I) инертен. При нагревании проявляет свойства окислителя. Оксид азота (I) при нагревании окисляет водород, аммиак, металлы, сернистый газ и др. При этом азот восстанавливается в простое вещество.
N2O + H2 → N2 + H2O
N2O + Mg → N2 + MgO
N2O + 2Cu → N2 + Cu2O
3N2O + 2NH3 → 4N2 + 3H2O
N2O + H2O + SO2 → N2 + H2SO4
Еще пример: оксид азота (I) окисляет углерод и фосфор при нагревании:
N2O + C → N2 + CO
5N2O + 2Р → 5N2 + Р2O5
2. При взаимодействии с сильными окислителями N2O может проявлять свойства восстановителя.
Например, N2O окисляется раствором перманганата в серной кислоте:
5N2O + 3H2SO4 + 2KMnO4 → 10NO + 2MnSO4 + K2SO4 + 3H2O
Оксид азота (II)
Оксид азота (II) – это несолеобразующий оксид. В нормальных условиях это бесцветный ядовитый газ, плохо растворимый в воде. На воздухе коричневеет из-за окисления до диоксида азота. Сжижается с трудом; в жидком и твёрдом виде имеет голубой цвет.
Способы получения.
1. В лаборатории оксид азота (II) получают действием разбавленной азотной кислоты (30%) на неактивные металлы.
Например, при действии 30 %-ной азотной кислоты на медь образуется NO:
3Cu + 8HNO3(разб.) → 3Cu(NO3)2 + 2NO + 4H2O
Также NO можно получить при окислении хлорида железа (II) или иодоводорода азотной кислотой:
3FeCl2 + NaNO3 + 4HCl → 3FeCl3 + NaCl + NO + 2H2O
2HNO3 + 6HI → 2NO + I2 + 4H2O
2. В природе оксид азота (II) образуется из азота и кислорода под действием электрического разряда, например, во время грозы:
N2 + O2 → 2NO
3. В промышленности оксид азота (II) получают каталитическим окислением аммиака:
4NH3 + 5O2 → 4NO + 6H2O
Химические свойства.
1. Оксид азота (II) легко окисляется под действием окислителей.
Например, горит в атмосфере кислорода:
2NO + O2 → 2NO2
Оксид азота (II) легко окисляется под действием хлора или озона:
2NO + Cl2 → 2NOCl
NO + O3 → NO2 + O2
2. В присутствии более сильных восстановителей проявляет свойства окислителя. В атмосфере оксида азота (II) могут гореть водород, углерод и т.п.
Например, оксид азота (II) окисляет водород и сернистый газ:
2NO + 2H2 → N2 + 2H2O
2NO + 2SO2 → 2SO3 + N2
Оксид азота (III)
Оксид азота (III), азотистый ангидрид – кислотный оксид. За счет азота со степенью окисления +3 проявляет восстановительные и окислительные свойства. Устойчив только при низких температурах, при более высоких температурах разлагается.
Способы получения: можно получить при низкой температуре из оксидов азота:
NO2 + NO ↔ N2O3
Химические свойства:
1. Оксид азота (III) взаимодействует с водой с образованием азотистой кислоты:
N2O3 + H2O ↔ 2HNO2
2. Оксид азота (III) взаимодействует с основаниями и основными оксидами:
Например, оксид азота (III) реагирует с гидроксидом и оксидом натрия с образованием нитрита натрия и воды:
N2O3 + 2NaOH → 2NaNO2 + H2O
N2O3 + Na2O → 2NaNO2
Оксид азота (IV)
Оксид азота (IV) — бурый газ. Очень ядовит! Для NO2 характерна высокая химическая активность.
Способы получения.
1. Оксид азота (IV) образуется при окислении оксида азота (I) и оксида азота (II) кислородом или озоном:
2NO + O2 → 2NO2
2. Оксид азота (IV) образуется при действии концентрированной азотной кислоты на неактивные металлы.
Например, при действии концентрированной азотной кислоты на медь:
4HNO3(конц.) + Cu → Cu(NO3)2 + 2NO2 + 2H2O
3. Оксид азота (IV) образуется также при разложении нитратов металлов, которые в ряду электрохимической активности расположены правее магния (включая магний) и при разложении нитрата лития.
Например, при разложении нитрата серебра:
2AgNO3 → 2Ag + 2NO2 + O2
Химические свойства.
1. Оксид азота (IV) реагирует с водой с образованием двух кислот — азотной и азотистой:
2NO2 + H2O → HNO3 + HNO2
Если растворение NO2 в воде проводить в избытке кислорода, то образуется только азотная кислота:
4NO2 + 2H2O + O2 → 4HNO3
Поскольку азотистая кислота неустойчива, то при растворении NO2 в теплой воде образуются HNO3 и NO:
3NO2 + H2O → 2HNO3 + NO
2. При растворении оксида азота (IV) в щелочах образуются нитраты и нитриты:
2NO2 + 2NaOH → NaNO3 + NaNO2 + H2O
4NO2 + 2Ca(OH)2 → Ca(NO2)2 + Ca(NO3)2 + 2H2O
В присутствии кислорода образуются только нитраты:
4NO2 + 4NaOH + O2 → 4NaNO3 + 2H2O
3. Оксид азота (IV) – сильный окислитель. В атмосфере оксида азота (IV) горят фосфор, уголь, сера, оксид серы (IV) окисляется до оксида серы (VI):
2NO2 + 2S → N2 + 2SO2
2NO2 + 2C → N2 + 2CO2
10NO2 + 8P → 5N2 + 4P2O5
NO2 + SO2 → SO3 + NO
4. Оксид азота (IV) димеризуется:
2NO2 ⇄ N2O4
Оксид азота (V)
N2O5 – оксид азота (V), ангидрид азотной кислоты – кислотный оксид.
Получение оксида азота (V).
1. Получить оксид азота (V) можно окислением диоксида азота:
2NO2 + O3 → N2O5 + O2
2. Еще один способ получения оксида азота (V) – обезвоживание азотной кислоты сильным водоотнимающим веществом, оксидом фосфора (V):
2HNO3 + P2O5 → 2HPO3 + N2O5
Химические свойства оксида азота (V).
1. При растворении в воде оксид азота (V) образует азотную кислоту:
N2O5 + H2O → 2HNO3
2. Оксид азота (V), как типичный кислотный оксид, взаимодействует с основаниями и основными оксидами с образованием солей-нитратов.
Например, оксид азота (V) реагирует с гидроксидом натрия:
N2O5 + 2NaOH → 2NaNO3 + H2O
Еще пример: оксид азота (V) реагирует с оксидом кальция:
N2O5 + CaO → Ca(NO3)2
3. За счет азота со степенью окисления +5 оксид азота (V) – сильный окислитель.
Например, он окисляет серу:
2N2O5 + S → SO2 + 4NO2
4. Оксид азота (V) легко разлагается при нагревании (со взрывом):
2N2O5 → 4NO2 + O2
Азотная кислота
Строение молекулы и физические свойства
Азотная кислота HNO3 – это сильная одноосновная кислота-гидроксид. При обычных условиях бесцветная, дымящая на воздухе жидкость, температура плавления −41,59 °C, кипения +82,6 °C ( при нормальном атмосферном давлении). Азотная кислота смешивается с водой во всех соотношениях. На свету частично разлагается.
Валентность азота в азотной кислоте равна IV, так как валентность V у азота отсутствует. При этом степень окисления атома азота равна +5. Так происходит потому, что атом азота образует 3 обменные связи и одну донорно-акцепторную, является донором электронной пары.
Поэтому строение молекулы азотной кислоты можно описать резонансными структурами:
Обозначим дополнительные связи между азотом и кислородом пунктиром. Этот пунктир по сути обозначает делокализованные электроны. Получается формула:
Способы получения
В лаборатории азотную кислоту можно получить разными способами:
1. Азотная кислота образуется при действии концентрированной серной кислоты на твердые нитраты металлов. При этом менее летучая серная кислота вытесняет более летучую азотную.
Например, концентрированная серная кислота вытесняет азотную из кристаллического нитрата калия:
KNO3 + H2SO4(конц) → KHSO4 + HNO3
2. В промышленности азотную кислоту получают из аммиака. Процесс осуществляется стадийно.
1 стадия. Каталитическое окисление аммиака.
4NH3 + 5O2 → 4NO + 6H2O
2 стадия. Окисление оксида азота (II) до оксида азота (IV) кислородом воздуха.
2NO + O2 → 2NO2
3 стадия. Поглощение оксида азота (IV) водой в присутствии избытка кислорода.
4NO2 + 2H2O + O2 → 4HNO3
Химические свойства
Азотная кислота – это сильная кислота. За счет азота со степенью окисления +5 азотная кислота проявляет сильные окислительные свойства.
1. Азотная кислота практически полностью диссоциирует в водном растворе.
HNO3 → H+ + NO3–
2. Азотная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например, азотная кислота взаимодействует с оксидом меди (II):
CuO + 2HNO3 → Cu(NO3)2 + H2O
Еще пример: азотная кислота реагирует с гидроксидом натрия:
HNO3 + NaOH → NaNO3 + H2O
3. Азотная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов, сульфитов).
Например, азотная кислота взаимодействует с карбонатом натрия:
2HNO3 + Na2CO3 → 2NaNO3 + H2O + CO2
4. Азотная кислота частично разлагается при кипении или под действием света:
4HNO3 → 4NO2 + O2 + 2H2O
5. Азотная кислота активно взаимодействует с металлами. При этом никогда не выделяется водород! При взаимодействии азотной кислоты с металлами окислителем всегда выступает азот +5. Азот в степени окисления +5 может восстанавливаться до степеней окисления -3, 0, +1, +2 или +4 в зависимости от концентрации кислоты и активности металла.
металл + HNO3 → нитрат металла + вода + газ (или соль аммония)
С алюминием, хромом и железом на холоду концентрированная HNO3 не реагирует – кислота «пассивирует» металлы, т.к. на их поверхности образуется пленка оксидов, непроницаемая для концентрированной азотной кислоты. При нагревании реакция идет. При этом азот восстанавливается до степени окисления +4:
Fe + 6HNO3(конц.) → Fe(NO3)3 + 3NO2 + 3H2O
Al + 6HNO3(конц.) → Al(NO3)3 + 3NO2 + 3H2O
Золото и платина не реагируют с азотной кислотой, но растворяются в «царской водке» – смеси концентрированных азотной и соляной кислот в соотношении 1 : 3 (по объему):
HNO3 + 3HCl + Au → AuCl3 + NO + 2H2O
Концентрированная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (IV), азот восстанавливается минимально:
4HNO3(конц.) + Cu → Cu(NO3)2 + 2NO2 + 2H2O
С активными металлами (щелочными и щелочноземельными) концентрированная азотная кислота реагирует с образованием оксида азота (I):
10HNO3 + 4Ca → 4Ca(NO3)2 + 2N2O + 5H2O
Разбавленная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (II).
8HNO3 (разб.) + 3Cu → 3Cu(NO3)2 + 2NO + 4H2O
С активными металлами (щелочными и щелочноземельными), а также оловом и железом разбавленная азотная кислота реагирует с образованием молекулярного азота:
12HNO3(разб) + 10Na → 10NaNO3 + N2 + 6H2O
При взаимодействии кальция и магния с азотной кислотой любой концентрации (кроме очень разбавленной) образуется оксид азота (I):
10HNO3 + 4Ca → 4Ca(NO3)2 + 2N2O + 5H2O
Очень разбавленная азотная кислота реагирует с металлами с образованием нитрата аммония:
10HNO3 + 4Zn → 4Zn(NO3)2 + NH4NO3 + 3H2O
Таблица. Взаимодействие азотной кислоты с металлами.
| Азотная кислота | ||||
| Концентрированная | Разбавленная | |||
| с Fe, Al, Cr | с неактивными металлами и металлами средней активности (после Al) | с щелочными и щелочноземельными металлами | с неактивными металлами и металлами средней активности (после Al) | с металлами до Al в ряду активности, Sn, Fe |
| пассивация при низкой Т | образуется NO2 | образуется N2O | образуется NO | образуется N2 |
6. Азотная кислота окисляет и неметаллы (кроме кислорода, водорода, хлора, фтора и некоторых других). При взаимодействии с неметаллами HNO3 обычно восстанавливается до NO или NO2, неметаллы окисляются до соответствующих кислот, либо оксидов (если кислота неустойчива).
Например, азотная кислота окисляет серу, фосфор, углерод, йод:
6HNO3 + S → H2SO4 + 6NO2 + 2H2O
Безводная азотная кислота – сильный окислитель. Поэтому она легко взаимодействует с красным и белым фосфором. Реакция с белым фосфором протекает очень бурно. Иногда она сопровождается взрывом.
5HNO3 + P → H3PO4 + 5NO2 + H2O
5HNO3 + 3P + 2H2O → 3H3PO4 + 5NO
Видеоопыт взаимодействия фосфора с безводной азотной кислотой можно посмотреть здесь.
4HNO3 + C → CO2 + 4NO2 + 2H2O
Видеоопыт взаимодействия угля с безводной азотной кислотой можно посмотреть здесь.
10HNO3 + I2 → 2HIO3 + 10NO2 + 4H2O
7. Концентрированная азотная кислота окисляет сложные вещества (в которых есть элементы в отрицательной, либо промежуточной степени окисления): сульфиды металлов, сероводород, фосфиды, йодиды, соединения железа (II) и др. При этом азот восстанавливается до NO2, неметаллы окисляются до соответствующих кислот (или оксидов), а металлы окисляются до устойчивых степеней окисления.
Например, азотная кислота окисляет оксид серы (IV):
2HNO3 + SO2 → H2SO4 + 2NO2
Еще пример: азотная кислота окисляет йодоводород:
6HNO3 + HI → HIO3 + 6NO2 + 3H2O
Азотная кислота окисляет углерод до углекислого газа, т.к. угольная кислота неустойчива.
3С + 4HNO3 → 3СО2 + 4NO + 2H2O
Сера в степени окисления -2 окисляется без нагревания до простого вещества, при нагревании до серной кислоты.
Например, сероводород окисляется азотной кислотой без нагревания до молекулярной серы:
2HNO3 + H2S → S + 2NO2 + 2H2O
При нагревании до серной кислоты:
2HNO3 + H2S → H2SO4 + 2NO2 + 2H2O
8HNO3 + CuS → CuSO4 + 8NO2 + 4H2O
Соединения железа (II) азотная кислота окисляет до соединений железа (III):
4HNO3 + FeS → Fe(NO3)3 + NO + S + 2H2O
8. Азотная кислота окрашивает белки в оранжево-желтый цвет («ксантопротеиновая реакция»).
Ксантопротеиновую реакцию проводят для обнаружения белков, содержащих в своем составе ароматические аминокислоты. К раствору белка прибавляем концентрированную азотную кислоту. Белок свертывается. При нагревании белок желтеет. При добавлении избытка аммиака окраска переходит в оранжевую.
Видеоопыт обнаружения белков с помощью азотной кислоты можно посмотреть здесь.
Азотистая кислота
Азотистая кислота HNO2 — слабая, одноосновная, химически неустойчивая кислота.
Получение азотистой кислоты.
Азотистую кислоту легко получить вытеснением из нитритов более сильной кислотой.
Например, соляная кислота вытесняет азотистую кислоту из нитрита серебра:
AgNO2 + HCl → HNO2 + AgCl
Химические свойства.
1. Азотистая кислота HNO2 существует только в разбавленных растворах, при нагревании она разлагается:
3HNO2 → HNO3 + 2NO + H2O
без нагревания азотистая кислота также разлагается:
2HNO2 → NO2 + NO + H2O
2. Азотистая кислота взаимодействует с сильными основаниями.
Например, с гидроксидом натрия:
HNO2 + NaOH → NaNO2 + H2O
3. За счет азота в степени окисления +3 азотистая кислота проявляет слабые окислительные свойства. Окислительные свойства HNO2 проявляет только при взаимодействии с сильными восстановителями.
Например, HNO2 окисляет иодоводород:
2HNO2 + 2HI → 2NO + I2 + 2H2O
Азотистая кислота также окисляет иодиды в кислой среде:
2НNO2 + 2KI + 2H2SO4 → K2SO4 + I2 + 2NO + 2H2O
Азотистая кислота окисляет соединения железа (II):
2HNO2 + 3H2SO4 + 6FeSO4 → 3Fe2(SO4)3 + N2 + 4H2O
4. За счет азота в степени окисления +3 азотистая кислота проявляет сильные восстановительные свойства. Под действием окислителей азотистая кислота переходит в азотную.
Например, хлор окисляет азотистую кислоту до азотной кислоты:
HNO2 + Cl2 + H2O → HNO3 + 2HCl
Кислород и пероксид водорода также окисляют азотистую кислоту:
2HNO2 + O2 → 2HNO3
HNO2 + H2O2 → HNO3 + H2O
Соединения марганца (VII) окисляют HNO2:
5HNO2 + 2HMnO4 → 2Mn(NO3)2 + HNO3 + 3H2O
Соли азотной кислоты — нитраты
Нитраты металлов — это твердые кристаллические вещества. Большинство очень хорошо растворимы в воде.
1. Нитраты термически неустойчивы, причем все они разлагаются на кислород и соединение, характер которого зависит от положения металла (входящего в состав соли) в ряду напряжений металлов:
- Нитраты щелочных и щелочноземельных металлов (до Mg в электрохимическом ряду) разлагаются до нитрита и кислорода.
Например, разложение нитрата натрия:
2KNO3 → 2KNO2 + O2
Исключение – литий.
Видеоопыт разложения нитрата калия можно посмотреть здесь.
- Нитраты тяжелых металлов (от Mg до Cu, включая магний и медь) и литий разлагаются до оксида металла, оксида азота (IV) и кислорода:
Например, разложение нитрата меди (II):
2Cu(NO3)2 → 2CuO + 4NO2 + O2
- Нитраты малоактивных металлов (правее Cu) – разлагаются до металла, оксида азота (IV) и кислорода.
Например, нитрат серебра:
2AgNO3 → 2Ag + 2NO2 + O2
Исключения:
Нитрит железа (II) разлагается до оксида железа (III):
4Fe(NO3)2 → 2Fe2O3 + 8NO2 + O2
Нитрат марганца (II) разлагается до оксида марганца (IV):
Mn(NO3)2 → MnO2 + 2NO2
2. Водные растворы не обладают окислительно-восстановительными свойствами, расплавы – сильные окислители.
Например, смесь 75% KNO3, 15% C и 10% S называют «черным порохом»:
2KNO3 + 3C + S → N2 + 3CO2 + K2S
Соли азотистой кислоты — нитриты
Соли азотистой кислоты устойчивее самой кислоты, и все они ядовиты. Поскольку степень окисления азота в нитритах равна +3, то они проявляют как окислительные свойства, так и восстановительные.
Кислород, галогены и пероксид водорода окисляют нитриты до нитратов:
2KNO2 + O2 → 2KNO3
KNO2 + H2O2 → KNO3 + H2O
KNO2 + H2O + Br2 → KNO3 + 2HBr
Лабораторные окислители — перманганаты, дихроматы — также окисляют нитриты до нитратов:
5KNO2 + 3H2SO4 + 2KMnO4 → 5KNO3 + 2MnSO4 + K2SO4 + 3H2O
3KNO2 + 4H2SO4 + K2Cr2O7 → 3KNO3 + Cr2(SO4)3 + K2SO4 + 4H2O
В кислой среде нитриты выступают в качестве окислителей.
При окислении йодидов или соединений железа (II) нитриты восстанавливаются до оксида азота (II):
2KNO2 + 2H2SO4 + 2KI → 2NO + I2 + 2K2SO4 + 2H2O
2KNO2 + 2FeSO4 + 2H2SO4 → Fe2(SO4)3 + 2NO + K2SO4 + 2H2O
При взаимодействии с очень сильными восстановителями (алюминий или цинк в щелочной среде) нитриты восстанавливаются максимально – до аммиака:
NaNO2 + 2Al + NaOH + 6H2O → 2Na[Al(OH)4] + NH3
Смесь нитратов и нитритов также проявляет окислительные свойства. Например, смесь нитрата и нитрита калия окисляет оксид хрома (III) до хромата калия:
3KNO2 + Cr2O3 + KNO3 → 2K2CrO4 + 4NO