Существуют несколько несложных способов, как определить белок. Для этого воспользуемся некоторыми его характерными свойствами.
Одна из групп, на которые разделяются все существующие белки – это белки альбумины. Эта группа наиболее распространена и наиболее известна. К альбуминам относится белок из куриных яиц, содержится в крови человека и животных, а также в растениях, мышцах и молоке.
Чтобы определить эту группу белка, воспользуемся её свойствами растворимости в воде. Если альбумины нагревать – они изменяют свою структуру, то есть «сворачиваются».
Итак, попробуем определить белок. Используем, например, сыворотку коровьей крови или яичный сырой белок. Поместим его в кастрюльку, можно разбавить водой и буден нагревать на медленном огне до кипения. Растворим немного соли в белковом растворе и прильём немного Оцет (уксусную кислоту).
В результате реакции увидим, что из раствора будут выпадать белые хлопья.
Определить белок можно и другим простым способом: белок изменяют структуру под воздействием спирта, поэтому достаточно к белковому раствору прилить такой же объём спирта. Так же, как и в предыдущем случае, мы увидим выпадение белка в виде белых хлопьев.
А вот следующий интересный опыт можно назвать ещё и полезным. Определить белок можно, используя соли тяжёлых металлов. Например, соль меди, железа, свинца (медный купорос CuSO4, хлориды железа FeCl2, FeCl3, нитрат свинца Pb(NO3)4 и др.). Если к водному раствору белка добавить одну (или несколько) таких солей, то выпадает осадок химического соединения белка с тяжёлым металлом. Для нашего организма, да и для организма животных соли тяжёлых металлов – ядовитые вещества, способствующие разрушению белка!
Определить белок также можно с помощью действия не него минеральных кислот (кроме ортофосфорной H3PO4). Если в пробирку налить азотную кислоту, а затем, осторожно, по стенке пробирки капнуть раствор белка, то по окружности стенки пробирки образуется белое кольцо выпавшего белка.
Ещё одна группа белков, называемая глобулинами – в отличии альбуминов не — растворяется в воде. Глобулины хорошо растворимы, если в растворе присутствуют соли. Содержатся глобулины в некоторых частях растений, молоке и мышцах живых организмов. К тому же установлено, что глобулины, выявленные в растениях, растворяются в 70% спирте!
И ещё одна группа белков – склеропротеины, к которым относятся ткани живых организмов, например, ногти, волосы, роговица глаза, а также костные ткани, рога животных и шерсть. Склеропротеины не растворяются в воде и не растворяются в спирте, но при их обработке сильными растворами кислот они приобретают способность растворяться, при этом частично разлагаться.
Глобулины и склеропротеины можно определить с помощью ксантопротеиновой реакции. Это цветная реакция определения белка, при которой, если нагреть пробу, содержащую белок, то проба изменит цвет на жёлтый. Затем при нейтрализации кислоты щёлочью цвет поменяется на оранжевый.
Такую реакцию, возможно, некоторым уже приходилось наблюдать на собственном опыте, когда на кожу попадала азотная кислота.
Следующая реакция по определению белка — биуретовая, которая заключается в добавлении разбавленного раствора натриевой или калиевой щёлочи к раствору белка. В тот же раствор необходимо добавить несколько капель раствора медного купороса. Наблюдаем изменение цвета раствора на красный, затем фиолетовый и сине-фиолетовый.
Если белок длительно нагревать в растворе кислот, то он будет расщепляться на составляющие – пептиды, затем до составляющих его аминокислот, что применяют в промышленности для приготовления приправ к пище.
From Wikipedia, the free encyclopedia
Protein detection is used for clinical diagnosis, treatment and biological research.[1] Protein detection evaluates the concentration and amount of different proteins in a particular specimen.[2] There are different methods and techniques to detect protein in different organisms. Protein detection has demonstrated important implications for clinical diagnosis, treatment and biological research.[3] Protein detection technique has been utilized to discover protein in different category food, such as soybean (bean), walnut (nut), and beef (meat).[4] Protein detection method for different type food vary on the basis of property of food for bean, nut and meat. Protein detection has different application in different field.
Protein Detection in Soybeans, Walnuts, Beef[edit]
Detection of Functional Modes in Protein
Purpose for protein detection in food[edit]
Allergies from food have been noted to become common disease nowadays. The food allergies in the clinical demonstration present different signs, for example mild symptoms from itching in the mouth and swelling of the lips to critical anaphylactic response result in fatal consequences.[5] According to statistic, about 2% adults and 8% children are experiencing hypersensitivity from industrialized countries. In order to reduce potential threatening reactions for life, avoiding the consumption from these allergenic foods strictly is the valid therapy. Therefore, sufficient description in term of potentially allergenic ingredients existing in food products is crucial and indispensable which can be monitored through protein detection.[6][7]
Rationale for protein detection in soybeans[edit]
The soybean has been consumed in processed foods all over the word because of its high nutrient and easy processing characteristic such as soybean milk, tofu, meat alternatives, and brewed soybean products.[5] microorganisms is used in brewage process for brewed soybean products like miso, soy sauce, natto and tempeh. Allergenicity stays in brewed soybean products. In Asian countries, these brewed soybean products are popular and traditional. The amount of patients from soybean allergy and the nearly infinite uses for soybean have gone up in the past a couple of years.[8]
Previous method for protein detection in soybeans[edit]
During the last 30 years, broad methods and techniques were experimented to discover soybean protein. These methods and techniques can be conveyed to lab environment easily.[9] The original and traditional methods were designed and tested in molecular biology spectrum. Enzyme‐Linked Immunosorbent Assay technique containing high susceptibility and specificity is reliable method to investigate soybean proteins through applying a protein which can identify a foreign molecule. This has been evaluated as a vacuolar protein including a molecular block of 34 kDa. The ELISA illustrated sufficient repeatability and reproducibility in lab assessment. But it can not test protein in soybean existing in brewed soybean products.[10] There are different studies to conduct experiments to assess soybean protein through ELISA. However, reproducibility, cross-reactivity and low repeatability make measurement difficult to be reliable in processed foods. These methods can not discover soybean protein staying in brewed soybean products.[11]
Current method for protein detection in soybeans[edit]
Compared with previous method, a heating process is involved in current abstraction technique to investigate soybean protein existing in brewed products. Since the heating process can deactivate the microbial proteolytic enzymes, the current abstraction technique can be used to disclose soybean protein in brewed soybean products.[12] The heating abstraction technique can be demonstrated as the following. To produce the good dispersibility for the specimen in the extraction buffer to carry out the heating process, 19mL of abstraction buffer is mixed with five glass beads in five millimeter diameter and 1 g of food homogenate. At 5, 15 and 60 min variable time, the mixture is abstracted under 25, 40, 60, 80 and 100 ° variable temperature through the heating in a water bath followed by every 5 minutes vortexing. Food abstractions generated through the previous and the current technique are centrifuged for 20 minutes at three thousand gram, then the supernatant is filtered off by a filter paper. The filtrate is gathered and applied for analysis immediately acting as the food specimen abstract.[13] The calibration standard solutions needs to be prepared to disclose soybean proteins by using ELISA. A three hundred milligram soybean powder specimen is mixed with a twenty milliliter compound including 0.5 M NaCl, 0.5% SDS, 20 mM Tris-HCl (pH 7.5), and 2% 2-ME. The compound is then shaken at room temperature for 16 hours for abstraction. The abstract is centrifuged for 30 minutes at twenty thousand gram, then the supernatant is selected by a 0.8-μm microfilter paper. The protein substance from the initial abstract is inspected with a 2-D Quant Kit. The initial abstract is diluted to 50 ng/mL combined with 0.1% SDS, 0.1% 2-ME, 0.1 M PBS (pH 7.4), 0.1% BSA, and 0.1% Tween 20, and it is deposited for ELISA at 4 °C playing as the calibration standard solution.[8]
Conclusion for current protein detection method in soybeans.[edit]
The detection limit for the ELISA is 1 μg/g and it can not assess soybean proteins existing in brewed soybean products due to degradation of the proteins in soybean through microbial proteolytic enzymes staying in the brewed products. The microbial proteolytic enzymes possibly restrain the detection of soybean protein storing in the brewed soybean products. The current abstraction technique can control protein degradation through the microbial proteolytic enzymes. The microbial proteolytic enzymes can be inhibited by heating, pH, and protease inhibitors in general.[14] The variable heating temperatures and abstraction times are examined to decide the ideal heating temperature and time to control microbial proteolytic enzymes. The heating conditions showed to optimize the control of microbial proteolytic enzymes is 80 °C for 15 minutes. So the heating temperature for the abstraction is set to 80 °C and the time is set to 15 minutes for the current abstraction technique.[15]
The current abstraction technique can restrain the degradation of soybean proteins through microbial proteolytic enzymes and can detect soybean protein in most brewed soybean products. The current abstraction technique combined with the heating is a useful and sensitive tool to discover soybean protein stored in processed foods and brewed soybean products. Without impacting microbial proteolytic enzymes, this method is appropriate to quantify soybean protein in processed foods. The proposed extraction and ELISA technique can be applied to control labeling systems for soybean ingredient through a trusty manner.[8]
Rationale for protein detection in walnuts[edit]
English walnuts (Juglans regia) and black walnuts (Juglans nigra) are two main types of walnuts in the market across the world. Walnuts are utilized as a valuable ingredient due to favorable health attributes, sensory properties and consumer sensation.[16][17] Shelled walnuts are broadly applied as ingredients in different foods such as salad, ice creams, bread and meat alternative. Walnut oil is introduced as a good source of mono- and polyunsaturated fatty acids and tocopherols.[18] And it is adopted as a food ingredient in salad dressings particularly. Walnut hull extract is considered as a dietary supplement and a seasoning in the food industry. In addition, ground walnut shells can be used in industrial field as extenders, carriers, fillers and abrasives for example jet cleaners. Tree nuts are regarded as one of the most common allergenic foods around the world.[19] Allergic reactions from tree nuts can be fierce and life threatening.[20][21] Individuals with walnut allergies can have result in fatal and near-fatal reactions from the unintended ingestion of walnuts, other tree nuts or possibly contamination of food with the walnuts ingredient.[22][23][24][25][26][27][28][29][30][31] To prevent walnut allergic reactions, the only effective way is to avoid walnuts in the diet.[32] The appropriate labeling of processed foods with walnuts ingredient is critical to protect walnut-allergic consumers. There are a couple of circumstances cause undeclared walnut residues such as sharing equipment between walnut-containing and other formulations and undeclared walnuts in ingredients.[33] The enzyme-linked immunosorbent assay (ELISA) can be used as the technique to detect walnuts residues with great sensitivity and specificity since walnuts allergic Individuals can have allergic reactions with low (milligram) amounts of walnuts.[34] Several different techniques can be applied to discover walnut residues as well such as polymerase chain reaction (PCR) method and ELISA method on the basis of polyclonal antisera raised against a particular 2S albumin walnut protein.[35][36][37]
Current method for protein detection in walnuts[edit]
The sandwich-type walnut ELISA is the current method used to detect protein in walnuts. The sandwich-type walnut ELISA can be applied as a critical analytical technique by food manufacturers and regulatory agencies for hygiene validation and the assessment of allergen control strategies.
Immunogen preparation[edit]
A mixture of several brands of English walnuts are used to produce the immunogen. The mixed walnuts need to be washed by deionized distilled water 6 times and air-dried. Portion of the walnuts are dry-roasted for 10 minutes at 270 ◦F. The roasted or raw walnuts are cleaved, frozen, and ground to a refined particle size through the blender. The ground roasted and ground raw walnuts are defatted and filtered. Then, the powdered raw or roasted walnuts are air-dried thoroughly. Both the defatted, powdered raw, and roasted walnuts can be utilized as immunogens. Protein concentrations of the defatted powdered immunogens are set through the Kjeldahl method with 46.4% raw defatted walnut and 34.9% roasted defatted walnut.[37]
Polyclonal antibody production and titer determination[edit]
Polyclonal antibodies are generated in 1 sheep, 1 goat, and 3 New Zealand white rabbits with each immunogen. The initial subcutaneous injections are given to the 10 animals including 3 rabbits, 1 sheep, and 1 goat on multiple sites with the defatted powdered immunogen and Freunds Complete Adjuvant. Titer values of collected antisera are evaluated by a noncompetitive ELISA method with walnut protein from abstracts of the proper raw or roasted immunogen.[37]
Cross-reactivity study and ELISA method[edit]
A variety of tree nuts, seeds, legumes, fruits and food ingredients are assessed for cross-reactivity in the walnut ELISA assay. The modified sandwich ELISA can be used to detect walnuts residues with sheep antiroasted walnut and rabbit antiroasted walnut antisera used as the capture and detector antibodies respectively.[37]
Conclusion for current protein detection method in walnuts[edit]
Walnut residues can be disclosed at 1 ppm quantitation limit in a diversity of food such as ice cream, muffins, cookies and chocolate. The walnut ELISA can be conducted to detect possible walnut residues allergy in other foods from sharing equipment and to evaluate the sanitation procedures targeted on removal of walnut residues from shared equipment in the food industry.[37]
Rationale for protein detection in beef[edit]
It has been reported that animal feedingstuffs containing processed animal protein (PAP) contaminated with prions have caused BSE infection of the cattle. Processed animal proteins (PAP) has been prohibited to apply as feed material for all farmed animals except fish meal currently. In addition, infections from consumption of undercooked raw beef has been declaimed to be an important pathogen for Enterohemorrhagic Escherichia coli O157:H7.[38]
Method for protein detection in beef[edit]
For processed animal protein, the specific polymerase chain reaction (PCR) based procedure parallelled with microscopic method is utilized to detect processed animal protein (PAP) in feedingstuffs. The limit detection for PCR has been evaluated on 0.05% for beef, 0.1% for pork and 0.2% for poultry meat and bone meal. Microscopic method can disclose 66.13% doubtful samples of feedingstuffs. Combined the results from the use of the microscopic and PCR methods, it has been stated that the molecular biology methods can be executed as a supplementary method for PAP detection.[39]
For undercooked raw beef, in order to make sure a safe beef supply, sensitive and quick detection techniques for E. coli O157:H7 are important in the meat industry. Three different techniques can be used in raw ground beef: the VIDAS ultraperformance E. coli test (ECPT UP), a noncommercial real-time (RT) PCR method and the U.S. Department of Agriculture, Food Safety and Inspection Service (USDA-FSIS) reference method to detect E. coli O157:H7. 25 g of individual raw beef samples and 375 g of raw beef composites can be examined for optimal enrichment times and the efficacy of testing. 6 hours of enrichment is sufficient for both the VIDAS ECPT UP and RT-PCR methods for 25 g samples of each type of raw ground beef, but 24 hours of enrichment is acquired for 375 g samples, Both the VIDAS ECPT UP and RT-PCR methods can generate similar results with those gained from the USDA-FSIS reference method after 18 to 24 hours of enrichment. Low levels of E. coli O157:H7 in 25 g of various types of raw ground beef can be disclosed through these methods, E. coli O157:H7 in composite raw ground beef up to 375 g can be detected as well.[38]
Implication from protein detection[edit]
Protein detection in cells from the human rectal mucous membrane can imply colorectal disease such as colon tumours, inflammatory bowel disease.[40] Protein detection based on antibody microarrays can implicate life signature for example organics and biochemical compounds in the solar system in astrobiology field.[41] Protein detection can monitor soybean protein labeling system in processed foods to protect consumers in a reliable way.[8] The labeling for soybean protein declaimed by protein detection has indicated to be the most important solution.[8] Detailed labeling description for the soybean ingredients in refined foods is required to protect the consumer.[8]
References[edit]
- ^ Engineering the bioelectronic interface : applications to analyte biosensing and protein detection. Davis, Jason J., Royal Society of Chemistry (Great Britain). Cambridge, UK: RSC Pub. 2009. ISBN 9781615836932. OCLC 701819884.
{{cite book}}: CS1 maint: others (link) - ^ «Protein Detection», Electrophoresis in Practice, Wiley-VCH Verlag GmbH & Co. KGaA, 2016-02-26, pp. 131–164, doi:10.1002/9783527695188.ch6, ISBN 9783527695188
- ^ Zhang, Hongquan; Li, Feng; Dever, Brittany; Wang, Chuan; Li, Xing-Fang; Le, X. Chris (2013-10-04). «Assembling DNA through Affinity Binding to Achieve Ultrasensitive Protein Detection». Angewandte Chemie International Edition. 52 (41): 10698–10705. doi:10.1002/anie.201210022. PMID 24038633.
- ^ Liu, Bin; Teng, Da; Wang, Xiumin; Wang, Jianhua (2013-01-30). «Detection of the Soybean Allergenic Protein Gly m Bd 28K by an Indirect Enzyme-Linked Immunosorbent Assay». Journal of Agricultural and Food Chemistry. 61 (4): 822–828. doi:10.1021/jf303076w. ISSN 0021-8561. PMID 23317377.
- ^ a b Wang, Xiaoyu; Jiang, Xiaofeng; Zhu, Shuxian; Liu, Lu; Xia, Junhan; Li, Lidong (2017). «Preparation of optical functional composite films and their application in protein detection». Colloids and Surfaces A: Physicochemical and Engineering Aspects. 535: 69–74. doi:10.1016/j.colsurfa.2017.09.026.
- ^ Cheng, Lin; Zhang, Jie; Lin, Yan; Wang, Qiong; Zhang, XiuXiu; Ding, YanHua; Cui, Hanfeng; Fan, Hao (2015). «An electrochemical molecular recognition-based aptasensor for multiple protein detection». Analytical Biochemistry. 491: 31–36. doi:10.1016/j.ab.2015.08.023. PMID 26344894.
- ^ Shimojo, Naoshi; Nakamura, Masashi; Sato, Nayu; Sano, Akiyo; Kobayashi, Tsukane; Yagami, Akiko; Kojima, Atsushi; Matsunaga, Kayoko (2016). «Utility of Immunoproteomics in Soybean Allergy». Journal of Allergy and Clinical Immunology. 137 (2): AB139. doi:10.1016/j.jaci.2015.12.587.
- ^ a b c d e f Morishita, Naoki; Matsumoto, Takashi; Morimatsu, Fumiki; Toyoda, Masatake (2014). «Detection of Soybean Proteins in Fermented Soybean Products by Using Heating Extraction: Detection of soybean in fermented food…». Journal of Food Science. 79 (5): T1049–T1054. doi:10.1111/1750-3841.12461. PMID 24811351.
- ^ Protein blotting and detection : methods and protocols. Kurien, Biji T., Scofield, R. Hal. New York: Humana Press. 2009. ISBN 9781597455428. OCLC 371501294.
{{cite book}}: CS1 maint: others (link) - ^ Morales-Narváez, Eden; Guix, Maria; Medina-Sánchez, Mariana; Mayorga-Martinez, Carmen C.; Merkoçi, Arben (2014). «Micromotor Enhanced Microarray Technology for Protein Detection». Small. 10 (13): 2542–2548. doi:10.1002/smll.201303068. hdl:10261/126975. PMID 24634101.
- ^ Detection of blotted proteins : methods and protocols. Kurien, Biji T.,, Scofield, R. Hal. New York, NY. ISBN 9781493927180. OCLC 913123725.
{{cite book}}: CS1 maint: others (link) - ^ Lin, Chenxiang; Katilius, Evaldas; Liu, Yan; Zhang, Junping; Yan, Hao (2006-08-11). «Self-Assembled Signaling Aptamer DNA Arrays for Protein Detection». Angewandte Chemie International Edition. 45 (32): 5296–5301. doi:10.1002/anie.200600438. ISSN 1433-7851. PMID 16847867.
- ^ Park, Do Hyun; Lee, Jae-Seung (2015). «Functionalized nanoparticle probes for protein detection». Electronic Materials Letters. 11 (3): 336–345. Bibcode:2015EML….11..336P. doi:10.1007/s13391-014-4383-0. ISSN 1738-8090. S2CID 52949902.
- ^ Nong, Rachel Yuan; Gu, Jijuan; Darmanis, Spyros; Kamali-Moghaddam, Masood; Landegren, Ulf (2012). «DNA-assisted protein detection technologies». Expert Review of Proteomics. 9 (1): 21–32. doi:10.1586/epr.11.78. ISSN 1478-9450. PMID 22292821. S2CID 207212401.
- ^ Detection of highly dangerous pathogens : microarray methods for the detection of BSL 3 and BSL 4 agents. Kostic, Tanja., Butaye, Patrick., Schrenzel, Jacques. Weinheim: Wiley-VCH. 2009. ISBN 9783527626687. OCLC 463436671.
{{cite book}}: CS1 maint: others (link) - ^ Ros, E; Nunez, I; Perez-Heras, A (2004). «A walnut diet improves endothelial function in hypercholesterolemic subjects. A randomized crossover trial». ACC Current Journal Review. 13 (6): 19–20. doi:10.1016/j.accreview.2004.06.062.
- ^ Almoosawi, Suzana Fyfe, Lorna Ho, Clement Al-Dujaili, Emad A S (2009-10-13). «The effect of polyphenol-rich dark chocolate on fasting capillary whole blood glucose, total cholesterol, blood pressure and glucocorticoids in healthy overweight and obese subjects». The British Journal of Nutrition. Cambridge University Press. 103 (6): 842–850. doi:10.1017/S0007114509992431. OCLC 706594347. PMID 19825207. S2CID 4113907.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Savage, G. P.; Dutta, P. C.; McNeil, D. L. (1999). «Fatty acid and tocopherol contents and oxidative stability of walnut oils». Journal of the American Oil Chemists’ Society. 76 (9): 1059–1063. doi:10.1007/s11746-999-0204-2. S2CID 82106409.
- ^ Preparation and use of food-based dietary guidelines : report of a Joint FAO/WHO Consultation. Joint FAO/WHO Consultation on the Preparation and Use of Food-Based Dietary Guideline., World Health Organization. Geneva: World Health Organization. 1998. ISBN 9241208805. OCLC 40216171.
{{cite book}}: CS1 maint: others (link) - ^ Silver, M.; Comline, R. S. (1975). «Transfer of gases and metabolites in the equine placenta: a comparison with other species». Journal of Reproduction and Fertility. Supplement (23): 589–594. ISSN 0449-3087. PMID 1529.
- ^ Teuber, Suzanne S.; Comstock, Sarah S.; Sathe, Shridhar K.; Roux, Kenneth H. (2003). «Tree nut allergy». Current Allergy and Asthma Reports. 3 (1): 54–61. doi:10.1007/s11882-003-0013-x. ISSN 1529-7322. PMID 12542995. S2CID 42075188.
- ^ Asthma ’84: Pharmacologic Update (1984 : Rancho Mirage, Calif.) (1985). Asthma ’84: Pharmacologic Update : October 31 to November 3, 1984, Rancho Mirage, California. Mosby. OCLC 12425311.
- ^ Bock, S.Allan; Muñoz-Furlong, Anne; Sampson, Hugh A. (2001). «Fatalities due to anaphylactic reactions to foods». Journal of Allergy and Clinical Immunology. 107 (1): 191–193. doi:10.1067/mai.2001.112031. PMID 11150011.
- ^ Lawrence Berkeley National Laboratory. United States. Department of Energy. Office of Scientific and Technical Information. (2008). Decreased expression of RNA interference machinery, Dicer and Drosha, is associated with poor outcome in ovarian cancer patients. Lawrence Berkeley National Laboratory. OCLC 727220807.
- ^ Sampson, Hugh A.; Mendelson, Louis; Rosen, James P. (1992-08-06). «Fatal and Near-Fatal Anaphylactic Reactions to Food in Children and Adolescents». New England Journal of Medicine. 327 (6): 380–384. doi:10.1056/NEJM199208063270603. ISSN 0028-4793. PMID 1294076.
- ^ Baker, D.G. (1997). Relationship between posttraumatic stress disorder and self-reported physical symptoms in Persian Gulf War veterans. OCLC 772409021.
- ^ Kemp, Stephen F. (1995-09-11). «Anaphylaxis: A Review of 266 Cases». Archives of Internal Medicine. 155 (16): 1749–54. doi:10.1001/archinte.1995.00430160077008. ISSN 0003-9926. PMID 7654108.
- ^ Warner, J.O. (2002). «How dangerous is food allergy in childhood?». Pediatric Allergy and Immunology. 13 (3): 149–150. doi:10.1034/j.1399-3038.2002.00059.x. ISSN 0905-6157. PMID 12144634. S2CID 10701629.
- ^ ScienceDirect (Service en ligne). The journal of pediatrics. OCLC 798778572.
- ^ Oki, T.; Yoshimoto, A.; Sato, S.; Takamatsu, A. (1975-12-18). «Purine nucleotide pyrophosphotransferase from Streptomyces morookaensis, capable of synthesizing pppApp and pppGpp». Biochimica et Biophysica Acta (BBA) — Enzymology. 410 (2): 262–272. doi:10.1016/0005-2744(75)90228-4. ISSN 0006-3002. PMID 1088.
- ^ Boyd, George K. (1989-07-01). «Fatal Nut Anaphylaxis in a 16-Year-Old Male: Case Report». Allergy and Asthma Proceedings. 10 (4): 255–257. doi:10.2500/108854189778959966. ISSN 1088-5412. PMID 2792751.
- ^ Taylor, Stephen L.; Bush, Robert K.; Busse, William W. (1986-11-01). «Avoidance Diets—How Selective Should We Be?». Allergy and Asthma Proceedings. 7 (6): 527–532. doi:10.2500/108854186779045502. ISSN 1088-5412.
- ^ Dawson, R. M. (1975). «The reaction of choline and 3,3-dimethyl-1-butanol with the acetylenzyme from acetylcholinesterase». Journal of Neurochemistry. 25 (6): 783–787. doi:10.1111/j.1471-4159.1975.tb04408.x. ISSN 0022-3042. PMID 1471. S2CID 45389128.
- ^ Prado, M.; Ortea, I.; Vial, S.; Rivas, J.; Calo-Mata, P.; Barros-Velázquez, J. (2016-11-17). «Advanced DNA- and Protein-based Methods for the Detection and Investigation of Food Allergens». Critical Reviews in Food Science and Nutrition. 56 (15): 2511–2542. doi:10.1080/10408398.2013.873767. ISSN 1040-8398. PMID 25848852. S2CID 21405610.
- ^ Brežná, B.; Hudecová, L.; Kuchta, T. (2006). «A novel real-time polymerase chain reaction (PCR) method for the detection of walnuts in food». European Food Research and Technology. 223 (3): 373–377. doi:10.1007/s00217-005-0214-8. ISSN 1438-2377. S2CID 186222380.
- ^ Yano, Takeo; Sakai, Yumiko; Uchida, Kohji; Nakao, Yoshiki; Ishihata, Kimie; Nakano, Shigeru; Yamada, Toshihiro; Sakai, Shinobu; Urisu, Atsuo (2007-07-23). «Detection of Walnut Residues in Processed Foods by Polymerase Chain Reaction». Bioscience, Biotechnology, and Biochemistry. 71 (7): 1793–1796. doi:10.1271/bbb.70118. ISSN 0916-8451. PMID 17617706.
- ^ a b c d e Doi, Hirotoshi; Touhata, Yuki; Shibata, Haruki; Sakai, Shinobu; Urisu, Atsuo; Akiyama, Hiroshi; Teshima, Reiko (2008-09-10). «Reliable Enzyme-Linked Immunosorbent Assay for the Determination of Walnut Proteins in Processed Foods». Journal of Agricultural and Food Chemistry. 56 (17): 7625–7630. doi:10.1021/jf801550h. ISSN 0021-8561. PMID 18681443.
- ^ a b Savoye, F.; Feng, P.; Rozand, C.; Bouvier, M.; Gleizal, A.; Thevenot, D. (2011). «Comparative Evaluation of a Phage Protein Ligand Assay with Real-Time PCR and a Reference Method for the Detection of Escherichia coli O157:H7 in Raw Ground Beef and Trimmings». Journal of Food Protection. 74 (1): 6–12. doi:10.4315/0362-028X.JFP-10-271. ISSN 0362-028X. PMID 21219756.
- ^ Kunze, H.; Bohn, E.; Bahrke, G. (1975). «Effects of psychotropic drugs on prostaglandin biosynthesis in vitro». The Journal of Pharmacy and Pharmacology. 27 (11): 880–881. doi:10.1111/j.2042-7158.1975.tb10239.x. ISSN 0022-3573. PMID 1505. S2CID 20327465.
- ^ Anderson, Neil; Suliman, Ibnauf; Bandaletova, Tatiana; Obichere, Austin; Lywood, Rupert; Loktionov, Alexandre (2011). «Protein biomarkers in exfoliated cells collected from the human rectal mucosa: implications for colorectal disease detection and monitoring». International Journal of Colorectal Disease. 26 (10): 1287–1297. doi:10.1007/s00384-011-1263-z. ISSN 0179-1958. PMID 21698353. S2CID 24118612.
- ^ Parro, Víctor; Rivas, Luis A.; Gómez-Elvira, Javier (2008). «Protein Microarrays-Based Strategies for Life Detection in Astrobiology». Space Science Reviews. 135 (1–4): 293–311. Bibcode:2008SSRv..135..293P. doi:10.1007/s11214-007-9276-1. ISSN 0038-6308. S2CID 122119527.
External links[edit]
Wikimedia Commons has media related to Soybean.
Wikimedia Commons has media related to Proteins.
- Fermentation improves nutritional value of beans
- Research Collaboratory for Structural Bioinformatics (see also Molecule of the Month, presenting short accounts on selected proteins from the PDB)
Как можно доказать наличие белков в продуктах питания
Ежедневно на столе каждого из нас калейдоскопом сменяются десятки различных продуктов питания. К сожалению, на вид не всегда можно с уверенностью утверждать, что в представленной пище есть белок. Если вы заботитесь о своем здоровье и с особой тщательностью подбираете список полезных белковых продуктов, то вам просто необходимо знать способ качественного определения белка в продуктах. А поможет вам в этом простая в исполнении биуретовая реакция.

Вам понадобится
- — продукт для анализа;
- — гидроксид натрия (NaOH) 10%-ный;
- — сульфат меди (CuSO4) 1%-ный;
- — мерный стаканчик с делением в 1 мл или пробирка;
- — вода;
- — пипетка;
- — прозрачная тара.
Инструкция
Возьмите исследуемый продукт и измельчите путем разрезания и растирания до состояния кашицы. Например, яичный желток разотрите ложкой, а мясо измельчите в блендере. Если вы берете заведомо жидкий продукт питания, например, бульон, то первый шаг можете смело пропустить.

В заранее подготовленный мерный стаканчик помещаем полученную в первом шаге массу в объеме 0,5 мл и разводим водой до деления в 1 мл. Это и станет нашим исследуемым раствором. Если в первом пункте вы брали жидкий продукт питания (бульон, компот), то водой разводить его нет необходимости, просто отмерьте 1 мл продукта мерным стаканчиком или пробиркой.

Добавляем в отдельной прозрачной таре (пробирке) к 1 мл исследуемого раствора 1 мл 10 % раствора гидроксида натрия (NaOH). В домашних условиях отлично подойдет любое средство для прочистки труб, в его состав всегда входит необходимый нам компонент и стоит копейки. Будьте осторожны при работе с этим веществом: при попадании на кожу вызывает серьезные химические ожоги.

Пипеткой добавляем к раствору 2-3 капли 1 % раствора сульфата меди (CuSO4). Приобрести его можно в хозяйственных магазинах, в супермаркетах отдел сад/огород, так как на практике медный купорос используют для борьбы с болезнями растений.

Перемешиваем содержимое прозрачной тары (пробирки). Внимательно следим за изменением окраски раствора. Если белок в биологическом продукте или лекарственном препарате — присутствует, то его пептидные связи образуют с ионами меди в щелочной среде комплексные соединения, цвет которых мы и будем объяснять в следующем шаге.
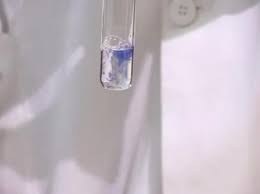
Интерпретируем изменение цвета исследуемого раствора. Если белки присутствуют – мы увидим фиолетовую окраску. В таком случае биуретовая реакция на качественное определение белка в продуктах питания будет считаться положительной. Однако, стоит обратить внимание и на оттенок жидкости, он должн стать красным либо синим.

Видео по теме
Обратите внимание
Интенсивность окраски будет зависеть от количества белка в растворе. А цвет окрашенного раствора зависит от длины полипептидной цепи.
Полезный совет
При работе с едким натрием и медным купоросом рекомендуется использовать индивидуальные средства защиты: резиновые перчатки, прорезиненный костюм, брызгозащитные очки. При попадании на слизистую – промойте проточной водой. При попадании на кожу промойте уксусом. Не допускайте пыления сульфата меди, используйте маску или респиратор. После работы обязательно тщательно вымойте руки и лицо.
Источники:
- Видео «биуретовая реакция».
- Описание химических принципов и вариантов биуретовой реакции.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Определение наличия белков в продуктах питания
Автор: Бушина Ирина Николаевна
Организация: КГК ОУ Школа №4
Населенный пункт: Хабаровский край, г. Амурск
Введение
Мало кто задумывается каждый день о том, чем именно питаться и как оптимально строить свой рацион. К сожалению, о питании чаще всего думают только люди, имеющие серьезные проблемы со здоровьем. Все знают о том, что в рационе должен быть белок. Для взрослого человека ежедневный прием животного белка должен составлять минимум 30% от приема всей пищи, а общее количество белка должно составлять в пределах 150 г. Но когда нами руководит голод, мы часто забываем о том, что еда не только должна быть вкусной и горячей. Но она должна быть и полезной! Именно про это забывают в рекламе, расхваливая тот или иной продукт. Во многих продуктах искусственного происхождения белок отсутствует вообще.
Исходя из актуальности проблемы, нами была сформулирована тема проекта: «Определение наличия белков в продуктах питания».
Цель проекта: Определить содержание белка в тестируемых образцах продуктов питания.
Задачи проекта:
- Изучить и проанализировать учебную литературу, материалы в сети «Интернет» по данной теме.
- С помощью качественной реакции определить содержание белка в тестируемых образцах продуктов питания.
- Подготовить рекомендации о выборе продуктов с наибольшим содержанием белка в тестируемых образцах продуктов питания.
Гипотеза : Искусственно созданные продукты питания не содержат белки.
Объект: продукты питания
Предмет: белки в продуктах питания
Научное название белка — протеин, что в переводе с греческого означает «первый». Высокомолекулярное вещество органического происхождения состоит из аминокислот. Белок входит в состав всех, абсолютно всех клеток организма. Большая часть клеток состоит из него наполовину. Визуально для нас протеин — это: мыщцы; кожа; органы; волосы. А если рассматривать глобально, то белок обеспечивает нам полноценное существование, так как:
- Защищает от вирусов.
- Большое количество белков в продуктах, которые мы включаем в свой рацион, — это иммунитет, так как именно из протеина состоят антитела, которые противостоят инфекциям.
- Регулирует все процессы в организме.
- Белки — исходное сырье для всевозможных элементов, которые обеспечивают человеку комфортное существование.
Для того чтобы представить последствия систематического недобора белка, достаточно просто еще раз пересмотреть все его основные функции в организме и мыслить от противного. Иными словами, дефицит белка — это:
- ослабленный иммунитет;
- сбой процессов, обеспечивающих комфортную жизнедеятельность организма;
- проблемы с мышцами, кожей,
- волосами, общее истощение;
- анемия.
Вывод: белок это один из трех китов, на которых держится здоровье человека.
Белки содержатся в продуктах животного и растительного происхождения (это мясо, яйца, рыба, молоко и молочные продукты, орехи, бобовые растения), а также в грибах.
Экспериментальная часть
Для проведения экспериментальной части нами были взяты 6 образцов продуктов питания: мясо (свинина), курица, рыба (навага), молоко «Родимая сторонка» 3,2% жирности, древесные грибы, куриный бульон «Роллтон». Для проведения качественной реакции мы использовали бульоны и растворы этих продуктов. Качественной реакцией для определения всех без исключения белков является биуретовая реакция. К 1 мл исследуемого раствора белка добавляют равный объем 10 % раствора гидроксида натрия и затем 2-3 капли раствора сульфата меди разбавленного, почти бесцветного раствора медного купороса.
При положительной реакции появляется фиолетовая окраска с красным либо синим оттенком.
Результаты
|
Продукты питания |
Результат проведения биуретовой реакции |
|
1. Мясной бульон |
Темно-синее окрашивание |
|
2. Куриный бульон |
Темно-синее окрашивание |
|
3. Рыбный бульон |
Синее окрашивание |
|
4. Отвар древесных грибов |
Осадок голубого цвета |
|
5. Молоко 3,2% |
Фиолетовое окрашивание |
|
6. Куриный бульон «Роллтон» |
Бурое окрашивание |
Из нашего исследования видно, мясной, куриный и рыбный бульоны содержат достаточное количество белка. Опытным путем также определено наличие белка в молоке. Однако, в курином бульоне «Роллтон» и отваре древесных грибов белки отсутствуют вообще.
А выбор за вами!
Приложения:
- file0.docx.. 20,7 КБ
- file1.ppt.zip.. 5,9 МБ
Опубликовано: 26.10.2020
Краткий обзор по методикам анализа белка в пищевых продуктах
В данном обзоре кратко описаны основные методы определения белка в пищевых продуктах. Указаны основные преимущества и недостатки имеющихся в настоящее время методик и оборудования. Данные обзор может быть полезен для специалистов пищевой промышленности и аналитических лабораторий на производстве продуктов питания. Для простоты восприятия текста при написании обзора авторы сознательно использовали упрощенную лексику и терминологию в описании химических процессов и молекулярной структуры соединений.
1. Введение
Белки (пептиды) представляют собой «полимеры» аминокислот. Белки состоят из двадцати различных аминокислот. Белки отличаются друг от друга в зависимости от типа, количества и последовательности аминокислот, составляющих основу полипептида. В результате они имеют разные молекулярные структуры и физико-химические свойства. Белки являются основными структурными компонентами многих натуральных продуктов, и зачастую определяют их общую текстуру, например, нежность мяса или рыбопродуктов. Изолированные белки часто добавляются в пищевые продукты в качестве ингредиентов, благодаря своим уникальным функциональным свойствам, т. е. их способностью обеспечить внешний вид, структуру или стабильность продукта. Белки нередко используются в процессах гелеобразования, как эмульгаторы, пенообразователи или загустители. Поэтому так важно иметь полную информацию о массовом содержании, типе, молекулярной структуре и функциональных свойствах белков входящих в состав пищевых продуктов.
2. Определение общей концентрации белка
2.1 Метод Кьельдаля
Метод Кьельдаля был разработан в 1883 году пивоваром Иоганном Кьельдалем. Сущность методики заключается в том, что образец продукта разлагается (сжигается) серной кислотой в присутствии катализатора, после чего полученный после разложения связанный в виде сульфата аммония азот может быть определен подходящей методикой титрования. Количество белка рассчитывается в зависимости от концентрации азота в продукте. В таком виде метод все еще используется и сегодня, хотя существует ряд усовершенствований для ускорения процесса и получения более точных данных. Данная методика считается арбитражным методом определения концентрации белка, например, в казеине. Поскольку метод Кьельдаля не измеряет содержание белка напрямую, необходим коэффициент преобразования (К), для перерасчета измеренной концентрации азота в концентрацию белка. Коэффициент 6,25 (что эквивалентно 0,16 г азота на грамм белка) используется для многих приложений, однако, это лишь среднее значение, и каждый белок имеет другой коэффициент преобразования в зависимости от его аминокислотного состава. Подробнее здесь
2.2. Общие принципы.
Метод Кьельдаля удобно разделить на три этапа: сжигание, нейтрализация и титрование.
Разложение. Образец анализируемой пробы взвешивается в специальную колбу, а затем разлагается при нагревании в присутствии серной кислоты (окислитель), безводного сульфата натрия (для ускорения реакции за счет повышения температуры кипения) и катализаторов, таких как медь, селен, титан, или ртуть. При разложении любого азота в продукте (кроме азота, который находится в виде нитратов или нитритов) образуется аммиак, который в растворе сильной серной связывается в ион аммония (NH 4 +) и, следовательно, остается в растворе. Общий вид реакции будет следующим:
N (food) ® (NH 4) 2 SO 4 (1) N (белков анализируемого продукта) ® (NH 4) 2 SO 4 (1)
Нейтрализация. После разложения содержимое колбы количественно переносят в специальную пробирку для отгонки, добавляют щелочь и отгоняют выделяющийся аммиак. Наиболее полно и гладко этот процесс проходит при использовании метода перегонки с паром. Общий вид реакции будет следующим:
(NH 4) 2 SO 4 + 2 NaOH ® 2NH 3 + 2H 2 O + Na 2 SO 4 (2) (2)
Газообразный аммиак, улавливается в отдельной колбе с избытком раствора бороной кислоты. Низкий рН раствора в колбе способствует переходу газообразного аммиака в ион аммония, и одновременно преобразует борную кислоту в борат ион: Общий вид реакции будет следующим:
NH 3 + H 3 BO 3 (борная кислота) ® NH 4 + + H 2 BO 3 — (Борат ионы) (3)
Титрование. Содержание азота рассчитывается по данным титрования. Борат ионы титруют серной или соляной кислотой, используя подходящий индикатор для определения конечной точки реакции.
H 2 BO 3 — + H + → H 3 BO 3 (4) H 2 BO 3 — + H + → H 3 BO 3 (4)
Концентрации ионов водорода (в молях), необходимое для достижения точки эквивалентности соответствует концентрации азота, в первоначальном образце (уравнение 3). Уравнение (5) может быть использовано для определения концентрации азота в образце, который весит м граммов и для титрования которого потрачено х М соляной кислоты:
(5) (5)
Где V S и V b объемы тирующей кислоты для образца и холостого опыта, 14g — молекулярная масса азота. Холостую пробу, как правило, используют, если требуется принять во внимание остаточный азот, который может содержаться в реагентах, используемых при проведении анализа. Как только содержание азота определено, можно рассчитать содержание белка с использованием соответствующего коэффициента преобразования:
Массовая доля белка = К * % N.
2.3. Преимущества и недостатки
Метод Кьельдаля широко используется в мире и до сих пор наравне со всеми другими методами. Его универсальность, высокая точность и хорошая воспроизводимость сделали его основным методом для оценки содержания белка в пищевых продуктах. Однако этот метод не отражает меру истинного белка, а определяет только общее содержание азота в образце, не выделяя небелковый азот. При этом в ряде случаев неучитывание при расчетах содержания небелкового азота может привести к критичным ошибкам при определении собственно белка. Более того, для различных белков требуются различные коэффициенты преобразования, вследствие отличия в аминокислотных последовательностях. Даже для различных белков одного продукта (например, молочных белков молока) коэффициент может отличаться значительно.
Использования концентрированной серной кислоты при высоких температурах также создает значительную опасность, как и использование некоторых дорогостоящих катализаторов. Кроме этого метод Кьельдаля трудоемок и требует значительного времени для его проведения. В настоящее время для снижения трудоемкости, времени и минимизации случайных ошибок разработаны системы различной степени автоматизации для выполнения всех описанных выше стадий анализа.
3. Метод Дюма
Разработанный и принятый не так давно метод Дюма предназначен для быстрого измерения концентрации белка в пробах продуктов питания. Этот метод впервые описан полтора века назад. Он начинает конкурировать с методом Кьельдаля как арбитражный метод анализа белков для некоторых продуктов питания в первую очередь из-за его оперативности.
3.1. Общие принципы
Образец известной массы сжигается при высокой температуре (около 900°С) в специальной ячейке в присутствии кислорода. Углекислый газ и вода удаляются путем пропускания газов через специальные колонки, которые поглощают их. Содержание азота измеряется путем передачи оставшегося после очистки газа на делительную колонку, на конце которой имеется детектор по теплопроводности. Дополнительно на колонке отделяется остаточной CO 2 и H 2 O. Прибор калибруется путем анализа материала, с известной концентрацией азота, например, ЭДТА (содержание азота 9,59%). После этого, сигнал с детектора по теплопроводности может быть преобразован в содержание азота. Как и для метода Кьельдаля необходимо преобразовывать концентрацию азота в образце, используя подходящие коэффициенты пересчета, которые зависят от точной аминокислотной последовательности белка.
3.2. Преимущества и недостатки
Основное преимущество — это скорость анализа, (по несколько минут на измерение, по сравнению с несколькими часами для Кьельдаля). Метод не требует токсичных химических веществ или катализаторов. Многие образцы могут быть измерены в автоматическом режиме. Метод прост в использовании.
Недостатки: Высокая начальная стоимость. Кроме того, метод также не дает меру истинного белка и для различных белков нужны различные поправочные коэффициенты. Небольшая масса и размер пробы затрудняет получение репрезентативной выборки.
4. Методы с использованием УФ-видимой спектроскопии
Для измерения концентрации белка существует ряд методов, основанных на УФ-видимой спектроскопии. Эти методы используют либо природные способности белков в поглощении (или рассеянии) света в УФ-видимой области электромагнитного спектра, либо предусматривает химическую или физическую модификацию белков, чтобы перевести их в форму, поглощающую (или рассеивающую) свет в этой области. Основные принципы любой из перечисленных ниже методик сходен. Прежде всего, при разработке методики следует выбрать химические группы, которые будут нести ответственность за поглощения или рассеяния излучения, например, пептидные связи, ароматические групп, основные группы для поглощения, для рассеивания — количество агрегированных белков. Далее создается градуировочная (калибровочная) зависимость поглощения (или мутности) от концентрации белка, для чего используются ряд белковых растворов с известной концентрацией. Абсорбцию (или мутность) анализируемой затем пробы определяется по построенной градуировочной зависимости.
Наиболее часто используемые УФ-методики для определения содержания белка в продуктах приводятся ниже:
4.1. Принципы
Прямые измерения при 280 нм. Триптофан и тирозин интенсивно поглощает ультрафиолетовый свет при 280 нм. Во многих белках содержание триптофана и тирозина, остается практически неизменным, так что их поглощения при 280 нм может быть использован для определения их концентрации. Преимущества этого метода в том, что процедура проста для выполнения, метод является неразрушающим, и никаких специальных реагентов не требуется. Основным недостатком является то, что нуклеиновые кислоты поглощают сильно при 280 нм и поэтому могут препятствовать измерению белка, если они присутствуют в достаточной концентрации. Для нивелирования этой проблемы были разработаны методы, в которых поглощение измеряется на двух различных длинах волн.
Биуретовый метод. При взаимодействии ионов меди (Cu 2 +) с пептидными связями в щелочных условиях продукт дает интенсивную фиолетово-пурпурную окраску. Биуретовый реагент, в готовой форме может быть приобретен как готовый реактив в специализированных магазинах. Его смешивают с белковым раствором, а затем выдерживают в течение 15−30 минут и определяют поглощение при 540 нм. Основным преимуществом этого метода это отсутствие помех от других соединений, которые поглощают на более низких волнах, и сама техника менее чувствительны к типу белка, поскольку она использует поглощения с участием пептидных связей, которые являются общими для всех белков, а не с отдельными его группами. Однако, метод имеет относительно низкую чувствительность по сравнению с другими УФ методами.
Метод Лоури. Метод Лоури объединяет биуретовый реагент с другим (реагент Фолина), последний реагирует с остатками тирозина и триптофа в белках. Это дает синеватый цвет, который поглощает в область между 500 — 750 нм в зависимости от того, какая требуется чувствительность. Существует небольшой пик поглощения около 500 нм, который может быть использован для определения высоких концентраций белка и интенсивный пик около 750 нм, который может быть использован для определения низких концентраций белка. Этот метод является более чувствительной к низкому содержанию белков, чем просто метод с биуретовым реактивом.
Методы со связыванием красителя (метод Брэдфорда) Сущность таких методов заключается в добавлении «отрицательно заряженного» красителя в раствор белка, рН которого регулируется так, чтобы белок находился в «положительно заряженной» области (т.е. меньше изоэлектрической точки). При этом белки образуют нерастворимый комплекс с красителем из-за электростатического притяжения между молекулами, а несвязанного краситель остается в растворе. Отрицательно заряженная часть красителя связывается с катионными группами основных аминокислот (гистидина, лизина и арганина) и любыми свободными аминогруппами. Количество несвязанного красителя, остающегося в растворе, после того как нерастворимый комплекс «белок-краситель» удаляется (например, центрифугированием) определяется при измерении его поглощения на соответствующей длине волны. Количество белка, которое присутствовало в исходном растворе пропорционально количеству красителя, добавленному первоначально и оставшемуся в растворе. (Для метода Бредфорда белки и их комплексы с красителем остаются в растворе, меняется интенсивность поглощения (визуально цвет) на анализируемой длине волны).
Турбометрический метод (рассеивание). Любые белковые молекулы, растворимые при обычных условия можно перевести в нерастворимую форму путем добавления определенных химических веществ, например, трихлоруксусной кислоты. Таким образом, концентрация белка может быть определено путем измерения степени мутности пропорциональной рассеиванию проходящего через раствор светового луча.
4.2. Преимущества и недостатки
Преимущества: УФ-видимой методы довольно быстро и просто выполнять, и они чувствительны к низкой концентрации белков.
Недостатки: Для большинства методов УФ-видимой спектроскопии необходимо использовать разбавленные и прозрачные растворы, которые не содержат загрязняющих веществ способных поглощать или рассеивать свет на выбранной для анализа длине волне. Необходимость прозрачного раствора означает, что большинство пищевых продуктов, должны пройти длительную пробоподготовку, прежде чем они будут пригодны для анализа, например, гомогенизация, экстракция, центрифугирование, фильтрация. Такая пробоподготовка может занять много времени и быть чрезвычайно трудоемкий. А иногда бывает невозможно количественно извлечь белки из определенных видов пищевых продуктов, особенно после того, как при обработке белки перешли в агрегированное состояние или образовали ковалентные связи с другими веществами. Кроме того, степень абсорбции зависит от типа анализируемого белка, которые могут отличаться в аминокислотных последовательностях.
5. Другие инструментальные методы
Существуют самые различные инструментальные методы для определения общего содержания белка в пищевых продуктах. Их можно разделить на три категории в соответствии с их физико-химическим принципом: (1) измерение объемных физических свойств, (2) измерения адсорбции излучения, и (3) измерение рассеяния излучения. Каждый инструментальных методов имеет свои преимущества и недостатки, и ассортимент объектов, на которые он может быть применен.
5.1. Принципы
Измерение физических свойств. Плотность: плотность белка больше, чем у большинства других компонентов пищи, таким образом, увеличение плотности пищи, напрямую связано с увеличением содержания белка. Следовательно, содержание белка в продукте может быть соотнесено с его плотностью. Показатель преломления: показатель преломления водных растворов увеличивается при увеличении концентрация белка, следовательно, результаты измерения этого показателя могут быть использованы для определения содержания белка.
Измерение адсорбции УФ-видимый: концентрация белков может быть определено путем измерения поглощения УФ-видимого излучения (подробнее описано выше).
ИК-ближняя и средняя область: Инфракрасные методы могут быть использованы для определения концентрации белков в пищевых продуктах. Белки поглощают в ИК-области за счет собственных молекулярных колебаний (растяжения и изгиба) определенных химических групп вдоль полипептидной цепочки. Таким образом, измеряя поглощение излучения на определенных длинах волн, можно рассчитать количественную концентрацию белка в образце. Он также не требует особой подготовки образца и является неразрушающим методом контроля. Его основные недостатки — высокая начальная стоимость и необходимость проведения комплексной и сложной калибровки.
Измерение рассеяния излучения. Рассеяние света: Концентрация белковых агрегатов в водных растворах может быть определена с помощью методов измерения рассеяния света, поскольку мутность раствора прямо пропорциональна концентрации белка. Ультразвуковое рассеяния: концентрация белковых агрегатов также может быть определена с помощью ультразвуковых методов рассеяния, поскольку скорость ультразвука и его поглощения связанны с концентрацией белка в растворе.
5.2. Преимущества и недостатки
Основные преимущества и недостатки инструментальных методов упоминалось выше. Также следует отметить, для всех этих методов должна существовать калибровочная кривая, которая с большой долей вероятности будет различной для различных типов белков и пищевых матриц, в которых они содержится. Как следствие все инструментальные методы наиболее корректно работают для анализа пищевых продуктов с относительно простыми композициями. Для продуктов питания, которые содержат множество различных компонентов, концентрация которых может варьироваться, определить вклад белка на фоне других компонентов зачастую бывает затруднительно.
6. Выбор метода
При анализе конкретного пищевого продукта обычно всегда возникает задача выбора конкретной методики для измерения концентрации белка в образце. Как решить, какой метод является наиболее подходящим? Первое, с чем нужно определиться это для каких целей будет проводиться анализ. Если анализ будет проводиться для сторонних организаций, с целью проведения сличений, или же для расчета за товар, следует пользоваться официально признанным арбитражным методом. Так Кьельдаль, и все чаще метод Дюма, были официально утверждены для широкого спектра пищевой промышленности. В противоположность этому, только небольшое число методом УФ спектроскопии были признаны официально. Но к примеру, для молока все чаще используется метод Брэдфорда, поскольку определение белка без одновременного определения и учета небелкового азота в молоке может привести к завышенным результатом с неприемлемой ошибкой.
Для целей контроля качества, часто более полезно иметь быстрый и простой метод измерения содержания белка и, следовательно, методы ИК-спектроскопии являются наиболее подходящими. В лабораториях где проводятся фундаментальные исследования, и где обычно работы выдуться с уже выделенными и очищенными образцами, методы с использованием УФ спектроскопии зачастую предпочтительнее, поскольку они дают быстрые и надежные измерения, и чувствительны к крайне низкой (до 0,001% масс.) концентрации белка.
Также следует учитывать и другие факторы, которые, возможно, придется рассматривать. В основном это:
- объем требуемой пробоподготовки
- требуемая чувствительность
- требуемая скорость проведения анализа
Методы Кьельдаля, Дюма, акустические и ИК методы, как правило, не требует специальной пробоподготовки, либо пробопоготовка автоматизирована в соответствующем блоке прибора. Во многих случаях после репрезентативной выборки объект анализируется непосредственно. В противоположность, различные методы УФ спектроскопии, как указано выше, требуют серьезной подготовки образца перед анализом. Белок должен быть сепарирован от образца, что обычно означает различные процедуры гомогенизации, экстракции, фильтрации и центрифугирования. Время, необходимое на анализ, и количество образцов, которые могут быть проанализирован одновременно, также являются важными факторами, которые следует учитывать при определении того, какая методика будет выбрана для анализа.
Другие заслуживающие упоминания факторы — это время амортизации оборудования, его начальная стоимость, наличие или отсутствие требуемого вспомогательного оборудования, стоимость расходных материалов и сроком их годности.
7. Цена вопроса
В заключении приведем ориентировочную стоимость постановки методики[1]:
|
Методика |
Примерная стоимость |
Примечания |
|
Метод Кьелдаля (ручной) |
От 20 000 руб. |
Без ОЛО |
|
Метод Кьелдаля (полуавтомат) |
От 200 000 руб. |
Без ОЛО |
|
Метод Кьелдаля (автомат) |
От 600 000 руб. |
|
|
Метод Дюма (автомат) |
От 100 000 руб. |
|
|
Метод ИК (БИК) (ручной [2]) |
От 400 000 руб. |
Без ОЛО |
|
Метод ИК (БИК) (автомат) |
От 1 200 000 руб. |
|
|
Метод УФ (ручной [3]) |
От 300 000 руб. |
Без ОЛО |
|
Метод УЗ (автомат) |
От 25 000 руб. |
|
|
Определение плотности |
От 5000 руб. |
Без ОЛО |
Дополнительно значительные суммы могут тратиться на проведение пусконаладочных работ, расходные материалы, доставку, обучение персонала, а также сертификацию и метрологическое обеспечение.
[1] Большинство автоматических анализаторов имеют специализированное применение.
[2] Указана стоимость собственно прибора. Калибровки выполняет пользователь, ручная пробоподготовка.
[3] Указана стоимость собственно прибора. Калибровки выполняет пользователь, ручная пробоподготовка.










