При растворении хлора в воде в небольших концентрациях (на уровне мг/л), практически весь он реагирует с водой с образованием соляной (HCl) и хлорноватистой (HClO) кислот. Хлорноватистая кислота является слабой и потому диссоциирует не полностью. Степень диссоциации зависит от рН и температуры. «Хлорирующей» способностью обладает только недиссоциированная форма, поэтому при рН более 8 эффективность обеззараживания резко снижается. Каждая из форм хлора получила свое название и, к сожалению, не одно. Существует огромная путаница в наименованиях различных форм хлора в воде. Так, например, в методике йодометрического титрования по ГОСТ 18191-72 происходит определение «суммарного остаточного хлора», без указания, чем она отличается от «суммарного остаточного активного хлора». Сам термин «активный хлор», более применимый именно к недиссоциированной форме HClO, распространятся в ГОСТе на все формы хлора, включая хлорамины. Это не единственные примеры. Фактически в каждой отрасли сложились свои, зачастую противоречащие друг другу термины. Это лишь приблизительная и далеко не полная таблица наименований форм хлора. В скобках приведены редко используемые и иногда не совсем верно интерпретируемые термины.
При растворении хлора в воде в небольших концентрациях (на уровне мг/л), практически весь он реагирует с водой с образованием соляной (HCl) и хлорноватистой (HClO) кислот. Хлорноватистая кислота является слабой и потому диссоциирует не полностью. Степень диссоциации зависит от рН и температуры. «Хлорирующей» способностью обладает только недиссоциированная форма, поэтому при рН более 8 эффективность обеззараживания резко снижается. Каждая из форм хлора получила свое название и, к сожалению, не одно. Существует огромная путаница в наименованиях различных форм хлора в воде. Так, например, в методике йодометрического титрования по ГОСТ 18191-72 происходит определение «суммарного остаточного хлора», без указания, чем она отличается от «суммарного остаточного активного хлора». Сам термин «активный хлор», более применимый именно к недиссоциированной форме HClO, распространятся в ГОСТе на все формы хлора, включая хлорамины. Это не единственные примеры. Фактически в каждой отрасли сложились свои, зачастую противоречащие друг другу термины. Это лишь приблизительная и далеко не полная таблица наименований форм хлора. В скобках приведены редко используемые и иногда не совсем верно интерпретируемые термины.
| Тривиальные термины | Термины СанПиН | Термины ГОСТ 18190-72 | Английские названия | Пояснения | Химическая форма |
| Активный хлор |
Active chlorine (Residual chlorine) |
Равновесная концентрация хлорноватистой кислоты, зависящая от рН и pКHClO при данной температуре | [HClO] | ||
|
Свободный хлор (Остаточный хлор) |
Свободный остаточный хлор | Свободный остаточный хлор |
Free chlorine Total residual chlorine (Total free chlorine) |
Хлор, присутствующий в воде в виде хлорноватистой кислоты, ионов гипохлорита или растворенного молекулярного хлора. | [HClO] + [ClO-] + [Cl2] |
| Связанный хлор | Связанный остаточный хлор | Combined chlorine | Часть общего хлора, присутствующего в воде в виде органических и неорганических хлораминов. | [NH3-nCln]+[R-NH2-nCln] | |
| Общий хлор | Суммарный остаточный активный хлор | Total chlorine | Суммарная концентрация всех форм хлорноватистой кислоты, неорганических и органических хлораминов. Зависит от первоначальной дозы хлорирующего агента в процессе дезинфекции |
[Cl2]+[HClO]+[ClO-]+[NH3-nCln]+[R-NH2-nCln], где R-органическая молекула n=2 – дихлорамины n=1 – монохлорамины |
|
|
Суммарный остаточный хлор (Активный хлор) |
Хлор, определяемый йодометрическим титрованием, соответствует общему хлору, но не всегда в полной мере учитывает содержание хлораминов |
[Cl2]+[HClO]+[ClO-]+[NH3-nCln]+[R-NH2-nCln] (частично), где R-органическая молекула n=2 – дихлорамины n=1 – монохлорамины |
05.08.05
к.х.н., Платонов М.М.
³⁵₁₇Cl . 35 — массовое число. ( число протонов + число нейтронов )
17 — число протонов.
35-17=18 — число нейтронов.
mp=1,00728 а. е. м.
mn= 1,00867 а. е. м.
Мя=35 а. е. м.
E связи = ΔM*C²
ΔM — дефект масс. С — скорость света.
ΔM =17*1,00728 + 18*1,00867 — 35 = 0,27982 а. е. м.
Е связи = 0,27982 * 1,66 * 10⁻²⁷ * (3*10⁸)² = 4,180*10⁻¹¹ Дж.
Е связи = 2,51 * 10⁸ = 251 МэВ.
Ковалентная связь образуется при взаимодействии неметаллов. Атомы неметаллов имеют высокую электроотрицательность и стремятся заполнить внешний электронный слой за счёт чужих электронов. Два таких атома могут перейти в устойчивое состояние, если объединят свои электроны.
Ковалентная связь — это связь между атомами неметаллов, образованная за счёт общих электронных пар.
Рассмотрим возникновение ковалентной связи в простых веществах.
1. Образование молекулы водорода.
Каждый атом водорода имеет один электрон. Для перехода в устойчивое состояние ему необходим ещё один электрон.
При сближении двух атомов электронные облака перекрываются. Образуется общая электронная пара, которая связывает атомы водорода в молекулу.
В пространстве между двумя ядрами общие электроны бывают чаще, чем в других местах. Там формируется область с повышенной электронной плотностью и отрицательным зарядом. Положительно заряженные ядра притягиваются к ней, и образуется молекула.
При этом каждый атом получает завершённый двухэлектронный внешний уровень и переходит в устойчивое состояние.
Рис. (1). Образование молекулы водорода
Ковалентная связь за счёт образования одной общей электронной пары называется одинарной.
Общие электронные пары (ковалентные связи) образуются за счёт неспаренных электронов, расположенных на внешних энергетических уровнях взаимодействующих атомов.
У водорода — один неспаренный электрон. Для других элементов их число равно 8 – № группы.
Неметаллы VIIА группы (галогены) имеют на внешнем слое один неспаренный электрон.
У неметаллов VIА группы (кислород, сера) таких электронов два.
У неметаллов VА группы (азот, фосфор) — три неспаренных электрона.
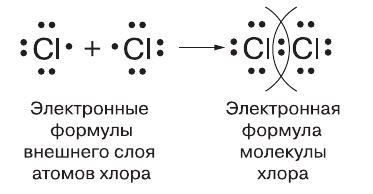
2. Образование молекулы хлора.
Атом хлора на внешнем уровне имеет семь электронов. Шесть из них образуют пары, а седьмой неспаренный.
При соединении атомов образуется одна общая электронная пара, то есть возникает одна ковалентная связь. Каждый атом получает завершённый восьмиэлектронный внешний слой. Связь в молекуле хлора тоже одинарная. Такие же одинарные связи существуют в молекулах фтора, брома и иода.
Рис. (2). Образование молекулы хлора
Если атомы имеют несколько неспаренных электронов, то образуются две или три общие пары.
3. Образование молекулы кислорода.
У атома кислорода на внешнем уровне — два неспаренных электрона.
При взаимодействии двух атомов кислорода возникают две общие электронные пары. Каждый атом заполняет свой внешний уровень до восьми электронов. Связь в молекуле кислорода двойная.

Рис. (3). Образование молекулы кислорода
4. Образование молекулы азота.
Атом азота имеет три неспаренных электрона на внешнем уровне.
В молекуле образуются три общие электронные пары. Связь в молекуле азота тройная.
Рис. (4). Образование молекулы азота
Образование ковалентных связей показывают структурные (графические) формулы, в которых общая электронная пара обозначается чертой. Одна черта между атомами обозначает одинарную связь, две черты — двойную, три черты — тройную:
Источники:
Рис. 1. Образование молекулы водорода © ЯКласс
Рис. 2. Образование молекулы хлора © ЯКласс
Рис. 3. Образование молекулы кислорода © ЯКласс
Рис. 4. Образование молекулы азота © ЯКласс
Запишите схему образования ковалентной связи на примере молекулы хлора.
reshalka.com
ГДЗ Химия 8 класс класс Габриелян. §35. Проверьте свои знания. Номер №3
Решение
Каждый атом хлора, как и любого другого галогена, содержит на внешнем электронном слое семь электронов: три электронные пары и один непарный электрон, что условно отражает следующая электронная формула его внешнего слоя:
Следовательно, каждому атому не хватает до завершения одного электрона. При сближении двух атомов хлора непарные электроны объединяются в общую электронную пару, которая и связывает их в молекулу.
Для того чтобы изобразить образование ковалентной связи, используют условное обозначение — общую электронную пару обозначают чёрточкой, или валентным штрихом. Формулу, в которой ковалентные связи обозначены валентным штрихом, называют структурной формулой. Для молекулы хлора структурную формулу записывают так: Cl − Cl