Примеры
П-1.1
Найти
абсолютное давление пара в котле,
приведенное к 0
ºС, если
манометр показывает р
= 0,13 МПа, а атмосферное давление по
ртутному барометру составляет 680 мм рт.
ст. (90660 Па) при температуре t
= 25 ºС.
Решение.
Из уравнения (1.4)
рабс
= ратм
+ рман.
Показание
барометра, полученное при t
= 25 ºС приводим к 0 ºС.
В0
= В(1
– 0,000172t)
= 90660·0,9957 =
90270 Па.
Тогда абсолютное
давление пара в котле
рабс
= 0,13 + 0,09 = 0,22 МПа.
П-1.2
Избыточное
давление в паровом котле р
= 0,04 МПа при барометрическом давлении
В01
= 96660 Па (725
мм рт. ст.). Чему будет равно избыточное
давление в котле, если показание барометра
повысится до В02
= 104660 Па, а
состояние пара в котле останется прежним?
Барометрическое давление приведено к
0 ºС.
Абсолютное давление
в котле
рабс
= 40000 + 96660 = 136660 Па.
Избыточное
давление при показании барометра В02
= 104660 Па.
рман
= 136660 – 104660 = 32000 Па.
Задачи
З-1.1
Для
измерения малых избыточных или
вакуумметрических давлений применяются
микроманометры (рис. 1). Определить
абсолютное давление в воздухопроводе
1, если длина столба жидкости в трубке
микроманометра 2, наклоненной под углом
α
= 30º, равна 180 мм. Рабочая жидкость –
спирт плотностью
= 0,8 г/см3.
Показание барометра 0,102 МПа. Давление
выразить в МПа, мм рт. ст., кг/см2.
Ответ:
рабс
= 0,1027 МПа = 770 мм рт. ст. = 1,047 кг/см2.

Рис. 1
З-1.2
Определить
абсолютное давление в паровом котле,
приведенное к 0 ºС, если манометр
показывает 0,245 МПа, а атмосферное давление
по ртутному барометру составляет В
= 93325 Па (700 мм рт. ст.) при
t
= 20 ºС.
Ответ:
р
= 0,338 МПа.
З-1.3
Разряжение
в газоходе 1 парового котла измеряется
тягомером с наклонной трубкой 2 (рис.
2). Угол наклона трубки
α = 30º, длина
столба воды l
= 160 мм. Определить абсолютное давление
газов, если показание ртутного барометра,
приведенное к 0 ºС, В0
= 98,7 кПа.
Ответ:
р
= 97,9 кПа.
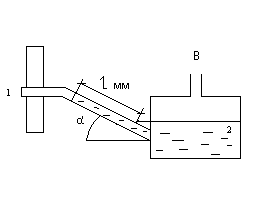
Рис. 2
З-1.4
Для
предупреждения испарения ртути, обычно
при пользовании ртутными манометрами
над уровнем ртути наливают столб воды.
Определить
абсолютное давление в сосуде, если
разность столбов ртути в U-образном
манометре составляет 580 мм рт. ст. при
температуре 25 ºС, а высота столба воды
над ртутью равна 150 мм. Атмосферное
давление по ртутному барометру В
= 102,7 кПа при t
= 25 ºС.
Ответ:
р
= 0,18 МПа.
З-1.5
Разряжение
в газоходе измеряется тягомером и равно
412 Па
(42 мм вод. ст.). Атмосферное
давление по ртутному барометру
В
= 100925 Па (757 мм рт. ст.) при t
= 15 ºС. Определить абсолютное давление
дымовых газов.
Ответ:
р
= 100250 Па.
2 Законы и уравнения состояния идеальных газов
Под
идеальным
газом понимают
воображаемый газ, в котором отсутствуют
силы притяжения между молекулами, а
собственный объем молекул исчезающе
мал по сравнению с объемом междумолекулярного
пространства. Таким образом, молекулы
идеального газа принимают за материальные
точки. В действительно существующих
газах при высоких температурах и малых
давлениях можно пренебречь силами
притяжения и
объёмом
самих молекул. Поэтому такие газы можно
также считать идеальными.
В
тех газах, которые находятся в состояниях,
достаточно близких к сжижению, нельзя
пренебречь силами притяжения между
молекулами и объемом последних. Такие
газы нельзя отнести к идеальным, и их
называют реальными
газами.
Основное уравнение
кинетической теории газов имеет вид
, (2.1)
где
р
–
давление идеального газа;
n
– число молекул в 1 м3
газа (концентрация молекул);
т
–
масса одной молекулы;
w
– средняя
квадратичная скорость поступательного
движения молекул;
—
средняя кинетическая энергия
поступательного движения одной молекулы.
Таким
образом, основное уравнение кинетической
теории газов устанавливает связь между
давлением газа, средней кинетической
энергией поступательного движения
молекул и их концентрацией.
Основные
зависимости, характеризующие соотношение
между параметрами идеального газа при
некоторых вполне определенных условиях
изменения его состояния, легко получаются
из основного уравнения кинетической
теории газов.
Для
газов, взятых при одинаковых температурах
и давлениях, имеет место следующая
зависимость, полученная на основе закона
Авогадро:
, (2.2)
где
μ
— молекулярная масса газа, кг/кмоль.
Так
как, согласно (1.2)
,
то
. (2.3)
Величина
μv
представляет собой объем килограмм-молекулы
или киломоля (кмоль) газа. Так как в 1 м3
газа могут содержаться, в зависимости
от параметров его состояния, разные
количества газа, принято относить 1 м3
газа к так называемым нормальным
условиям
(н.у.), при которых рабочее вещество
находится под давлением р
= 101325 Па и Т
= 273,15 К (760 мм рт. ст. и 0 ºС). Объем кмоля
всех идеальных газов равен Vμ
= 22,4136 м3/кмоль
при н.у. Плотность и удельный объем
любого газа при н.у. определяются из
равенств
кг/м3;
нм3/кг. (2.4)
Характеристическое
уравнение идеального газа или уравнение
состояния связывает между собой основные
параметры состояния – давление, объем
и температуру – и может быть представлено
следующими уравнениями, каждое из
которых отличается от другого тем, что
относится к различным массам газа:
первое – к общей массе в кг, второе – к
1 кг, третье – к 1 кмолю газа (уравнение
Клапейрона–Менделеева):
pV
= MRT, (2.5)
pv
= RT, (2.6)
pVμ
= μRT, (2.7)
где
р
– давление газа в Па;
V
– объем газа в м3;
М
– масса газа в кг;
v
– удельный объем газа в м3/кг;
Vμ
– молярный объем газа в м3/кмоль;
R
– газовая постоянная для 1 кг газа в
Дж/(кг·К);
μR
– универсальная газовая постоянная 1
кмоля газа в Дж/(кмоль·К).
Численное
значение универсальной газовой постоянной
получается из уравнения (2.7) при подстановке
значений входящих в него величин при
н.у.:
Дж/(кмоль·К). (2.8)
Газовую
постоянную, отнесенную к 1 кг газа,
определяют из уравнения
Дж/(кг·К), (2.9)
где
μ
– масса 1 кмоля газа, кг (численно равная
молекулярной массе газа).
Пользуясь
характеристическим уравнением для двух
различных состояний какого-либо газа,
можно получить выражение для определения
любого параметра при переходе от одного
состояния к другому, если значения
остальных параметров известны:
, (2.10)
. (2.11)
Уравнение
(2.10) можно переписать следующим образом:
, (2.12)
следовательно,
можно определить плотность газа при
переходе из одного состояния в другое:
,
кг/м3. (2.13)
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Пример 2.1
В пусковом баллоне дизеля вместимостью 0,3 м3 содержится воздух, плотность которого 2,86 кг/м3. Определить массу воздуха в баллоне.
Решение
Массу воздуха в баллоне Определим по формуле:
= 2,86 кг/м3·0,3 м3 = 0,86 кг.
Пример 2.2
Диаметр днища коллектора водотрубного котла = 1,2 м, давление пара в котле
= 2,5 МПа. Найти силу, действующую на днище коллектора изнутри.
Решение
Площадь днища коллектора равна:
= 0,785
= 0,785·1,22 = 1,13 м2.
Сила, действующая на днище коллектора котла изнутри, равна:
= 2,5·106 ·1,13 = 2,83·106 Н = 2,83 МН.
Пример 2.3
Найти связь между единицами давления.
Решение
1 ат (техн.) = 1 кг/см2 = 10000 кг/м2 = 735,6 мм рт. ст = 10 м вод. ст =
= 0,981 бар = 98067 Па;
1 атм (физ.) = 1,032 кг/см2 = 760 мм рт. ст = 10332 мм вод. ст = 1,01 бар =
= 101325 Па.
Пример 2.4
Определить абсолютное давление пара в котле, если манометр показывает = 1,35 бар, а атмосферное давление по ртутному барометру составляет
= 680 мм рт. ст. при
oС.
Решение
Абсолютное давление определим по формуле:
.
Показание барометра получено при температуре ртути 25 oС. Это показание нужно привести к 0 oС:
= 680 мм рт. ст. – (4,31 мм · 680 мм рт. ст.) / 1000 мм = 677,07 мм рт. ст.
Абсолютное давление пара в котле равно:
1,35·105 + 677,07 · 133 = 2,25 · 105 Па = 0,225 МПа.
Рабочее тело и параметры его состояния
Передача тепловой энергии осуществляет рабочее тело, т. е. веществом, способным воспринимать теплоту и совершать работу. В отопительно-котельной технике рабочее тело это горячая вода и водяной пар.
В водогрейных или паровых котлах и парогенераторах теплота продуктов сгорания, образующаяся при сжигании топлива, передается через стенки котла (площадь поверхности нагрева) к воде, которая нагревается до определенной температуры или преобразуется в пар. В результате сообщения теплоты рабочее тело изменяет свое состояние, характеризующееся параметрами состояния рабочего тела: температурой, удельным объемом, давлением. Часто эти параметры называют основными.
Температура — мера нагретости тела, которая является величиной, определяющей направление самопроизвольной передачи теплоты.
Температура измеряется в градусах. Градус — одна сотая часть расстояния на столбике ртути между точками, соответствующими температурам плавления льда и кипения воды при атмосферном давлении 101,3 кПа (760 мм рт. ст.). Шкалу температур, полученную таким образом, называют стоградусной, или шкалой Цельсия °С. Температуру, выраженную по этой шкале, принято обозначать буквой t.
Стоградусная, или международная, практическая шкала применяется наравне с основной в международной системе (СИ) термодинамической шкалой температур Кельвина. За начало отсчета температур по этой шкале принят абсолютный нуль (- 273 °С) — наинизшая теоретически возможная температура, при которой отсутствует движение молекул. При этом размер градуса оставлен таким же, как в практической шкале. Выраженную по шкале Кельвина температуру обозначают буквой Т, а единицу ее измерения — (Кельвин) К. Температура, выраженная в Кельвинах, связана с температурой в градусах Цельсия соотношением:
T = t + 273.
Таким образом, по данной шкале температура таяния льда равна 273 К, а температура кипения воды 373 К. Однако следует отметить, что температура кипения зависит от давления. При давлении выше атмосферного вода закипает при температуре более 100 °С. Например, при давлении 0,17 МПа температура кипения составит 115 С.
Удельный объем v — это объем единицы массы вещества
v = V/M,
где V — объем тела, м3; М — масса тела, кг.
Величина, обратная удельному объему, называется плотностью и обозначается буквой р:
p =1/v = M/V.
Давление — сила, действующая на единицу площади поверхности тела (нормально или перпендикулярно последней).
Чтобы определить давление Р, надо силу F разделить на площадь S, на которую она действует, т. е.
P=F/S.
В Международной системе СИ за единицу давления принят Паскаль (Па=Н/м2) — давление силы, равной 1 Ньютону, на 1 квадратный метр. Эта единица давления очень мала и пользоваться ею практически неудобно, поэтому употребляют более крупные кратные единицы: 1 МПа (мегапаскаль) = 106 Па (для измерения, например давления пара в котле), 1 кПа (килопаскаль) — 103 Па (для измерения, например барометрического давления).
Широкое распространение в технике имеет внесистемная единица давления — техническая атмосфера (или кратко атмосфера): 1ат = 98,0665 × 103Па = 0,0981 МПа = 1 кгс/см2 = 104 кгс/м2.
Небольшие давления, а также разрежения измеряют иногда высотой столба жидкости (например, воды, ртути). Единицы измерения 1 мм вод. ст. и 1 м вод. ст. широко используются в технике (1 мм вод. ст. = 9,807 Па).
В закрытых сосудах различают давление избыточное, разрежение (или вакуум) и абсолютное. Давление в закрытом сосуде, превышающее атмосферное, называется избыточным (ати), а давление меньше атмосферного разрежением или вакуумом. Абсолютное давление (ата) равно сумме измеренного избыточного и атмосферного давлений или разности атмосферного давления и измеренного разрежения.
Избыточное или рабочее давление в котлах, трубопроводах и других сосудах измеряют приборами, которые называются манометрами, а вакуум или разрежение измеряют вакуумметрами. Например, манометр показывает давление пара в котле 0,07 МПа (0,7 кгс/см2). Это значит, что давление в котле 0,7 ати. Для того чтобы получить абсолютное давление пара в котле, необходимо к 0,7 ати прибавить атмосферное давление, т. е, 0,7 + 1 = 1,7 ата (атмосферы абсолютные).
Если в каком-либо сосуде имеется разрежение, равное 0,5 ата, то абсолютное давление составит 1 — 0,5 = 0,5 ата или 0,05 МПа.
Обозначив Ра — атмосферное давление; Рм — избыточное или манометрическое давление, Р — абсолютное давление, Рв — разрежение или вакуум, имеем следующие формулы соотношения давлений:
Рм = Р — Ра; Р = Рк + Ра; Рв = Ра — Р
Атмосферное давление. Земля окружена воздушной оболочкой (атмосферой) толщиной в несколько сотен километров. Поверхность земли и находящиеся на ней предметы подвержены действию атмосферного давления.
Давление в 1 атмосферу уравновешивается столбиком ртути высотой 760 мм (физическая атмосфера). Зная плотность ртути, можно подсчитать величину физической атмосферы в другие единицах, например в кгс/м : 13595×0,76=10331,2 кгс/м2, или 1,033 кгс/см2. Таким образом, физическая атмосфера равна 760 мм рт. ст., или 1,033 кгс/см2 или 101,3 кПа, Физическая атмосфера сокращенно обозначается атм. В отличие от физической, техническая атмосфера (1 ат) равна 1 кгс/см3, или 735,6 мм рт. ст., или 98 кПа; 1 кгс/м2 = 1 мм вод. ст.
Атмосферное давление зависит от состояния погоды и высоты местности над уровнем моря. Атмосферное давление на уровне моря равно 101,3 кПа (760 мм рт. ст.). Чем выше над уровнем моря точка поверхности земли, тем меньше атмосферное давление. Этим и объясняется то, что температура кипения воды высоко в горах менее 100 °С. Атмосферное давление измеряется приборами, которые называют барометрами. Помимо основных параметров рабочее тело имеет теплоемкость, теплопроводность.
Теплоемкость — количество теплоты, необходимое для изменения температуры какого-либо вещества на один градус. Тепловые свойства вещества характеризуются теплоемкостью его единицы количества (1 кг, 1 м3, 1 киломоль), которую соответственно называют удельной массовой, объемной или киломольной теплоемкостью. Единицами измерения указанных удельных теплоемкостей являются в Международной системе единиц СИ кДж/(кг×град); кДж/(м3×град); кДж/(кмоль×град) или ккал/(кг×град); ккал/(м3×град); ккал/(кмоль×град).
Для газов удельная теплоемкость зависит от того, в каких условиях происходит нагревание. При этом различают удельную теплоемкость при постоянном объеме Сv и удельную теплоемкость при постоянном давлении Ср. Причем Ср всегда больше, чем Сv. Для твердых тел и жидкостей эти теплоемкости не различаются.
Зная удельную теплоемкость вещества, по формуле
Q=Cm(t2 – t1)
Можно рассчитать количество теплоты (кДж или ккал), идущее на нагревание или охлаждение тела. В данной формуле С — удельная теплоемкость; m — единица количества вещества; t1 – t2 — разность температур.
Значения удельной теплоемкости веществ и материалов, наиболее часто встречающихся в отопительно-котельной технике, приводятся ниже, кДж/ (кг×град) ккал/(кг×град).
В табл. 1 даны значения Ср и Cv для некоторых газов при температуре 0 °С.
Водяной пар и его свойства. Водяной пар получают в паровых котлах при постоянном давлении (Р = const). В отопительных котельных малой мощности давление пара не превышает 0,07 МПа (0,7 кгс/см2).
Переход вещества из жидкого состояния в газообразное называется парообразованием, а из газообразного состояния в жидкое — конденсацией. Процесс парообразования протекает следующим образом. Сначала происходит нагрев воды до температуры кипения при соответствующем давлении. При дальнейшем сообщении теплоты кипящая вода превращается в пар и ее температура до полного испарения воды остается постоянной.Кипение есть процесс парообразования во всем объеме жидкости.
Количество теплоты, которое необходимо сообщить воде для превращения ее из жидкого состояния в парообразное при температуре кипения, называется скрытой теплотой парообразования или теплотой испарения.
В теплотехнических расчетах часто приходится иметь дело с энтальпией, которая может быть оценена как суммарное количество теплоты, которое требуется для превращения 1 кг воды, взятой при 0°С, в пар при постоянном давлении. Энтальпия (или теплосодержание) — параметр состояния газа. Например, в открытом сосуде энтальпия кипящей воды составит около 420 кДж/кг (100 ккал/кг). Скрытая теплота парообразования воды при атмосферном давлении равна 2260 кДж/кг (539 ккал/кг). Следовательно, энтальпия пара при атмосферном давлении составит 420 + 2260 = 2680 кДж/кг (100 + 539 = 639 ккал/кг). С увеличением давления пара скрытая теплота парообразования уменьшается, а энтальпия пара повышается.
Различают пар насыщенный и перегретый.
Пар, находящийся в динамическом равновесии со своей жидкостью и имеющий одинаковые с жидкостью температуру и давление, называется насыщенным.
Обычно в процессе парообразования в пар попадают капельки котловой воды. Такой пар называется влажным насыщенным. Насыщенный пар, не имеющий капелек воды, называется сухим насыщенным. Доля сухого насыщенного пара во влажном называется степенью сухости пара и обозначается х. При этом влажность пара будет равна 1 — х. Для сухого насыщенного пара х = 1.
Таблица 1. Массовая удельная теплоемкость некоторых газов при постоянных давлениях и объеме
Влажность насыщенного пара нормально работающих паровых чугунных котлов составляет 1-3 %.
Если сообщить теплоту сухому насыщенному пару при данном постоянном давлении, то получится перегретый пар. Перегретый пар не содержит в себе влаги и его температура при данном давлении выше температуры котловой воды. В отопительных установках перегретый пар обычно не применяют.
Разновидностью процесса парообразования является испарение воды. Испарение воды в открытом сосуде при атмосферном давлении может происходить и при температуре меньше 100 °С, В отличие от кипения, когда паровые пузыри возникают во всем объеме, испарение воды происходит только с поверхности жидкости. Чем меньше паров воды в окружающем воздухе и чем выше температура воды, тем интенсивнее идет испарение с ее поверхности.
Обычно зависимости между параметрами состояния рабочего тела изучают и устанавливают для упрощенной модели рабочего тела, например идеального газа, в котором отсутствуют силы взаимодействия между молекулами газа, а сами молекулы принимаются за материальные точки, не имеющие объема. С методической точки зрения такой подход более удобен. Однако законы термодинамики и полученные на их основе соотношения, справедливы не только для газа, а вообще для всяких тел независимо от их агрегатного состояния. Несмотря на то, что в природе идеальный газ отсутствует, в теплотехнических расчетах вполне допустимо (без особой погрешности для точности расчетов) принимать за идеальные все газы, с которыми в теплотехнике приходится иметь дело, за исключением водяного пара, который относится к реальным газам. Уравнения состояния реальных газов (в отличие от идеальных) имеют сложный характер и для практических расчетов неудобны, поэтому их обычно используют для составления диаграмм, пригодных для теплотехнических расчетов, и таблиц термодинамических свойств реальных газов, важных для техники.
Примеры решения задач теплотехники
Ниже приведены примеры решения простейших задач с использованием основных законов теплотехники и термодинамики.
Задача
Манометр, установленный на паровом котле, показывает давление 1,8 МПа.
Каково абсолютное давление пара в котле, если атмосферное давление равно 0,099 МПа.
Решение:
Абсолютное давление определяется, как сумма внешнего (барометрического) и избыточного (манометрического) давлений:
рабс = рб + ризб = 1,8 + 0,099 ≈ 1,9 МПа.
***
Задача
Вакуумметр показывает разрежение 80 кПа.
Каково абсолютное давление в сосуде, если атмосферное давление по барометру составляет 0,1 МПа?
Решение:
Задача решается аналогично предыдущей, но в этом случае абсолютное давление в сосуде определяется, как разность между внешним (барометрическим) давлением и избыточным давлением, которое показывает вакуумметр.
Учитывая, что 0,1 МПа равен 100 кПа, получим:
рабс = рб + ризб = 100 – 80 = 20 кПа.
***
Задача
В баллоне содержится 2 килограмма кислорода при давлении 8,3 МПа и температуре 15˚ С.
Вычислить вместимость (емкость) баллона.
Величину удельной газовой постоянной для кислорода принять равной R = 259,8 Дж/(кг×К).
Решение:
Абсолютная температура кислорода при 15˚ С будет равна: T = 15 + 273 (К).
Давление в баллоне равно 8,3 МПа, что соответствует 8,3×106 Па.
Из уравнения состояния Менделеева — Клайперона получаем:
V = MRT/p = 2 × 259,8(15 + 273)/(8,3×106) = 0,018 м3 = 18 л.
***
Задача
Резервуар вместимостью 4 м3 заполнен углекислым газом.
Найти массу этого газа и его вес, если избыточное давление, показываемое манометром, присоединенным к резервуару, равно 40 кПа, температура газа — 80˚ С, а атмосферное (барометрическое) давление равно 102,4 кПа.
Удельная газовая постоянная для углекислого газа равна R = 188,9 Дж/(кг×К).
Решение:
Абсолютное давление углекислого газа в резервуаре равно сумме барометрического и избыточного давлений:
рабс = рб + ризб = 102,4 + 40 = 142,4 кПа = 142,4×103 Па.
Абсолютная температура газа будет равна: Т = 80 + 273 = 353 К.
Применив уравнение Менделеева-Клайперона, определим массу углекислого газа, заключенного в резервуаре:
М = рV/(RT) = 142,4×103 × 4/(188,9 × 353) = 8,53 кг.
Вес газа определяется, как произведение его массы на ускорение свободного падения:
G = Mg = 8,53 × 9,81 = 83,8 Н.
***
Задача
В продуктах сгорания топлива содержится по объему:
— углекислый газ СО2 – 12,2 %;
— кислород О2 – 7,1 %;
— уклекислота СО – 0,4 %;
— азот N2 – 80,3 %.
Определить для продуктов сгорания (смеси газов): массовый состав, среднюю молекулярную массу, плотность и газовую постоянную.
Решение
Продукты сгорания топлива представляют собой смесь перечисленных выше газов.
Молекулярные массы газов, входящих в смесь (справочные данные):
μСО2 = 44; μО2 = 32; μСО = 28; μN2 = 28.
В соответствии с законом Дальтона найдем среднюю молекулярную массу смеси газов в продуктах сгорания:
μсм = Σ riμi = 0,122×44 + 0,0071×32 + 0,004×28 + 0,803×28 = 30,2.
где: ri и μi – соответственно объемная доля i-го газа в смеси и его молекулярная масса.
Плотность смеси (при нормальных условиях) определим из соотношения:
ρсм = μсм/22,4 = 1,35 кг/м3.
Определим массовую долю каждого газа в составе продуктов сгорания из соотношения: mi = μi ri/μсм.
- mСО2 = 44×0,122/30,2 = 0,175;
- mО2 = 32×0,071/30,2 = 0,0752;
- mСО = 28×0,04/30,2 = 0,0037;
- mN2 = 28×0,803/30,2 = 0,745.
Зная молекулярную массу продуктов сгорания, вычислим удельную газовую постоянную смеси:
Rсм = R0/μсм = 8310/30,2 = 275,0 Дж/(кг×К),
где R0 = 8310 Дж/(кг×К) – универсальная газовая постоянная.
***
Внутренняя энергия и работа газа
Скачать теоретические вопросы к экзаменационным билетам
по учебной дисциплине «Основы гидравлики и теплотехники»
(в формате Word, размер файла 68 кБ)
Скачать рабочую программу
по учебной дисциплине «Основы гидравлики и теплотехники» (в формате Word):
- для специальности СПО «Механизация сельского хозяйства»
- для специальности СПО «Техническое обслуживание и ремонт автомобильного транспорта»
Скачать календарно-тематический план
по учебной дисциплине «Основы гидравлики и теплотехники» (в формате Word):
- для специальности СПО «Механизация сельского хозяйства»
- для специальности СПО «Техническое обслуживание и ремонт автомобильного транспорта»





