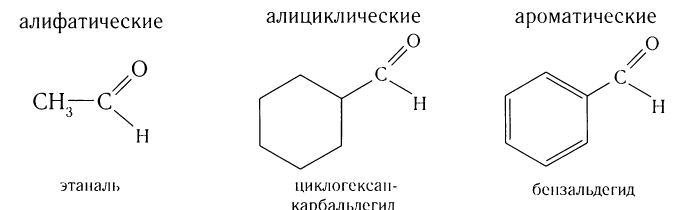
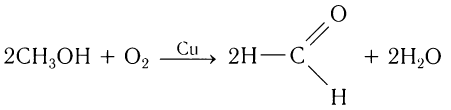
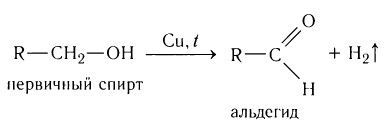
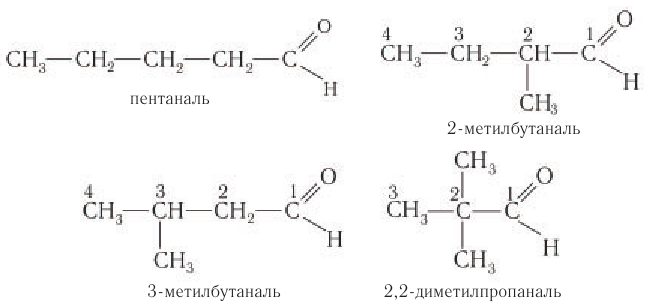
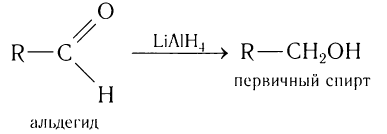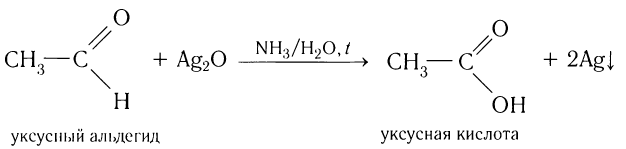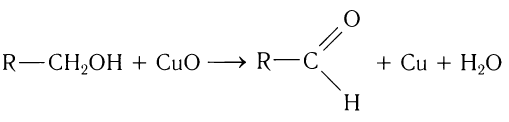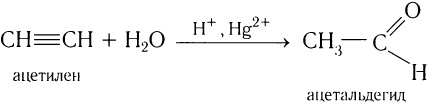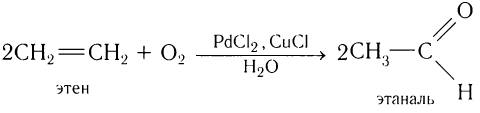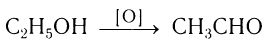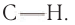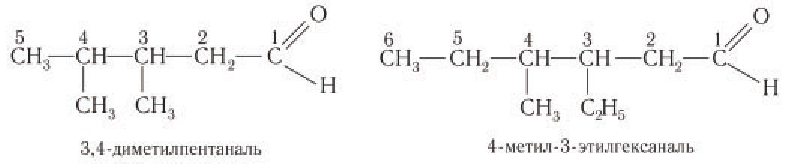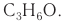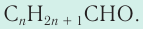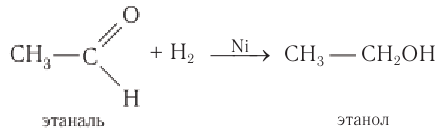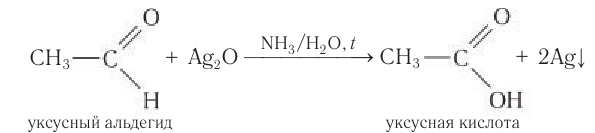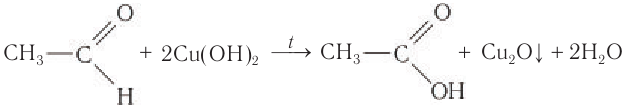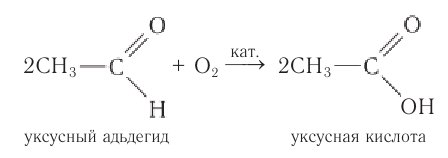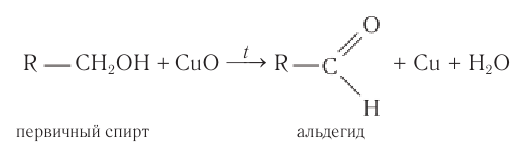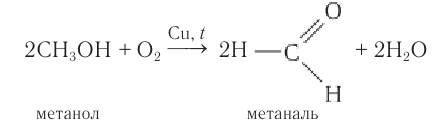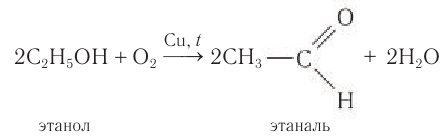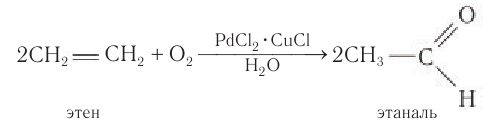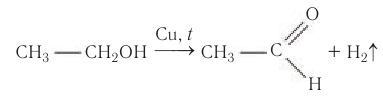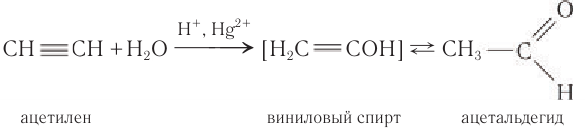Альдегиды — летучие жидкости органического состава, являющиеся продуктом неполного окисления спиртов. Карбонильная группа
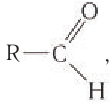
в молекулах альдегидов связана с одним атомом водорода и одной группой R.
Не часто встречаются в природе в отдельном виде, но, несомненно, играют важную роль в физиологических процессах растений и животных.
Общая формула альдегидов CnH2nO.
Многие альдегиды имеют специфический запах. Высшие альдегиды, в особенности непредельные, используются в пищевой промышленности и парфюмерии.

Номенклатура и изомерия альдегидов
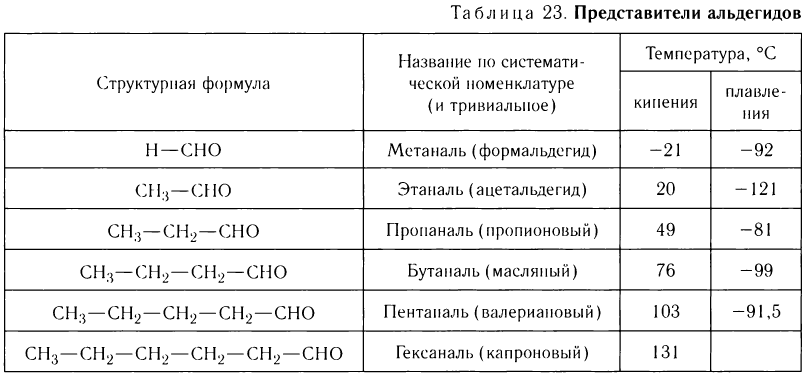
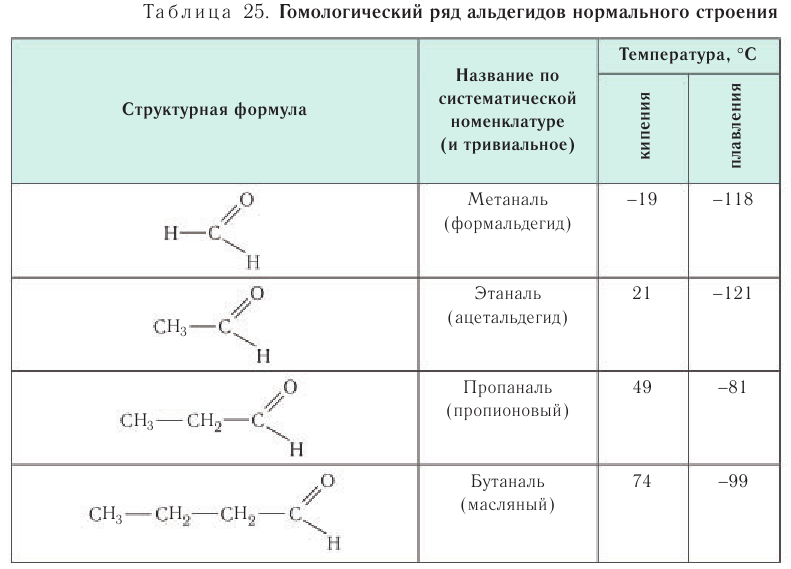
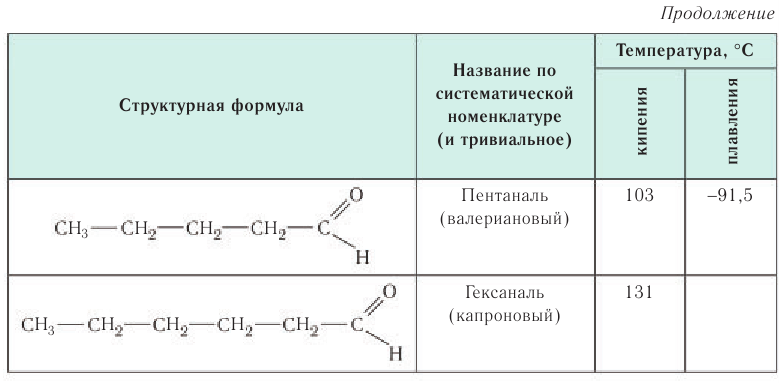
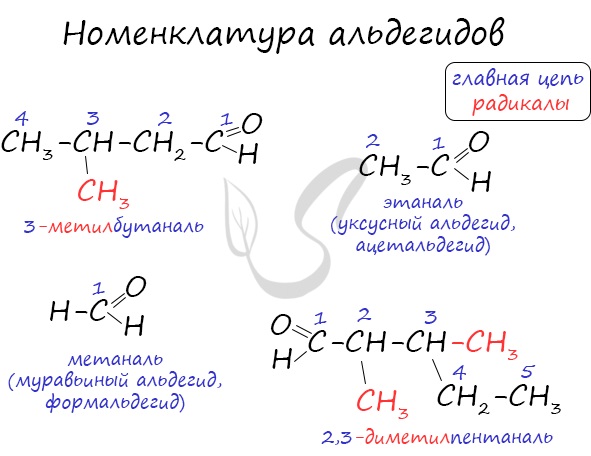
Названия альдегидов формируются путем добавления суффикса «аль» к названию алкана с соответствующим числом атомов углерода: метаналь,
этаналь, пропаналь, бутаналь, пентаналь и т.д.
Вы можете встретить их молекулярные формулы, где группа OH записана наоборот — HO. Например: метаналь — HCHO, этаналь —
CH3CHO, пропаналь — C2H5CHO. Это делают специально для того, чтобы их было легче отличить от спиртов.
Многие альдегиды имеют тривиальные названия. Наиболее известные: метаналь — формальдегид, этаналь — ацетальдегид. Замечу, что формалином
называется 40% раствор формальдегида.
Для альдегидов характерна структурная изомерия: углеродного скелета, межклассовая изомерия с кетонами.
Получение альдегидов и кетонов
- Окисление спиртов
- Пиролиз солей карбоновых кислот
- Каталитическое дегидрирование спиртов
- Реакция Кучерова
- Гидролиз дигалогеналканов
- Окисление метана
- Кумольный способ получения ацетона (и фенола)
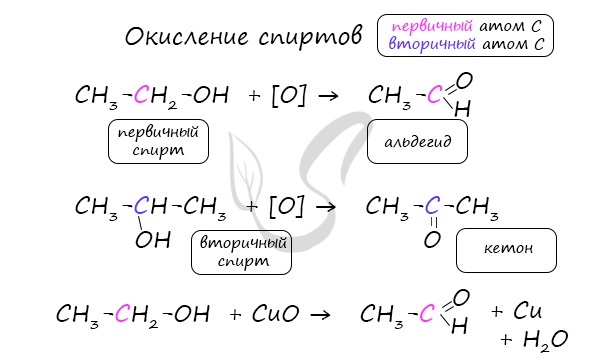
Важно заметить, что при окислении первичных спиртов образуются альдегиды, при окислении вторичных спиртов — кетоны.
Окисление с помощью оксида меди относится к лабораторным способам получения альдегидов.
Этот способ также просто осуществить в лабораторных условиях. При пиролизе (нагревании без доступа кислорода) кальциевых или
бариевых солей карбоновых кислот возможно получение кетонов.

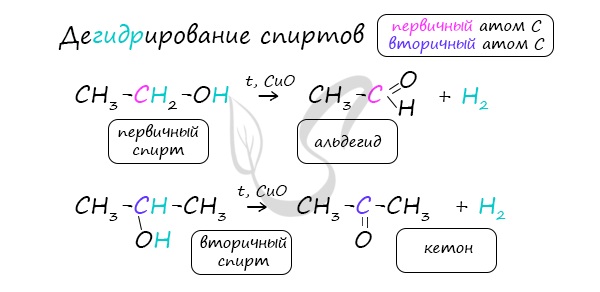
В присутствии катализатора и при нагревании спиртов от гидроксогруппы и прилежащего к ней атома углерода отщепляется по
атому водорода. В результате образуется карбонильная группа.
Реакцией Кучерова называют гидратацию алкинов в присутствии солей двухвалентной ртути.
В результате такой реакции ацетилен превращается в уксусный альдегид. Все остальные его гомологи: пропин, бутин, пентин и т.д. превращаются в
соответствующие кетоны.

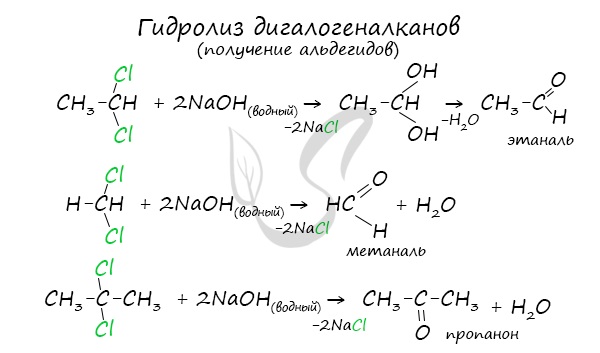
Для получения альдегида два атома галогена должны находиться у первичного атома углерода, для получения кетонов — у вторичного.
В результате такого гидролиза образуются двухатомные спирты, в которых две OH-группы прилежат к одному атому углерода. Такие соединения неустойчивы
и распадаются на карбонильное соединение (альдегид или кетон) и воду.
В промышленности окислением метана при температуре 500 °C и в присутствии катализатора получают формальдегид.

В прошлой теме, посвященной фенолам, мы касались данного способа. В результате такой реакции образуется не только фенол, но и ацетон.

Химические свойства альдегидов и кетонов
Запомните, что для альдегидов и кетонов характерны реакции присоединения по карбонильной группе. Это является важным отличием альдегидов от карбоновых кислот, для которых реакции присоединения не характерны.
- Реакции присоединения
- Окисление альдегидов
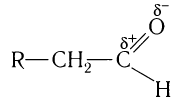
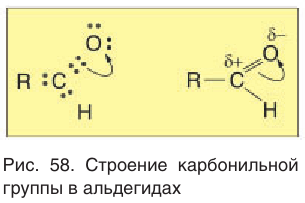
Для понимания механизма реакции важно вспомнить об электроотрицательности. В карбонильной группе кислорд, как более электроотрицательный
элемент, тянет электронную плотность на себя от углерода. На атоме кислорода возникает частичный отрицательный заряд (δ-), а на атоме
углерода частичный положительный (δ+).
Основы школьного курса физики подсказывают, что отрицательный заряд притягивает положительный: именно так и будет происходить
при присоединении различных молекул к карбонильной группе альдегидов и кетонов.
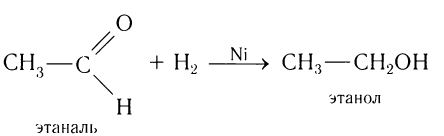
Реакция гидрирования альдегидов происходит по типу присоединения, сопровождается разрывом двойной связи в карбонильной группе.
Гидрирование альдегидов приводит к образованию первичных, а гидрирование кетонов — вторичных спиртов.
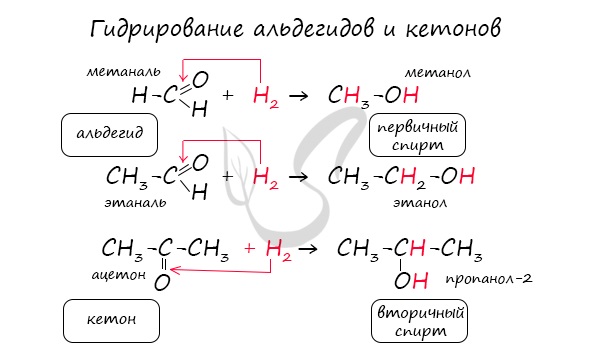
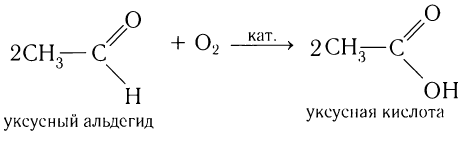
В результате полного окисления, горения, образуется углекислый газ и вода.
2CH3CHO + 5O2 → 4CO2 + 4H2O
Альдегиды легко окисляются до карбоновых кислот в лабораторных условиях. Это осуществляется с помощью известной реакции
серебряного зеркала. Данная реакция является качественной для альдегидов.
Кетоны, в отличие от альдегидов, в реакции окисления не вступают.

Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли

Важно заметить, что при окислении метаналя, образовавшаяся муравьиная кислота тут же окисляется до угольной кислоты, которая
распадается на углекислый газ и воду. Это связано с интересным фактом — наличием альдегидной группы у муравьиной кислоты.

Окисление также возможно другим реагентом — гидроксидом меди II. Эта реакция также относится к качественным для
альдегидов, в результате образуется кирпично-красный осадок оксида меди I.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
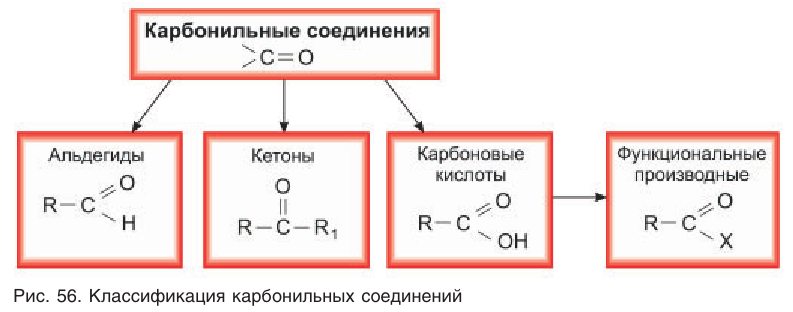
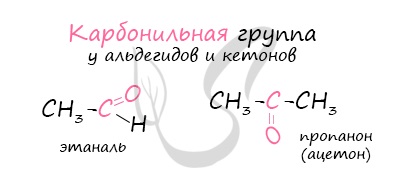
Карбонильные соединения – это органические вещества, молекулы которых содержат карбонильную группу:
Карбонильные соединения делятся на альдегиды и кетоны. Общая формула карбонильных соединений: СnH2nO.
Строение, изомерия и гомологический ряд альдегидов и кетонов
Химические свойства альдегидов и кетонов
Способы получения альдегидов и кетонов
Альдегидами называются органические соединения, содержащие карбонильную группу, в которой атом углерода связан с радикалом и одним атомом водорода.
Структурная формула альдегидов:
Кетонами называются соединения, в молекуле которых карбонильная группа связана с двумя углеводородными радикалами.
Структурная формула кетонов:
Строение карбонильных соединений
Атом углерода в карбонильной группе находится в состоянии sp2 -гибридизации и образует три σ-связи и одну π-связь.
Одна из σ–связей – связь С–О, все три σ–связи расположены в одной плоскости под углом 120о друг к другу.
π-Связь образована р-электронами атомов углерода и кислорода.
Из-за большей электроотрицательности атома кислорода по сравнению с атомом углерода связь С=О сильно поляризована, электронная плотность смещена к более электроотрицательному атому кислорода.
На атоме кислорода возникает частичный отрицательный (δ–), а на атоме углерода – частичный положительный (δ+) заряды.
Номенклатура карбонильных соединений
- По систематической номенклатуре к названию углеводорода добавляют суффикс «-АЛЬ».
Нумерация ведется от атома углерода карбонильной группы.
Например, 2-метилпропаналь
- К названию кетонов добавляют в название суффикс «-ОН». После этого добавляют номер атомов углерода карбонильной группы.
- Тривиальные названия альдегидов и кетонов приведены в таблице.
Изомерия карбонильных соединений
Изомерия альдегидов
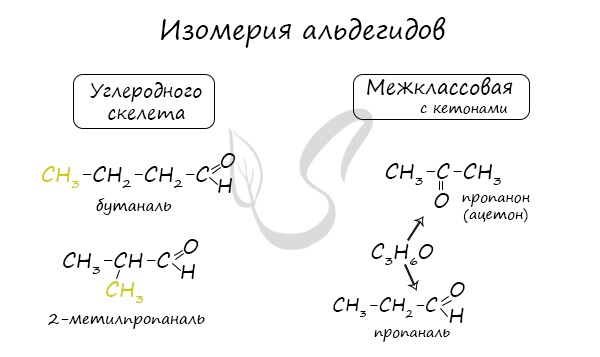
Для альдегидов характерна структурная изомерия – изомерия углеродного скелета и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
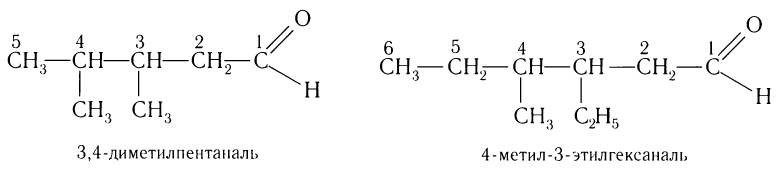
Изомерия углеродного скелета характерна для альдегидов, которые содержат не менее четырех атомов углерода.
Например. Формуле С4Н8О соответствуют два альдегида-изомера углеродного скелета
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Альдегиды являются межклассовыми изомерами с кетонами, непредельными спиртами и непредельными простыми эфирами, содержащими одну двойную связь в молекуле. Общая формула этих классов органических соединений — CnH2nО.
Межклассовая изомерия характерна для альдегидов, которые содержат не менее трех атомов углерода.
Например. Межклассовые изомеры с общей формулой С3Н6О: пропаналь СН3–CH2–CHO и ацетон CH3–СO–CH3
Изомерия кетонов
Для кетонов характерна изомерия углеродного скелета, изомерия положения карбонильной группы и межклассовая изомерия.
Изомерия углеродного скелета характерна для кетонов, которые содержат не менее пяти атомов углерода.
Например. Формуле С5Н10О соответствуют кетоны-изомеры углеродного скелета
Изомерия положения карбонильной группы характерна для кетонов, которые содержат не менее пяти атомов углерода.
Например. Формуле С5Н10О соответствуют два кетона-изомера углеродного скелета
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Кетоны являются межклассовыми изомерами с альдегидами, непредельными спиртами и непредельными простыми эфирами, содержащими одну двойную связь в молекуле. Общая формула этих классов органических соединений — CnH2nО.
Межклассовая изомерия характерна для кетонов, которые содержат не менее трех атомов углерода.
Например. Межклассовые изомеры с общей формулой С3Н6О: пропаналь СН3–CH2–CHO и ацетон CH3–СO–CH3
Физические свойства альдегидов и кетонов
Все альдегиды и кетоны, кроме формальдегида – жидкости. Лёгкие альдегиды хорошо растворимы в воде из-за водородных связей, которые они образуют с водой.
Химические свойства альдегидов и кетонов
1. Реакции присоединения
В молекулах карбонильных соединений присутствует двойная связь С=О, поэтому для карбонильных соединений характерны реакции присоединения по двойной связи. Присоединение к альдегидам протекает легче, чем к кетонам.
1.1. Гидрирование
Альдегиды при взаимодействии с водородом в присутствии катализатора (например, металлического никеля) образуют первичные спирты, кетоны — вторичные:
1.2. Присоединение воды
При гидратации формальдегида образуется малоустойчивое вещество, называемое гидрат. Оно существует только при низкой температуре.
1.3. Присоединение спиртов
При присоединении спиртов к альдегидам образуются вещества, которые называются полуацетали.
В качестве катализаторов процесса используют кислоты или основания.
Полуацетали существует только при низкой температуре.
Полуацетали – это соединения, в которых атом углерода связан с гидроксильной и алкоксильной (-OR) группами.
Полуацеталь может взаимодействовать с еще одной молекулой спирта в присутствии кислоты. При этом происходит замещение полуацетального гидроксила на алкоксильную группу OR’ и образованию ацеталя:
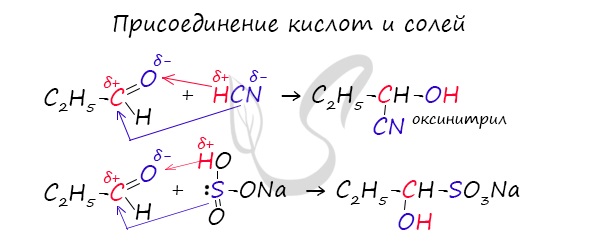
1.4. Присоединение циановодородной (синильной) кислоты
Карбонильные соединения присоединяют синильную кислоту HCN. При этом образуется гидроксинитрил (циангидрин):
2. Окисление альдегидов и кетонов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
Альдегид → карбоновая кислота
Формальдегид→ муравьиная кислота→ углекислый газ
вторичные спирты → кетоны
Типичные окислители — гидроксид меди (II), перманганат калия KMnO4, K2Cr2O7, аммиачный раствор оксида серебра (I).
Кетоны окисляются только при действии сильных окислителей и нагревании.
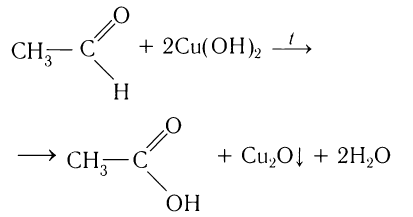
2.1. Окисление гидроксидом меди (II)
Происходит при нагревании альдегидов со свежеосажденным гидроксидом меди, при этом образуется красно-кирпичный осадок оксида меди (I) Cu2O. Это — одна из качественных реакций на альдегиды.
Видеоопыт окисления муравьиного альдегида гидроксидом меди (II) можно посмотреть здесь.
Например, муравьиный альдегид окисляется гидроксидом меди (II)
HCHO + Cu(OH)2 = Cu + HCOOH + H2O
Чаще в этой реакции образуется оксид меди (I):
HCHO + 2Cu(OH)2 = Cu2O + HCOOH + 2H2O
2.2. Окисление аммиачным раствором оксида серебра
Альдегиды окисляются аммиачным раствором оксида серебра (реакция «серебряного зеркала»).
Поскольку раствор содержит избыток аммиака, продуктом окисления альдегида будет соль аммония карбоновой кислоты.
Например, при окислении муравьиного альдегида аммиачным раствором оксида серебра (I) образуется карбонат аммония
Например, при окислении уксусного альдегида аммиачным раствором оксида серебра образуется ацетат аммония
Образование осадка серебра при взаимодействии с аммиачным раствором оксида серебра — качественная реакция на альдегиды.
Упрощенный вариант реакции:
2.3. Жесткое окисление
При окислении под действием перманганатов или соединений хрома (VI) альдегиды окисляются до карбоновых кислот или до солей карбоновых кислот (в нейтральной среде). Муравьиный альдегид окисляется до углекислого газа или до солей угольной кислоты (в нейтральной среде).
Например, при окислении уксусного альдегида перманганатом калия в серной кислоте образуется уксусная кислота
Кетоны окисляются только в очень жестких условиях (в кислой среде при высокой температуре) под действием сильных окислителей: перманганатов или дихроматов.
Реакция протекает с разрывом С–С-связей (соседних с карбонильной группой) и с образованием смеси карбоновых кислот с меньшей молекулярной массой или СО2.
| Карбонильное соединение/ Окислитель | KMnO4, кислая среда | KMnO4, H2O, t |
| Метаналь СН2О | CO2 | K2CO3 |
| Альдегид R-СНО | R-COOH | R-COOK |
| Кетон | R-COOH/ СО2 | R-COOK/ K2СО3 |
2.4. Горение карбонильных соединений
При горении карбонильных соединений образуются углекислый газ и вода и выделяется большое количество теплоты.
CnH2nО + 3n/2O2 → nCO2 + nH2O + Q
Например, уравнение сгорания метаналя:
CH2O + O2 = CO2 + H2O
3. Замещение водорода у атома углерода, соседнего с карбонильной группой
Карбонильные соединения вступают в реакцию с галогенами, в результате которой получается хлорзамещенный (у ближайшего к карбонильной группе атома углерода) альдегид или кетон.
Например, при хлорировании уксусного альдегида образуется хлорпроизводное этаналя
Полученное из ацетальдегида вещество называется хлораль. Продукт присоединения воды к хлоралю (хлоральгидрат) устойчив и используется как лекарство.
4. Конденсация с фенолами
Формальдегид может взаимодействовать с фенолом. Катализатором процесса выступают кислоты или основания:
Дальнейшее взаимодействие с другими молекулами формальдегида и фенола приводит к образованию фенолоформальдегидных смол и воды:
Фенол и формальдегид вступают в реакцию поликонденсации.
Поликонденсация — это процесс соединения молекул в длинную цепь (полимер) с образованием побочных продуктов с низкой молекулярной массой (вода или др.).
5. Полимеризация альдегидов
Полимеризация характерна в основном для легких альдегидов. Для альдегидов характерна линейная и циклическая полимеризация.
Например, в растворе формалина (40 %-ного водного раствора формальдегида) образуется белый осадок полимера формальдегида, который называется полиформальдегид или параформ:
Получение карбонильных соединений
1. Окисление спиртов
При окислении первичных спиртов образуются альдегиды, при окислении вторичных спиртов – кетоны.
1.1. Окисление спиртов оксидом меди (II)
Например, при окислении этанола оксидом меди образуется уксусный альдегид
Например, при окислении изопропанола оксидом меди образуется ацетон
1.2. Окисление спиртов кислородом на меди
При пропускании паров спирта с кислородом над медной сеткой образуются альдегиды и кетоны.
Например, при окислении пропанола-1 кислородом в присутствии меди образуется пропаналь
В промышленности формальдегид получают окислением метанола на серебряном катализаторе при температуре 650оС и атмосферном давлении:
1.3. Окисление спиртов сильными окислителями
Вторичные спирты при этом окисляются до кетонов. Первичные спирты можно окислить до альдегидов, если предотвратить дальнейшее окисление альдегида (например, отгонять образующийся альдегид в ходе реакции).
2. Дегидрирование спиртов
При пропускании спирта над медной сеткой при нагревании образуются карбонильные соединения.
Например, при дегидрировании этанола образуется этаналь
3. Гидратация алкинов
Присоединение воды к алкинам в присутствии солей ртути (II) приводит к образованию карбонильных соединений.
Например, при гидратации ацетилена образуется уксусный альдегид
Например: при гидратации пропина образуется ацетон
4. Гидролиз дигалогенпроизводных алканов
Под действием водного раствора щелочи образуется неустойчивый диол с двумя ОН-группами при одном атоме С, он теряет воду, превращаясь в альдегид или кетон.
Например: при гидролизе 1,1-дихлорэтана образуется этаналь
5. Пиролиз солей карбоновых кислот
При нагревании солей карбоновых кислот и двухвалентных металлов образуются неорганические соли (карбонаты) и кетоны.
Например: при пиролизе ацетата кальция образуется ацетон и карбонат кальция:
6. Кумольный способ получения ацетона
Ацетон в промышленности получают каталитическим окислением кумола.
Первый этап процесса – получение кумола алкилированием бензола пропеном в присутствии фосфорной кислоты:
Второй этап – окисление кумола кислородом. Процесс протекает через образование гидропероксида изопропилбензола:
Суммарное уравнение реакции:
7. Каталитическое окисление алкенов
При окислении этилена кислородом в присутствии катализаторов образуется уксусный альдегид.
From Wikipedia, the free encyclopedia
In organic chemistry, an aldehyde () is an organic compound containing a functional group with the structure R−CH=O.[1] The functional group itself (without the «R» side chain) can be referred to as an aldehyde but can also be classified as a formyl group. Aldehydes are a common motif in many chemicals important in technology and biology.[2][3]
Structure and bonding[edit]
Aldehydes feature a carbon center that is connected by a double bond to oxygen and a single bond to hydrogen and a single bond to a third substituent, which is carbon or, in the case of formaldehyde, hydrogen. The central carbon is often described as being sp2-hybridized. The aldehyde group is somewhat polar. The C=O bond length is about 120-122 picometers.[4]
Physical properties and characterization[edit]
Aldehydes have properties that are diverse and that depend on the remainder of the molecule. Smaller aldehydes are more soluble in water, formaldehyde and acetaldehyde completely so. The volatile aldehydes have pungent odors.
Aldehydes can be identified by spectroscopic methods. Using IR spectroscopy, they display a strong νCO band near 1700 cm−1. In their 1H NMR spectra, the formyl hydrogen center absorbs near δH 9.5 to 10, which is a distinctive part of the spectrum. This signal shows the characteristic coupling to any protons on the α carbon with a small coupling constant typically less than 3.0 Hz. The 13C NMR spectra of aldehydes and ketones gives a suppressed (weak) but distinctive signal at δC 190 to 205.
Applications and occurrence[edit]
Important aldehydes and related compounds. The aldehyde group (or formyl group) is colored red. From the left: (1) formaldehyde and (2) its trimer 1,3,5-trioxane, (3) acetaldehyde and (4) its enol vinyl alcohol, (5) glucose (pyranose form as α-D-glucopyranose), (6) the flavorant cinnamaldehyde, (7) retinal, which forms with opsins photoreceptors, and (8) the vitamin pyridoxal.
Naturally occurring aldehydes[edit]
Traces of many aldehydes are found in essential oils and often contribute to their favorable odours, e.g. cinnamaldehyde, cilantro, and vanillin. Possibly because of the high reactivity of the formyl group, aldehydes are not common in several of the natural building blocks: amino acids, nucleic acids, lipids. Most sugars, however, are derivatives of aldehydes. These aldoses exist as hemiacetals, a sort of masked form of the parent aldehyde. For example, in aqueous solution only a tiny fraction of glucose exists as the aldehyde.
Synthesis[edit]
There are several methods for preparing aldehydes,[2] but the dominant technology is hydroformylation.[5] Illustrative is the generation of butyraldehyde by hydroformylation of propene:
Oxidative routes[edit]
Aldehydes are commonly generated by alcohol oxidation. In industry, formaldehyde is produced on a large scale by oxidation of methanol.[6] Oxygen is the reagent of choice, being «green» and cheap. In the laboratory, more specialized oxidizing agents are used, but chromium(VI) reagents are popular. Oxidation can be achieved by heating the alcohol with an acidified solution of potassium dichromate. In this case, excess dichromate will further oxidize the aldehyde to a carboxylic acid, so either the aldehyde is distilled out as it forms (if volatile) or milder reagents such as PCC are used.[7]
Oxidation of primary alcohols to form aldehydes can be achieved under milder, chromium-free conditions by employing methods or reagents such as IBX acid, Dess–Martin periodinane, Swern oxidation, TEMPO,. or the Oppenauer oxidation.[citation needed]
Another oxidation route significant in industry is the Wacker process, whereby ethylene is oxidized to acetaldehyde in the presence of copper and palladium catalysts (acetaldehyde is also produced on a large scale by the hydration of acetylene).
On the laboratory scale, α-hydroxy acids are used as precursors to prepare aldehydes via oxidative cleavage.[8][9]
Specialty methods[edit]
| Reaction name | Substrate | Comment |
|---|---|---|
| Ozonolysis | Alkenes | Ozonolysis of non-fully-substituted alkenes yield aldehydes upon a reductive work-up. |
| Organic reduction | Esters | Reduction of an ester with diisobutylaluminium hydride (DIBAL-H) or sodium aluminium hydride. |
| Rosenmund reaction | Acyl chlorides | Acyl chlorides selectively reduced to aldehydes. Lithium tri-t-butoxyaluminium hydride (LiAlH(OtBu)3) is an effective reagent.[citation needed] |
| Wittig reaction | Ketones | A modified Wittig reaction using methoxymethylenetriphenylphosphine as a reagent. |
| Formylation reactions | Nucleophilic arenes | Various reactions, for example the Vilsmeier-Haack reaction. |
| Nef reaction | Nitro compounds | The acid hydrolysis of a primary nitro compound to form an aldehyde. |
| Kornblum oxidation | Haloalkanes | The oxidation of primary halide with dimethyl sulfoxide to form an aldehyde. |
| Zincke reaction | Pyridines | Zincke aldehydes formed in a reaction variation. |
| Stephen aldehyde synthesis | Nitriles | Hydrolysis of an iminium salt generated by tin(II) chloride and HCl to form an aldehyde. |
| Geminal halide hydrolysis | Geminal dihalides | Hydrolysis of primary geminal dihalides to yield aldehydes. |
| Meyers synthesis | Oxazines | Hemiaminal oxazine hydrolysis with water and oxalic acid to yield an aldehyde. |
| Hofmann rearrangement variation[10][11] | unsaturated or α-hydroxy amides | Aldehydes via the hydrolysis of an intermediate carbamate. |
| McFadyen-Stevens reaction | Hydrazides | Base-catalyzed thermal decomposition of acylsulfonylhydrazides. |
| Biotransformation | Alkenes | Lyophilized cell cultures of Trametes hirsuta in the presence of oxygen.[12] |
Common reactions[edit]
Aldehydes participate in many reactions.[2] From the industrial perspective, important reactions are (a) condensations, e.g., to prepare plasticizers and polyols, and (b) reduction to produce alcohols, especially «oxo-alcohols». From the biological perspective, the key reactions involve addition of nucleophiles to the formyl carbon in the formation of imines (oxidative deamination) and hemiacetals (structures of aldose sugars).[2]
Acid-base reactions[edit]
Because of resonance stabilization of the conjugate base, an α-hydrogen in an aldehyde is weakly acidic, with a pKa near 17. This acidification is attributed to (i) the electron-withdrawing quality of the formyl center and (ii) the fact that the conjugate base, an enolate anion, delocalizes its negative charge. The formyl proton itself does not readily undergo deprotonation.
Enolization[edit]
Aldehydes (except those without an alpha carbon, or without protons on the alpha carbon, such as formaldehyde and benzaldehyde) can exist in either the keto or the enol tautomer. Keto–enol tautomerism is catalyzed by either acid or base. Usually the enol is the minority tautomer, but it is more reactive. The enolization typically reverses several times per second.[13]
Reduction[edit]
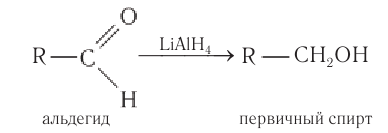
The formyl group can be readily reduced to a primary alcohol (−CH2OH). Typically this conversion is accomplished by catalytic hydrogenation either directly or by transfer hydrogenation. Stoichiometric reductions are also popular, as can be effected with sodium borohydride.
Oxidation[edit]
The formyl group readily oxidizes to the corresponding carboxyl group (−COOH). The preferred oxidant in industry is oxygen or air. In the laboratory, popular oxidizing agents include potassium permanganate, nitric acid, chromium(VI) oxide, and chromic acid. The combination of manganese dioxide, cyanide, acetic acid and methanol will convert the aldehyde to a methyl ester.[14]
Another oxidation reaction is the basis of the silver-mirror test. In this test, an aldehyde is treated with Tollens’ reagent, which is prepared by adding a drop of sodium hydroxide solution into silver nitrate solution to give a precipitate of silver(I) oxide, and then adding just enough dilute ammonia solution to redissolve the precipitate in aqueous ammonia to produce [Ag(NH3)2]+ complex. This reagent converts aldehydes to carboxylic acids without attacking carbon–carbon double bonds. The name silver-mirror test arises because this reaction produces a precipitate of silver, whose presence can be used to test for the presence of an aldehyde.
A further oxidation reaction involves Fehling’s reagent as a test. The Cu2+ complex ions are reduced to a red-brick-coloured Cu2O precipitate.
If the aldehyde cannot form an enolate (e.g., benzaldehyde), addition of strong base induces the Cannizzaro reaction. This reaction results in disproportionation, producing a mixture of alcohol and carboxylic acid.
Nucleophilic addition reactions[edit]
Nucleophiles add readily to the carbonyl group. In the product, the carbonyl carbon becomes sp3-hybridized, being bonded to the nucleophile, and the oxygen center becomes protonated:
In many cases, a water molecule is removed after the addition takes place; in this case, the reaction is classed as an addition–elimination or addition–condensation reaction. There are many variations of nucleophilic addition reactions.
Oxygen nucleophiles[edit]
In the acetalisation reaction, under acidic or basic conditions, an alcohol adds to the carbonyl group and a proton is transferred to form a hemiacetal. Under acidic conditions, the hemiacetal and the alcohol can further react to form an acetal and water. Simple hemiacetals are usually unstable, although cyclic ones such as glucose can be stable. Acetals are stable, but revert to the aldehyde in the presence of acid. Aldehydes can react with water to form hydrates, R−CH(OH)2. These diols are stable when strong electron withdrawing groups are present, as in chloral hydrate. The mechanism of formation is identical to hemiacetal formation.
Nitrogen nucleophiles[edit]
In alkylimino-de-oxo-bisubstitution, a primary or secondary amine adds to the carbonyl group and a proton is transferred from the nitrogen to the oxygen atom to create a carbinolamine. In the case of a primary amine, a water molecule can be eliminated from the carbinolamine intermediate to yield an imine or its trimer, a hexahydrotriazine This reaction is catalyzed by acid. Hydroxylamine (NH2OH) can also add to the carbonyl group. After the elimination of water, this results in an oxime. An ammonia derivative of the form H2NNR2 such as hydrazine (H2NNH2) or 2,4-dinitrophenylhydrazine can also be the nucleophile and after the elimination of water, resulting in the formation of a hydrazone, which are usually orange crystalline solids. This reaction forms the basis of a test for aldehydes and ketones.[15]
Carbon nucleophiles[edit]
The cyano group in HCN can add to the carbonyl group to form cyanohydrins, R−CH(OH)CN. In this reaction the CN− ion is the nucleophile that attacks the partially positive carbon atom of the carbonyl group. The mechanism involves a pair of electrons from the carbonyl-group double bond transferring to the oxygen atom, leaving it single-bonded to carbon and giving the oxygen atom a negative charge. This intermediate ion rapidly reacts with H+, such as from the HCN molecule, to form the alcohol group of the cyanohydrin.
Organometallic compounds, such as organolithium reagents, Grignard reagents, or acetylides, undergo nucleophilic addition reactions, yielding a substituted alcohol group. Related reactions include organostannane additions, Barbier reactions, and the Nozaki–Hiyama–Kishi reaction.
In the aldol reaction, the metal enolates of ketones, esters, amides, and carboxylic acids add to aldehydes to form β-hydroxycarbonyl compounds (aldols). Acid or base-catalyzed dehydration then leads to α,β-unsaturated carbonyl compounds. The combination of these two steps is known as the aldol condensation.
The Prins reaction occurs when a nucleophilic alkene or alkyne reacts with an aldehyde as electrophile. The product of the Prins reaction varies with reaction conditions and substrates employed.
Bisulfite reaction[edit]
Aldehydes characteristically form «addition compounds» with bisulfites:
This reaction is used as a test for aldehydes and is useful for separation or purification of aldehydes.[15][16]
More complex reactions[edit]
| Reaction name | Product | Comment |
|---|---|---|
| Wolff–Kishner reduction | Alkane | If an aldehyde is converted to a simple hydrazone (RCH=NHNH2) and this is heated with a base such as KOH, the terminal carbon is fully reduced to a methyl group. The Wolff–Kishner reaction may be performed as a one-pot reaction, giving the overall conversion RCH=O → RCH3. |
| Pinacol coupling reaction | Diol | With reducing agents such as magnesium |
| Wittig reaction | Alkene | Reagent: an ylide |
| Takai reaction | Alkene | Diorganochromium reagent |
| Corey–Fuchs reactions | Alkyne | Phosphine-dibromomethylene reagent |
| Ohira–Bestmann reaction | Alkyne | Reagent: dimethyl (diazomethyl)phosphonate |
| Johnson–Corey–Chaykovsky reaction | Epoxide | Reagent: a sulfonium ylide |
| Oxo-Diels–Alder reaction | Pyran | Aldehydes can, typically in the presence of suitable catalysts, serve as partners in cycloaddition reactions. The aldehyde serves as the dienophile component, giving a pyran or related compound. |
| Hydroacylation | Ketone | In hydroacylation an aldehyde is added over an unsaturated bond to form a ketone. |
| Decarbonylation | Alkane | Catalysed by transition metals |
Dialdehydes[edit]
A dialdehyde is an organic chemical compound with two aldehyde groups. The nomenclature of dialdehydes have the ending -dial or sometimes -dialdehyde. Short aliphatic dialdehydes are sometimes named after the diacid from which they can be derived. An example is butanedial, which is also called succinaldehyde (from succinic acid).
Biochemistry[edit]
Some aldehydes are substrates for aldehyde dehydrogenase enzymes which metabolize aldehydes in the body. There are toxicities associated with some aldehydes that are related to neurodegenerative disease, heart disease, and some types of cancer.[17]
Examples of aldehydes[edit]
- Formaldehyde (methanal)
- Acetaldehyde (ethanal)
- Propionaldehyde (propanal)
- Butyraldehyde (butanal)
- Isovaleraldehyde
- Benzaldehyde (phenylmethanal)
- Cinnamaldehyde
- Vanillin
- Tolualdehyde
- Furfural
- Retinaldehyde
- Glycolaldehyde
Examples of dialdehydes[edit]
- Glyoxal
- Malondialdehyde
- Succindialdehyde
- Glutaraldehyde
- Phthalaldehyde
Uses[edit]
Of all aldehydes, formaldehyde is produced on the largest scale, about 6000000 tons per year. It is mainly used in the production of resins when combined with urea, melamine, and phenol (e.g., Bakelite). It is a precursor to methylene diphenyl diisocyanate («MDI»), a precursor to polyurethanes.[6] The second main aldehyde is butyraldehyde, of which about 2500000 tons per year are prepared by hydroformylation. It is the principal precursor to 2-ethylhexanol, which is used as a plasticizer.[18] Acetaldehyde once was a dominating product, but production levels have declined to less than 1000000 tons per year because it mainly served as a precursor to acetic acid, which is now prepared by carbonylation of methanol. Many other aldehydes find commercial applications, often as precursors to alcohols, the so-called oxo alcohols, which are used in detergents. Some aldehydes are produced only on a small scale (less than 1000 tons per year) and are used as ingredients in flavours and perfumes such as Chanel No. 5. These include cinnamaldehyde and its derivatives, citral, and lilial.
Nomenclature[edit]
IUPAC names for aldehydes[edit]
The common names for aldehydes do not strictly follow official guidelines, such as those recommended by IUPAC, but these rules are useful. IUPAC prescribes the following nomenclature for aldehydes:[19][20][21]
- Acyclic aliphatic aldehydes are named as derivatives of the longest carbon chain containing the aldehyde group. Thus, HCHO is named as a derivative of methane, and CH3CH2CH2CHO is named as a derivative of butane. The name is formed by changing the suffix -e of the parent alkane to -al, so that HCHO is named methanal, and CH3CH2CH2CHO is named butanal.
- In other cases, such as when a −CHO group is attached to a ring, the suffix -carbaldehyde may be used. Thus, C6H11CHO is known as cyclohexanecarbaldehyde. If the presence of another functional group demands the use of a suffix, the aldehyde group is named with the prefix formyl-. This prefix is preferred to methanoyl-.
- If the compound is a natural product or a carboxylic acid, the prefix oxo- may be used to indicate which carbon atom is part of the aldehyde group; for example, CHOCH2COOH is named 3-oxoethanoic acid.
- If replacing the aldehyde group with a carboxyl group (−COOH) would yield a carboxylic acid with a trivial name, the aldehyde may be named by replacing the suffix -ic acid or -oic acid in this trivial name by -aldehyde.
Etymology[edit]
The word aldehyde was coined by Justus von Liebig as a contraction of the Latin alcohol dehydrogenatus (dehydrogenated alcohol).[22][23] In the past, aldehydes were sometimes named after the corresponding alcohols, for example, vinous aldehyde for acetaldehyde. (Vinous is from Latin vinum «wine», the traditional source of ethanol, cognate with vinyl.)
The term formyl group is derived from the Latin word formica «ant». This word can be recognized in the simplest aldehyde, formaldehyde, and in the simplest carboxylic acid, formic acid.
See also[edit]
- Enol
- Pseudoacid
References[edit]
- ^ IUPAC Gold Book, aldehydes.
- ^ a b c d Smith, Michael B.; March, Jerry (2007), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th ed.), New York: Wiley-Interscience, ISBN 978-0-471-72091-1
- ^ Saul Patai, ed. (1966). The Carbonyl Group. PATAI’S Chemistry of Functional Groups. Vol. 1. John Wiley & Sons. doi:10.1002/9780470771051. ISBN 9780470771051.Jacob Zabicky, ed. (1970). The Carbonyl Group. PATAI’S Chemistry of Functional Groups. Vol. 2. John Wiley & Sons. doi:10.1002/9780470771228. ISBN 9780470771228.
- ^ G. Berthier, J. Serre (1966). «General and Theoretical Aspects of the Carbonyl Group». In Saul Patai (ed.). The Carbonyl Group. PATAI’S Chemistry of Functional Groups. Vol. 1. John Wiley & Sons. pp. 1–77. doi:10.1002/9780470771051.ch1. ISBN 9780470771051.
- ^ Bertleff, W.; Roeper, M. and Sava, X. (2003) «Carbonylation» in Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH: Weinheim. doi:10.1002/14356007.a05_217.pub2
- ^ a b Reuss, G.; Disteldorf, W.; Gamer, A. O. and Hilt, A. (2005) «Formaldehyde» in Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim. doi:10.1002/14356007.a11_619.
- ^ Ratcliffe, R. W. (1988). «Oxidation with the Chromium Trioxide-Pyridine Complex Prepared in situ: 1-Decanal». Organic Syntheses.; Collective Volume, vol. 6, p. 373
- ^ Ōeda, Haruomi (1934). «Oxidation of some α-hydroxy-acids with lead tetraacetate». Bulletin of the Chemical Society of Japan. 9 (1): 8–14. doi:10.1246/bcsj.9.8.
- ^ Nwaukwa, Stephen; Keehn, Philip (1982). «Oxidative cleavage of α-diols, α-diones, α-hydroxy-ketones and α-hydroxy- and α-keto acids with calcium hypochlorite [Ca(OCl)2]». Tetrahedron Letters. 23 (31): 3135–3138. doi:10.1016/S0040-4039(00)88578-0.
- ^ Weerman, R.A. (1913). «Einwirkung von Natriumhypochlorit auf Amide ungesättigter Säuren». Justus Liebigs Annalen der Chemie. 401 (1): 1–20. doi:10.1002/jlac.19134010102.
- ^ Everett, Wallis; Lane, John (1946). The Hofmann Reaction. Organic Reactions. Vol. 3. pp. 267–306. doi:10.1002/0471264180.or003.07. ISBN 9780471005285.
- ^ Sutton, Peter; Whittall, John (2012). Practical Methods for Biocatalysis and Biotransformations 2. Chichester, West Sussex: John Wiley & Sons, Ltd. pp. 199–202. ISBN 9781119991397.
- ^ aldehyde Tautomerism|Britannica
- ^ Corey, Elias J.; Gilman, Norman W.; Ganem, B. E. (1968). «New methods for the oxidation of aldehydes to carboxylic acids and esters». J. Am. Chem. Soc. 90 (20): 5616–5617. doi:10.1021/ja01022a059.
- ^ a b Shriner, R. L.; Hermann, C. K. F.; Morrill, T. C.; Curtin, D. Y.; Fuson, R. C. (1997). The Systematic Identification of Organic Compounds. John Wiley & Sons. ISBN 978-0-471-59748-3.
- ^ Furigay, Maxwell H.; Boucher, Maria M.; Mizgier, Nikola A.; Brindle, Cheyenne S. (2018-04-02). «Separation of Aldehydes and Reactive Ketones from Mixtures Using a Bisulfite Extraction Protocol». Journal of Visualized Experiments (134): 57639. doi:10.3791/57639. ISSN 1940-087X. PMC 5933314. PMID 29658940.
- ^ Chen, Che-Hong; Ferreira, Julio Cesar Batista; Gross, Eric R.; Rosen, Daria Mochly (1 January 2014). «Targeting Aldehyde Dehydrogenase 2: New Therapeutic Opportunities». Physiological Reviews. 94 (1): 1–34. doi:10.1152/physrev.00017.2013. PMC 3929114. PMID 24382882.
- ^ Kohlpaintner, C.; Schulte, M.; Falbe, J.; Lappe, P. and Weber, J. (2008) «Aldehydes, Aliphatic» in Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim. doi:10.1002/14356007.a01_321.pub2.
- ^ Short Summary of IUPAC Nomenclature of Organic Compounds Archived 2006-09-01 at the Wayback Machine, web page, University of Wisconsin Colleges, accessed on line August 4, 2007.
- ^ §R-5.6.1, Aldehydes, thioaldehydes, and their analogues, A Guide to IUPAC Nomenclature of Organic Compounds: recommendations 1993, IUPAC, Commission on Nomenclature of Organic Chemistry, Blackwell Scientific, 1993.
- ^ §R-5.7.1, Carboxylic acids, A Guide to IUPAC Nomenclature of Organic Compounds: recommendations 1993, IUPAC, Commission on Nomenclature of Organic Chemistry, Blackwell Scientific, 1993.
- ^ Liebig, J. (1835) «Sur les produits de l’oxidation de l’alcool» (On the products of the oxidation of alcohol), Annales de Chimie et de Physique, 59: 289–327. From page 290: «Je le décrirai dans ce mémoire sous le nom d’aldehyde ; ce nom est formé de alcool dehydrogenatus.» (I will describe it in this memoir by the name of aldehyde; this name is formed from alcohol dehydrogenatus.)
- ^ Crosland, Maurice P. (2004), Historical Studies in the Language of Chemistry, Courier Dover Publications, ISBN 9780486438023.
External links[edit]
Look up aldehyde in Wiktionary, the free dictionary.
Wikiquote has quotations related to Aldehyde.
План урока:
Строение альдегидов и кетонов
Классификация альдегидов и кетонов
Номенклатура альдегидов и кетонов
Гомологический ряд альдегидов и кетонов
Изомерия альдегидов и кетонов
Способы получения альдегидов и кетонов
Физические свойства альдегидов и кетонов
Химические свойства альдегидов и кетонов
Применение альдегидов и кетонов
Приятный цветочный запах духов, аромат ванильных булочек, корицы и фруктов кроются в альдегидах и кетонах. Жидкость для снятия лака и строительные растворители также производят из карбонильных соединений. Без альдегидов и кетонов невозможно представить жизнь человека.
Карбонильные соединения – молекулы, содержащие карбонильную группу С=О. Они состоят из двух классов– альдегидов (R-CHO) и кетонов (R-CO-R’).
Общая формула гомологического ряд карбонильных соединений: CnH2nO.
Строение альдегидов и кетонов
Для карбонильных (входящих в состав функциональной группы альдегидов или кетонов)углеродных атомов характерна sp2-гибридизация. Все σ-связи располагаются под углом 120˚.
Кислородный атом более электроотрицателен, поэтому связь С=О поляризована. Он стягивает на себя электронную плотность, поэтому на кислороде образуется частично отрицательный заряд δ—, а на углероде из функциональной группы – частично положительный заряд δ+.
Классификация альдегидов и кетонов
В классификации заключено отличительное строение молекулы. В основе одной из классификаций лежит строение радикала.
Также альдегиды и кетоны можно классифицировать по количеству карбонильных групп.
Номенклатура альдегидов и кетонов
В соответствии с систематической номенклатурой в альдегидах добавляется суффикс «-аль» (например, метанАЛЬ), а в кетонах –«-он» (например, метанОН).
Алгоритм составления названия
- Нахождение главной углеродной цепи.
- Нумерация главной цепи, начиная с углеродного атома функциональной группы.
- Название углеводородного радикала.
- Если в молекуле присутствует альдегидная группа, то к названию прибавляется суффикс -аль. Если в соединении есть одна кетонная группа, то к названию прибавляется суффикс -он, а есть кетонных группы две, то к названию прибавляется суффикс -дион.
Гомологический ряд альдегидов и кетонов
Ряд альдегидов начинается с соединения с одним углеродным атомом – с метаналя. Он содержится во многих природных объектах, например, в деревьях. Характерный запах новой мебели – это запах метаналя, который при больших концентрациях опасен для здоровья человека и животных.
Гомологический ряд кетонов начинается с пропанона. Это соединение широко известен как хороший растворитель. Ацетон характеризуется резким характерным запахом.
Изомерия карбонильных соединений
Для карбонильных соединений свойственна как структурная, так и пространственная изомерия. Пространственная изомерия включает оптическую и цис-транс. Оптическая изомерия возможна при наличии ассиметричного атома углерода в молекуле, а цис-транс-изомерия – при наличии кратной связи.
Цис-транс-изомерия альдегидов.
Оптическая изомерия альдегида.
Структурная изомерия альдегидов
Структурная изомерия кетонов
Способы получения альдегидов и кетонов
Карбонильные соединения можно получить несколькими способами.
Окисление спиртов
Окисление протекает при нагревании. Альдегиды получают с помощью реакций окисления первичных спиртов, а кетоны – вторичных.
Дегидрирование спиртов
Реакция заключается в пропускании спиртовых паров над медью.
Взаимодействие алкинов с водой, или реакция Кучерова
Для проведения реакции необходим катализатор в виде соли ртути (II).
Гидролиз дигалогенпроизводных алканов
В ходе щелочного гидролиза образуется диол, содержащий две гидроксильные группы –ОН у одного атома углерода. Эта структура неустойчива, поэтому быстро образуется в альдегид или кетон.
Пиролиз солей карбоновых кислот
Для проведения данной реакции необходимо нагревание и наличие двухвалентных металлов. В результате образуются кетоны и карбонаты.
Кумольный метод получения пропанона
В промышленности пропанон, или более известный как ацетон, получают с помощью каталитического окисления кумола. Синтез пропанона проходит в два этапа.
Физические свойства альдегидов и кетонов
У соединений этого класса атомы не могут формировать водородные связи. Эта особенность отражается в низких температурах плавления и кипения, по сравнению со спиртами. У кетонов температура плавления и кипения немного выше, чем у альдегидов.
Существование в виде характерно только для формальдегида. Альдегиды с двумя-пятью и кетоны с тремя-четырьмя углеродными атомами – жидкости. Агрегатное состояние высших соединений – твердое. Низшие карбонильные молекулы растворимы в воде, а по мере увеличения углеродной цепи эта способность падает. Все альдегиды и кетоны хорошо растворимы в органических растворителях.
Особенность представителей класса заключается в особенных ароматах. Низшие альдегиды и кетоны отличаются резким запахом, средние имеют неприятный запах, а высшие обладают цветочными ароматами. Альдегиды опасны при вдыхании, т.к. поражают слизистые, а также оказывают негативное влияние на нервную систему.
Формальдегид – опасный для здоровья бесцветный газ. Его можно отличить по резкому запаху. Формальдегид относится к группе веществ раздражающего или слезоточивого действия. Водный раствор 40-% формальдегида – формалин, который обладает дезинфицирующим эффектом и используется для хранения биологических объектов.
Ацетальдегид – бесцветная жидкость с низкой температурой кипения в 21˚С. Обладает запахом зеленой листвы. Негативно влияет на организм человека и животных.
Некоторые альдегиды люди используют как источник витаминов. Например, в пиродоксале содержится витамин В6.
Некоторые насекомые в качестве защиты используют сильные запахи, в состав которых входят альдегиды. Эти соединения оказывают раздражающее действие.
Химические свойства альдегидов и кетонов
Реакции определяются наличием группы С=О, которая создает активное вещество. Для альдегидов свойственна большая реакционная способность по сравнению с кетонами.
Реакции присоединения
Данные реакции проходят по двойной связи.
- Взаимодействие с водородом
Гидрирование альдегидов приводит к образованию первичных спиртов, а кетонов – вторичных.
- Взаимодействие с водой
Гидратация возможна только для формальдегида и уксусного альдегида. В результате гидратации формальдегида синтезируется гидратная форма, которая существует только при низких температурах.
- Присоединение спиртов
При взаимодействии спиртов и альдегидов образуются полуацетали, которые существуют только при низких температурах. Реакции протекает при участии катализатора – кислоты или щелочи.
При реакции полуацеталя с еще одной молекулы спирта в присутствии протона Н+полуацетальный гидроксил замещается на алкоксильную группу и образуется ацеталь.
- Присоединение циановодородной кислоты
Окисление
Альдегиды легко поддаются окислению. Кетоны окисляются только при участии сильных окислителей и при высоких температурах.
- Окисление гидроксидом меди (II)
Для данной реакции требуется свежеприготовленный гидроксид меди (II). Характерная черта реакции – образование краснокирпичного осадка оксида меди (I)Cu2O.
- Окисление аммиачным раствором оксида серебра
Особенность данной реакции заключается в том, что на стенках пробирки образуется небольшой слой металлического серебра («серебряное зеркало»).
Упрощенная форма уравнения:
- Жесткое окисление
Окислителями могут быть перманганаты и соединения хрома (VI).
Кетоны подвергаются окислению только под действием перманганатов и дихроматов при нагревании.
- Горение (полное окисление)
Реакции замещения
При взаимодействии с галогенами образуется галогензамещенный (у ближайшего к функциональной группе атома углерода) альдегид или кетон.
Поликонденсация
Формальдегид может реагировать с фенолом при наличии катализатора – кислоты или щелочи.
Полимеризация
Реакция полимеризации возможна для легких альдегидов.
Применение альдегидов и кетонов
Карбонильные соединения широко применяются во многих отраслях. Им характерна высокая реакционная активность.
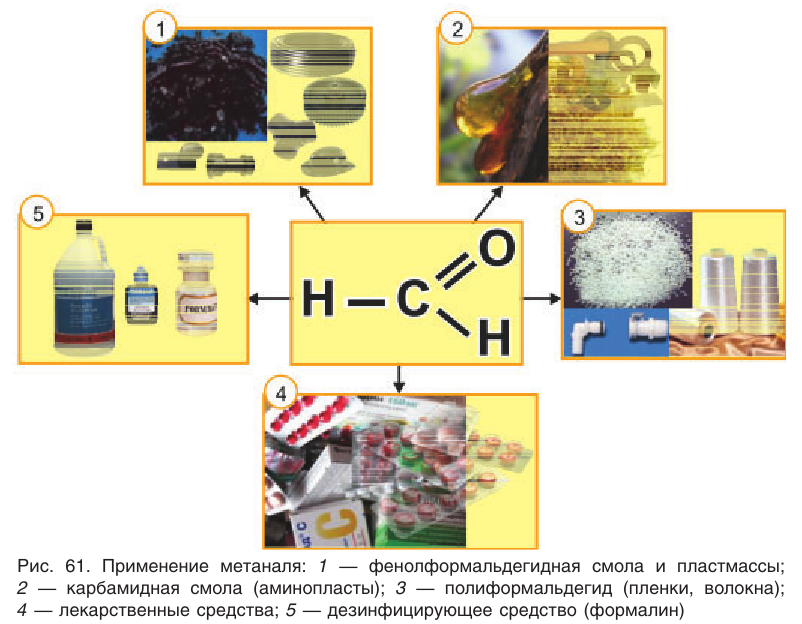
Формальдегид применяется для получения пластмасс, формальдегидных смол, а также в производстве лекарств и продуктов органического синтеза и в обработке кож в кожевенной промышленности. При взаимодействии формальдегида и аммиака образуется уротропин – мочегонный препарат. Иногда прессованный уротропин используют как сухое горючее.
Ацетальдегид используется в получении уксусной кислоты, уксусного ангидрида, этилацетата и др.
Ацетон применяется в лакокрасочной промышленности, в производстве ацетатного шелка, пироксилина (бездымного пороха), киноплёнки.
Метаналь в основном используют для получения формальдегидной смолы, которая применяется в производстве пластмасс, клея, лаков.
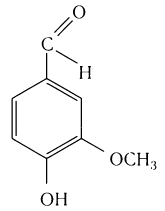
Ванилин – альдегид, который используют в пищевой промышленности (в особенности при изготовлении выпечки) и парфюмерии. Он имеет характерный сладкий запах.
Цитраль – альдегид с цитрусовым ароматом. Его применяют в качестве отдушки моющих средств и косметики. Цитраль также входит в состав организмов муравьев. Он используется в медицине для понижения давления, а также для изготовления препаратов улучшающих зрение, антисептиков и антибактериальных средств.
Бензальдегид содержится в эфирных маслах и обладает запахом горького миндаля. Он в виде гликозида содержится в семенах миндаля, косточках вишни, абрикоса и персика.
Содержание:
Альдегиды:
Органические соединения, в молекулах которых имеется карбонильная группа
Карбонильные соединения делятся на две большие группы — альдегиды и кетоны. Со строением и свойствами альдегидов вы познакомитесь в данном параграфе.
Альдегидами называют органические соединения, в которых карбонильная группа
Для альдегидов группа атомов 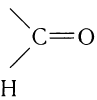
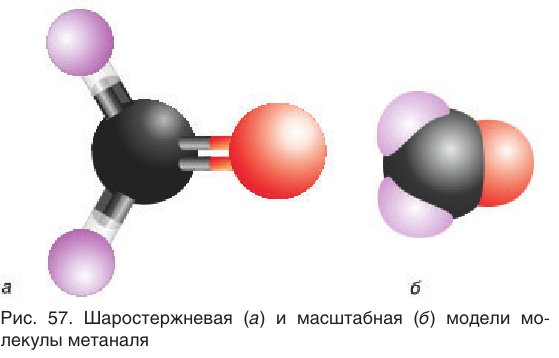
Простейшим представителем альдегидов является метаналь
(формальдегид, или муравьиный альдегид)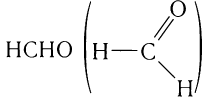
Это единственный альдегид, в молекуле которого карбонильная группа соединена с двумя атомами водорода.
В зависимости от строения углеводородного заместителя различают альдегиды:
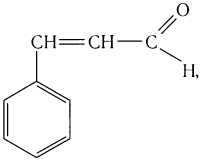
Многие альдегиды и их производные встречаются в живой природе. Например, в миндале обнаружены бензальдегид и его производные:
в корице — З-фенилпропеналь (коричный альдегид):
в стручках ванили — пахучее вещество ванилин:
В данном курсе химии вы познакомитесь с алифатическими альдегидами, производными алканов (насыщенных углеводородов).
Общая формула, отражающая химическое строение алифатических насыщенных альдегидов, 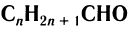
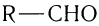
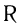
Общая формула насыщенных альдегидов
Общая формула насыщенных альдегидов 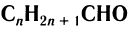
Общая формула, отражающая молекулярный состав насыщенных альдегидов, 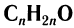
В таблице 23 приведены названия, сокращенные структурные формулы и некоторые физические свойства нескольких представителей насыщенных альдегидов.
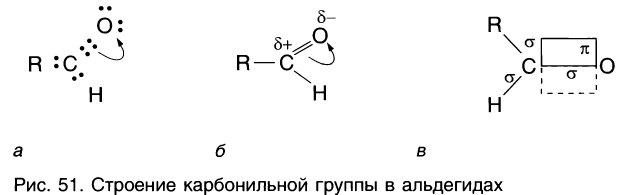
Рассмотрим электронное строение карбонильной группы (рис. 51).
В карбонильной группе связь между атомами углерода и кислорода двойная. Атом углерода образует три 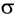
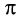
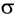
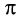
Связь С = О полярна.
Связь С = О короче и ее анергия больше, чем связи С = С.
Длина связи С = С — 0,134 нм, а С = 0 — 0,121 нм, энергия связи С = С — 620 кДж/моль, а С = 0 — 710 кДж/моль.
Полярность связи С = О сказывается на физических и химических свойствах альдегидов, которые являются высоко реакционноспособными веществами.
Номенклатура альдегидов
По правилам номенклатуры ИЮПАК названия альдегидов образуются от названий соответствующих алканов с добавлением суффикса —аль, например НСНО — метаналь, СН3СНО — этаналь.
При названии альдегидов с разветвленной углеродной цепью нумерация главной цепи начинается с атома углерода альдегидной группы.
Например:
Для альдегидов сохраняются и тривиальные названия, например: НСНО — формальдегид, или муравьиный альдегид, СН3СНО — уксусный альдегид, СН3СН2СНО — пропионовый альдегид и т. д.
Изомерия альдегидов
Изомерия альдегидов обусловлена изомерией углеродной цепи.
Первые три члена гомологического ряда альдегидов — метаналь, этаналь, пропаналь — изомеров не имеют.
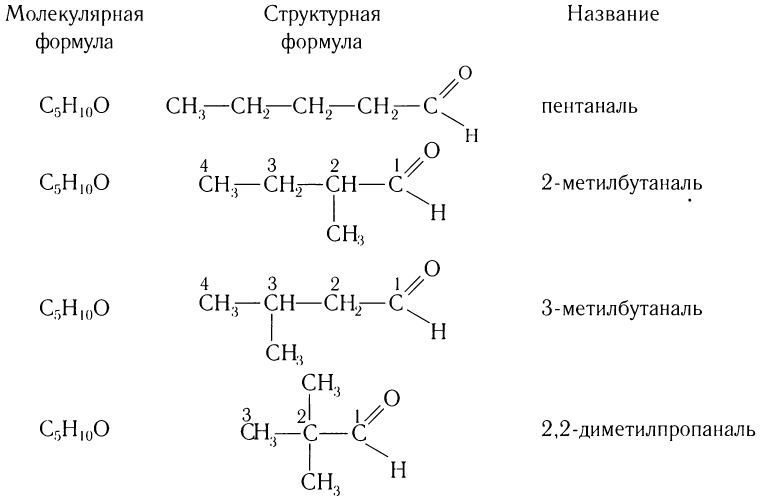
Число изомеров у альдегидов с увеличением числа углеродных атомов в молекуле сильно возрастает. Например, для альдегидов состава С5Н10О существует четыре изомера альдегида (без учета стереоизомеров).
Составу С6Н12О соответствует семь изомерных альдегидов (без учета пространственных изомеров) и т. д.
Физические свойства альдегидов
В обычных условиях метаналь (формальдегид, или муравьиный альдегид) находится в газообразном состоянии, имеет резкий неприятный запах, ядовит. Остальные альдегиды — жидкости или твердые вещества. Низшие альдегиды имеют резкий неприятный запах, а высшие альдегиды обладают цветочными запахами и широко применяются в парфюмерии.
Имеется характерный запах также у некоторых ароматических альдегидов и альдегидов ненасыщенного ряда. Например: фенилуксусный альдегид С6Н5СН2СНО имеет запах гиацинтов и потому его называют гиацинтовым.
Ознакомиться с характерными запахами некоторых альдегидов можно в домашних условиях. При выпечке широко используется ванилин, получающийся синтетически. Многим чистящим средствам, использующимся в домашнем хозяйстве, запах лимона придает синтетический альдегид строения
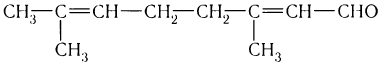
Температуры кипения альдегидов более низкие, чем соответствующих спиртов. Это объясняется тем, что в альдегидах в отличие от спиртов отсутствуют межмолекулярные водородные связи.
Простейшие альдегиды легко растворяются в воде. Например, растворимость уксусного альдегида в воде неограниченная, формальдегида — хорошая (раствор альдегида с массовой долей 40 % называют формалином), растворимость пропионового альдегида:
44 г на 100 см3 (25 °С).
Органические соединения, в которых карбонильная группа связана с одним атомом водорода и одним углеводородным заместителем, называют альдегидами.
Общая формула насыщенных алифатических альдегидов 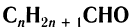
Структурная изомерия альдегидов обусловлена изомерией углеродной цепи.
Химические свойства альдегидов
Рассмотрим важнейшие химические свойства насыщенных алифатических альдегидов.
Реакции присоединения
По месту двойной связи С = О у альдегидов могут проходить реакции присоединения.
Альдегиды способны присоединять водород по связи С = О на никелевом или платиновом катализаторе с образованием первичных спиртов:
Гидрирование альдегидов относят к реакции восстановления. В промышленности реакцию гидрирования альдегидов используют для получения первичных спиртов.
В качестве эффективных восстановителей альдегидов используется алюмогидрид лития. В этих реакция он является источником гидридных анионов:
Реакция окисления
Альдегиды легко окисляются (значительно легче, чем спирты) в соответствующие карбоно-вые кислоты. Их можно окислить даже такими мягкими окислителями, как оксид серебра(І) и гидроксид меди(ІІ).
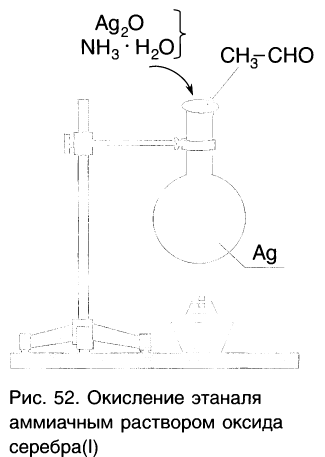
Так, если к аммиачному раствору оксида серебра(І) прилить раствор уксусного альдегида и смесь нагрет то происходит окисление альдегида с образованием уксусной кислоты. Внутренняя поверхность колбы, в которой нагревается смесь, покрывается при этом тонким слоем серебра (рис. 52).
Эту реакцию называют реакцией серебряного зеркала. Она является одной из качественных реакций для обнаружения альдегидной группы:
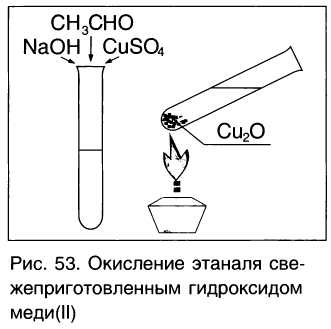
Другая качественная реакция на альдегиды — реакция со свежеприготовленным гидроксидом меди(ІІ). При окислении гидроксид меди(ІІ), имеющий светло — голубой цвет, восстанавливается в гидроксид меди(І) желтого цвета, который при нагревании превращается в оксид меди(І) красного цвета (рис. 53):
Окислить альдегиды в соответствующие кислоты можно также такими окислителями, как 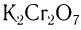
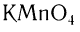
Высокая реакционная способность альдегидов обусловлена строением карбонильной группы.
Для альдегидов характерны реакции присоединения по месту двойной связи С=О и окисления по месту связи С — Н в альдегидной группе.
Получение альдегидов. Применение альдегидов и их производных
Получение:
Многие альдегиды и их производные используются в различных областях производства органических соединений.
Природными источниками для их промышленного получения являются углеводороды крекинга нефти, галогенпроизводные, спирты.
Рассмотрим лабораторные, а затем промышленные способы получения альдегидов.
Лабораторные способы:
1.Окисление первичных спиртов оксидом металла (СuО) или подкисленным раствором бихромата калия:
2. Гидратация ацетилена в условиях реакции Кучерова в присутствии солей двухвалентной ртути идет с образованием ацетальдегида:
Промышленные способы:
1.Окисление алкенов в присутствии солей палладия:
Этот метод является одним из современных промышленных методов и относится к экологически чистым.
2.Окисление спиртов. Спирты могут быть превращены в карбонильные соединения в результате окислительных процессов. При окислении первичных спиртов образуются альдегиды:
Метаналь (формальдегид) в промышленности получают окислением метанола кислородом воздуха в присутствии катализаторов (медь или серебро):
Получение альдегидов дегидрированием спиртов широко используется в современной промышленности. Само название класса органических соединений «альдегиды» возникло именно благодаря этому способу их получения (лат. alcohol dehydrogenates — спирт дегидрированный).
При пропускании паров спирта над катализатором при высоких температурах происходит дегидрирование первичных спиртов в альдегиды:
Применение альдегидов и их производных:
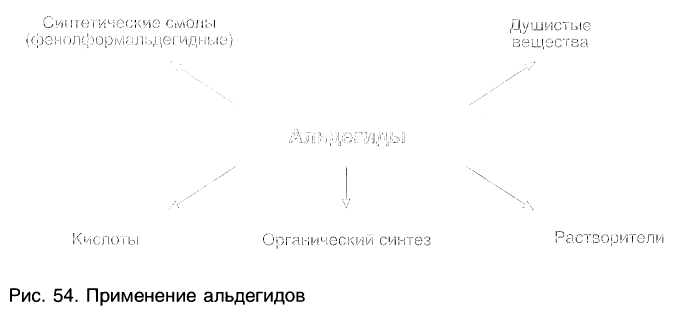
Альдегиды находят применение в различных областях промышленности. Формальдегид используется в качестве исходного сырья для получения фенолформальдегидных пластмасс, синтетического каучука и лекарственных средств.
А. М. Бутлеров н 1860 г. впервые синтезировал из формальдегида и аммиака органическое вещество гексаметилентетрамин, или уротропин, которое используется в медицине.
Ацетальдегид применяют для производства уксусной кислоты и уксусного ангидрида, этилацетата, хлораля.
Бензальдегид С6Н5СНО в природе встречается в связанном виде в листьях лавровишен, косточках персиков, абрикосов, слив, в горьком миндале. Он используется для получения душистых и лекарственных веществ, некоторых красителей.
Пропеналь СН2 = СН — СНО применяют для получения пластмасс, отличающихся боль-шой твердостью, глицерина, акриловой кислоты, лекарственных средств.
На рисунке 54 показаны области использования альдегидов.
Существуют лабораторные и промышленные способы получения альдегидов. К основным промышленным способам относят: окисление алкенов, спиртов, дегидрирование спиртов.
Альдегиды
Агьдегиды и карбоновые кислоты относятся к карбонильным соединениям (рис. 56). Карбонильными называют вещества, в состав которых входит карбонильная (или оксо-) группа 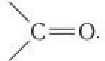
В молекулах альдегидов карбонильная группа связана с одним атомом водорода и одним углеводородным заместителем (R), а в кетонах — с двумя углеводородными заместителями (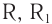
Карбонильные соединения в школьном курсе химии изучаются на примере альдегидов и карбоновых кислот. Рассматриваются также строение и свойства сложных эфиров — функциональных производных карбоновых кислот.
Строение: Альдегидами называют производные углеводородов, в молекулах которых атом водорода замещен на группу
Карбонильную группу 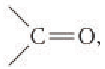
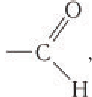
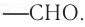
В молекуле простейшего альдегида метаналя 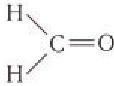
В зависимости от строения углеводородного заместителя, связанного с альдегидной группой, различают насыщенные, ненасыщенные, ароматические альдегиды и др. В данном курсе вы будете изучать строение и свойства альдегидов — производных насыщенных углеводородов (алканов).
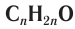
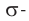
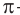
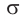

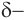
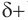

Номенклатура: По правилам номенклатуры ИЮПАК названия насыщенных альдегидов образуются из названий соответствующих алканов с добавлением суффикса -аль, например НСНО — метаналь, 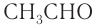
При названии альдегидов с разветвленной углеводородной цепью нумерация атомов углерода главной цени начинается с атома углерода альдегидной группы. Названия заместителей перечисляются в алфавитном порядке с указанием номера атома углерода, с которым они связаны. Например:
Для альдегидов сохраняются и тривиальные названия, например: НСНО — формальдегид, или муравьиный альдегид, 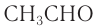
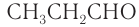
Масштабная модель молекулы уксусного альдегида приведена на рисунке 59.
Изомерия: Структурная изомерия альдегидов обусловлена изомерией углеродного скелета.
Первые три представителя класса — метаналь, этаналь, пропаналь — изомеров альдегидов не имеют.
Число изомеров у альдегидов с увеличением числа углеродных атомов в молекуле возрастает. Например, для альдегидов состава 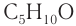
Составу 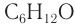
Для альдегидов характерна и межклассовая изомерия. Насыщенные альдегиды изомерны кетонам — карбонильным производным насыщенных углеводородов с тем же числом атомов углерода в молекуле, что и у альдегидов. К кетонам относятся производные углеводородов, молекулы которых содержат карбонильную группу 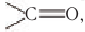
Например, простейший кетон ацетон 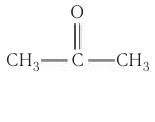
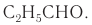
Ацетон — важнейший в промышленном отношении продукт, получаемый, как вам уже известно, кумольным методом как сопутствующий фенолу продукт.
Физические свойства: Метаналь (при и. у.) — бесцветный газ, альдегиды 
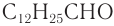
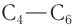
Имеется характерный запах также у некоторых ароматических альдегидов и альдегидов ненасыщенного ряда. Например, фенилуксусный альдегид 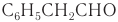
Низшие альдегиды хорошо растворяются в воде. Например, растворимость этаналя в воде неограниченная, метаналя (формальдегида) — хорошая (раствор с массовой долей альдегида 40% называют формалином). С увеличением молярной массы альдегидов их растворимость в воде уменьшается.
Температуры кипения и плавления альдегидов по мере увеличения молярной массы закономерно возрастают (см. табл. 25), но при этом они ниже, чем у соответствующих спиртов. Это явление связано с тем, что в молекулах альдегидов карбонильная группа не настолько полярна, чтобы образовывать водородные связи с другими молекулами этого же соединения, как это происходит у спиртов.
Альдегиды — производные углеводородов, у которых атом водорода замещен на группу —СНО.
Общая формула альдегидов — производных алканов —
Структурная изомерия альдегидов обусловлена изомерией углеродного скелета.
Химические свойства альдегидов
Химические свойства альдегидов обусловлены наличием в составе молекул карбонильной группы с полярной 


Реакции присоединения: Альдегиды способны присоединять водород по связи 
Например, при пропускании паров этаналя вместе с водородом над нагретым никелевым катализатором происходит присоединение водорода и образуется спирт этанол:
Гидрирование альдегидов относят к реакции восстановления.
В промышленности реакцию гидрирования альдегидов используют для получения насыщенных первичных спиртов.
В качестве эффективных восстановителей альдегидов используется также алюмогидрид лития. В этих реакциях он является источником гидридных анионов:
Реакция окисления: Альдегиды способны не только восстанавливаться, но и окисляться значительно легче, чем спирты, при этом образуются соответствующие карбоновые кислоты. Альдегиды можно окислить даже такими мягкими окислителями, как оксид серебра(I) и гидроксид меди(II). Реакции окисления альдегидов протекают при расщеплении связи 
Так, если к аммиачному раствору оксида серебра(I) прилить раствор уксусного альдегида и смесь нагреть, то происходит окисление альдегида с образованием уксусной кислоты. Внутренняя поверхность пробирки, в которой нагревается смесь, покрывается при этом тонким слоем серебра (рис. 60):
Это так называемая реакция серебряного зеркала, которая может служить качественной реакцией на альдегиды.
Если к свежеосажденному гидроксиду меди(II) прилить раствор уксусного альдегида и смесь нагреть, то также происходит окисление альдегида до уксусной кислоты. При этом гидроксид меди(II) светло-голубого цвета восстанавливается в гидроксид меди(I) желтого цвета, который при нагревании превращается в оксид меди(I) красного цвета:
Эта реакция так же, как реакция серебряного зеркала, используется для качественного обнаружения альдегидов.
Окислить альдегиды в соответствующие кислоты можно также такими окислителями, как 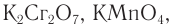
Высокая реакционная способность альдегидов обусловлена строением карбонильной группы.
Для альдегидов характерны реакции присоединения по двойной связи 

Получение и применение альдегидов
Получение: Альдегиды получают окислением первичных насыщенных одноатомных спиртов. В лаборатории в качестве окислителей используют оксид меди(II) или пероксид водорода, в общем виде этот процесс можно записать так:
В промышленных условиях метаналь получают окислением метанола кислородом воздуха в присутствии медного или серебряного катализатора:
Этаналь получают аналогичным методом:
Уксусный альдегид был выделен в лаборатории немецким химиком Ю.Либихом в 1835 г., а первый представитель класса альдегидов — муравьиный альдегид — был получен в лаборатории также немецким химиком А. Гофманом в 1868 г.
Одним из современных промышленных методов получения низших альдегидов является окисление алкенов кислородом воздуха в присутствии хлоридов палладия и меди. Этаналь в промышленности получают преимущественно этим методом:
В современной промышленности широко используется такой способ получения альдегидов, как каталитическое дегидрирование первичных насыщенных спиртов. Так, например, при пропускании паров этанола при высокой температуре над поверхностью медного катализатора происходит дегидрирование этанола и образование этаналя:
Этот способ получения альдегидов объясняет само название класса — спирт дегидрированный (от лат. alcohol dehydrogenates).
Этаналь можно получить гидратацией ацетилена в условиях реакции Кучерова в присутствии солей двухвалентной ртути:
В реакции сначала к ацетилену идет присоединение воды по одной связи, и образуется ненасыщенный виниловый спирт, у которого гидроксильная группа связана с атомом углерода при двойной связи. Ненасыщенные спирты неустойчивы и легко изомеризуются. Поэтому виниловый спирт превращается в уксусный альдегид. Эта реакция впервые была открыта русским химиком М. Г. Кучеровым. Используемые в реакции в качестве катализатора соли ртути опасны для здоровья человека, поэтому эту реакцию для промышленного получения карбонильных соединений не используют.
Применение: Рассмотрим области применения важных в промышленном отношении альдегидов — метаналя и этаналя. Основное количество получаемого в промышленности метаналя (формальдегида) расходуется на производство фенолфор-мальдегидных смол, из которых получают фенолформальдегидные пластмассы (см. § 28). Полиформальдегид 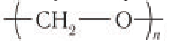
Метаналь используется обычно в виде водного раствора — формалина. Формалин обладает сильными дезинфицирующими свойствами. Его применяют для дезинфекции и дубления кож, хранения анатомических препаратов, в сельском хозяйстве — для протравливания семян.
На рисунке 61 показаны области применения метаналя.
Этаналь (уксусный альдегид) используют в промышленных масштабах для получения уксусной кислоты и ее производных.
В некоторых отраслях производства находят применение альдегиды, производные ненасыщенных и ароматических углеводородов. Например, ненасыщенный альдегид пропеналь 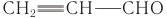
Ароматический альдегид бензальдегид 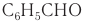
К основным промышленным способам получения альдегидов относят окисление алкенов и спиртов, дегидрирование спиртов.
Метаналь и этаналь используются во многих отраслях производства.
- Карбоновые кислоты в химии
- Сложные эфиры в химии
- Жиры в химии
- Углеводы в химии
- Ненасыщенные углеводороды
- Ароматические углеводороды
- Спирты в химии
- Фенолы в химии








































![{displaystyle {ce {[O] + CH3(CH2)9OH -> CH3(CH2)8CHO + H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4fe12103929f870bd0f268e0ff4023984be8707d)