Проявляется
у элементов, имеющих сходные электронные
формулы. Элементы, входящие в подгруппу
электронных аналогов, аналогичны по
конфигурации внешнего электронного
слоя и достраивающихся внутренних
подуровней. Отнесению к электронным
аналогам не препятствуют отличия в
конфигурации благородного газа,
включенного в электронную формулу
([He]2,
[Ne]10
и т.д.); при этом конфигурация [Xe]544f14
считается эквивалентной конфигурации
благородного газа. Провал электрона
также не нарушает электронную аналогию.
Так, например, молибден ([Kr]364d54s1
и вольфрам [Xe]544f145d46s2)
являются электронными аналогами, хотя
их электронные формулы отличаются по
структуре как внешнего, так и внутренних
электронных слоев.
Различают
полные и неполные электронные аналоги.
Полные аналоги имеют аналогичные
электронные конфигурации в любых
степенях окисления. Неполные электронные
аналоги характеризуются сходными
электронными конфигурациями лишь в
некоторых степенях окисления.
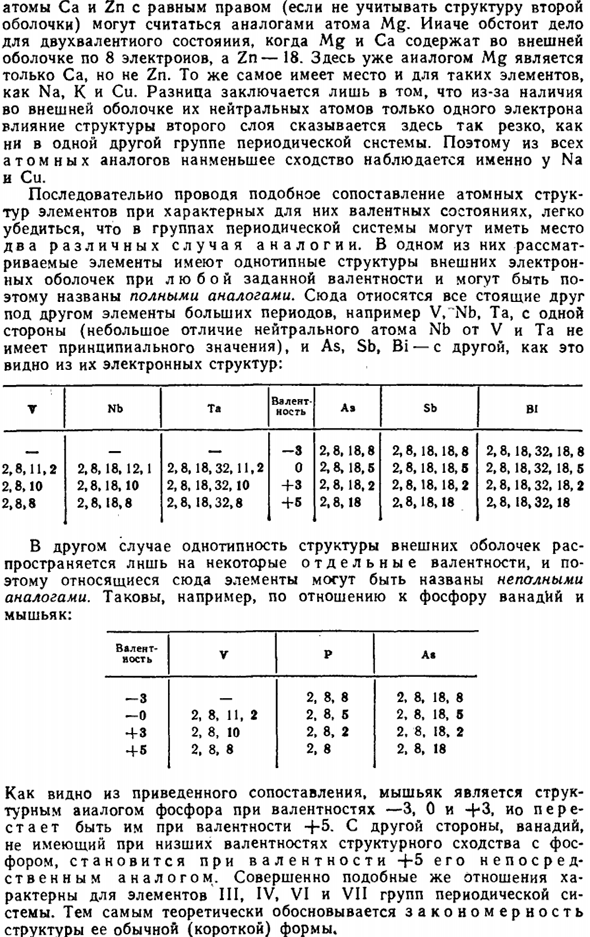
Рассмотрим
деление группы на подгруппы электронных
аналогов на примере VI
группы. Как следует из рис. 4., в группе
VI
можно выделить три подгруппы полных
электронных аналогов, соединенных
сплошными линиями. Первая из них включает
кислород и серу, вторая — селен, теллур
и полоний, третья — хром, молибден и
вольфрам; электронные конфигурации
атомов в любой из этих подгрупп аналогичны,
независимо от степени окисления. Так,
все элементы подгруппы селена в степени
окисления -2 имеют конфигурацию ns2np6,
в степени окисления +4 — ns2np2,
в степени окисления +6 — (n-1)d10.
В то же время элементы VI
группы образуют две подгруппы неполных
аналогов. В одну из них входят кислород,
сера, селен, теллур и полоний, соединенные
на рис. 4 прерывистой линией. Эти элементы
имеют аналогичные электронные конфигурации
во всех степенях окисления, кроме высшей.
Действительно, в степени окисления +6
сере отвечает электронная формула
[Ne]10,
а селену — [Ar]183d10,
хотя во всех остальных степенях окисления
(-2, +4) электронные конфигурации сравниваемых
элементов позволяют считать их аналогами.
Вторую подгруппу неполных электронных
аналогов образуют кислород, сера, хром,
молибден и вольфрам (пунктирная линия
на рис. 4). Для этой подгруппы аналогичные
электронные конфигурации отвечают лишь
высшей степени окисления элемента: как
видно на рис. 4 в степени окисления +6 все
они имеют конфигурацию благородного
газа.
На
такие же подгруппы электронных аналогов
подразделяются также III-V
и VII
группы периодической системы, т.е. все
группы, состоящие из p-
и d-элементов.
Группы, включающие s-
и d-элементы,
имеют несколько иную структуру. В этом
случае все элементы А-подгруппы являются
полными электронными аналогами, в
результате чего в группе могут быть
выделены две подгруппы полных электронных
аналогов и одна подгруппа неполных
аналогов, объединяющая первые два
элемента А-подгруппы и все элементы
В-подгруппы: эти элементы имеют аналогичные
конфигурации только в нулевой степени
окисления. На рис. 4 показана структура
I
группы периодической системы; в этой
группе подгруппы полных электронных
аналогов образуют элементы литий,
натрий, калий, рубидий, цезий и медь,
серебро, золото, а подгруппа неполных
аналогов (волнистая линия на рис. 4.)
объединяет литий, натрий, медь, серебро
и золото — элементы, имеющие в нулевой
степени окисления электронную конфигурацию
ns1.
VIII
группа, включающая элементы с разным
числом валентных электронов, естественно,
имеет иную структуру. Она состоит из
пяти подгрупп полных электронных
аналогов (неон, аргон; криптон, ксенон,
радон; железо, рутений, осмий; кобальт,
родий, иридий; никель, палладий, платина)
и одной подгруппы неполных электронных
аналогов (неон, аргон, железо, рутений,
осмий) с конфигурацией благородного
газа в степени окисления +8.
Электронная
аналогия представляет собой еще более
узкий тип аналогии, нежели типовая.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Электронные аналоги в химии
- Электронные аналоги. Необходимой предпосылкой для возможности рационального рассмотрения фактического материала обобщения на основе периодических законов является правильный подбор сходных элементов. Это разделение, руководствуясь простой близостью определенных признаков, сделать нельзя, так как не только формальное сходство между ними, но и регулярные различия, отражающие развитие атомной структуры рассматриваемого ряда, служат признаком сходства рассматриваемого ряда. elements.
- It именно эти структуры как детерминанты всего химического поведения элемента лежат в основе правильного подбора аналогов. Если нейтральные и элементарные ионы (ионизированные атомы) представляют собой неструктурированные шары, то их свойства определяются только величиной заряда и радиусом. Как правило, на внешней оболочке играет решающую роль в определении наиболее важных химических свойств.
Но на самом деле, структура электронной оболочки-это очень важно.
Людмила Фирмаль
Зависимость свойств атомов и ионов от внешнего 2-го слоя уже менее выражена(влияние их структуры не столь выражено, электронов во внешнем слое больше, а электронов во 2-м рассматриваемом слое меньше).Значение структуры, даже более глубокой, чем лежащий электронный слой (за исключением атомов лантаноидов и актинидов), сводится почти к нулю. Таким образом, при разделении аналогов, в первом приближении, можно рассматривать только внешнюю оболочку, учитывая только особенности (в основном в атомах переходного металла) и 2-й элемент, если это необходимо.
Принимая это во внимание, рассмотрим такие элементы, как Mg, Ca и Zn. Если валентность равна нулю(то есть форма нейтрального атома), то все они имеют по 2 электрона во внешнем shell. So … Атомы Ca и Zn с равными правами(если не принимать во внимание структуру 2-й оболочки) можно считать аналогами атома Mg. Иначе обстоит дело, когда Mg и Ca содержат по 8 электронов во внешней оболочке, причем в 2-валентном состоянии, которым является Zn-18.Вот, только, не зн, это аналог мг.
То же самое относится и к таким элементам, как Na, K и Cu. Единственное отличие состоит в том, что во внешней оболочке нейтрального атома имеется только 1 электрон, поэтому здесь влияние структуры 2-го слоя проявляется не так резко в других группах периодической системы. Таким образом, среди всех атомных аналогов наименьшее сходство наблюдается именно в Na и Cu.
Последовательно проводя такое сравнение атомной структуры элемента в характерном валентном состоянии. In 1 из них рассматриваемый элемент имеет тот же тип строения, что и внешняя электронная оболочка для любой валентности, поэтому его можно назвать полным аналогом. Сюда относятся, например, V, 1Mb.
Легко увидеть, что в группе периодических элементов могут возникать 2 различные аналогии systems.
Людмила Фирмаль
Ta (небольшая разница между нейтральными атомами Nb и V и Ta в основном незначительна), а также все элементы большого периода друг под другом, такие как As, Sb, Bi и т. д.: Т НБ Т «валентность Ле-СБ Би _ −3 2.8、18.8 2.8、18.18.8 2.8、18.32、18.8 2,8,11,2 2,8,18,12,1 2,8、18、32,11,2 0 2,8,18,5 2,8,18。 18.5 2.8. 18.32, 18.5 2.8.10 2.8.18.10 2.8、18.32.10 +3 2、8、18.2 2,8,18,18,2 2,8,18,32、18,2 2.8.8 2.8.18.8 2.8、18.32.8 +5 2.8.18 2.8.18.18 2.8、18.32.18
В другом случае однородность структуры внешней оболочки распространяется на индивидуальную валентность, поэтому элементы, связанные здесь, можно назвать несовершенными аналогами. Например, фосфор, ванадий и мышьяк: V P A растяжение позвоночника » −3 _ 2、8、8 2.8、18. Восемь −0 2, 8. 11, 2 и 2. 8. 5-2. 8. 18. Б 43, 2, 8. 10 2, 8, 2, 2. 8. 18, 2 часа дня. Черное и белое 2、8、8 2、8 2、8、18 Как видно из приведенного выше сравнения, мышьяк является структурным аналогом фосфора с валентностью-3, 0, а с валентностью-f-5 фосфор элиминируется.
Ванадий, с другой стороны, имеет низкую валентность и не имеет структурного сходства с фосфором, а с валентностью-f-5 он становится его прямым аналогом. Довольно схожие соотношения характерны для элементов III, IV, VI и VII группы периодической system. So, теоретически, мы продемонстрируем закономерность структуры обычной (короткой) формы. Из вышеизложенного следует, что для всех валентностей, за исключением положительной группы, соответствующей числу (которое можно назвать характеристическим, как правило, максимумом), задан один и тот же ряд сходных элементов (а), а значение характеристики-множество (Б) существенно отличается:
Группа I G1 III IV V VI VI VII Есть ли на Кей Си быть мг Са ЗН Б Ал Ка га с-Си-Ти ГК Н П в Асос СГ ГП ф ки млн Бр B Li Na K Si Be Mg Ca Zn B Al Sc Ga C Si Ti Ge N P V As (0) s Cr Se (F) CI Mn Br Распределение обоих аналогов четко показано следующими изменениями в периодической системе (стр. 2. 36).Сплошная линия на нем соединена с полным аналогом. Большая пунктирная линия-это элемент, который подобен всем валентностям, кроме характеристики, а маленькая пунктирная линия-это элемент, который подобен присутствию (и только если есть) характеристической валентности.
Значок|а| актинидов с анемонами | актинидов с фонарем / значок / актинидов с фонарем. Как удобно пользоваться системой, обратите внимание на номер каждой строки аналога (кроме 8, 9 и 10).Прямой или минус 10 соответствует номеру труппы. Например, в 3-й группе левая подгруппа (включая элемент начала периода) и правая подгруппа (включая элемент конца периода) образованы строками 4 и 4, строками 14, строками 3 и 13 соответственно.
Для всех валентных состояний, характерных для них, а также для формы нейтральных атомов, она является оптимальной для классификации химических веществ на ее основе. Добавь 1) определение положения водорода в системе требует дополнительного discussion. In при формальном подходе к строению своих атомов водород становится аналогом лития.
Однако природа внешней электронной оболочки определяет аналогии элементов не сами по себе, а лишь в свете общих закономерностей развития структуры. По последним миграциям периода 2!С подобным элементом положительный заряд ядра и количество внешних электронов уменьшаются на 8 единиц (Ne — » — He). так, по сути, нейтральный атом водорода является аналогом атома фтора.
С отрицательной валентностью водород также относится к фтору, как гелий к неону. От Li до Na и так далее. Кроме того, если он положительный(если это голый Протон), он не имеет аналогов с другими элементами、 Стоя полностью away. So, водород является несовершенным аналогом фтора. Близость к семейству галонов совпадает со всей совокупностью физических свойств водорода. 2) рассмотренная выше структура внешней электронной оболочки помимо формального сходства щелочных металлов и водорода, ее размещение в первой группе часто мотивируется it.
In химические взаимодействия, водород обычно ведет себя как металл. Однако в большинстве случаев поведение такого водорода упускается из виду, что характерно только для реакций, протекающих в водной среде solutions. In дело в том, что наиболее частой встречей является реакция такого водорода, но если характеризовать его как элемент, то нельзя отводить ему решающую роль, так как химическая функция атома сильно искажается здесь особыми свойствами положительных не (голых протонов).
Степень металличности элемента оценивается по легкости расщепления электронов его атомов. С этой точки зрения сравните натрий, водород и хлор. На + 118 ккал на * + е сі + 300 ккал СГ + е H + 315 ккал H * + e Как показывают эти данные, энергия ионизации водорода не только резко превышает энергию ионизации удара, но и несколько превышает энергию ионизации хлора. Поэтому нет вопроса о том, какова специфика функций металла для свободных атомов водорода.
В присутствии воды появляется дополнительный эффект-гидратация как о, так и О, где среди интересующих количеств не-С1 * энергия гидратации неизвестна, но в этом приближенном расчете она может быть равна энергии гидратации Ионов Na4.Тогда у нас есть: На * + р-р = » = * НВ-101 ккал Ф СГ + СГ с AQ + 101 ккал H * + aq H * + 265 ккал Суммируя все уравнения трн для каждого из предыдущих уравнений и членов, мы получаем сводку поведения атомов в водной среде.
Na + aq-f 17 ккал Na * + e CI + aq + 199 ккал CV + e Н-ф р-р + 50 ккал ч ’+ е Как видно из этих результатов, водород во входной среде очень близок к Na. Чем C1, то есть в этих условиях он действительно напоминает металл. Однако это сходство не присуще самому атому, и поэтому оно не может служить основанием для определения местоположения водорода в периодической системе. Структурная однородность атома и атомов элементов 1-й группы имеет те же формальные свойства, что и однородность атома гелия и атомов элементов 2-й группы.
Смотрите также:
Предмет химия
2.2. Периодический закон и система д.И. Менделеева
В 1869г. Д.И.Менделеев сформулировал периодический закон: «свойства простых веществ, а также формы и свойства соединения элементов находятся в периодической зависимости от величины их атомных весов» и создал систему, отражающую электронное строение атомов.
В 1913г. Мозли определил, что порядковый номер элемента в таблице Д.И.Менделеева численно равен заряду ядра атома. Поэтому современная формулировка периодического закона такова: «свойства химических элементов, а также форма и свойства их соединений находятся в периодической зависимости от порядкового номера элемента».
Периодические изменения в свойствах элементов связаны с периодической повторяемостью электронных структур атомов.
Порядковый номер элемента характеризует заряд ядра атома и количество электронов в оболочке. Элементы располагаются по мере увеличения заряда ядер их атомов.
Периодическая система состоит из периодов и групп. Период – это последовательный горизонтальный ряд элементов с одинаковым значением главного квантового числа. Группа – это вертикальный ряд элементов с одинаковым количеством валентных электронов. Элементы одной группы разделяются на две подгруппы: главную и побочную. В главной подгруппе объединяются элементы, у которых валентные электроны располагаются на s- и p- подуровнях внешнего квантового уровня. В побочную подгруппу – элементы, у которых валентные электроны располагаются на внешнем s- и предвнешнем d-подуровнях.
Электронные аналоги
Химические элементы, у которых имеется одинаковая конфигурация валентных электронов, называются электронными аналогами.
У полных аналогов совпадают электронные конфигурации двух последних периодов.
Например: 32Ge: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 2
50Sn: …………. 4s 2 4p 6 5s 2 4d 10 5p 2
У неполных аналогов совпадают электронные конфигурации только последнего периода.
Например: 6C: 1s 2 2s 2 2p 2
14Si: 1s 2 2s 2 2p 6 3s 2 3p 6
Электронные аналоги, являющиеся химическими аналогами, характеризуются одинаковым количеством валентных электронов, которые участвуют в образовании химических связей.
Свойства элементов
Очень важной характеристикой элемента с точки зрения строения атома является радиус атома. С ростом положительного заряда ядра радиус у элементов изменяется. В периоде слева направо радиус уменьшается вследствие сжатия электронной оболочки (заряд ядра увеличивается, электроны сильнее притягиваются к ядру). В группах сверху вниз радиус увеличивается вследствие увеличения количества квантовых уровней. Чем больше радиус атома, тем слабее удерживаются валентные электроны, тем легче отдает их атом в химических реакциях. Как отдача электронов, так и принятие электронов характеризуются энергетическим эффектом, который определяется тремя видами энергии:
энергия ионизации (J) – энергия, которая необходима для отрыва валентных электронов от атома и превращения атома в положительно заряженную частицу – ион. Она измеряется в эВ/атом или кДж/моль.
Энергия ионизации зависит от радиуса атома. С увеличением радиуса энергия ионизации уменьшается в группе сверху вниз, увеличивается в периоде с ростом количества валентных электронов. Энергия ионизации характеризует металлические (восстановительные) свойства, его активность. Чем больше величина энергии ионизации, тем меньше металлические свойства;
энергия сродства к электрону (Е) – энергия (единицы измерения эВ/атом или кДж/моль), которая выделяется при присоединении валентных электронов к атому, при этом атом превращается в отрицательно заряженную частицу. Эта энергия характеризует неметаллические (окислительные) свойства химических элементов; в группе сверху вниз уменьшается, в периоде увеличивается;
электроотрицательность – это полусумма энергии ионизации и энергии сродства к электрону: Э.О. = (I+E) / 2. Электроотрицательность – способность атома в молекуле притягивать к себе электроны. За единицу принята элетроотрицательность лития Li. В группе электроотрицательность уменьшается cверху вниз, в периоде увеличивается слева направо. Зная значение энергии для каждого из атомов, мы можем дать окислительно-восстановительную характеристику элемента. (Значения электроотрицательности атомов по Полингу представлены в приложении).
Что такое электронный аналог
Билет №3. Периодическая система Д.И.Менделеева (ПСЭ). Взаимосвязь химических свойств простых веществ с электронным строением атомов. Случаи несоответствия высшей валентности элемента номеру группы ПСЭ. Характер зависимостей радиусов атомов, энергии ионизации, сродства к электрону и электроотрицательности в ПСЭ. Металлы и неметаллы.
Свойства элементов и их соединений находятся в периодической зависимости от заряда ядра и порядкового номера элемента в таблице, т.к. с ростом заряда и порядкового номера периодически возобновляются на более высоких уровнях электронные конфигурации внешних слоев.
Групповые аналоги – элементы одной группы, объединенные по признаку одинакового числа валентных электронов на внешнем слое (пример: 17 Cl 3s 2 3p 5 и 25 Mn 3d 5 4s 2 ).
Электронные аналоги – элементы, объединенные в одну подгруппу и имеющие аналогичную электронную формулу (пример: Cr, Mg, W).
Большая Энциклопедия Нефти и Газа
Электронные аналоги электрохимических ячеек могут оказаться весьма полезными при применении разностного способа измерения — для формирования опорных ( компенсирующих) электрических сигналов, воспроизводящих фарадеевский ток, соответствующий определяемому компоненту с заданной концентрацией, или ток помехи, обусловленный зарядом емкости двойного слоя и электрохимической реакцией посторонних веществ. Такое применение эквивалента ячейки целесообразно при выполнении массовых однотипных анализов. [5]
Электронными аналогами называются элементы, у которых валентные электроны расположены на ор-биталях, описываемых общей для всех элементов формулой. В периодической системе элементов электронные аналоги входят в состав одной подгруппы. [6]
Электронными аналогами называются элементы, у которых валентные электроны расположены на орби-талях, описываемых общей для всех элементов формулой. [7]
Электронными аналогами называются элементы, у которых валентные электроны расположены на ор-биталях, описываемых общей для всех элементов формулой. В периодической системе элементов электронные аналоги входят в состав одной подгруппы. [8]
Ближайшими электронными аналогами наиболее исследованных бинарных полупроводников типа А3В5 являются тройные соединения типа А2В4С52, которые и были объектом настоящего исследования. Следует отметить, что между соединениями А3В5 и А2В4СГ 2 имеется и определенное различие, заключающееся в том, что тройные соединения кристаллизуются, в основном, в тетрагональной решетке типа халькопирита, тогда как бинарные — обладают кубической решеткой типа сфалерита. Другим обстоятельством, отличающим тройные соединения от бинарных, является усложнение состава, но можно предположить, что это обстоятельство играет менее существенную роль, как следует из сопоставления свойств элементарных ( А4) и бинарных тетраэдрическнх кристаллов. [9]
Это полные электронные аналоги , последние из d — элементов, у которых завершен d — подуровень. В этом отношении цинк и его аналоги отличаются от остальных d — элементов. [10]
Блок-схема электронного аналога системы дифференциальных уравнений (6.20) показана на рис. 6.9. С помощью АВМ можно получить амплитудно-частотную характеристику [ и исследовать зависимость резонансных амплитуд от различных параметров. [11]
Сера — электронный аналог кислорода , типичный элемент VI группы периодической системы. На ее внешнем электронном слое 6 электронов, а поэтому она довольно легко присоединяет два электрона, проявляя окислительные свойства. Кроме того, сера проявляет восстановительные свойства. Свободная сера может существовать в виде нескольких аллотропных форм: ромбической, моноклинической, пластической. [12]
В подгруппах электронных аналогов радиусы атомов сверху вниз увеличиваются вместе с увеличением числа электронных уровней. [13]
У его электронных аналогов , находящихся в разных периодах, возможно возникновение других форм связи за счет наличия другого числа свободных ор -, биталей. [15]
Электронные аналоги химических элементов
Почему натрий и калий это электронные аналоги? Что такое вообще электронный аналог?
- Попроси больше объяснений
- Следить
- Отметить нарушение
Что ты хочешь узнать?
Ответ
Проверено экспертом
Электронные аналоги — имеют однотипную структуру электронных оболочек(к примеру, ns²nd¹⁰).
Как видим, калий и натрий имеют однотипную структуру электронных оболочек, а именно np⁶ns¹, следовательно они являются электронными аналогами.
Билет №3. Периодическая система Д.И.Менделеева (ПСЭ). Взаимосвязь химических свойств простых веществ с электронным строением атомов. Случаи несоответствия высшей валентности элемента номеру группы ПСЭ. Характер зависимостей радиусов атомов, энергии ионизации, сродства к электрону и электроотрицательности в ПСЭ. Металлы и неметаллы.
Свойства элементов и их соединений находятся в периодической зависимости от заряда ядра и порядкового номера элемента в таблице, т.к. с ростом заряда и порядкового номера периодически возобновляются на более высоких уровнях электронные конфигурации внешних слоев.
Групповые аналоги – элементы одной группы, объединенные по признаку одинакового числа валентных электронов на внешнем слое (пример: 17 Cl 3s 2 3p 5 и 25 Mn 3d 5 4s 2 ).
Электронные аналоги – элементы, объединенные в одну подгруппу и имеющие аналогичную электронную формулу (пример: Cr, Mg, W).
Взаимосвязь химических (физических) свойств с местоположением элемента:
Электронный аналог
Электронные аналоги являются химическими аналогами. [1]
Электронные аналоги ( атомы или ионы) характеризуются близкими химическими свойствами. [2]
Электронные аналоги Мп-Тс , Re, находящиеся в 5 и 6 периодах, обладают более явными металлическими свойствами и такого резкого падения температуры плавления у них нет. [4]
Электронные аналоги электрохимических ячеек могут оказаться весьма полезными при применении разностного способа измерения — для формирования опорных ( компенсирующих) электрических сигналов, воспроизводящих фарадеевский ток, соответствующий определяемому компоненту с заданной концентрацией, или ток помехи, обусловленный зарядом емкости двойного слоя и электрохимической реакцией посторонних веществ. Такое применение эквивалента ячейки целесообразно при выполнении массовых однотипных анализов. [5]
Электронными аналогами называются элементы, у которых валентные электроны расположены на ор-биталях, описываемых общей для всех элементов формулой. В периодической системе элементов электронные аналоги входят в состав одной подгруппы. [6]
Электронными аналогами называются элементы, у которых валентные электроны расположены на орби-талях, описываемых общей для всех элементов формулой. [7]
Электронными аналогами называются элементы, у которых валентные электроны расположены на ор-биталях, описываемых общей для всех элементов формулой. В периодической системе элементов электронные аналоги входят в состав одной подгруппы. [8]
Ближайшими электронными аналогами наиболее исследованных бинарных полупроводников типа А3В5 являются тройные соединения типа А2В4С52, которые и были объектом настоящего исследования. Следует отметить, что между соединениями А3В5 и А2В4СГ 2 имеется и определенное различие, заключающееся в том, что тройные соединения кристаллизуются, в основном, в тетрагональной решетке типа халькопирита, тогда как бинарные — обладают кубической решеткой типа сфалерита. Другим обстоятельством, отличающим тройные соединения от бинарных, является усложнение состава, но можно предположить, что это обстоятельство играет менее существенную роль, как следует из сопоставления свойств элементарных ( А4) и бинарных тетраэдрическнх кристаллов. [9]
Это полные электронные аналоги , последние из d — элементов, у которых завершен d — подуровень. В этом отношении цинк и его аналоги отличаются от остальных d — элементов. [10]
Блок-схема электронного аналога системы дифференциальных уравнений (6.20) показана на рис. 6.9. С помощью АВМ можно получить амплитудно-частотную характеристику [ и исследовать зависимость резонансных амплитуд от различных параметров. [11]
Сера — электронный аналог кислорода , типичный элемент VI группы периодической системы. На ее внешнем электронном слое 6 электронов, а поэтому она довольно легко присоединяет два электрона, проявляя окислительные свойства. Кроме того, сера проявляет восстановительные свойства. Свободная сера может существовать в виде нескольких аллотропных форм: ромбической, моноклинической, пластической. [12]
В подгруппах электронных аналогов радиусы атомов сверху вниз увеличиваются вместе с увеличением числа электронных уровней. [13]
У его электронных аналогов , находящихся в разных периодах, возможно возникновение других форм связи за счет наличия другого числа свободных ор -, биталей. [15]
Материал предоставлен журналом Радиолюбитель
В мире электроники существуют два вида элементов: активные и реактивные. Отличаются они тем, что параметры реактивных элементов (конденсаторы, катушки индуктивности) зависят от частоты сигнала, а параметры активных (резисторы, диоды) — неизменны на любой частоте.
Принцип действия реактивных элементов основывается на их способности запасать электрическую энергию (произведение напряжения на ток, т.е. мощность). Но, так как непосредственно «законсервировать» мощность невозможно (подразумевается -доступным для большинства радиолюбителей способом), то приходится идти на некоторые ухищрения — преобразовывать электрическую энергию в какое-нибудь электрическое поле, и тогда, если это преобразование идет с затратой энергии, то при обратном преобразовании (поле —> энергия) энергия будет выделяться.
Конденсатор преобразует электрическую энергию в электростатическое поле, а катушка индуктивности — в электромагнитное. Для лучшего понимания этих процессов работу всей схемы можно сравнить с работой гидроэлектростанции (ГЭС), тогда водохранилище — аналог конденсатора, а вертолет, поднимающий воду на резиновом тросе — аналог катушки индуктивности.
Так как конденсатор запасает энергию в виде электростатического поля, которое, как видно из названия, статично (неподвижно), то заряд на конденсаторе, после отключения заряжающего тока, может сохраняться практически бесконечно долго. Так же и в водохранилище: после закрытия шлюзов, отделяющих его от реки или моря, вода может сохраняться очень долго. Правда, она постепенно испаряется (ток утечки — у конденсатора) и может просачиваться сквозь неплотно закрытые шлюзы, и сквозь землю (соответственно — потребляемый схемой ток и сопротивление окружающей среды). Кроме того, если при открытых шлюзах вода в реке изменяется плавно, через шлюзы течет слабый поток воды. При резком изменении уровня воды в реке сила потока увеличивается и, если река мгновенно обмелеет (по какой-либо причине), поток воды может быть столь сильным, что сможет разрушить шлюзы, и возникшая в результате волна разрушит все, стоящее на ее пути. У конденсатора, при плавном изменении напряжения на его обкладках, заряжающий/разряжающий ток невелик, и при увеличении скорости возрастания напряжения (подразумевается, что выходное сопротивление управляющей конденсатором схемы близко к нулю) на конденсаторе ток также возрастает. Если же напряжение на обкладках конденсатора изменяется очень резко (короткое замыкание), то вся энергия, запасенная конденсатором (разряд) или необходимая для создания электростатического поля некоторой напряженности (заряд), практически мгновенно превратиться в мощность (т.е. U · I) — с искрами, дымом и сгоревшими р-n переходами.
Таким образом, конденсатор запасает некоторое количество (в зависимости от емкости) энергии, которая сохраняется долго, а отдается — по первому требованию, и если амплитуда переменного синусоидального (не пилообразного или, тем более, цифрового меандра!) сигнала неизменна и равна, например, 2 В, то емкостное сопротивление конденсатора при увеличении частоты сигнала будет уменьшаться, — то есть при этом будет увеличиваться протекающий через конденсатор переменный ток (ведь при этом увеличивается крутизна импульсов, т.е. увеличивается скорость изменения напряжения).
Катушка индуктивности работает по иному принципу. Электромагнитное поле внутри ее сохраняется только в том случае, пока через катушку течет ток, кактолько этот ток прекратиться (один или оба вывода катушки отсоединят от схемы), электромагнитное поле почти мгновенно «превратиться» в мощность (произведение U · I). Так как ток нагрузки катушки (I) равен практически нулю, напряжение на выводах катушки будет очень большим — намного больше, чем напряжение питания. Теоретически оно бесконечно большое, но практически редко бывает больше тысяч вольт. Этот эффект называется «ЭДС (электродвижущая сила) самоиндукции», и разнообразные индукционные умножители напряжения, а также практически все импульсные схемы работают только благодаря этому эффекту.
Электромагнитное поле довольно инерционно: оно возникает (или пропадает) не сразу же после подачи (прекращения) мощности (U · I) на выводы катушки, а весьма плавно увеличивается/уменьшается в течение некоторого времени. Оно зависит от количества витков катушки (т.е. ее индуктивности) — чем оно больше, тем дольше нарастает поле внутри катушки. Мгновенно намагнитить катушку индуктивности невозможно — также как невозможно мгновенно наполнить ведро водой из крана, и чем больше индуктивность катушки (чем больше объем ведра), тем дольше продолжается процесс намагничивания. Если же внутрь катушки ввести сердечник из ферромагнитного материала, то эта катушка, при том же числе витков, будет намагничиваться (размагничиваться) гораздо дольше — ведь сердечник тоже нужно учитывать. То есть индуктивность катушки с сердечником гораздо больше (в сотни…тысячи раз), чем без него.
Выводы:
- использовать катушку индуктивности для хранения энергии нельзя;
- активное сопротивление (резисторное) катушки индуктивности на низких частотах минимально и равно сопротивлению провода, которым она намотана: при увеличении частоты сигнала к активному сопротивлению прибавляется индуктивное, и полное сопротивление катушки увеличивается. На бесконечно большой частоте сопротивление катушек увеличивается не более чем в тысячи раз относительно активного.
Емкость конденсатора зависит от площади обкладок и толщины диэлектрика. Чем больше площадь и меньше толщина, тем выше емкость. Но толщину диэлектрика очень сильно уменьшать нельзя -ведь при этом уменьшится максимально допустимое рабочее напряжение. Поэтому для увеличения емкости лучше всего увеличивать размеры обкладок. Кроме того, у всех накопителей энергии (конденсаторы, батарейки, аккумуляторы и пр.) есть такой параметр, как внутреннее сопротивление (в зарубежной литературе оно не совсем точно зовется эффективным последовательным сопротивлением, сокращенно-ESR). Любой источник энергии можно представить как идеальный источник, внутри которого установлен резистор некоторого сопротивления. При увеличении тока нагрузки падение напряжения на этом резисторе увеличивается (U = I · R), т.е. КПД (качество) элемента ухудшается. Для уменьшения внутреннего сопротивления конденсатора нужно увеличить размеры пластин и их толщину.
Индуктивность катушки зависит от количества витков (чем их больше, тем выше индуктивность) и магнитной проницаемости сердечника. Активное (внутреннее) сопротивление катушки зависит от толщины провода и материала, из которого он изготовлен (медь или алюминий). Чем толще провод, тем меньше активное сопротивление.
Из всего вышесказанного можно сделать такой вывод: чем больше емкость конденсатора или чем выше индуктивность катушки индуктивности, тем больше их габаритные размеры. Современные конденсаторы емкостью в доли фарады, с внутренним сопротивлением 1 Ом и напряжением 16 В, по размерам похожи на пивную бутылку и стоят 50 у.е. Дроссели (катушки с очень большой индуктивностью, всегда с магнитным сердечником) индуктивностью 1000 Гн и активным сопротивлением 10 Ом имеют массу не менее 10 кг А теперь представьте, как будет выглядеть ваша схема на парочке микросхем и с такими радиоэлементами! А в некоторых схемах необходимы реактивные элементы с еще более «крутыми» параметрами.
Поэтому проблема замены огромных реактивных элементов их малогабаритными электронными аналогами всегда волновала радиолюбителей, работающих с ними, по той причине, что невозможно создать такой аналог индуктивности, который преобразовывал бы электрическую энергию в электростатическое поле и наоборот. Но кто сказал, что аналог индуктивности должен работать с электромагнитным полем — это же не трансформатор с его вторичными обмотками?!
Философский камень древние алхимики так и не нашли, а вот электронные аналоги реактивных элементов радиолюбители придумали довольно давно. Ниже я познакомлю читателей с наиболее популярными схемами. Их единственный серьезный недостаток — необходим источник питания, но преимущества-дешевизна комплектующих и крайне малые размеры — позволяют пренебречь им.
Известны два варианта подобных схем: умножители, увеличивающие емкость или индуктивность припаянного элемента в несколько (до 1000) раз и так называемые гираторы, которые с припаянным конденсатором ведут себя как катушки индуктивности, а с катушкой — как конденсаторы.
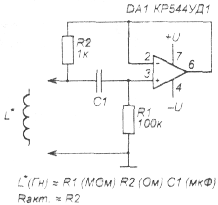
Схема умножителя емкости изображена на рис. 1.
Рис. 1
Схема умножителя емкости
Операционный усилитель (ОУ) DA1 включен как повторитель сигнала (коэффициент усиления равен 1), а на резисторах R1 и R2 собран делитель тока. В исходном состоянии напряжение на прямом входе ОУ (вывод 3) равно нулю, и конденсатор С1 разряжен; при подаче на выводы, отмеченные как С* некоторого напряжения через резисторы R2 и R1 начинает течь некоторый ток (так как напряжение на выходе ОУ равно нулю). Конденсатор С1 плавно заряжается через резистор R1, и также плавно уменьшается входной ток. Как только напряжение на конденсаторе С1 станет равным напряжению на входе С*, этот ток уменьшится до нуля. Если же теперь замкнуть вход С* на нагрузку, на- пряжение на нижнем по схеме выводе резистора R2 станет меньше, чем на верхнем (напряжение на выходе ОУ равно напряжению на конденсаторе С1, а последнее больше нуля), т.е. через резистор R2 будет течь некоторый ток, который схема отбирает у источника питания (а не С1!), одновременно через резистор R1 разряжается конденсатор С1.
Так как сопротивление резистора R1 в 100 раз больше сопротивления R2, то схема ведет себя как конденсатор, емкость которого в 100 раз больше емкости С1. Конденсатор С1 может быть как полярным, так и неполярным -таким же будет и вход схемы. Напряжение на входе не должно превышать напряжение питания схемы.
Внутреннее сопротивление этой схемы как конденсатора численно равно сопротивлению резистора R2. Уменьшать сопротивление этого резистора нежелательно — выход ОУ маломощный, и выходной ток не превышает 20 мА. Если вам нужен конденсатор с меньшим выходным сопротивлением, нужно или выбрать мощный ОУ (из отечественных — К157УД1; 300 мА), или поставить на выходе обычного ОУ составной эмиттерный повторитель (рис. 2). В таком случае сопротивление резистора R2 можно уменьшить в h21э раз, т.е. до 10…20 Ом. Если эмиттерные повторители собрать на составных транзисторах Дарлингтона (КТ972, КТ973, КТ825, КТ827), его сопротивление можно будет уменьшить еще раз в 10, но с такими транзисторами даже скоростные ОУ серий 544, 574 нормально работают (без возбуждения) только на частотах до 10…100 кГц.
Рис. 2
Схема умножителя емкости с составным эмиттерным повторителем
Вместо конденсатора С1 можно припаять катушку индуктивности — ее индуктивность увеличиться в R1/R2 раз, активное сопротивление будет равно сопротивлению резистора R2, а ЭДС самоиндукции не будет превышать напряжение питания схемы. Если сопротивление резистора R1 меньше 1 кОм, нужно позаботиться о защите входа ОУ от самоиндукции катушки L1 (два защитных диода: между входом и проводами «+U», «-U»).
Схема гиратора изображена на рис. 3. Эта схема очень часто используется для имитации индуктивности: их, в отличие от конденсаторов, большинству радиолюбителей приходится наматывать самостоятельно.
Рис. 3
Схема гиратора
Пока частота входного сигнала довольно велика, емкостное сопротивление конденсатора С1 гораздо меньше сопротивления резистора R1, и сигнал на выходе ОУ повторяет входной сигнал. Падение напряжения на выводах резистора R2 ничтожно мало, и ОУ практически не шунтирует входной сигнал. При уменьшении частоты входного сигнала емкостное сопротивление конденсатора С1 возрастает, и амплитуда сигнала на выходе ОУ становится меньше, чем на входе схемы. Переменный ток через резистор R2 возрастает, т.е. индуктивное сопротивление схемы уменьшается. На постоянном токе емкостное сопротивление конденсатора бесконечно, и активное сопротивление равно сопротивлению резистора R2. К выходу ОУ в этой схеме также можно подключить эмиттерные повторители.
Сопротивление резистора R1 во всех схемах не должно превышать 1 МОм — иначе нужно будет учитывать наводки и помехи. Конденсатор С1 в схеме на рис. 3 должен быть неполярным. DA1 можно заменить на любой другой ОУ; если вы используете ОУ с биполярными транзисторами на входе, перемычку между выходом и инверсным входом желательно разорвать, и соединить эти выводы через резистор такого же сопротивления, как и R1. Впрочем, делать это необязательно.
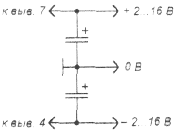
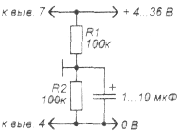
Запитывать схему нужно отдвухполярного источника питания (рис. 4); один из выводов конденсатора С* или катушки индуктивности L* соединен с общим проводом. Если для питания используется схема по рис. 4б, то емкость фильтрующего конденсатора должна как минимум в 10 раз превышать емкость конденсатора С1, а сопротивления резисторов делителя напряжения не должно быть меньше сопротивления резистора R1. Напряжения «+U» и «-U», относительно общего провода, могут быть неодинаковыми по величине (например, +20 В и -4 В), но тогда внутреннее сопротивление схемы для разных полуволн может быть разным.
Рис. 4а
Питание схемы от двухполярного источника питания
Рис. 4б
Питание схемы от двухполярного источника питания
Доброго дня химики!
Немогу разобраться с тем, что такое электронные-аналоги( В инете нашел, что элементы имеющие одинаковое электронное строение, но ведь такого не бывает.
Есть 7 элементов : Иттрий , Цирконий , Ниобий , Молибден, Технеций , Рутений, Родий
Как определить какие из них явдляются электронными аналогами?
зы: электронно-графические формулы прилагаются
Зарание благодарю!
Изменено 19 Февраля, 2012 в 12:04 пользователем pimi