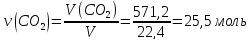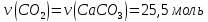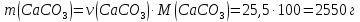If an anhydride produces acid/s on addition of water to it,then the anhydride will be anhydride of acid/s. These are generally oxides of nonmetal
For example
1 .#SO_2+H_2O->H_2SO_3#
Here #SO_2# forms #H_2SO_3# when reacted with water . So #SO_2# is anhydride of # H_2SO_3#
2 .#(CH_3CO)_2O+H_2O->2CH_3COOH#
Here #(CH_3CO)_2O# forms #CH_3COOH# when reacted with water . So #(CH_3CO)_2O# is anhydride of # CH_3COOH#
3 .#2NO_2+H_2O->HNO_2+HNO_3#
Here #NO_2# forms #HNO_3 and HNO_2 # when reacted with water . So #NO_2# is mixed anhydride of #HNO_3 and HNO_2 #
If an anhydride produces base on addition of water to it,then the anhydride will be anhydride of base. These are generally oxides of metal. (Exception: Some higher valent metallic oxides can form acids when treated with water. They should be treated as anhydride of acid)
Example
#CaO+H_2O->Ca(OH)_2#
Here #CaO# forms #Ca(OH)_2# when reacted with water . So #CaO# is anhydride of # Ca(OH)_2#
АНГИДРИДЫ НЕОРГАНИЧЕСКИХ КИСЛОТ
АНГИДРИДЫ НЕОРГАНИЧЕСКИХ КИСЛОТ, оксиды, при взаимод.
к-рых с водой образуются к-ты, напр.: SO3 + Н2О ->
H2SO4. Оксиды, дающие при р-ции с водой две к-ты
(напр., 2NO2 + Н2О -> HNO3 + HNO2),
рассматривают как ангидриды обеих к-т. Назв. ангидридов производят
от назв. соответствующих к-т, напр. SO2 — сернистый, N2O5
— азотный ангидрид. Однако термин «ангидрид» выходит из употребления; для
обозначения ангидридов используют номенклатуру, принятую для любых оксидов элементов.
Ангидриды — твердые в-ва (В2О3, Р2О5
и др.), жидкости (SO3, Мn2О7 и др.) или
газы (С12О, SO2 и др.). Многие из них мож-
но получить дегидратацией соответствующих к-т при нагр. или действии
сильных поглотителей влаги, напр.:
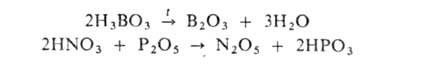
Ангидриды-весьма реакционноспособные соединения. С водой обычно реагируют быстро.
Интенсивно взаимод. с основными оксидами и основаниями с образованием солей.
Многие ангидриды (СrO3, Мn2О7, С12О
и др.)-сильные окислители. Ряд ангидридов имеет важное практич. значение. См.,
напр., Азота оксиды, Бора оксиды, Фосфора оксиды, Хлора оксиды. С. И.
Дракин.
===
Исп. литература для статьи «АНГИДРИДЫ НЕОРГАНИЧЕСКИХ КИСЛОТ»: нет данных
Страница «АНГИДРИДЫ НЕОРГАНИЧЕСКИХ КИСЛОТ» подготовлена по материалам химической энциклопедии.
Ангидрид
—химическое
соединение какого либо, элемента с
кислородом, которое можно получить,
отнимая воду от соответствующей
кислоты.
1)
Взаимодействие с водой (Кроме
SiO2)
приводит к образованию кислоты:
SO3
+ H2O
= H2SO4
2)
Взаимодействуют со щелочами с образованием
соли и воды:
CO2
+ Ba(OH)2
= BaCO3
+ H2O,
но
при недостатке щелочи может образовываться
кислая соль:
SO2
+ KOH = KHSO3
3)
Также кислотные оксиды взаимодействуют
с основными оксидами, вследствие чего
образуется соль:
CO2
+ CaO = CaCO3
4)
Взаимодействуют с солями летучей
кислоты, образуется соль и кислотный
оксид:
SiO2
+ CaCO3
= CaSiO3
+ CO2(газ)
— при нагревании.
5)
Взаимодействуют с амфотерными оксидами
с образованием средней соли:
Al2O3
+ 3SO3
= Al2(SO4)3
SO3
—
ангидрид серной кислоты
H2SO4;
N2O5
—
ангидрид азотной кислоты HNO3;
P2O5
– ангидрид форсфорной кислоты H3PO4;
Cl2O5
— ангидрид хлорноватой кислоты HClO3
Mn2O7
— ангидрид марганцевой кислоты HMnO4….
2. Определите формулу соединения, содержащего 80% углерода и 20% водорода, относительная плотность которогопо водороду равна 15. Какие законы химии вы используете для рассчетов.
|
Дано: w w D Найти: Молекулярнаяформула-? |
Решение: 1).Определяем D Mr 2).Определяем, 30-100% x-80% 3).Определяем, m(H)=30-24=6. 4). n(C)=24:12=2 n(H)=6:1=6 Формула |
В
расчетах используется следствие из
закона Авогадро.
3.
Как можно получить углекислый газ из
известняка, в котором содержится 85%
СаСО3?Составьте
уравнение реакции. Какая масса этого
вещества потребуется для получения
571,2 л СО2
(н.у.). Какие законы химии вы использовали
для расчетов?
|
Дано: ω%(СаСО3)=85 V(CO2)=571,2 Найти: m(известняка) |
Решение 1) CaCO3→CaO+CO2 2) 3) 4) 5) 2550 Х Х Ответ: |
В
расчетах используется закон эквивалентов
и закон сохранения массы.
4.
Атомный номер элемента 55, атомная масса
133. Укажите число протонов, электронов,
нейтронов, атомный номер элемента, число
неспаренных электронов, семейство
элементов. Напишите полную электронную,
электронографическую формулу валентных
электронов. Какую информацию можно
получить еще, зная атомный номер элемента?
Атомный
номер элемента 55, атомная масса 133 –
элемент Cs
цезий
Протоны
– 55
Электроны
– 55
Нейтроны
– 78
Атомный
номер – 55
Число
неспаренных электронов – 1
Семейство
элементов – s-элементы
Атомная
масса – 133
Полная
электронная
формула:
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s1
Внешний
энергетический уровень атома цезия
содержит 1 электрон, который является
валентным. Возбужденного состояния
нет. Энергетическая диаграмма основного
состояния принимает следующий вид:
Соседние файлы в предмете Химия
- #
- #
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Ангидрид кислоты
редактировать
ангидрид кислоты— это тип химического соединения, полученного удалением молекул воды из кислоты.
. В органической химии, ангидриды органических кислот содержат функциональную группу R (CO) O (CO) R ‘. Ангидриды органических кислот часто образуются, когда один эквивалент воды удаляется из двух эквивалентов органической кислоты в реакции дегидратации.
В неорганической химии ангидрид кислоты относится к кислому оксиду, оксиду, который реагирует с водой с образованием оксикислоты (неорганической кислота, содержащая кислород или угольную кислоту ), или с основанием с образованием соли.
Номенклатура
Номенклатура органических кислот ангидриды образованы от названий составляющих карбоновых кислот, которые подверглись дегидратации с образованием соединения. В симметричных ангидридах кислот, где для образования соединения использовалась только одна составляющая карбоновая кислота (например, при дегидратации пропановой кислоты 2CH 3CH2COOH → CH 3CH2C (O) OC (O) CH 2CH3+ H 2 O), используется только префикс исходной карбоновой кислоты и добавляется суффикс «ангидрид». В асимметричных ангидридах кислот, где для получения ангидрида использовались две разные карбоновые кислоты (например, дегидратация между бензойной кислотой и пропановой кислотой, C 6H5COOH + CH 3CH2COOH → C 6H5C (O) OC (O) CH 2CH3+ H 2 O), префиксы обеих прореагировавших кислот указаны перед суффиксом, в данном случае дается бензойный пропановый ангидрид, который альтернативно может называться бензолкарбоновой этановым ангидридом.
См. Также
- Базовый ангидрид, оксид, который реагирует с водой с образованием гидроксидной соли
Ссылки
Последняя правка сделана 2021-06-08 21:24:42
Содержание доступно по лицензии CC BY-SA 3.0 (если не указано иное).