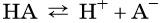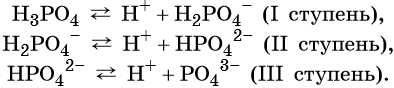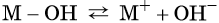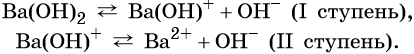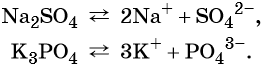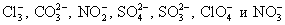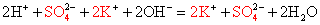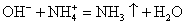Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей (средних)
Катионами называют положительно заряженные ионы.
Анионами называют отрицательно заряженные ионы.
В процессе развития химии понятия «кислота» и «основание» претерпели серьёзные изменения. С точки зрения теории электролитической диссоциации кислотами называют электролиты, при диссоциации которых образуются ионы водорода H + , а основаниями — электролиты, при диссоциации которых образуются гидроксид-ионы OH – . Эти определения в химической литературе известны как определения кислот и оснований по Аррениусу.
В общем виде диссоциацию кислот представляют так:
где A – — кислотный остаток.
Такие свойства кислот, как взаимодействие с металлами, основаниями, основными и амфотерными оксидами, способность изменять окраску индикаторов, кислый вкус и т. д., обусловлены наличием в растворах кислот ионов H + . Число катионов водорода, которые образуются при диссоциации кислоты, называют её основностью. Так, например, HCl является одноосновной кислотой, H2SO4 — двухосновной, а H3PO4 — трёхосновной.
Многоосновные кислоты диссоциируют ступенчато, например:
От образовавшегося на первой ступени кислотного остатка H2PO4 – последующий отрыв иона H + происходит гораздо труднее из-за наличия отрицательного заряда на анионе, поэтому вторая ступень диссоциации протекает гораздо труднее, чем первая. На третьей ступени протон должен отщепляться от аниона HPO4 2– , поэтому третья ступень протекает лишь на 0,001%.
В общем виде диссоциацию основания можно представить так:
где M + — некий катион.
Такие свойства оснований, как взаимодействие с кислотами, кислотными оксидами, амфотерными гидроксидами и способность изменять окраску индикаторов, обусловлены наличием в растворах OH – -ионов.
Число гидроксильных групп, которые образуются при диссоциации основания, называют его кислотностью. Например, NaOH — однокислотное основание, Ba(OH)2 — двухкислотное и т. д.
Многокислотные основания диссоциируют ступенчато, например:
Большинство оснований в воде растворимо мало. Растворимые в воде основания называют щелочами.
Прочность связи М—ОН возрастает с увеличением заряда иона металла и увеличением его радиуса. Поэтому сила оснований, образуемых элементами в пределах одного и того же периода, уменьшается с возрастанием порядкового номера. Если один и тот же элемент образует несколько оснований, то степень диссоциации уменьшается с увеличением степени окисления металла. Поэтому, например, у Fe(OH)2 степень основной диссоциации больше, чем у Fe(OH)3.
Электролиты, при диссоциации которых одновременно могут образовываться катионы водорода и гидроксид-ионы, называют амфотерными. К ним относят воду, гидроксиды цинка, хрома и некоторые другие вещества. Их полный перечень приведён в уроке 6, а их свойства рассмотрены в уроке 16.
Солями называют электролиты, при диссоциации которых образуются катионы металлов (а также катион аммония NH4 + ) и анионы кислотных остатков.
Химические свойства солей будут описаны в уроке 18.
Тренировочные задания
1. К электролитам средней силы относится
2. К сильным электролитам относится
3. Сульфат-ион в значительном количестве образуется при диссоциации в водном растворе вещества, формула которого
4. При разбавлении раствора электролита степень диссоциации
1) остается неизменной
2) понижается
3) повышается
4) с начала повышается, потом понижается
5. Степень диссоциации при нагревании раствора слабого электролита
1) остается неизменной
2) понижается
3) повышается
4) с начала повышается, потом понижается
6. Только сильные электролиты перечислены в ряду:
7. Водные растворы глюкозы и сульфата калия соответственно являются:
1) с ильным и слабым электролитом
2) неэлектролитом и сильным электролитом
3) слабым и сильным электролитом
4) слабым электролитом и неэлектролитом
8. Степень диссоциации электролитов средней силы
1) больше 0,6
2) больше 0,3
3) лежит в пределах 0,03—0,3
4) менее 0,03
9. Степень диссоциации сильных электролитов
1) больше 0,6
2) больше 0,3
3) лежит в пределах 0,03—0,3
4) менее 0,03
10. Степень диссоциации слабых электролитов
1) больше 0,6
2) больше 0,3
3) лежит в пределах 0,03—0,3
4) менее 0,03
11. Электролитами являются оба вещества:
1) фосфорная кислота и глюкоза
2) хлорид натрия и сульфат натрия
3) фруктоза и хлорид калия
4) ацетон и сульфат натрия
12. В водном растворе фосфорной кислоты H3PO4 наименьшая концентрация частиц
13. Электролиты расположены в порядке увеличения степени диссоциации в ряду
14. Электролиты расположены в порядке уменьшения степени диссоциации в ряду
15. Практически необратимо диссоциирует в водном растворе
1) уксусная кислота
2) бромоводородная кислота
3) фосфорная кислота
4) гидроксид кальция
16. Электролитом, более сильным по сравнению с азотистой кислотой, будет
1) уксусная кислота
2) сернистая кислота
3) фосфорная кислота
4) гидроксид натрия
17. Ступенчатая диссоциация характерна для
1) фосфорной кислоты
2) соляной кислоты
3) гидроксида натрия
4) нитрата натрия
18. Только слабые электролиты представлены в ряду
1) сульфат натрия и азотная кислота
2) уксусная кислота, сероводородная кислота
3) сульфат натрия, глюкоза
4) хлорид натрия, ацетон
19. Каждое из двух веществ является сильным электролитом
1) нитрат кальция, фосфат натрия
2) азотная кислота, азотистая кислота
3) гидроксид бария, сернистая кислота
4) уксусная кислота, фосфат калия
20. Оба вещества являются электролитами средней силы
1) гидроксид натрия, хлорид калия
2) фосфорная кислота, азотистая кислота
3) хлорид натрия, уксусная кислота
4) глюкоза, ацетат калия
Катионы и анионы в химии, таблица растворимости
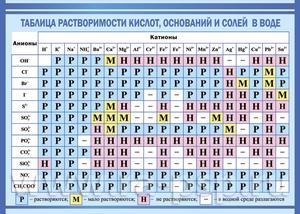
Показатели растворимости в воде
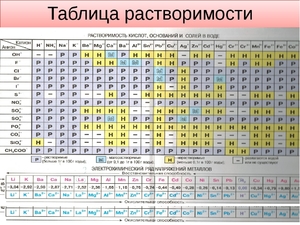
Она помогает при решении химических уравнений, где участвуют ионные реакции. Если результатом будет получение нерастворимого вещества, то реакция возможна. Существует несколько вариантов:
- Вещество хорошо растворяется;
- Малорастворимо;
- Практически не растворяется;
- Нерастворимо;
- Гидрализуется и не существует в контакте с водой;
- Не существует.
Это интересно: металлы и неметаллы в периодической таблице Менделеева.
Электролиты
Это растворы или сплавы, проводящие электрический ток. Электропроводность их объясняется мобильностью ионов. Электролиты можно поделить на 2 группы:
- Сильные. Растворяются полностью, независимо от степени концентрации раствора.
- Слабые. Диссоциация проходит частично, зависит от концентрации. Уменьшается при большой концентрации.
Теория электролитической растворимости
Одновременно с диссоциацией проходит противоположный процесс – соединение ионов в молекулы. Кислоты – это такие электролиты, при распаде которых образуется катион – ион водорода. Основания – анионы – это гидроксид ионы. Щелочи – это основания, которые растворяются в воде. Электролиты, которые способны образовывать и катионы и анионы, называются амфотерными.
Это такая частица, в которой больше протонов или электронов, он будет называться анион или катион, в зависимости от того, чего больше: протонов или электронов. В качестве самостоятельных частиц они встречаются во многих агрегатных состояниях: газах, жидкостях, кристаллах и в плазме. Понятие и название ввёл в обиход Майкл Фарадей в 1834 году. Он изучал воздействие электричества на растворы кислот, щелочей и солей.
Простые ионы несут на себе ядро и электроны. Ядро составляет почти всю атомную массу и состоит из протонов и нейтронов. Количество протонов совпадает с порядковым номером атома в периодической системе и зарядом ядра. Ион не имеет определённых границ из-за волнового движения электронов, поэтому невозможно измерить их размеры.
Отрыв электрона от атома требует, в свою очередь, затрат энергии. Она называется энергия ионизации. Когда присоединяется электрон, происходит выделение энергии.
Катионы
Это частицы, носящие положительный заряд. Могут иметь разную величину заряда, например: Са2+ — двузарядный катион, Na+ — однозарядный катион. Мигрируют к отрицательному катоду в электрическом поле.
Анионы
Это элементы, имеющие отрицательный заряд. А также обладает различным количеством величины зарядов, например, CL- — однозарядный ион, SO42- — двухзарядный ион. Такие элементы входят в состав веществ, обладающих ионной кристаллической решёткой, в поваренной соли и многих органических соединениях.
- Натрий. Щелочной металл. Отдав один электрон, находящийся на внешнем энергетическом уровне, атом превратится в положительный катион.
- Хлор. Атом этого элемента принимает на последний энергетический уровень один электрон, он превратится в отрицательный хлорид анион.
- Поваренная соль. Атом натрия отдаёт электрон хлору, вследствие этого в кристаллической решётке катион натрия окружён шестью анионами хлора и наоборот. В результате такой реакции образуется катион натрия и анион хлора. Благодаря взаимному притяжению формируется хлорид натрия. Между ними образуется прочная ионная связь. Соли — это кристаллические соединения с ионной связью.
- Кислотный остаток. Это отрицательно заряженный ион, находящийся в сложном неорганическом соединении. Он встречается в формулах кислот и солей, стоит обычно после катиона. Практически для всех таких остатков есть своя кислота, например, SO4 – от серной кислоты. Кислот некоторых остатков не существует, и их записывают формально, но они образуют соли: фосфит ион.
Химия – наука, где возможно творить практически любые чудеса. Катион вы можете узнать по ссылке.
Ионные уравнения
Ионные уравнения — неотъемлемая часть сложной и интересной химической науки. Такие уравнения позволяют наглядно увидеть, какие ионы вступают в химические превращения. В виде ионов записывают вещества, которые подвергаются электролитической диссоциации. Разберем историю вопроса, алгоритм составления ионных уравнений и примеры задач.
ИСТОРИЯ ВОПРОСА
Еще древние алхимики, проводя нехитрые химические реакции в поисках философского камня и записывая в толстые фолианты результаты своих исследований, использовали определенные знаки для химических веществ. У каждого ученого была своя система, что неудивительно: каждый хотел защитить свои тайные знания от происков завистников и конкурентов. И лишь в VIII веке появляются единые обозначения для некоторых элементов.
В 1615 году Жан Бегун в своей книге «Начала химии», что по праву считается одним из первых учебников в этом разделе естествознания, предложил использовать условные обозначения для записи химических уравнений. И лишь в 1814 году шведский химик Йонс Якоб Берцелиус создал систему химических символов на основе одной или двух первых букв латинского названия элемента, подобную той, с которой ученики знакомятся на уроках.
В восьмом классе (параграф 12, учебник «Химия. 8 класс» под редакцией В.В. Еремина) ребята научились составлять молекулярные уравнения реакций, где и реагенты, и продукты реакций представлены в виде молекул.
Однако это упрощенный взгляд на химические превращения. И об этом задумывались ученые уже в XVIII веке.
Аррениус в результате своих экспериментов выяснил, что растворы некоторых веществ проводят электрический ток. И доказал, что вещества, обладающие электропроводностью, в растворах находятся в виде ионов: положительно заряженных катионов и отрицательно заряженных анионов. И именно эти заряженные частицы вступают в реакции.
ЧТО ТАКОЕ ИОННЫЕ УРАВНЕНИЯ
Ионные уравнения реакций — это химические равенства, в которых вещества, вступающие в реакцию, и продукты реакций обозначены в виде диссоциированных ионов. Уравнения данного типа подходят для записи химических реакций замещения и обмена в растворах.
Ионные уравнения — неотъемлемая часть сложной и интересной химической науки. Такие уравнения позволяют наглядно увидеть, какие ионы вступают в химические превращения. В виде ионов записывают вещества, которые подвергаются электролитической диссоциации (тема подробно разбирается в параграфе 10, учебник «Химия. 9 класс» под редакцией В.В. Еремина). В виде молекул записывают газы, вещества, выпадающие в осадок, и слабые электролиты, которые практически не диссоциируют. Газы обозначаются стрелкой вверх (↑), субстанции, выпадающие в осадок, стрелкой вниз (↓).
ОСОБЕННОСТИ ИОННЫХ УРАВНЕНИЙ
1. Реакции ионного обмена, в отличие от окислительно-восстановительных реакций, протекают без нарушения валентности веществ, вступающих в химические превращения.

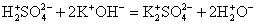
2. Реакции между ионами протекают при условии образования в ходе реакции плохорастворимого осадка, выделения летучего газа или образования слабых электролитов.
Удивительно, что реакции обмена могут проходить даже с нерастворимыми солями слабых кислот. В этом случае сильная кислота вытесняет слабую из ее солей. В качестве примера можно привести сокращенное ионное уравнение разведения карбоната кальция в сильных кислотах.
АЛГОРИТМ СОСТАВЛЕНИЯ ИОННОГО УРАВНЕНИЯ
Записываем молекулярное уравнение химического процесса.
Балансируем молекулярное уравнение с помощью коэффициентов.
Чтобы правильно сбалансировать равенство, нужно вспомнить закон сохранения массы веществ (параграф 12, «Химия. 8 класс» под редакцией В.В. Еремина), согласно которому в ходе химических превращений новые атомы не появляются, а старые не разрушаются. Т.е. число атомов в продуктах реакции равно числу атомов в исходных веществах. Помним, что водород и кислород уравниваем в последнюю очередь.
Определяем, какие вещества в химической реакции диссоциируют, т.е. распадаются на ионы.
Записываем в виде ионов:
- растворимые соли;
- сильные кислоты (H2SO4, HNO3, HCl и др.);
- растворимые в воде основания.
Записываем в виде молекул:
- нерастворимые соли;
- слабые кислоты, щелочи, вода;
- оксиды;
- газы;
- простые вещества;
- большинство органических соединений.
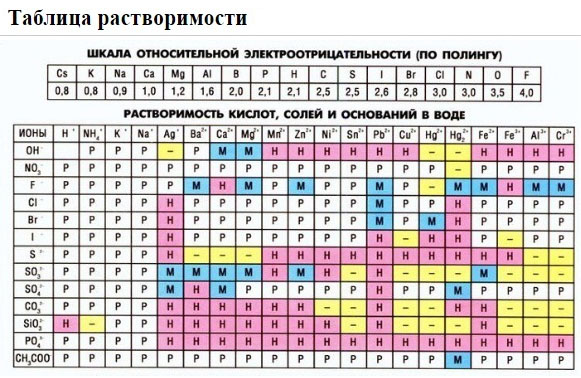
Если есть сомнения в растворимости реагента или продукта реакции, можно проверить по специальной таблице, которая является справочным материалом, ей можно пользоваться на различных экзаменах.
В таблице, помимо растворимости соединений, представлены также заряды катионов и анионов, участвующих в реакциях.
Определяем многоатомные ионы.
Это необходимо сделать, т.к. данные соединения не разлагаются на отдельные атомы и имеют свой заряд. Чаще всего в химических превращениях участвуют следующие многоатомные ионы:
Записываем равенство таким образом, чтобы все диссоциирующие субстанции были представлены в виде катионов и анионов.
Проверяем, чтобы уравнение было сбалансировано, т.е. количество различных атомов в частях с реагентами и продуктами реакции совпадало.
На данном этапе мы получили полное ионное уравнение.
Вычеркиваем идентичные ионы в обеих частях равенства, т.е. катионы и анионы с одинаковыми нижними индексами и зарядами, и переписываем равенство без данных ионов.
Проверяем, чтобы количество атомов элементов совпадало в правой и левой частях уравнения. Таким образом получаем краткое ионное уравнение.
ПРИМЕРЫ
Задача 1
Выясните, произойдет ли химическое взаимодействие между растворами гидроксида калия и хлорида аммония. (Записать для реакции молекулярное, полное ионное и сокращенное ионное уравнение.)
Записываем молекулярное уравнение, проверяем коэффициенты.
Помним, что гидроксид аммония — нестабильное соединение и разлагается на аммиак и воду.
Записываем окончательное уравнение:
NB! Благодаря летучести и резкому раздражающему запаху 3%-й раствор NH3 называется «нашатырный спирт» и используется в медицине.
Подсматривая в таблицу растворимости, помечаем полное ионное уравнение, не забывая о зарядах ионов.
Вычеркивая идентичные катионы и анионы в обеих частях реакции, составляем краткое ионное уравнение.
Делаем вывод: химическая реакция между гидроксидом калия и хлоридом аммония протекает с образованием воды и выделением аммиака — летучего газа с резким запахом.
Задача 2
А сейчас выполним задание из учебника «Химия. 9 класс» под редакцией В.В. Еремина.
Налейте в пробирку 1 мл раствора карбоната натрия и аккуратно прилейте к нему пару капелек соляной кислоты.
Составьте уравнение реакции, напишите полное и сокращенное ионные уравнения.
Записываем реакцию в молекулярном виде, расставляем коэффициенты, если это необходимо.
Подсматривая в таблицу растворимости, записываем полное ионное уравнение, не забывая отмечать заряды ионов.
Вычеркивая одинаковые катионы и анионы в правой и левой частях равенства, составляем краткое ионное уравнение.
Вопрос «Что происходит?» остался без ответа. К сожалению, в домашних условиях этот опыт осуществить трудновато, так как стиральной содой уже давно никто не пользуется, да и соляную кислоту в аптеке уже не продают. Но примерно такой же визуальный эффект можно наблюдать, если смешать раствор пищевой соды с раствором уксусной кислоты.
источники:
http://obrazovanie.guru/himiya/kationy-i-aniony-tablitsa-rastvorimosti.html
http://rosuchebnik.ru/material/ionnye-uravneniya/
Катионы и анионы
Что такое катионы и анионы:
Катионы и анионы — это типы ионов, то есть атомы, которые приобрели или потеряли электроны через химические связи.
Атом, имеющий одинаковое количество протонов (положительный заряд) и электронов (отрицательный заряд), считается электрически нейтральным. Когда этот атом принимает или передает электроны, он называется ионом, который, в свою очередь, может быть:
- Катион: атом, который потерял (или прогнулся) электроны и поэтому заряжен положительно.
- Ânion: атом, который получил (или принял) электроны и, следовательно, заряжен отрицательно.
катион
Катион — это атом, который имеет положительный заряд, потому что в нем больше протонов, чем электронов.
Щелочные металлы (литий, натрий, калий, рубидий, цезий и францио), как правило, образуют катионы, поскольку в их валентном слое имеется только 1 электрон. Это означает, что энергия, необходимая для удаления этого электрона, очень мала, что делает эти элементы очень реактивными.
Катион представлен символом +, следующим за именем элемента. Количество потерянных электронов указывает на тип катиона:
- Катионы с зарядом +1 называются одновалентными.
- Катионы с зарядом +2 называются бивалентами.
- Катионы с зарядом +3 называются трехвалентными.
Типы катионов также можно определить по количеству знаков +. Таким образом, элемент, представленный только +, является одновалентным катионом, в то время как другой элемент, представленный +++, является трехвалентным катионом.
Примеры катионов
- Al + 3 (алюминий)
- Ca + 2 (кальций)
- Mg + 2 (магний)
- Na + 1 (натрий)
- К + 1 (калий)
- Zn + 2 (цинк)
- Pb + 4 (свинец)
анион
Анион — это атом с отрицательным зарядом, потому что в нем больше электронов, чем протонов. Элементы семейства азота, калькогенов и галогенов имеют тенденцию образовывать анионы, потому что они легко принимают электроны.
Анион представлен символом — после имени элемента. Количество полученных электронов указывает на тип аниона:
- Анионы с зарядом -1 называются одновалентными.
- Анионы с зарядом -2 называются бивалентами.
- Анионы с зарядом -3 называются трехвалентными.
Как и в катионах, анионы также могут быть идентифицированы по количеству сигналов. Таким образом, элемент, представленный только — это одновалентный анион, а другой элемент, представленный -, является двухвалентным анионом.
Примеры анионов
- O-2 (кислород)
- N-3 (азид)
- F-1 (фтор)
- Br-1 (бромид)
- С-2 (сера)
- Cl-1 (хлорид)
Ионные Связи
Ионные или электовалентные связи представляют собой связи, которые возникают между катионами и анионами.
Элементы могут принимать, давать или делить электроны таким образом, чтобы их последний энергетический слой имел 8 электронов. Это известно как теория октетов .
Согласно теории октетов, атомы имеют тенденцию стабилизироваться, когда в валентном слое (последнем электронном слое) находится 8 электронов. Таким образом, будучи положительно заряженными, катионы связываются с отрицательно заряженными анионами. Таким образом, атомы дают или принимают электроны для достижения равновесия.
Связи, образованные между катионами и анионами, очень прочны и имеют тенденцию иметь следующие признаки:
- являются твердыми и ломкими при нормальных условиях температуры и давления;
- очень точка кипения и кипения;
- ваш лучший растворитель — вода;
- при растворении в жидкости проводить электрический ток.
Ионные связи образуют ионные соединения, такие как хлорид натрия (поваренная соль), образованный связью Na + (катион натрия) + Cl- (хлорид-анион) → NaCl.
Примеры ионных соединений
Некоторые примеры ионных соединений:
- NaCl — Хлорид натрия (поваренная соль)
- Na 2 SO 4 — сульфат натрия
- CaCO 3 — карбонат кальция
- NaNO 3 — Нитрат натрия
Катионный стол
| Li + | литий | Fe + 2 | железистый |
|---|---|---|---|
| Na + | натрий | Со + 2 | cobaltoso |
| К + | калий | Ni + 2 | Niqueloso |
| Rb + | рубидий | Sn + 2 | содержащий двухвалентное олово |
| Cs + | цезий | Pb + 2 | Plumboso |
| (NH 4 ) + | аммоний | Mn + 2 | марганцевых |
| Ag + | серебро | Pt + 2 | относящийся к платине |
| Cu + | медь | Би + 3 | висмут |
| Hg + | Ртути | Al + 3 | Нержавеющая сталь |
| Au + | Auroso | Cr + 3 | хром |
| Mg + 2 | магний | Au + 3 | золотоносный |
| Ca + 2 | кальций | Fe + 3 | трехвалентного железа |
| Sr + 2 | стронций | Со + 3 | кобальтовые |
| Ба + 2 | барий | Ni + 3 | Niquélico |
| Zn + 2 | цинк | Sn + 4 | оловянный |
| CD + 2 | кадмий | Pb + 4 | свинцовый |
| Cu + 2 | двухвалентной | Мн + 4 | марганца |
| Hg + 2 | содержащий двухвалентную ртуть | Pt + 4 | платина |
Таблица анионов
| F- | фторид | P 2 O 7 -4 | пирофосфат |
|---|---|---|---|
| Cl | хлорид | (№ 2 ) — | нитрит |
| бром | бромид | (№ 3 ) — | нитрат |
| I- | йодид | S-2 | сульфид |
| (ClO) — | гипохлорит | (SO4) -2 | сульфат |
| (CLO 2 ) — | хлорит | (SO 3 ) -2 | сульфит |
| (CLO 3 ) — | хлорат | (S 2 O 3 ) -2 | тиосульфат |
| (CLO 4 ) — | перхлорат | (S 4 O 6 ) -2 | персульфат |
| (BrO) — | гипобромит | (MnO 4 ) — | перманганат |
| (BrO3) — | бромат | (MnO 4 ) -2 | манганат |
| (IO) — | гипоиодит | (SiO3) -2 | метасиликат |
| (IO 3 ) — | йодат | (SiO 4 ) -4 | ортосиликат |
| (IO 4 ) — | периодатное | (CrO 4 ) -2 | хромат |
| (CN) — | цианид | (CrO 7 ) -2 | дихромат |
| (CNO) — | цианат | (AsO3) -3 | арсенит |
| (ЦНС) — | тиоцианат | (AsO 4 ) -3 | мышьяковокислый |
| (C 2 H 3 O 2 ) — | ацетат | (SbO3) -3 | Antimônito |
| (СО 3) -2 | карбонат | (SbO 4 ) -3 | антимонат |
| (С2-4) -2 | оксалат | (BO 3 ) -3 | борат |
| [Fe (CN) 6 ] -3 | гексационоферрата | (SnO 3 ) -2 | станнат |
| [Fe (CN) 6 ] -4 | железистосинеродистый | (SnO 2 ) -2 | станнин |
| (PO 3 ) — | метафосфат | (AlO 2 ) — | алюминат |
| (H 2 PO 2 ) — | гипофосфит | (PbO 2 ) -2 | Plumbito |
| (HPO 3 ) -2 | фосфит | (ZnO 2 ) -2 | zincato |
| (ПО 4 ) -3 | ортофосфат |
Какие бывают анионы?
Анио́н — отрицательно заряженный ион. … Отрицательный заряд обусловлен избытком электронов по сравнению с количеством протонов. Заряд аниона дискретен и выражается в единицах элементарного отрицательного электрического заряда; например, Cl − — однозарядный анион, а остаток серной кислоты SO42− — двузарядный анион.
Что такое катионы и анионы?
Катио́н — положительно заряженный ион. Характеризуется величиной положительного электрического заряда: например, NH4+ — однозарядный катион аммония, Ca2+ — двухзарядный катион кальция. В электрическом поле, катионы притягиваются к отрицательному электроду — катоду.
Какие вещества относятся к Анионам?
К анионам относятся гидроксид-ион OH − , ионы кислотных остатков I − , Br − , Cl − , NO 3 − и др. В растворах электролитов сумма зарядов катионов равна сумме зарядов анионов, поэтому эти растворы электронейтральны.
Что представляют собой анионы?
Анион представляет собой молекулу кислорода с отрицательным зарядом. Атомы, из которых состоит воздушная смесь, при обычных условиях нейтральны.
Чем полезны анионы?
Анион может нейтрализовать пыль, уничтожить вирусы, могут проникнуть в клетки бактерий и уничтожить их, таким образом, защищая организм человека от отрицательных последствий. Чем больше в воздухе анионов, тем меньше микробов, когда концентрация анионов достигает определенный уровень – микробы полностью уничтожаются.
Что такое анионы и на какие группы они делятся?
Ионы подразделяют на две большие группы — простые и сложные. Простые (одноатомные) ионы содержат одно атомное ядро. Сложные (многоатомные) ионы содержат не менее двух атомных ядер. Отдельно выделяют ион-радикалы — заряженные свободные радикалы.
Почему анионы так называются?
Анио́н — атом, или молекула, электрический заряд которой отрицателен, что обусловлено избытком электронов по сравнению с количеством положительных элементарных зарядов. Таким образом, анион — отрицательно заряженный ион.
Как найти катионы и анионы?
Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей (средних)
- Катионами называют положительно заряженные ионы.
- Анионами называют отрицательно заряженные ионы.
- Солями называют электролиты, при диссоциации которых образуются катионы металлов (а также катион аммония NH4+) и анионы кислотных остатков.
Как называется кислотный остаток PO4?
Кислотный остаток – это то, что останется от кислоты, если убрать водород. То есть, в азотной кислоте HNO3 кислотный остаток -NO3, в сероводородной Н2S кислотный остаток -S, в фосфорной кислоте H3PO4 кислотный остаток — PO4.
Как определить ионы?
Частица, в которой содержится разное число протонов и электронов, называется ионом. Если количество протонов больше, ион приобретает положительный заряд и становится катионом. Ионы с отрицательным зарядом (преобладают электроны) называются анионами.
Какой знак у катиона?
Атом может состоять из протонов, нейтронов и электронов. Положительно (+) заряженная частица (атом, молекула) называется тогда, когда количество протонов (p+) в атоме превышает количество в его составе электронов (e-) : + > — . Такая частица называется катион.
Сколько групп катионов?
Сероводородная аналитическая классификация катионов таблица
| Группы | Катионы, относящиеся к данной группе |
|---|---|
| 1 | K+, Na+, NH4+,Mg+2 |
| 2 | Ca+2, Ba+2 |
| 3 | Fe+3, Fe+2, Co+2, Mn+2, Zn+2, Al+3, Cr+3, Ni+2 |
| 4 | 1 подгруппа: Hg+, Hg+2, Ag+, Pb+2, Cu+2 2 подгруппа: As(III, V), Sb(III, V), Sn(II, IV) |
Какие анионы относятся ко 2 группе?
Ко 2-ой группе относятся: хлорид-ион Cl-, бромид-ион Br-, йодид-ион I-, сульфид-ион S2-. 3-я группа анионов – соли бария и серебра, растворимые в воде.
Что представляют собой анионы почему эти частицы так называются?
Отрицательно (-) заряженная частица (атом, молекула) называется тогда, когда количество электронов (e-) в атоме превышает количество в его составе протонов (p+): + < — . Такая частица называется анион.
Зачем нужны анионы?
Считается, что основная польза анионов (отрицательно заряженных молекул) заключается в активизации деятельности эритроцитов.
Для чего анионы?
Анионы, соединяясь с кислородом воздуха, образуют ионизированный кислород, способный улучшить иммунные качества человеческого организма и предотвратить многие заболевания. Анионы очищают, стерилизуют воздух и придают ему антисептические качества.
Что такое ионизация простыми словами?
Ионизация — процесс образования ионов из нейтральных атомов или молекул, идущий с поглощением теплоты. Положительные ионы образуются в результате отрыва электрона (или электронов) от атомов и молекул. В особых случаях нейтральные атомы и молекулы могут присоединять электроны и образовывать отрицательные ионы.
Урок-практикум
«Качественные реакции обнаружения
некоторых катионов и анионов»
Цели
урока:
Обучающие:
- Дать
понятия «качественная реакция», сформировать понимание учащихся
о возможности использования качественных реакций для анализа образцов
воды, продолжить формирование умения записывать уравнения химических
реакций в ионном виде.
Воспитывающие:
- Способствовать
формированию умения применять приемы логического мышления, способствовать
развитию грамотной устной и письменной химической речи.
Развивающие:
- Создать
условия для развития коммуникативной культуры, диалогической речи
учащихся, прививать навыки работы с веществами.
Оборудование:
·
Растворы
индикаторов (метилоранжа, лакмуса, фенолфталеина), растворы нитрата серебра,
хлорида бария, сульфата натрия, серной кислоты, гидроксида натрия (калия).
Набор реактивов должен быть рассчитан на пару учащихся, в наборе каждой парте
стоят три пробирки с прозрачными растворами: серной кислоты (пробирка №1),
гидроксида калия (пробирка №2) и хлорида бария (пробирка №3).
·
При
возможности урок лучше сопровождать электронной презентацией.
Ход
урока
1.
Организационный момент (1-2 мин).
Учитель организует
внимание учащихся.
2.
Овладение содержанием учебного материала (20 мин).
А) Понятие
качественных реакций.
Качественные
реакции — характерные реакции, используемые для идентификации различных
веществ.
Для определения
присутствия веществ, анионов, катионов используются различные химические
реакции. Эти реакции широко используются при проведении качественного анализа,
целью которого является определение наличия веществ или ионов в растворах или
смесях.
Качественные
реакции можно разделить на два вида: качественные реакции на катионы и анионы.
Качественные
реакции на катионы
Это реакции, с
помощью которых можно определить наличие того или иного катиона в растворе.
Основные качественные реакции на катионы представлены в таблице 1.
Таблица 1.
Качественные
реакции на катионы.
|
Катион |
Воздействие |
Наблюдаемая |
|
|
Пламя |
Карминово-красное |
|
|
Пламя |
Желтое |
|
К+ |
Пламя |
Фиолетовое |
|
Са2+ |
Пламя |
Кирпично-красное |
|
Sr2+ |
Пламя |
Карминово-красное |
|
Ва2+ |
Пламя S042- |
Желто-зеленое |
|
Сu2+ |
Вода |
Гидратированные |
|
РЬ2+ |
S2- |
Выпадение |
|
Аg+ |
Cl— |
Выпадение Аg+ +Cl— |
|
Fe2+ |
гексациано-феррат |
Выпадение К++ |
|
Fe3+ |
1) K4[Fe(CN)6] 2) |
Выпадение К+ + Fe3+ Появление |
|
Al3+ |
щелочь |
Выпадение |
|
NH4+ |
щелочь, |
Запах |
|
Н+ (кислая |
Индикаторы: |
красное красное окрашивание |
Качественные
реакции на катионы основаны на протекании химической реакции и на изменении
цвета пламени, то есть на физическом процессе.
Определить наличие
в растворе таких ионов как Li+, Na+, К+, Са2+,
Sr2+ с помощью химического взаимодействия невозможно, так
как эти ионы не могут быть связаны в растворе с образованием нерастворимого
вещества. Ионы, которые можно связать в растворе с образоваием осадка можно
обнаружит с помощью химических реакций, так например ионы серебра дают белый
осадок хлорида серебра с ионоами хлора: Аg+ +Cl—=AgCl.
Некоторые ионы
можно определить двумя способами и по химическому взаимодействию, и по цвету
пламени. Например, ионы Ba2+ окрашивают пламя в желто-зеленый цвет,
но также ионы Ba2+ вступают в реакцию с анионами SO42-
с образованием сульфата бария: SO42- + Ba2+ =
BaSO4.
Таким образом
определить наличие в растворе катионов можно как с помощью химических реакций,
так по окраски пламени.
Качественные реакции на анионы
Это реакции, с
помощью которых можно определить наличие того или иного аниона в растворе.
Основные качественные реакции на анионы представлены в таблице 2.
Таблица 2.
Качественные
реакции на катионы.
|
Анион |
Реактив |
Наблюдаемая реакция |
|
S042- |
Ва2+ |
Выпадение Ва2+ |
|
N03— |
1) |
Образование Возникновение |
|
РО43- |
ионы Ag+ |
Выпадение |
|
СrO42- |
ионы Ва2+ |
Выпадоние |
|
S2- |
ионы РЬ2+ |
Выпадение |
|
СО32- |
ионы Са2+ |
выпадение |
|
CO2 |
известковая |
Са(ОН)2 |
|
SO32- |
ионы Н+ |
Появление |
|
F— |
ионы Са2+ |
Выпадение-белого |
|
Cl— |
ионы Аg+ |
Выпадение |
|
Br— |
ионы Аg+ |
Выпадение |
|
I— |
ионы Аg+ |
Выпадение |
|
ОН— |
индикаторы: фенолфталеин |
синее |
Качественные
реакции на анионы основаны на химическом взаимодействии, то есть определить
наличие того или иного иона можно, только проведя химическую реакцию. Например,
что бы определить наличие в растворе ионов хлора, необходимо провести
химическое взаимодействие изучаемого объекта с растворимой солью серебра, тогда
сущность реакции будет отражаться следующим ионным уравнением:
Аg+ +CI—=
AgCl
В своей работе я
буду использовать качественные реакции для изучения воды различного
происхождения.
Таким
образом,
проведя качественные реакции можно подтвердить однозначно их наличие
определенных ионов в растворе.
Б)
Использование качественных реакций.
Данный этап урока
посвящен тому, где можно использовать качественные реакции. Ученик, выполнявший
исследовательскую работу рассказывает о практической части своей работы, где
проводилось исследование различных образцов воды.
Экспериментальная
часть работы состояла из двух опытов по изучению качественного состава образцов
водопроводной и природной воды.
Цель:
исследование состава воды (водопроводного и природного происхождения) с помощью
качественных реакций (на ионы H+, OH—, Cl—, SO42-).
а) Первый опыт:
Характеристика
изучаемых образцов воды:
Водопроводная вода(село);
Водопроводная вода
(территория школы);
Растаявший снег
(около школы);
Фильтрованная,
водопроводная вода из территории школы(фильтр «Аквафор»).
Опыт проводился следующим
образом: каждый образец воды был разделен на четыре части. К каждой части
соответственно добавлялся соответствующий реактив, полученные наблюдения
представлены в таблице, а ход опыта на рисунке. В случае определения проведения
качественных реакций на кислоту и щелочь, по мимо изучаемых образцов
использовались контрольные образцы, содержащие соответственно соляную кислоту и
гидроксид калия. Это необходимо, для того чтобы лучше увидеть изменение цвета
индикатора.
|
Реактив |
№ образца |
|||
|
1 |
2 |
3 |
4 |
|
|
Метилоранж |
Цвет не |
Цвет не |
Цвет не |
Цвет не |
|
Фенолфталеин |
Раствор |
Раствор |
Раствор |
Раствор |
|
Нитрат |
Появился |
Раствор |
Цвет не |
Цвет не |
|
Хлорид |
Изменений |
Изменений |
Изменений |
Изменений |
В
первом опыте исследовались четыре образца воды (водопроводная вода и Красного
Села; водопроводная вода с территории гимназии; растаявший снег,
собранный около гимназии; фильтрованная вода), наблюдения представлены в
таблице, откуда видно, что в исследуемых образцах нет кислоты, щелочей и
сульфат ионов. Опыт показал, что в водопроводной воде из Красного Села
содержится значительное количество хлорид ионов, а в водопроводной воде с
территории гимназии содержание хлорид ионов не значителен. Вода, полученная при
таянии снега, и фильтрованная вода не содержат хлорид ионов в обнаруживаемых
количествах.
б) Второй опыт:
Характеристика
изучаемых образцов воды:
- Образец
воды с магистрали - Снег
из малопосещаемого места - Снег
из дворовой территории - Дистиллированная
вода
Данный опыт
проводился аналогично первому опыту, ход опыта представлен на рисунке 2, а
результаты наблюдений в таблице.
|
Реактив |
№ образца |
|||
|
1 |
2 |
3 |
4 |
|
|
Метилоранж |
Цвет не |
Цвет не |
Цвет не |
Цвет не |
|
Фенолфталеин |
Раствор |
Раствор |
Раствор |
Раствор |
|
Нитрат |
Появился |
Цвет не |
Цвет не |
Цвет не |
|
Хлорид |
Появился |
Изменений |
Изменений |
Изменений |
Во
втором опыте исследовались четыре образца воды (снег с магистрали, снег с
малопосещаемого места, снег из дворовой территории и дистиллированная вода).
Наблюдения представлены в таблице, откуда видно, что в исследуемых образцах нет
кислоты и щелочи. Опыт показал, что снег с магистрали содержит значительное
количество хлорид ионов и небольшое количество сульфат ионов. Другие образцы не
содержат в обнаруживаемых количествах ни сульфат, ни хлорид ионов.
Если предположить,
что изучаемые образцы воды могут содержать хлорид ионы в виде хлорид магния, а
сульфат-ионы в составе сульфата натрия, то можно записать следующие уравнения
реакций:
Качественная
реакция на хлорид-ионы:
2AgNO3
+ MgCl2 = 2AgCl + Mg(NO3)2
2Ag+ + 2NO3- +
Mg2+ + 2Cl- = 2AgCl + Mg2+ + 2NO3-
2Ag+ + 2Cl-= 2AgCl
Ag+ + Cl-= AgCl
Качественные
реакции на сульфат-ионы:
BaCl2 +
Na2SO4 = BaSO4 + 2NaCl
Ba2+ +
2Cl— + 2Na+ + SO42- = BaSO4
+ 2Na+ + 2Cl—
Ba2+ +
SO42- = BaSO4
Таким
образом,
используя образцы природной и водопроводной воды, с помощью качественных
реакций, я определила содержание ионов хлорида и бария, кислотность воды.
Опыты показали,
что водопроводная вода из Красного Села определяемые с помощью качественной
реакции, количества хлорид ионов, а водопроводная вода из гимназии — нет.
3.
Закрепление знаний учебного материала (10 мин).
На данном этапе
учащимся предлагается выполнить практическое задание по проведению качественных
реакций.
Задание:
С помощью
качественных реакций доказать, что выданные вам вещества — растворы серной
кислоты (пробирка №1), гидроксида калия (пробирка №2) и хлорида бария (пробирка
№3). Записать наблюдения и уравнения соответствующих реакций. Учащиеся
выполняют задания в парах и заполняют таблицу:
|
ФИО |
|||
|
Уравнение |
|||
|
Качественная |
Необходимый |
Наблюдения |
Уравнение |
|
Качественная |
Необходимый |
Наблюдения |
Уравнение |
|
Вывод |
Домашнее задание
обычно отсутствует.
4.
Завершение урока (1-2 мин).
Учитель благодарит
учащихся за урок, оценивает деятельность учащихся в целом и отдельных учащихся
индивидуально. Собирает таблицы с выполненным заданием.
Данную таблицу могут использовать учащиеся 9-х классов при подготовке к ГИА (задание С3 — 1 вариант; задания С3 и С4 — 2 вариант)
Скачать:
Предварительный просмотр:
Качественные реакции для определения катионов и анионов электролитов (кислот, солей и щелочей)
|
Определяемый катион |
Определяемое вещество |
Реактив для определения |
Сокращённое ионное уравнение |
Признак реакции |
|
Н+ |
все кислоты |
Индикаторы: м-о лакмус ф-ф |
красный красный бесцветный |
|
|
Li+ |
соль лития |
пламя |
красное окрашивание |
|
|
Na+ |
соль натрия |
пламя |
жёлтое окрашивание |
|
|
K+ |
соль калия |
пламя |
фиолетовое окрашивание |
|
|
Ca2+ |
соль кальция |
пламя |
кирпично-красное окрашивание |
|
|
растворимая соль кальция |
растворы карбонатов (Na2CO3) |
Ca+2 + CO32- = CaCO3 ↓ |
образуется белый осадок |
|
|
Ba2+ |
соль бария |
пламя |
жёлто-зелёное окрашивание |
|
|
растворимая соль бария |
серная кислота (H2SO4), растворы сульфатов (Na2SO4) |
Ba2+ + SO42- = BaSO4↓ |
белый плотный осадок |
|
|
Cu2+ |
соль меди (II) |
пламя |
зелёное окрашивание |
|
|
растворимая соль меди(II) |
Раствор щёлочи (NaOH) |
Cu2+ + 2OH— = Cu(OH)2↓ |
синий студенистый осадок |
|
|
Fe2+ |
растворимая соль железа (II) |
Раствор щёлочи (NaOH) |
Fe2+ + 2OH— = Fe(OH)2↓ |
зелёный осадок |
|
Раствор красной кровяной соли K3[Fe(CN)6] |
3Fe2+ + 2[Fe(CN)6]3- =Fe3[Fe(CN)6]2↓ |
Синий осадок (турнбулева синь) |
||
|
Fe3+ |
растворимая соль железа (III) |
Раствор щёлочи (NaOH) |
Fe3+ + 3OH— = Fe(OH)3↓ |
бурый осадок |
|
Раствор роданида аммония или калия (NH4CNS или КСNS) |
Fe3+ + 3CNS— = Fe(CNS)3 |
кроваво-красный раствор |
||
|
Раствор жёлтой кровяной соли K4[Fe(CN)6] |
4Fe3+ + 3[Fe(CN)6]4- =Fe4[Fe(CN)6]3↓ |
Синий осадок (берлинская лазурь) |
||
|
Al3+ |
растворимая соль алюминия |
Раствор щёлочи (NaOH) |
Al3+ + 3OH— = Al(OH)3↓ |
желеобразный осадок белого цвета, который растворяется в избытке щёлочи |
|
NH4+ |
соль аммония |
Раствор щёлочи (NaOH) при нагревании |
NH4+ + ОН— = NH3↑ + Н2О |
образуется газ с резким запахом |
|
Ag+ |
растворимая соль серебра |
Соляная кислота или растворы хлоридов |
Ag+ + Cl— = AgCl↓ |
образуется белый творожистый осадок |
|
Определяемый анион |
Определяемое вещество |
Реактив для определения |
Сокращённое ионное уравнение |
Признак реакции |
|
OH— |
щёлочи |
индикаторы: фенолфталеин м-о лакмус |
малиновый жёлтый синий |
|
|
Cl— |
соляная кислота и хлориды |
раствор нитрата серебра (AgNO3) |
Ag+ + Cl— = AgCl↓ |
образуется белый творожистый осадок |
|
Br— |
бромоводородная кислота и бромиды |
раствор нитрата серебра (AgNO3) |
Ag+ + Br— = AgBr↓ |
образуется желтоватый творожистый осадок |
|
I— |
йодоводородная кислота и йодиды |
раствор нитрата серебра (AgNO3) |
Ag+ + I— = AgI↓ |
образуется жёлтый творожистый осадок |
|
S2- |
сульфиды |
Сильные кислоты (HCl, HNO3, H2SO4) |
S2- + 2H+ = H2S↑ |
образуется газ с неприятным запахом |
|
растворимые соли меди (II) |
S2- + Cu2+ = CuS↓ |
образуется чёрный осадок |
||
|
SO42- |
сульфаты |
растворимые соли бария |
SO42- + Ba2+ = BaSO4↓ |
белый осадок |
|
NO3— |
нитраты |
медь (Cu) и концентрированная серная кислота для определения азотной кислоты используется только медь |
Cu + NO3— + 2Н+ = Cu2+ + NO2↑ + H2O |
образуется бурый газ |
|
PO43- |
ортофосфаты |
раствор нитрата серебра (AgNO3) |
3Ag+ + PO43- = Ag3PO4 ↓ |
образуется жёлтый осадок |
|
CrO42- |
хроматы |
растворимые соли бария |
Ba2+ + CrO42- = BaCrO4 ↓ |
образуется жёлтый осадок |
|
CO32- |
карбонаты |
Сильные кислоты (HCl, HNO3, H2SO4) |
CO32- + 2Н+ = СO2↑ + H2O |
образуется бесцветный газ без запаха |
|
SO32- |
сульфиты |
Сильные кислоты (HCl, HNO3, H2SO4) |
SO32- + 2Н+ = SO2↑ + H2O |
образуется газ с резким запахом |
По теме: методические разработки, презентации и конспекты
«Электролиты. Реакции в растворах электролитов»
Обобщающий урок по теме «Электролиты. Реакции в растворах электролитов» . Урок включает в себя фронтальный опрос, дифференцированные задания, парную лабораторную работу. Проведен в 8 классе….
Качественные реакции на катионы и анионы
Разработка занятия по химии для 9 класса по учебнику Г.Е.Рудзитиса, Ф.Г.Фельдмана с использованием ЭФУ (эллектронной формы учебника) по теме «Качественные реакции на катионы и анионы» при подготовке к…
- Мне нравится