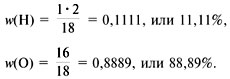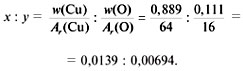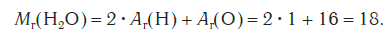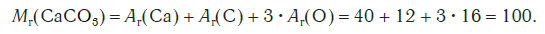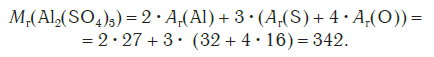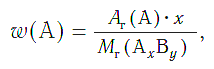Как найти АТОМНУЮ долю?
(не массовую).
Перед вами страница с вопросом Как найти АТОМНУЮ долю?, который относится к
категории Химия. Уровень сложности соответствует учебной программе для
учащихся 5 — 9 классов. Здесь вы найдете не только правильный ответ, но и
сможете ознакомиться с вариантами пользователей, а также обсудить тему и
выбрать подходящую версию. Если среди найденных ответов не окажется
варианта, полностью раскрывающего тему, воспользуйтесь «умным поиском»,
который откроет все похожие ответы, или создайте собственный вопрос, нажав
кнопку в верхней части страницы.
Среднее относительное содержание данного химического элемента в какой-либо природной системе (звезды, Солнечная система, планеты) называется его распространенностью или кларком. Содержание элементов обычно выражают в массовых или атомных долях, в процентах. [c.225]
Содержание легирующего компонента атомные доли [c.126]
О 0,25 0,50 0,75 100 Содертание золота, атомные доли [c.328]
Тамман установил, что коррозионная стойкость полностью гомогенных твердых растворов в отсутствие заметной диффузии при легировании менее устойчивого металла более устойчивым изменяется не непрерывно, а скачками (рис. 225). Резкое изменение коррозионной стойкости происходит, когда концентрация легирующего элемента достигает атомной доли, или величины, кратной этому числу, т. е. 8, % и т. д. атомной доли — правило п18 Таммана. [c.327]
Сплав Защищающий компонент Граница устойчивости, атомные доли Изученные сверхструктуры [c.329]
В виде примера вычислим состав коррозионностойкой хромистой стали, содержащей / атомной доли хрома в твердом растворе. Атомный вес железа равен 55,85, хрома — 52,01, и = 1 [c.127]
Наступление пассивного состояния хромистых сталей подчиняется правилу п/8 порогов устойчивости Таммана, чем и объясняется то, что хромистые стали с небольшим содержанием хрома (менее /в атомной доли) не являются в большинстве случаев устойчивыми в сильно агрессивных средах. [c.214]
Как известно, почти все металлы термодинамически неустойчивы, т. е. их стандартный электродный потенциал ме.обр, являющийся количественной характеристикой термодинамической устойчивости, имеет отрицательное значение. Согласно правилу Таммана, повышение термодинамической устойчивости сплава возможно, если сплав образует структуру твердого раствора, а концентрация более стойкого металла равна /г/8 атомных долей (где п — целое число, равное 1, 2, 3 и т. д., зависящее от системы твердых растворо в и от агрессивности среды). Эффект повышения термодинамической устойчивости основан на образовании в некоторых сплавах сверхструктуры, характеризующейся упорядоченным расположением атомов в твердом растворе, благодаря чему [c.36]
Основным легирующим элементом нержавеющих сталей является хром, который облагораживает электродный потенциал стали и повышает ее коррозионную стойкость. Повышение коррозионной стойкости при увеличении содержания хрома в стали происходит скачкообразно. Первый порог коррозионной устойчивости достигается при концентрации хрома, равной 12,8%, что соответствует 1/8 атомной доли хрома в соста,ве стали. Для обеспечения коррозионной стойкости стали это количество хрома должно находиться в твердом растворе железа и не образовывать карбидов. При увеличении его содержания до 18% или до 25—28% достигается второй порог и наблюдается дальнейшее повышение коррозионной стойкости стали. Однако увеличение содержания хрома приводит к понижению механических свойств стали, особенно ударной вязкости, а также затрудняет сварку, вызывая хрупкость сварного шва. Поэтому стали с высоким содержанием хрома после сварки требуют термической обработки. [c.40]
По методу Тодоса [17] можно получить более точные результаты, вычисляя а и 6 аддитивно из атомных долей на следующих основаниях [c.225]
Атомная доля бора, % P 10- Ом-см Ра, Ом см . Число носителей тока X Х10-1 , см-з [c.430]
В этом выражении концентрации выражены в г-ионах на литр, а содержание металлов в осадке — в атомных долях. [c.567]
Состав расплава выражен в атомных долях. [c.100]
Известно, что свойства веществ зависят от их чистоты. В последние годы, особенно вследствие потребпостей атомной энергетики и радиоэлектроники, чистота веществ приобрела невиданную ранее актуальность. Количественным показателем степени чистоты является концентрация в них примеси чужеродных частиц, которая выражается в массовых, молярных или атомных долях в процентах. Примеси с содержанием 10 —10 мае. долей, %, и меиее называют обычно микропримесямн. Заводы настоящего, тем более будущего, должны работать с веществами заданной чистоты. [c.32]
Если компоненты только частично смешиваются в твердом состоянии, то диаграмма плавкости имеет вид, изображенный на рис. 26. Многие бинарные системы имеют диаграмму плавкости вида, изображенного на рис. 27. Однако в реальных случаях и эти системы при преобладающем содержании одного из компонентов, т. е. когда молярная (атомная) доля одного из компонентов в смеси близка к единице, имеют диаграмму плавкости, соответствующую правой или левой части рис. 26. Это обусловлено тем, что в процессе кристаллизации часть примеси захватывается кристаллами основного вещества вследствие образования смешенных кристаллов (твердых растворов) или вследствие адсорбции примесных молекул на гранях растущих кристаллов. [c.106]
Указанные отношения, умноженные на 100, дают мольную (атомную) долю в процентах. [c.209]
Большой вклад в становление и развитие геохимии науки о химическом составе, закономерностях распространения и распределения элементов и их соединений на Земле — внесли В. И. Вернадский, А. П. Виноградов, В. Гольдшмидт и др. По предложению А. Е. Ферсмана числа, показывающие среднее содержание какого-либо химического элемента в природе, называются кларками в честь ученого, сделавшего первый расчет (1889) распространенности химических элементов в земной коре. Кларки могут быть выражены либо в атомных долях (%), показывающих долю (%) числа атомов данного элемента от общего числа атомов имеющихся элементов, либо в массовых долях (%), показывающих, какая доля. (%) приходится на данный элемент от общей массы рассматриваемой природной системы. Эти показатели связаны отношением массовой доли к атомной, равным Аг. 20, где Аг — относительная атомная масса данного элемента, а 20 — усредненная масса атомов земной коры. [c.201]
Введем атомные доли компонентов с, = + Л/а) = Ыг/М, [c.85]
Складывая вместе эти соотношения, найдем, что д1 + да = д сп> где о СП — средняя атомная плотность бинарной системы (сплава). Обозначим 1 (5) + С2 а»(5) = Я(5), Рг 8)1 3) = Кг, р2 

Определить для системы таллий (2) — ртуть (1) изменение парциальных молярных энтальпий и изменение энтальпии, энергии Гиббса, энтропии в результате образования 1 кг растворов указанных концентраций при 298 К (Л 2 — атомная доля таллия). [c.151]
Различные элементы представлены и распространены на Земле неравномерно. Большинство легких элементов с массовыми числами до 50 составляет в сумме — 99,4 атомных долей, % трех оболочек атмосферы, гидросферы и литосферы. На долю остальных элементов приходится всего — 0,6 атомных доли, %. В соответствии с этим выделяют так называемые редкие элементы, содержание которых на Земле мало. Так, для цезия оно составляет 9-10 %, для рения для церия 5-10 %, а содержание других ланта- [c.43]
Определение пределов растворимости при образовании твердых растворов. Определение основано на зависимости параметров твердого раствора от содержания растворенного компонента. По правилу Вегарда параметры решетки твердого раствора изменяются линейно с изменением его состава (атомной долей компонентов). В действительности это часто не соблюдается, однако в относительно небольшом интервале концентраций указанную зависимость можно с определенным допушением считать линейной, т. е. принять [c.99]
Рассчитайте равновесные доли молекул дейтеромета-нов СН4 О (/ = О, 1, 2, 3, 4), если атомная доля дейтерия в системе составляет а) 50 % б) 10 %. [c.64]
Чистые, специально обезгажеиные металлы (в том числе тонкие металлические пленки, нанесенные на стекло), каталитически совершенно неактивны по отношению к гидрированию этилена в присутствии никеля, меди, железа, платины, палладия и вольфрама. Пленки тех же металлов с точно дозированным количеством газовой примеси своеобразно изменяют каталитическую активность в зависимости от содержания захваченной примеси (рис. 21) активность пленок проходит через резкий максимум. Основным меняющимся параметром является атомная доля у, равная у=Ы Ма, [c.127]
Природные соединения и получение кремния. Содержание кремния в земной коре составляет 27,6 мае. долей, %, и по распространенности он уступает только кислороду. При оценке распространенности элементов в атомных долях в % кремний смещается на третье место, располагаясь после кислорода и водорода. В природе кремний находится только в связанном состоянии. Среди важнейших минералов кремния кремнезем5102, каолинит А14(5]40, )(0Н)й, полевые шпаты Ме(А151зОв), где Ме—Ыа, К, слюды МеЭ(А15 зОю) (ОН, Р)а, где Ме — Ыа, К, а Э — А1, Ре. [c.199]
О.С.ГАБРИЕЛЯН,
И.Г.ОСТРОУМОВ,
А.К.АХЛЕБИНИН
СТАРТ В ХИМИЮ
7 класс
Продолжение. Начало см. в № 1, 2, 3, 4, 5/2006
Глава 2. Математика в химии
§ 10. Относительная атомная и
молекулярная массы

внимательно посмотрим на таблицу Д.И.Менделеева
и выберем один из элементов. Например, обитатель
шестой «квартиры» – углерод. Что изображено в
этой клетке? Знак (символ) химического элемента и
его название. В верхнем левом углу – порядковый
номер элемента, под символом элемента – его
название. А что означает записанное под
названием число 12,011?
Это число называется относительной атомной
массой элемента, в нашем случае – углерода.
Как вы помните, одно из важнейших свойств
атомов химических элементов – их масса.
Статья опубликована при поддержке группы компаний «Евроинжиниринг». Бензогенераторы, дизельгенераторы, снегоуборщики, блоки автоматического запуска, комплекты для ТО, предпусковые подогреватели, контейнеры для генераторов и другие товары от ведущих мировых производителей. Доставка по всей России, наличный и безналичный расчёт, гарантия качества. Доступна услуга выездного обслуживания бензиновых и дизельных генераторов. Всю подробную информацию Вы найдёте на сайте: http://energyprofessional.ru.
Размерность массы вам хорошо известна: ее
выражают в граммах, килограммах, миллиграммах.
Существуют, конечно, и другие единицы массы:
тонны, например, или центнеры. Однако в
повседневной жизни бывает удобно оперировать не
точной массой предмета, а сравнением ее с
чем-либо. Поскольку массы атомов и молекул
чрезвычайно малы, их сравнивают с массой атома
самого легкого элемента – водорода. Такое
сравнение позволяет утверждать, что масса атома
углерода в 12 раз больше массы атома водорода.
Масса атома кислорода больше массы атома
водорода в 16 раз, а масса атома железа – в 56 раз.
Величина, показывающая, во сколько раз масса
атома данного элемента больше массы атома
водорода, принятой за единицу, называется
относительной атомной массой элемента.
Относительную атомную массу элемента
обозначают символом Аr. Подстрочная
буква r – это первая буква английского слова relative,
что значит относительный. Например: Аr(Н) =
1,
Аr(С) = 12, Аr(N) = 14, Аr(О) = 16, Аr(Fe)
= 56, Аr(Cl) = 35,5.
Обычно относительные атомные массы всех
элементов округляют до целых чисел, кроме хлора
(Аr(Cl) = 35,5), хотя в таблице Д.И.Менделеева
они приведены с большей точностью.
Обратите внимание, что относительная атомная
масса хотя массой и называется, но размерности не
имеет.
Обладают ли массой молекулы веществ? Конечно!
Можете ли вы ответить на вопрос, во сколько раз
молекула воды тяжелее атома водорода? Это очень
просто: надо сложить относительные атомные массы
всех атомов, входящих в состав молекулы (рис. 56):
Mr(H2O) = 2Ar(H) + Ar(O)
= 2•1 + 16 = 18.
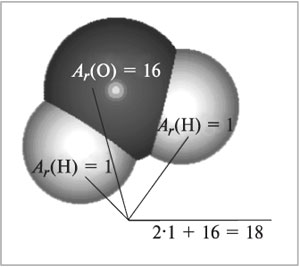 |
Рис. 56.
|
Величина Mr(H2O) – это относительная
молекулярная масса воды. Правильнее было бы
называть ее относительной формульной массой.
Во-первых, не все вещества состоят из молекул (мы
уже приводили в пример железо и графит).
Во-вторых, при расчете этой величины нужно
внимательно смотреть на формулу вещества и не
забывать про индексы, указывающие на число
атомов каждого элемента:
Mr(СH4) = Ar(С) + 4Ar(Н)
= 12 + 4•1 = 16,
Mr(SO2) = Ar(S) + 2Ar(O)
= 32 + 2•16 = 64.
Таблица относительных атомных масс Дж.Дальтона
была далека от совершенства, содержала довольно
много ошибок. Но благодаря ей стало возможным
определять формулы химических веществ по
соотношению масс входящих в их состав элементов.
Как это делалось, мы расскажем на следующем
уроке.
1.
Что такое относительная атомная масса? Почему
эта величина не имеет размерности?2. Что такое относительная молекулярная
масса? Как она рассчитывается?3. В состав молекулы фосфорной кислоты
входят три атома водорода, один атом фосфора и
четыре атома кислорода. Найдите относительную
молекулярную массу этого вещества.4. Рассчитайте относительные молекулярные
массы веществ по их формулам: Br2, H2O, CO2,
H2SO4, KOH, BaCl2. Значения
относительных атомных масс найдите по таблице
Д.И.Менделеева, округлите их до целых чисел (за
исключением хлора,
Ar(Cl) = 35,5).
5.
Атом серы образует с атомами кислорода два
сложных вещества (их называют оксидами) разного
состава. Относительная молекулярная масса
первого оксида равна 64, а второго – 80. Выведите
формулы этих оксидов.6. Не производя расчетов, а только на
основании значений относительных атомных масс
(найдите их по таблице Д.И.Менделеева) определите,
у какого из веществ, формулы которых приведены
ниже, наибольшая и наименьшая относительные
молекулярные массы: а) селеноводорода H2Se; б)
воды Н2О;
в) теллуроводорода H2Te; г) сероводорода H2S.
§11. Массовая доля элемента в сложном
веществе
С XVII в. химия перестала быть описательной
наукой. Ученые-химики стали широко использовать
измерение вещества. Все более
совершенствовалась конструкция весов,
позволяющих определять массы образцов. Для
газообразных веществ помимо массы измеряли
также объем и давление. Применение
количественных измерений дало возможность
понять сущность химических превращений,
определять состав сложных веществ.
Как вы уже знаете, в состав сложного вещества
входят два или более химических элементов.
Очевидно, что масса всего вещества слагается из
масс составляющих его элементов. Значит, на долю
каждого элемента приходится определенная часть
массы вещества.
Массовой долей элемента называется отношение
массы этого элемента в сложном веществе к массе
всего вещества, выраженное в долях единицы (или в
процентах):
Массовая доля элемента в соединении
обозначается латинской строчной буквой w
(«дубль-вэ») и показывает долю (часть массы),
приходящуюся на данный элемент в общей массе
вещества. Эта величина может выражаться в долях
единицы или в процентах. Конечно, массовая доля
элемента в сложном веществе всегда меньше
единицы (или меньше 100%). Ведь часть от целого
всегда меньше целого, как долька апельсина
меньше всего апельсина.
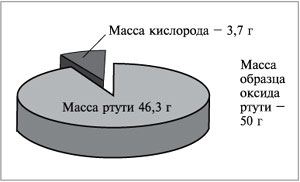
Например, в состав оксида ртути входят два
элемента – ртуть и кислород. При нагревании 50 г
этого вещества получается 46,3 г ртути и 3,7 г
кислорода (рис. 57). Рассчитаем массовую долю ртути
в сложном веществе:
|
|
Рис. 57.
|
Массовую долю кислорода в этом
веществе можно рассчитать двумя способами. По
определению массовая доля кислорода в оксиде
ртути равна отношению массы кислорода к массе
оксида:
Зная, что сумма массовых долей элементов в
веществе равна единице (100%), массовую долю
кислорода можно вычислить по разности:
w(O) = 1 – 0,926 = 0,074,
или
w(О) = 100% – 92,6% = 7,4%.
Для того чтобы найти массовые доли элементов
предложенным способом, необходимо провести
сложный и трудоемкий химический эксперимент по
определению массы каждого элемента. Если же
формула сложного вещества известна, та же задача
решается значительно проще.
Для расчета массовой доли элемента нужно его
относительную атомную массу умножить на число
атомов (n) данного элемента в формуле и
разделить на относительную молекулярную массу
вещества:
Например, для воды (рис. 58):
Mr(H2O) = 1•2 + 16 = 18,
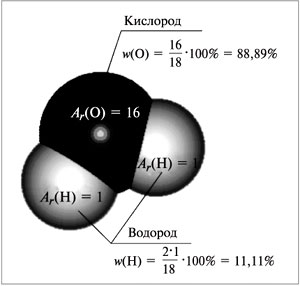 |
Рис. 58.
|
Далее рассмотрим решение задач на
вычисление массовых долей элементов в сложных
веществах.
Задача 1. Рассчитайте массовые доли
элементов в аммиаке, формула которого NH3.
Дано:
вещество аммиак NH3.
Найти:
w(N), w(H).
Решение
1) Рассчитаем относительную молекулярную массу
аммиака:
Mr(NH3) = Ar(N) + 3Ar(H)
= 14 + 3•1 = 17.
2) Найдем массовую долю азота в веществе:
3) Вычислим массовую долю водорода в аммиаке:
w(H) = 1 – w(N) = 1 – 0,8235 = 0,1765, или 17,65%.
Ответ. w(N) = 82,35%, w(H) = 17,65%.
Задача 2. Рассчитайте массовые доли
элементов в серной кислоте, имеющей формулу H2SO4.
Дано:
серная кислота H2SO4.
Найти:
w(H), w(S), w(O).
Решение
1) Рассчитаем относительную молекулярную массу
серной кислоты:
Mr(H2SO4) = 2Ar(H)
+ Ar(S) + 4Ar(O) = 2•1 + 32 + 4•16 = 98.
2) Найдем массовую долю водорода в веществе:
3) Вычислим массовую долю серы в серной кислоте:
4. Рассчитаем массовую долю кислорода в
веществе:
w(O) = 1 – (w(H) + w(S)) = 1 – (0,0204 +
0,3265) = 0,6531, или 65,31%.
Ответ. w(H) = 2,04%, w(S) = 32,65%, w(O) = 65,31%.
Чаще химикам приходится решать обратную
задачу: по массовым долям элементов определять
формулу сложного вещества. То, как решаются
подобные задачи, проиллюстрируем одним
историческим примером.
Из природных минералов – тенорита и куприта –
были выделены два соединения меди с кислородом
(оксиды). Они отличались друг от друга по цвету и
массовым долям элементов. В черном оксиде
массовая доля меди составляла 80%, а массовая доля
кислорода – 20%. В оксиде меди красного цвета
массовые доли элементов составляли
соответственно 88,9% и 11,1%. Каковы же формулы этих
сложных веществ? Проведем несложные
математические расчеты.
Пример 1. Расчет химической формулы черного
оксида меди (w(Cu) = 0,8 и w(О) = 0,2).
1) Обозначим формулу вещества с помощью
индексов х, у – по числу атомов химических
элементов в его составе: СuxOy.
2) Отношение индексов равно отношению частных
от деления массовой доли элемента в соединении
на относительную атомную массу элемента:
3) Полученное соотношение нужно привести к
соотношению целых чисел: индексы в формуле,
показывающие число атомов, не могут быть
дробными. Для этого полученные числа разделим на
меньшее (т.е. любое) из них:
Получилась формула – СuO.
Пример 2. Расчет формулы красного оксида
меди по известным массовым долям w(Cu) = 88,9% и w(O)
= 11,1%.
Дано:
w(Cu) = 88,9%, или 0,889,
w(O) = 11,1%, или 0,111.
Найти:
формулу.
Решение
1) Обозначим формулу оксида СuxOy.
2) Найдем соотношение индексов x и y:
3) Приведем соотношение индексов к отношению
целых чисел:
Ответ. Формула соединения – Cu2O.
А теперь немного усложним задачу.
Задача 3. По данным элементного
анализа состав прокаленной горькой соли,
использовавшейся еще алхимиками в качестве
слабительного средства, следующий: массовая доля
магния – 20,0%, массовая доля серы – 26,7%, массовая
доля кислорода – 53,3%.
Дано:
w(Mg) = 20,0%, или 0,2,
w(S) = 26,7%, или 0,267,
w(O) = 53,3%, или 0,533.
Найти:
формулу.
Решение
1) Обозначим формулу вещества с помощью
индексов x, y, z: MgxSyOz.
2) Найдем соотношение индексов:
3) Определим значение индексов x, y, z:
Ответ. Формула вещества – MgSO4.
1.
Что называется массовой долей элемента в сложном
веществе? Как рассчитывается эта величина?2. Рассчитайте массовые доли элементов в
веществах: а) углекислом газе CO2;
б) сульфиде кальция СаS; в) натриевой селитре NaNO3;
г) оксиде алюминия Al2O3.3. В каком из азотных удобрений массовая
доля питательного элемента азота наибольшая: а)
хлориде аммония NH4Cl; б) сульфате аммония (NH4)2SO4;
в) мочевине (NH2)2CO?
4.
В минерале пирите на 7 г железа приходится 8 г
серы. Вычислите массовые доли каждого элемента в
этом веществе и определите его формулу.5. Массовая доля азота в одном из его оксидов
равна 30,43%, а массовая доля кислорода – 69,57%.
Определите формулу оксида.
6. В средние века из золы костра выделяли
вещество, которое называли поташ и использовали
для варки мыла. Массовые доли элементов в этом
веществе: калий – 56,6%, углерод – 8,7%, кислород –
34,7%. Определите формулу поташа.
В уроке 7 «Относительная молекулярная и относительная формульная массы» из курса «Химия для чайников» научимся вычислять относительную молекулярную массу, а также относительную формульную массу веществ; кроме того, выясним что такое массовая доля и приведем формулу для ее вычисления. Напоминаю, что в прошлом уроке «Валентность» мы дадим определение валентности, научились ее определять; рассмотрели элементы с постоянной и переменной валентностью, кроме того научились составлять химические формулы по валентности.
Каждый химический элемент характеризуется определенным значением относительной атомной массы. Состав любого вещества выражается молекулярной или простейшей формулой его структурной единицы. Такая структурная единица состоит из определенного числа атомов химических элементов. Поэтому масса структурной единицы может быть выражена в атомных единицах массы.
Содержание
- Относительная молекулярная масса
- Относительная формульная масса
- Вычисление массовой доли химического элемента по формуле вещества
Относительная молекулярная масса
Вещества молекулярного строения характеризуются величиной относительной молекулярной массы, которая обозначается Mr.
Относительная молекулярная масса — это физическая величина, равная отношению массы одной молекулы вещества к 1/12 части массы атома углерода.
Эта величина равна сумме относительных атомных масс всех химических элементов с учетом числа их атомов в молекуле. Например, рассчитаем относительную молекулярную массу воды H2O:
Относительная молекулярная масса серной кислоты H2SO4:
Относительные молекулярные массы, как и относительные атомные массы, являются величинами безразмерными. Значение Мr показывает, во сколько раз масса молекулы данного вещества больше атомной единицы массы u. Например, если Mr(H2O) = 18, это значит, что масса молекулы H2O в 18 раз больше 1/12 части массы атома углерода, т. е. в 18 раз больше атомной единицы массы. Соответственно, масса молекулы H2SO4 в 98 раз больше 1/12 части массы атома углерода.
Относительная формульная масса
Вещества немолекулярного строения также характеризуются подобной величиной, которая называется относительной формульной массой. Как и относительная молекулярная масса, она равна сумме относительных атомных масс всех элементов, входящих в состав структурной единицы таких веществ — формульной единицы, и также обозначается Mr. При этом, конечно, необходимо учитывать индексы у символов атомов.
Например, относительная формульная масса вещества CaCO3 равна:
Относительная формульная масса вещества Al2(SO4)3 равна:
Относительная формульная масса показывает, во сколько раз масса формульной единицы данного вещества больше 1/12 части массы атома углерода, или атомной единицы массы u.
Вычисление массовой доли химического элемента по формуле вещества
По формуле вещества можно рассчитать массовую долю атомов каждого химического элемента, который входит в состав этого вещества, т. е. определить, какую часть от общей массы вещества составляет масса атомов данного элемента.
Массовая доля (w) атомов химического элемента в веществе показывает, какая часть относительной молекулярной (формульной) массы вещества приходится на атомы данного элемента.
Массовая доля атомов элемента А в сложном веществе АxBy рассчитывается по формуле:
где w («дубль-вэ») — массовая доля элемента А;
Ar(А) — относительная атомная масса элемента А;
х, у — числа атомов элементов А и В в формуле вещества;
Mr(АхBy) — относительная молекулярная (формульная) масса вещества АхBy.
Массовые доли выражаются в долях единицы или в процентах.
Пример. Определите массовые доли элементов в фосфорной кислоте H3PO4
Спойлер
[свернуть]
Краткие выводы урока:
- Относительная молекулярная (формульная) масса вещества — это физическая величина, равная отношению массы молекулы (формульной единицы) вещества к 1/12 части массы атома углерода.
- Эта величина равна сумме относительных атомных масс химических элементов, входящих в состав молекулы (формульной единицы) данного вещества, с учетом числа атомов каждого элемента.
Надеюсь урок 7 «Относительная молекулярная и относительная формульная массы» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
найди число атомов каждого элемента в молекуле оксида углерода, если массовая доля углерода в нём равна (42,86) %, а массовая доля кислорода — (57,14) %.
1. Примем массу оксида равной (100) г. Масса углерода в такой порции равна (42,86) г, а масса кислорода — (57,14) г.
2. Находим относительные атомные массы элементов в Периодической таблице:
3. Обозначаем число атомов углерода как (x), а число атомов кислорода — (y), и записываем отношение масс:
.
4. Получаем выражение:
5. Находим отношение (x : y):
.
В молекуле оксида углерода на (1) атом углерода приходится (1) атом кислорода.