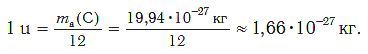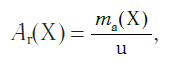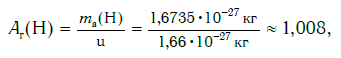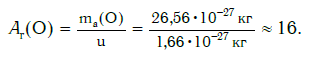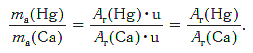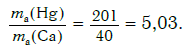← Молярная и молекулярная масса
- Относительная молекулярная масса K: 39.0983
- Молярная масса K: 39.0983 г/моль (0.0391 кг/моль)
| Элемент | Всего атомов | Атомная масса, а.е.м. | Общая масса атомов, а.е.м. |
|---|---|---|---|
| K (калий) | 1 | 39.0983 | 39.0983 |
| 39.0983 |
Расчёт молярной и относительной молекулярной массы K
- Mr[K] = Ar[K] = 39.0983 = 39.0983
- Молярная масса (в кг/моль) = Mr[K] : 1000 = 39.0983 : 1000 = 0.0391 кг/моль
Электронная конфигурация атома калия
Калькулятор массы
Химическая формула соединения
Рассчитать
Поделитесь информацией с друзьями
Скачать перечень калькуляторов
Относительные молекулярные массы других соединений
C3H5N3O9 [227.0865]
C2Ca [64.0994]
Калькулятор молекулярной массы

В уроке 2 «Относительная атомная масса химических элементов» из курса «Химия для чайников» рассмотрим разные способы выражения массы химических элементов. Напоминаю, что в прошлом уроке «Атомы и химические элементы» мы рассмотрели, кто и когда высказал идею о том, что все вокруг состоит из атомов; также выяснили, что из себя представляет химический элемент и каким образом обозначается.
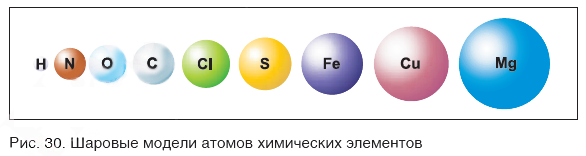
Чем различаются атомы разных элементов между собой? Вы уже знаете: массой, размерами и строением. На рисунке 30 показаны шаровые модели атомов некоторых химических элементов, конечно, не в реальных размерах, а многократно увеличенные. В действительности атомы настолько малы, что их невозможно рассмотреть даже в самые лучшие оптические микроскопы.
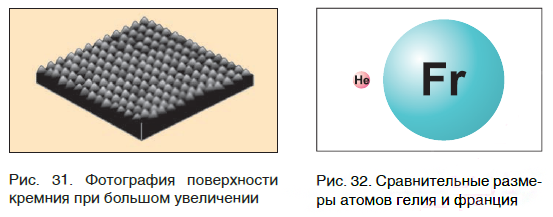
На заметку: В конце XX в. у ученых появились более совершенные микроскопы, позволяющие достигать увеличения в несколько десятков миллионов раз. Они называются туннельными микроскопами. На рисунке 31 показана фотография поверхности кремния. На ней отчетливо видны отдельные атомы, расположенные на поверхности этого вещества.
Размеры и масса атомов
Современная наука обладает методами, позволяющими определять размеры и массы атомов. Так, например, самый легкий атом — атом водорода. Его масса равна 0,0000000000000000000000000016735 кг. Самым маленьким является атом гелия He. Диаметр этого атома равен приблизительно 0,00000000098 м. Записывать и читать такие числа затруднительно, поэтому обычно их представляют в более удобном виде: 1,6735·10−27 кг и 9,8·10−10 м. Атомы большинства химических элементов по своим размерам значительно больше атома гелия. Самый большой из них — атом элемента франция Fr. Его диаметр в 7 раз больше диаметра атома гелия (рис. 32).
Еще больше различаются атомы разных элементов по массе. Масса атома обозначается символом ma и выражается в единицах массы СИ (кг). Так, например, масса атома углерода равна: ma(С) = 19,94·10−27 кг, а атома кислорода — ma(О) = 26,56·10−27 кг. Масса атома самого тяжелого из существующих на Земле элементов — урана U — почти в 237 раз больше массы атома водорода.
Атомная единица массы
Пользоваться такими маленькими величинами масс атомов при расчетах неудобно. К тому же, когда в XIX в. начало формироваться атомно- молекулярное учение, ученые еще не представляли реальных размеров и масс атомов. Поэтому на практике вместо истинных масс атомов стали применять их относительные значения. Они рассчитывались по массовым отношениям простых веществ в реакциях друг с другом. Химики предположили, что эти отношения пропорциональны массам соответствующих атомов. Именно так в начале XIX в. Дж. Дальтон ввел понятие относительной атомной массы, приняв за единицу сравнения массу самого легкого атома — водорода.
В настоящее время в качестве такой единицы сравнения используется 1/12 часть массы атома углерода (рис. 33). Она получила название атомной единицы массы (а. е. м.). Ее международное обозначение — u (от английского слова «unit» — единица):
Атомная единица массы — это 1/12 часть массы атома углерода, которая равна 1,66·10−27 кг.
Относительная атомная масса
Сравнивая средние массы атомов различных элементов с атомной единицей массы, получают значения относительных атомных масс химических элементов.
Относительная атомная масса элемента — это физическая величина, которая показывает, во сколько раз масса атома данного химического элемента больше 1/12 части массы атома углерода.
Относительная атомная масса обозначается символами Ar (А — первая буква английского слова «atomic» —атомный, r — первая буква английского слова «relative», что значит относительный), следовательно:
где Х — символ данного элемента.
Например, относительная атомная масса водорода:
а кислорода:
Как видите, относительная атомная масса показывает, во сколько раз масса атома данного элемента больше атомной единицы массы u.
В таблице Менделеева приведены относительные атомные массы всех элементов. В расчетах при решении задач мы будем пользоваться округленными до целых значениями этих величин (см. урок 1).
Внимание! Очень часто относительную атомную массу называют просто атомной массой. Однако следует отличать атомную массу — величину относительную (например, Ar(О) = 16) — от массы атома — величины, выражаемой в единицах массы — килограммах (ma(O) = 26,56·10−27 кг) или атомных единицах массы (ma(O) = 16·u).
Пример. Во сколько раз атом ртути тяжелее атома кальция?
Решение. Относительные атомные массы элементов равны: Ar(Hg) = 201 и Ar(Ca) = 40.
Масса атома ртути равна: ma(Hg) = Ar(Hg)·u (кг).
Масса атома кальция равна: ma(Са) = Ar(Са)·u (кг).
Другими словами, отношение масс атомов этих элементов равно отношению их относительных атомных масс. Следовательно, отношение масс атомов ртути и кальция равно:
Ответ: в 5,03 раза.
Краткие выводы урока:
- Атомная единица массы представляет собой 1/12 часть массы атома углерода.
- Относительная атомная масса химического элемента равна отношению массы его атома к 1/12 части массы атома углерода.
- Относительная атомная масса химического элемента является величиной безразмерной и показывает, во сколько раз масса атома данного элемента больше атомной единицы массы.
Надеюсь урок 2 «Относительная атомная масса химических элементов» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Калий и его характеристики
Общая характеристика калия
Калий не встречается в природе в свободном состоянии. Наиболее важными минералами калия являются: сильвин KCl, сильвинит NaCl×KCl, карналлит KCl×MgCl2×6H2O, каинит KCl×MgSO4×3H2O.
В виде простого вещества калий представляет собой блестящий серебристо-серый металл (рис. 1) с объемно-центрированной кристаллической решеткой. Исключительно реакционноспособный металл: на воздухе быстро окисляется, образуя рыхлые продукты взаимодействия.
Рис. 1. Калий. Внешний вид.
Атомная и молекулярная масса калия
Относительной молекулярная масса вещества (Mr) – это число, показывающее, во сколько раз масса данной молекулы больше 1/12 массы атома углерода, а относительная атомная масса элемента (Ar) — во сколько раз средняя масса атомов химического элемента больше 1/12 массы атома углерода.
Поскольку в свободном состоянии калий существует в виде одноатомных молекул K, значения его атомной и молекулярной масс совпадают. Они равны 39,0983.
Изотопы калия
Известно, что в природе калий может находиться в виде двух стабильных изотопов 39Kи 41K. Их массовые числа равны 39 и 41 соответственно. Ядро атома изотопа калия 39K содержит девятнадцать протонов и двадцать нейтронов, а изотопа 41K – такое же количество протонов идвадцать два нейтрона.
Существуют искусственные изотопы калия с массовыми числами от 32-х до 55-ти, среди которых наиболее стабильным является 40K с периодом полураспада равным 1,248×109 лет.
Ионы калия
На внешнем энергетическом уровне атома калия имеется один электрон, который является валентным:
1s22s22p63s23p64s1.
В результате химического взаимодействия калий отдает свой единственный валентный электрон, т.е. является его донором, и превращается в положительно заряженный ион:
К0-1e → Л+.
Молекула и атом калия
В свободном состоянии калий существует в виде одноатомных молекул Л. Приведем некоторые свойства, характеризующие атом и молекулу калия:
|
Энергия ионизации атома, эВ |
4,34 |
|
Относительная электроотрицательность |
0,82 |
|
Радиус атома, нм |
0,235 |
Примеры решения задач
| Калий | |
|---|---|
| Серебристо-белый мягкий металл | |

Элементарный калий |
|
| Название, символ, номер | Калий / Kalium (K), 19 |
| Атомная масса (молярная масса) |
39,0983(1) а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 4s1 |
| Радиус атома | 235 пм |
| Ковалентный радиус | 203 пм |
| Радиус иона | 133 пм |
| Электроотрицательность | 0,82 (шкала Полинга) |
| Электродный потенциал | −2,92 В |
| Степени окисления | 0; +1 |
| Энергия ионизации (первый электрон) |
418,5 (4,34) кДж/моль (эВ) |
| Плотность (при н. у.) | 0,856 г/см³ |
| Температура плавления | 336,8 К; +63,65 °C |
| Температура кипения | 1047 К; 773,85 °C |
| Уд. теплота плавления | 2,33 кДж/моль |
| Уд. теплота испарения | 76,9 кДж/моль |
| Молярная теплоёмкость | 29,6 Дж/(K·моль) |
| Молярный объём | 45,3 см³/моль |
| Структура решётки | кубическая объёмно-центрированная |
| Параметры решётки | 5,332 Å |
| Температура Дебая | 100 K |
| Теплопроводность | (300 K) 79,0 Вт/(м·К) |
| Номер CAS | 7440-09-7 |
Калий — элемент первой группы (по старой классификации — главной подгруппы первой группы), четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 19. Обозначается символом K (лат. Kalium). Простое вещество калий — мягкий щелочной металл серебристо-белого цвета.
В природе калий встречается только в соединениях с другими элементами, например, в морской воде, а также во многих минералах.
Очень быстро окисляется на воздухе и очень легко вступает в химические реакции, особенно с водой, образуя щёлочь.
Во многих свойствах калий очень близок натрию, но с точки зрения биологической функции и использования клетками живых организмов они антагонистичны.
Содержание
- 1 История и происхождение названия
- 2 Нахождение в природе
- 2.1 Месторождения
- 3 Получение
- 4 Физические свойства
- 5 Химические свойства
- 5.1 Взаимодействие с простыми веществами
- 5.2 Взаимодействие со сложными веществами
- 5.3 Соединения с кислородом
- 5.4 Гидроксид
- 6 Применение
- 6.1 Важные соединения
- 7 Биологическая роль
- 7.1 Калий в организме человека
- 8 Изотопы
История и происхождение названия
Соединения калия используются с древнейших времён. Так, производство поташа (который применялся как моющее средство) существовало уже в XI веке. Золу, образующуюся при сжигании соломы или древесины, обрабатывали водой, а полученный раствор (щёлок) после фильтрования выпаривали. Сухой остаток, помимо карбоната калия K2CO3, содержал сульфат калия K2SO4, соду и хлорид калия KCl.
19 ноября 1807 года в Бейкеровской лекции английский химик Дэви сообщил о выделении калия электролизом расплава едкого кали (KOH)(в рукописи лекции Дэви указал, что он открыл калий 6 октября 1807 года). Дэви назвал его «потасий» (лат. potasium; это название (правда, в некоторых языках с двумя буквами s) до сих пор употребительно в английском, французском, испанском, португальском и польском языках. При электролизе влажного едкого кали KOH на ртутном катоде он получил амальгаму калия, а после отгонки ртути — чистый металл. Дэви определил его плотность, изучил химические свойства, в том числе разложение воды и поглощение водорода.
В 1808 году французские химики Гей-Люссак и Л. Тенар выделили калий химическим путём — прокаливанием KOH с углём.
В 1809 году немецкий физик Л. В. Гильберт предложил название «калий» (лат. kalium, от араб. аль-кали — поташ). Это название вошло в немецкий язык, оттуда в большинство языков Северной и Восточной Европы (в том числе русский) и «победило» при выборе символа для этого элемента — K.
Нахождение в природе
Ввиду высокой химической активности калий в свободном состоянии в природе не встречается. Породообразующий элемент, входит в состав слюд, полевых шпатов и т. д. Также калий входит в состав минералов сильвина KCl, сильвинита KCl·NaCl, карналлита KCl·MgCl2·6H2O, каинита KCl·MgSO4·6H2O, а также присутствует в золе некоторых растений в виде карбоната K2CO3 (поташ). Калий входит в состав всех клеток (см. ниже раздел Биологическая роль). Кларк калия в земной коре составляет 2,4 % (5-й по распространённости металл, 7-й по содержанию в коре элемент). Средняя концентрация в морской воде — 380 мг/л.
Месторождения
Крупнейшие месторождения калия находятся на территории Канады (производитель PotashCorp), России (ПАО «Уралкалий», г. Березники, г. Соликамск, Пермский край, Верхнекамское месторождение калийных руд), Белоруссии (ПО «Беларуськалий», г. Солигорск, Старобинское месторождение калийных руд).
Получение
Калий, как и другие щелочные металлы, получают электролизом расплавленных хлоридов или щелочей. Так как хлориды имеют более высокую температуру плавления (600—650 °C), то чаще проводят электролиз расплавленных щелочей с добавкой к ним соды или поташа (до 12 %). При электролизе расплавленных хлоридов на катоде выделяется расплавленный калий, а на аноде — хлор:
-
- K+ + e− → K
- 2Cl− → Cl2
При электролизе гидроксида калия на катоде также выделяется расплавленный калий, а на аноде — кислород:
-
- 4OH− → 2H2O + O2
Вода из расплава быстро испаряется. Чтобы калий не взаимодействовал с хлором или кислородом, катод изготовляют из меди и над ним помещают медный цилиндр. Образовавшийся калий в расплавленном виде собирается в цилиндре. Анод изготовляют также в виде цилиндра из никеля (при электролизе щелочей) либо из графита (при электролизе хлоридов).
Важное промышленное значение имеют и методы термохимического восстановления:
-
- Na + KOH →N2,380−450oC NaOH + K
и восстановление из расплава хлорида калия карбидом кальция, алюминием или кремнием.
Физические свойства
Калий — серебристый металл с характерным блеском на свежеобразованной поверхности. Очень лёгок и легкоплавок. Относительно хорошо растворяется в ртути, образуя амальгамы. Будучи внесённым в пламя горелки, калий (а также его соединения) окрашивает пламя в характерный розово-фиолетовый цвет.
Калий активно взаимодействует с водой. Выделяющийся водород воспламеняется, а ионы калия придают пламени фиолетовый цвет. Раствор фенолфталеина в воде становится малиновым, демонстрируя щелочную реакцию образующегося KOH
Калий образует кристаллы кубической сингонии, пространственная группа I m3m, параметры ячейки a = 0,5247 нм, Z = 2.
Химические свойства
Элементарный калий, как и другие щелочные металлы, проявляет типичные металлические свойства и очень химически активен, является сильным восстановителем. На воздухе свежий срез быстро тускнеет из-за образования плёнок соединений (оксиды и карбонат). При длительном контакте с атмосферой способен полностью разрушиться. С водой реагирует со взрывом. Хранить его необходимо под слоем бензина, керосина или силикона, дабы исключить контакт воздуха и воды с его поверхностью. С Na, Tl, Sn, Pb, Bi калий образует интерметаллиды.
Взаимодействие с простыми веществами
Калий при комнатной температуре реагирует с кислородом воздуха, галогенами; практически не реагирует с азотом (в отличие от лития и натрия). При умеренном нагревании реагирует с водородом с образованием гидрида (200—350 °C):
-
- 2K + H2 ⟶ 2KH
с халькогенами (100—200 °C, E = S, Se, Te):
-
- 2K + E ⟶ K2E
При сгорании калия на воздухе образуется надпероксид калия KO2 (с примесью K2O2):
-
- K + O2 ⟶ KO2
В реакции с фосфором в инертной атмосфере образуется фосфид калия зелёного цвета (200 °C):
-
- 3K + P ⟶ K3P
Взаимодействие со сложными веществами
Калий при комнатной температуре (+20 °C) активно реагирует с водой, кислотами, растворяется в жидком аммиаке (−50 °C) с образованием тёмно-синего раствора аммиаката калия.
-
- 2K + 2H2O ⟶ 2KOH + H2↑
-
- 2K + 2HCl ⟶ 2KCl + H2↑
-
- K + 6NH3 ⟶ [K(NH3)]6
Калий глубоко восстанавливает разбавленные серную и азотную кислоты:
-
- 8K + 6H2SO4 ⟶ 4K2SO4 + SO2↑ + S↓ + 6H2O
-
- 21K + 26HNO3 ⟶ 21KNO3 + NO↑ + N2O↑ + N2↑ + 13H2O
При сплавлении металлического калия со щелочами он восстанавливает водород гидроксогруппы:
-
- 2K + 2KOH ⟶ 2K2O + H2↑ (450∘C)
При умеренном нагревании реагирует с газообразным аммиаком с образованием амида (+65…+105 °C):
-
- 2K + 2NH3 ⟶ 2KNH2 + H2
Металлический калий реагирует со спиртами с образованием алкоголятов:
-
- 2K + 2C2H5OH ⟶ 2C2H5OK + H2↑
Алкоголяты щелочных металлов (в данном случае — этилат калия) широко используются в органическом синтезе.
Соединения с кислородом
При взаимодействии калия с кислородом воздуха образуется не оксид, а пероксид и супероксид:
-
- 2K + O2 ⟶ K2O2
- K + O2 ⟶ KO2
Оксид калия может быть получен при нагревании металла до температуры не выше 180 °C в среде, содержащей очень мало кислорода, или при нагревании смеси супероксида калия с металлическим калием:
-
- 4K + O2 ⟶ 2K2O
- KO2 + 3K ⟶ 2K2O
Оксиды калия обладают ярко выраженными осно́вными свойствами, бурно реагируют с водой, кислотами и кислотными оксидами. Практического значения они не имеют. Пероксиды представляют собой желтовато-белые порошки, которые, хорошо растворяясь в воде, образуют щёлочи и пероксид водорода:
-
- K2O2 + 2H2O ⟶ 2KOH + H2O2
-
- 4KO2 + 2H2O ⟶ 4KOH + 3O2↑
-
- 4KO2 + 2CO2 ⟶ 2K2CO3 + 3O2↑
Советский изолирующий противогаз ИП-5
Свойство обменивать углекислый газ на кислород используется в изолирующих противогазах и на подводных лодках. В качестве поглотителя используют эквимолярную смесь супероксида калия и пероксида натрия. Если смесь не эквимолярна, то в случае избытка пероксида натрия поглотится больше газа, чем выделится (при поглощении двух объёмов CO2 выделяется один объём O2), и давление в замкнутом пространстве упадёт, а в случае избытка супероксида калия (при поглощении двух объёмов CO2 выделяется три объёма O2) выделяется больше газа, чем поглотится, и давление повысится.
В случае эквимолярной смеси (Na2O2:K2O4 = 1:1) объёмы поглощаемого и выделяемого газов будут равны (при поглощении четырёх объёмов CO2 выделяется четыре объёма O2).
Пероксиды являются сильными окислителями, поэтому их применяют для отбеливания тканей в текстильной промышленности.
Получают пероксиды прокаливанием металлов на воздухе, освобождённом от углекислого газа.
Также известен озонид калия KO3, оранжево-красного цвета. Получить его можно взаимодействием гидроксида калия с озоном при температуре не выше +20 °C:
-
- 4KOH + 4O3 ⟶ 4KO3 + O2 + 2H2O
Озонид калия является очень сильным окислителем, например, окисляет элементарную серу до сульфата и дисульфата уже при +50 °C:
-
- 6KO3 + 5S ⟶ K2SO4 + 2K2S2O7
Гидроксид
Основная статья: Гидроксид калия
Гидроксид калия (или едкое кали) представляет собой твёрдые белые непрозрачные, очень гигроскопичные кристаллы, плавящиеся при температуре 360 °C. Гидроксид калия относится к щелочам. Он хорошо растворяется в воде с выделением большого количества тепла. Растворимость едкого кали при +20 °C в 100 г воды составляет 112 г.
Применение
- Жидкий при комнатной температуре сплав калия и натрия используется в качестве теплоносителя в замкнутых системах, например, в атомных силовых установках на быстрых нейтронах. Кроме того, широко применяются его жидкие сплавы с рубидием и цезием. Сплав с составом 12 % натрия, 47 % калия, 41 % цезия обладает рекордно низкой температурой плавления −78 °C.
- Соединения калия — важнейший биогенный элемент и потому применяются в качестве удобрений. Калий является одним из трёх базовых элементов, которые необходимы для роста растений наряду с азотом и фосфором. В отличие от азота и фосфора, калий является основным клеточным катионом. При его недостатке у растения прежде всего нарушается структура мембран хлоропластов — клеточных органелл, в которых проходит фотосинтез. Внешне это проявляется в пожелтении и последующем отмирании листьев. При внесении калийных удобрений у растений увеличивается вегетативная масса, урожайность и устойчивость к вредителям.
- Соли калия широко используются в гальванотехнике, так как, несмотря на относительно высокую стоимость, они часто более растворимы, чем соответствующие соли натрия, и потому обеспечивают интенсивную работу электролитов при повышенной плотности тока.
Важные соединения
- Бромид калия применяется в медицине и как успокаивающее средство для нервной системы.
- Гидроксид калия (едкое кали) применяется в щелочных аккумуляторах и при сушке газов.
- Карбонат калия (поташ) используется как удобрение, при варке стекла, как кормовая добавка для птицы.
- Хлорид калия (сильвин, «калийная соль») используется как удобрение.
- Нитрат калия (калийная селитра) — удобрение, компонент чёрного пороха.
- Перхлорат и хлорат калия (бертолетова соль) используются в производстве спичек, ракетных порохов, осветительных зарядов, взрывчатых веществ, в гальванотехнике.
- Дихромат калия (хромпик) — сильный окислитель, используется для приготовления «хромовой смеси» для мытья химической посуды и при обработке кожи (дубление). Также используется для очистки ацетилена на ацетиленовых заводах от аммиака, сероводорода и фосфина.
Кристаллы перманганата калия
- Перманганат калия — сильный окислитель, используется как антисептическое средство в медицине и для лабораторного получения кислорода.
- Тартрат натрия-калия (сегнетова соль) в качестве пьезоэлектрика.
- Дигидрофосфат и дидейтерофосфат калия в виде монокристаллов в лазерной технике.
- Пероксид калия и супероксид калия используются для регенерации воздуха на подводных лодках и в изолирующих противогазах (поглощает углекислый газ с выделением кислорода).
- Фтороборат калия — важный флюс для пайки сталей и цветных металлов.
- Цианид калия применяется в гальванотехнике (серебрение, золочение), при добыче золота и при нитроцементации стали. Чрезвычайно ядовит, один из сильнейших ядов.
- Калий совместно с перекисью калия применяется при термохимическом разложении воды на водород и кислород (калиевый цикл «Газ де Франс», Франция).
- Сульфат калия применяется как удобрение.
Биологическая роль
Калий — важнейший биогенный элемент, особенно в растительном мире. При недостатке калия в почве растения развиваются очень плохо, уменьшается урожай, поэтому около 90 % добываемых солей калия используют в качестве удобрений.
Калий в качестве катиона наряду с катионами натрия является базовым элементом так называемого калиево-натриевого насоса клеточной мембраны, который играет важную роль в проведении нервных импульсов.
Калий в организме человека
Калий содержится большей частью в клетках, до 40 раз больше, чем в межклеточном пространстве. В процессе функционирования клеток избыточный калий покидает цитоплазму, поэтому для сохранения концентрации он должен нагнетаться обратно при помощи натрий-калиевого насоса. Калий и натрий между собой функционально связаны и выполняют следующие функции:
- Создание условий для возникновения мембранного потенциала и мышечных сокращений.
- Поддержание осмотической концентрации крови.
- Поддержание кислотно-щелочного баланса.
- Нормализация водного баланса.
Рекомендуемая суточная доля калия составляет для детей от 600 до 1700 миллиграммов, для взрослых — от 1800 до 5000 миллиграммов. Потребность в калии зависит от массы тела, физической активности, физиологического состояния и климата места проживания. Рвота, продолжительные поносы, обильное потение, использование мочегонных повышают потребность организма в калии.
Основными пищевыми источниками являются бобы (в первую очередь белая фасоль), шпинат и капуста кормовая, финики, картофель, батат, сушёные абрикосы, дыня, киви, авокадо, помело, бананы, брокколи, печень, молоко, ореховое масло, цитрусовые, виноград. Калия достаточно много в рыбе и молочных продуктах.
Практически все сорта рыбы содержат более 200 мг калия на 100 г. Количество калия в разных видах рыбы различается.
Овощи, грибы и травы также содержат много калия, однако в консервированных продуктах его уровень может быть гораздо меньше. Много калия содержится в шоколаде.
Всасывание происходит в тонком кишечнике. Усвоение калия облегчает витамин B6, затрудняет — алкоголь.
При недостатке калия развивается гипокалиемия. Возникают нарушения работы сердечной и скелетной мускулатуры. Продолжительный дефицит калия может быть причиной острой невралгии.
При избытке калия развивается гиперкалиемия, для которой основным симптомом является язва тонкого кишечника. Настоящая гиперкалиемия может вызвать остановку сердца.
Изотопы
Основная статья: Изотопы калия
Природный калий состоит из трёх изотопов. Два из них стабильны: 39K (изотопная распространённость 93,258 %) и 41K (6,730 %). Третий изотоп 40K (0,0117 %) является бета-активным с периодом полураспада 1,251 миллиарда лет. Сравнительно малый период полураспада и большая распространённость калия по сравнению с ураном и торием означает, что на Земле ещё 2 млрд лет назад и ранее калий-40 вносил главный вклад в естественный радиационный фон. В каждом грамме природного калия в секунду распадается в среднем 31,0±0,3 ядра 40K, благодаря чему, например, в организме человека массой 70 кг ежесекундно происходит около 4000 радиоактивных распадов. Поэтому легкодоступные в быту соединения калия (поташ, хлорид калия, калийная селитра и т. д.) можно использовать как пробные радиоактивные источники для проверки бытовых дозиметров. 40K наряду с ураном и торием считается одним из основных источников геотермальной энергии, выделяемой в недрах Земли (полная скорость энерговыделения оценивается в 40—44 ТВт). В минералах, содержащих калий, постепенно накапливается 40Ar, один из продуктов распада калия-40, что позволяет измерять возраст горных пород; калий-аргоновый метод является одним из основных методов ядерной геохронологии.
Один из искусственных изотопов — 37K, — с временем полураспада 1,23651 секунды, применяется в экспериментах по изучению Стандартной модели слабого взаимодействия.
|
Периодическая система химических элементов Д. И. Менделеева |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
Электрохимический ряд активности металлов |
|---|
|
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu, |
|
Щелочные металлы |
||||||
|---|---|---|---|---|---|---|
|
Таблица атомных масс химических элементов.
Атомная единица массы она же дальтон (русское обозначение – Да, международное – Da), она же углеродная единица – внесистемная единица массы, применяемая для масс молекул, атомов, атомных ядер и элементарных частиц.
Атомная единица массы имеет русское обозначение – а.е.м. и международное обозначение – u.
Атомная единица массы определяется как 1⁄12 массы свободного покоящегося атома углерода 12C, находящегося в основном состоянии.
Атомная единица массы не является единицей Международной системы единиц (СИ), но Международный комитет мер и весов относит её к единицам, допустимым к применению наравне с единицами СИ.
В Российской Федерации в соответствии с Постановлением Правительства РФ от 31 октября 2009 г. N 879 “Об утверждении Положения о единицах величин, допускаемых к применению в Российской Федерации” атомная единица массы допущена для использования в качестве внесистемной единицы без ограничения срока действия допуска с областью применения «атомная физика».
Молярная масса химического элемента или иного вещества, выраженная в граммах на моль, численно равна атомной массе этого химического элемента (или этого вещества).
Таблица атомных масс химических элементов (1 часть):
| Атомный номер | Химический элемент | Символ | Атомная масса |
| 1 | Водород | H | 1,00784-1,00811 а.е.м. (г/моль) |
| 2 | Гелий | He | 4,002602(2) а.е.м. (г/моль) |
| 3 | Литий | Li | 6,938-6,997 а.е.м. (г/моль) |
| 4 | Бериллий | Be | 9,012182(3) а.е.м. (г/моль) |
| 5 | Бор | B | 10,806-10,821 а.е.м. (г/моль) |
| 6 | Углерод | C | 12,0096-12,0116 а.е.м. (г/моль) |
| 7 | Азот | N | 14,00643-14,00728 а.е.м. (г/моль) |
| 8 | Кислород | O | 15,99903-15,99977 а.е.м. (г/моль) |
| 9 | Фтор | F | 18,998403163(6) а.е.м. (г/моль) |
| 10 | Неон | Ne | 20,1797(6) а.е.м. (г/моль) |
| 11 | Натрий | Na | 22,98976928(2) а.е.м. (г/моль) |
| 12 | Магний | Mg | 24,304-24,307 а.е.м. (г/моль) |
| 13 | Алюминий | Al | 26,9815386(8) а.е.м. (г/моль) |
| 14 | Кремний | Si | 28,084-28,086 а.е.м. (г/моль) |
| 15 | Фосфор | P | 30,973762(2) а.е.м. (г/моль) |
| 16 | Сера | S | 32,059-32,076 а.е.м. (г/моль) |
| 17 | Хлор | Cl | 35,446-35,457 а.е.м. (г/моль) |
| 18 | Аргон | Ar | 39,948(1) а.е.м. (г/моль) |
| 19 | Калий | K | 39,0983(1) а.е.м. (г/моль) |
| 20 | Кальций | Ca | 40,078(4) а.е.м. (г/моль) |
| 21 | Скандий | Sc | 44,955912(6) а.е.м. (г/моль) |
| 22 | Титан | Ti | 47,867(1) а.е.м. (г/моль) |
| 23 | Ванадий | V | 50,9415(1) а.е.м. (г/моль) |
| 24 | Хром | Cr | 51,9961(6) а.е.м. (г/моль) |
| 25 | Марганец | Mn | 54,938045(5) а.е.м. (г/моль) |
| 26 | Железо | Fe | 55,845(2) а.е.м. (г/моль) |
| 27 | Кобальт | Co | 58,933194(4) а.е.м. (г/моль) |
| 28 | Никель | Ni | 58,6934(4) а.е.м. (г/моль) |
| 29 | Медь | Cu | 63,546(3) а.е.м. (г/моль) |
| 30 | Цинк | Zn | 65,38(2) а.е.м. (г/моль) |
Таблица атомных масс химических элементов (2 часть):
| 31 | Галлий | Ga | 69,723(1) а.е.м. (г/моль) |
| 32 | Германий | Ge | 72,630(8) а.е.м. (г/моль) |
| 33 | Мышьяк | As | 74,92160(2) а.е.м. (г/моль) |
| 34 | Селен | Se | 78,971(8) а.е.м. (г/моль) |
| 35 | Бром | Br | 79,901-79,907 а.е.м. (г/моль) |
| 36 | Криптон | Kr | 83,798(2) а.е.м. (г/моль) |
| 37 | Рубидий | Rb | 85,4678(3) а.е.м. (г/моль) |
| 38 | Стронций | Sr | 87,62(1) а.е.м. (г/моль) |
| 39 | Иттрий | Y | 88,90585(2) а.е.м. (г/моль) |
| 40 | Цирконий | Zr | 91,224(2) а.е.м. (г/моль) |
| 41 | Ниобий | Nb | 92,90638(2) а.е.м. (г/моль) |
| 42 | Молибден | Mo | 95,95(1) а.е.м. (г/моль) |
| 43 | Технеций | Tc | 97,9072 а.е.м. (г/моль) |
| 44 | Рутений | Ru | 101,07(2) а.е.м. (г/моль) |
| 45 | Родий | Rh | 102,90550(2) а.е.м. (г/моль) |
| 46 | Палладий | Pd | 106,42(1) а.е.м. (г/моль) |
| 47 | Серебро | Ag | 107,8682(2) а.е.м. (г/моль) |
| 48 | Кадмий | Cd | 112,411(8) а.е.м. (г/моль) |
| 49 | Индий | In | 114,818(1) а.е.м. (г/моль) |
| 50 | Олово | Sn | 118,710(7) а.е.м. (г/моль) |
| 51 | Сурьма | Sb | 121,760(1) а.е.м. (г/моль) |
| 52 | Теллур | Te | 127,60(3) а.е.м. (г/моль) |
| 53 | Йод | I | 126,90447(3) а.е.м. (г/моль) |
| 54 | Ксенон | Xe | 131,293(6) а.е.м. (г/моль) |
| 55 | Цезий | Cs | 132,9054519(2) а.е.м. (г/моль) |
| 56 | Барий | Ba | 137,327(7) а.е.м. (г/моль) |
| 57 | Лантан | La | 138,90547(7) а.е.м. (г/моль) |
| 58 | Церий | Ce | 140,116(1) а.е.м. (г/моль) |
| 59 | Празеодим | Pr | 140,90765(2) а.е.м. (г/моль) |
| 60 | Неодим | Nd | 144,242(3) а.е.м. (г/моль) |
Таблица атомных масс химических элементов (3 часть):
| 61 | Прометий | Pm | 144,9127 а.е.м. (г/моль) |
| 62 | Самарий | Sm | 150,36(2) а.е.м. (г/моль) |
| 63 | Европий | Eu | 151,964(1) а.е.м. (г/моль) |
| 64 | Гадолиний | Gd | 157,25(3) а.е.м. (г/моль) |
| 65 | Тербий | Tb | 158,92535(2) а.е.м. (г/моль) |
| 66 | Диспрозий | Dy | 162,500(1) а.е.м. (г/моль) |
| 67 | Гольмий | Ho | 164,93032(2) а.е.м. (г/моль) |
| 68 | Эрбий | Er | 167,259(3) а.е.м. (г/моль) |
| 69 | Тулий | Tm | 168,93421(2) а.е.м. (г/моль) |
| 70 | Иттербий | Yb | 173,045(10) а.е.м. (г/моль) |
| 71 | Лютеций | Lu | 174,9668(1) а.е.м. (г/моль) |
| 72 | Гафний | Hf | 178,49(2) а.е.м. (г/моль) |
| 73 | Тантал | Ta | 180,94788(2) а.е.м. (г/моль) |
| 74 | Вольфрам | W | 183,84(1) а.е.м. (г/моль) |
| 75 | Рений | Re | 186,207(1) а.е.м. (г/моль) |
| 76 | Осмий | Os | 190,23(3) а.е.м. (г/моль) |
| 77 | Иридий | Ir | 192,217(3) а.е.м. (г/моль) |
| 78 | Платина | Pt | 195,084(9) а.е.м. (г/моль) |
| 79 | Золото | Au | 196,966569(4) а.е.м. (г/моль) |
| 80 | Ртуть | Hg | 200,592(3) а.е.м. (г/моль) |
| 81 | Таллий | Tl | 204,382-204,385 а.е.м. (г/моль) |
| 82 | Свинец | Pb | 207,2(1) а.е.м. (г/моль) |
| 83 | Висмут | Bi | 208,98040(1) а.е.м. (г/моль) |
| 84 | Полоний | Po | 208,9824 а.е.м. (г/моль) |
| 85 | Астат | At | 209,9871 а.е.м. (г/моль) |
| 86 | Радон | Rn | 222,0176 а.е.м. (г/моль) |
| 87 | Франций | Fr | 223,0197 а.е.м. (г/моль) |
| 88 | Радий | Ra | 226,0254 а.е.м. (г/моль) |
| 89 | Актиний | Ac | 227,0278 а.е.м. (г/моль) |
| 90 | Торий | Th | 232,03806(2) а.е.м. (г/моль) |
Таблица атомных масс химических элементов (4 часть):
| 91 | Протактиний | Pa | 231,03588(2) а.е.м. (г/моль) |
| 92 | Уран | U | 238,02891(3) а.е.м. (г/моль) |
| 93 | Нептуний | Np | 237,0482 а.е.м. (г/моль) |
| 94 | Плутоний | Pu | 244,0642 а.е.м. (г/моль) |
| 95 | Америций | Am | 243,061375 а.е.м. (г/моль) |
| 96 | Кюрий | Cm | 247,0703 а.е.м. (г/моль) |
| 97 | Берклий | Bk | 247,0703 а.е.м. (г/моль) |
| 98 | Калифорний | Cf | 251,0796 а.е.м. (г/моль) |
| 99 | Эйнштейний | Es | 252,083 а.е.м. (г/моль) |
| 100 | Фермий | Fm | 257,0951 а.е.м. (г/моль) |
| 101 | Менделевий | Md | 258,1 а.е.м. (г/моль) |
| 102 | Нобелий | No | 259,1009 а.е.м. (г/моль) |
| 103 | Лоуренсий | Lr | 266 а.е.м. (г/моль) |
| 104 | Резерфордий (Курчатовий) | Rf | 267 а.е.м. (г/моль) |
| 105 | Дубний (Нильсборий) | Db | 268 а.е.м. (г/моль) |
| 106 | Сиборгий | Sg | 269 а.е.м. (г/моль) |
| 107 | Борий | Bh | 270 а.е.м. (г/моль) |
| 108 | Хассий | Hs | 269 а. е. м. (г/моль) |
| 109 | Мейтнерий | Mt | 278 а. е. м. (г/моль) |
| 110 | Дармштадтий | Ds | 281 а. е. м. (г/моль) |
Коэффициент востребованности
6 770