Как определить радиус атома
Под радиусом атома понимается расстояние между ядром данного атома и его самой дальней электронной орбитой. На сегодняшний день общепринятой единицей измерения атомного радиуса является пикометр(пм). Определить радиус атома очень легко.

Вам понадобится
- Периодическая таблица Менделеева
Инструкция
Первым делом, под рукой должна иметься обычная таблица Менделеева, в которой по порядку расставлены все известные человечеству химические элементы. Найти эту таблицу очень легко в любом справочнике по химии, школьном учебнике, либо же ее можно приобрести отдельно, в ближайшем книжном магазине.
В правом верхнем углу у каждого из химических элементов указан его порядковый номер. Этот номер полностью совпадает с атомным радиусом данного атома.
Например, порядковый номер хлора (Cl) — 17. Это означает, что расстояние от ядра атома хлора до самой дальней его орбиты движения стабильного электрона равно 17 пм. Если требуется найти не только атомный радиус, но и распределение электронов по электронным орбитам, то эти данные можно подчеркнуть из столбика цифр, расположенного справа от названия химического элемента.
Обратите внимание
Благодаря таблице Менделеева, очень легко найти не только атомный радиус, но и атомную массу, молекулярную массу, период и ряд того или иного элемента, а также и распределение электронов по электронным орбитам вместе с количеством орбит.
Наиболее популярной моделью атома является модель, принятая в 1913 году Нильсом Бором. Также она известна как планетарная модель. Связано это с тем, что электроны, подобно планетам Солнечной системы, движутся вокруг Солнца — ядра атома. Орбиты движения электронов постоянны. Разработка данной модели дала толчок к развитию нового направления в теоретической физике — квантовой механике.
Самый первый радиус орбиты движения электрона называется боровским радиусом, а энергия электронов на первой орбите называется энергией ионизации атома.
Полезный совет
Стоит отметить, что радиус любого атома обратно пропорционален количеству протонов в его ядре, а также равен заряду его ядра.
Источники:
- как изменяется радиус атома
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Вступление
Радиус атома химического элемента — это расстояние от центра ядра до внешней оболочки электрона.
Поскольку граница не является четко определенным физическим объектом, существуют различные неэквивалентные определения Радиус атома.
Четыре широко используемых определения Радиус атома: радиус Ван-дер-Ваальса, ион …
Согласно википедии…
Радиус атома химического элемента является мерой размера его атомов, обычно это среднее или типичное расстояние от центра ядра до границы окружающих оболочек электронов.
Оглавление
Я хотел бы разобрать следующие темы:
- Определение атомного радиуса
- Что означает Радиус атома
- Как найти Радиус атома в таблице Менделеева
- Тренд периодической таблицы атомного радиуса
- Как Радиус атома увеличивается
- Исключения из тренда атомного радиуса
- Единицы атомного радиуса
- Как измеряется Радиус атома
- Атомный радиус против ионного радиуса
- Атомный радиус против атомного номера
- Как предсказать Радиус атома
Определение атомного радиуса
Радиус атома — это половина расстояния между соседними атомами одного и того же элемента в молекуле.
Измерение атомных радиусов химических элементов — сложная задача, поскольку размер атома составляет порядка 1,2 × 10-10 м.
Атомный радиус определяется как расстояние между ядрами двух одинаковых атомов, связанных вместе.
Что означает Радиус атома
Размер атома.
Радиус атома определяется как половина расстояния между ядрами идентичных атомов, которые связаны вместе.
Радиус атома (r) атома можно определить как половину расстояния (d) между двумя ядрами в двухатомной молекуле.
Тренд периодической таблицы атомного радиуса
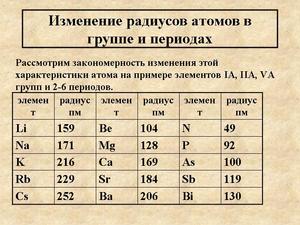
Атомный радиус уменьшается с течением времени и увеличивается по группе.
В общем, Радиус атома уменьшается за период и увеличивается вниз по группе.
С течением времени эффективный заряд ядра увеличивается, поскольку электронное экранирование остается постоянным.
Как Радиус атома увеличивается
По мере того, как вы движетесь вниз в группе.
Есть две основные тенденции Радиус атома.
Первая периодическая тенденция Радиус атома состоит в том, что атомные радиусы увеличиваются по мере того, как вы движетесь вниз в группе.
Исключения из тренда атомного радиуса
Радиус кислорода немного больше радиуса азота.
Радиус атома атомов обычно уменьшается слева направо через период.
Есть несколько небольших исключений, например, радиус кислорода немного больше радиуса азота.
В течение определенного периода протоны добавляются к ядру, поскольку электроны добавляются к одному и тому же основному энергетическому уровню.
Единицы атомного радиуса
Пикометры, равные 10-12 метров.
Радиус атома (r) атома можно определить как половину расстояния (d) между двумя ядрами в двухатомной молекуле.
Для элементов измерены атомные радиусы.
Единицы измерения атомных радиусов — пикометры, равные 10-12 метрам.
Как измеряется Радиус атома
Расстояние от ядра атома до электронных облаков вокруг ядра.
Радиус атома можно определить, только измерив расстояние между ядрами двух соприкасающихся атомов, а затем уменьшив это расстояние вдвое.
Тип измеряемого здесь Радиус атома называется металлическим радиусом или ковалентным радиусом в зависимости от соединения.
Атомный радиус против ионного радиуса
Атомный радиус составляет половину диаметра нейтрального атома.
Другими словами, это половина диаметра атома по отношению к внешним стабильным электронам.
Ионный радиус составляет половину расстояния между двумя атомами газа, которые только касаются друг друга.
Атомный радиус против атомного номера
С увеличением атомного номера Радиус атома уменьшается.
Это связано с тем, что по мере движения вниз по столбцам Радиус атома увеличивается.
Следовательно, при переходе через периоды радиус уменьшается, но при перемещении вниз по столбцам радиус увеличивается.
Как предсказать Радиус атома
Разделение расстояния между ядрами соприкасающихся атомов пополам.
Радиус атома можно определить, только измерив расстояние между ядрами двух соприкасающихся атомов, а затем уменьшив это расстояние вдвое.
Видео: Радиус атома — Основное введение -…
Сейчас я хотел бы показать похожее видео под названием «Радиус атома — Basic Introduction -…»:
Совет: включите кнопку заголовка, если она вам нужна. Выберите «автоматический перевод» в кнопке настроек, если вы не знаете английский язык.
Цитата
Если вам нужно включить факт или информацию в задание или эссе, вы также должны указать, где и как вы нашли эту информацию (Радиус атома).
Это повышает доверие к вашей статье и иногда требуется в высших учебных заведениях.
Чтобы упростить себе жизнь (и цитирование), просто скопируйте и вставьте приведенную ниже информацию в свое задание или эссе:
Luz, Gelson. Радиус атома. Материалы Блог. Gelson Luz.com. дд мм гггг. URL.
Теперь замените дд, мм и гггг на день, месяц и год, когда вы просматриваете эту страницу. Также замените URL-адрес фактическим URL-адресом этой страницы. Этот формат цитирования основан на MLA.
Чтобы разобраться в вопросе, что в современной науке называется радиусом атома, вспомним, что из себя представляет сам атом. По классическим представлениям в центре атома находится ядро, состоящее из протонов и нейтронов, а вокруг ядра каждый на своей орбите вращаются электроны.
Содержание:
- Радиус атома в физике
- Атомный радиус в химии и кристаллографии
- Какие бывают виды
- Как зависит от типа химической связи
- Видео
Радиус атома в физике
Поскольку в данной модели строения атома электроны являются пространственно ограниченными частицами, т. е. корпускулами, логично считать атомным радиусом (а. р.) расстояние от его ядра до самой дальней, или внешней, орбиты, по которой вращаются так называемые валентные электроны.
Однако по современным, квантовомеханическим представлениям, определить данный параметр нельзя так однозначно, как это делается в классической модели. Здесь электроны уже не представляются в виде частиц-корпускул, а получают свойства волн, т. е. пространственно-неограниченных объектов. В такой модели точно определить положение электрона просто невозможно. Здесь эта частица уже представляется в виде электронной орбитали, плотность которой меняется, в зависимости от расстояния до ядра атома.
Итак, в современной модели строения атома его радиус нельзя определить однозначно. Поэтому в квантовой физике, общей химии, физике твердого тела и других смежных науках эту величину сегодня определяют как радиус сферы, в центре которой находится ядро, внутри которой сосредоточено 90-98% плотности электронного облака. Фактически это расстояние и определяет границы атома.
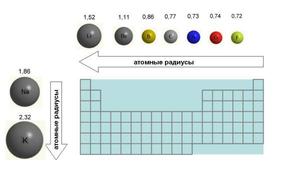
Если рассмотреть Периодическую таблицу химических элементов (таблицу Менделеева), в которой приведены атомные радиусы, можно увидеть определенные закономерности, которые выражаются в том, что в пределах периода эти числа уменьшаются слева направо, а в пределах группы они увеличиваются сверху вниз. Такие закономерности объясняются тем, что внутри периода при движении слева направо заряд атома возрастает, что увеличивает силу притяжения им электронов, а при движении внутри группы сверху вниз все больше заполняется электронных оболочек.
Атомный радиус в химии и кристаллографии
Какие бывают виды
Данная характеристика сильно варьируется, в зависимости от того, в какой химической связи состоит атом. Поскольку все вещества в природе в подавляющем своем большинстве состоят из молекул, понятие а. р. используют для определения межатомных расстояний в молекуле. А данная характеристика зависит от свойств входящих в молекулу атомов, т. е. их положения в Периодической системе химических элементов. Обладая разными физическими и химическими свойствами, молекулы образуют все огромное разнообразие веществ.
По сути, эта величина очерчивает сферу действия силы электрического притяжения ядра атома и его внешних электронных оболочек. За пределами этой сферы в действие вступает сила электрического притяжения соседнего атома. Существует несколько типов химической связи атомов в молекуле:
- ковалентная;
- ионная;
- металлическая;
- ван-дер-ваальсова.
Соответственно этим связям таким же будет и атомный радиус.
Как зависит от типа химической связи
При ковалентной связи АР определяется как половина расстояния между соседними атомами в одинарной химической связи Х—Х, причем Х — это неметалл, ибо данная связь свойственна неметаллам. Например, для галогенов ковалентный радиус будет равен половине межъядерного расстояния Х—Х в молекуле Х2, для молекул селена Se и серы S — половине расстояния Х—Х в молекуле Х8, для углерода С он будет равен половине кратчайшего расстояния С—С в кристалле алмаза.
Данная химическая связь обладает свойством аддитивности, т. е. суммирования, что позволяет определять межъядерные расстояния в многоатомных молекулах. Если связь в молекуле двойная или тройная, то ковалентный АР уменьшается, т. к. длины кратных связей меньше одинарных.
При ионной связи, образующейся в ионных кристаллах, используют значения ионного АР для определения расстояния между ближайшими анионом и катионом, находящимися в узлах кристаллической решетки. Такое расстояние определяется как сумма радиусов этих ионов.
Существует несколько способов определения ионных радиусов, при которых отличаются значения у индивидуальных ионов. Но в результате эти способы дают примерно одинаковые значения межъядерных расстояний. Эти способы или системы были названы в честь ученых, проводивших в этой области соответствующие исследования:
- Гольдшмидта;
- Полинга;
- Белова и Бокия;
- других ученых.
При металлической связи, возникающей в кристаллах металлов, АР принимаются равными половине кратчайшего расстояния между ними. Металлический радиус зависит от координационного числа К. При К=12 его значение условно принимается за единицу. Для координационных чисел 4, 6 и 8 металлические радиусы одного и того же элемента соответственно будут равны 0.88, 0.96 и 0.98.
Если взять два разных металла и сравнить металлические радиусы их элементов, то близость этих значений друг к другу будет означать необходимое, но недостаточное условие взаимной растворимости этих металлов по типу замещения. Например, жидкие калий К и литий Li в обычных условиях не смешиваются и образуют два жидких слоя, потому что их металлические радиусы сильно различаются (0.236 нм и 0.155 нм соответственно), а калий К с цезием Cs образуют твердый раствор благодаря близости их радиусов (0.236 нм и 0.268 нм).
Ван-дер-ваальсовы АР используют для определения эффективных размеров атомов благородных газов, а также расстояний между ближайшими одноименными атомами, принадлежащими разным молекулам и не связанными химической связью (пример — молекулярные кристаллы). Если такие атомы сблизятся на расстояние, меньшее суммы их ван-дер-ваальсовых радиусов, между ними возникнет сильное межатомное отталкивание. Эти радиусы определяют минимально допустимые границы контакта двух атомов, принадлежащих соседним молекулам.
Кроме того, данные АР используют для определения формы молекул, их конформаций и упаковки в молекулярных кристаллах. Известен принцип «плотной упаковки», когда молекулы, образующие кристалл, входят друг в друга своими «выступами» и «впадинами». На основе этого принципа интерпретируются данные кристаллографии и предсказываются структуры молекулярных кристаллов.
Видео
Это полезное видео поможет вам понять, что такое радиус атома.
From Wikipedia, the free encyclopedia
Diagram of a helium atom, showing the electron probability density as shades of gray.
The atomic radius of a chemical element is a measure of the size of its atom, usually the mean or typical distance from the center of the nucleus to the outermost isolated electron. Since the boundary is not a well-defined physical entity, there are various non-equivalent definitions of atomic radius. Four widely used definitions of atomic radius are: Van der Waals radius, ionic radius, metallic radius and covalent radius. Typically, because of the difficulty to isolate atoms in order to measure their radii separately, atomic radius is measured in a chemically bonded state; however theoretical calculations are simpler when considering atoms in isolation. The dependencies on environment, probe, and state lead to a multiplicity of definitions.
Depending on the definition, the term may apply to atoms in condensed matter, covalently bonding in molecules, or in ionized and excited states; and its value may be obtained through experimental measurements, or computed from theoretical models. The value of the radius may depend on the atom’s state and context.[1]
Electrons do not have definite orbits nor sharply defined ranges. Rather, their positions must be described as probability distributions that taper off gradually as one moves away from the nucleus, without a sharp cutoff; these are referred to as atomic orbitals or electron clouds. Moreover, in condensed matter and molecules, the electron clouds of the atoms usually overlap to some extent, and some of the electrons may roam over a large region encompassing two or more atoms.
Under most definitions the radii of isolated neutral atoms range between 30 and 300 pm (trillionths of a meter), or between 0.3 and 3 ångströms. Therefore, the radius of an atom is more than 10,000 times the radius of its nucleus (1–10 fm),[2] and less than 1/1000 of the wavelength of visible light (400–700 nm).
For many purposes, atoms can be modeled as spheres. This is only a crude approximation, but it can provide quantitative explanations and predictions for many phenomena, such as the density of liquids and solids, the diffusion of fluids through molecular sieves, the arrangement of atoms and ions in crystals, and the size and shape of molecules.[citation needed]
History[edit]
In 1920, shortly after it had become possible to determine the sizes of atoms using X-ray crystallography, it was suggested that all atoms of the same element have the same radii.[3] However, in 1923, when more crystal data had become available, it was found that the approximation of an atom as a sphere does not necessarily hold when comparing the same atom in different crystal structures.[4]
Definitions[edit]
Widely used definitions of atomic radius include:
- Van der Waals radius: In the simplest definition, half the minimum distance between the nuclei of two atoms of the element that are not otherwise bound by covalent or metallic interactions.[5] The Van der Waals radius may be defined even for elements (such as metals) in which Van der Waals forces are dominated by other interactions. Because Van der Waals interactions arise through quantum fluctuations of the atomic polarisation, the polarisability (which can usually be measured or calculated more easily) may be used to define the Van der Waals radius indirectly.[6]
- Ionic radius: the nominal radius of the ions of an element in a specific ionization state, deduced from the spacing of atomic nuclei in crystalline salts that include that ion. In principle, the spacing between two adjacent oppositely charged ions (the length of the ionic bond between them) should equal the sum of their ionic radii.[5]
- Covalent radius: the nominal radius of the atoms of an element when covalently bound to other atoms, as deduced from the separation between the atomic nuclei in molecules. In principle, the distance between two atoms that are bound to each other in a molecule (the length of that covalent bond) should equal the sum of their covalent radii.[5]
- Metallic radius: the nominal radius of atoms of an element when joined to other atoms by metallic bonds.[citation needed]
- Bohr radius: the radius of the lowest-energy electron orbit predicted by Bohr model of the atom (1913).[7][8] It is only applicable to atoms and ions with a single electron, such as hydrogen, singly ionized helium, and positronium. Although the model itself is now obsolete, the Bohr radius for the hydrogen atom is still regarded as an important physical constant.
Empirically measured atomic radius[edit]
The following table shows empirically measured covalent radii for the elements, as published by J. C. Slater in 1964.[9] The values are in picometers (pm or 1×10−12 m), with an accuracy of about 5 pm. The shade of the box ranges from red to yellow as the radius increases; gray indicates lack of data.
| Group (column) |
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |
| Period (row) |
|||||||||||||||||||
| 1 | H 25 |
He |
|||||||||||||||||
| 2 | Li 145 |
Be 105 |
B 85 |
C 70 |
N 65 |
O 60 |
F 50 |
Ne |
|||||||||||
| 3 | Na 180 |
Mg 150 |
Al 125 |
Si 110 |
P 100 |
S 100 |
Cl 100 |
Ar |
|||||||||||
| 4 | K 220 |
Ca 180 |
Sc 160 |
Ti 140 |
V 135 |
Cr 140 |
Mn 140 |
Fe 140 |
Co 135 |
Ni 135 |
Cu 135 |
Zn 135 |
Ga 130 |
Ge 125 |
As 115 |
Se 115 |
Br 115 |
Kr |
|
| 5 | Rb 235 |
Sr 200 |
Y 180 |
Zr 155 |
Nb 145 |
Mo 145 |
Tc 135 |
Ru 130 |
Rh 135 |
Pd 140 |
Ag 160 |
Cd 155 |
In 155 |
Sn 145 |
Sb 145 |
Te 140 |
I 140 |
Xe |
|
| 6 | Cs 260 |
Ba 215 |
* |
Lu 175 |
Hf 155 |
Ta 145 |
W 135 |
Re 135 |
Os 130 |
Ir 135 |
Pt 135 |
Au 135 |
Hg 150 |
Tl 190 |
Pb 180 |
Bi 160 |
Po 190 |
At |
Rn |
| 7 | Fr |
Ra 215 |
** |
Lr |
Rf |
Db |
Sg |
Bh |
Hs |
Mt |
Ds |
Rg |
Cn |
Nh |
Fl |
Mc |
Lv |
Ts |
Og |
| * |
La 195 |
Ce 185 |
Pr 185 |
Nd 185 |
Pm 185 |
Sm 185 |
Eu 185 |
Gd 180 |
Tb 175 |
Dy 175 |
Ho 175 |
Er 175 |
Tm 175 |
Yb 175 |
|||||
| ** |
Ac 195 |
Th 180 |
Pa 180 |
U 175 |
Np 175 |
Pu 175 |
Am 175 |
Cm |
Bk |
Cf |
Es |
Fm |
Md |
No |
|||||
Explanation of the general trends[edit]
A graph comparing the atomic radius of elements with atomic numbers 1–100. Accuracy of ±5 pm.
The way the atomic radius varies with increasing atomic number can be explained by the arrangement of electrons in shells of fixed capacity. The shells are generally filled in order of increasing radius, since the negatively charged electrons are attracted by the positively charged protons in the nucleus. As the atomic number increases along each row of the periodic table, the additional electrons go into the same outermost shell; whose radius gradually contracts, due to the increasing nuclear charge. In a noble gas, the outermost shell is completely filled; therefore, the additional electron of next alkali metal will go into the next outer shell, accounting for the sudden increase in the atomic radius.
The increasing nuclear charge is partly counterbalanced by the increasing number of electrons, a phenomenon that is known as shielding; which explains why the size of atoms usually increases down each column. However, there is one notable exception, known as the lanthanide contraction: the 5d block of elements are much smaller than one would expect, due to the weak shielding of the 4f electrons.
Essentially, the atomic radius decreases across the periods due to an increasing number of protons. Therefore, there is a greater attraction between the protons and electrons because opposite charges attract, and more protons create a stronger charge. The greater attraction draws the electrons closer to the protons, decreasing the size of the particle. Therefore, the atomic radius decreases. Down the groups, atomic radius increases. This is because there are more energy levels and therefore a greater distance between protons and electrons. In addition, electron shielding causes attraction to decrease, so remaining electrons can go farther away from the positively charged nucleus. Therefore, the size, or atomic radius, increases.
The following table summarizes the main phenomena that influence the atomic radius of an element:
| factor | principle | increase with… | tend to | effect on radius |
|---|---|---|---|---|
| electron shells | quantum mechanics | principal and azimuthal quantum numbers | increase down each column | increases the atomic radius |
| nuclear charge | attractive force acting on electrons by protons in nucleus | atomic number | increase along each period (left to right) | decreases the atomic radius |
| shielding | repulsive force acting on outermost shell electrons by inner electrons | number of electrons in inner shells | reduce the effect of the 2nd factor | increases the atomic radius |
Lanthanide contraction[edit]
The electrons in the 4f-subshell, which is progressively filled from lanthanum (Z = 57) to ytterbium (Z = 70), are not particularly effective at shielding the increasing nuclear charge from the sub-shells further out. The elements immediately following the lanthanides have atomic radii which are smaller than would be expected and which are almost identical to the atomic radii of the elements immediately above them.[10] Hence lutetium is in fact slightly smaller than yttrium, hafnium has virtually the same atomic radius (and chemistry) as zirconium, and tantalum has an atomic radius similar to niobium, and so forth. The effect of the lanthanide contraction is noticeable up to platinum (Z = 78), after which it is masked by a relativistic effect known as the inert-pair effect.[citation needed]
Due to lanthanide contraction, the 5 following observations can be drawn:
- The size of Ln3+ ions regularly decreases with atomic number. According to Fajans’ rules, decrease in size of Ln3+ ions increases the covalent character and decreases the basic character between Ln3+ and OH− ions in Ln(OH)3, to the point that Yb(OH)3 and Lu(OH)3 can dissolve with difficulty in hot concentrated NaOH. Hence the order of size of Ln3+ is given:
La3+ > Ce3+ > …, … > Lu3+. - There is a regular decrease in their ionic radii.
- There is a regular decrease in their tendency to act as a reducing agent, with an increase in atomic number.
- The second and third rows of d-block transition elements are quite close in properties.
- Consequently, these elements occur together in natural minerals and are difficult to separate.
d-block contraction[edit]
The d-block contraction is less pronounced than the lanthanide contraction but arises from a similar cause. In this case, it is the poor shielding capacity of the 3d-electrons which affects the atomic radii and chemistries of the elements immediately following the first row of the transition metals, from gallium (Z = 31) to bromine (Z = 35).[10]
Calculated atomic radius[edit]
The following table shows atomic radii computed from theoretical models, as published by Enrico Clementi and others in 1967.[11] The values are in picometres (pm).
| Group (column) |
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |
| Period (row) |
|||||||||||||||||||
| 1 | H 53 |
He 31 |
|||||||||||||||||
| 2 | Li 167 |
Be 112 |
B 87 |
C 67 |
N 56 |
O 48 |
F 42 |
Ne 38 |
|||||||||||
| 3 | Na 190 |
Mg 145 |
Al 118 |
Si 111 |
P 98 |
S 88 |
Cl 79 |
Ar 71 |
|||||||||||
| 4 | K 243 |
Ca 194 |
Sc 184 |
Ti 176 |
V 171 |
Cr 166 |
Mn 161 |
Fe 156 |
Co 152 |
Ni 149 |
Cu 145 |
Zn 142 |
Ga 136 |
Ge 125 |
As 114 |
Se 103 |
Br 94 |
Kr 88 |
|
| 5 | Rb 265 |
Sr 219 |
Y 212 |
Zr 206 |
Nb 198 |
Mo 190 |
Tc 183 |
Ru 178 |
Rh 173 |
Pd 169 |
Ag 165 |
Cd 161 |
In 156 |
Sn 145 |
Sb 133 |
Te 123 |
I 115 |
Xe 108 |
|
| 6 | Cs 298 |
Ba 253 |
* |
Lu 217 |
Hf 208 |
Ta 200 |
W 193 |
Re 188 |
Os 185 |
Ir 180 |
Pt 177 |
Au 174 |
Hg 171 |
Tl 156 |
Pb 154 |
Bi 143 |
Po 135 |
At 127 |
Rn 120 |
| 7 | Fr |
Ra |
** |
Lr |
Rf |
Db |
Sg |
Bh |
Hs |
Mt |
Ds |
Rg |
Cn |
Nh |
Fl |
Mc |
Lv |
Ts |
Og |
| * |
La 226 |
Ce 210 |
Pr 247 |
Nd 206 |
Pm 205 |
Sm 238 |
Eu 231 |
Gd 233 |
Tb 225 |
Dy 228 |
Ho 226 |
Er 226 |
Tm 222 |
Yb 222 |
|||||
| ** |
Ac |
Th |
Pa |
U |
Np |
Pu |
Am |
Cm |
Bk |
Cf |
Es |
Fm |
Md |
No |
See also[edit]
- Atomic radii of the elements (data page)
- Chemical bond
- Covalent radius
- Bond length
- Steric hindrance
- Kinetic diameter
Notes[edit]
- Difference between empirical and calculated data: Empirical data means «originating in or based on observation or experience» or «relying on experience or observation alone often without due regard for system and theory data».[12] In other words, the data are measured through physical observation, and vetted by other experiments generating similar results. Calculated data, on the other hand, are derived from theoretical models. Such predictions are especially useful for elements whose radii cannot be measured experimentally (e.g. those that have not been discovered, or that have too short of a half-life).
References[edit]
- ^
Cotton, F. A.; Wilkinson, G. (1988). Advanced Inorganic Chemistry (5th ed.). Wiley. p. 1385. ISBN 978-0-471-84997-1. - ^
Basdevant, J.-L.; Rich, J.; Spiro, M. (2005). Fundamentals in Nuclear Physics. Springer. p. 13, fig 1.1. ISBN 978-0-387-01672-6. - ^
Bragg, W. L. (1920). «The arrangement of atoms in crystals». Philosophical Magazine. 6. 40 (236): 169–189. doi:10.1080/14786440808636111. - ^
Wyckoff, R. W. G. (1923). «On the Hypothesis of Constant Atomic Radii». Proceedings of the National Academy of Sciences of the United States of America. 9 (2): 33–38. Bibcode:1923PNAS….9…33W. doi:10.1073/pnas.9.2.33. PMC 1085234. PMID 16576657. - ^ a b c
Pauling, L. (1945). The Nature of the Chemical Bond (2nd ed.). Cornell University Press. LCCN 42034474. - ^
Federov, Dmitry V.; Sadhukhan, Mainak; Stöhr, Martin; Tkatchenko, Alexandre (2018). «Quantum-Mechanical Relation between Atomic Dipole Polarizability and the van der Waals Radius». Physical Review Letters. 121 (18): 183401. arXiv:1803.11507. Bibcode:2018PhRvL.121r3401F. doi:10.1103/PhysRevLett.121.183401. PMID 30444421. S2CID 53564141. Retrieved 9 May 2021. - ^
Bohr, N. (1913). «On the Constitution of Atoms and Molecules, Part I. – Binding of Electrons by Positive Nuclei» (PDF). Philosophical Magazine. 6. 26 (151): 1–24. Bibcode:1913PMag…26….1B. doi:10.1080/14786441308634955. Archived (PDF) from the original on 2011-09-02. Retrieved 8 June 2011. - ^
Bohr, N. (1913). «On the Constitution of Atoms and Molecules, Part II. – Systems containing only a Single Nucleus» (PDF). Philosophical Magazine. 6. 26 (153): 476–502. Bibcode:1913PMag…26..476B. doi:10.1080/14786441308634993. Archived (PDF) from the original on 2008-12-09. Retrieved 8 June 2011. - ^
Slater, J. C. (1964). «Atomic Radii in Crystals». Journal of Chemical Physics. 41 (10): 3199–3205. Bibcode:1964JChPh..41.3199S. doi:10.1063/1.1725697. - ^ a b
Jolly, W. L. (1991). Modern Inorganic Chemistry (2nd ed.). McGraw-Hill. p. 22. ISBN 978-0-07-112651-9. - ^
Clementi, E.; Raimond, D. L.; Reinhardt, W. P. (1967). «Atomic Screening Constants from SCF Functions. II. Atoms with 37 to 86 Electrons». Journal of Chemical Physics. 47 (4): 1300–1307. Bibcode:1967JChPh..47.1300C. doi:10.1063/1.1712084. - ^ «Definition of EMPIRICAL».
Поскольку
квантовая механика запрещает точное
определение координат частицы, понятия
«радиус атома», «радиус иона» условны.
Атомные радиусы подразделяют на радиусы
атомов металлов, ковалентные радиусы
атомов металлов и радиусы атомов
благородных газов. Их определяют как
половину расстояния между слоями атомов
в кристаллая соответствующих простых
в-в. рентгенографическим или
нейтронографичским методами.
В
общем случае радиус атома зависит не
только от природы атомов, но и от характера
химической связи между ними, агрегатного
состояния, температуры и ряда других
факторов. Это обстоятельство лишний
раз указывает на относительность понятия
«радиус атома». Атомы не являются
несжижаемыми, неподвижно застывшими
шариками, они всегда принимают участие
во вращательном и колебательном движении.
Радиусы
атомов благородных газов значительно
больше радиусов атомов неметаллов
соответствующих периодов, поскольку в
кристаллах благородных газов межатомное
взаимодействие очень слабое.
Шкала
ионных радиусов, понятно, не может быть
основана на тех же принципах, что шкала
атомных радиусов (ни одна хар-ка
индивидуального иона не может быть
объективно определена). Современная
шкала ионных радиусов основана на
допущении, что границей между ионами
является точка минимума электронной
плотности на линии, соединяющей центры
ионов.
Периодический
закон ведёт к след. закономерностям в
изменении атомных и ионных радиусов:
1)
в периодах слева направо в целом радиус
атома уменьшается, затем в конце резко
возрастает у атома благородного газа.
2)
в подгруппах сверху вниз происходит
рост радиуса атома: более значительный
в главных подгруппах и менее значительный
– в побочных.
3)
радиус катиона меньше радиуса атома и
уменьшается с ростом заряда катиона.
4)
радиус аниона больше радиуса атома.
5)
в периодах радиусы ионов d-элементов
одинакового заряда плавно уменьшаются,
это так называемое d-сжатие.
6)
аналогичное явление отмечается и для
f-элементов.
7)
Радиусы однотипных ионов (имеющих
сходную электронную «макушку») в
подгруппах плавно возрастают.

Если различные ионы имеют одинаковое
число электронов (изоэлектронные), то
размер таких ионов будет определяться
зарядом ядра иона. Наименьшим будет ион
с большим зарядом ядра. Радиус
изоэлектронных ионов уменьшается с
ростом заряда иона.
Вопрос 9) Относительная сила кислот и оснований (схема Косселя) на примерах … .
Сила
кислородных кислот будет возрастать с
увеличением степени окисления атома
элемента и уменьшается радиуса его
иона. У оснований наоборот.
Сила
бескислородных кислот возрастает с
уменьшением степени окисления атома
элемента и увеличением радиуса его
иона. Сила бескислородных кислот в
растворе будет возрастать в подгруппе,
т.к при одинаковой степени окисления
атома элемента увеличивается радиус
его иона.
Более
сильным электролитам из двух считается
тот, у которого при одинаковой молярной
концентрации больше степень диссоциации.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #