Азотная кислота
Строение молекулы и физические свойства
Азотная кислота HNO3 – это сильная одноосновная кислота-гидроксид. При обычных условиях бесцветная, дымящая на воздухе жидкость, температура плавления −41,59 °C, кипения +82,6 °C ( при нормальном атмосферном давлении). Азотная кислота смешивается с водой во всех соотношениях. На свету частично разлагается.
Валентность азота в азотной кислоте равна IV, так как валентность V у азота отсутствует. При этом степень окисления атома азота равна +5. Так происходит потому, что атом азота образует 3 обменные связи и одну донорно-акцепторную, является донором электронной пары.
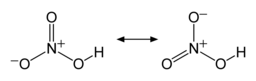
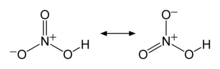
Поэтому строение молекулы азотной кислоты можно описать резонансными структурами:
Обозначим дополнительные связи между азотом и кислородом пунктиром. Этот пунктир по сути обозначает делокализованные электроны. Получается формула:
Способы получения
В лаборатории азотную кислоту можно получить разными способами:
1. Азотная кислота образуется при действии концентрированной серной кислоты на твердые нитраты металлов. При этом менее летучая серная кислота вытесняет более летучую азотную.
Например, концентрированная серная кислота вытесняет азотную из кристаллического нитрата калия:
KNO3 + H2SO4(конц) → KHSO4 + HNO3
2. В промышленности азотную кислоту получают из аммиака. Процесс осуществляется постадийно.
1 стадия. Каталитическое окисление аммиака.
4NH3 + 5O2 → 4NO + 6H2O
2 стадия. Окисление оксида азота (II) до оксида азота (IV) кислородом воздуха.
2NO + O2 → 2NO2
3 стадия. Поглощение оксида азота (IV) водой в присутствии избытка кислорода.
4NO2 + 2H2O + O2 → 4HNO3
Химические свойства
Азотная кислота – это сильная кислота. За счет азота со степенью окисления +5 азотная кислота проявляет сильные окислительные свойства.
1. Азотная кислота практически полностью диссоциирует в водном растворе.
HNO3 → H+ + NO3–
2. Азотная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например, азотная кислота взаимодействует с оксидом меди (II):
CuO + 2HNO3 → Cu(NO3)2 + H2O
Еще пример: азотная кислота реагирует с гидроксидом натрия:
HNO3 + NaOH → NaNO3 + H2O
3. Азотная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов, сульфитов).
Например, азотная кислота взаимодействует с карбонатом натрия:
2HNO3 + Na2CO3 → 2NaNO3 + H2O + CO2
4. Азотная кислота частично разлагается при кипении или под действием света:
4HNO3 → 4NO2 + O2 + 2H2O
5. Азотная кислота активно взаимодействует с металлами. При этом никогда не выделяется водород! При взаимодействии азотной кислоты с металлами окислителем всегда выступает азот +5. Азот в степени окисления +5 может восстанавливаться до степеней окисления -3, 0, +1, +2 или +4 в зависимости от концентрации кислоты и активности металла.
металл + HNO3 → нитрат металла + вода + газ (или соль аммония)
С алюминием, хромом и железом на холоду концентрированная HNO3 не реагирует – кислота «пассивирует» металлы, т.к. на их поверхности образуется пленка оксидов, непроницаемая для концентрированной азотной кислоты. При нагревании реакция идет. При этом азот восстанавливается до степени окисления +4:
Fe + 6HNO3(конц.) → Fe(NO3)3 + 3NO2 + 3H2O
Al + 6HNO3(конц.) → Al(NO3)3 + 3NO2 + 3H2O
Золото и платина не реагируют с азотной кислотой, но растворяются в «царской водке» – смеси концентрированных азотной и соляной кислот в соотношении 1 : 3 (по объему):
HNO3 + 3HCl + Au → AuCl3 + NO + 2H2O
Концентрированная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (IV), азот восстанавливается минимально:
4HNO3(конц.) + Cu → Cu(NO3)2 + 2NO2 + 2H2O
С активными металлами (щелочными и щелочноземельными) концентрированная азотная кислота реагирует с образованием оксида азота (I):
10HNO3 + 4Ca → 4Ca(NO3)2 + N2O + 5H2O
Разбавленная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (II).
8HNO3 (разб.) + 3Cu → 3Cu(NO3)2 + 2NO + 4H2O
С активными металлами (щелочными и щелочноземельными), а также оловом и железом разбавленная азотная кислота реагирует с образованием молекулярного азота:
12HNO3(разб) + 10Na → 10NaNO3 + N2 + 6H2O
При взаимодействии кальция и магния с азотной кислотой любой концентрации (кроме очень разбавленной) образуется оксид азота (I):
10HNO3 + 4Ca → 4Ca(NO3)2 + 2N2O + 5H2O
Очень разбавленная азотная кислота реагирует с металлами с образованием нитрата аммония:
10HNO3 + 4Zn → 4Zn(NO3)2 + NH4NO3 + 3H2O
Таблица. Взаимодействие азотной кислоты с металлами.
| Азотная кислота | ||||
| Концентрированная | Разбавленная | |||
| с Fe, Al, Cr | с неактивными металлами и металлами средней активности (после Al) | с щелочными и щелочноземельными металлами | с неактивными металлами и металлами средней активности (после Al) | с металлами до Al в ряду активности, Sn, Fe |
| пассивация при низкой Т | образуется NO2 | образуется N2O | образуется NO | образуется N2 |
6. Азотная кислота окисляет и неметаллы (кроме кислорода, водорода, хлора, фтора и некоторых других). При взаимодействии с неметаллами HNO3 обычно восстанавливается до NO или NO2, неметаллы окисляются до соответствующих кислот, либо оксидов (если кислота неустойчива).
Например, азотная кислота окисляет серу, фосфор, углерод, йод:
6HNO3 + S → H2SO4 + 6NO2 + 2H2O
Безводная азотная кислота – сильный окислитель. Поэтому она легко взаимодействует с красным и белым фосфором. Реакция с белым фосфором протекает очень бурно. Иногда она сопровождается взрывом.
5HNO3 + P → H3PO4 + 5NO2 + H2O
5HNO3 + 3P + 2H2O → 3H3PO4 + 5NO
Видеоопыт взаимодействия фосфора с безводной азотной кислотой можно посмотреть здесь.
4HNO3 + C → CO2 + 4NO2 + 2H2O
Видеоопыт взаимодействия угля с безводной азотной кислотой можно посмотреть здесь.
10HNO3 + I2 → 2HIO3 + 10NO2 + 4H2O
7. Концентрированная азотная кислота окисляет сложные вещества (в которых есть элементы в отрицательной, либо промежуточной степени окисления): сульфиды металлов, сероводород, фосфиды, йодиды, соединения железа (II) и др. При этом азот восстанавливается до NO2, неметаллы окисляются до соответствующих кислот (или оксидов), а металлы окисляются до устойчивых степеней окисления.
Например, азотная кислота окисляет оксид серы (IV):
2HNO3 + SO2 → H2SO4 + 2NO2
Еще пример: азотная кислота окисляет иодоводород:
6HNO3 + HI → HIO3 + 6NO2 + 3H2O
Сера в степени окисления -2 окисляется без нагревания до простого вещества, при нагревании до серной кислоты.
Например, сероводород окисляется азотной кислотой без нагревания до молекулярной серы:
2HNO3 + H2S → S + 2NO2 + 2H2O
При нагревании до серной кислоты:
2HNO3 + H2S → H2SO4 + 2NO2 + 2H2O
8HNO3 + CuS → CuSO4 + 8NO2 + 4H2O
Соединения железа (II) азотная кислота окисляет до соединений железа (III):
4HNO3 + FeS → Fe(NO3)3 + NO + S + 2H2O
8. Азотная кислота окрашивает белки в оранжево-желтый цвет («ксантопротеиновая реакция«).
Ксантопротеиновую реакцию проводят для обнаружения белков, содержащих в своем составе ароматические аминокислоты. К раствору белка прибавляем концентрированную азотную кислоту. Белок свертывается. При нагревании белок желтеет. При добавлении избытка аммиака окраска переходит в оранжевую.
Видеоопыт обнаружения белков с помощью азотной кислоты можно посмотреть здесь.
Азотная кислота является одной из самых сильных минеральных кислот, в концентрированном виде выделяет пары
желтого цвета с резким запахом. За исключением золота и платины растворяет все металлы.
Применяют азотную кислоту для получения красителей, удобрений, органических нитропродуктов, серной и фосфорной
кислот. В результате ожога азотной кислотой образуется сухой струп желто-зеленого цвета.

Получение
В промышленности азотную кислоту получают в результате окисления аммиака на платино-родиевых катализаторах.
NH3 + O2 → (кат. Pt) NO + H2O
NO + O2 → NO2
NO2 + H2O + O2 → HNO3
Чистая азотная кислота впервые была получена действием на селитру концентрированной серной кислоты:
KNO3 + H2SO4(конц.) → KHSO4 + HNO3↑
Химические свойства
- Кислотные свойства
- Термическое разложение
- Реакции с неметаллами
- Реакции с металлами
Является одноосновной сильной кислотой, вступает в реакции с основными оксидами, основаниями. С солями реагирует при условии
выпадения осадка, выделения газа или образования слабого электролита.
CaO + HNO3 → Ca(NO3)2 + H2O
HNO3 + NaOH → NaNO3 + H2O
Na2CO3 + HNO3 → NaNO3 + H2O + CO2↑

При нагревании азотная кислота распадается. На свету (hv) также происходит подобная реакция, поэтому азотную кислоту следует хранить в
темном месте.
HNO3 → (hv) NO2 + H2O + O2
Азотная кислота способна окислить все неметаллы, при этом, если кислота концентрированная, азот обычно восстанавливается до NO2,
если разбавленная — до NO.
HNO3(конц.) + C → CO2 + H2O + NO2
HNO3(конц.) + S → H2SO4 + NO2 + H2O
HNO3(разб.) + S → H2SO4 + NO + H2O
HNO3(конц.) + P → H3PO4 + NO2 + H2O

В любой концентрации азотная кислота проявляет свойства окислителя, при этом азот восстанавливается до степени окисления от +5 до -3. На какой
именно степени окисления остановится азот, зависит от активности металла и концентрации азотной кислоты.
Для малоактивных металлов (стоящих в ряду напряжений после водорода) реакция с концентрированной азотной кислотой происходит с образованием
нитрата и преимущественно NO2.
Cu + HNO3(конц.) → Cu(NO3)2 + NO2 + H2O
С разбавленной азотной кислотой газообразным продуктом преимущественно является NO.
Cu + HNO3(разб.) → Cu(NO3)2 + NO + H2O
В реакциях с металлами, стоящими левее водорода в ряду напряжений, возможны самые разные газообразные (и не газообразные) продукты: бурый газ NO2,
NO, N2O, атмосферный газ N2, NH4NO3.
Помните о закономерности: чем более разбавлена кислота и активен металл, тем сильнее восстанавливается азот. Ниже представлены реакции цинка
с азотной кислотой в различных концентрациях.
Zn + HNO3(70% — конц.) → Zn(NO3)2 + NO2 + H2O
Zn + HNO3(35% — ср. конц.) → Zn(NO3)2 + NO + H2O
Zn + HNO3(20% — разб.) → Zn(NO3)2 + N2O + H2O
Zn + HNO3(10% — оч. разб.) → Zn(NO3)2 + N2 + H2O

Посмотрите на таблицу ниже, в которой также отражены изученные нами закономерности.

Концентрированная холодная азотная кислота пассивирует хром, железо, алюминий, никель, свинец и бериллий. Это происходит
за счет оксидной пленки, которой покрыты данные металлы.
Al + HNO3(конц.) ⇸ (реакция не идет)
При нагревании или амальгамировании (покрытие ртутью) перечисленных металлов реакция с азотной кислотой идет, так
как оксидная пленка на поверхности металлов разрушается.
Al + HNO3 → (t) Al(NO3)3 + NO2 + H2O
Соли азотной кислоты — нитраты NO3—
Получение
Получают нитраты в ходе реакции азотной кислоты с металлами, их оксидами и основаниями.
Fe + HNO3(разб.) → Fe(NO3)2 + N2O + H2O
В реакциях с оксидами и основаниями газообразный продукт обычно не выделяется.
MgO + HNO3 → Mg(NO3)2 + H2O
Cr(OH)3 + HNO3 → Cr(NO3)3 + H2O

Нитрат аммония получают реакция аммиака с азотной кислотой.
NH3 + HNO3 → NH4NO3
Обратите внимание на следующую закономерность: концентрированная азотная кислота, как правило, окисляет железо и хром до +3. Разбавленная
кислота — до +2.
Fe + HNO3(разб.) → Fe(NO3)2 + N2O + H2O
Fe + HNO3(конц.) → Fe(NO3)3 + NO + H2O
Химические свойства
- Реакции с металлами, основаниями и кислотами
- Разложение нитратов
Как и для всех солей, из нитратов можно вытеснить металл другим более активным. Соли реагируют с основаниями и кислотами, если в результате
реакции выпадает осадок, выделяется газ или образуется слабый электролит (вода).
Hg(NO3)2 + Mg → Mg(NO3)2 + Hg
Pb(NO3)2 + LiOH → Pb(OH)2 + LiNO3
AgNO3 + KCl → AgCl↓ + KNO3

Ba(NO3)2 + Na2SO4 → BaSO4 + NaNO3
Нитраты разлагаются в зависимости от активности металла, входящего в их состав.

Pb(NO3)2 → (t) PbO + NO2 + O2
NaNO3 → (t) NaNO2 + O2
Cu(NO3)2 → (t) CuO + NO2 + O2
PtNO3 → (t) Pt + NO2 + O2

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
|
||
|
||
| Names | ||
|---|---|---|
| IUPAC name
Nitric acid |
||
Other names
|
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| 3DMet |
|
|
| ChEBI |
|
|
| ChEMBL |
|
|
| ChemSpider |
|
|
| ECHA InfoCard | 100.028.832 |
|
| EC Number |
|
|
|
Gmelin Reference |
1576 | |
| KEGG |
|
|
| MeSH | Nitric+acid | |
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
| UN number | 2031 | |
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
HNO3 | |
| Molar mass | 63.012 g·mol−1 | |
| Appearance | Colorless liquid[1] | |
| Odor | Acrid, suffocating[1] | |
| Density | 1.51 g/cm3, 1.41 g/cm3 [68% w/w] | |
| Melting point | −42 °C (−44 °F; 231 K) | |
| Boiling point | 83 °C (181 °F; 356 K) 68% solution boils at 121 °C (250 °F; 394 K) | |
|
Solubility in water |
Miscible | |
| log P | −0.13[2] | |
| Vapor pressure | 48 mmHg (20 °C)[1] | |
| Acidity (pKa) | −1.4[3] | |
| Conjugate base | Nitrate | |
|
Magnetic susceptibility (χ) |
−1.99×10−5 cm3/mol | |
|
Refractive index (nD) |
1.397 (16.5 °C) | |
|
Dipole moment |
2.17 ± 0.02 D | |
| Thermochemistry | ||
|
Std molar |
146 J/(mol·K)[4] | |
|
Std enthalpy of |
−207 kJ/mol[4] | |
| Hazards | ||
| GHS labelling: | ||
|
Pictograms |
 
|
|
|
Signal word |
Danger | |
|
Hazard statements |
H272, H300, H310, H330, H373, H411 | |
|
Precautionary statements |
P210, P220, P260, P305+P351+P338, P310, P370+P378 | |
| NFPA 704 (fire diamond) |
[5] 3 0 2 OX |
|
| Flash point | Non-flammable | |
| Lethal dose or concentration (LD, LC): | ||
|
LC50 (median concentration) |
138 ppm (rat, 30 min)[1] | |
| NIOSH (US health exposure limits): | ||
|
PEL (Permissible) |
TWA 2 ppm (5 mg/m3)[1] | |
|
REL (Recommended) |
TWA 2 ppm (5 mg/m3) ST 4 ppm (10 mg/m3)[1] |
|
|
IDLH (Immediate danger) |
25 ppm[1] | |
| Safety data sheet (SDS) | ICSC 0183 | |
| Related compounds | ||
|
Other anions |
Nitrous acid | |
|
Other cations |
|
|
|
Related compounds |
|
|
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Nitric acid is the inorganic compound with the formula HNO3. It is a highly corrosive mineral acid.[6] The compound is colorless, but older samples tend to be yellow cast due to decomposition into oxides of nitrogen. Most commercially available nitric acid has a concentration of 68% in water. When the solution contains more than 86% HNO3, it is referred to as fuming nitric acid. Depending on the amount of nitrogen dioxide present, fuming nitric acid is further characterized as red fuming nitric acid at concentrations above 86%, or white fuming nitric acid at concentrations above 95%.
Nitric acid is the primary reagent used for nitration – the addition of a nitro group, typically to an organic molecule. While some resulting nitro compounds are shock- and thermally-sensitive explosives, a few are stable enough to be used in munitions and demolition, while others are still more stable and used as pigments in inks and dyes. Nitric acid is also commonly used as a strong oxidizing agent.
Physical and chemical properties
Commercially available nitric acid is an azeotrope with water at a concentration of 68% HNO3. This solution has a boiling temperature of 120.5 °C (249 °F) at 1 atm. It is known as «concentrated nitric acid». The azeotrope of nitric acid and water is a colourless liquid at room temperature.
Two solid hydrates are known: the monohydrate HNO3·H2O or oxonium nitrate [H3O]+[NO3]− and the trihydrate HNO3·3H2O.
An older density scale is occasionally seen, with concentrated nitric acid specified as 42 Baumé.[7]
Contamination with nitrogen dioxide
Fuming nitric acid contaminated with yellow nitrogen dioxide
Nitric acid is subject to thermal or light decomposition and for this reason it was often stored in brown glass bottles:
- 4 HNO3 → 2 H2O + 4 NO2 + O2
This reaction may give rise to some non-negligible variations in the vapor pressure above the liquid because the nitrogen oxides produced dissolve partly or completely in the acid.
The nitrogen dioxide (NO2) and/or dinitrogen tetroxide (N2O4) remains dissolved in the nitric acid coloring it yellow or even red at higher temperatures. While the pure acid tends to give off white fumes when exposed to air, acid with dissolved nitrogen dioxide gives off reddish-brown vapors, leading to the common names «red fuming nitric acid» and «white fuming nitric acid». Nitrogen oxides (NOx) are soluble in nitric acid.
Fuming nitric acid
Commercial-grade fuming nitric acid contains 98% HNO3 and has a density of 1.50 g/cm3. This grade is often used in the explosives industry. It is not as volatile nor as corrosive as the anhydrous acid and has the approximate concentration of 21.4 M.
Red fuming nitric acid, or RFNA, contains substantial quantities of dissolved nitrogen dioxide (NO2) leaving the solution with a reddish-brown color. Due to the dissolved nitrogen dioxide, the density of red fuming nitric acid is lower at 1.490 g/cm3.
An inhibited fuming nitric acid, either White Inhibited Fuming Nitric Acid (IWFNA), or Red Inhibited Fuming Nitric Acid (IRFNA), can be made by the addition of 0.6 to 0.7% hydrogen fluoride (HF). This fluoride is added for corrosion resistance in metal tanks. The fluoride creates a metal fluoride layer that protects the metal.
Anhydrous nitric acid
White fuming nitric acid, pure nitric acid or WFNA, is very close to anhydrous nitric acid. It is available as 99.9% nitric acid by assay. One specification for white fuming nitric acid is that it has a maximum of 2% water and a maximum of 0.5% dissolved NO2. Anhydrous nitric acid has a density of 1.513 g/cm3 and has the approximate concentration of 24 molar. Anhydrous nitric acid is a colorless mobile liquid with a density of 1.512 g/cm3 that solidifies at −42 °C (−44 °F) to form white crystals[clarification needed]. As it decomposes to NO2 and water, it obtains a yellow tint. It boils at 83 °C (181 °F). It is usually stored in a glass shatterproof amber bottle with twice the volume of head space to allow for pressure build up, but even with those precautions the bottle must be vented monthly to release pressure.
Structure and bonding
Two major resonance representations of
HNO3
The two terminal N–O bonds are nearly equivalent and relatively short, at 1.20 and 1.21 Å.[8] This can be explained by theories of resonance; the two major canonical forms show some double bond character in these two bonds, causing them to be shorter than N–O single bonds. The third N–O bond is elongated because its O atom is bonded to H atom,[9][10] with a bond length of 1.41 Å in the gas phase.[8] The molecule is slightly aplanar (the NO2 and NOH planes are tilted away from each other by 2°) and there is restricted rotation about the N–OH single bond.[6][11]
Reactions
Acid-base properties
Nitric acid is normally considered to be a strong acid at ambient temperatures. There is some disagreement over the value of the acid dissociation constant, though the pKa value is usually reported as less than −1. This means that the nitric acid in diluted solution is fully dissociated except in extremely acidic solutions. The pKa value rises to 1 at a temperature of 250 °C.[12]
Nitric acid can act as a base with respect to an acid such as sulfuric acid:
- HNO3 + 2 H2SO4 ⇌ [NO2]+ + [H3O]+ + 2 HSO−4; Equilibrium constant: K ≈ 22
The nitronium ion, [NO2]+, is the active reagent in aromatic nitration reactions. Since nitric acid has both acidic and basic properties, it can undergo an autoprotolysis reaction, similar to the self-ionization of water:
- 2 HNO3 ⇌ [NO2]+ + NO−3 + H2O
Reactions with metals
Nitric acid reacts with most metals, but the details depend on the concentration of the acid and the nature of the metal. Dilute nitric acid behaves as a typical acid in its reaction with most metals. Magnesium, manganese, and zinc liberate H2:
- Mg + 2 HNO3 → Mg(NO3)2 + H2
- Mn + 2 HNO3 → Mn(NO3)2 + H2
- Zn + 2 HNO3 → Zn(NO3)2 + H2
Nitric acid can oxidize non-active metals such as copper and silver. With these non-active or less electropositive metals the products depend on temperature and the acid concentration. For example, copper reacts with dilute nitric acid at ambient temperatures with a 3:8 stoichiometry:
- 3 Cu + 8 HNO3 → 3 Cu(NO3)2 + 2 NO + 4 H2O
The nitric oxide produced may react with atmospheric oxygen to give nitrogen dioxide. With more concentrated nitric acid, nitrogen dioxide is produced directly in a reaction with 1:4 stoichiometry:
- Cu + 4 H+ + 2 NO−3 → Cu2+ + 2 NO2 + 2 H2O
Upon reaction with nitric acid, most metals give the corresponding nitrates. Some metalloids and metals give the oxides; for instance, Sn, As, Sb, and Ti are oxidized into SnO2, As2O5, Sb2O5, and TiO2 respectively.[13]
Some precious metals, such as pure gold and platinum-group metals do not react with nitric acid, though pure gold does react with aqua regia, a mixture of concentrated nitric acid and hydrochloric acid. However, some less noble metals (Ag, Cu, …) present in some gold alloys relatively poor in gold such as colored gold can be easily oxidized and dissolved by nitric acid, leading to colour changes of the gold-alloy surface. Nitric acid is used as a cheap means in jewelry shops to quickly spot low-gold alloys (< 14 karats) and to rapidly assess the gold purity.
Being a powerful oxidizing agent, nitric acid reacts with many non-metallic compounds, sometimes explosively. Depending on the acid concentration, temperature and the reducing agent involved, the end products can be variable. Reaction takes place with all metals except the noble metals series and certain alloys. As a general rule, oxidizing reactions occur primarily with the concentrated acid, favoring the formation of nitrogen dioxide (NO2). However, the powerful oxidizing properties of nitric acid are thermodynamic in nature, but sometimes its oxidation reactions are rather kinetically non-favored. The presence of small amounts of nitrous acid (HNO2) greatly increases the rate of reaction.[13]
Although chromium (Cr), iron (Fe), and aluminium (Al) readily dissolve in dilute nitric acid, the concentrated acid forms a metal-oxide layer that protects the bulk of the metal from further oxidation. The formation of this protective layer is called passivation. Typical passivation concentrations range from 20% to 50% by volume (see ASTM A967-05[where?][clarification needed]). Metals that are passivated by concentrated nitric acid are iron, cobalt, chromium, nickel, and aluminium.[13]
Reactions with non-metals
Being a powerful oxidizing acid, nitric acid reacts with many organic materials, and the reactions may be explosive. The hydroxyl group will typically strip a hydrogen from the organic molecule to form water, and the remaining nitro group takes the hydrogen’s place. Nitration of organic compounds with nitric acid is the primary method of synthesis of many common explosives, such as nitroglycerin and trinitrotoluene (TNT). As very many less stable byproducts are possible, these reactions must be carefully thermally controlled, and the byproducts removed to isolate the desired product.
Reaction with non-metallic elements, with the exceptions of nitrogen, oxygen, noble gases, silicon, and halogens other than iodine, usually oxidizes them to their highest oxidation states as acids with the formation of nitrogen dioxide for concentrated acid and nitric oxide for dilute acid.
- C (graphite) + 4 HNO3 → CO2 + 4 NO2 + 2 H2O
- 3 C (graphite) + 4 HNO3 → 3 CO2 + 4 NO + 2 H2O
Concentrated nitric acid oxidizes I2, P4, and S8 into HIO3, H3PO4, and H2SO4, respectively.[13] Although it reacts with graphite and amorphous carbon, it does not react with diamond; it can separate diamond from the graphite that it oxidizes.[14]
Xanthoproteic test
Nitric acid reacts with proteins to form yellow nitrated products. This reaction is known as the xanthoproteic reaction. This test is carried out by adding concentrated nitric acid to the substance being tested, and then heating the mixture. If proteins that contain amino acids with aromatic rings are present, the mixture turns yellow. Upon adding a base such as ammonia, the color turns orange. These color changes are caused by nitrated aromatic rings in the protein.[15][16] Xanthoproteic acid is formed when the acid contacts epithelial cells. Respective local skin color changes are indicative of inadequate safety precautions when handling nitric acid.
Production
Nitric acid is made by reaction of nitrogen dioxide (NO2) with water.
- 4 NO2 + 2 H2O → 2 HNO3 + NO + NO2 + H2O
The net reaction is:
- 3 NO2 + H2O → 2 HNO3 + NO
Normally, the nitric oxide produced by the reaction is reoxidized by the oxygen in air to produce additional nitrogen dioxide.
Bubbling nitrogen dioxide through hydrogen peroxide can help to improve acid yield.
- 2 NO2 + H2O2 → 2 HNO3
Commercial grade nitric acid solutions are usually between 52% and 68% nitric acid. Production of nitric acid is via the Ostwald process, named after German chemist Wilhelm Ostwald. In this process, anhydrous ammonia is oxidized to nitric oxide, in the presence of platinum or rhodium gauze catalyst at a high temperature of about 500 K (227 °C; 440 °F) and a pressure of 9 standard atmospheres (910 kPa).
- 4 NH3(g) + 5 O2(g) → 4 NO(g) + 6 H2O(g) (ΔH = −905.2 kJ/mol)
Nitric oxide is then reacted with oxygen in air to form nitrogen dioxide.
- 2 NO(g) + O2(g) → 2 NO2(g) (ΔH = −114 kJ/mol)
This is subsequently absorbed in water to form nitric acid and nitric oxide.
- 3 NO2(g) + H2O(l) → 2 HNO3(aq) + NO(g) (ΔH = −135.74 kJ/mol)
The nitric oxide is cycled back for reoxidation. Alternatively, if the last step is carried out in air:
- 4 NO2(g) + O2(g) + 2 H2O(l) → 4 HNO3(aq)
The aqueous HNO3 obtained can be concentrated by distillation up to about 68% by mass. Further concentration to 98% can be achieved by dehydration with concentrated H2SO4. By using ammonia derived from the Haber process, the final product can be produced from nitrogen, hydrogen, and oxygen which are derived from air and natural gas as the sole feedstocks.[17]
Laboratory synthesis
In the laboratory, nitric acid can be made by thermal decomposition of copper(II) nitrate, producing nitrogen dioxide and oxygen gases, which are then passed through water to give nitric acid.
- 2 Cu(NO3)2 → 2 CuO + 4 NO2 + O2
Then, following the Ostwald process:
- 2 NO2 + H2O → HNO2 + HNO3
Alternatively, the reaction of equal moles of any nitrate salt such as sodium nitrate with sulfuric acid (H2SO4), and distilling this mixture at nitric acid’s boiling point of 83 °C. A nonvolatile residue of the metal hydrogen sulfate remains in the distillation vessel. The red fuming nitric acid obtained may be converted to the white nitric acid.[10]
- NaNO3 + H2SO4 → HNO3 + NaHSO4
The dissolved NOx is readily removed using reduced pressure at room temperature (10–30 minutes at 200 mmHg or 27 kPa) to give white fuming nitric acid. This procedure can also be performed under reduced pressure and temperature in one step in order to produce less nitrogen dioxide gas.[18]
Dilute nitric acid may be concentrated by distillation up to 68% acid, which is a maximum boiling azeotrope. In the laboratory, further concentration involves distillation with either sulfuric acid or magnesium nitrate, which serve as dehydrating agents. Such distillations must be done with all-glass apparatus at reduced pressure, to prevent decomposition of the acid. Industrially, highly concentrated nitric acid is produced by dissolving additional nitrogen dioxide in 68% nitric acid in an absorption tower.[19] Dissolved nitrogen oxides are either stripped in the case of white fuming nitric acid, or remain in solution to form red fuming nitric acid. More recently, electrochemical means have been developed to produce anhydrous acid from concentrated nitric acid feedstock.[20]
Uses
Nitric acid in a laboratory
The main industrial use of nitric acid is for the production of fertilizers. Nitric acid is neutralized with ammonia to give ammonium nitrate. This application consumes 75–80% of the 26 million tonnes produced annually (1987). The other main applications are for the production of explosives, nylon precursors, and specialty organic compounds.[21]
Precursor to organic nitrogen compounds
In organic synthesis, industrial and otherwise, the nitro group is a versatile functional group. A mixture of nitric and sulfuric acids introduces a nitro substituent onto various aromatic compounds by electrophilic aromatic substitution. Many explosives, such as TNT, are prepared this way:
- C6H5CH3 + 3 HNO3 → C6H2(NO2)3CH3 + 3 H2O
Either concentrated sulfuric acid or oleum absorbs the excess water.
- H2S2O7 + H2O → 2 H2SO4
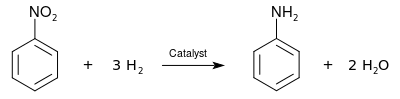
The nitro group can be reduced to give an amine group, allowing synthesis of aniline compounds from various nitrobenzenes:
Use as an oxidant
The precursor to nylon, adipic acid, is produced on a large scale by oxidation of «KA oil»—a mixture of cyclohexanone and cyclohexanol—with nitric acid.[21]
Rocket propellant
Nitric acid has been used in various forms as the oxidizer in liquid-fueled rockets. These forms include red fuming nitric acid, white fuming nitric acid, mixtures with sulfuric acid, and these forms with HF inhibitor.[22] IRFNA (inhibited red fuming nitric acid) was one of three liquid fuel components for the BOMARC missile.[23]
Niche uses
Metal processing
Nitric acid can be used to convert metals to oxidized forms, such as converting copper metal to cupric nitrate. It can also be used in combination with hydrochloric acid as aqua regia to dissolve noble metals such as gold (as chloroauric acid). These salts can be used to purify gold and other metals beyond 99.9% purity by processes of recrystallization and selective precipitation. Its ability to dissolve certain metals selectively or be a solvent for many metal salts makes it useful in gold parting processes.
Analytical reagent
In elemental analysis by ICP-MS, ICP-AES, GFAA, and Flame AA, dilute nitric acid (0.5–5.0%) is used as a matrix compound for determining metal traces in solutions.[24] Ultrapure trace metal grade acid is required for such determination, because small amounts of metal ions could affect the result of the analysis.
It is also typically used in the digestion process of turbid water samples, sludge samples, solid samples as well as other types of unique samples which require elemental analysis via ICP-MS, ICP-OES, ICP-AES, GFAA and flame atomic absorption spectroscopy. Typically these digestions use a 50% solution of the purchased HNO3 mixed with Type 1 DI Water.
In electrochemistry, nitric acid is used as a chemical doping agent for organic semiconductors, and in purification processes for raw carbon nanotubes.
Woodworking
In a low concentration (approximately 10%), nitric acid is often used to artificially age pine and maple. The color produced is a grey-gold very much like very old wax- or oil-finished wood (wood finishing).[25]
Etchant and cleaning agent
The corrosive effects of nitric acid are exploited for some specialty applications, such as etching in printmaking, pickling stainless steel or cleaning silicon wafers in electronics.[26]
A solution of nitric acid, water and alcohol, nital, is used for etching metals to reveal the microstructure. ISO 14104 is one of the standards detailing this well known procedure.
Nitric acid is used either in combination with hydrochloric acid or alone to clean glass cover slips and glass slides for high-end microscopy applications.[27] It is also used to clean glass before silvering when making silver mirrors.[28]
Commercially available aqueous blends of 5–30% nitric acid and 15–40% phosphoric acid are commonly used for cleaning food and dairy equipment primarily to remove precipitated calcium and magnesium compounds (either deposited from the process stream or resulting from the use of hard water during production and cleaning). The phosphoric acid content helps to passivate ferrous alloys against corrosion by the dilute nitric acid.[citation needed]
Nitric acid can be used as a spot test for alkaloids like LSD, giving a variety of colours depending on the alkaloid.[29]
Nuclear fuel reprocessing
Nitric acid plays a key role in PUREX and other nuclear fuel reprocessing methods, where it can dissolve many different actinides. The resulting nitrates are converted to various complexes that can be reacted and extracted selectively in order to separate the metals from each other.
Safety
Nitric acid is a corrosive acid and a powerful oxidizing agent. The major hazard posed by it is chemical burns, as it carries out acid hydrolysis with proteins (amide) and fats (ester), which consequently decomposes living tissue (e.g. skin and flesh). Concentrated nitric acid stains human skin yellow due to its reaction with the keratin. These yellow stains turn orange when neutralized.[30] Systemic effects are unlikely, and the substance is not considered a carcinogen or mutagen.[31]
The standard first-aid treatment for acid spills on the skin is, as for other corrosive agents, irrigation with large quantities of water. Washing is continued for at least 10–15 minutes to cool the tissue surrounding the acid burn and to prevent secondary damage. Contaminated clothing is removed immediately and the underlying skin washed thoroughly.
Being a strong oxidizing agent, nitric acid can react violently with many compounds.
Use in acid attacks
Nitric acid is one of the most common types of acid used in acid attacks.[32]
History
The discovery of mineral acids such as nitric acid is generally believed to go back to 13th-century European alchemy.[33] It has sometimes been claimed that nitric acid occurs in various earlier Arabic works such as the Ṣundūq al-ḥikma («Chest of Wisdom») attributed to Jabir ibn Hayyan or the Taʿwīdh al-Ḥākim attributed to the Fatimid caliph al-Hakim bi-Amr Allah,[34] but the conventional view is that nitric acid was first described in pseudo-Geber’s De inventione veritatis («On the Discovery of Truth», after c. 1300).[35] Descriptions of nitric acid are also found in works falsely attributed to Albert the Great and Ramon Llull, who prepared it by distilling a mixture containing niter and green vitriol and called it «eau forte» (aqua fortis).[36][37]
In the 17th century, Johann Rudolf Glauber devised a process to obtain nitric acid by distilling potassium nitrate with sulfuric acid. In 1776 Antoine Lavoisier cited Joseph Priestley’s work to point out that it can be converted from nitric oxide (which he calls «nitrous air»), «combined with an approximately equal volume of the purest part of common air, and with a considerable quantity of water.»[38][a] In 1785 Henry Cavendish determined its precise composition and showed that it could be synthesized by passing a stream of electric sparks through moist air.[36] In 1806, Humphry Davy reported the results of extensive distilled water electrolysis experiments concluding that nitric acid was produced at the anode from dissolved atmospheric nitrogen gas. He used a high voltage battery and non-reactive electrodes and vessels such as gold electrode cones that doubled as vessels bridged by damp asbestos.[39]
The industrial production of nitric acid from atmospheric air began in 1905 with the Birkeland–Eyde process, also known as the arc process.[40] This process is based upon the oxidation of atmospheric nitrogen by atmospheric oxygen to nitric oxide with a very high temperature electric arc. Yields of up to approximately 4–5% nitric oxide were obtained at 3000 °C, and less at lower temperatures.[40][41] The nitric oxide was cooled and oxidized by the remaining atmospheric oxygen to nitrogen dioxide, and this was subsequently absorbed in water in a series of packed column or plate column absorption towers to produce dilute nitric acid. The first towers bubbled the nitrogen dioxide through water and non-reactive quartz fragments. About 20% of the produced oxides of nitrogen remained unreacted so the final towers contained an alkali solution to neutralize the rest.[42] The process was very energy intensive and was rapidly displaced by the Ostwald process once cheap ammonia became available.
Another early production method was invented by French engineer Albert Nodon around 1913. His method produced nitric acid from electrolysis of calcium nitrate converted by bacteria from nitrogenous matter in peat bogs. An earthenware pot surrounded by limestone was sunk into the peat and staked with tarred lumber to make a compartment for the carbon anode around which the nitric acid is formed. Nitric acid was pumped out from an earthenware[43] pipe that was sunk down to the bottom of the pot. Fresh water was pumped into the top through another earthenware pipe to replace the fluid removed. The interior was filled with coke. Cast iron cathodes were sunk into the peat surrounding it. Resistance was about 3 ohms per cubic meter and the power supplied was around 10 volts. Production from one deposit was 800 tons per year.[43][44]
Once the Haber process for the efficient production of ammonia was introduced in 1913, nitric acid production from ammonia using the Ostwald process overtook production from the Birkeland–Eyde process. This method of production is still in use today.
Notes
- ^ He goes on to point out that «nitrous air» is the reverse, or «nitric acid deprived of air and water.»[38]
References
- ^ a b c d e f g NIOSH Pocket Guide to Chemical Hazards. «#0447». National Institute for Occupational Safety and Health (NIOSH).
- ^ «nitric acid_msds».
- ^ Bell, R. P. (1973), The Proton in Chemistry (2nd ed.), Ithaca, NY: Cornell University Press
- ^ a b Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A22. ISBN 978-0-618-94690-7.
- ^ «Safety Data Sheet» (PDF). fishersci.com. Fisher Scientific International. 23 March 2015. p. 2. Archived (PDF) from the original on 10 September 2022. Retrieved 4 October 2022.
- ^ a b Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. pp. 465–471. ISBN 978-0-08-037941-8.
- ^ Dean, John (1992). Lange’s Handbook of Chemistry (14 ed.). McGraw-Hill. pp. 2.79–2.80. ISBN 978-0-07-016194-8.
- ^ a b Cox, A. P.; Ellis, M. C.; Attfield, C. J.; Ferris, A. C. (1994). «Microwave spectrum of DNO3, and average structures of nitric and nitrous acids». J. Mol. Struct. 320: 91–106. doi:10.1016/0022-2860(93)08008-R.
- ^ Luzzati, V. (1951). «Structure cristalline de l’acide nitrique anhydre». Acta Crystallographica (in French). 4 (2): 120–131. doi:10.1107/S0365110X51000404.
- ^ a b Allan, D. R.; Marshall, W. G.; Francis, D. J.; Oswald, I. D. H.; Pulham, C. R.; Spanswick, C. (2010). «The crystal structures of the low-temperature and high-pressure polymorphs of nitric acid» (PDF). Dalton Trans. (Submitted manuscript). 39 (15): 3736–3743. doi:10.1039/B923975H. PMID 20354626.
- ^ Cox, A. P.; Riveros, J. M. (1965). «Microwave Spectrum and Structure of Nitric Acid». 42: 3106. doi:10.1063/1.1696387.
- ^ IUPAC SC-Database A comprehensive database of published data on equilibrium constants of metal complexes and ligands
- ^ a b c d Catherine E. Housecroft; Alan G. Sharpe (2008). «Chapter 15: The group 15 elements». Inorganic Chemistry (3rd ed.). Pearson. ISBN 978-0-13-175553-6.
- ^ Ōsawa, Eiji (December 2007). «Recent progress and perspectives in single-digit nanodiamond». Diamond and Related Materials. 16 (12): 2018–2022. Bibcode:2007DRM….16.2018O. doi:10.1016/j.diamond.2007.08.008.
- ^ Sherman, Henry Clapp (2007). Methods of organic analysis. Read Books. p. 315. ISBN 978-1-4086-2802-7.
- ^ Knowles, Frank (2007). A practical course in agricultural chemistry. Read Books. p. 76. ISBN 978-1-4067-4583-2.
- ^ Considine, Douglas M., ed. (1974). Chemical and process technology encyclopedia. New York: McGraw-Hill. pp. 769–72. ISBN 978-0-07-012423-3.
- ^ PubChem. «Nitric acid». pubchem.ncbi.nlm.nih.gov. Retrieved 2020-08-03.
- ^ Urbanski, Tadeusz (1965). Chemistry and technology of explosives. Oxford: Pergamon Press. pp. 85–86. ISBN 978-0-08-010239-9.
- ^ US 6200456, Harrar, Jackson E.; Quong, Roland & Rigdon, Lester P. et al., «Large-scale production of anhydrous nitric acid and nitric acid solutions of dinitrogen pentoxide», published April 13, 1987, issued March 13, 2001, assigned to United States Department of Energy
- ^ a b Thiemann, Michael; Scheibler, Erich; Wiegand, Karl Wilhelm. «Nitric Acid, Nitrous Acid, and Nitrogen Oxides». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a17_293.
- ^ Clark, John D (1972). Ignition!. Rutgers University Press. ISBN 978-0-8135-0725-5.
- ^ «BOMARC Summary». BILLONY.COM. Retrieved 2009-05-28.
- ^ Eaton, Andrew D.; Greenberg, Arnold E.; Rice, Eugene W.; Clesceri, Lenore S.; Franson, Mary Ann H., eds. (2005). Standard Methods For the Examination of Water and Wastewater (21 ed.). American Public Health Association. ISBN 978-0-87553-047-5. Also available on CD-ROM and online by subscription.[page needed]
- ^ Jewitt, Jeff (1997). Hand-applied finishes. Taunton Press. ISBN 978-1-56158-154-2. Retrieved 2009-05-28.
- ^ Muraoka, Hisashi (1995) «Silicon wafer cleaning fluid with HNO3, HF, HCl, surfactant, and water» U.S. Patent 5,635,463
- ^ Fischer, A. H.; Jacobson, K. A.; Rose, J.; Zeller, R. (1 May 2008). «Preparation of Slides and Coverslips for Microscopy». Cold Spring Harbor Protocols. 2008 (6): pdb.prot4988. doi:10.1101/pdb.prot4988. PMID 21356831.
- ^ Curtis, Heber D. (February 1911). «Methods of Silvering Mirrors». Publications of the Astronomical Society of the Pacific. 23 (135): 13. Bibcode:1911PASP…23…13C. doi:10.1086/122040. S2CID 120665136.
- ^ O’Neal, Carol L; Crouch, Dennis J; Fatah, Alim A (April 2000). «Validation of twelve chemical spot tests for the detection of drugs of abuse». Forensic Science International. 109 (3): 189–201. doi:10.1016/S0379-0738(99)00235-2. PMID 10725655.
- ^ May, Paul (November 2007). «Nitric acid». Retrieved 2009-05-28.
- ^ «Nitric acid: Toxicological overview». Health Protection Agency. Retrieved 2011-12-07.
- ^ Rees, Anna (1 October 2013). «Freeze mob to highlight the issue of acid attacks». RESET.to. Retrieved 25 June 2021.
- ^ Multhauf, Robert P. (1966). The Origins of Chemistry. London: Oldbourne. pp. 140-141, quote: «But among them we find the rudiments of processes which were finally to lead to the discovery of the mineral acids, sulphuric, hydrochloric and nitric. The mineral acids manifest themselves clearly only about three centuries after al-Razi, in the works of Europeans […]». Needham, Joseph; Ping-Yü, Ho; Gwei-Djen, Lu; Sivin, Nathan (1980). Science and Civilisation in China. Volume 5, Chemistry and Chemical Technology. Part IV, Spagyrical Discovery and Invention: Apparatus, Theories and Gifts. Cambridge: Cambridge University Press. ISBN 978-0-521-08573-1. p. 195, quote: «It is generally accepted that mineral acids were quite unknown both to the ancients in the West and to the Arabic alchemists.» Al-Hassan, Ahmad Y. (2001). Science and Technology in Islam: Technology and applied sciences. UNESCO. ISBN 978-92-3-103831-0. p. 59, quote: «The text is given here in full because of the prevailing notion that Islamic chemists did not produce mineral acids.» Karpenko, Vladimír; Norris, John A. (2002). «Vitriol in the History of Chemistry». Chemické listy. 96 (12): 997–1005. p. 1002, quote: «[…] dating the discovery of nitric acid is likewise uncertain. It is estimated that this discovery took place after 1300 […] A passage from the second part of Pseudo-Geber’s Summa perfectionis […] was long considered to be the earliest known recipe for sulfuric acid […]». Newman, William R. (2006). Atoms and Alchemy: Chymistry and the Experimental Origins of the Scientific Revolution. Chicago: University of Chicago Press. ISBN 978-0226576961. p. 98, quote: «[…] between the time when the Summa perfectionis was written and the seventeenth century, the mineral acids–sulfuric, hydrochloric, nitric, and the mixture of the latter two, called aqua regia, had been discovered.»
- ^ For the claims regarding the Ṣundūq al-ḥikma, see Al-Hassan 2001, p. 62; Holmyard, John Eric (1931). Makers Of Chemistry. Oxford: Clarendon Press. p. 60. For the claim regarding the Taʿwīdh al-Ḥākim, see Al-Hassan 2001, p. 62.
- ^ Karpenko & Norris 2002, p. 1002. As Karpenko & Norris note, the uncertain dating of the pseudo-Geber corpus (which was probably written by more than one author) renders the date of its description of nitric acid equally uncertain. According to Al-Hassan 2001, p. 62, recipes for the preparation of nitric acid also occur in the Liber Luminis luminum, a Latin treatise usually attributed to Michael Scot (died before 1236) but perhaps translated by him from the Arabic. One of the manuscripts of the Liber Luminis luminum mentions that it was translated by Michael Scot; see Moureau, Sébastien (2020). «Min al-kīmiyāʾ ad alchimiam. The Transmission of Alchemy from the Arab-Muslim World to the Latin West in the Middle Ages». Micrologus. 28: 87–141. hdl:2078.1/211340. p. 115 (no. 22). Al-Hassan 2001 mentions Abu Bakr al-Razi as the work’s author, but this is likely a conflation with several other Latin treatises called Liber Luminis luminum that were sometimes attributed to al-Razi; see Moureau 2020, p. 107 (no. 5), p. 114 (no. 20), pp. 114–115 (no. 21).
- ^ a b Chisholm, Hugh, ed. (1911). «Nitric Acid» . Encyclopædia Britannica. Vol. 19 (11th ed.). Cambridge University Press. pp. 711–712.
- ^ Thomson, Thomas (1830). The history of chemistry. Vol. 1. Cushing/Whitney Medical Library, Yale University. London, H. Colburn, and R. Bentley. p. 40.
- ^ a b Gillispie, Charles Coulston (1960). The Edge of Objectivity: An Essay in the History of Scientific Ideas. Princeton, NJ: Princeton University Press. pp. 223–24. ISBN 0-691-02350-6.
- ^ Davy, John, ed. (1839). «On Some Chemical Agencies of Electricity». The Collected Works of Sir Humphry Davy. Vol. 5. pp. 1–12.
- ^ a b Mellor, J. W. (1918). Modern Inorganic Chemistry. Longmans, Green and Co. p. 509.
- ^ Martin, Geoffrey; Barbour, William (1915). Industrial Nitrogen Compounds and Explosives. Crosby Lockwood and Son. p. 21.
- ^ Knox, Joseph (1914). The Fixation of Atmospheric Nitrogen. D. Van Nostrand Company. pp. 45–50.
- ^ a b Dary, G. (1913). «The Production of Nitrates by the Direct Electrolysis of Peat Deposits». London Electrical Review. 73: 1020–1021.
- ^ Hale, Arthur (1919). The Manufacture of Chemicals by Electrolysis. D. Van Nostrand Co. pp. 30–32. Retrieved 2019-09-15.
External links
- NIOSH Pocket Guide to Chemical Hazards
- National Pollutant Inventory – Nitric Acid Fact Sheet
- Calculators: surface tensions, and densities, molarities and molalities of aqueous nitric acid
- v
- t
- e
Salts and covalent derivatives of the nitrate ion
Определение и формула
Неорганическая сильная одноосновная кислота.
Формула
HNO3HNO_3
Свойства азотной кислоты
Физические свойства
Представляет собой бесцветную жидкость, дымящую на воздухе. С водой смешивается в любых соотношениях. Концентрированной азотной кислотой называют растворы с концентрацией HNO3, равной 60-70%, «дымящей азотной кислотой» 95-98%-ные растворы азотной кислоты.
| Свойство | Описание |
|---|---|
| плотность | 1,51 г/см3 |
| молярная масса | 63,01 г/моль |
| температура кипения | +82,6°C |
| температура плавления | -41,59 ᵒС |
Химические свойства
В химических реакциях азотная кислота может выступать в роли сильной одноосновной кислоты, либо окислителя. Азотная кислота высокой концентрации обычно окрашена в бурый цвет за счет присутствия в ней оксида азота (IV), образующегося по уравнению:
4HNO3⟶4NO2↑+2H2O+O24HNO_3 longrightarrow 4NO_2↑+ 2H_2O + O_2↑
Такое же превращение азотная кислота претерпевает при нагревании.
Кислотные свойства
- Диссоциация в воде
HNO3⟷H++NO3−HNO3 longleftrightarrow H^+ + NO_3^-
- Взаимодействие с основными и амфотерными оксидами
MgO+2HNO3⟶Mg(NO3)2+H2OMgO + 2HNO_3 longrightarrow Mg(NO_3)_2 + H_2O
ZnO+2HNO3⟶Zn(NO3)2+H2OZnO + 2HNO_3 longrightarrow Zn(NO_3)_2 + H_2O
- Взаимодействие с основаниями и амфотерными гидроксидами
NaOH+HNO3⟶NaNO3+H2ONaOH + HNO_3 longrightarrow NaNO_3 + H_2O
Zn(OH)2+2HNO3⟶Zn(NO3)2+2H2OZn(OH)_2 + 2HNO_3 longrightarrow Zn(NO_3)_2 + 2H_2O
- Взаимодействие с солями слабых кислот (карбонатами, силикатами)
BaCO3+2HNO3⟶Ba(NO3)2+CO2↑+H2OBaCO_3 + 2HNO_3 longrightarrow Ba(NO_3)_2 + CO_2↑ + H_2O
Окислительные свойства
В азотной кислоте атом азота находится в высшей степени окисления +5, благодаря чему азотная кислота любой концентрации может выступать в роли окислителя. Азот может восстанавливаться до степеней окисления от +4 до -3. Возможные продукты восстановления азотной кислоты при взаимодействии с металлами представлены в таблице 1.
Таблица 1. Типичные продукты восстановления азотной кислоты
| Степень окисления азота | +4 | +2 | +1 | 0 | -3 |
|---|---|---|---|---|---|
| Формула вещества | NO2 | NO | N2O | N2 | NH4NO3 |
Увеличение активности металла и разбавление кислоты способствуют более полному восстановлению азотной кислоты.
- Взаимодействие с металлами
Железо (Fe), алюминий (Al), хром (Cr) пассивируются холодной концентрированной азотной кислотой.
Азотная кислота не взаимодействует с золотом, металлами платиновой группы и танталом. В остальных случаях продукты (табл. 2) зависят от концентрации HNO3:
Таблица 2. Зависимость продуктов реакции взаимодействия азотной кислоты с металлами от концентрации кислоты и активности металла
| Формула кислоты | Концентрация | Активность металла | Продукты взаимодействия с кислотой |
| HNO3 | Концентрированная | Независимо от активности металла | Соль + NO2 + Н2О |
| Разбавленная | Активный металл Li-Zn | Соль + N2 + Н2О | |
| Металл средней активности Fe-Pb | Соль + N2O + Н2О | ||
| Неактивный металл (после Н2) | Соль + NO + Н2О | ||
| Очень разбавленная | Активный металл | Соль + NH4NO3 + Н2О |
- Взаимодействие с неметаллами
При взаимодействии с неметаллами азотная кислота восстанавливается до NONO или NO2NO_2:
S+6HNO3S + 6HNO_3(конц.) ⟶H2SO4+6NO2↑+2H2Olongrightarrow H_2SO_4 + 6NO_2↑ + 2H_2O
S+2HNO3S + 2HNO_3(разб.) ⟶H2SO4+2NO↑longrightarrow H_2SO_4 + 2NO↑
- Взаимодействие со сложными веществами-восстановителями
FeS+4HNO3FeS + 4HNO_3(разб.) ⟶Fe(NO3)3+S+NO↑+2H2Olongrightarrow Fe(NO_3)_3 +S + NO↑ + 2H_2O
Взаимодействие с органическими соединениями
Взаимодействие углеводородов с азотной кислотой используется для введения в молекулу органического вещества нитрогруппы –NO2NO_2. В результате нитрования углеводородов образуются нитросоединения.
- Реакция Коновалова (взаимодействие разбавленной азотной кислоты с алканами):
CH4+HNO3⟶CH3NO2+H2OCH_4 + HNO_3 longrightarrow CH_3NO_2 + H_2O
- Нитрование аренов
C6H6+HNO3⟶C6H5NO2+H2OC_6H_6 + HNO_3 longrightarrow C_6H_5NO_2 + H_2O
Источники получения
В природе не встречается.
Способом производства является каталитическое окисление синтетического аммиака на платиновом катализаторе до смеси оксидов азота с дальнейшим поглощением их водой:
4NH3+5O2⟶4NO+6H2O4NH_3 + 5O_2 longrightarrow 4NO + 6H_2O
2NO+O2⟶2NO22NO + O_2 longrightarrow 2NO_2
4NO2+O2+2H2O⟶4HNO34NO_2 + O_2 + 2H_2O longrightarrow 4HNO_3
Применение
- Производство минеральных удобрений (нитратов);
- органический синтез (получение нитроалканов, анилиза, нитроцеллюлоз, тринитротолуола);
- производство лекарственных средств (нитроглицерин);
- военная промышленность (производство взрывчатых веществ, в качестве окислителя ракетного топлива, синтез отравляющих веществ);
- травление печатных форм в станковой графике;
- ювелирное дело (определение золота в сплаве).
Тест по теме «Азотная кислота»
Ее хранят в темных емкостях. Свет не любит азотная кислота. При ярком освещении вещество разлагается на бурый газ – один из оксидов азота, и воду. В полумраке же, кислота с водой легко смешивается в любых пропорциях. У вещества есть и кристаллическое состояние. Оно может быть моноклинным и ромбическим. Это указывает на форму ячеек кристаллической решетки.
Моноклинная составлена из наклоненных параллелепипедов, а ромбическая, соответственно, из ромбов. Отличаются ли свойства растворов кислоты от ее кристаллов, как вещество добывается и где применяется? Вопросы заданы, остается дать на низ ответы.
Свойства азотной кислоты
В обычных условиях кристаллическую кислоту можно лицезреть лишь в жарких странах. В твердое состояние бесцветная жидкость переходит лишь при 42-ух градусах Цельсия. До этой отметки вещество остается жидким и парит. При этом, реагент источает резкий, удушливый запах. С ним, собственно, связана история открытия азотной кислоты. Обнаружил ее Даниэль Резерфорд.
Шотландец изучал продукты сжигания серы, угля, фосфора. В ходе работ выделялся газ, который химик назвал удушливым воздухом. Ученый отметил, что вещество не поддерживает горение и непригодно для дыхания. Позже, выяснилась формула азотной кислоты: — HNO3. Получается, вещество одноосновное. Так именуют кислоты, в состав которых входит лишь один атом водорода. С водой вещество смешивается в любых пропорциях. Поэтому, существует концентрированная азотная кислота и неконцентрированная.
Первая активно дымит, то есть, летуча. Химические свойства концентрата разнятся с разбавленой версией. Если кислоты в растворе около 60%, он будет реагировать со всеми металлами кроме алюминия, железа, иридия, хрома, натрия, золота и платины. Отсюда вывод, в какой таре нужно хранить вещество. Золотые и платиновые фляги, конечно, не выгодны.
А вот емкости из железа и алюминия и бюджетны, и надежны, поскольку закрывают кислоту от света. Главное, не выбрать тару из меди. Азотная кислота ее растворит. Реагируя с металлами, концентрированный раствор азотной кислоты выделяет бурый газ. Его формула: — NО2. Параллельно, образуются соли кислоты. В зависимости от растворенного металла, реакции разнятся.
При взаимодействии с рядом до магния, образуются диоксиды, и выделяется кислород. Реакция с солями металлов, находящимися после магния до меди, дает бурый газ, оксид азота и кислород. Если к кислоте присоединится соль любого металла после меди, металл отделится. Вместе с ним выделяются бурый газ и кислород. Разбавленная азотная кислота реагирует с большинством тех же металлов, но, окисляется при этом до аммиака.
К такому исходу приводит взаимодействие, к примеру, с цинком и элементами щелочноземельной группы. В реакцию вступает и железо. Так что, разбавленную кислоту в емкостях из сплавов с феррумом лучше не хранить. Итогом взаимодействия с азотной кислотой разбавленного типа может стать не только аммиак, но и аммиачная селитра. Самый редкий вариант – закись азота.
Ее даст, к примеру, реакция с магнием. С остальными металлами азотная кислота образует оксид азота. Его можно получить, в частности, при взаимодействии с серебром. Выпадет оксид аргентума, образуется вода и оксид азота. По этой же схеме проходят реакции кислоты с неметаллами, только, вместо солей формируется серная кислота.
Из реакций с другими кислотами примечательно смешивание с соляной. Последней, берут 3 части, а первой – одну. Получается царская водка. Ее так назвали, поскольку вещество растворяет даже золото – металл правителей, сильных мира сего. На такое не способна ни одна из чистых кислот. Благородные металлы им поддаются редко, а золото, вовсе, никогда.
Добыча азотной кислоты
В малых количествах вещество возможно добывать даже из воздуха, причем, в прямом смысле. Не секрет, что азот – одна из составляющих атмосферы. На 15-ый газ в ней приходятся 78% . Азот реагирует с кислородом, образуя оксид. Дальнейшее окисление дает диоксид азота. Это тот самый бурый газ. Он-то и реагирует с водой, взвесь которой, как известно, имеется в воздухе. Вступая в контакт с облаками, туманом, бурый газ переходит в азотную кислоту.
Массовая доля азотной кислоты в атмосфере столь мала, что вещество не наносит вред человеку, да и другим живым организмам. Для промышленной добычи кислота из воздуха тоже не годится. На заводах пользуются иными схемами. Первая: — производство азотной кислоты из аммиака. Сначала, проводят его конверсию, то есть, дробление состава исходной газовой смеси.
Реакция проходит на платинородиевых сетках при температуре около 1000 градусов Цельсия. Так получают оксид азота. Его окисляют до диоксида. Это вторая стадия процесса. После, оксиды азота абсорбируют водой. В итоге, получается азотная кислота и чистая вода. Описанный метод приводит к образованию разбавленной кислоты. Возможна последующая концентрация. Поэтому, метод наиболее популярен, ведь потребителям нужна, как насыщенная, так и ненасыщенная кислоты.
Работая с аммиаком, промышленники «убивают одним выстрелом двух зайцев». Второй метод производства реактива приводит сразу к получению концентрата. Речь о прямом синтезе из оксидов азота. Берут жидкие. Они взаимодействуют с водой и кислородом. Такие реакции с азотной кислотой проходят под давлением в 5 мегапаскалей. Получается диоксид азота. В обычных условиях он переходит в жидкое состояние. Окисление аммиака дает двойной оксид азота. В газовой смеси его около 11%. Сжижжают диоксид под давлением. При стандартных условиях переход невозможен.
Применение азотной кислоты
Как составная царской водки азотная кислота является частью пробирных кислот. С их помощью изучают качество золота. Без соответствующих исследований слитки не поступят в банки, а украшения – на прилавки магазинов. Прежде чем апробировать и продать драгоценный металл, его нужно добыть. В этом тоже помогают азотная кислота и царская водка. Ими обрабатывают руды, выводя нужные элементы в раствор.
Остается осадить металлы и осушить, очистить от примесей. Так добывают не только благородные, но и неблагородные элементы. Из металлов, как известно, делают сплавы, а из них, к примеру, технику. Если рассматривать воздушную и космическую, в них присутствует чистая кислота. Ее примешивают к топливу, получая оксид. Азотная кислота выступает в роли окислителя. В его присутствии процесс сгорания эффективнее, выделяется больше тепла. Так что, часть реагента производят для ракетного топлива.
Соль азотной кислоты – сырье для производства удобрений. Наиболее популярны: нитрат кальция, нитрат натрия, нитрат аммония и нитрат калия. Все это соли, объединенные названием «селитры». Азот позволяет растениям быстро развиваться, повышает урожайность. Дело в том, что 15-ый элемент входит в состав хлорофилла. Это зеленый пигмент растений, отвечающий за усвоение энергии Солнца.
Чем больше освоенной энергии, тем лучше развитие трав, кустарников, деревьев. Слово «селитра» на слуху и у пиротехников. Азотная кислота – основа взрывчатых веществ. Аммиачной селитры в большинстве из них около 60%. Остатки – дизельное топливо, или иное горючее. Получить можно, как безобидный фейерверк, так и военную бомбу.
Цена азотной кислоты
Азотная кислота, как и большинство востребованных кислот, бывает чистой и технической, отягощенной примесями. Последняя дешевле. Чистый реагент дороже. Для справки, ГОСТ 4461-77 – норма для очищенной кислоты. Реагент российского производства стоит в районе 30-55-ти рублей за килограмм. Ценник зависит от концентрации раствора.
Для технической кислоты верхний ценовой предел, обычно, составляет 40 рублей за кило. Предусмотрена и большая фасовка. Есть, к примеру, 25-литровые канистры, в которые разливается азотная кислота. Купить реагент с максимальной выгодой позволяют оптовые заказы. Такие уходят на предприятия, где знают правила обращения с реагентом.
Он разъедает не только металлы, но и слизистые. Пары вещества могут затруднить дыхание, повредить трахеи, выстилающие ткани носа. Поэтому, с кислотой работают лишь в масках. При нарушении правил, кроме трудностей с дыханием, наступает отравление. Интоксикация выражается в рвоте, чесотке, нарушениях зрения, обоняния. Более-менее безобидны лишь слабые растворы реагента. Именно такие, к примеру, используют в школьных лабораториях. Учиться обращению с химическими реагентами стоит с малых лет.
Видео об азотной кислоте