Существуют несколько несложных способов, как определить белок. Для этого воспользуемся некоторыми его характерными свойствами.
Одна из групп, на которые разделяются все существующие белки – это белки альбумины. Эта группа наиболее распространена и наиболее известна. К альбуминам относится белок из куриных яиц, содержится в крови человека и животных, а также в растениях, мышцах и молоке.
Чтобы определить эту группу белка, воспользуемся её свойствами растворимости в воде. Если альбумины нагревать – они изменяют свою структуру, то есть «сворачиваются».
Итак, попробуем определить белок. Используем, например, сыворотку коровьей крови или яичный сырой белок. Поместим его в кастрюльку, можно разбавить водой и буден нагревать на медленном огне до кипения. Растворим немного соли в белковом растворе и прильём немного Оцет (уксусную кислоту).
В результате реакции увидим, что из раствора будут выпадать белые хлопья.
Определить белок можно и другим простым способом: белок изменяют структуру под воздействием спирта, поэтому достаточно к белковому раствору прилить такой же объём спирта. Так же, как и в предыдущем случае, мы увидим выпадение белка в виде белых хлопьев.
А вот следующий интересный опыт можно назвать ещё и полезным. Определить белок можно, используя соли тяжёлых металлов. Например, соль меди, железа, свинца (медный купорос CuSO4, хлориды железа FeCl2, FeCl3, нитрат свинца Pb(NO3)4 и др.). Если к водному раствору белка добавить одну (или несколько) таких солей, то выпадает осадок химического соединения белка с тяжёлым металлом. Для нашего организма, да и для организма животных соли тяжёлых металлов – ядовитые вещества, способствующие разрушению белка!
Определить белок также можно с помощью действия не него минеральных кислот (кроме ортофосфорной H3PO4). Если в пробирку налить азотную кислоту, а затем, осторожно, по стенке пробирки капнуть раствор белка, то по окружности стенки пробирки образуется белое кольцо выпавшего белка.
Ещё одна группа белков, называемая глобулинами – в отличии альбуминов не — растворяется в воде. Глобулины хорошо растворимы, если в растворе присутствуют соли. Содержатся глобулины в некоторых частях растений, молоке и мышцах живых организмов. К тому же установлено, что глобулины, выявленные в растениях, растворяются в 70% спирте!
И ещё одна группа белков – склеропротеины, к которым относятся ткани живых организмов, например, ногти, волосы, роговица глаза, а также костные ткани, рога животных и шерсть. Склеропротеины не растворяются в воде и не растворяются в спирте, но при их обработке сильными растворами кислот они приобретают способность растворяться, при этом частично разлагаться.
Глобулины и склеропротеины можно определить с помощью ксантопротеиновой реакции. Это цветная реакция определения белка, при которой, если нагреть пробу, содержащую белок, то проба изменит цвет на жёлтый. Затем при нейтрализации кислоты щёлочью цвет поменяется на оранжевый.
Такую реакцию, возможно, некоторым уже приходилось наблюдать на собственном опыте, когда на кожу попадала азотная кислота.
Следующая реакция по определению белка — биуретовая, которая заключается в добавлении разбавленного раствора натриевой или калиевой щёлочи к раствору белка. В тот же раствор необходимо добавить несколько капель раствора медного купороса. Наблюдаем изменение цвета раствора на красный, затем фиолетовый и сине-фиолетовый.
Если белок длительно нагревать в растворе кислот, то он будет расщепляться на составляющие – пептиды, затем до составляющих его аминокислот, что применяют в промышленности для приготовления приправ к пище.
Автор: Катранжи Оксана Васильевна
Организация: МБОУ СОШ №4
Населенный пункт: Краснодарский край, Красноармейского р–на, ст–ца Полтавская
Сценарий урока.
Урок 13. Биология 10 класс (углубленный уровень)
Тема: Лабораторная работа 5 «Обнаружение белков, углеводов, липидов с помощью качественных реакций».
Тип урока: урок лабораторной работы.
Цель урока: изучить примеры качественных реакций на белки, углеводы и липиды растительных и животных тканей.
Задачи:
— образовательная: изучить примеры качественных реакций на белки, углеводы и липиды растительных и животных тканей; провести лабораторную работу 5 «Обнаружение углеводов, липидов с помощью качественных реакций», сделать выводы по проделанной работе;
— развивающая: развивать стремление к познанию химического строения живых организмов;
— воспитательная: воспитывать у учащихся навыки самостоятельного поиска информации, ее интерпретации, планирования и выполнения эксперимента.
Оборудование: ТСО (технические средства обучения кабинета биологии: ПК в сборе, МФУ лазерный Brother, интерактивная панель Jnfo RAY, планшетные регистраторы Einstein (мобильный класс-комплект устройств с внешними датчиками pH), ЦОР (ццифровые образовательные ресурсы — интерактивное учебное пособие «Наглядная биология. Химия клетки. Вещества клетки и ткани»), учебник биологии для 10 класса под ред. В.К.Шумного, Г.М.Дымшица, коллекция «Семена и плоды», лабораторное оборудование и материалы для лабораторной работы учащихся (расписано подробно в ходе лабораторной работы) — микролаборатория биологическая, образцы животных и растительных жиров, углеводов, реактивы.
Продолжительность урока составляет 45 минут.
Для дистанционной формы обучения необходимо использовать ссылки на видео из сети интернет с указанными в ходе работ опытами (или видеосъемки опытов, сделанные учителем в кабинете биологии), а так же дополнительные материалы: таблица качественных реакций на основные классы органических соединений, инструкция по проведению лабораторной работы, инструкция по технике безопасности.
Форма работы учащихся: групповая (задания распределяются по 2 группам), парная (химический эксперимент выполняется парой учащихся, сидящих за одной партой) и индивидуальная (заполнение таблицы с результатами эксперимента и написанием выводов).
Планируемые образовательные результаты:
|
Предметные |
Коммуникативные |
Личностные |
|
— различать неорганические и органические вещества клетки, объяснять их значение для организма. — наблюдать демонстрацию опытов учителем, научится воспроизводить эти опыты самостоятельно, анализировать их результаты; — формировать умение работы с наглядным материалом и лабораторным оборудованием; — формировать умение делать выводы. — знать и соблюдать правила поведения в кабинете биологии во время выполнения лабораторной работы. |
-излагать свое мнение в монологе, аргументируя его, уметь вести диалог; уметь корректировать свое мнение, понимать позицию оппонента, признавать свои погрешности и недочеты; — работать в группах или парах. |
— формировать познавательные установки и мотивы, направленные на изучение живой природы; — формировать понимание важности точки зрения товарища по группе; — научить ставить групповой успех выше личного, сопереживать успеху и неудачам товарищей. |
Урок способствует формированию у учеников следующих УУД:
|
Познавательные |
Регулятивные |
Личностные |
|
— находить достоверную информацию, необходимую для решения задач; — анализировать и обобщать учебный материал; — устанавливать причинно-следственные связи. — формировать умение классифицировать различные органические вещества и уметь распознавать их в тканях растительных и животных организмов. |
— определять цель, проблему в деятельности; -выбирать средства достижения цели; — выдвигать версии; — работать по учебному плану. |
— уметь корректно вести диалог, уважать мнение товарища, но уметь отстаивать свою позицию; — вырабатывать уважительно-доброжелательное отношение к окружающим. |
Ход урока.
I. Организационный момент (6 мин).
Записать в тетради тему лабораторной работы. Постановка цели и выдвижение рабочей гипотезы. Распределение учащихся по рабочим группам. Инструктаж по технике безопасности.
Знакомство с инструкцией по технике безопасности перед выполнением лабораторной работы. Учащиеся расписываются в журнале инструктажей.
Постановка цели. Определить с помощью цветных реакций наличие белков, жиров (липидов) и углеводов в исследуемых образцах.
Выдвижение гипотезы. Присутствие белков, жиров (липидов) и углеводов в биологических объектах или растворах можно определить с помощью цветных реакций, протекание которых обусловлено наличием в исследуемых объектах специфических групп и связей.
Класс делится на две рабочие группы.
Первая группа определяет наличие в исследуемых образцах и выполняет качественные реакции на белки и жиры, а вторая — на углеводы (глюкоза и сахароза, крахмал).
Учащиеся с помощью учителя ставят перед собой цель выполняемой на уроке части проекта, намечают задачи, выполнение которых приведет к поставленной цели, знакомятся с инструкцией по проведению лабораторной работы, разбивают проект на этапы последовательных действий, определяют, какие именно реакции будут использовать в ходе работ, распределяют обязанности членов группы, анализируют по итогам работы полученный продукт проекта.
II. Актуализация новых знаний у учащихся – теоретическая подготовка к выполнению лабораторной работы 5 «Обнаружение белков, углеводов, липидов с помощью качественных реакций» (6 мин.)
Подготовка к лабораторной работе. Учитель знакомит учащихся с органическими веществами живой клетки, используя ТСО и ЦОР — интерактивное учебное пособие «Наглядная биология. Химия клетки. Вещества клетки и ткани» и коллекцию «Семена и плоды». Богаты белком и крахмалом семена злаков, крахмалом – клубни картофеля, жирами – семена масличных культур (подсолнечник), углеводами глюкозой и сахарозой сочные плоды. Животные белки представлены яичным белком.
III. Практическое применение полученных знаний – выполнение лабораторной работы 5 «Обнаружение белков, углеводов, липидов с помощью качественных реакций» (18 мин.)
Лабораторное оборудование: водяная баня, спиртовки, штативы лабораторные, штативы с пробирками, мерные стаканчики, стеклянные палочки, пипетки, пинцеты, фарфоровая ступка с пестиком, фильтровальная бумага, чашки Петри, спички.
Реактивы: водный раствор яичного белка (белок одного куриного яйца отделяют от желтка, растворяют в 15–20-кратном объеме дистиллированной воды, затем раствор фильтруют через марлю, сложенную в 3–4 слоя, и хранят в холодильнике;10 % и 30% раствор гидроксида натрия; 1 % раствор сульфата меди; 1 % раствор ацетата свинца; концентрированная азотная кислота; 1 % раствор крахмала, 20% серная кислота, 1% раствор йода, 1 % раствор сахарозы и глюкозы, 5 % раствор сульфата меди, аммиачный раствор оксида серебра, жир растительный, вода, 2 % раствор Co(NO3)2, этанол, семена подсолнечника, крахмальный клейстер, мука, клубень картофеля.
1 группа.
Ход работ.
Задание 1. Биуретовая реакция.
В щелочной среде белки, а также продукты их гидролиза – пептиды дают фиолетовое или красно-фиолетовое окрашивание с солями меди. Реакция обязана наличию пептидных связей в белках: Интенсивность окраски зависит от длины полипептида.
- В пробирку налейте 5 капель раствора яичного белка, затем 10 капель 10 %-го раствора щелочи.
- Добавьте 1–2 капли раствора сульфата меди, смесь перемешайте. Признак реакции — появляется красно-фиолетовое окрашивание.
- Из муки и воды в чашке Петри стеклянной палочкой замесите кусочек теста, промойте его в воде пинцетом. Получившуюся клейковину – белок протестируйте биуретовой реакцией. Что наблюдаете?
- Записать название реакции, условия проведения, ее признаки и выводы по эксперименту в таблицу Оформление результатов.
Задание 2. Ксантопротеиновая реакция.
Реакция характерна для некоторых ароматических аминокислот (фенилаланина, тирозина, триптофана), а также для пептидов, их содержащих. При действии азотной кислоты образуется нитросоединение желтого цвета. Далее нитропроизводные могут реагировать со щелочью с образованием натриевой соли, имеющей желто-оранжевое окрашивание:
Данную работу необходимо выполнять в вытяжном шкафу, соблюдая особую осторожность!
Выполняет 1 ученик от группы под руководством учителя.
- В пробирку налейте 5 капель раствора яичного белка и ОСТОРОЖНО по стенке прибавьте 3–4 капли концентрированной азотной кислоты.
- Смесь осторожно нагрейте. Выпадает осадок, который окрашивается в желтый цвет.
- После охлаждения в пробирку ОСТОРОЖНО по стенке прилейте 10 капель 30 %-го раствора NaOH, желтая окраска переходит в оранжевую.
- Записать название реакции, условия проведения, ее признаки и выводы по эксперименту в таблицу Оформление результатов.
Задание 3. Обнаружение и эмульгирование жиров (липидов).
Лецитин, входящий в состав желтка куриного яйца, относится к фосфолипидам. Он не растворяется в воде (в отличие от белка куриного яйца), но растворяется в теплом этиловом спирте. Исходя из этого, предположите, каким образом можно обнаружить лецитин в сыром желтке.
- В одну пробирку добавить яичный желток и воду, а во вторую яичный желток и теплый этиловый спирт. Размешать стеклянной палочкой. Что наблюдаете?
- В фарфоровую ступку положить семена подсолнечника (масленичная культура) и хорошо растереть их пестиком. Растертую массу положить на фильтровальную бумагу. Что мы можем наблюдать? Появление на бумаге жирных пятен.
- В 3 пробирки помещают по 2-3 мл дистиллированной воды и растительного масла. Необходимо следить, чтобы количество воды и жира было приблизительно одинаковым. Добавляют в пробирку несколько капель раствора яичного белка, во вторую — несколько капель раствора КОН, в третью- не добавляют ничего (она будет служить контролем). Взбалтывают содержимое всех пробирок, ставят их по порядку в штатив и наблюдают образование в первых двух пробирках относительно устойчивой эмульсии, а в третьей — расслоение неустойчивой эмульсии на жир и воду.
Возможен выбор получения устойчивой эмульсии жиров с добавлением белка, или КОН.
- Записать название реакции условия проведения, ее признаки и выводы по эксперименту в таблицу Оформление результатов.
- группа.
Ход работ.
Задание 1. Качественные реакции на глюкозу.
Глюкоза является альдегидоспиртом, так как имеет в составе молекулы как альдегидную группу, так и гидроксогруппы. Качественными реакциями на обнаружение глюкозы могут служить реакции на многоатомные спирты и альдегиды.
- В пробирку внести 10 капель 1 % – ного раствора углевода — глюкозы. Добавить по 10 капель гидроксида натрия и по 2 капли сульфата меди, нагревают до кипения. В пробирках с глюкозой выпадает сначала желтый осадок гидроксида меди I, а позже осадок оксида меди (I) кирпично–красного цвета.
Примечание: в качестве качественной реакции на глюкозу учащиеся могут выбрать реакцию «серебряного зеркала» с аммиачным раствором оксида серебра, или же реакцию с гидроксидом меди без нагревания.
- Глюкоза не изменяет окраски индикаторов, следовательно, не содержит карбоксильную группу и не является кислотой. Проверим, содержит ли глюкоза альдегидную группу. Для этого проведём качественную реакцию на альдегиды – реакцию «серебряного зеркала».
CH2OH-(CHOH)4-COH + Ag2O = CH2OH-(CHOH)4-COOH + 2Ag
- Как спирт глюкоза может реагировать с гидроксидом меди – давать ярко-синий прозрачный раствор гликозида меди.
- Записать название и уравнение реакции условия проведения, ее признаки и выводы по эксперименту в таблицу Оформление результатов.
Задание 2. Качественная реакция на сахарозу.
- Проба на сахарозу. Качественная реакция с солями кобальта. Реактивы: 1 % раствор сахарозы; 2 % раствор Co(NO3)2,; 5 % раствор NaOH. Ход работы. В пробирку с 2 мл раствора сахарозы добавляют 1 мл раствора NaOH и несколько капель соли кобальта. Жидкость окрашивается в фиолетовый цвет.
Примечание: если добавить к сахарозе раствор кислоты, то образовавшаяся в результате реакции глюкоза даст реакцию при нагревании – выпадение осадок оксида меди (I) кирпично–красного цвета.
- Записать название реакции условия проведения, ее признаки и выводы по эксперименту в таблицу Оформление результатов.
Задание 3. Обнаружение крахмала..Качественнная реакция на крахмал.
- Капните раствором йода на разрезанный клубень картофеля и кусочек теста. Что наблюдаете?
- Приготовьте пробирку с раствором крахмала, или накрахмаленную ткань. Крахмал с раствором йода образует окрашенное соединение синего цвета. К 10 каплям раствора крахмала добавить 1 – 2 капли йода. Наблюдается ярко–синее окрашивание. Это качественная реакция на крахмал.
- Записать название реакции условия проведения, ее признаки и выводы по эксперименту в таблицу Оформление результатов.
IV. Закрепление материала – оформление результатов работы и написание выводов (10 мин.)
Оформите проведенные исследования в виде таблицы.
|
№ задания |
Условия проведения реакции |
Наблюдаемое явление |
Протекающие реакции (уравнение, или название) |
Вывод |
V. Рефлексия, домашнее задание (5 мин).
Рефлексия. Учащиеся обсуждают успешность и результаты выполненных групповых проектов с учителем и делают выводы, что такие классы органических веществ, как белки и углеводы, можно обнаружить при помощи нескольких вариантов качественных химических реакций. Выбор учащимися реакций для проекта определяется их трудоемкостью и имеющимися реактивами. Например, реакция «серебряного зеркала» на наличие альдегидной группы в молекуле глюкозы требует дорогостоящих реактивов и достаточно трудоемка, в отличие от реакции, в которой гидроксид меди реагирует с глюкозой, как с многоатомным спиртом.
Домашнее задание: параграф 6, вопросы 1-4 на стр. 48-49, подготовить сообщение на темы «Функции липидов».
1. Структурная функция. 2. Энергетическая функция. 3. Функция терморегуляции. 4. Запасающая функция.
5. Регуляторная функция.
Карта оценки метапредметных результатов: умение формулировать исследовательскую цель, делить цель на ряд последовательных задач, планировать путь достижения результата, выбирать оптимальный вариант решения задачи.
|
Умение формулировать исследовательскую цель, делить цель на ряд последовательных задач, планировать путь достижения результата. |
— совместно с учителем в состоянии поставить перед собой цель выбранного проекта; — демонстрирует понимание совокупности действий, необходимых для выполнения этой цели; — способен в хронологической последовательности выполнить все необходимые этапы проекта, чтобы достигнуть поставленной цели; — способен дать описание продукта, который должен быть получен в результате выполнения проекта. |
— в состоянии самостоятельно поставить ряд конкретных практических задач, поэтапное выполнение которых приведет к достижению поставленной в проекте цели; — контролирует соблюдение последовательности действий и точность выполнения отдельных экспериментов; — дает полную характеристику своей деятельности на каждом пройденном этапе; -анализирует полученный результат, сравнивая с предполагаемым описанием продукта, который должен быть получен в результате выполнения проекта. |
-самостоятельно определяет, какие действия следует предпринять для решения поставленных задач; -анализирует имеющиеся ресурсы для выполнения поставленных задач, способен предложить свою стратегию достижения цели на основе анализа имеющихся в распоряжении альтернатив; -делает выбор в пользу того, или иного метода (технологии), применяемого при решении задач, опираясь на мнение учителя и товарищей по группе; -в процессе работы над заданием корректирует план на основании оценки промежуточных результатов; -способен прогнозировать последствия появления продукта. |
Приложения:
- file0.docx.. 62,8 КБ
Опубликовано: 16.03.2021
Краткий обзор по методикам анализа белка в пищевых продуктах
В данном обзоре кратко описаны основные методы определения белка в пищевых продуктах. Указаны основные преимущества и недостатки имеющихся в настоящее время методик и оборудования. Данные обзор может быть полезен для специалистов пищевой промышленности и аналитических лабораторий на производстве продуктов питания. Для простоты восприятия текста при написании обзора авторы сознательно использовали упрощенную лексику и терминологию в описании химических процессов и молекулярной структуры соединений.
1. Введение
Белки (пептиды) представляют собой «полимеры» аминокислот. Белки состоят из двадцати различных аминокислот. Белки отличаются друг от друга в зависимости от типа, количества и последовательности аминокислот, составляющих основу полипептида. В результате они имеют разные молекулярные структуры и физико-химические свойства. Белки являются основными структурными компонентами многих натуральных продуктов, и зачастую определяют их общую текстуру, например, нежность мяса или рыбопродуктов. Изолированные белки часто добавляются в пищевые продукты в качестве ингредиентов, благодаря своим уникальным функциональным свойствам, т. е. их способностью обеспечить внешний вид, структуру или стабильность продукта. Белки нередко используются в процессах гелеобразования, как эмульгаторы, пенообразователи или загустители. Поэтому так важно иметь полную информацию о массовом содержании, типе, молекулярной структуре и функциональных свойствах белков входящих в состав пищевых продуктов.
2. Определение общей концентрации белка
2.1 Метод Кьельдаля
Метод Кьельдаля был разработан в 1883 году пивоваром Иоганном Кьельдалем. Сущность методики заключается в том, что образец продукта разлагается (сжигается) серной кислотой в присутствии катализатора, после чего полученный после разложения связанный в виде сульфата аммония азот может быть определен подходящей методикой титрования. Количество белка рассчитывается в зависимости от концентрации азота в продукте. В таком виде метод все еще используется и сегодня, хотя существует ряд усовершенствований для ускорения процесса и получения более точных данных. Данная методика считается арбитражным методом определения концентрации белка, например, в казеине. Поскольку метод Кьельдаля не измеряет содержание белка напрямую, необходим коэффициент преобразования (К), для перерасчета измеренной концентрации азота в концентрацию белка. Коэффициент 6,25 (что эквивалентно 0,16 г азота на грамм белка) используется для многих приложений, однако, это лишь среднее значение, и каждый белок имеет другой коэффициент преобразования в зависимости от его аминокислотного состава. Подробнее здесь
2.2. Общие принципы.
Метод Кьельдаля удобно разделить на три этапа: сжигание, нейтрализация и титрование.
Разложение. Образец анализируемой пробы взвешивается в специальную колбу, а затем разлагается при нагревании в присутствии серной кислоты (окислитель), безводного сульфата натрия (для ускорения реакции за счет повышения температуры кипения) и катализаторов, таких как медь, селен, титан, или ртуть. При разложении любого азота в продукте (кроме азота, который находится в виде нитратов или нитритов) образуется аммиак, который в растворе сильной серной связывается в ион аммония (NH 4 +) и, следовательно, остается в растворе. Общий вид реакции будет следующим:
N (food) ® (NH 4) 2 SO 4 (1) N (белков анализируемого продукта) ® (NH 4) 2 SO 4 (1)
Нейтрализация. После разложения содержимое колбы количественно переносят в специальную пробирку для отгонки, добавляют щелочь и отгоняют выделяющийся аммиак. Наиболее полно и гладко этот процесс проходит при использовании метода перегонки с паром. Общий вид реакции будет следующим:
(NH 4) 2 SO 4 + 2 NaOH ® 2NH 3 + 2H 2 O + Na 2 SO 4 (2) (2)
Газообразный аммиак, улавливается в отдельной колбе с избытком раствора бороной кислоты. Низкий рН раствора в колбе способствует переходу газообразного аммиака в ион аммония, и одновременно преобразует борную кислоту в борат ион: Общий вид реакции будет следующим:
NH 3 + H 3 BO 3 (борная кислота) ® NH 4 + + H 2 BO 3 — (Борат ионы) (3)
Титрование. Содержание азота рассчитывается по данным титрования. Борат ионы титруют серной или соляной кислотой, используя подходящий индикатор для определения конечной точки реакции.
H 2 BO 3 — + H + → H 3 BO 3 (4) H 2 BO 3 — + H + → H 3 BO 3 (4)
Концентрации ионов водорода (в молях), необходимое для достижения точки эквивалентности соответствует концентрации азота, в первоначальном образце (уравнение 3). Уравнение (5) может быть использовано для определения концентрации азота в образце, который весит м граммов и для титрования которого потрачено х М соляной кислоты:
(5) (5)
Где V S и V b объемы тирующей кислоты для образца и холостого опыта, 14g — молекулярная масса азота. Холостую пробу, как правило, используют, если требуется принять во внимание остаточный азот, который может содержаться в реагентах, используемых при проведении анализа. Как только содержание азота определено, можно рассчитать содержание белка с использованием соответствующего коэффициента преобразования:
Массовая доля белка = К * % N.
2.3. Преимущества и недостатки
Метод Кьельдаля широко используется в мире и до сих пор наравне со всеми другими методами. Его универсальность, высокая точность и хорошая воспроизводимость сделали его основным методом для оценки содержания белка в пищевых продуктах. Однако этот метод не отражает меру истинного белка, а определяет только общее содержание азота в образце, не выделяя небелковый азот. При этом в ряде случаев неучитывание при расчетах содержания небелкового азота может привести к критичным ошибкам при определении собственно белка. Более того, для различных белков требуются различные коэффициенты преобразования, вследствие отличия в аминокислотных последовательностях. Даже для различных белков одного продукта (например, молочных белков молока) коэффициент может отличаться значительно.
Использования концентрированной серной кислоты при высоких температурах также создает значительную опасность, как и использование некоторых дорогостоящих катализаторов. Кроме этого метод Кьельдаля трудоемок и требует значительного времени для его проведения. В настоящее время для снижения трудоемкости, времени и минимизации случайных ошибок разработаны системы различной степени автоматизации для выполнения всех описанных выше стадий анализа.
3. Метод Дюма
Разработанный и принятый не так давно метод Дюма предназначен для быстрого измерения концентрации белка в пробах продуктов питания. Этот метод впервые описан полтора века назад. Он начинает конкурировать с методом Кьельдаля как арбитражный метод анализа белков для некоторых продуктов питания в первую очередь из-за его оперативности.
3.1. Общие принципы
Образец известной массы сжигается при высокой температуре (около 900°С) в специальной ячейке в присутствии кислорода. Углекислый газ и вода удаляются путем пропускания газов через специальные колонки, которые поглощают их. Содержание азота измеряется путем передачи оставшегося после очистки газа на делительную колонку, на конце которой имеется детектор по теплопроводности. Дополнительно на колонке отделяется остаточной CO 2 и H 2 O. Прибор калибруется путем анализа материала, с известной концентрацией азота, например, ЭДТА (содержание азота 9,59%). После этого, сигнал с детектора по теплопроводности может быть преобразован в содержание азота. Как и для метода Кьельдаля необходимо преобразовывать концентрацию азота в образце, используя подходящие коэффициенты пересчета, которые зависят от точной аминокислотной последовательности белка.
3.2. Преимущества и недостатки
Основное преимущество — это скорость анализа, (по несколько минут на измерение, по сравнению с несколькими часами для Кьельдаля). Метод не требует токсичных химических веществ или катализаторов. Многие образцы могут быть измерены в автоматическом режиме. Метод прост в использовании.
Недостатки: Высокая начальная стоимость. Кроме того, метод также не дает меру истинного белка и для различных белков нужны различные поправочные коэффициенты. Небольшая масса и размер пробы затрудняет получение репрезентативной выборки.
4. Методы с использованием УФ-видимой спектроскопии
Для измерения концентрации белка существует ряд методов, основанных на УФ-видимой спектроскопии. Эти методы используют либо природные способности белков в поглощении (или рассеянии) света в УФ-видимой области электромагнитного спектра, либо предусматривает химическую или физическую модификацию белков, чтобы перевести их в форму, поглощающую (или рассеивающую) свет в этой области. Основные принципы любой из перечисленных ниже методик сходен. Прежде всего, при разработке методики следует выбрать химические группы, которые будут нести ответственность за поглощения или рассеяния излучения, например, пептидные связи, ароматические групп, основные группы для поглощения, для рассеивания — количество агрегированных белков. Далее создается градуировочная (калибровочная) зависимость поглощения (или мутности) от концентрации белка, для чего используются ряд белковых растворов с известной концентрацией. Абсорбцию (или мутность) анализируемой затем пробы определяется по построенной градуировочной зависимости.
Наиболее часто используемые УФ-методики для определения содержания белка в продуктах приводятся ниже:
4.1. Принципы
Прямые измерения при 280 нм. Триптофан и тирозин интенсивно поглощает ультрафиолетовый свет при 280 нм. Во многих белках содержание триптофана и тирозина, остается практически неизменным, так что их поглощения при 280 нм может быть использован для определения их концентрации. Преимущества этого метода в том, что процедура проста для выполнения, метод является неразрушающим, и никаких специальных реагентов не требуется. Основным недостатком является то, что нуклеиновые кислоты поглощают сильно при 280 нм и поэтому могут препятствовать измерению белка, если они присутствуют в достаточной концентрации. Для нивелирования этой проблемы были разработаны методы, в которых поглощение измеряется на двух различных длинах волн.
Биуретовый метод. При взаимодействии ионов меди (Cu 2 +) с пептидными связями в щелочных условиях продукт дает интенсивную фиолетово-пурпурную окраску. Биуретовый реагент, в готовой форме может быть приобретен как готовый реактив в специализированных магазинах. Его смешивают с белковым раствором, а затем выдерживают в течение 15−30 минут и определяют поглощение при 540 нм. Основным преимуществом этого метода это отсутствие помех от других соединений, которые поглощают на более низких волнах, и сама техника менее чувствительны к типу белка, поскольку она использует поглощения с участием пептидных связей, которые являются общими для всех белков, а не с отдельными его группами. Однако, метод имеет относительно низкую чувствительность по сравнению с другими УФ методами.
Метод Лоури. Метод Лоури объединяет биуретовый реагент с другим (реагент Фолина), последний реагирует с остатками тирозина и триптофа в белках. Это дает синеватый цвет, который поглощает в область между 500 — 750 нм в зависимости от того, какая требуется чувствительность. Существует небольшой пик поглощения около 500 нм, который может быть использован для определения высоких концентраций белка и интенсивный пик около 750 нм, который может быть использован для определения низких концентраций белка. Этот метод является более чувствительной к низкому содержанию белков, чем просто метод с биуретовым реактивом.
Методы со связыванием красителя (метод Брэдфорда) Сущность таких методов заключается в добавлении «отрицательно заряженного» красителя в раствор белка, рН которого регулируется так, чтобы белок находился в «положительно заряженной» области (т.е. меньше изоэлектрической точки). При этом белки образуют нерастворимый комплекс с красителем из-за электростатического притяжения между молекулами, а несвязанного краситель остается в растворе. Отрицательно заряженная часть красителя связывается с катионными группами основных аминокислот (гистидина, лизина и арганина) и любыми свободными аминогруппами. Количество несвязанного красителя, остающегося в растворе, после того как нерастворимый комплекс «белок-краситель» удаляется (например, центрифугированием) определяется при измерении его поглощения на соответствующей длине волны. Количество белка, которое присутствовало в исходном растворе пропорционально количеству красителя, добавленному первоначально и оставшемуся в растворе. (Для метода Бредфорда белки и их комплексы с красителем остаются в растворе, меняется интенсивность поглощения (визуально цвет) на анализируемой длине волны).
Турбометрический метод (рассеивание). Любые белковые молекулы, растворимые при обычных условия можно перевести в нерастворимую форму путем добавления определенных химических веществ, например, трихлоруксусной кислоты. Таким образом, концентрация белка может быть определено путем измерения степени мутности пропорциональной рассеиванию проходящего через раствор светового луча.
4.2. Преимущества и недостатки
Преимущества: УФ-видимой методы довольно быстро и просто выполнять, и они чувствительны к низкой концентрации белков.
Недостатки: Для большинства методов УФ-видимой спектроскопии необходимо использовать разбавленные и прозрачные растворы, которые не содержат загрязняющих веществ способных поглощать или рассеивать свет на выбранной для анализа длине волне. Необходимость прозрачного раствора означает, что большинство пищевых продуктов, должны пройти длительную пробоподготовку, прежде чем они будут пригодны для анализа, например, гомогенизация, экстракция, центрифугирование, фильтрация. Такая пробоподготовка может занять много времени и быть чрезвычайно трудоемкий. А иногда бывает невозможно количественно извлечь белки из определенных видов пищевых продуктов, особенно после того, как при обработке белки перешли в агрегированное состояние или образовали ковалентные связи с другими веществами. Кроме того, степень абсорбции зависит от типа анализируемого белка, которые могут отличаться в аминокислотных последовательностях.
5. Другие инструментальные методы
Существуют самые различные инструментальные методы для определения общего содержания белка в пищевых продуктах. Их можно разделить на три категории в соответствии с их физико-химическим принципом: (1) измерение объемных физических свойств, (2) измерения адсорбции излучения, и (3) измерение рассеяния излучения. Каждый инструментальных методов имеет свои преимущества и недостатки, и ассортимент объектов, на которые он может быть применен.
5.1. Принципы
Измерение физических свойств. Плотность: плотность белка больше, чем у большинства других компонентов пищи, таким образом, увеличение плотности пищи, напрямую связано с увеличением содержания белка. Следовательно, содержание белка в продукте может быть соотнесено с его плотностью. Показатель преломления: показатель преломления водных растворов увеличивается при увеличении концентрация белка, следовательно, результаты измерения этого показателя могут быть использованы для определения содержания белка.
Измерение адсорбции УФ-видимый: концентрация белков может быть определено путем измерения поглощения УФ-видимого излучения (подробнее описано выше).
ИК-ближняя и средняя область: Инфракрасные методы могут быть использованы для определения концентрации белков в пищевых продуктах. Белки поглощают в ИК-области за счет собственных молекулярных колебаний (растяжения и изгиба) определенных химических групп вдоль полипептидной цепочки. Таким образом, измеряя поглощение излучения на определенных длинах волн, можно рассчитать количественную концентрацию белка в образце. Он также не требует особой подготовки образца и является неразрушающим методом контроля. Его основные недостатки — высокая начальная стоимость и необходимость проведения комплексной и сложной калибровки.
Измерение рассеяния излучения. Рассеяние света: Концентрация белковых агрегатов в водных растворах может быть определена с помощью методов измерения рассеяния света, поскольку мутность раствора прямо пропорциональна концентрации белка. Ультразвуковое рассеяния: концентрация белковых агрегатов также может быть определена с помощью ультразвуковых методов рассеяния, поскольку скорость ультразвука и его поглощения связанны с концентрацией белка в растворе.
5.2. Преимущества и недостатки
Основные преимущества и недостатки инструментальных методов упоминалось выше. Также следует отметить, для всех этих методов должна существовать калибровочная кривая, которая с большой долей вероятности будет различной для различных типов белков и пищевых матриц, в которых они содержится. Как следствие все инструментальные методы наиболее корректно работают для анализа пищевых продуктов с относительно простыми композициями. Для продуктов питания, которые содержат множество различных компонентов, концентрация которых может варьироваться, определить вклад белка на фоне других компонентов зачастую бывает затруднительно.
6. Выбор метода
При анализе конкретного пищевого продукта обычно всегда возникает задача выбора конкретной методики для измерения концентрации белка в образце. Как решить, какой метод является наиболее подходящим? Первое, с чем нужно определиться это для каких целей будет проводиться анализ. Если анализ будет проводиться для сторонних организаций, с целью проведения сличений, или же для расчета за товар, следует пользоваться официально признанным арбитражным методом. Так Кьельдаль, и все чаще метод Дюма, были официально утверждены для широкого спектра пищевой промышленности. В противоположность этому, только небольшое число методом УФ спектроскопии были признаны официально. Но к примеру, для молока все чаще используется метод Брэдфорда, поскольку определение белка без одновременного определения и учета небелкового азота в молоке может привести к завышенным результатом с неприемлемой ошибкой.
Для целей контроля качества, часто более полезно иметь быстрый и простой метод измерения содержания белка и, следовательно, методы ИК-спектроскопии являются наиболее подходящими. В лабораториях где проводятся фундаментальные исследования, и где обычно работы выдуться с уже выделенными и очищенными образцами, методы с использованием УФ спектроскопии зачастую предпочтительнее, поскольку они дают быстрые и надежные измерения, и чувствительны к крайне низкой (до 0,001% масс.) концентрации белка.
Также следует учитывать и другие факторы, которые, возможно, придется рассматривать. В основном это:
- объем требуемой пробоподготовки
- требуемая чувствительность
- требуемая скорость проведения анализа
Методы Кьельдаля, Дюма, акустические и ИК методы, как правило, не требует специальной пробоподготовки, либо пробопоготовка автоматизирована в соответствующем блоке прибора. Во многих случаях после репрезентативной выборки объект анализируется непосредственно. В противоположность, различные методы УФ спектроскопии, как указано выше, требуют серьезной подготовки образца перед анализом. Белок должен быть сепарирован от образца, что обычно означает различные процедуры гомогенизации, экстракции, фильтрации и центрифугирования. Время, необходимое на анализ, и количество образцов, которые могут быть проанализирован одновременно, также являются важными факторами, которые следует учитывать при определении того, какая методика будет выбрана для анализа.
Другие заслуживающие упоминания факторы — это время амортизации оборудования, его начальная стоимость, наличие или отсутствие требуемого вспомогательного оборудования, стоимость расходных материалов и сроком их годности.
7. Цена вопроса
В заключении приведем ориентировочную стоимость постановки методики[1]:
|
Методика |
Примерная стоимость |
Примечания |
|
Метод Кьелдаля (ручной) |
От 20 000 руб. |
Без ОЛО |
|
Метод Кьелдаля (полуавтомат) |
От 200 000 руб. |
Без ОЛО |
|
Метод Кьелдаля (автомат) |
От 600 000 руб. |
|
|
Метод Дюма (автомат) |
От 100 000 руб. |
|
|
Метод ИК (БИК) (ручной [2]) |
От 400 000 руб. |
Без ОЛО |
|
Метод ИК (БИК) (автомат) |
От 1 200 000 руб. |
|
|
Метод УФ (ручной [3]) |
От 300 000 руб. |
Без ОЛО |
|
Метод УЗ (автомат) |
От 25 000 руб. |
|
|
Определение плотности |
От 5000 руб. |
Без ОЛО |
Дополнительно значительные суммы могут тратиться на проведение пусконаладочных работ, расходные материалы, доставку, обучение персонала, а также сертификацию и метрологическое обеспечение.
[1] Большинство автоматических анализаторов имеют специализированное применение.
[2] Указана стоимость собственно прибора. Калибровки выполняет пользователь, ручная пробоподготовка.
[3] Указана стоимость собственно прибора. Калибровки выполняет пользователь, ручная пробоподготовка.
1.
Биохимия
— это наука, изучающая качественный и
количественный состав, а также пути,
способы, закономерности, биологическую
и физиологическую роль превращения
вещества, энергии и информации в живом
организме.
Задача
врача
заключается в том, чтобы предотвратить
развитие патологического процесса в
организме и ее решение возможно лишь
при своевременной и правильной
диагностике, назначении адекватного
лечения, которое возможно лишь в том
случае, если врач понимает сущность
происходящего в организме.
1.
Познание молекулярных механизмов
физиологических, генетических и
иммунологических процессов жизнедеятельности
в норме и при патологии и действии на
организм различных факторов.
2.
Совершенствование методов профилактики,
диагностики и лечения заболеваний.
3.
Разработка новых лекарственных средств,
нормализующих обменные процессы.
4.
Разработка научных основ, рационального,
сбалансированного питания, здорового
образа жизни.
В
зависимости от объекта исследования
или направления исследования биохимию
подразделяют на такие разделы как:
—
общая биохимия
которая изучает общие вопросы химических
основ жизнедеятельности различных
организмов
—
бионеорганическая химия
изучающая роль и значение в процессе
жизнедеятельности комплексов
неорганических ионов с органическими
соединениями
—
биоорганическая химия исследующая
физико-химические основы функционирования
живых систем
—
биохимия человека и животных, (растений,
микроорганизмов)
—
техническая биохимия, изучающая
состав пищевых продуктов, химическую
основу технологических процессов их
хранения, переработки и т.д.
—
сравнительная (эволюционная) биохимия
которая исследует биохимические процессы
в сравнительном (эволюционном) аспекте
—
радиационная биохимия изучает
биохимические основы радиационного
повреждения и способы его профилактики
в живой организме
—
медицинская
(клиническая) биохимия
исследует биохимические основы
патологических процессов.
|
Метод |
Характеристика |
|
Исследование целого |
1. удаление органа
2. изменение диеты 3. прием лекарств
4. введение
5. наблюдение за
6. использование |
|
Перфузия |
наиболее пригодны |
|
Инкубация |
чаще используются |
|
Инкубация |
наиболее пригодны |
|
Изучение |
1. работа с
2. можно удалять
3. можно |
|
Исследование |
широко используются |
|
Субфракционирование |
например |
|
Выделение |
обязательно при |
|
Клонирование |
исследование |
В 10 – 13 вв. в
Европе с развитием алхимии стал
накапливаться материал о составе
органических соединений.
В 14 — 17 вв. получила
развитие ядрохимия. Важнейшим
представителем был Парацельс. Он
предположил, что в основе всех
заболеваний лежит нарушение хода
химических реакций и что лечить их
надо тоже химическими веществами.
Ядрохимия
дала много практического для медицины.
Кроме этого ятрохимия поддерживала
виталистические взгляды.
В
17 – 18 вв. широкое признание получила
теория, которая объясняла процессы
горения выделением из горящего тела
особого невесомого вещества и была
опровергнута Ломоносовым и Лавуазье,
которые открыли закон сохранения
энергии.
В
1828 г. Ф. Вёлер впервые синтезировал
мочевину, открыв тем самым эпоху
органического синтеза.
В
1839 г Ю. Либих установил, что в состав
пищи входят белки, жиры и углеводы.
В
1845 г. Г. Кольбе синтезировал уксусную
кислоту
В
1854 г М. Бертло синтезировал жиры.
В
1861 г А.М. Бутлеров синтезировал углеводы.
В
1847 г. Ходнев издал первый учебник
биохимии.
В
1903 г. было введено понятие «биохимия».
До 20-х годов
получила развитие биохимия углеводов
и липидов.
30-е
годы — биохимия втаминов и гормонов.
40-50-е
годы – биохимия ДНК, РНК, белков.
Основоположником
отечественной биохимии является
профессор Александр Яковлевич Данилевский
(1839-1923), который в 1863 г. создал первую
кафедру биохимии в Казанском университете,
создал первую русскую школу биохимиков.
Значение
БХ для врача сводится к тому, чтобы
решать на молекулярном= уровне задачи
фундаментальные, общебиологические,
включая проблему зависимости человека
от экосистемы, которую необходимо не
только понимать, но защищать и научиться
разумно ею пользоваться.
2.
БЕЛКИ – это
ВМС, состоящие из аминокислот (всего
20) и имеющие 4 уровня структурной
организации, а в настоящее время
выделяют еще и пятый уровень.
Уровни
структурной организации, формы и размеры
белковых молекул.
ПЕРВИЧНАЯ
СТРУКТУРА
– это последовательность аминокислот
в полипептидной цепи. Стабильность
обусловлена ковалентными пептидными
связями, возможно участие небольшого
числа дисульфидных связей. Первичная
структура имеет ряд особенностей:
1.
Ее стабильность обусловлена ковалентными
пептидными связями, возможно участие
небольшого числа дисульфидных связей.
2.
В полипептидной цепи могут быть
обнаружены разнообразные комбинации
аминокислот.
3.
Каждый индивидуальный белок является
уникальной первичной структурой и
замены аминокислот приводят к изменению
физикохимических и биологических
функций.
4.
В некоторых ферментах, обладающих
близкими свойствами встречаются
сходные последовательности аминокислот
(в частности активных центров).
ВТОРИЧНАЯ
СТРУКТУРА
— конфигурация полипепидной цепи, то
есть наибольшее свертывание полипептидной
цепи в спиральную конформацию. Так
как возникла двойная связь, то вращение
затрудняется и формируется водородная
связь, что приводит к возникновению
спиральной конформации полипептидной
цепи (а
–спирали).
Существует также в-конформация
вторичной структуры (две или более
полипептидных цепей, расположены
параллельно между этими цепями точно
образуются водородные связи)
ТРЕТИЧНАЯ
СТРУКТУРА
– пространственная ориентация
полипептидной цепи в определённом
объёме в(трёхмерном пространстве).
Основной движущей силой в возникновении
третичной структуры является
взаимодействие радикалов аминокислот
с молекулами воды. При этом полярные
гидрофобные радикалы аминокислот
как бы вталкиваютя внутрь белковой
молекулы, образуя там «сухие» зоны, в
то время как полярные гидрофильные
радикалы оказываются ориентированными
в сторону воды.
Под
четвертичной
структурой
белка понимают способ укладки в
пространстве отдельных полипептидных
цепей, обладающих одинаковой (или
разной) первичной, вторичной и третичной
структурой, и формирование единого
макромолекулярного образования в
структурном и функциоанльном отношении.
Каждая отдельно взятая полипептидная
цепь, которая называется протомером,
чаще всего не обладает биологической
активностью. Эту способность белок
приобретает при объединении с другими
протомерами. Образовавшуюся при этом
молекулу называют мультимером.
Мультимерные белки чаще всего
построены из чётного числа протомеров.
Функционально активная часть мультимера
называется субъеденицей.
ПЯТЫЙ
УРОВЕНЬ
организации
представлен в виде ферментных
комплексов, которые катализируют
цепной и метаболический путь. Эти
комплексы называются метаболонами,
они чаще связаны с клеточными
мембранами.
3.
Большое число
белков и их многообразие требует создания
классификации белков. Чаще всего
пользуются функциональной классификацией,
разделяя их по выполняемым ими функциям
(см выше).
Можно разделить
белки по степени сложности их молекул
на простые и сложные. Простые построены
только из аминокислот, а сложные содержат
в своем составе дополнительные небелковые
группы. Такие группы называют
простетическими.
По форме белковой
молекулы белки делят на глобулярные
(шаровидные) и фибриллярные (нитевидные).
По растворимости
в воде выделяют водорастворимые,
солерастворимые, нерастворимые в воде.
Последние характерны для биологических
мембран.
Классификация.
Выделяют
две группы белков:
простые
(протеины);
построены только из аминокислот и
при гидролизе распадаются только на
аминокислоты: альбумины, гистоны,
глобулины, проламины, протеиноиды;
сложные
(протеиды);
состоят из простого белка и небелкового
комплекса (протетической группы):
фосфопротеиды, хромопротеиды,
нуклеопротеиды, гликопротеиды,
липопротеиды.
Простые белки
построены только из аминокислот. Сложные
белки содержат небелковые компоненты
3
структура белка.
Для уникального пространственного
расположения атомов в молекуле белка
(укладки полипептидной цепи в пространстве),
которое «запрограммированно» самой
аминокислотной и поэтому образуется
самопроизвольно, тем не менее нужны
помощники. Эти помощники также являются
белками и получили название шапероны.
Впервые они были открыты как «белки
теплового шока» (hsp
60 и hsp
70). Их функция заключается в защите
складывающейся полипептидной цепи от
взаимодействия с другими многочисленными
клеточными белками и, возможно, в
ускорении этого процесса.
Функции
белков:
1.Каталтическая
(обеспечивает поток вещества, энергии,
информации: около 2500 ферментов
являются
белками).
2.
Транспортная (гемоглобин переносит
кислород и углекислый газ, альбумины,
трансферин, церулоплазмин).
3.
Трофическая (резервная: альбумины, белки
мышц, козеин, избыток белка превращается
в липиды и углеводы).
4.
Сократительная (локомоторная: актин,
миозин).
5.
Пластическая (структурная: коллаген,
кератин, эластин).
6.
Регуляторная (гормоны, альбумины
регулируют осмотическое давление,
водно-солевой баланс).
7.
Защитная (интерфферон, протромбин,
фибриноген).
8.
Рецепторная (белки являются рецепторами,
с помощью которых происходит восприятие
сигнала из внешней среды).
9.
Энергетическая.
Кроме
всего этого белок — это главный
злемент регуляции наследственного
материала, генератор энергетического
топлива в организме.
4.
Под влиянием
различных физических и химическх
факторов белки подвергаются свёртыванию
и выпадают в осадок, теряя свои
нативные свойства. Денатурация
– это изменение общего плана (конформации)
уникальной структуры нативной молекулы
белка, приводящее к потере биологических
функций и физико- хмических свойств
(растворимости).
Факторы,
вызывающие денатурацию:
1. Температура
(большинство белков денатурирует при
нагревании до 60 градусов).
2. Ионизирующее
излучение.
3. Химические
факторы:
а) концентрированные
кислоты и щёлочи;
б) водоотнимающие
растворы;
в) тяжёлые
металлы;
г) гемолитические
яды.
Механизм
денатурации.
В
основе денатурации лежит освобождение
энергии, которое возникает в результате
разрушения связей (в основном
водородных, дисульфидных). Пептидные
связи не затрагиваются, поэтому
первичная структура сохраняется. При
этом происходит освобождение
гидрофобных участков и понижается
растворимость, так как гидрофобные
участки взаимодействуют друг с другом.
За счёт дополнительной энергии
образуются случайные беспорядочные
структуры. При непродолжительном
действии и быстром удалении
денатурирующего агента возможна
Ренатурация
белка с
полным восстановлением исходной
структуры и нативных свойств.
Признаки
денатурации:
1. снижение
растворимости, особенно в ИЭТ, и вязкости
белковых растворов;
2. освобждение
функциональных СН — групп;
3. изменение
характера рассеивания рентгеновских
лучей;
4. снижение или
потеря биологической активности
(каталитической, антигенной, гормональной).
Состояние,
близкое к денатурации, наблюдается
при взаимодействии антитела с антигеном.
Практическое
использование денатурации:
-
используя
процесс денатурации в мягких условиях,
его используют для получения и
хранения ферментов в низких
температурах. -
явление
денатурации используют в пищевой
промышлености (для получения яичного
порошка, консервов). -
в
медицине денатурацию используют для
осаждения чужеродных белков, при
ожогах, обморожениях.
Количественное
определение общего белка в сыворотке
крови биуретовым методом.
В
пробирку вносят 0,05 мл сыворотки крови,
а затем — 2,5 мл биуретового раствора.
Осторожно перемешивают. Через 30 минут
в кювете при зелёном светофильтре
(540 нм). Концентрацию исследуемого
раствора сравнивают с графиком
концентрации белка. Нормальное
содержание белка в сыворотке у взрослых
6,5% — 8,5%, у детей — 5,6%- 8,55%.
Принцип
метода. В
щелочной среде пептидные связи белка
образуют с ионами двухвалентной меди
комплекс фиолетового цвета. Интенсивность
окраски раствора прямо пропорциональна
концентрации белка, определяемой
фотометрически.
Клинико-диагностическое
значение. Нормальное
содержание белка в сыворотке крови у
взрослых людей – 65–85 г/л, у детей –
58–85 г/л.
Повышенное содержание
белка (гиперпротеинемия) встречается
редко (при ревматизме, плазмоцитозе).
Пониженное содержание белка
(гипопротеинемия) – при злокачественных
опухолях, дистрофии.
Рефрактометрический
метод:
В основе лежит
не одинаковая способность различных
сред преломлять проходящие через
них лучи света. Отношение sin
угла падения к sin угла
преломления называется коэффициентом
преломления. Попадатель
преломления вычисляется при помощи
рефрактометра и соответственно этому
значению находится процент содержания
белка в сыворотке по таблице.
Для количественного
анализа белков можно использовать
определение белкового азота. Для этого
пробу сжигают при высокой температуре
в присутствии серной кислоты и перекиси
водорода (окислитель). Происходит
минерализация, при этом азот в форме
аммиака связывается серной кислотой
(сульфат аммония). Количество сульфата
аммония определяют или с реактивом
Несслера, или после перегонки аммиака
титрометрически.
Значительно чаще
для количественного определения
используют цветные реакции (биуретовую
или реакцию на фенольные группы Lowry).
Биуретовая реакция основана на том, что
в щелочной среде ионы меди реагируют с
пептидными группировками, образуя
комплексные соединения, окрашенные в
фиолетовый цвет. Интенсивность окраски
фотометрируется. Сочетание биуретовой
реакции и реакции на фенольные группировки
используется в методе Lowry.
Для количественного
определения индивидуальных белков в
сложных смесях белков большой популярностью
пользуются иммунологические методы.
При взаимодействии белка со специфической
антисывороткой образуется мутный
раствор. Интенсивность помутнения может
быть измерена колориметрическими
методами.
6.
Многие белки в своем составе, помимо
аминокислот, могут содержать и небелковые
компоненты. Такие небелковые соединения
в составе белков получили название
простетических
групп. В
зависимости от химического состава
простетической группы сложные белки
можно разделить на несколько классов:
1.
Хромопротеины.
Это белки, простетическая группа которых
имеет окраску. К ним относятся многие
белки, содержащие металлы. Например,
церулоплазмин — белок, содержащий медь,
имеет синюю окраску. Белок, переносящий
витамин B12,
имеет розовый цвет (этот витамин содержит
кобальт в своем составе). Хорошо изучены
белки, содержащие железо: гемоглобин,
миоглобин, цитохромы. Они имеют красную
окраску. Присутствие витамина B2
придает белкам желтый цвет (флавопротеины).
2.
Гликопротеины.
Это белки, простетическая группа которых
содержит углеводы. Гликопротеины — это
небольшая часть белково-углеводных
комплексов, к которым относятся также
протеогликаны и мукопротеины. Этим
белкам принадлежит важная роль в
структурной организации клеток и тканей,
они выполняют защитные функции. Основная
часть внеклеточных белков — это
гликопротеины.
3.
Липопротеины.
Это белки, простетическая группа которых
содержит липиды. Они обеспечивают
транспорт липидов в крови, являются
компонентами биологических мембран.
4.
Металлопротеины.
Это белки, частично перекрывающиеся с
хромопротеинами. Простетичская группа
у них представлена металлами. Они
транспортируют или участвуют в
депонировании металлов (ферритин,
трансферрин).
5.
Нуклеопротеины.
Простетическая группа у таких белков
— нуклеиновая кислота. Различают
дезоксирибонуклеопротеины (простетическая
группа — ДНК) и рибонуклеопротеины
(простетичесая группа — РНК). Им принадлежит
важная роль в сохранении, передаче и
реализации генетической информации.
6.
Фосфопротеины.
Белки, которые содержат в своем составе
фосфорную кислоту, популярны в клетке
потому, что процесс фосфорилирования
является способом влияния на конформацию
белка и поэтому используется в системах
регуляции процессов жизнедеятельности.
Простетические
группы соединяются разными типами
связей. Так для нуклеопротеинов
характерной является ионная связь, у
гликопротеинов и фосфопротеинов
преобладает ковалентная связь, у
липопротеинов — силы гидрофобного
взаимодействия, металлопротеинов —
донорно-акцепторные связи.
Аллостерические
эффекторы. Влияние
эффекторов на ферменты можно объяснить
просто, добавив к сказанному выше, что
у фермента есть два центра связывания
лигандов. Роль одного лиганда будет
выполнять субстрат, взаимодействующий
с активным центром, а второй лиганд –
эффектор, связывающийся со специальным
аллостерическим центром.
Регуляция
активности с помощью гормонов.
Гормональная
регуляция осуществляется на генетическом
уровне путём обратимого фосфорилирования.
Например, под действием адреналина
происходит активация процесса распада
гликогена. В ходе этого процесса
образуется небелковое соединения –
у-АМФ. у-АМФ – внутриклеточный гормон
(вторичный посредник) является
аллостерическим регулятором большого
числа протеинлипаз. у-АМФ образуется
из АТФ под действием аденилатциклаз.
7. Ферменты,
как и белки, делятся на 2 группы: простые
и сложные.
Простые целиком и полностью состоят
из аминокислот и при гидролизе образуют
исключительно аминокислоты. Их
пространственная организация ограничена
третичной структурой. Это в основом
ферменты ЖКТ: пепсин, трипсин, лизацим,
фосфатаза. Сложные ферменты кроме
белковой части содержат и небелковые
компоненты. Эти небелковые компоненты
отличаются по прочности связывания
с белковой частью (аллоферментом).
Если константа диссоциации сложного
фермента настолько мала, что в растворе
все полипептидные цепи оказываются
связанными со своими небелковыми
компонентами и не разделяются при
выделении и очистке, то небелковый
компонент называется простетической
группой и
рассматривается как интегральная
часть молекулы фермента.
Под
коферментом
понимают
дополнительную группу, легко отделяющуюся
от аллофермента при диссоциации. Между
аллоферментом и простейшей группой
существует ковалентная связь, довольно
сложная. Между аллофермнтом и
коферментом существует нековалентная
связь (водородные или электростатические
взаимодействия). Типичными представителями
коферментов являются :
В1
— тиамин; пирофосфат (он содержит В)
В2
— рибофлавин; ФАД, ФНК
РР
— НАД, НАДФ
Н
– биотин; биозитин
В6
— пиридоксин; пиридоксальфосфат
Пантотеновая
кислота: коэнзим А
Многие
двухвалентные металлы (Cu,
Fe,
Mn,
Mg)
тоже выполняют роль кофакторов,
хотя и не относятся ни к коферментам,
ни к простетическим группам. Металлы
входят в состав активного центра
или стабилизируют оптимальный вариант
сруктуры активного центра.
Кофакторы
– любой фактор влияющий на активность
фермента (многие двухвалентные металлы
(Сu2+, Fe2+, Fe3+, Mn2+, Мg2+, Ca2+)). Металлы входят
в состав активного центра или стабилизируют
оптимальный вариант структуры активного
центра. Fe2+,
Fe3+
гемоглобин,
каталаза, пероксидаза.
Строение НАД и
НАДФ.
НАД и НАДФ являются
коферментами пиридинзависимых
дегидрогеназ. Способность НАД и НАДФ
играть роль точного переносчика
водорода связана с наличием в их структуре
амида никотиновой кислоты.
В
клетках НАД – зависимые дегидрогеназы
участвуютв процессах переноса
электронов от субстрата к О. НАДФ –
зависимые дегидрогеназы играют роль в
процессах биосинтеза. Поэтому коферменты
НАД и НАДФ отличаются по внутриклеточной
локализации: НАД концентрируется в
митохондриях, а большая часть НАДФ
находится в цитоплазме.
Строение
ФАД и ФМН.
ФАД и ФМН являются
простетическими группами флавиновых
ферментов. Они очень прочно, в отличие
от НАД и НАДФ, присоединяются к
аллоферменту. Активной частью
молекулы ФАД и ФМН является
изоаллоксадиновое кольцо рибофлавин,
к атомам азота которого могут
присоединятся 2 атома водорода.
9.
Активный
(субстратный) центр
– зто совокупность функциональных
групп, расположенных в разных участках
полипептидной цепи, но близко структурно
и функционально ориентированных (в
процессе укладки третичной структуры)
и имеющих прямое отношение к катализу.
Этот центр состоит из функциональных
групп и радикалов: SH
– (цистеин), — ОН (серин), — СООН (аспарагин),
имидазольное кольцо гистидина и
фенилаланина.
Активный
центр включает в себя:
1) каталитический
участок или центр, непосредственно
взаимодействующий с субстратом,
осуществляющий катализ;
2)
контактная площадка, осуществляющая
специфическое сродство фермента к
субстрату и является местом фиксации
субстрата к поверхности фермента;
3) включительные
участки – карман, ложбинки.
Предполагается, что
формирование активного центра фермента
начинается уже на ранних этапах
синтеза белка-фермента на рибосомах,
когда линейная однотипная структура
полипептидной цепи превращается в
трёхмерное тело строго определённой
конфигурации, точнее активный центр
формируется из функциональ – ных групп
различных аминокислот.
У
олигомерных ферментов (имеющих
четвертичную структуру) имеются центры
аллостерической
регуляции
– это участки связывания фермента с
низким молекулярным веществом
(эффектором или модификатором), имеющим
иную, чем субстраты или продукт,
структуру (АТФ, АДФ, НАД, промежуточные
метаболиты.
П
эффектора к аллостерическому центру
приводит к изменению третичной
структуры и соответственно конфигурации
активного центра, вызывая снижение
или повышение энзиматической активности.
В связи с этим существует и два
пространственно удалённых аллостерических
центра: активации и ингибирования.
Ферменты, активность которых
контролируется состоянием как
активного, так и аллостерического
центров, называютсяаллостерическими
ферментами.
Все ферменты и
метаболиеские процессы компартментализованы
(раздельны и изолированы). В нормальной
клетке находится около 1000 ферментов.
Упорядоченное взаимодействие ферментов
достигается путём многоуровневой
регуляции и компартментализации. Зная
локализацию ферментов в клетке и
определяя их активность в крови,
можно судить о степени деструкции
ткани.
Ядро:
локализованы
РНК – полимеразы, НАД – синтетаза,
ферменты, участвующие в репликации
ДНК.
Митохондрии:
ферменты
тканевого дыхания, окислительного
фосфорилирования, ферменты в-окисления
жирных кислот, цикла Кребса, синтеза
мочевины.
Лизосомы:
гидролитические
ферменты с оптимумом рН в области
5 (пептиды, эстеразы).
Рибосомы:
ферменты
белкового синтеза.
ЭПС:
ферменты
синтеза липидов, ферменты гидроксилирования,
ферменты детоксикации (метилирования,
ацетилирования), коньюгации.
Мембраны:
Na
–K
–АТФаза, аденилатциклаза, ферменты
транспорта субстратов.
Цитоплазма:
ферменты
гликолиза, активации аминокислот,
синтеза жирных кислот.
Мультиферментные
системы локализуются в структуре
органелл таким образом, что каждый
фермент располагается в непосредственной
близости от следующего фермента
данной последовательности реакции.
Благодаря также компартментализации
в клетке могут одновременно протекать
2 несовместимых процесса: в-окисление
жирных кислот в митохондриях и синтез
жирных кислот в цитоплазме).
Под
органоспецифичностью
понимают наличие
метаболических путей, присущих только
данному органу. Следовательно,
органоспецифические
ферменты – это
ферменты, катализирующие определённые
метаболические пути, присущие
определённому органу.
Хотя
органы и имеют различные выражения
того или иного пути, они имеют важное
значение для диагностики многих
заболеваний путём определения их
активности. Так, для печени характерна
высшая активность АЛаТ, АсаТ,
сорбитдегидрогеназа, ГДГ. Причём
активность АЛаТ выше, чем АСаТ, так
как АСаТ лучше спрятана во внутренних
печёночных структурах.
Почки
– щелочная фосфатаза.
Простата
– кислая фосфатаза.
Миокард
– ЛДГ1,
ЛДГ2,
НН и НВ изоферменты.
При
нарушении целостности тканей этих
органов, ферменты выделяются в сыворотку
крови, где их активность резко
возрастает. В зависимости от того,
активность какого фермента возросла,
можно судить не только о локализации
патологического процесса, но и о
степени его тяжести. Но для более
конкретной и точной диагностики
заболевания (для определения
интенсивности и глубины повреждения
ткани) нужны маркёрные
ферменты,
принадлежащие определённой конкретной
органелле.
10.
Фермент взаимодействует с субстратом
согласно этим трём теориям:
1-й
этап: происходит ориентация субстрата
относительно субстратного центра
фермента и его постепенное
«
причаливание » к « якорной» площадке.
2-й
этап: жёсткая фиксация на « якорной»
площадке и подгонка структур активного
центра к структурам субстрата.
3-й
этап: непосредственный катализ.
E
S ——— P + Q
0
) S + E =====ES ===== E + P
подстадии
1) E + S =====ES
2)ES
=====ES*
(новая модификация субстрата)
3)
ES*=====ES**
4)
ES**======ES***
5) ES***=====EP
6) EP======E + P
Эта
теория промежуточных соединений,
согласно которой после образования
ЕS-комплекса
продолжает насыщаться субстратом до
тех пор, пока субстрат не превратится
в продукт, после чего происходит
отщепление Е от образовавшегося из
S
продукта (Р).
В
реакциях анаболизма А + В —— АВ фермент
иожет соединяться как с одним, так
и с другим субстратом, или с обоими
субстратами:


ЕАВ ——Е + АВ
ЕВ
В
реакциях катаболизма: АВ ——— А + В
-
АВ
+ Е ——- АВЕ -
АВЕ
——- А + ВЕ АВ + Е —— А + В + Е -
ВЕ
——- В + Е
В
образовании фермент –субстратного
комплекса учавствуют водородные связи,
электростатические и гидрофобные
взаимодействия, а также в ряде случаев
ковалентные и координационные связи.
Следует
отметить, что для каталитической
активности фермента существенное
значение имеет пространственная
структура активного центра, в которой
жёсткие участки а-спиралей
чередуются гибкими, эластичными
линейными отрядами, которые обеспечивают
динамичность, пластичность, способность
изменяться под действием субстрата,
что и лежит в основе теории «
индуцированного» соответствия. Причём
для каталитического процесса
существенное значение имеет не только
пространственная комплементарность
между ферментом и субстратом, но и
наличие электростатического соответствия,
обусловленного спариванием противоположно
заряженных групп субстрата и активного
центра фермента. С термодинамической
точки зрения ферменты ускоряют
химические реакции за счёт энергии
активации.
Энергия
активации – энергия,
необходимая для перевода всех молекул
моля вещества в активное состояние
при данной температуре, то есть энергия,
которая необходима молекуле, чтобы
преодолеть энергетический барьер.
Фермент снижает энергию активации
путём увеличения числа активированных
молекул, которые становятся
реакционноспособными на более низком
энергетическом уровне, то есть
снижается и энергетический барьер.
К
характеризующая ход неферментативных
реакций.
Кривая,
характеризующая ход ф
реакций.
Общая
теория ферментативного катализа
постулировала, что фермент Е сначала
обратимо и относительно быстро связывается
с со своим субстратом S в реакции:
E
+ S = ES, Образовавшийся
при этом фермент-субстратный комплекс
ES затем распадается в второй более
медленной (лимитирующей) стадии реакции:
ES = Е + Р.
Теория
промежут связей:
1.Е+S=ES
2.ES=ES*
3.ES*=ES**
4.ES**=EP
5.EP=E+P
Этапы
фермент катализа:
1
этап:
происходит сближение и ориентация
субстрата относительно субстратного
центра фермента
и его постепенное «причаливание» к
«якорной»
площадке.
2
этап:
напряжение и деформация: индуцированное
соответствие — происходит присоединение
субстрата, которое вызывает конформационные
изменения в молекуле фермента приводящие
к напряжению структуры активного центра
и деформации связанного субстрата.
3
этап:
непосредственный катализ.
Как можно доказать наличие белков в продуктах питания
Ежедневно на столе каждого из нас калейдоскопом сменяются десятки различных продуктов питания. К сожалению, на вид не всегда можно с уверенностью утверждать, что в представленной пище есть белок. Если вы заботитесь о своем здоровье и с особой тщательностью подбираете список полезных белковых продуктов, то вам просто необходимо знать способ качественного определения белка в продуктах. А поможет вам в этом простая в исполнении биуретовая реакция.

Вам понадобится
- — продукт для анализа;
- — гидроксид натрия (NaOH) 10%-ный;
- — сульфат меди (CuSO4) 1%-ный;
- — мерный стаканчик с делением в 1 мл или пробирка;
- — вода;
- — пипетка;
- — прозрачная тара.
Инструкция
Возьмите исследуемый продукт и измельчите путем разрезания и растирания до состояния кашицы. Например, яичный желток разотрите ложкой, а мясо измельчите в блендере. Если вы берете заведомо жидкий продукт питания, например, бульон, то первый шаг можете смело пропустить.

В заранее подготовленный мерный стаканчик помещаем полученную в первом шаге массу в объеме 0,5 мл и разводим водой до деления в 1 мл. Это и станет нашим исследуемым раствором. Если в первом пункте вы брали жидкий продукт питания (бульон, компот), то водой разводить его нет необходимости, просто отмерьте 1 мл продукта мерным стаканчиком или пробиркой.

Добавляем в отдельной прозрачной таре (пробирке) к 1 мл исследуемого раствора 1 мл 10 % раствора гидроксида натрия (NaOH). В домашних условиях отлично подойдет любое средство для прочистки труб, в его состав всегда входит необходимый нам компонент и стоит копейки. Будьте осторожны при работе с этим веществом: при попадании на кожу вызывает серьезные химические ожоги.

Пипеткой добавляем к раствору 2-3 капли 1 % раствора сульфата меди (CuSO4). Приобрести его можно в хозяйственных магазинах, в супермаркетах отдел сад/огород, так как на практике медный купорос используют для борьбы с болезнями растений.

Перемешиваем содержимое прозрачной тары (пробирки). Внимательно следим за изменением окраски раствора. Если белок в биологическом продукте или лекарственном препарате — присутствует, то его пептидные связи образуют с ионами меди в щелочной среде комплексные соединения, цвет которых мы и будем объяснять в следующем шаге.
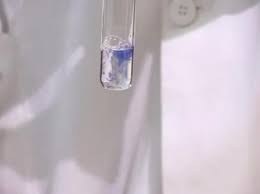
Интерпретируем изменение цвета исследуемого раствора. Если белки присутствуют – мы увидим фиолетовую окраску. В таком случае биуретовая реакция на качественное определение белка в продуктах питания будет считаться положительной. Однако, стоит обратить внимание и на оттенок жидкости, он должн стать красным либо синим.

Видео по теме
Обратите внимание
Интенсивность окраски будет зависеть от количества белка в растворе. А цвет окрашенного раствора зависит от длины полипептидной цепи.
Полезный совет
При работе с едким натрием и медным купоросом рекомендуется использовать индивидуальные средства защиты: резиновые перчатки, прорезиненный костюм, брызгозащитные очки. При попадании на слизистую – промойте проточной водой. При попадании на кожу промойте уксусом. Не допускайте пыления сульфата меди, используйте маску или респиратор. После работы обязательно тщательно вымойте руки и лицо.
Источники:
- Видео «биуретовая реакция».
- Описание химических принципов и вариантов биуретовой реакции.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.










