Физические свойства
Бромид калия KBr — соль щелочного металла калия и бромоводородной кислоты. Белое кристаллическое вещество. Плавится без разложения. Хорошо растворяется в воде (гидролиза нет).
Относительная молекулярная масса Mr = 119; относительная плотность для тв. и ж. состояния d = 2,75; tпл = 734º C.
Способ получения
1. При температуре 150–200º C, в результате взаимодействия калия и брома, образуется бромид калия:
2K + Br2 = 2KBr
2. Холодный йодид калия реагирует с бромом. При этом образуются бромид калия и осадок йод:
2KI + Br2 = 2KBr + I2↓
Качественная реакция
Качественная реакция на бромид калия — взаимодействие с нитратом серебра, в результате реакции происходит образование осадка бледно — желтого цвета:
1. При взаимодействии с нитратом серебра, бромид калия образует нитрат калия и осадок бромид серебра:
KBr + AgNO3 = KNO3 + AgBr↓
Химические свойства
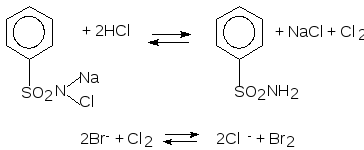
1. Бромид калия вступает в реакцию с простыми веществами. Горячий бромид калия взаимодействует с хлором. В результате реакции происходит образование хлорида калия и газа брома:
2KBr + Cl2 = 2KCl + Br2↑
2. Бромид калия способен вступать в реакцию со сложными веществами:
Бромид калия реагирует с кислотами. Твердый бромид калия реагирует с холодной серной кислотой с концентрацией 10–50%. Взаимодействие данных веществ приводит к образованию сульфата калия и бромоводородной кислоты:
2KBr + H2SO4 = K2SO4 + 2HBr,
Если концентрацию горячей серной кислоты поднять выше 50 %, то в результате реакции образуется гидросульфат калия, бром, оксид серы (IV) и вода:
2KBr + 3H2SO4 = 2KHSO4 + Br2 + SO2 + 2H2O
Admin2
Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время.
Вы можете также связаться с преподавателем напрямую:
8(906)72 3-11-5 2
Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте.
Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши.
Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить».
Этим вы поможете сделать сайт лучше.
К сожалению, регистрация на сайте пока недоступна.
На сайте есть сноски двух типов:
Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего.
Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения.
Здесь вы можете выбрать параметры отображения органических соединений.
Бромид калия (KBr): структура и свойства
Бромид калия (KBr): структура и свойства — Наука
Содержание:
В бромид калия (KBr) представляет собой галоидную соль, продуцируемую сильно электроположительным элементом, таким как калий (K), и другим сильно электроотрицательным элементом, таким как бром (Br). Внешний вид — белое кристаллическое твердое вещество, гигроскопично; то есть впитывает воду из окружающей среды.
При инфракрасном анализе образцов использование ячеек KBr для хранения образца очень практично из-за их прозрачности, которая не взаимодействует с падающим излучением.
Структура (твердое состояние)
Кристаллическая структура: хлорид натрия.
Координационная геометрия: октаэдрическая.
Биполярный момент: 10,41 Д (газ).
Тип ссылки
KB имеет связь ионного типа. Этот тип связи очень распространен, когда присоединен щелочной металл, который находится в семействе IA периодической таблицы.
Это элементы с высокой реакционной способностью, поскольку они обладают большой способностью терять электроны и образовывать положительно заряженные катионы с элементами семейства VIIA.
Эта группа известна под названием галоген, что означает образование соли. Это очень электроотрицательные элементы, поэтому они притягивают электроны, которые высвобождаются электроположительными элементами, образуя отрицательно заряженные анионы.
Эти связи обычно возникают в водной среде, поскольку именно вода способствует образованию положительных и отрицательных ионов в процессе диссоциации.
В этом типе связи существует электростатическая связь между заряженными частицами, поэтому сила между ними не очень велика; отсюда его способность к диссоциации в воде.
Физические и химические свойства
Физический
Молярная масса
Плотность
Температура плавления
Точка кипения
Растворимость воды
53,5 г / 100 мл (0 ° С)
Этот элемент проводит электрический ток в растворе и кристаллизуется в прямоугольные призмы или кубики с едким (кислым) вкусом.
Химическая
KBr — стабильное соединение при комнатной температуре. Он характеризуется низкой реакционной способностью с другими веществами.
С нитратом серебра он дает желтовато-белый осадок бромида серебра, который широко используется в фотографии из-за его чувствительности к свету.
Хотя это соединение с низкой реакционной способностью, для работы с ним необходимо использовать нитриловые перчатки, защитные маски, защитные очки, фартук и закрытую обувь.
Приложения
— Он действует как мочегонное и слабительное (слабительное), хотя он также имеет другие применения с точки зрения здоровья в нервной сфере.
— До появления фенобарбитала бромид калия применялся как успокаивающее и противосудорожное средство. Исследование сэра Уильяма Гоуэса подчеркнуло важность бромида как эффективного соединения для лечения судорог. Следует отметить, что ион бромида (Br – ) отвечает за заживление, независимо от сопутствующего катиона.
Эпилепсия
В январе 1874 года доктор Фрэнсис Ансти сообщил о случае эпилепсии, «излеченной» бромидом калия, когда припадки полностью прекратились и отсутствовали еще долгое время после того, как лекарство было прекращено.
Ансти упомянула доктора Хьюлингса Джексона, чей общий опыт по этому вопросу в значительной степени соответствовал ее опыту.
Объединенный опыт Ансти и Джексона, должно быть, распространился на такую широкую область, что были и другие случаи, когда бромид калия использовался в сочетании с каннабис индика, и, как оказалось, оказал положительное влияние на лечение эпилепсии.
Контроль судорог у собак
В одном исследовании добавление бромида калия (KBr) к режиму лечения собак с припадками снизило их тяжесть.
Использование KBr позволило значительно снизить пероральные дозы фенобарбитала у 7 из 10 собак, тем самым устранив большую часть вызванных лекарством поведенческих аномалий и снизив риск гепатотоксичности (токсичность для печени).
Был сделан вывод, что KBr следует рассматривать как дополнительную терапию для собак с тяжелыми судорожными расстройствами, которые не реагируют на высокие дозы только фенобарбитала.
Спектроскопия
Бромид калия помогает идентифицировать жидкие соединения с помощью инфракрасной спектроскопии. Этот метод используется для определения элементного состава вещества.
Каждая молекула имеет уникальный профиль поглощения света в инфракрасном (ИК) спектре. Это определяется путем прохождения через образец луча инфракрасного света.
Жидкие и твердые образцы готовят к исследованию, помещая их между двумя пластинами бромида калия. Пластинки прозрачны для инфракрасного света и не дают никаких линий на спектре.
Пластины соли бромида калия используются, потому что, будучи гигроскопичными, они могут притягивать молекулы воды.
Ссылки
- Перас, Л., К., (1990), Калий бромид в качестве дополнения к фенобарбиталу для лечения неконтролируемых судорог у собак, статья в журнале: Progress in veterinary Neurology vol. No. 1pp95-101.ref.1 Получено с cabdirect.org
- Chevallier, M, A., (1854), Словарь изменений и фальсификаций пищевых продуктов, лекарственных и коммерческих веществ, с указанием средств их распознавания. Мадрид, Manuel Álvarez Printing, Estudios, 9
- Нортон Мэннинг, П. (апрель 1875 г.), Journal of Mental Science,Бромид калия при эпилепсии, Volume 21, Issue 93, 78-80, doi.org / 10.1017 / S0368315X00000086, онлайн-публикация, февраль 2018 г.
Что такое детрит? (В биологии, геологии и медицине)
Пероксид натрия (Na2O2): состав, свойства, применение
источники:
http://acetyl.ru/o/qy48.php
http://ru1.warbletoncouncil.org/bromuro-potasio-1256

Содержание
- Получение
- В промышленности
- В лаборатории
- Растворимость
- Химические свойства
- Бромирующий агент
- Применение
- Физиологическое действие
Бромид калия — неорганическое соединение, калиевая соль бромоводородной кислоты с химической формулой KBr. Имеет вид бесцветного кристаллического вещества.
| Бромид калия | |
|---|---|
| Общие | |
| Систематическое наименование |
Бромид калия |
| Хим. формула | KBr |
| Физические свойства | |
| Состояние | бесцветные кристаллы |
| Молярная масса | 119,01 г/моль |
| Плотность | 2,75 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 734 °C |
| • кипения | 1435 °C |
| Химические свойства | |
| Растворимость | |
| • в воде | 65,220, 94,680 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7758-02-3 |
| PubChem | 253877 |
| Рег. номер EINECS | 231-830-3 |
| SMILES |
[K+].[Br-] |
| InChI |
1S/BrH.K/h1H;/q;+1/p-1 IOLCXVTUBQKXJR-UHFFFAOYSA-M |
| RTECS | TS7650000 |
| ChEBI | 32030 |
| ChemSpider | 22854 |
| Безопасность | |
| Токсичность | малотоксичен |
| Пиктограммы ECB |  |
| NFPA 704 |
Получение
В промышленности
- Для промышленных нужд бромид калия получают с помощью взаимодействия карбоната калия со смешанным бромидом железа (II, III) Fe3Br8:
В лаборатории
- В лабораторных условиях можно получать бромид калия с помощью взаимодействия гидроксида калия, брома и аммиака:
- Прямой синтез при комнатной температуре:
- Замещение бромом менее активного галогена (иода):
- Термическое разложение при температуре выше 434°С бромата калия:
-
Свойство
ЗначениеСтандартная энтальпия образования (298 К)
-392,5 кДж/мольЭнтропия образования (298 К)
95,85 Дж/(моль·К)Теплоёмкость (298 К)
52,07 Дж/(моль·К)Энтальпия плавления
29 кДж/мольРастворимость
Растворитель Температура, °C Растворимость,
г/100 г растворителяАцетон 20 0,03 Вода 0 53,5 Вода 10 59,5 Вода 20 65,2 Вода 25 68,1 Вода 30 70,9 Вода 40 75,8 Вода 60 85,5 Вода 80 94,6 Вода 100 103,3 Вода 150 127,3 Вода 200 153,2 Глицерин 25 17,8 Метанол 20 2,1 Этанол 20 0,46 Этанол 55 0,54 Химические свойства
Бромид калия является типичной ионной солью. При растворении в воде подвергается полной диссоциации, при этом не гидролизуется, поскольку образован сильным основанием (гидроксид калия) и сильной кислотой (бромоводородная кислота). Не образует кристаллогидратов. Не растворяется в концентрированной бромоводородной кислоте.
- Бром вытесняется более активными галогенами:
- В растворах могут протекать обычные обменные реакции:
- Проявляет восстановительные свойства:
-
(конц.
, кип.)
(разб.
)
(конц.
, кип.)
- С некоторыми бромидами в концентрированных растворах могут образовываться комплексные соединения:
- Электролиз в горячем растворе:
Бромирующий агент
- Используется для селективного транс-бромирования кратных связей алкенов и алкинов в присутствии диацетокси йодбензола в системе дихлорметан-вода. Для цис-бромирования применяют систему церий-аммоний нитрат—бромид калия.
- Для монобромирования дезактивированных производных анилина применяют окислительное бромирование бромидом калия и перборатом натрия.
Применение
- Используют как источник бромид-ионов для получения бромида серебра, который используется для изготовления фото- и киноплёнок.
- Применяется в составе фотографических проявителей в качестве антивуалирующего вещества. По сравнению с другими антивуалентами практически не поднимает контраст изображения.
- Для изучения ИК-спектров жидких веществ часто применяют технологию помещения вещества между пластинками из бромида калия (так называемую «таблетку»). Бромид калия не поглощает ИК-излучение в достаточно широком интервале длин волн, что позволяет использовать его для этих целей.
Физиологическое действие
Широко используется как противосудорожное и седативное вещество в конце 19 и начале 20 веков. Его действие основано на физиологическом влиянии бромид-иона (бромид натрия менее эффективен). KBr в настоящее время используется в качестве ветеринарного препарата, как противосудорожное лекарство для собак и кошек.
В разбавленных водных растворах бромид калия придаёт раствору сладкий вкус, при более высоких концентрациях раствор обладает горьким вкусом (эти эффекты обусловлены главным образом действием иона калия).
При высокой концентрации бромид калия сильно раздражает слизистую оболочку желудка, что приводит к тошноте и рвоте.
Смертельная доза LD50 равна 3070 мг/кг.
-
Общие
сведения.
Формула:
KBr
Броми́д
ка́лия
бесцветное кристаллическое вещество, калиевая соль
бромоводородной
кислоты.
Стандартная
энтальпия образования (298 К):
-392,5 кДж/моль
Энтропия
образования (298 К):
95,85 Дж/(моль·К)
Теплоёмкость (298
К):
52,07 Дж/(моль·К)
Энтальпия
плавления:
29 кДж/моль
Молярная
масса:
119,01 г/моль
Плотность:
2,75 г/см³
Температура
плавления:
734 °C
Температура
кипения:
1435 °C
-
Получение.
-
Для
промышленных нужд бромид калия получают
с помощью взаимодействия карбоната
калия со
смешанным бромидом
железа (II, III)Fe3Br8[1]:
4K2CO3 +
Fe3Br8 →
8KBr + Fe3O4 +
4CO2
-
В
лаборатоных условиях можно получать
бромид калия с помощью взаимодействия гидроксида
калия, брома и аммиака:
6KOH
+ 3Br2 +
3NH3 →
6KBr + 6H2O
+ N2↑
-
Качественный
анализ.
-
Аналитические
реакции на катион калия.
1.
Реакция с виннокаменной кислотой
H2C4H4O6
с образованием белого кристаллического
осадка гидротартрата калия, растворимого
в горячей воде, сильных кислотах и
щелочах и нерастворимого в уксусной
кислоте (ГФ).
KCl
+
H2C4H4O6
KHC4H4O6
+ HCl
Реакцию
проводят в присутствии ацетата натрия.
HCl
+ CH3COONa
CH3COOH
+ NaCl
Условия
проведения реакции: а) достаточно высокая
концентрация К+
в растворе;
б)
проведение реакции на холоду; в)
слабокислая или нейтральная реакция
раствора (рН 4-7);
г)
потирание стеклянной палочкой о стенку
пробирки.
Мешающие
ионы: NH4+,
катионы s2—
и d-элементов.
2.
Реакция с гексанитритокобальтатом(III)
натрия Na3[Co(NO2)6]
с образованием кристаллического осадка
жёлтого цвета, растворимого в сильных
кислотах, разлагающегося щелочами (ГФ).
2
KCl +
Na3[Co(NO2)6]
K2Na[Co(NO2)6]
+ 2 NaCl
Условия
проведения реакции: а) использование
свежеприготовленного реагента;
б)
избыток реагента; в) слабокислая среда
(рН 4-6); г) проведение реакции на холоду;
д) потирание стеклянной палочкой о
стенку пробирки.
Мешающие
ионы: NH4+,
катионы р- и d-элементов.
Реакция
используется как дробная после удаления
мешающих ионов действием гидроксида
натрия или карбоната натрия.
3.
Окрашивание бесцветного пламени горелки
в фиолетовый цвет (ГФ).
4.
Реакция с перхлоратом аммония NH4CIO4
с образованием кристаллов, имеющих вид
многогранников с затемненными гранями
(МКС).
KCl
+ NH4ClO4
KClO4
+ NH4Cl
Реакция
дробная, специфичная, проводится при
нагревании для повышения чувствительности
реакции.
Аналитические
реакции на бромид-ион.
1.
С
групповым реагентом — раствором AgNO3
(ГФ).
Методика:
к 2-3 каплям раствора бромида, подкисленного
HNO3
прибавляют 1-2 капли раствора нитрата
серебра. Выпадает желтоватый творожистый
осадок, трудно растворимый в водном
растворе аммиака, нерастворимый в
(NH4)2CO3.
-
С
хлорамином Б или хлорной водой (ГФ)
(экстракционный способ).
Методика:
к 2 каплям раствора, содержащего
бромид-ион, прибавляют 2 капли разбавленной
HCl, 3-5 капель хлороформа и 3-5 капли
хлорамина, взбалтывают. Слой хлороформа
окрашивается в жёлто-бурый цвет.
Иодид-ионы
должны отсутствовать или их предварительно
окисляют до иодноватой кислоты (см.
реакции с хлорной водой или KMnO4).
-
Количественный
анализ.
-
.
Определение
массовой доли бромида калия (натрия) в
растворе
аргентометрическим
методом Фольгарда
(вариант
обратного титрования)
Определение
основано на осаждении бромид-ионов
избытком раствора нитрата серебра в
азотнокислой среде, непрореагировавшая
часть которого оттитровывается раствором
тиоцианата аммония в присутствии
комплексообразующего индикатора
железоаммониевых квасцов.
KBr
+ AgNO3
= AgBr +
KNO3
+ (AgNO3)
AgNO3
+ NH4SCN
= AgSCN
+
NH4NO3
в
конечной точке титрования:
Fe
NH4(SO4)2
+ 3 NH4SCN
= Fe(SCN)3
+ 2 (NH4)2SO4
М
(KBr)
= 119,02 г/моль
М
(NaBr)
= 102,90 г/моль
Методика:
Определённый
объём раствора бромида калия или натрия
(индивидуальное задание) помещают в
колбу для титрования, прибавляют 3-5 см3
0,05 М раствора нитрата серебра, 10 капель
раствора железо-аммониевых квасцов и
титруют 0,05 М раствором тиоцианата
аммония до красноватой окраски раствора.
-
Применение.
Используют
как источник бромид-ионов для получения
бромида серебра, который используется
для изготовления фото-
и киноплёнок.
Бромид
калия облегчает
приступы аллергии вызванных дрозофилами.
Для
изучения ИК-спектров жидких веществ
часто применяют технологию помещения
вещества между пластинками из бромида
калия (так называемую «таблетку»). Бромид
калия не поглощает ИК-излучение в
достаточно широком интервале длин волн
(от 0,25 мкм до 25 мкм), что позволяет
использовать его для этих целей. Также
для изготовления таблеток для измерения
инфракрасных спектров поглощения иногда
применяют фторид
кальция.
-
Список
литературы.
-
Лурье
Ю.Ю. Справочник по аналитической химии.
Москва, 1972; -
Методическое
указание «Инструментальные методы
анализа», Пермь, 2004; -
Методическое
указание «Качественный химический
анализ», Пермь, 2003; -
Методическое
указание «Количественный химический
анализ», Пермь, 2004; -
Рабинович
В.А., Хавин З.Я. Краткий химический
справочник, Ленинград, 1991; -
«Большая
советская энциклопедия»; -
http://ru.wikipedia.org/.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Бромид калия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 24 сентября 2011;
проверки требуют 10 правок.
Перейти к: навигация,
поиск
| Бромид калия | |
 |
|
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Бромид калия |
| Химическая формула | KBr |
| Физические свойства | |
| Состояние (ст. усл.) | бесцветные кристаллы |
| Отн. молек. масса | 119 а. е. м. |
| Молярная масса | 119,01 г/моль |
| Плотность | 2,75 г/см³ |
| Термические свойства | |
| Температура плавления | 734 °C |
| Температура кипения | 1435 °C |
| Классификация | |
| Рег. номер CAS | 7758-02-3 |
Броми́д ка́лия (калий бромистый) — бесцветное кристаллическое вещество, калиевая соль бромоводородной кислоты. Химическая формула — KBr.
Содержание
- 1 Получение
- 2 Физико-химические свойства
- 2.1 Термодинамические величины
- 2.2 Растворимость
- 3 Химические свойства
- 3.1 Бромирующий агент
- 4 Применение
- 5 Физиологическое действие
- 6 Внешние ссылки
- 7 Примечания
- 8 Литература
- 9 См. также
[править] Получение
Для промышленных нужд бромид калия получают с помощью взаимодействия карбоната калия со смешанным бромидом железа (II, III) Fe3Br8[1]:
- 4K2CO3 + Fe3Br8 → 8KBr + Fe3O4 + 4CO2
В лабораторных условиях можно получать бромид калия с помощью взаимодействия гидроксида калия, брома и аммиака:
- 6KOH + 3Br2 + 2NH3 → 6KBr + 6H2O + N2↑
[править] Физико-химические свойства
Дипольный момент молекулы составляет 9,1 Дебая.
[править] Термодинамические величины
| Свойство | Значение |
|---|---|
| Стандартная энтальпия образования (298 К) | -392,5 кДж/моль |
| Энтропия образования (298 К) | 95,85 Дж/(моль·К) |
| Теплоёмкость (298 К) | 52,07 Дж/(моль·К) |
| Энтальпия плавления | 29 кДж/моль[2] |
[править] Растворимость
| Растворитель | Температура, °C | Растворимость, г/100 г растворителя |
|---|---|---|
| Ацетон | 20 | 0,03 |
| Вода | 0 | 53,5 |
| Вода | 10 | 59,5 |
| Вода | 20 | 65,2 |
| Вода | 25 | 68,1 |
| Вода | 30 | 70,9 |
| Вода | 40 | 75,8 |
| Вода | 60 | 85,5 |
| Вода | 80 | 94,6 |
| Вода | 100 | 103,3[3] |
| Вода | 150 | 127,3[3] |
| Вода | 200 | 153,2[3] |
| Глицерин | 25 | 17,8 |
| Метанол | 20 | 2,1 |
| Этанол | 20 | 0,46 |
| Этанол | 55 | 0,54 |
[править] Химические свойства
Бромид калия является типичной ионной солью. При растворении в воде подвергается полной диссоциации, при этом не подвергается гидролизу, так как соль образована сильным основанием (гидроксид калия) и сильной кислотой (бромоводородная кислота).
В растворах могут протекать обычные обменные реакции:
- KBr + AgNO3 → AgBr↓ + KNO3
С некоторыми бромидами в растворе могут образовываться комплексные соединения:
- 2KBr + CuBr2 → K2[CuBr4]
[править] Бромирующий агент
- Используется для селективного транс-бромирования кратных связей алкенов и алкинов в присутствии диацетокси йодбензола в системе дихлорметан-вода[4]. Для цис-бромирования применяют систему церий-аммоний нитрат—бромид калия[5].
- Для монобромирования дезактивированных производных анилина применяют окислительное бромирование бромидом калия и перборатом натрия[6].
[править] Применение
- Используют как источник бромид-ионов для получения бромида серебра, который используется для изготовления фото- и киноплёнок.
- Бромид калия облегчает приступы аллергии вызванных дрозофилами[7].
Приставка для ИК-спектрофотометра для изучения спектров жидких веществ в таблетах из бромида калия
- Для изучения ИК-спектров жидких веществ часто применяют технологию помещения вещества между пластинками из бромида калия (так называемую «таблетку»). Бромид калия не поглощает ИК-излучение в достаточно широком интервале длин волн (от 0,25 мкм до 25 мкм), что позволяет использовать его для этих целей. Также для изготовления таблеток для измерения инфракрасных спектров поглощения иногда применяют фторид кальция.
[править] Физиологическое действие
Широко используется как противосудорожное и седативное вещество в конце 19 и начале 20 веков. Его действие основанно на физиологическом влиянии бромид-иона (бромид натрия менее эффективен). KBr в настоящее время используется в качестве ветеринарного препарата, как противосудорожное лекарство для собак и кошек.
В разбавленных водных растворах бромид калия придаёт раствору сладкий вкус, при более высоких концентрациях раствор обладает горьким вкусом (эти эффекты обусловлены главным образом действием иона калия).
При высокой концентрации бромид калия сильно раздражает слизистую оболочку желудка, что приводит к тошноте и рвоте.
Смертельная доза LD50 равна 3070 мг/кг.
[править] Внешние ссылки
- Инфракрасная спектроскопия (англ.)
[править] Примечания
- ↑ Бромид калия на сайте Chemport.ru
- ↑ Рабинович В.А., Хавин З.Я. «Краткий химический справочник» Л.: Химия, 1977
- ↑ 1 2 3 При повышенном давлении.
- ↑ Efficient Bromination of Alkenes and Alkynes Using Potassium Bromide and Diacetoxy Iodobenzene. Synthetic Communications, V. 39, Issue 2, PP. 220-227 (англ.)
- ↑ An efficient bromination of alkenes using cerium(IV) ammonium nitrate (CAN) and potassium bromide. Tetrahedron V. 57, Issue 34, PP. 7417-742 (англ.)
- ↑ Mild and regioselective oxidative bromination of anilines using potassium bromide and sodium perborate. Tetrahedron Letters. — V. 41, Issue 13, PP. 2083-2085 (англ.)
- ↑ Potassium bromide, an anticonvulsant, is effective at alleviating seizures in the Drosophila bang-sensitive mutant bang senseless. Brain Research. — V. 1020, Issues 1-2, PP. 45-52 (англ.)
[править] Литература
- Рабинович В.А., Хавин З.Я. «Краткий химический справочник». Л.: Химия, 1977.
- Некрасов Б.В. «Основы общей химии». В 2-ух томах., М.:Химия, 1973.
[править] См. также
- Бромид натрия
- Инфракрасная спектроскопия