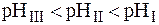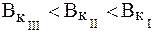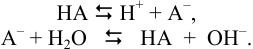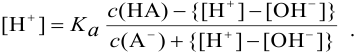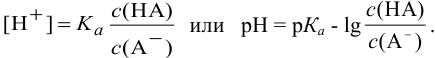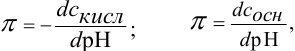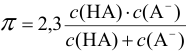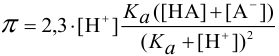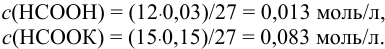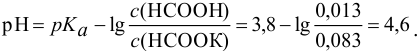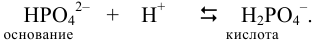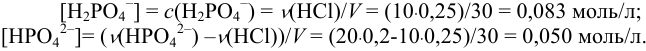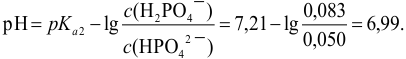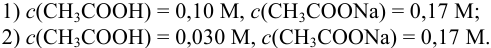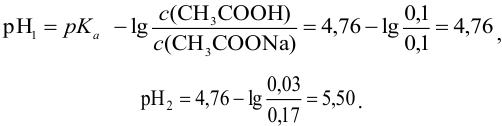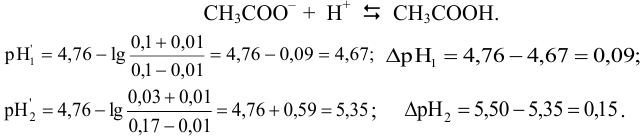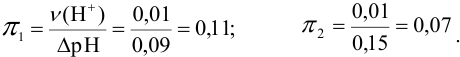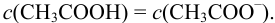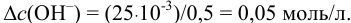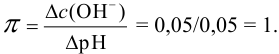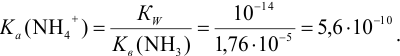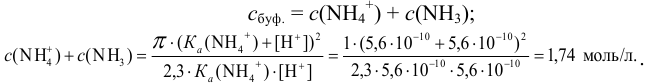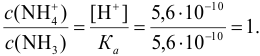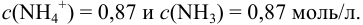Рассчеты, связанные с приготовлением буферных растворов
Вычисление буферной емкости по кислоте
Задача 51.
Какова буферная емкость по кислоте, если прибавление к 80 мл буферного раствора 30 мл 0,1 М раствора HCl вызвало изменение pH на единицу?
Решение:
Буферная емкость (buffer capacity) ß – число эквивалентов кислоты или щелочи, которое следует добавить к 1 л буферного раствора, чтобы изменить рН на единицу. Буферную емкость рассчитывают по уравнению:
ß = n/(z • V • ∆pH)
HCl — кислота одноосновная, поэтому z = 1:
n(HCl) = CV = 0,030 • 0,1 = 0,003 моль;
V(буфера) = 0,08 л
ß = 0,003/(1 • 0.08 • 1) = 0,0375 моль/л.
Ответ: ß = 0,0375 моль-экв/л.
Вычисление рН буферного раствора
Задача 52.
Вычислите рН раствора, полученного при смешивании 29 см3 6,2 Н. раствора уксусной кислоты и 1 см3 2,0 Н. раствора ацетата натрия.
Решение:
Получается буферный раствор — смесь слабой кислоты и ее соли (анионов слабой кислоты):
рН = рКа + lg[CM(соли)/CM(кислоты)];
CM = СH/z, где z — число эквивалентности.
Для кислоты z равно основности, для соли — числу катионов или анионов, умноженному на заряд соответствующего иона.
Уксусная кислота — одноосновная, поэтому z = 1.
В формуле ацетата натрия имеется по 1 иону с единичным зарядом, поэтому z = 1.
Соответственно, для обоих веществ СН = СМ.
При смешивании раствора получен буферный раствор объемом 29 + 1 = 30 мл = 0,03 л.
С1V1 = C2V2, отсюда:
См(СН3СООNa) = С1V1/V2(буф. p-pa) = (6,2 • 0,029)/0,03 = 5,99 М;
См(CH3COOH) = С1V1/V2(буф.) = (2 • 0,001)/0,03 = 0,067 М;
рК(СН3СООН) = 4,76;
рН = 4,76 + lg(5,99/0,067) = 4,76 + lg89,4 = 4,76 + 1,95 = 6,71.
Ответ: рН = 6,71.
Расчет количества (моль) одноосновной кислоты
Задача 53.
Какое количество (моль) одноосновной кислоты необходимо ввести больному с рН крови 7,6 объемом 4л и буферной емкостью по кислоте 0,06 моль/л для нормализации рН крови?
Решение:
Установлено, что состоянию нормы соответствует определенный диапазон колебаний рН крови – от 7,37 до 7,44 со средней величиной 7,40. Рассчет будем производить по формуле:
ß = n/(z • V • ∆pH), где
ß — буферная емкость, n — количество вещества кислоты или соли, z — основность кислоты, V — объем раствора, ∆pH — изменене системы.
ß = 0,06 моль/л;
z = 1, потому что кислота одноосновная;
∆pH = (7,6 — 7,4) = 0,2;
V = 4л.
Рассчитаем количество (моль) одноосновной кислоты, получим:
ß = n/(z • V • ∆pH);
n(кислоты) = ß • (z • V • ∆pH) = 0,06 моль/л • (1 • 4 л •0,2) = 0,048 моль.
Ответ: n(кислоты) = 0,048 моль.
Рассчеты, связанные с приготовлением буферных растворов
Вычисление буферной емкости по кислоте
Задача 51.
Какова буферная емкость по кислоте, если прибавление к 80 мл буферного раствора 30 мл 0,1 М раствора HCl вызвало изменение pH на единицу?
Решение:
Буферная емкость (buffer capacity) ß – число эквивалентов кислоты или щелочи, которое следует добавить к 1 л буферного раствора, чтобы изменить рН на единицу. Буферную емкость рассчитывают по уравнению:
ß = n/(z • V • ∆pH)
HCl — кислота одноосновная, поэтому z = 1:
n(HCl) = CV = 0,030 • 0,1 = 0,003 моль;
V(буфера) = 0,08 л
ß = 0,003/(1 • 0.08 • 1) = 0,0375 моль/л.
Ответ: ß = 0,0375 моль-экв/л.
Вычисление рН буферного раствора
Задача 52.
Вычислите рН раствора, полученного при смешивании 29 см 3 6,2 Н. раствора уксусной кислоты и 1 см 3 2,0 Н. раствора ацетата натрия.
Решение:
Получается буферный раствор — смесь слабой кислоты и ее соли (анионов слабой кислоты):
рН = рКа + lg[CM(соли)/CM(кислоты)];
CM = СH/z, где z — число эквивалентности.
Для кислоты z равно основности, для соли — числу катионов или анионов, умноженному на заряд соответствующего иона.
Уксусная кислота — одноосновная, поэтому z = 1.
В формуле ацетата натрия имеется по 1 иону с единичным зарядом, поэтому z = 1.
Соответственно, для обоих веществ СН = СМ.
При смешивании раствора получен буферный раствор объемом 29 + 1 = 30 мл = 0,03 л.
Ответ: рН = 6,71.
Расчет количества (моль) одноосновной кислоты
Задача 53.
Какое количество (моль) одноосновной кислоты необходимо ввести больному с рН крови 7,6 объемом 4л и буферной емкостью по кислоте 0,06 моль/л для нормализации рН крови?
Решение:
Установлено, что состоянию нормы соответствует определенный диапазон колебаний рН крови – от 7,37 до 7,44 со средней величиной 7,40. Рассчет будем производить по формуле:
ß = n/(z • V • ∆pH), где
ß — буферная емкость, n — количество вещества кислоты или соли, z — основность кислоты, V — объем раствора, ∆pH — изменене системы.
ß = 0,06 моль/л;
z = 1, потому что кислота одноосновная;
∆pH = (7,6 — 7,4) = 0,2;
V = 4л.
Рассчитаем количество (моль) одноосновной кислоты, получим:
ß = n/(z • V • ∆pH);
n(кислоты) = ß • (z • V • ∆pH) = 0,06 моль/л • (1 • 4 л •0,2) = 0,048 моль.
Ответ: n(кислоты) = 0,048 моль.
Буферные растворы
Буферные растворы — это растворы, величина рН которых мало изменяется при добавлении к ним небольших количеств сильных кислот или щелочей, а также при разбавлении.
C точки зрения протонной теории простейший буферный раствор состоит из слабой кислоты и сопряженного ей основания или слабого основания и его сопряженной кислоты. В этом случае буферное действие растворов характеризуется наличием кислотно-основного равновесия:
Образуемые сопряженные кислотно-основные пары НА/А– и В/ВН+ называют буферными системами.
Классификация буферных систем
1. Кислотные. Состоят из слабой кислоты и соли этой кислоты. Например, ацетатная буферная система (CH3COOH+ СН3СООNa ), гидрокарбонатная буферная система (H2CO3 +NaHCO3 ).
2. Основные. Состоят из слабого основания и его соли. Например, аммиачная буферная система (NH3⋅H2O + NH4Cl).
3. Солевые. Состоят из кислой и средней соли или двух кислых солей. Например, карбонатная буферная система (NaHCO3+Na2CO3 ), фосфатная буферная система (КН2PO4 + К2НPO4).
4. Аминокислотные и белковые. Если суммарный заряд молекулы аминокислоты или белка равен нулю (изоэлектрическое состояние), то растворы этих соединений не являются буферными. Их буферное действие начинает проявляться тогда, когда к ним добавляют некоторое количество кислоты или щелочи. Тогда часть белка (аминокислоты) переходит из изоэлектрического состояния в форму “белок-кислота” или соответственно в форму “белок-основание”. Образуется смесь двух форм белка: а) слабая “белок-кислота” + соль этой слабой кислоты; б) слабое “белок — основание” + соль этого слабого основания:

Расчет рН буферных систем
Для расчета рН в буферном растворе на примере ацетатного буфера рассмотрим процессы, в нем протекающие, и их влияние друг на друга.
Ацетат натрия практически полностью диссоциирует на ионы, ацетат-ион подвергается гидролизу, как ион слабой кислоты:
CH3COONa → Na+ + CH3COO–
CH3COO– + HOH ⇄ CH3COOH + OH–
Уксусная кислота, также входящая в буфер, диссоциирует лишь в незначительной степени:
CH3COOН ⇄CH3COO– + H+
Слабая диссоциация СН3СООН еще более подавляется в присутствии СН3СООNa, поэтому концентрацию недиссоциированной уксусной кислоты принимаем практически равной ее начальной концентрации:
С другой стороны, гидролиз соли также подавлен наличием в растворе кислоты. Поэтому можно считать, что концентрация ацетат-ионов в буферной смеси практически равна исходной концентрации соли без учета концентрации ацетат-ионов, образующихся в результате диссоциации кислоты:
Согласно закону действующих масс, равновесие между продуктами диссоциации уксусной кислоты и недиссоциированными молекулами подчиняется уравнению:
Кд = 
Подставив общую концентрацию кислоты и соли в уравнение константы диссоциации, получим: [Н+] = Кд
отсюда для кислотных буферных систем: рН = рК(кислоты) + lg 
рК — отрицательный десятичный логарифм константы диссоциации
После аналогичного вывода для основных буферных систем:
рОН = рК(основания) + lg 
где рК(кислоты),рК(основания) — отрицательный десятичный логарифм константы электролитической диссоциации слабой кислоты; слабого основания; [соль] — концентрация соли, [кислота] — концентрация кислоты, [основание] — концентрация основания.
Из этих уравнений видно, что рН кислотной (основной) буферной системы зависит от природы слабого электролита (рК(кислоты), рК(основания)) и от соотношения концентраций соли и кислоты (основания).
Следует отметить, что буферные системы эффективно поддерживают рН в диапазоне: рК(кислоты)± 1 для кислотных систем; 14 – (рК(основания)± 1) для основных систем.
Механизм действия буферных систем:
1. Разбавление. При разбавлении водой происходит уменьшение концентрации обоих компонентов в буферной системе в одинаковой степени, поэтому величина их соотношения не изменится. рК(кислоты) и рК(основания) являются постоянными при данной температуре и не зависят от разбавления. Действительно, одновременное понижение концентраций кислоты и соли в ацетатной буферной системе от 0,1М до 0,001М при разбавлении водой изменяет рН буферного раствора с 4,63 до 4,73 (это ничтожное изменение рН при разбавлении буферного раствора в 100 раз обусловлено некоторым изменением коэффициента активности соли). Следовательно, разбавление в конечном итоге мало изменяет рН буферных систем.
2. Добавление кислот и оснований. При добавлении небольших количеств сильных кислот или оснований рН буферных систем изменяется незначительно. Например, рассмотрим ацетатный буфер:
кислотный компонент – основной компонент–
слабая кислота сопряженное основание
а) При добавлении к ацетатному буферу небольшого количества HCl, происходит взаимодействие ионов Н+ с основным компонентом буферного раствора:
Н+ + СН3СОО–⇄ СН3СООН.
Степень диссоциации СН3СООН мала и концентрация [H+] практически не меняется. рН буферного раствора уменьшится, но незначительно.
Таким образом, если к ацетатному буферу добавить Х моль/л HCl, то уравнение для расчета рН буферной системы принимает вид:
рН = рК(кислоты) + lg
б) При добавлении небольшого количества NaOH, 

В результате этого, добавленное сильное основание заменяется эквивалентным количеством слабого сопряженного основания (СН3СОО–), которое в меньшей степени влияет на реакцию cреды. рН буферного раствора увеличивается, но незначительно.
Таким образом, если к ацетатному буферу добавить У моль/л NaOH, то уравнение для расчета рН буферной системы принимает вид:
рН = рК(кислоты) + lg
Способность буферного раствора сохранять значение рН при добавлении сильной кислоты или щелочи приблизительно на постоянном уровне характеризует буферная емкость.
Буферная емкость (В) — это число молей эквивалента сильной кислоты или щелочи, которое необходимо добавить к 1 л буферного раствора, чтобы сместить его рН на единицу.
Буферная емкость системы определяется по отношению к добавляемым кислоте (Вкисл.) или основанию (щелочи) (Восн.) и рассчитывается по формулам:
Вкисл.= 
где V(HA), V(B) — объемы добавленных кислоты или щелочи, л.; Сн(НА), Сн(В) — молярные концентрации эквивалента соответственно кислоты и щелочи; V(б. р.) — объем исходного буферного раствора, л.; рНо, рН — значения рН буферного раствора до и после добавления кислоты или щелочи; |рН-рНо| — разность рН по модулю.
Буферная емкость по отношению к кислоте (Вкисл.) определяется концентрацией (количеством эквивалентов) компонента с основными свойствами; буферная емкость по отношению к основанию (Восн.) определяется концентрацией (количеством эквивалентов) компонента с кислотными свойствами в буферном растворе.
Максимальная буферная емкость при добавлении сильных кислот и оснований достигается при соотношении компонентов буферного раствора равном единице, когда рН = рК, при этом Восн.= В кисл. (рис.1).Поэтому, применение любой буферной смеси ограничено определенной областью рН (областью буферирования), а именно:
рН = рК(кислоты)± 1 для кислотных систем, или
рН= 14 – (рК(основания)± 1) для основных систем.
Буферная емкость зависит не только от отношения концентраций компонентов буферного раствора, но и от общей концентрации буферной смеси.
Рис.1. Изменение буферной емкости в зависимости от величины отношения [соль]/[кислота].
Пусть, например, даны два буферных раствора, один из которых содержит по 100, а другой – по 10 миллимолей уксусной кислоты и ацетата натрия. Сравним, как изменяются их рН при добавлении к 1 л каждого раствора 5 миллимолей соляной кислоты.
Добавляемая кислота вступит в реакцию с ацетатом натрия, и это отношение в первом растворе станет равным 0,9, а во втором 0,33. В итоге у первого раствора отношение соль/кислота и, следовательно, величина рН изменились меньше. Отсюда видно, что первый буферный раствор обладает большей буферной емкостью.
Таким образом, буферная емкость в основном зависит от соотношения концентраций компонентов и их абсолютных концентраций, а следовательно, от разбавления.
Буферные системы организма
Главным источником ионов водорода в организме является углекислый газ, образующийся в результате метаболизма (обмена веществ) ≈ 15000 ммоль/сутки.
Гидратация углекислого газа приводит к образованию угольной кислоты:
СО2 + Н2О ⇄ Н2СО3⇄ 
В меньшей степени количество ионов Н+ (30–80 ммоль/сутки) обусловлено поступлением в организм, а также образованием в нем таких кислот как серной (в результате обмена серусодержащих аминокислот), фосфорной (при метаболизме фосфорсодержащих соединений), органических кислот, образующихся при неполном окислении липидов и углеводов.
Организм освобождается от кислот благодаря процессам дыхания и мочевыделения, т. е. в организме существует взаимосвязь между метаболическими процессами и газообменом. В оценке кислотно-основного состояния организма важно не только определение значения рН, но и характеристика механизмов, обеспечивающих регуляцию этого параметра.
Если бы в организме не было немедленных буферных механизмов и респираторной (дыхательной) компенсации, то тогда даже обычные, ежедневные нагрузки кислотами сопровождались бы значительными колебаниями величины рН.
Постоянство рН жидких сред организма поддерживается в живых организмах буферными системами. Главным из них являются гидрокарбонатная, гемоглобиновая, фосфатная и белковая. Действие всех буферных систем в организме взаимосвязано, что обеспечивает биологическим жидкостям постоянное значение рН. В организме человека и животных буферные системы находятся в крови (плазме и эритроцитах), в клетках и межклеточных пространствах других тканей.
Буферные системы крови представлены буферными системами плазмы крови и буферными системами эритроцитов. Буферные системы плазмы – гидрокарбонатная, белковая и фосфатная, роль последней незначительна. На их долю приходится ≈ 44% буферной емкости крови. Буферные системы эритроцитов – гемоглобиновая, гидрокарбонатная, система органических фосфатов (фосфатная). На их долю приходится ≈ 56% буферной емкости крови.
РН буферных растворов.
Для буферной системы I типа НА/A — концентрацию ионов Н + в растворе легко вычислить, исходя из константы диссоциации слабой кислоты (для простоты изложения вместо активностей ионов в выражении для 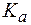
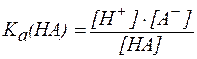
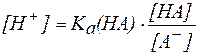
В присутствии второго компонента буферного раствора – сильного электролита – равновесие диссоциации слабой кислоты НA, согласно принципу Ле Шателье, смещено влево. Поэтому можно считать, что концентрация недиссоциированных молекул НA практически равна концентрации кислоты в буферном растворе, а концентрация ионов A — равна концентрации соли.
В таком случае можно записать:
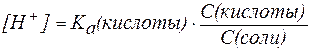 , , |
(3) |
где С(кислоты) и С(соли) – молярные концентрации кислоты и соли.
Если равенство (3) прологарифмировать (взять отрицательный десятичный логарифм левой и правой частей уравнения), то получим:
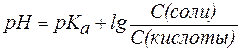 . . |
(4) |
Так, рН фосфатной буферной системы состава NaH2PO4/Na2HPO4 можно рассчитать по уравнению:
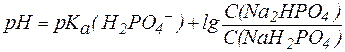
где 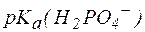
В случаях, когда требуется получить буферный раствор с задан-ным значением pH, используют уравнение:
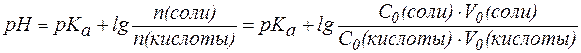 , , |
(5) |
где индексом «0» обозначены характеристики исходных растворов кислоты и соли, смешиванием которых получают требуемую буферную смесь.
Для буферной системы II типа В/ВН + , например аммонийной, гидроксидный и водородный показатели вычисляют по уравнениям:
где 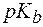
В общем виде уравнение для расчета pH буферных систем выглядит следующим образом:
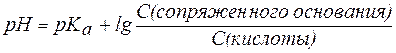 , , |
(7) |
и называется уравнениемГендерсона-Гассельбаха.
Из уравнения Гендерсона-Гассельбаха следует, что:
1. Величина рН буферных растворов зависит от константы диссоциации кислоты или основания и от соотношения количеств компонентов, но практически не зависит от разбавления или концент-рирования растворов. Действительно, в этих процессах концентрации компонентов буферного раствора изменяются пропорционально, поэтому их соотношение, которое определяет значение рН буферного раствора, остается неизменным.
Если концентрации компонентов буферных растворов превы-шают 0,1 моль/л, то в расчетах необходимо учитывать коэффициенты активности ионов системы.
2. Показатель константы диссоциации слабого электролита опре-деляет область буферного действия раствора, т.е. тот интервал значе-ний водородного показателя, в котором сохраняются буферные свой-ства системы. Поскольку буферное действие продолжается, пока не израсходовано 90% компонента (т.е. его концентрация не уменьши-лась на порядок), то область (зона) буферного действия отличается от 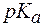
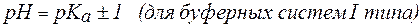
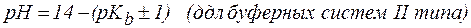
Амфолиты могут иметь несколько зон буферного действия, каждая из которых отвечает соответствующей константе 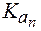
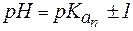
Таким образом, максимально допустимое соотношение компонентов раствора, при котором он проявляет буферное действие, составляет 10:1.
Пример 1. Можно ли приготовить ацетатный буфер с рН = 6,5, если 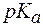
Поскольку зона буферного действия определяется как 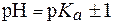
Буферная емкость.
Прибавлять кислоту или щелочь, существенно не меняя рН буферного раствора, можно лишь в относительно небольших коли-чествах, так как способность буферных растворов сохранять постоян-ство рН ограничена.
Величина, характеризующая способность буферного раствора противодействовать смещению реакции среды при добавлении кислот и щелочей, называется буферной емкостью (В).Различают буферную емкость по кислоте ( 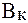
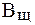
Буферная емкость (В) измеряется количеством кислоты или щелочи (моль или ммоль эквивалента), добавление которого к 1 л буферного раствора изменяет рН на единицу.
На практике буферную емкость определяют титрованием. Для этого определенный объем буферного раствора титруют сильной кислотой или щелочью известной концентрации до достижения точки эквивалентности. Титрование проводят в присутствии кислотно-основных индикаторов, при правильном выборе которых фиксируют состояние, когда компонент буферной системы прореагирует полностью. По полученным результатам рассчитывают величину буферной емкости ( 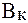
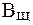
где С( 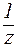
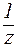
V(к-ты ), V(щел) — объемы добавленных растворов кислоты или щелочи (л; мл);
V(буфера) — объем буферного раствора (л; мл);
pH0 и pH — значения рН буферного раствора до и после титрования кислотой или щелочью (изменение рН берется по абсолютной величине).
Буферную емкость выражают в [моль/л] или в [ммоль/л].
Буферная емкость зависит от ряда факторов:
1. Чем больше абсолютное содержание компонентов пары основание/сопряженная кислота, тем выше буферная емкость буфер-ного раствора.
Буферная емкость зависит от соотношения количеств компо-нентов буферного раствора, а следовательно, и от рН буфера. Буфер-ная емкость максимальна при равных количествах компонентов бу-ферной системы и уменьшается с отклонением от этого соотношения.
3. При различном содержании компонентов буферные емкости раствора по кислоте и по щелочи отличаются. Так, в буферном растворе I типа чем больше содержание кислоты, тем больше буферная емкость по щелочи, а чем больше содержание соли, тем больше буферная емкость по кислоте. В буферном растворе II типа чем больше содержание соли, тем больше буферная емкость по щелочи, а чем больше содержание основания, тем больше буферная емкость по кислоте.
Пример 2. Для приготовления ацетатных буферных смесей растворы кислоты и соли одинаковой молярной концентрации были смешаны в следующих объемных соотношениях:
| Состав буферной системы | Объемные соотношения компонентов буферной системы | |
| раствор I | раствор II | раствор III |
| CH3COOH | ||
| CH3COONa |
Не прибегая к расчетам, определить, в каком из трёх буферных растворов будет наблюдаться:
а) наибольшее значение рН;
б) максимальная буферная емкость;
в) наибольшая буферная емкость по кислоте.
В случае равных концентраций компонентов уравнение (5) принимает вид:
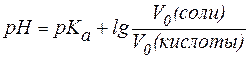
Так как 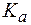
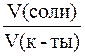
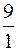
Максимальной буферной емкостью характеризуется II раствор, так как в нем соотношение количеств компонентов составляет 1:1.
Буферная емкость по кислоте для ацетатного буфера определя-ется содержанием сопряженного основания, т.е. соли: чем оно больше, тем больше буферная емкость раствора по кислоте. Поэтому:
Таким образом, наибольшую емкость по кислоте будет иметь I раствор.
http://pandia.ru/text/80/586/88844.php
http://helpiks.org/6-25734.html
Измерить
рН полученного от преподавателя буферного
раствора (объёмом 20 мл). Прибавить к нему
из бюретки 1 мл 0,1М раствора NaOH
или 0,1М раствора HCl в
зависимости от того, определяется
буферная емкость по кислоте или по
щелочи (по заданию преподавателя),
стаканчик приподнять и осторожно и
тщательно размешать содержимое. Измерить
рН и записать полученный результат в
таблицу 8.
Таким
путём прибавлять к исследуемому раствору
по 1 мл кислоты или щелочи до изменения
его рН приблизительно на единицу по
сравнению с начальным значением рН.
Вычислить общий объём прибавленного
реактива и соответствующее изменение
рН (рН) буферного
раствора. Вычислить буферную емкость
по формуле:
где Б – буферная
емкость по кислоте или щелочи; С1
– концентрация кислоты или щёлочи; V1
– объём прибавленного раствора кислоты
или щелочи, мл; V – объём
буферного раствора, взятый для
исследования, мл; рН
– разность значений рН до и после
прибавления кислоты или щёлочи (берётся
величина рН наиболее
близкая к 1). Например, при добавлении 4
мл кислоты рН = 0,89;
при добавлении 5 мл кислоты рН
= 1,07. 1,07 – 1,00 < 1,00 – 0,89, поэтому для
расчета используют рН
= 1,07.
Результаты
определения буферной емкости записать
в таблицу 8.
Таблица 8
Результаты определения буферной емкости номерного раствора
|
Исследуемый |
Объем |
рН |
Объем |
рН |
рН |
|
20 |
1 2 3 4 .. |
Б = …….
Таблица 9
Результаты
измерения рН и вычисления СН+
растворов
|
N |
Исследуемый |
рН |
СН+, |
|
1 |
Дистиллированная |
||
|
2 |
Почвенная |
По найденным
значениям рН вычислить активность ионов
водорода в растворе.
Пример: рН
= 2,34
— lg
aH+
= 2,34 lg aH+
= -2,34
lg
aH+
= 3,66
aH+
= 4,5710-3
М.
Результаты записать
в таблицу 9.
По окончании работы
с прибором электроды ополоснуть
дистиллированной водой, на электрод
сравнения надеть колпачок, стеклянный
– погрузить в стаканчик с дистиллированной
водой.
3. Электрическая проводимость и ее использование для анализа растворов электролитов.
Одним из многообразных
физических свойств растворов электролитов
является электрическая проводимость,
т.е. их способность проводить электрический
ток под действием внешнего электрического
поля.
Эта способность
электролитов объясняется наличием
ионов, несущих положительные и
отрицательные заряды, которые в отсутствии
внешнего электрического поля движутся
беспорядочно, все направления перемещения
ионов являются равновероятными. При
наложении внешнего электрического
поля движение ионов становится
упорядоченным. Катионы двигаются
по направлению к катоду, а анионы в
противоположном направлении — к
аноду.
Так как перенос
электричества в растворах осуществляется
за счет движения ионов, то количество
электричества, переносимое через
раствор, зависит от ряда факторов: от
природы вещества (сильный или слабый
электролит); концентрации ионов;
температуры и других параметров.
Мерой электрической
проводимости L растворов
электролитов является количество
электричества, выраженное в кулонах,
которое проходит через раствор за
единицу времени. Сила тока, возникающего
при движении ионов в растворе электролита
под влиянием внешнего электрического
поля, будет определяться уравнением:
I =
L × E
где I
— сила тока, L — электрическая
проводимость раствора, Е — напряженность
внешнего электрического поля.
С другой стороны,
согласно закону Ома, сила тока равна:
где R
— сопротивление раствора.
При сравнении этих
двух уравнений получим:
Таким
образом, электрическую проводимость
раствора электролита можно
характеризовать как величину, обратную
сопротивлению.
Сопротивление
электролита зависит от длины проводника
(),
площади поперечного сечения (S)
и удельного сопротивления ():
Если мы подставим
значение R в уравнение
электрической проводимости, то
получим:
где:
величина, обратная удельному сопротивлению
1/ =
, называется удельной электрической
проводимостью. Обозначается она
греческой буквой
(«каппа»). В
результате получим уравнение:
L
= ×
При
условии, что S = 1 м2
и l = 1 м, электрическая
проводимость раствора электролита
будет равна удельной электрической
проводимости:
L =
Удельная
электрическая проводимость — это
электрическая проводимость раствора
электролита, помещенного между электродами
площадью поперечного сечения 1 м2,
отстоящими друг от друга на 1 м. То
есть удельной электрической проводимостью
называется электрическая проводимость
1 м3 данного электролита. В системе
СИ единицей электрической проводимости
является Cименс (См),
следовательно, удельную электрическую
проводимость растворов выражают в См
/ м.
Так
как переносчиками электрических зарядов
в растворах являются ионы, то
электрическая проводимость раствора
будет тем больше, чем больше концентрация
ионов, чем быстрее они движутся в
электрическом поле и чем больше их
валентность. С увеличением концентрации
удельная электрическая проводимость
увеличивается, достигает максимального
значения, а при очень больших концентрациях
(порядка 10 моль/л и выше)
начинает
уменьшаться (рис.2).
Такая
зависимость четко выражена для сильных
электролитов и в меньшей степени для
слабых электролитов. Наличие максимумов
на кривых объясняется тем, что в
разбавленных растворах сильных
электролитов скорость движения ионов
почти не зависит от концентрации и
растет прямо пропорционально числу
ионов, которое увеличивается с
концентрацией. При достижении определенной
концентрации в растворах сильных
электролитов скорость движения ионов
уменьшается из-за появления ионных
атмосфер, вследствие чего уменьшается
скорость движения иона, в результате
чего удельная электрическая проводимость
также уменьшается.
Для
растворов слабых электролитов уменьшение
удельной электрической проводимости
с ростом концентрации объясняется
уменьшением степени диссоциации. В
результате количество образовавшихся
ионов в растворе слабого электролита
будет возрастать в меньшей степени,
чем аналитическая концентрация раствора.
Рис.2. Зависимость
растворов сильных и слабых
растворов электролитов от С.
Поскольку
перенос электричества в растворах
осуществляется за счет движения ионов,
следовательно, его количество зависит
от скорости движения ионов, которая
обратно пропорциональна их ионному
радиусу.
Так как ионы в
водной среде гидратируются, то необходимо
учитывать гидратированный «эффективный»
радиус иона, а не кристаллохимический.
Электропроводность
растворов щелочных металлов:
кристаллохимический
радиус иона
L
Na+ K+
Rb+ Cs+
р
гидратированного иона
Абсолютная
скорость движения иона (U) – путь в
метрах, пройденный ионом за 1 секунду
при напряженности электрического поля
в 1 Вольт. Размерность абсолютной скорости
м2В-1с-1.
Эти скорости в обычных условиях очень
малы и составляют величины порядка
10-7… 10-8 м2В-1с-1
Незначительная скорость ионов объясняется
их высокой гидратацией и сопротивлением
среды. Обращают на себя внимание большие
значения скоростей ионов водорода
(33,610-8)
и гидроксила (18,710-8)
в воде по сравнению с другими ионами,
что объясняется эстафетным перемещением
этих ионов.
Протоны проходят
не весь путь до катода, а только расстояние
между молекулами воды, т.е. как бы
передаются по эстафете от одной молекулы
воды до другой. Средняя продолжительность
жизни иона гидроксония (Н3О+)
составляет 10-11сек. Большая скорость
движения ОН— — ионов объясняется
тем же механизмом, однако при этом протон
передается от молекулы воды к
гидроксил-ионам. В результате процесс
выглядит как перемещение ОН— —
ионов к аноду.
Для
оценки количества электричества,
переносимого через раствор катионами
и анионами в отдельности, используется
понятие электролитической
подвижности
ионов — катиона (к)
и аниона (а):
к
= Uк
F
а
= Ua
F,
где
F
– число Фарадея = 96500 кул.
Влияние
заряда иона на удельную электрическую
проводимость состоит в том, что, чем
выше заряд иона, тем больше электричества
он переносит с одного электрода на
другой. В таблице 10 даются
к
и
а
некоторых ионов.
Таблица 10
Подвижности
ионов (∞)
при бесконечном
разведении (катионы)
|
ионы |
температура, |
ионы |
температура, |
||||||
|
0 |
18 |
25 |
100 |
0 |
18 |
25 |
100 |
||
|
Н+(Н2О) |
225,0 |
315,0 |
349,7 |
637,0 |
⅓Se+++ |
— |
— |
64,7 |
— |
|
Li+ |
19,1 |
33,4 |
38,7 |
120,0 |
⅓Ce+++ |
— |
— |
67,0 |
— |
|
Nа+ |
25,9 |
43,5 |
50,1 |
150,0 |
⅓Cr+++ |
— |
— |
67,0 |
— |
|
К+ |
40,3 |
64,6 |
73,5 |
200,0 |
½Mn++ |
27,0 |
44,0 |
53,5 |
— |
|
Rb+ |
— |
67,5 |
77,5 |
— |
½Fe++ |
28,0 |
44,0 |
53,5 |
— |
|
Cs+ |
44,0 |
68,0 |
76,8 |
200,0 |
⅓Fe+++ |
— |
— |
68,0 |
— |
|
NH4+ |
40,3 |
64,0 |
73,7 |
184,0 |
½Co++ |
28,0 |
45,0 |
54,0 |
— |
|
½Ве++ |
— |
— |
45,0 |
— |
½Ni++ |
28,0 |
45,0 |
54,0 |
— |
|
½Mg++ |
28,5 |
45,0 |
53,1 |
170,0 |
½Cu++ |
20,0 |
45,0 |
56,0 |
— |
|
½Ca++ |
30,8 |
51,0 |
59,5 |
187,0 |
Ag+ |
33,0 |
54,0 |
61,9 |
180,0 |
|
½Sr++ |
31,0 |
51,0 |
59,5 |
— |
½Zn++ |
28,0 |
45,0 |
53,5 |
— |
|
½Ва++ |
33,6 |
55,0 |
63,7 |
200,0 |
½Cd++ |
28,0 |
45,0 |
54,0 |
— |
|
½Ra++ |
33,0 |
56,6 |
66,8 |
— |
Tl+ |
43,0 |
66,0 |
74,9 |
— |
|
⅓Al+++ |
29,0 |
— |
63,0 |
— |
½Rb++ |
38,0 |
60,0 |
70,0 |
— |
Анионы
|
ионы |
температура, |
ионы |
температура, |
||||||
|
0 |
18 |
25 |
100 |
0 |
18 |
25 |
100 |
||
|
OH— |
105,0 |
174,0 |
200,0 |
446,0 |
½SeO42- |
— |
65,0 |
75,7 |
— |
|
F— |
— |
46,6 |
55,4 |
— |
N3— |
— |
— |
69,5 |
— |
|
Cl— |
41,4 |
65,5 |
76,3 |
207,0 |
NO2— |
44,0 |
59,0 |
72,0 |
189,0 |
|
ClO2— |
— |
— |
52,0 |
— |
NO3— |
40,2 |
61,7 |
71,4 |
— |
|
ClO3— |
36,0 |
55,0 |
64,0 |
172,0 |
NCO— |
— |
54,8 |
64,6 |
— |
|
ClO4— |
37,3 |
59,1 |
68,0 |
179,0 |
PO4H2— |
— |
28,0 |
36,0 |
— |
|
Br— |
41,3 |
67,6 |
78,4 |
— |
½PO4H2- |
— |
— |
57,0 |
— |
|
BrO3— |
31,0 |
49,0 |
56,0 |
155,0 |
AsO4H2— |
— |
— |
34,0 |
— |
|
J— |
42,0 |
66,5 |
76,9 |
— |
CO3H— |
— |
— |
44,5 |
— |
|
JO3— |
21,0 |
33,9 |
41,0 |
127,0 |
½ |
36,0 |
60,5 |
72,0 |
— |
|
JO4— |
— |
49,0 |
55,6 |
— |
CN— |
— |
— |
78,0 |
— |
|
SH— |
40,0 |
57,0 |
65,0 |
— |
½CrO42- |
42,0 |
72,0 |
85,0 |
— |
|
SO3H— |
27,0 |
— |
50,0 |
— |
MnO42- |
36,0 |
53,0 |
62,8 |
— |
|
½ |
— |
— |
72,0 |
— |
HCOO— |
— |
47,0 |
— |
— |
|
½ |
34,0 |
68,3 |
79,8 |
256,0 |
CH3COO— |
20,0 |
34,0 |
41,0 |
130,0 |
|
½S2O82- |
— |
— |
86,0 |
— |
½(C2O4)2- |
32,0 |
63,0 |
— |
— |
|
SCN— |
41,7 |
56,6 |
66,5 |
— |
С
ростом температуры удельная электрическая
проводимость растворов электролитов
увеличивается в среднем на 2 % на каждый
градус. Увеличение электрической
проводимости с ростом температуры
объясняется уменьшением вязкости воды,
а также ростом кинетической энергии
ионов, т.е. скорости их движения.
Так
как удельная электрическая проводимость
раствора электролита определяется
количеством ионов между электродами с
= 1 м и S
= 1 м2
и скоростью этих ионов, то
=
Ск
Uk
F + Ca
Ua
F
= Ci (k
+
a),
где
Сi
— ионная концентрация в 1 м3
раствора,
k
и
a
– электролитические подвижности катиона
и аниона.
Концентрацию
раствора (С) обычно выражают на 1 литр,
тогда
1000
= Сi
(k
+
a)
Это
уравнение называется основным
уравнением электрической проводимости.
В
слабых электролитах ионная концентрация
(Ci)
связана с аналитической концентрацией
уравнением:
Ci
= C
,
где
— степень электролитической диссоциации.
Тогда
основное уравнение электрической
проводимости для слабых электролитов
будет иметь вид:
1000
= С
(k
+
a)
Степень
электролитической диссоциации показывает,
какая часть молекул электролита в
растворе распалась на ионы:
=
Значение
измеряется в пределах от 0 до 1. Зависит
от природы электролита, природы
растворителя, температуры раствора и
степени его разбавления. У большинства
электролитов степень диссоциации по
мере увеличения температуры увеличивается,
а у некоторых (NH4OH,
СН3СООН) достигает максимума, а
затем уменьшается в связи с уменьшением
диэлектрической постоянной растворителя,
что благоприятствует образованию
молекул из ионов.
Известно, чем
больше диэлектрическая постоянная
растворителя, тем сильнее выражен
процесс диссоциации растворенного в
нем вещества. С разбавлением раствора
электролита вероятность взаимодействия
ионов в растворе уменьшается, степень
электролитической диссоциации
увеличивается.
В сильных
электролитах, где молекулы растворенного
вещества полностью диссоциированы на
ионы, ионная концентрация связана с
аналитической концентрацией уравнением:
Ci
= C fэ ,
где
fэ — коэффициент
электрической проводимости, отражающий
меру электростатического взаимодействия
и гидратации ионов в растворе. По своему
физическому смыслу fэ
соответствует fa
-коэффициенту активности. fэ
увеличивается при разбавлении
раствора и достигает 1 при максимальном
разбавлении, когда силы взаимодействия
между ионами приближаются к нулю. Для
разбавленных (С
0.1) растворов электролитов fэ
1. Поэтому при работе
с биологическими растворами принимают
fэ =1. Для сильных
электролитов основное уравнение
электропроводности имеет вид:
1000 = Сi
fэ (k
+
a)
Поскольку удельная
электрическая проводимость зависит от
многих факторов, и на её основе нельзя
сделать какие-либо выводы о влиянии на
величину проводимости электролитов
концентрации ионов, а также силы их
взаимодействия, Ленц ввел понятие
молярной или эквивалентной
электрической проводимости.
Молярной
электрической проводимостью λv
называется электрическая проводимость
столба раствора, содержащего 1 кмоль
(г×экв) электролита, заключенного
между электродами, расположенными на
расстоянии 1 м друг от друга. Молярную
электрическую проводимость обозначают
греческой буквой
(«лямбда»). Чтобы показать, к какому
разбавлению раствора относится молярная
электрическая проводимость, возле буквы
ставится индекс
(v), обозначающий разбавление
в литрах (V = 1/С), т.е.
количество литров, содержащее 1 кмоль
электролита, — v.
Формула,
связывающая молярную электрическую
проводимость с удельной имеет вид:
λv
=
1000 V
Отсюда:
λ
= 1000
С
Размерность v
— Смм2/кмоль.
Последний множитель
часто опускается и молярную электрическую
проводимость выражают в Смм2,
имея в виду 1 кмоль растворенного
вещества.
Молярная электрическая
проводимость у сильных и слабых
электролитов возрастает с увеличением
разбавления и достигает предельного
значения, которое называется молярной
электрической проводимостью при
бесконечном разбавлении и обозначается
.
Молярная электрическая
проводимость обусловлена при любом
разбавлении одинаковым количеством
электролита, а именно 1 кмоль. Ее
возрастание с разбавлением для слабых
электролитов объясняется тем, что
при этом увеличивается степень
диссоциации, т.е. увеличивается количество
свободных ионов, переносящих электричество.
При достаточно
большом разбавлении наступает полная
диссоциация раствора (
= 1), в этот момент v
достигает максимального значения,
равного ,
и дальнейшее разбавление не изменяет
данную величину, так как число ионов в
растворе остается неизменным.
Рис.3.
Влияние разбавления раствора на молярную
электрическую проводимость.
Из рисунка 3 видно,
что молярная электрическая проводимость
растворов сильных электролитов быстро
увеличивается и уже при умеренном
разбавлении почти достигает предела.
При разбавлении электролита увеличивается
объем раствора, соответственно
увеличивается расстояние между ионами.
В определенный момент ионы достигают
максимальной скорости движения. После
этого с увеличением разбавления скорость
движения остается неизменной, а молярная
электрическая проводимость переходит
в молярную электрическую проводимость
при бесконечном разбавлении ().
Растворы слабых
электролитов ведут себя иначе. Их
молярная электрическая проводимость
до разбавления близка к нулю и затем
медленно возрастает с увеличением
разбавления, так как увеличивается
степень диссоциации.
На основании
изложенного выше:
=
Следовательно,
молярная электрическая проводимость
электролита при бесконечном разбавлении
равна сумме электролитических подвижностей
катиона и аниона. В этом заключается
закон Кольрауша (закон аддитивности)
или закон независимого перемещения
ионов.
Молярная электрическая
проводимость также зависит от температуры
и увеличивается на 2 — 2,5 % с увеличением
температуры на градус.
Используя
основное уравнение электрической
проводимости для слабых электролитов
и закон Кольрауша, можно рассчитать
степень электролитической диссоциации:
1000
= С
(k
+
a)
α = 1000 /С(k
+
a),
где
1000 /С = λv,
(k
+
a)
= ,
тогда
α
= λv /
(уравнение
Аррениуса)
В
случае сильных электролитов аналогично
можно рассчитать коэффициент электрической
проводимости:
fэ
= 1000 /С(k
+
a)=
λv /
Степень диссоциации
зависит от концентрации и поэтому
непригодна для количественной оценки
силы электролита. Мерой силы слабого
электролита является константа
электролитической диссоциации,
величина которой для данного электролита
постоянна при любых концентрациях.
Константа электролитической диссоциации
определяется природой электролита и
меняется лишь с изменением температуры.
Чем константа электролита меньше, тем
слабее данный электролит:
Приведенная формула
является аналитическим выражением
закона разбавления Оствальда.
Буферная емкость раствора
Рассчитайте буферную емкость раствора, содержащего по 1 моль муравьиной кислоты (KД (HCOOH) = 1,77 ⋅ 10-4) и формиата натрия (HCOONa) в 1 литре раствора, по отношению к соляной кислоте (HCl) и гидроксида натрия (NaOH).
Решение задачи
Буферная емкость раствора характеризует способность буферного раствора поддерживать постоянное значение pH при добавлении кислоты или щелочи.
Буферную емкость раствора выражают количеством кислоты или щелочи, которое необходимо добавить к 1 л буферного раствора, чтобы понизить или повысить pH раствора на единицу. Добавление к буферному раствору кислоты понижает, а добавление щелочи увеличивает pH раствора.
Буферная емкость раствора тем больше, чем выше концентрация компонентов:
В данном случае получаем:
С H+ = 1,77 ⋅ 10-4⋅ 1 /1 = 1,77 ⋅ 10-4 (моль/л).
Вычислим водородный показатель буферного раствора по формуле:
Водородный показатель (pH) раствора численно равен отрицательному десятичному логарифму концентрации ионов водорода в этом растворе.
Получаем:
pH (буф. р-ра) = -lg 1,77 ⋅ 10-4= 3,75.
Обозначим буферную емкость раствора по отношению к соляной кислоте (HCl) через х моль. Тогда при добавлении х моль соляной кислоты (HCl) к 1 л раствора
концентрация муравьиной кислоты (HCOOH) увеличится до (1 + х) моль/л, а концентрация формиата натрия (HCOONa) уменьшится до (1 — х) моль/л.
При добавлении соляной кислоты (HCl) в количестве, равном буферной емкости раствора, pH раствора понизится на единицу, то есть будет равным 2,75.
В этом случае:
С H+ = 1,78 ⋅ 10-3 (моль/л)
1 – х = 0,1 (1 + х)
х = 0,818.
Таким образом, буферная емкость раствора по отношению к соляной кислоте (HCl) равна 0,818 моль/л.
Обозначим буферную емкость раствора по отношению к гидроксиду натрия (NaOH) через у моль. При добавлении у моль гидроксида натрия (NaOH) к 1 л раствора
концентрация соли (1 + у) моль/л; концентрация муравьиной кислоты (HCOOH) – (1 — у) моль/л.
При добавлении гидроксида натрия (NaOH) в количестве, равном буферной емкости раствора по отношению к NaOH, pH раствора увеличится на единицу и будет равным 4,75.
В этом случае:
С H+ = 1,78 ⋅ 10-5 (моль/л)
0,1 (1 + у) = 1 – у
у = 0,818.
Буферную емкость раствора по отношению к гидроксиду натрия (NaOH) также равна 0,818 моль/л.
Ответ:
буферную емкость раствора по отношению к соляной кислоте равна 0,818 моль/л;
буферную емкость раствора по отношению к гидроксиду натрия равна 0,818 моль/л.
Похожие задачи
Буферные растворы
Важным случаем кислотно-основного равновесия является равновесие в растворах, содержащих кислотно-основные сопряженные пары и обладающих буферным действием (буферные растворы). Их готовят разными способами: растворяя в воде слабую кислоту и ее соль (буферный раствор кислотного типа); слабое основание и его соль (буферный раствор основного типа); две соли многоосновных кислот разной степени замещения (например 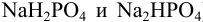
Буферное действие подобных систем проявляется в способности поддерживать 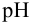
В растворе, содержащем сопряженную пару, например НА и 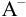
Концентрация ионов водорода в таком растворе (с учетом автопротолиза воды) выражается уравнением:
При достаточно высоких концентрациях 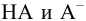
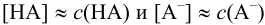
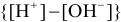
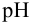
Каждый буферный раствор характеризуется сопротивляемостью к изменениям pH. Количественно ее выражают буферной емкостью 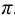
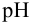
где 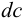
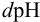
Буферная емкость связана с концентрацией компонентов буферной системы:
и с константой диссоциации кислоты 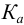
Зная буферную емкость, можно найти изменение 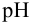
Пример 3.8.
К 12 мл 0,030 М раствора муравьиной кислоты прибавлено 15 мл 0,15 М раствора формиата калия. Вычислить pH полученной смеси.
Решение:
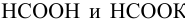
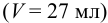
Рассчитаем 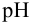
Пример 3.9.
К 20 мл 0,20 М раствора двухзамещенного фосфата калия прибавлено 10 мл 0,25 М раствора 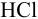
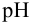
Решение:
При смешивании данных растворов происходит реакция:
Количество добавленной сильной кислоты меньше, чем 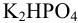
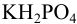
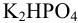
Находим 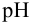
Пример 3.10.
Сравнить эффективность двух буферных растворов:
Решение:
Рассчитаем 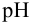
Эффективность буферного раствора будем оценивать по величине буферной емкости. Для этого к каждому буферному раствору “добавим” 0,01 моль 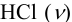
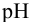
Рассчитаем буферную емкость с учетом формулы (3.12):
Первый буферный раствор обладает большей буферной емкостью, так как в этом растворе
Пример 3.11.
Определить состав аммонийной буферной смеси с 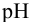
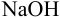
Решение:
Найдем 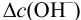
Найдем необходимую буферную емкость по формуле (3.12):
Рассчитаем константу кислотности 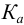
Зная 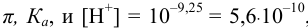
Из уравнения (3.11) находим отношение компонентов:
Следовательно, состав смеси:
Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы: