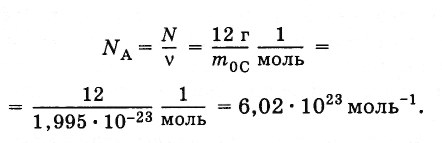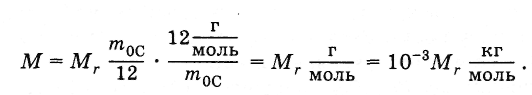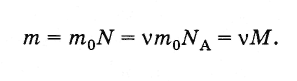найди число атомов каждого элемента в молекуле оксида углерода, если массовая доля углерода в нём равна (42,86) %, а массовая доля кислорода — (57,14) %.
1. Примем массу оксида равной (100) г. Масса углерода в такой порции равна (42,86) г, а масса кислорода — (57,14) г.
2. Находим относительные атомные массы элементов в Периодической таблице:
3. Обозначаем число атомов углерода как (x), а число атомов кислорода — (y), и записываем отношение масс:
.
4. Получаем выражение:
5. Находим отношение (x : y):
.
В молекуле оксида углерода на (1) атом углерода приходится (1) атом кислорода.
Чтобы узнать число атомов в молекуле, достаточно знать молекулярную формулу вещества. После чего мы суммируем число всех атомов в молекуле. Число атомов конкретного химического элемента в веществе мы узнаем по нижнему индексу.
Среди простых веществ, в природе молекулы встречаются не так часто. Среди них: водород H2, азот N2, кислород O2, озон O3, йод I2. За исключением озона все эти молекулы содержат по 2 атома.
Примеры
Определить количество атомов в молекуле воды H2O.
Молекула воды содержит 2 атома водорода и 1 атом кислорода. Значит всего в молекуле содержится 3 атома.
Определить количество атомов в молекуле этана C2H6.
Молекула содержит 2 атома углерода и 6 атомов водорода. Всего в молекуле содержится 2 + 6 = 8 атомов.
Определить количество атомов в молекуле оксида азота (V) N2O5.
Молекула содержит 2 атома азота и 5 атомов кислорода. Всего в молекуле содержится 2 + 5 = 7 атомов.
Определить количество атомов в молекуле пищевой соды NaHCO3.
Молекула содержит 1 атом натрия, 1 атом водорода и 3 атома кислорода. Всего в молекуле содержится 1 + 1 + 3 = 5 атомов.
Определить число атомов в молекуле глюкозы C6H12O6.
Молекула содержит 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода. Всего в молекуле содержится 6 + 12 + 6 = 24 атома.
Определить число атомов в молекуле аспаргина (одна из аминокислот) C4H8O3N2.
Как видим, молекула аспаргина содержит 4 атома углерода, 8 атомов водорода, 3 атома кислорода и 2 атома азота. Всего молекула содержит 4 + 8 + 3 + 2 = 17 атомов.
Как видим, рассчитать общее число атомов в молекуле не такая уж и сложная задача.
Какая ж тут формула может быть? Пишем молекулярную формулу и подсчитываем сумму индексов.
H2O = 2 + 1 = 3
CO2 = 1 + 2 = 3
CO = 1 + 1 = 2
Или нарисовать молекулу и собственным корявым пальцем пересчитать атомы.
Похоже Вы не так поняли. Афтор спрашивает «в веществе», а не в молекуле.
По формуле N=NAm/M, где NA — пост.Авогадро, M — молярная масса и, собственно, N — количество молекул в образце массой m. Далее N умножить на количество атомов в одной молекуле.
Как найти количество атомов в веществе
Чтобы найти количество атомов в веществе, определите, что это за вещество. Затем найдите его массу и молярную массу. После чего отношение массы и молярной массы умножьте на число Авогадро, которое равно 6,022*1023.
Вам понадобится
- Для определения количества атомов в веществе возьмите точные весы (рычажные или электронные), таблицу Менделеева, манометр, термометр.
Инструкция
Определение количества атомов в чистом веществе
Взвесьте образец исследуемого вещества на точных весах, результат получите в граммах. Убедитесь, что оно состоит из одноатомных молекул. Затем, используя таблицу Менделеева, найдите молярную массу исследуемого вещества, выраженную в граммах на моль. Для этого найдите элемент, соответствующий веществу, из которого состоит тело, и запишите его молекулярную массу. Она и будет равна молярной массе, выраженной в граммах на моль. Например, для железа (Fe) это 55,845 г/моль. Если же точно известен изотоп, например железо 55, то можно брать целое число, правда, чистые изотопы зачастую радиоактивны. Затем массу вещества поделите на его молярную массу, а результат умножьте на 6,022*10^23. Это и будет количество атомов в данной массе вещества.
Количество атомов в сложном веществе
Если вещество состоит из многоатомных молекул, например, вода, молекула которой состоит из одного атома кислорода и двух атомов водорода, сделайте следующую последовательность действий. С помощью весов найдите массу образца. Затем запишите его химическую формулу, и с помощью таблицы Менделеева найдите молярную массу каждого из атомов, из которых состоит молекула. В случае с водой это будет водород – 1 грамм на моль, и кислород – 16 грамм на моль. Поскольку водорода 2 атома, умножьте молярную массу на это число, в результате получите общую молярную массу 18 грамм на моль. Затем массу в граммах делим на молярную массу в граммах на моль и умножаем на 6,022*10^23. Результатом будет количество молекул в веществе, это число умножьте на количество атомов в одной молекуле (для воды оно равно 3).
Количество атомов в смесях и сплавах
Если вещество представляет собой смесь нескольких веществ с известными массовыми долями, измерьте его общую массу. Затем найдите массы чистых веществ, умножив массу на соответствующие доли. Например, если бронза содержит 70% меди и 30 % олова, но для получения массы меди умножьте массу образца на 0,7, а для получения массы олова умножите массу образца на 0,3. Далее действуйте, как описано в предыдущих пунктах.
Количество атомов в газе
Если газ находится в нормальных условиях (давление 760 мм рт. ст. и температура 00С), определите объем этого газа геометрическими методами (например, чтобы найти объем газа в комнате, представляющей собой параллелепипед, перемножьте длину, ширину и высоту), выразив его в кубических метрах. Полученное число поделите на 0,0224 и умножьте на 6,022*10^23. Если молекула газа двухатомная, умножьте результат на 2.
Если известны давление, объем и температура газа (давление измеряется манометром, а температура термометром), то найдите произведение давления в Паскалях на объем в куб. метрах, поделите на значение температуры в Кельвинах, и число 8,31. Полученный результат умножьте на 6,022*10^23 и количество атомов в молекуле газа.
Видео по теме
Обратите внимание
Как найти количество атомов в веществе. Чтобы найти количество атомов в веществе, определите, что это за вещество. Затем найдите его массу и молярную массу. После чего отношение массы и молярной массы умножьте на число Авогадро, которое равно 6,022*1023. Вам понадобится.
Полезный совет
Метод основан на связи между атомной (или молекулярной) массой кристаллического вещества, его плотностью, числом Авогадро и неким коэффициентом, который определяют из расстояний между атомами в кристаллической решетке. Зная это число, можно различными способами, которые и были испробованы в 1908-1910 гг., найти число N. Можно собрать α-частицы в цилиндре Фарадея, измерить их заряд и, разделив его на число частиц, получить заряд каждой из них; половина его дает нам элементарный заряд, по которому уже определяется число N…
Источники:
- как определить количество атомов
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Количество вещества
Чем больше атомов
или молекул в макроскопическом теле,
тем, очевидно, больше вещества содержится
в нем. Число молекул в макроскопических
телах огромно. Поэтому удобно указывать
не абсолютное число атомов, а относительное.
Принято
сравнивать число молекул или атомов в
данном теле с числом атомов, содержащихся
в углероде массой 12 г. Относительное
число атомов или молекул в теле
характеризуется особой физической
величиной, называемой количеством
вещества.
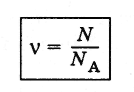
Количеством
вещества v
называют отношение числа молекул N
в
данном теле к числу атомов NA
в
12 г углерода*.
(2.2.2)
* Если вещество
состоит из отдельных атомов, не
объединенных в молекулы, то здесь и в
дальнейшем под числом молекул надо
подразумевать число атомов.
Зная
количество вещества v
и число NA,
мы
тем самым знаем число молекул N
в
веществе. Количество вещества выражают
в молях.
Моль
— это количество вещества, содержащего
столько же молекул, сколько атомов
содержится в углероде массой 12 г.
Если
количество вещества равно, например,
2,5 моль, то это означает, что число молекул
в теле в 2,5 раза превышает число атомов
в 12 г углерода, т. е. равно 2,5
NA.
Постоянная Авогадро
Число
молекул или атомов в моле вещества
называют постоянной Авогадро. Это
название дано в честь итальянского
ученого XIX
в. А. Авогадро**.
** А. Авогадро
(1776—1856) — итальянский физик и химик;
автор четырехтомного труда, который
был первым руководством по молекулярной
физике.
Согласно определению
моля постоянная Авогадро одинакова для
всех веществ. Она равна, в частности,
числу атомов в моле углерода, т. е. в 12 г
углерода.
Для
вычисления постоянной Авогадро надо
найти массу одного атома углерода (или
любого другого атома). Грубую оценку
массы можно сделать так, как это было
выполнено для массы молекулы воды.
Наиболее точные методы определения
массы основаны на отклонении пучков
ионов электромагнитным полем. Измерения
дают для массы атома углерода т0С
=
1,995·10-23
г. Отсюда постоянная Авогадро равна
(2.2.3)
Наименование
моль-1
указывает, что NA
—
число атомов любого вещества, взятого
в количестве одного моля. Если количество
вещества v
= 2,5 моль, то число молекул в теле N
= vNA
= 1,5·1024.
Существует много
других методов определения постоянной
Авогадро, не связанных с нахождением
масс атомов. Все они приводят к одним и
тем же результатам. Постоянная Авогадро
играет важнейшую роль во всей молекулярной
физике и является универсальной
постоянной.
Огромная величина
постоянной Авогадро показывает, насколько
малы микроскопические масштабы по
сравнению с макроскопическими. Тело,
обладающее количеством вещества 1 моль,
имеет привычные для нас макроскопические
размеры.
Молярная масса
Наряду
с относительной молекулярной массой
Мr,
в
физике и химии широко используется
понятие молярной массы М.
Молярной
массой называют массу
вещества,
взятого в количестве одного моля.
Согласно этому
определению молярная масса равна
произведению массы молекулы на постоянную
Авогадро:

(2.2.4)
Молярная
масса простым образом связана с
относительной молекулярной массой.
Подставив в формулу (2.2.4) выражения т0
из
(2.2.2) и NA
из
(2.2.3), получим:
(2.2.5)
Например,
молярная масса воды Н2О
равна 18 г/моль, или 0,18 кг/моль, так как
относительная молекулярная масса воды
приближенно равна 18.
Масса
m
произвольного
количества вещества v
и молярная масса М
связаны
соотношением:
(2.2.6)
Так,
масса 3 моль воды равна: m
= 3
моль·0,018 кг/моль = 0,054 кг.
Используя
формулы (2.2.6) и (2.2.2), можно получить
формулу для числа молекул в теле в
зависимости от массы тела m
и
молярной массы М:
(2.2.7)
Нужно
запомнить значение постоянной Авогадро:
достаточно знать порядок величины 1023.
Столько
молекул содержится в
12 г углерода,
в
18 г воды
и т. д. Формулы (2.2.1),
(2.2.2) и
(2.2.4)
дают
определения новым физическим величинам:
относительной молекулярной массе,
количеству вещества и молярной массе.
Вывести их нельзя, их надо просто
запомнить. Остальные формулы можно
вывести, и запоминать их необязательно.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #