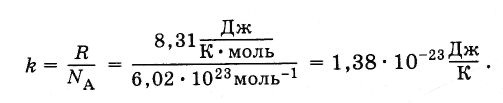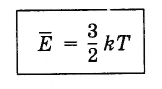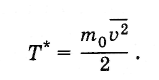Откуда взялась физическая постоянная Больцмана?
Постоянная Больцмана – постоянная величина, которая названа в честь своего первооткрывателя – Людвига Эдварда Больцмана. Австрийский физик опередил свое время, сделав значительный вклад в статическую физику, заложив фундамент в молекулярно-кинетическую теорию и доказав миру, что поведение и физические свойства материи напрямую зависят от явлений на атомном уровне. Постоянная обозначается символом k и равняется 1,38 x 10–23 Дж/К. Она напрямую связывает параметры микромира (атомы и молекулы) с макроскопическими свойствами (температура и давление).
Что же это такое и в каких единицах измеряется
Определение
Постоянная Больцмана – это такая физическая постоянная, которая связывает энергию и температуру, измеряется в Дж ⋅ К −1. В рамках этого определения давление обуславливается упругими столкновениями молекул газа о стенки сосуда, а температура скоростью молекул (их кинетической энергией движения).
Рассмотрим два метода нахождения коэффициента Больцмана:
Важно! Постоянная Больцмана и Постоянная Стефана-Больцмана – не одно и то же. Так как по определению постоянная Стефана-Больцмана: неизменная величина – коэффициент пропорциональности в законе Стефана-Больцмана: полная энергия, которая излучается единицей площади с поверхности абсолютно черного тела, пропорциональная 0,25 степени температура. Значение — 5,670 374 419… ⋅10⁻⁸ Вт·м⁻²·К⁻⁴. полная энергия, излучаемая единицей площади поверхности абсолютно чёрного тела за единицу времени, пропорциональна четвёртой степени термодинамической температуры.
Как найти постоянную Больцмана при помощи уравнения Менделеева-Клайперона
Постоянная Больцмана используется в уравнении, используемого для нахождения идеального газа и выглядит как:
pV= uRT, где:
- p – это давление
- V – это объем
- u – это «ню», количество вещества, измеряемое в молях
- R – это универсальная газовая величина, являющаяся постоянной и равная 8,314
- T – температура в Кельвинах
А универсальная газовая постоянная находится с использованием неизменной Больцмана по формуле R = kNa,
Na – постоянная Авогадро, равная 6·10^23
Через эксперимент определим, что при изменении температуры с Т0=273 до Т=373, давление изменилось с p0=1,013·105 Па до p 0 = 1, 38 ⋅ 10. Такой эксперимент легко можно повторить, используя термометр для изменения температуры (важно не забыть после перевести в Кельвины по формуле T=t+T0, где Т0 – это 273, а t – температура в цельсиях) и манометр для давления.
Далее важно не забывать, что количество молекул в 1 моле газа равняется число Авогадро, а при 1 атм V = 22,4 л.
Подставляем все вышеперечисленные параметры в уравнение и вычисляет число k.
Вывод постоянной Больцмана с использованием броуновской формулы взвешенных частиц
Проведем эксперимент для следующего метода вычисления. Возьмем и подвесим на упругой нити зеркало небольшого размера. Наша система воздух-зеркало существует в статическом равновесии (состояние покоя под действием сил). Зеркало в данной системе можно считать броуновской частицей, так как о него ударяются молекулы воздуха. Беря во внимание его подвешенное состояние, наблюдаем вращательные колебания вокруг оси, которая совпадает с вертикально направленной нитью-подвесом. Далее направляем на зеркало луч света и видим, что при малейших поворотах и движениях зеркала луч заметно смещается. Это позволяет найти вращательные колебания у зеркала.
Модуль кручения можем обозначить буквой L, а J – будет моментом инерции для оси вращения, ф – угол поворота зеркала. Равенство крутильных колебаний будет выглядеть как:
Jф = -Lф
В правой части запишем минус, так как момент сил упругости возвращает зеркало в состояние равновесия. При преобразовании уравнения колебаний и домножения обеих частей на ф получим:
Jφ22+Lφ22=Const
Так как колебания гармонические, то здесь действует закон сохранения энергии, значит потенциальная будет переходить в кинетическую и так далее. С учетом закона равномерного распределения энергии запишем конечную формулу и подставим исходные данные, получим постоянную Больцмана:
k=⟨φ2⟩/LT
Данные, которые мы получили в эксперименте, это максимальное значение угла поворота ⟨φ⟩≈4×10−6, модуль кручения L≈10^15Н×м при температуре T≈290K. Таким образом, через макропараметры мы можем найти требуемую физическую постоянную.
Значение постоянной Больцмана
С помощью данной постоянной легко можно связать микрочастицы (молекулы, электроны, протоны, кварки) с элементами макромира (температуру Кельвина). Для примера приведем формулу связи энергии поступательного движения молекул с температурой по Кельвину по формуле:
maxE > = 3/ 2 k T
Физическая Больцмана, помимо уравнения Менделеева-Клайперона, также помогает найти среднюю энергию молекулы, кинетическую теорию газа, распределение Больцмана-Максвелла и многое другое. Постоянная важна для исследования полупроводников, определяет энтропию с использованием формулы S = k log p + b.
Уравнение вида 1/2 mv2 = kT является своеобразным «мостиком» для микропараметров в левой стороне и макропараметрами в правой части.
Нет времени решать самому?
Наши эксперты помогут!
Приведем пример задач с использованием k
Задача 1:
Чтобы определить экспериментальным путем значения Авогадро с использованием метода Перрена, нашли, что если увеличить слой жидкости на 13 мкм, то концентрация частиц гуммигута упадет в 2 раза. Найдите радиус частичек при температуре 1 градус по Цельсию, плотность жидкости 0,910, а плотность гуммигута 1,210.
Решение с пояснениями: маленькие частицы ведут себя подобно молекулам при взвешивании в газе или жидкости, поэтому нахождение изменения их концентрации справедливо по распределению Больцмана.
[n=n_{0} exp left(frac{-E_{h}}{k T}right)]
n – это концентрация, h – это высота, к – постоянная, Т – температура в Кельвинах, п0 – концентрация на высоте, равной нулю, от неё отсчитывается потенциальная энергия, которая записывается как:
[E_{h}=Vleft(rho-rho_{1}right) g h]
V – принимаем за объем единичной частицы.
Подставим в формулу логарифм п0, который равняется 2, а затем вставим значения и посчитаем значение объема:
[V=frac{k T ln 2}{left(rho-rho_{1}right) g h}=72,5 cdot 10^{-21} mathrm{~m}^{3}]
Переведем через радиус правильного шара и получим г = 2,58 107м.
Ответ: радиус частичек гуммигута равняется г = 2,58 107м.
Задача 2:
Глубина скважины равняется 8 км, молярная масса воздуха 29-10-3 кг/моль, температура – 300 Кельвинов, воздушное давление над поверхностью Земли = 1 амт. Какое давление окажет воздух на дно скважины?
Решение с пояснениями:
Формула потенциальной энергии:
Eh = -mgh.
Для того, чтобы узнать распределение молекул по глубине, запишем формулу распределения Больцмана:
[n=n_{0} exp left(frac{-E_{h}}{k T}right)=n_{0} exp left(frac{m g h}{k T}right)]
Если Р = пкТ, то запишем уравнение при постоянной концентрации его молекул, которое будет равняться:
[P=P_{0} exp left(frac{m g h}{k T}right)=P_{0} exp left(frac{mathrm{Mgh}}{R T}right)]
Вставим известные значения и посчитаем давление:
[P=1 text { атм } cdot e^{frac{29 cdot 9,8 cdot 8 cdot 10^{3}}{8,31 cdot 10^{3} cdot 3 cdot 10^{2}}}=2,489 text { атм } cdot P=2,5 cdot 10^{5} text { Па. }]
Ответ: Давление воздуха на дно скважины равняется 2105 Па.
Задача 3:
Основание атмосферного столба равняется 1см2, у второго столба высотой 1000 метров то же основание. Сравнить полное число молекул обоих столбов.
Решение с пояснениями:
Обозначим число молекул в 1 объема и при нулевой высоте как N0, тогда формула распределения данных частиц по высоте будет выглядеть следующим образом:
[N(h)=N_{0} e^{-m g h /(k T)}=N_{0} e^{-mu g h /(R T)}]
Полное число молекул в столбе с основанием в 1 см2 и заданной высотой
[N(H)=int_{0}^{H} N(z) d z=N_{0} int_{0}^{H} e^{-mu g h /(R T)} d z=N_{0} frac{R T}{mu g}left(1-e^{-mu g H /(R T)}right)]
где µ — будет являться молярной массой воздуха.
Подставим значение высоты и получим:
[N(H rightarrow infty)=2.1 cdot 10^{25}]
Ответ: N(H = 103 ) = 0.25· 1025.
From Wikipedia, the free encyclopedia
| Boltzmann constant | |
|---|---|

Ludwig Boltzmann, the constant’s namesake |
|
| Symbol: | kB |
| Value in joules per kelvin: | 1.380649×10−23 J⋅K−1[1] |
The Boltzmann constant (kB or k) is the proportionality factor that relates the average relative thermal energy of particles in a gas with the thermodynamic temperature of the gas.[2] It occurs in the definitions of the kelvin and the gas constant, and in Planck’s law of black-body radiation and Boltzmann’s entropy formula, and is used in calculating thermal noise in resistors. The Boltzmann constant has dimensions of energy divided by temperature, the same as entropy. It is named after the Austrian scientist Ludwig Boltzmann.
As part of the 2019 redefinition of SI base units, the Boltzmann constant is one of the seven «defining constants» that have been given exact definitions. They are used in various combinations to define the seven SI base units. The Boltzmann constant is defined to be exactly 1.380649×10−23 J⋅K−1.[1]
Roles of the Boltzmann constant[edit]
Macroscopically, the ideal gas law states that, for an ideal gas, the product of pressure p and volume V is proportional to the product of amount of substance n and absolute temperature T:
where R is the molar gas constant (8.31446261815324 J⋅K−1⋅mol−1).[3] Introducing the Boltzmann constant as the gas constant per molecule[4] k = R/NA transforms the ideal gas law into an alternative form:
where N is the number of molecules of gas.
Role in the equipartition of energy[edit]
Given a thermodynamic system at an absolute temperature T, the average thermal energy carried by each microscopic degree of freedom in the system is 1/2kT (i.e., about 2.07×10−21 J, or 0.013 eV, at room temperature). This is generally true only for classical systems with a large number of particles, and in which quantum effects are negligible.
In classical statistical mechanics, this average is predicted to hold exactly for homogeneous ideal gases. Monatomic ideal gases (the six noble gases) possess three degrees of freedom per atom, corresponding to the three spatial directions. According to the equipartition of energy this means that there is a thermal energy of 3/2kT per atom. This corresponds very well with experimental data. The thermal energy can be used to calculate the root-mean-square speed of the atoms, which turns out to be inversely proportional to the square root of the atomic mass. The root mean square speeds found at room temperature accurately reflect this, ranging from 1370 m/s for helium, down to 240 m/s for xenon.
Kinetic theory gives the average pressure p for an ideal gas as
Combination with the ideal gas law
shows that the average translational kinetic energy is
Considering that the translational motion velocity vector v has three degrees of freedom (one for each dimension) gives the average energy per degree of freedom equal to one third of that, i.e. 1/2kT.
The ideal gas equation is also obeyed closely by molecular gases; but the form for the heat capacity is more complicated, because the molecules possess additional internal degrees of freedom, as well as the three degrees of freedom for movement of the molecule as a whole. Diatomic gases, for example, possess a total of six degrees of simple freedom per molecule that are related to atomic motion (three translational, two rotational, and one vibrational). At lower temperatures, not all these degrees of freedom may fully participate in the gas heat capacity, due to quantum mechanical limits on the availability of excited states at the relevant thermal energy per molecule.
Role in Boltzmann factors[edit]
More generally, systems in equilibrium at temperature T have probability Pi of occupying a state i with energy E weighted by the corresponding Boltzmann factor:
where Z is the partition function. Again, it is the energy-like quantity kT that takes central importance.
Consequences of this include (in addition to the results for ideal gases above) the Arrhenius equation in chemical kinetics.
Role in the statistical definition of entropy[edit]
Boltzmann’s grave in the Zentralfriedhof, Vienna, with bust and entropy formula.
In statistical mechanics, the entropy S of an isolated system at thermodynamic equilibrium is defined as the natural logarithm of W, the number of distinct microscopic states available to the system given the macroscopic constraints (such as a fixed total energy E):
This equation, which relates the microscopic details, or microstates, of the system (via W) to its macroscopic state (via the entropy S), is the central idea of statistical mechanics. Such is its importance that it is inscribed on Boltzmann’s tombstone.
The constant of proportionality k serves to make the statistical mechanical entropy equal to the classical thermodynamic entropy of Clausius:
One could choose instead a rescaled dimensionless entropy in microscopic terms such that
This is a more natural form and this rescaled entropy exactly corresponds to Shannon’s subsequent information entropy.
The characteristic energy kT is thus the energy required to increase the rescaled entropy by one nat.
The thermal voltage[edit]
In semiconductors, the Shockley diode equation—the relationship between the flow of electric current and the electrostatic potential across a p–n junction—depends on a characteristic voltage called the thermal voltage, denoted by VT. The thermal voltage depends on absolute temperature T as
where q is the magnitude of the electrical charge on the electron with a value 1.602176634×10−19 C.[5] Equivalently,
At room temperature 300 K (27 °C; 80 °F), VT is approximately 25.85 mV[6][7] which can be derived by plugging in the values as follows:
At the standard state temperature of 298.15 K (25.00 °C; 77.00 °F), it is approximately 25.69 mV. The thermal voltage is also important in plasmas and electrolyte solutions (e.g. the Nernst equation); in both cases it provides a measure of how much the spatial distribution of electrons or ions is affected by a boundary held at a fixed voltage.[8][9]
History[edit]
The Boltzmann constant is named after its 19th century Austrian discoverer, Ludwig Boltzmann. Although Boltzmann first linked entropy and probability in 1877, the relation was never expressed with a specific constant until Max Planck first introduced k, and gave a more precise value for it (1.346×10−23 J/K, about 2.5% lower than today’s figure), in his derivation of the law of black-body radiation in 1900–1901.[10] Before 1900, equations involving Boltzmann factors were not written using the energies per molecule and the Boltzmann constant, but rather using a form of the gas constant R, and macroscopic energies for macroscopic quantities of the substance. The iconic terse form of the equation S = k ln W on Boltzmann’s tombstone is in fact due to Planck, not Boltzmann. Planck actually introduced it in the same work as his eponymous h.[11]
In 1920, Planck wrote in his Nobel Prize lecture:[12]
This constant is often referred to as Boltzmann’s constant, although, to my knowledge, Boltzmann himself never introduced it – a peculiar state of affairs, which can be explained by the fact that Boltzmann, as appears from his occasional utterances, never gave thought to the possibility of carrying out an exact measurement of the constant.
This «peculiar state of affairs» is illustrated by reference to one of the great scientific debates of the time. There was considerable disagreement in the second half of the nineteenth century as to whether atoms and molecules were real or whether they were simply a heuristic tool for solving problems. There was no agreement whether chemical molecules, as measured by atomic weights, were the same as physical molecules, as measured by kinetic theory. Planck’s 1920 lecture continued:[12]
Nothing can better illustrate the positive and hectic pace of progress which the art of experimenters has made over the past twenty years, than the fact that since that time, not only one, but a great number of methods have been discovered for measuring the mass of a molecule with practically the same accuracy as that attained for a planet.
In versions of SI prior to the 2019 redefinition of the SI base units, the Boltzmann constant was a measured quantity rather than a fixed value. Its exact definition also varied over the years due to redefinitions of the kelvin (see Kelvin § History) and other SI base units (see Joule § History).
In 2017, the most accurate measures of the Boltzmann constant were obtained by acoustic gas thermometry, which determines the speed of sound of a monatomic gas in a triaxial ellipsoid chamber using microwave and acoustic resonances.[13][14] This decade-long effort was undertaken with different techniques by several laboratories;[a] it is one of the cornerstones of the 2019 redefinition of SI base units. Based on these measurements, the CODATA recommended 1.380649×10−23 J/K to be the final fixed value of the Boltzmann constant to be used for the International System of Units.[15]
Value in different units[edit]
| Values of k | Units | Comments |
|---|---|---|
| 1.380649×10−23 | J/K | SI by definition, J/K = m2⋅kg/(s2⋅K) in SI base units |
| 8.617333262×10−5 | eV/K | [note 1] |
| 2.083661912×1010 | Hz/K | (k/h) [note 1] |
| 1.380649×10−16 | erg/K | CGS system, 1 erg = 1×10−7 J |
| 3.297623483×10−24 | cal/K | [note 1] 1 calorie = 4.1868 J |
| 1.832013046×10−24 | cal/°R | [note 1] |
| 5.657302466×10−24 | ft lb/°R | [note 1] |
| 0.695034800 | cm−1/K | (k/(hc)) [note 1] |
| 3.166811563×10−6 | Eh/K | (Eh = hartree) |
| 1.987204259×10−3 | kcal/(mol⋅K) | (kNA) [note 1] |
| 8.314462618×10−3 | kJ/(mol⋅K) | (kNA) [note 1] |
| −228.5991672 | dB(W/K/Hz) | 10 log10(k/(1 W/K/Hz)),[note 1] used for thermal noise calculations |
| 1.536179187×10−40 | kg/K | k/c2, where c is the speed of light[16] |
Since k is a proportionality factor between temperature and energy, its numerical value depends on the choice of units for energy and temperature. The small numerical value of the Boltzmann constant in SI units means a change in temperature by 1 K only changes a particle’s energy by a small amount. A change of 1 °C is defined to be the same as a change of 1 K. The characteristic energy kT is a term encountered in many physical relationships.
The Boltzmann constant sets up a relationship between wavelength and temperature (dividing hc/k by a wavelength gives a temperature) with one micrometer being related to 14387.777 K, and also a relationship between voltage and temperature (kT in units of eV corresponds to a voltage) with one volt being related to 11604.518 K. The ratio of these two temperatures, 14387.777 K / 11604.518 K ≈ 1.239842, is the numerical value of hc in units of eV⋅μm.
Natural units[edit]
The Boltzmann constant provides a mapping from the characteristic microscopic energy E to the macroscopic temperature scale T = E/k. In fundamental physics, this mapping is often simplified by using the natural units of setting k to unity. This convention means that temperature and energy quantities have the same dimensions.[17][18] In particular, the SI unit kelvin becomes superfluous, being defined in terms of joules as 1 K = 1.380649×10−23 J.[19] With this convention, temperature is always given in units of energy, and the Boltzmann constant is not explicitly needed in formulas.[17]
This convention simplifies many physical relationships and formulas. For example, the equipartition formula for the energy associated with each classical degree of freedom (
As another example, the definition of thermodynamic entropy coincides with the form of information entropy:
where Pi is the probability of each microstate.
See also[edit]
- CODATA 2018
- Thermodynamic beta
- List of scientists whose names are used in physical constants
Notes[edit]
- ^ Independent techniques exploited: acoustic gas thermometry, dielectric constant gas thermometry, johnson noise thermometry. Involved laboratories cited by CODATA in 2017: LNE-Cnam (France), NPL (UK), INRIM (Italy), PTB (Germany), NIST (USA), NIM (China).
- ^ a b c d e f g h i The value is exact but not expressible as a finite decimal; approximated to 9 decimal places only.
References[edit]
- ^ a b
Newell, David B.; Tiesinga, Eite (2019). The International System of Units (SI). NIST Special Publication 330. Gaithersburg, Maryland: National Institute of Standards and Technology. doi:10.6028/nist.sp.330-2019. S2CID 242934226. - ^ Richard Feynman (1970). The Feynman Lectures on Physics Vol I. Addison Wesley Longman. ISBN 978-0-201-02115-8.
- ^ «Proceedings of the 106th meeting» (PDF). 16–20 October 2017.
- ^ Petrucci, Ralph H.; Harwood, William S.; Herring, F. Geoffrey (2002). GENERAL CHEMISTRY: Principles and Modern Applications (8th ed.). Prentice Hall. p. 785. ISBN 0-13-014329-4.
- ^ «2018 CODATA Value: elementary charge». The NIST Reference on Constants, Units, and Uncertainty. NIST. 20 May 2019. Retrieved 20 May 2019.
- ^ Rashid, Muhammad H. (2016). Microelectronic circuits: analysis and design (Third ed.). Cengage Learning. pp. 183–184. ISBN 9781305635166.
- ^ Cataldo, Enrico; Lieto, Alberto Di; Maccarrone, Francesco; Paffuti, Giampiero (18 August 2016). «Measurements and analysis of current-voltage characteristic of a pn diode for an undergraduate physics laboratory». arXiv:1608.05638v1 [physics.ed-ph].
- ^ Kirby, Brian J. (2009). Micro- and Nanoscale Fluid Mechanics: Transport in Microfluidic Devices (PDF). Cambridge University Press. ISBN 978-0-521-11903-0.
- ^ Tabeling, Patrick (2006). Introduction to Microfluidics. Oxford University Press. ISBN 978-0-19-856864-3.
- ^ Planck, Max (1901), «Ueber das Gesetz der Energieverteilung im Normalspectrum», Ann. Phys., 309 (3): 553–63, Bibcode:1901AnP…309..553P, doi:10.1002/andp.19013090310. English translation: «On the Law of Distribution of Energy in the Normal Spectrum». Archived from the original on 17 December 2008.
- ^ Gearhart, Clayton A. (2002). «Planck, the Quantum, and the Historians». Physics in Perspective. 4 (2): 177. Bibcode:2002PhP…..4..170G. doi:10.1007/s00016-002-8363-7. ISSN 1422-6944. S2CID 26918826.
- ^ a b Planck, Max (2 June 1920), The Genesis and Present State of Development of the Quantum Theory (Nobel Lecture)
- ^ Pitre, L; Sparasci, F; Risegari, L; Guianvarc’h, C; Martin, C; Himbert, M E; Plimmer, M D; Allard, A; Marty, B; Giuliano Albo, P A; Gao, B; Moldover, M R; Mehl, J B (1 December 2017). «New measurement of the Boltzmann constant by acoustic thermometry of helium-4 gas» (PDF). Metrologia. 54 (6): 856–873. Bibcode:2017Metro..54..856P. doi:10.1088/1681-7575/aa7bf5. hdl:11696/57295. S2CID 53680647. Archived from the original (PDF) on 5 March 2019.
- ^ de Podesta, Michael; Mark, Darren F; Dymock, Ross C; Underwood, Robin; Bacquart, Thomas; Sutton, Gavin; Davidson, Stuart; Machin, Graham (1 October 2017). «Re-estimation of argon isotope ratios leading to a revised estimate of the Boltzmann constant» (PDF). Metrologia. 54 (5): 683–692. Bibcode:2017Metro..54..683D. doi:10.1088/1681-7575/aa7880. S2CID 125912713.
- ^ Newell, D. B.; Cabiati, F.; Fischer, J.; Fujii, K.; Karshenboim, S. G.; Margolis, H. S.; Mirandés, E. de; Mohr, P. J.; Nez, F. (2018). «The CODATA 2017 values of h, e, k, and N A for the revision of the SI». Metrologia. 55 (1): L13. Bibcode:2018Metro..55L..13N. doi:10.1088/1681-7575/aa950a. ISSN 0026-1394.
- ^ «CODATA Value: Kelvin-kilogram relationship».
- ^ a b Kalinin, M; Kononogov, S (2005), «Boltzmann’s Constant, the Energy Meaning of Temperature, and Thermodynamic Irreversibility», Measurement Techniques, 48 (7): 632–36, doi:10.1007/s11018-005-0195-9, S2CID 118726162
- ^ Kittel, Charles; Kroemer, Herbert (1980). Thermal physics (2nd ed.). San Francisco: W.H. Freeman. p. 41. ISBN 0716710889.
We prefer to use a more natural temperature scale […] the fundamental temperature has the units of energy.
- ^ Mohr, Peter J; Shirley, Eric L; Phillips, William D; Trott, Michael (1 October 2022). «On the dimension of angles and their units». Metrologia. 59 (5): 053001. arXiv:2203.12392. Bibcode:2022Metro..59e3001M. doi:10.1088/1681-7575/ac7bc2.
External links[edit]
- Draft Chapter 2 for SI Brochure, following redefinitions of the base units (prepared by the Consultative Committee for Units)
- Big step towards redefining the kelvin: Scientists find new way to determine Boltzmann constant
Материал
из свободной русской энциклопедии «Традиция»
Для постоянной, связанной с энергией излучения чёрного тела, смотри Постоянная
Стефана-Больцмана
|
Значение |
Размерность |
|
1,380 6504(24) • 10−23 |
Дж•К−1 |
|
8,617 343(15) • 10−5 |
эВ•К−1 |
|
1,3807• 10−16 |
эрг•К−1 |
|
Смотри также Значения в |
Постоянная Больцмана (k или kB) — физическая постоянная,
определяющая связь между температурой вещества и энергией теплового движения
частиц этого вещества. Названа в честь австрийского физика Людвига Больцмана,
сделавшего большой вклад в статистическую физику, в которой эта постоянная
играет ключевую роль. Её экспериментальное значение в системе СИ равно
Дж/К.
В таблице последние цифры в круглых скобках указывают стандартную
погрешность значения постоянной. В принципе, постоянная Больцмана может быть
получена из определения абсолютной температуры и других физических постоянных.
Однако точное вычисление постоянной Больцмана с помощью основных принципов
слишком сложно и невыполнимо при современном уровне знаний.
Экспериментально постоянную Больцмана можно определить с помощью закона
теплового излучения Планка, описывающего распределение энергии в спектре
равновесного излучения при определённой температуре излучающего тела, а также
другими методами.
Существует связь между универсальной газовой постоянной и числом
Авогадро , из которой следует значение постоянной Больцмана:
Размерность постоянной Больцмана такая же, как и у энтропии.
Содержание
- 1 История
- 2 Уравнение состояния
идеального газа - 3 Связь между температурой и
энергией - 3.1 Соотношения газовой
термодинамики - 4 Множитель Больцмана
- 5 Роль в статистическом
определении энтропии - 6 Роль в физике
полупроводников: тепловое напряжение - 7 Применения в других
областях - 8 Постоянная Больцмана в
планковских единицах - 9 Постоянная Больцмана в
теории бесконечной вложенности материи - 10 Значения в различных
единицах - 11 Ссылки
- 12 См. также
История
В 1877 г. Больцман впервые связал между собой энтропию и вероятность, однако
достаточно точное значение постоянной k как коэффициента связи в формуле
для энтропии появилось лишь в трудах М. Планка. При выводе закона излучения
чёрного тела Планк в 1900–1901 гг. для постоянной Больцмана нашёл значение
1,346 • 10−23 Дж/K, почти на 2,5% меньше принятого в настоящее
время.[2]
До 1900 г. соотношения, которые сейчас записываются с постоянной Больцмана,
писались с помощью газовой постоянной R, а вместо средней энергии на
одну молекулу использовалась общая энергия вещества. Лаконичная формула вида S
= k log W на бюсте Больцмана стала таковой благодаря Планку. В
своей нобелевской лекции в 1920 г. Планк писал: [3]
Эта константа часто называется постоянной Больцмана, хотя, насколько я знаю,
сам Больцман никогда не вводил её — странное состояние дел, при том, что в
высказываниях Больцмана не было речи о точном измерении этой константы.
Такая ситуация может быть объяснена проведением в то время научных дебатов
по выяснению сущности атомного строения вещества. Во второй половине 19 века
существовали значительные разногласия в отношении того, являются ли атомы и
молекулы реальными, либо они лишь удобный способ описания явлений. Не было
единства и в том, являются ли «химические молекулы», различаемые по
их атомной массе, теми же самыми молекулами, что и в кинетической теории. Далее
в нобелевской лекции Планка можно найти следующее:[3]
«Ничто не может лучше продемонстрировать положительную и ускоряющуюся
скорость прогресса, чем искусство эксперимента за последние двадцать лет, когда
было открыто сразу множество методов измерения массы молекул практически с той
же точностью, что и измерение массы какой-нибудь планеты».
Уравнение
состояния идеального газа
Для идеального газа справедлив объединённый газовый закон, связывающий
давление P, объём V, количество вещества n в молях,
газовую постоянную R и абсолютную температуру T:
В данном равенстве можно сделать замену .
Тогда газовый закон будет выражаться через постоянную Больцмана и количество
молекул N в объёме газа V:
Связь
между температурой и энергией
В однородном идеальном газе, находящемся при абсолютной температуре T, энергия, приходящаяся на каждую поступательную
степень свободы, равна, как следует из распределения Максвелла, kT / 2. При комнатной температуре
(≈ 300 K) эта энергия составляет Дж,
или 0,013 эВ.
Соотношения
газовой термодинамики
В одноатомном идеальном газе каждый атом обладает тремя степенями свободы,
соответствующими трём пространственным осям, что означает, что на каждый атом
приходится энергия 3kT / 2. Это хорошо
согласуется с экспериментальными данными. Зная тепловую энергию, можно
вычислить среднеквадратичную скорость атомов, которая обратно пропорциональна
квадратному корню из атомной массы. Среднеквадратичная скорость при комнатной
температуре изменяется от 1370 м/с для гелия до 240 м/с для ксенона.
Кинетическая теория даёт формулу для среднего давления P идеального
газа:
Учитывая, что средняя кинетическая энергия прямолинейного движения равна:
находим уравнение состояния идеального газа:
Это соотношение неплохо выполняется и для молекулярных газов; однако
зависимость теплоёмкости изменяется, так как молекулы могут иметь
дополнительные внутренние степени свободы по отношению к тем степеням свободы,
которые связаны с движением молекул в пространстве. Например, двухатомный газ
имеет уже приблизительно пять степеней свободы.
Множитель
Больцмана
В общем случае система в равновесии с тепловым резервуаром при температуре T
имеет вероятность p занять состояние с энергией E, что может быть
записано с помощью соответствующего экспоненциального множителя Больцмана:
В данном выражении фигурирует величина kT с размерностью энергии.
Вычисление вероятности используется не только для расчётов в кинетической
теории идеальных газов, но и в других областях, например в химической кинетике
в уравнении Аррениуса.
Роль
в статистическом определении энтропии
Основная статья: Термодинамическая
энтропия
Вена, Zentralfriedhof,
изображение Больцмана и формулы для энтропии на бюсте.
Энтропия S изолированной термодинамической системы в
термодинамическом равновесии определяется через натуральный логарифм от числа
различных микросостояний W, соответствующих
данному макроскопическому состоянию (например, состоянию с заданной полной
энергией E):
Коэффициент пропорциональности k является
постоянной Больцмана. Это выражение, определяющее связь между микроскопическими
и макроскопическими состояниями (через W и энтропию S
соответственно), выражает центральную идею статистической механики и является
главным открытием Больцмана.
В классической термодинамике используется выражение Клаузиуса для энтропии:
Таким образом, появление постоянной Больцмана k
можно рассматривать как следствие связи между термодинамическим и
статистическим определениями энтропии.
Энтропию можно выразить в единицах k , что даёт следующее:
В таких единицах энтропия точно соответствует информационной энтропии.
Характерная энергия kT равна количеству теплоты, необходимому для
увеличения энтропии S‘ на один
нат.
Роль
в физике полупроводников: тепловое напряжение
В отличие от других веществ, в полупроводниках существует сильная
зависимость электропроводности от температуры:
где множитель σ0 достаточно слабо
зависит от температуры по сравнению с экспонентой, EA
– энергия активации проводимости. Плотность электронов проводимости также экспоненциально
зависит от температуры. Для тока через полупроводниковый p-n-переход вместо
энергии активации рассматривают характерную энергию данного p-n перехода при
температуре T как характерную
энергию электрона в электрическом поле:
где q – элементарный электрический заряд, а VT
есть тепловое напряжение, зависящее от температуры.
Данное соотношение является основой для выражения постоянной Больцмана в
единицах эВ∙К−1. При комнатной температуре (≈ 300 K)
значение теплового напряжения порядка 25,85 милливольт ≈ 26 мВ.
В классической теории часто используют формулу, согласно которой эффективная
скорость носителей заряда в веществе равна произведению подвижности носителей μ на напряженность электрического поля. В другой формуле
плотность потока носителей связывается с коэффициентом диффузии D и с градиентом концентрации носителей n:
Согласно соотношению Эйнштейна-Смолуховского, коэффициент диффузии связан с
подвижностью:
Постоянная Больцмана k входит
также в закон Видемана-Франца, по которому отношение коэффициента
теплопроводности к коэффициенту электропроводности в металлах пропорционально
температуре и квадрату отношения постоянной Больцмана к электрическому заряду.
Применения
в других областях
Для разграничения температурных областей, в которых поведение вещества
описывается квантовыми или классическими методами, служит температура Дебая:
где – постоянная
Дирака, есть предельная частота упругих
колебаний кристаллической решётки, u –
скорость звука в твёрдом теле, n –
концентрация атомов.
При температурах ниже QD
требуется использовать квантовую статистику. Если же температуры выше QD, то тепловая энергия (порядка kT)
превышает характерную энергию колебаний решётки и система может быть описана
формулами классической статистической механики.
Постоянная Больцмана входит в формулу Найквиста, определяющую средний
квадрат шумового напряжения в электрической цепи с сопротивлением R в
полосе частот Δν при температуре T. В
классическом приближении формула для теплового шума имеет вид:
Постоянная Больцмана в
планковских единицах
В планковской системе естественных единиц постоянная Больцмана равна 1. Это
даёт
как среднюю кинетическую энергию газовой молекулы на одну степень свободы;
при этом определение термодинамической энтропии совпадает с определением
информационной энтропии:
Планковская единица температуры равна 1,416 785(71) • 1032 К,
соответствуя энергии покоя планковской массы.
Постоянная
Больцмана в теории бесконечной вложенности материи
С точки зрения теории бесконечной
вложенности материи, постоянная Больцмана является характеристикой лишь
одного, а именно атомного уровня материи. Как показывает анализ естественных
единиц измерения физических величин, при использовании вместо температурной
шкалы шкалы тепловой энергии, содержащейся в единице количества вещества,
постоянная Больцмана становится излишней. Отсюда следует, что при использовании
температуры как физической величины на некотором масштабном уровне материи
необходимо пересчитывать значение постоянной Больцмана для этого уровня материи
с помощью соответствующих коэффициентов
подобия. Теоретической основой для этой процедуры является SPФ-симметрия.
Для уровня звёзд аналогично звёздной постоянной Планка, задающей
характерный момент импульса типичных звёздных объектов, появляется звёздная постоянная Больцмана. Eё
значение равно Kps = k ∙ Ф = 9,187∙1032
Дж/К, где Ф – коэффициент подобия по массе. [4]
Звёздная постоянная Больцмана определяет связь между эффективной температурой
совокупности типичных звёздных объектов как меры тепловой энергии, и средней
кинетической энергией движения в расчёте на один звёздный объект. Кроме этого,
она связывает внутреннюю температуру звёздных объектов с внутренней энергий
вещества этих объектов. Аналогичные постоянные могут быть вычислены для каждого
масштабного уровня материи. Следовательно, обычная постоянная Больцмана не
только позволяет оценить кинетическую температуру частиц вещества по известной
энергии этого вещества, но и даёт возможность найти температуру вещества внутри
самих частиц, например, внутри нуклона.
Значения в различных единицах
|
Значение k |
Размерность |
Примечание |
|
1,380 6504(24) • 10−23 |
Дж / К |
единицы СИ, значение CODATA 2006[1] |
|
8,617 343(15) • 10−5 |
эВ/K |
1 эВ 1/k = 11 604,51(2) K/эВ |
|
2,303 6644(36) • 1010 |
Гц/K |
1 Гц = 6,626 068 96(33) • 10−34 Дж |
|
3,166 815(36) • 10−6 |
EH/K |
EH = 2R∞hc = |
|
1,380 6504(24) • 10−16 |
эрг/K |
1 эрг = 1• 10−7 Дж |
|
3,297 6268(56) • 10−24 |
кал/K |
1 калория = 4,1868 Дж |
|
1,832 0149(31) • 10−24 |
кал/R |
1 градус Ранкина = 4/9 K |
|
1,039 9503(18) • 10−23 |
Фут фунт/R |
1 Фут-фунт сила = 1,355 817 948 331 4004 Дж |
|
0,695 0356(12) |
см−1/K |
1 см−1 = 1,986 445 501(99) |
Поскольку k есть константа пропорциональности между температурой и
энергией, численное значение k зависит от выбора единиц изменения
температуры и энергии. Шкала температур Кельвина выбиралась из того условия,
чтобы интервал температур, в котором существует жидкая вода, равнялся 100
градусов. Малое численное значение k является отражением малости энергии
в джоулях, необходимой для увеличения энергии частицы на 1 К. Как правило,
в физических выражениях используется произведение kT как характерная
энергия при температуре T. Если измерять температуру в энергетических
единицах, подобно планковским единицам, тогда постоянная Больцмана будет не
нужна вообще, равняясь точно 1. [5]
Ссылки
- а
б CODATA, 2006 - Max Planck «Ueber das Gesetz der
Energieverteilung im Normalspectrum» // Annalen der Physik. — 1901. — Т. 309. — № 3. — С. 553–63.. English
translation: «On the Law of Distribution of
Energy in the Normal Spectrum«. - а б Max Planck «The Genesis and Present State
of Development of the Quantum Theory (Nobel Lecture)». — 2 June 1920. - Федосин С.
Г. Физика и философия подобия от
преонов до метагалактик, Пермь: Стиль-МГ, 1999, 544 стр., Табл.66,
Ил.93, Библ. 377 назв. ISBN 5-8131-0012-1. - Kalinin, M; Kononogov, S
«Boltzmann’s Constant, the Energy Meaning of Temperature, and
Thermodynamic Irreversibility» // Measurement Techniques. —
2005. — Т. 48. —
№ 7. — С. 632–36.
См. также
- Число Авогадро
- Универсальная газовая
постоянная - Уравнение состояния
идеального газа - Планковские единицы
- Бесконечная вложенность материи
- Звёздные постоянные
- Звёздная постоянная Больцмана
Постоянная Больцмана
Больцман
Людвиг (1844—1906) —
великий австрийский физик, один из
основоположников молекулярно-кинетической
теории. В трудах Больцмана
молекулярно-кинетическая теория впервые
предстала как логически стройная,
последовательная физическая теория.
Больцман дал статистическое истолкование
второго закона термодинамики. Им много
сделано для развития и популяризации
теории электромагнитного поля Максвелла.
Борец по натуре, Больцман страстно
отстаивал необходимость молекулярного
истолкования тепловых явлений и принял
на себя основную тяжесть борьбы с
учеными, отрицавшими существование
молекул.
В
уравнение (4.5.3) входит отношение
универсальной газовой постоянной R
к
постоянной Авогадро NA.
Это
отношение одинаково для всех веществ.
Оно называется постоянной
Больцмана,
в честь Л. Больцмана, одного из основателей
молекулярно-кинетической теории.
Постоянная Больцмана
равна:
(4.5.4)
Уравнение (4.5.3) с
учетом постоянной Больцмана записывается
так:
(4.5.5)
Физический смысл постоянной Больцмана
Исторически
температура была впервые введена как
термодинамическая величина, и для нее
была установлена единица измерения —
градус (см. § 3.2). После установления
связи температуры со средней кинетической
энергией молекул стало очевидным, что
температуру можно определять как среднюю
кинетическую энергию молекул и выражать
ее в джоулях или эргах, т. е. вместо
величины Т
ввести
величину Т*
так,
чтобы
Определенная таким
образом температура связана с температурой,
выражаемой в градусах, следующим образом:
Поэтому постоянную
Больцмана можно рассматривать как
величину, связывающую температуру,
выражаемую в энергетических единицах,
с температурой, выраженной в градусах.
Зависимость давления газа от концентрации его молекул и температуры
Выразив
Е
из
соотношения (4.5.5) и подставив в формулу
(4.4.10), получим выражение, показывающее
зависимость давления газа от концентрации
молекул и температуры:
(4.5.6)
Из формулы (4.5.6)
вытекает, что при одинаковых давлениях
и температурах концентрация молекул у
всех газов одна и та же.
Отсюда следует
закон Авогадро: в равных объемах газов
при одинаковых температурах и давлениях
содержится одинаковое число молекул.
Средняя
кинетическая энергия поступательного
движения молекул прямо пропорциональна
абсолютной температуре. Коэффициент
пропорциональности —
постоянную
Больцмана k
=
10-23Дж/К
— надо
запомнить.
§ 4.6. Распределение максвелла
В большом числе
случаев знание одних средних значений
физических величин недостаточно.
Например, знание среднего роста людей
не позволяет планировать выпуск одежды
различных размеров. Надо знать
приблизительное число людей, рост
которых лежит в определенном интервале.
Точно так же важно знать числа молекул,
имеющих скорости, отличные от среднего
значения. Максвелл первым нашел, как
эти числа можно определять.
Вероятность случайного события
В §4.1 мы уже
упоминали, что для описания поведения
большой совокупности молекул Дж. Максвелл
ввел понятие вероятности.
Как
неоднократно подчеркивалось, в принципе
невозможно проследить за изменением
скорости (или импульса) одной молекулы
на протяжении большого интервала
времени. Нельзя также точно определить
скорости всех молекул газа в данный
момент времени. Из макроскопических
условий, в которых находится газ
(определенный объем и температура), не
вытекают с необходимостью определенные
значения скоростей молекул. Скорость
молекулы можно рассматривать как
случайную
величину, которая
в данных макроскопических условиях
может принимать различные значения,
подобно тому как при бросании игральной
кости может выпасть любое число очков
от 1 до 6 (число граней кости равно шести).
Предсказать, какое число очков выпадет
при данном бросании кости, нельзя. Но
вероятность
того, что выпадет, скажем, пять очков,
поддается определению.
Что
же такое вероятность наступления
случайного события? Пусть произведено
очень большое число N
испытаний
(N
—
число бросаний кости). При этом в N‘
случаях
имел место благоприятный исход испытаний
(т. е. выпадение пятерки). Тогда вероятность
данного события равна отношению числа
случаев с благоприятным исходом к
полному числу испытаний при условии,
что это число сколько угодно велико:
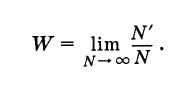
(4.6.1)
Для
симметричной кости вероятность любого
выбранного числа очков от 1 до 6 равна
.
Мы
видим, что на фоне множества случайных
событий обнаруживается определенная
количественная закономерность, появляется
число. Это число — вероятность —
позволяет вычислять средние значения.
Так, если произвести 300 бросаний кости,
то среднее число выпаданий пятерки, как
это следует из формулы (4.6.1), будет равно:
300 ·= 50, причем совершенно безразлично,
бросать 300 раз одну и ту же кость или
одновременно 300 одинаковых костей.
Несомненно, что
поведение молекул газа в сосуде гораздо
сложнее движения брошенной игральной
кости. Но и здесь можно надеяться
обнаружить определенные количественные
закономерности, позволяющие вычислять
статистические средние, если только
ставить задачу так же, как в теории игр,
а не как в классической механике. Нужно
отказаться от неразрешимой задачи
определения точного значения скорости
молекулы в данный момент и попытаться
найти вероятность того, что скорость
имеет определенное значение.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Краткое описание
Определение
Постоянная Больцмана — физическая постоянная, определяющая связь между температурой и энергией.
Взаимосвязь между макроскопическими свойствами материи (давление, температура) и характером движения атомов и молекул описывается молекулярно-кинетической теорией. Одним из ее создателей являлся Людвиг Больцман.
Определение
В рамках этой теории температура газа объясняется кинетической энергией его молекул (скоростью движения), а давление — их упругими ударами о стенки сосуда. Это соотношение устанавливает формула:
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
(frac{mv^2}2=kT)
где m — масса молекул газа, v — их средняя скорость, k — постоянная Больцмана, а T — температура газа по шкале Кельвина.
Физический смысл постоянной Больцмана заключается в обеспечении взаимосвязи характеристик атомно-молекулярного уровня и объемными свойствами газа, которые можно измерить при помощи приборов.
Постоянная Больцмана обозначается буквой k, а ее величина равна
(k=1.38times10^{-23}Дж/К)
Как соотносится энергия и температура
При абсолютной температуре T в идеальном однородном газе на каждую поступательную степень свободы приходится энергия (kT/2), что следует из распределения Максвелла. Значение этой энергии при 300 К (комнатной температуре) составляет примерно
(2.07times10^{-21} Дж.)
В идеальном одноатомном газе каждый атом имеет три степени свободы, которые соответствуют трем пространственным осям. Поэтому энергию, приходящуюся на каждый атом можно выразить как
(frac{3kT}2)
Если известна величина тепловой энергии, то нетрудно рассчитать среднеквадратичную скорость атомов. Она будет обратно пропорциональна корню квадратному из атомной массы. Например, при температуре 300 К среднеквадратичная скорость молекул ксенона составит 240 м/с, а гелия — 1370 м/с.
Вычисления для молекулярного газа усложняются. Это связано с увеличением степеней свобод. Так, например, при низкой температуре двухатомный газ имеет уже две вращательных и три поступательных степеней свободы. Рассмотрим решение конкретной задачи.
Задача
Газ состоит из N-атомных объемных молекул и находится при определенной температуре Т, при которой у молекул возбуждены колебательные, вращательные и поступательные степени свободы. Найти среднюю энергию молекул этого газа.
Решение
На каждую степень свободы в среднем приходится одинаковая величина кинетической энергии (закон равномерного распределения энергии по степеням свободы), которая равна
(leftlangleSigma_irightrangle=frac{kT}2)
Тогда можно утверждать, что средняя энергия молекулы составит
(leftlangleSigmarightrangle=frac{ikT}2)
Сделаем небольшое пояснение: i — сумма поступательных, вращательных и удвоенного количества колебательных степеней свободы, то есть
(i=m_{post}+m_{vr}+2m_{kol})
Теперь необходимо определить сколько степеней свободы имеют молекулы рассматриваемого газа:
(m_{post}=3, m_{vr}=3)
тогда (m_{kol}=3N-6)
(i=6+6N-12=6N-6)
(leftlangleSigmarightrangle=frac{6N-6}2kT)
Сокращаем полученное выражение и получаем:
(leftlangleSigmarightrangle=left(3N-3right)kT)
Ключевые нюансы
Постоянная Больцмана представляет собой отношение газовой постоянной (R) к постоянной Авогадро (Na):
(k=frac R{N_a})
По состоянию на 2017 год в международной системе единиц (СИ) ее значение составляет
(1,380649times10^{-23},)
а размерность — Дж/К.
Постоянную Больцмана не следует путать с постоянной Стефана-Больцмана, которая является константой пропорциональности в законе Стефана-Больцмана.
Способы нахождения постоянной Больцмана
Для нахождения постоянной Больцмана можно использовать различные методы.
Универсальный метод
Искомый коэффициент входит в уравнение состояния идеального газа:
(p=frac NVkT)
Многочисленные опыты показывают, что при нагревании любого газа от T0=273 К до Т1=373 K его давление на стенки сосуда увеличивается с (P_0=1.013times10^5) Па до (P_1=1.38times10^5 Па.)
Провести такой опыт совсем несложно. В качестве газа используется обычный воздух, давление измеряется при помощи манометра, а температура — термометра. При этом известно, что один моль любого газа при нормальных условиях занимает объем V=22,4 л и содержит (6.02times10^{23}) молекул.
Подставим известные параметры в уравнение состояния идеального газа:
(P_0=frac N{V_0}kT_0)
(P_1=frac N{V_1}kT_1)
Отсюда, коэффициент k
(k=frac{P_1V_1-P_0V_0}{Nleft(T_1-T_0right)})
Подставив в получившиеся уравнение известные данные и решив его получаем значение постоянной Больцмана равное (1.38times10^{-23}.)
Через формулу броуновского движения
Небольшое зеркальце подвешивают на упругой нити. Система зеркало-воздух находится в статическом равновесии. О поверхность зеркала ударяются хаотично движущиеся молекулы воздуха. Поэтому оно ведет себя как одна из броуновских частиц. Помимо этого, зеркало будет совершать и крутильные колебания вокруг оси, которой является упругая нить-подвес.
Зеркальную поверхность освещают лучом света. При ее, даже небольших поворотах, отраженный луч будет смещаться. Это позволяет не только увидеть, но и измерить крутильные колебания.
Обозначим угол поворота зеркала как (varphi), момент инерции зеркала — J, а модуль кручения подвеса — L. Теперь запишем уравнение крутильных колебаний, которое будет иметь вид:
(J_varphi=-L_varphi)
Умножив обе части уравнения на (varphi) и преобразовав его получаем:
(frac{Jvarphi^2}2+frac{Lvarphi^2}2=Const)
Так как малые крутильные колебания являются гармоничными, то можно записать:
(frac12Jleftlanglevarphi^2rightrangle=frac12Lleftlanglevarphi^2rightrangle=frac12kT)
Исходя из него получаем:
(leftlanglevarphi^2rightrangle=frac{kT}L)
Отсюда
(k=frac{leftlanglevarphi^2rightrangle L}T)
Подставив в полученную формулу полученные опытным путем данные, например
(leftlanglevarphi^2rightrangleapprox4times10^{-6})
(Lapprox10^{-15}Нtimes м)
(Tapprox290K)
Получаем приблизительное значение постоянной Больцмана равное
(1.38times10^{-23};Дж/К)
Области применения
Постоянная Больцмана является важным членом многих уравнений:
- кинетической теории газов;
- распределения Максвелла-Больцмана;
- средней энергии молекулы;
- состояния идеального газа.
Кроме того, постоянная Больцмана играет роль в распределении энергии, используется в определении энтропии. Немаловажное значение имеет эта константа и в физике полупроводников. Она входит в состав формулы, описывающей зависимость между электропроводимостью и температурой.