Строение электронных оболочек атомов

4.7
Средняя оценка: 4.7
Всего получено оценок: 1707.
4.7
Средняя оценка: 4.7
Всего получено оценок: 1707.
Атом – мельчайшая частица вещества, состоящая из ядра и электронов. Строение электронных оболочек атомов определяется положением элемента в Периодической системе химических элементов Д. И. Менделеева.
Электрон и электронная оболочка атома
Атом, который в целом является нейтральным, состоит из положительно заряженного ядра и отрицательно заряженной электронной оболочки (электронное облако), при этом, суммарные положительные и отрицательные заряды равны по абсолютной величине. При вычислении относительной атомной массы массу электронов не учитывают, так как она ничтожно мала и в 1840 раз меньше массы протона или нейтрона.
Электрон – совершенно уникальная частица, которая имеет двойственную природу: он имеет одновременно свойства волны и частицы. Они непрерывно движутся вокруг ядра.
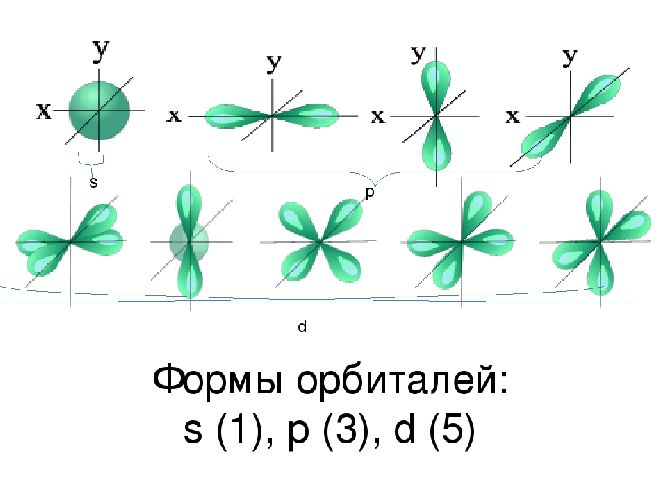
Пространство вокруг ядра, где вероятность нахождения электрона наиболее вероятна, называют электронной орбиталью, или электронным облаком. Это пространство имеет определенную форму, которая обозначается буквами s-, p-, d-, и f-. S-электронная орбиталь имеет шаровидную форму, p-орбиталь имеет форму гантели или объемной восьмерки, формы d- и f-орбиталей значительно сложнее.
Вокруг ядра электроны расположены на электронных слоях. Каждый слой характеризуется расстоянием от ядра и энергией, поэтому электронные слои часто называют электронными энергетическими уровнями. Чем ближе уровень к ядру, тем меньше энергия электронов в нем. Один элемент отличается от другого числом протонов в ядре атома и соответственно числом электронов. Следовательно, число электронов в электронной оболочке нейтрального атома равно числу протонов, содержащимся в ядре этого атома. Каждый следующий элемент имеет в ядре на один протон больше, а в электронной оболочке – на один электрон больше.
Вновь вступающий электрон занимает орбиталь с наименьшей энергией. Однако максимальное число электронов на уровне определяется формулой:
N=2n2,
где N – максимальное число электронов, а n – номер энергетического уровня.
На первом уровне может быть только 2 электрона, на втором – 8 электронов, на третьем – 18 электронов, а на четвертом уровне – 32 электрона. На внешнем уровне атома не может находится больше 8 электронов: как только число электронов достигает 8, начинает заполняться следующий, более далекий от ядра уровень.
Строение электронных оболочек атомов
Каждый элемент стоит в определенном периоде. Период – это горизонтальная совокупность элементов, расположенных в порядке возрастания заряда ядер их атомов, которая начинается щелочным металлом, а заканчивается инертным газом. Первые три периода в таблице – малые, а следующие, начиная с четвертого периода – большие, состоят из двух рядов. Номер периода, в котором находится элемент имеет физический смысл. Он означает, сколько электронных энергетических уровней имеется в атоме любого элемента данного периода. Так, элемент хлор Cl находится в 3 периоде, то есть его электронная оболочка имеет три электронных слоя. Хлор стоит в VII группе таблицы, причем в главной подгруппе. Главной подгруппой называется столбец внутри каждой группы, который начинается с 1 или 2 периода.
Таким образом, состояние электронных оболочек атома хлора таково: порядковый номер элемента хлора – 17, что означает, что атом имеет в ядре 17 протонов, а в электронной оболочке – 17 электронов. На 1 уровне может быть только 2 электрона, на 3 уровне – 7 электронов, так как хлор находится в главной подруппе VII группы. Тогда на 2 уровне находится:17-2-7=8 электронов.
Что мы узнали?
Тема «Строение электронных оболочек атомов» по химии (8 класс) кратко объясняет строение атома, свойства и расположение электронов. Также она дает представление о распределении электронов по уровням в периодической системе Д. И. Менделеева.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Никита Губский
7/10
-
Антон Неврамов
10/10
-
Александр Алишевич
7/10
-
Паша Кривов
10/10
-
Александр Котков
10/10
-
Саша Штрейкер
8/10
-
Тимур Насыров
10/10
-
Фыафыафыа Фыафыа
10/10
-
Ангелина Шумовская
8/10
-
Al Unicorn
9/10
Оценка доклада
4.7
Средняя оценка: 4.7
Всего получено оценок: 1707.
А какая ваша оценка?
Как вычислить общее количество электронов в слоях?
Число электронов на последнем внешнем уровне равно номеру группы. Максимальное число электронов на энергетическом уровне определяется формулой N = 2 * n^2 , где N — общее число электронов на энергетическом уровне, n — номер уровня.
Как определить общее число электронов?
Менделеева число электронов=числу протонов, но со знаком — число нейтронов=атомная масса элемента (найдешь в таблице) — порядковый номер. Возьмем любой элемент, например, ФОСФОР (P) Чтобы определить количество протонов и электронов, смотрим на порядковый номер элемента в таблице Менделеева.
Сколько электронов на 4 уровне?
| Энергетический уровень | Число подуровней | Максимальное число электронов на уровне |
|---|---|---|
| n=1 (K) | 1 | 2 |
| n=2 (L) | 2 | 8 |
| n=3 (M) | 3 | 18 |
| n=4 (N) | 4 | 32 |
Как определить количество электронов в заряде?
Чтобы узнать заряд тела, необходимо заряд электрона умножить на количество зарядов n: q = e · n .
Сколько электронов на внешнем уровне?
На каждом энергетическом уровне может находиться ограниченное число электронов: На первом – не более двух электронов; На втором – не более восьми электронов; На третьем – не более восемнадцати электронов.
Сколько электронов на внешнем слое у натрия?
На внешнем энергетическом уровне натрий имеет один электрон, который он легко отдаёт, превращаясь в положительно заряженный катион Na+.
Сколько электронов на первом слое?
Установлено, что максимальное число электронов на энергетическом уровне равно 2n², где n — его номер. Значит, на первом уровне может находиться не более 2 электронов, на втором — не более 8, на третьем — не более 18 и т.
Сколько электронов на электронных слоях?
Подуровни оболочек
| Обозначение подуровня | l | Макс. кол-во электронов |
|---|---|---|
| p | 1 | 6 |
| d | 2 | 10 |
| f | 3 | 14 |
| g | 4 | 18 |
В каком порядке электронные уровни заполняются электронами?
Правила заполнения электронных орбиталей Электроны занимают уровни последовательно, в порядке увеличения их энергии (принцип наименьшей энергии). Число энергетических уровней в атоме равно номеру периода, в котором находится элемент. В этом заключается физический смысл номера периода в таблице Д.
Сколько электронов на внешнем уровне у атома кремния?
Кремний – неметалл четвёртой группы периодической системы. На внешнем энергетическом уровне атома располагается четыре электрона. Имеет степень окисления +2.
Как найти нейтроны в химии?
Число протонов определяем по порядковому номеру элемента. Значит, число нейтронов в ядре можно найти, если от относительной атомной массы отнять порядковый номер.
Как рассчитать нейтроны?
Поскольку абсолютная часть атомной массы приходится на протоны и нейтроны, вычитание числа протонов (т. е. атомного номера, который равен числу протонов) из атомной массы дает число нейтронов в атоме. В нашем примере: 14 (атомная масса) — 6 (число протонов) = 8 (число нейтронов).
В каком элементе 13 электронов?
Углерод-13 — Википедия
Как определить количество электронов у иона?
Положительно заряженный ион или катион имеет больше протонов , чем электроны. Номер протона — это атомный номер элемента, а номер электрона — это атомный номер за вычетом заряда. Отрицательно заряженный ион или анион имеет больше электронов , чем протоны. Опять же, число протонов — это атомный номер.
Как определить элемент по количеству электронов?
Атом — электронейтральная частица, поэтому число электронов в нём равно числу протонов. Порядковый номер элемента = заряд ядра атома = число протонов в ядре = число электронов в атоме.
Как распределяются электроны по энергетическим уровням?
В нормальном (невозбужденном) состоянии атома электроны должны располагаться на самых низких доступных для них энергетических уровнях. Поэтому,казалось бы, в любом атоме в нормальном состоянии все электроны должны находиться в состоянии Is (я — 1, / = 0), а основные термы всех атомов должны быть типа 5-термов (L — Q).
Сколько электронов на внешнем энергетическом уровне у галогенов?
К галогенам относятся фтор F, хлор Cl, бром Br, иод I, астат At, а также (формально) искусственный элемент теннессин Ts. Все галогены — неметаллы, являются сильными окислителями. На внешнем энергетическом уровне 7 электронов.
Загрузить PDF
Загрузить PDF
Электронная конфигурация атома — это численное представление его электронных орбиталей. Электронные орбитали — это области различной формы, расположенные вокруг атомного ядра, в которых математически вероятно нахождение электрона. Электронная конфигурация помогает быстро и с легкостью сказать читателю, сколько электронных орбиталей есть у атома, а также определить количество электронов, находящихся на каждой орбитали. Прочитав эту статью, вы освоите метод составления электронных конфигураций.
-
1
Найдите атомный номер вашего атома. Каждый атом имеет определенное число электронов, связанных с ним. Найдите символ вашего атома в таблице Менделеева. Атомный номер — это целое положительное число, начинающееся от 1 (у водорода) и возрастающее на единицу у каждого последующего атома. Атомный номер — это число протонов в атоме, и, следовательно, это еще и число электронов атома с нулевым зарядом.
-
2
Определите заряд атома. Нейтральные атомы будут иметь столько же электронов, сколько показано в таблице Менделеева. Однако заряженные атомы будут иметь большее или меньшее число электронов — в зависимости от величины их заряда. Если вы работаете с заряженным атомом, добавляйте или вычитайте электроны следующим образом: добавляйте один электрон на каждый отрицательный заряд и вычитайте один на каждый положительный.
- Например, атом натрия с зарядом -1 будет иметь дополнительный электрон в добавок к своему базовому атомному числу 11. Иначе говоря, в сумме у атома будет 12 электронов.
- Если речь идет об атоме натрия с зарядом +1, от базового атомного числа 11 нужно отнять один электрон. Таким образом, у атома будет 10 электронов.
-
3
Запомните базовый список орбиталей. По мере того, как у атома увеличивается число электронов, они заполняют различные подуровни электронной оболочки атома согласно определенной последовательности. Каждый подуровень электронной оболочки, будучи заполненным, содержит четное число электронов. Имеются следующие подуровни:
- s-подуровень (любое число в электронной конфигурации, которое стоит перед буквой «s») содержит единственную орбиталь, и, согласно Принципу Паули, одна орбиталь может содержать максимум 2 электрона, следовательно, на каждом s-подуровне электронной оболочки может находиться 2 электрона.
- p-подуровень содержит 3 орбитали, и поэтому может содержать максимум 6 электронов.
- d-подуровень содержит 5 орбиталей, поэтому в нем может быть до 10 электронов.
- f-подуровень содержит 7 орбиталей, поэтому в нем может быть до 14 электронов.
- g-, h-, i- и k-подуровни являются теоретическими. Атомы, содержащие электроны в этих орбиталях, неизвестны. g-подуровень содержит 9 орбиталей, поэтому теоретически в нем может быть 18 электронов. В h-подуровне может быть 11 орбиталей и максимум 22 электрона; в i-подуровне —13 орбиталей и максимум 26 электронов; в k-подуровне — 15 орбиталей и максимум 30 электронов.
- Запомните порядок орбиталей с помощью мнемонического приема:[1]
Sober Physicists Don’t Find Giraffes Hiding In Kitchens (трезвые физики не находят жирафов, скрывающихся на кухнях).
-
4
Разберитесь в записи электронной конфигурации. Электронные конфигурации записываются для того, чтобы четко отразить количество электронов на каждой орбитали. Орбитали записываются последовательно, причем количество атомов в каждой орбитали записывается как верхний индекс справа от названия орбитали. Завершенная электронная конфигурация имеет вид последовательности обозначений подуровней и верхних индексов.
- Вот, например, простейшая электронная конфигурация: 1s2 2s2 2p6. Эта конфигурация показывает, что на подуровне 1s имеется два электрона, два электрона — на подуровне 2s и шесть электронов на подуровне 2p. 2 + 2 + 6 = 10 электронов в сумме. Это электронная конфигурация нейтрального атома неона (атомный номер неона — 10).
-
5
Запомните порядок орбиталей. Имейте в виду, что электронные орбитали нумеруются в порядке возрастания номера электронной оболочки, но располагаются по возрастанию энергии. Например, заполненная орбиталь 4s2 имеет меньшую энергию (или менее подвижна), чем частично заполненная или заполненная 3d10, поэтому сначала записывается орбиталь 4s. Как только вы будете знать порядок орбиталей, вы сможете с легкостью заполнять их в соответствии с количеством электронов в атоме. Порядок заполнения орбиталей следующий: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p.
- Электронная конфигурация атома, в котором заполнены все орбитали, будет иметь следующий вид: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d107p6
- Обратите внимание, что приведенная выше запись, когда заполнены все орбитали, является электронной конфигурацией элемента Uuo (унуноктия) 118, атома периодической системы с самым большим номером. Поэтому данная электронная конфигурация содержит все известные в наше время электронные подуровни нейтрально заряженного атома.
-
6
Заполняйте орбитали согласно количеству электронов в вашем атоме. Например, если мы хотим записать электронную конфигурацию нейтрального атома кальция, мы должны начать с поиска его атомного номера в таблице Менделеева. Его атомный номер — 20, поэтому мы напишем конфигурацию атома с 20 электронами согласно приведенному выше порядку.
- Заполняйте орбитали согласно приведенному выше порядку, пока не достигнете двадцатого электрона. На первой 1s орбитали будут находится два электрона, на 2s орбитали — также два, на 2p — шесть, на 3s — два, на 3p — 6, и на 4s — 2 (2 + 2 + 6 +2 +6 + 2 = 20.) Иными словами, электронная конфигурация кальция имеет вид: 1s2 2s2 2p6 3s2 3p6 4s2.
- Обратите внимание: орбитали располагаются в порядке возрастания энергии. Например, когда вы уже готовы перейти на 4-й энергетический уровень, то сначала записывайте 4s орбиталь, а затем 3d. После четвертого энергетического уровня вы переходите на пятый, на котором повторяется такой же порядок. Это происходит только после третьего энергетического уровня.
-
7
Используйте таблицу Менделеева как визуальную подсказку. Вы, вероятно, уже заметили, что форма периодической системы соответствует порядку электронных подуровней в электронных конфигурациях. Например, атомы во второй колонке слева всегда заканчиваются на «s2«, а атомы на правом краю тонкой средней части оканчиваются на «d10» и т.д. Используйте периодическую систему как визуальное руководство к написанию конфигураций — как порядок, согласно которому вы добавляете к орбиталям соответствует вашему положению в таблице. Смотрите ниже:
- В частности, две самые левые колонки содержат атомы, чьи электронные конфигурации заканчиваются s-орбиталями, в правом блоке таблицы представлены атомы, чьи конфигурации заканчиваются p-орбиталями, а в нижней части атомы заканчиваются f-орбиталями.
- Например, когда вы записываете электронную конфигурацию хлора, размышляйте следующим образом: «Этот атом расположен в третьем ряду (или «периоде») таблицы Менделеева. Также он располагается в пятой группе орбитального блока p периодической системы. Поэтому, его электронная конфигурация будет заканчиваться на …3p5
- Обратите внимание: элементы в области орбиталей d и f таблицы характеризуются энергетическими уровнями, которые не соответствуют периоду, в котором они расположены. Например, первый ряд блока элементов с d-орбиталями соответствует 3d орбиталям, хотя и располагается в 4 периоде, а первый ряд элементов с f-орбиталями соответствует орбитали 4f, несмотря на то, что он находится в 6 периоде.
-
8
Выучите сокращения написания длинных электронных конфигураций. Атомы на правом краю периодической системы называются благородными газами. Эти элементы химически очень устойчивы. Чтобы сократить процесс написания длинных электронных конфигураций, просто записывайте в квадратных скобках химический символ ближайшего благородного газа с меньшим по сравнению с вашим атомом числом электронов, а затем продолжайте писать электронную конфигурацию последующих орбитальных уровней. Смотрите ниже:
- Чтобы понять эту концепцию, полезно будет написать пример конфигурации. Давайте напишем конфигурацию цинка (атомный номер 30), используя сокращение, включающее благородный газ. Полная конфигурация цинка выглядит так: 1s2 2s2 2p6 3s2 3p6 4s2 3d10. Однако мы видим, что 1s2 2s2 2p6 3s2 3p6 — это электронная конфигурация аргона, благородного газа. Просто замените часть записи электронной конфигурации цинка химическим символом аргона в квадратных скобках ([Ar].)
- Итак, электронная конфигурация цинка, записанная в сокращенном виде, имеет вид: [Ar]4s2 3d10.
- Учтите, если вы пишете электронную конфигурацию благородного газа, скажем, аргона, писать [Ar] нельзя! Нужно использовать сокращение благородного газа, стоящего перед этим элементом; для аргона это будет неон ([Ne]).
Реклама
-
1
Освойте периодическую таблицу ADOMAH. Данный метод записи электронной конфигурации не требует запоминания, однако требует наличия переделанной периодической таблицы, поскольку в традиционной таблице Менделеева, начиная с четвертого периода, номер периода не соответствует электронной оболочке. Найдите периодическую таблицу ADOMAH — особый тип периодической таблицы, разработанный ученым Валерием Циммерманом. Ее легко найти посредством короткого поиска в интернете.[2]
- В периодической таблице ADOMAH горизонтальные ряды представляют группы элементов, такие как галогены, инертные газы, щелочные металлы, щелочноземельные металлы и т.д. Вертикальные колонки соответствуют электронным уровням, а так называемые «каскады» (диагональные линии, соединяющие блоки s,p,d и f) соответствуют периодам.
- Гелий перемещен к водороду, поскольку оба этих элемента характеризуются орбиталью 1s. Блоки периодов (s,p,d и f) показаны с правой стороны, а номера уровней приведены в основании. Элементы представлены в прямоугольниках, пронумерованных от 1 до 120. Эти номера являются обычными атомными номерами, которые представляют общее количество электронов в нейтральном атоме.
-
2
Найдите ваш атом в таблице ADOMAH. Чтобы записать электронную конфигурацию элемента, найдите его символ в периодической таблице ADOMAH и вычеркните все элементы с большим атомным номером. Например, если вам нужно записать электронную конфигурацию эрбия (68), вычеркните все элементы от 69 до 120.
- Обратите внимание на номера от 1 до 8 в основании таблицы. Это номера электронных уровней, или номера колонок. Игнорируйте колонки, которые содержат только вычеркнутые элементы. Для эрбия остаются колонки с номерами 1,2,3,4,5 и 6.
-
3
Посчитайте орбитальные подуровни до вашего элемента. Смотря на символы блоков, приведенные справа от таблицы (s, p, d, and f), и на номера колонок, показанные в основании, игнорируйте диагональные линии между блоками и разбейте колонки на блоки-колонки, перечислив их по порядку снизу вверх. И снова игнорируйте блоки, в которых вычеркнуты все элементы. Запишите блоки-колонки, начиная от номера колонки, за которым следует символ блока, таким образом: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s (для эрбия).
- Обратите внимание: Приведенная выше электронная конфигурация Er записана в порядке возрастания номера электронного подуровня. Ее можно также записать в порядке заполнения орбиталей. Для этого следуйте по каскадам снизу вверх, а не по колонкам, когда вы записываете блоки-колонки: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f12.
-
4
Посчитайте электроны для каждого электронного подуровня. Подсчитайте элементы, в каждом блоке-колонке которые не были вычеркнуты, прикрепляя по одному электрону от каждого элемента, и запишите их количество рядом с символом блока для каждого блока-колонки таким образом: 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f12 5s2 5p6 6s2. В нашем примере это электронная конфигурация эрбия.
-
5
Учитывайте неправильные электронные конфигурации. Существует восемнадцать типичных исключений, относящихся к электронным конфигурациям атомов в состоянии с наименьшей энергией, также называемом основным энергетическим состоянием. Они не подчиняются общему правилу только по последним двум-трем положениям, занимаемым электронами. При этом действительная электронная конфигурация предполагает нахождение электронов в состоянии с более низкой энергией в сравнении со стандартной конфигурацией атома. К атомам-исключениям относятся:
- Cr (…, 3d5, 4s1); Cu (…, 3d10, 4s1); Nb (…, 4d4, 5s1); Mo (…, 4d5, 5s1); Ru (…, 4d7, 5s1); Rh (…, 4d8, 5s1); Pd (…, 4d10, 5s0); Ag (…, 4d10, 5s1); La (…, 5d1, 6s2); Ce (…, 4f1, 5d1, 6s2); Gd (…, 4f7, 5d1, 6s2); Au (…, 5d10, 6s1); Ac (…, 6d1, 7s2); Th (…, 6d2, 7s2); Pa (…, 5f2, 6d1, 7s2); U (…, 5f3, 6d1, 7s2); Np (…, 5f4, 6d1, 7s2) и Cm (…, 5f7, 6d1, 7s2).
Реклама
Советы
- Чтобы найти атомный номер атома, когда он записан в форме электронной конфигурации, просто сложите все числа, которые идут за буквами (s, p, d, и f). Это работает только для нейтральных атомов, если вы имеете дело с ионом, то ничего не получится — вам придется добавить или вычесть количество дополнительных или потерянных электронов.
- Число, идущее за буквой — это верхний индекс, не сделайте ошибку в контрольной.
- «Стабильности полузаполненного» подуровня не существует. Это упрощение. Любая стабильность, которая относится к «наполовину заполненным» подуровням, имеет место из-за того, что каждая орбиталь занята одним электроном, поэтому минимизируется отталкивание между электронами.
- Каждый атом стремится к стабильному состоянию, а самые стабильные конфигурации имеют заполненные подуровни s и p (s2 и p6). Такая конфигурация есть у благородных газов, поэтому они редко вступают в реакции и в таблице Менделеева расположены справа. Поэтому, если конфигурация заканчивается на 3p4, то для достижения стабильного состояния ей необходимо два электрона (чтобы потерять шесть, включая электроны s-подуровня, потребуется больше энергии, поэтому потерять четыре легче). А если конфигурация оканчивается на 4d3, то для достижения стабильного состояния ей необходимо потерять три электрона. Кроме того, полузаполненные подуровни (s1, p3, d5..) являются более стабильными, чем, например, p4 или p2; однако s2 и p6 будут еще более устойчивыми.
- Когда вы имеете дело с ионом, это значит, что количество протонов не равно количеству электронов. Заряд атома в этом случае будет изображен сверху справа (как правило) от химического символа. Поэтому атом сурьмы с зарядом +2 имеет электронную конфигурацию 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p1. Обратите внимание, что 5p3 изменилось на 5p1. Будьте внимательны, когда конфигурация нейтрального атома заканчивается на подуровни, отличные от s и p. Когда вы забираете электроны, вы можете забрать их только с валентных орбиталей (s и p орбиталей). Поэтому, если конфигурация заканчивается на 4s2 3d7 и атом получает заряд +2, то конфигурация будет заканчиваться 4s0 3d7. Обратите внимание, что 3d7 не меняется, вместо этого теряются электроны s-орбитали.
- Существуют условия, когда электрон вынужден «перейти на более высокий энергетический уровень». Когда подуровню не хватает одного электрона до половинной или полной заполненности, заберите один электрон из ближайшего s или p- подуровня и переместите его на тот подуровень, которому необходим электрон.
- Имеется два варианта записи электронной конфигурации. Их можно записывать в порядке возрастания номеров энергетических уровней или в порядке заполнения электронных орбиталей, как было показано выше для эрбия.
- Также вы можете записывать электронную конфигурацию элемента, записав лишь валентную конфигурацию, которая представляет собой последний s и p подуровень. Таким образом, валентная конфигурация сурьмы будет иметь вид 5s2 5p3.
- Ионы не то же самое. С ними гораздо сложнее. Пропустите два уровня и действуйте по той же схеме в зависимости от того, где вы начали, и от того, насколько велико количество электронов.
Реклама
Об этой статье
Эту страницу просматривали 483 393 раза.
Была ли эта статья полезной?
Электронная конфигурация атома
Электронная конфигурация атома — это формула, показывающая расположение электронов в атоме по уровням и
подуровням. После изучения статьи Вы узнаете, где и как располагаются электроны, познакомитесь с квантовыми числами и
сможете построить электронную конфигурацию атома по его номеру, в конце статьи приведена таблица элементов.
Для чего изучать электронную конфигурацию элементов?
Атомы как конструктор: есть определённое количество деталей, они отличаются друг от друга, но две детали
одного типа абсолютно одинаковы. Но этот конструктор куда интереснее, чем пластмассовый и вот почему.
Конфигурация меняется в зависимости от того, кто есть рядом. Например, кислород рядом с водородом может
превратиться в воду, рядом с натрием в газ, а находясь рядом с железом вовсе превращает его в ржавчину.
Что бы ответить на вопрос почему так происходит и предугадать поведение атома рядом с другим необходимо
изучить электронную конфигурацию, о чём и пойдёт речь ниже.
Сколько электронов в атоме?
Атом состоит из ядра и вращающихся вокруг него электронов, ядро состоит из протонов и нейтронов. В нейтральном
состоянии у каждого атома количество электронов равно количеству протонов в его ядре. Количество
протонов обозначили порядковым номером элемента, например, сера, имеет 16 протонов — 16й элемент периодической
системы. Золото имеет 79 протонов — 79й элемент таблицы Менделеева. Соответственно, в сере в нейтральном
состоянии 16 электронов, а в золоте 79 электронов.
Где искать электрон?
Наблюдая поведение электрона были выведены определённые закономерности, они описываются
квантовыми числами, всего их четыре:
- Главное квантовое число
- Орбитальное квантовое число
- Магнитное квантовое число
- Спиновое квантовое число
Орбиталь
Далее, вместо слова орбита, мы будем использовать термин «орбиталь», орбиталь — это волновая функция электрона,
грубо — это область, в которой электрон проводит 90% времени.
N — уровень
L — оболочка
Ml — номер орбитали
Ms — первый или второй электрон на орбитали
Орбитальное квантовое число l
В результате исследования электронного облака, обнаружили, что в зависимости от уровня энергии,
облако принимает четыре основных формы: шар, гантели и другие две, более сложные.
В порядке возрастания энергии, эти формы называются s-,p-,d- и f-оболочкой.
На каждой из таких оболочек может располагаться 1 (на s), 3 (на p), 5 (на d) и 7 (на f)
орбиталей. Орбитальное квантовое число — это оболочка, на которой находятся
орбитали. Орбитальное квантовое число для s,p,d и f-орбиталей соответственно
принимает значения 0,1,2 или 3.
На s-оболочке одна орбиталь (L=0) — два электрона
На p-оболочке три орбитали (L=1) — шесть электронов
На d-оболочке пять орбиталей (L=2) — десять электронов
На f-оболочке семь орбиталей (L=3) — четырнадцать электронов
Магнитное квантовое число ml
На p-оболочке находится три орбитали, они обозначаются цифрами
от -L, до +L, то есть, для p-оболочки (L=1) существуют орбитали «-1», «0» и «1».
Магнитное квантовое число обозначается буквой ml.
Внутри оболочки электронам легче
располагаться на разных орбиталях, поэтому первые электроны заполняют по одному на каждую
орбиталь, а затем уже к каждому присоединяется его пара.
Рассмотрим d-оболочку:
d-оболочке соответствует значение L=2, то есть пять орбиталей (-2,-1,0,1 и 2), первые пять
электронов заполняют оболочку принимая значения Ml=-2,Ml=-1,Ml=0,
Ml=1,Ml=2.
Спиновое квантовое число ms
Спин — это направление вращения электрона вокруг своей оси, направлений два, поэтому спиновое квантовое число
имеет два значения: +1/2 и -1/2. На одном энергетическом подуровне могут находиться два электрона только с
противоположными спинами. Спиновое квантовое число обозначается ms
Главное квантовое число n
Главное квантовое число — это уровень энергии, на данный момент известны семь энергетических уровней,
каждый обозначается арабской цифрой: 1,2,3,…7. Количество оболочек на каждом уровне равно номеру уровня:
на первом уровне одна оболочка, на втором две и т.д.
Номер электрона
Итак, любой электрон можно описать четырьмя квантовыми числами, комбинация из этих чисел уникальна для каждой
позиции электрона, возьмём первый электрон, самый низкий энергетический уровень это N=1, на первом уровне
распологается одна оболочка, первая оболочка на любом уровне имеет форму шара (s-оболочка), т.е. L=0,
магнитное квантовое число может принять только одно значение, Ml=0 и спин будет равен +1/2.
Если мы возьмём пятый электрон (в каком бы атоме он не был), то главные квантовые числа для него будут:
N=2, L=1, M=-1, спин 1/2.
Энергетические уровни с подуровнями для наглядности изображены ниже, сверху вниз расположены уровни
и цветом разделены подуровни:
| 1 | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2 | |||||||||||||||||||
| 3 | |||||||||||||||||||
| 4 | |||||||||||||||||||
| 5 | |||||||||||||||||||
| 6 | |||||||||||||||||||
| 7 | |||||||||||||||||||
| 8 | |||||||||||||||||||
| Таблица 1. Распределение электронов по энергетическим уровням |
Здесь, сверху-вниз показаны энергетические уровни (1-7), слева-направо разделены по группам электронные
подуровни (s,p,d,f), в каждой ячейке располагаются по два электрона в противоположных направлениях. Общий
принцип распределения электронов такой, что энергетические подуровни заполняются в порядке суммы главного
и орбитального квантовых чисел, то есть: 1S, 2S, 2P, 3S, 3P, 4S, 3D и так далее, если сумма одинакова, то
сначала заполняется уровень с меньшим главным квантовым числом N.
У некоторых элементов имеются отклонения в формировании электронной конфигурации, а именно у
24Cr,
29Cu,
41Nb,
42Mo,
44Ru,
45Rh,
46Pd,
47Ag,
78Pt,
79Au
Элементы
Проверьте себя, составьте электронную конфигурацию для элементов #4, #10 и #21, затем проверьте себя по таблице ниже.
| № | Элемент | Название | Электронная конфигурация | Энергетических уровней |
|---|---|---|---|---|
| 1 | H | водород | 1s 1 | 1 |
| 2 | He | гелий | 1s 2 | 1 |
| 3 | Li | литий | 1s 22s 1 | 2 |
| 4 | Be | бериллий | 1s 22s 2 | 2 |
| 5 | B | бор | 1s 22s 22p 1 | 2 |
| 6 | C | углерод | 1s 22s 22p 2 | 2 |
| 7 | N | азот | 1s 22s 22p 3 | 2 |
| 8 | O | кислород | 1s 22s 22p 4 | 2 |
| 9 | F | фтор | 1s 22s 22p 5 | 2 |
| 10 | Ne | неон | 1s 22s 22p 6 | 2 |
| 11 | Na | натрий | 1s 22s 22p 63s 1 | 3 |
| 12 | Mg | магний | 1s 22s 22p 63s 2 | 3 |
| 13 | Al | алюминий | 1s 22s 22p 63s 23p1 | 3 |
| 14 | Si | кремний | 1s 22s 22p 63s 23p2 | 3 |
| 15 | P | фосфор | 1s 22s 22p 63s 23p3 | 3 |
| 16 | S | сера | 1s 22s 22p 63s 23p4 | 3 |
| 17 | Cl | хлор | 1s 22s 22p 63s 23p5 | 3 |
| 18 | Ar | аргон | 1s 22s 22p 63s 23p6 | 3 |
| 19 | K | калий | 1s 22s 22p 63s 23p64s 1 | 4 |
| 20 | Ca | кальций | 1s 22s 22p 63s 23p64s 2 | 4 |
| 21 | Sc | скандий | 1s 22s 22p 63s 23p64s 23d1 | 4 |
| 22 | Ti | титан | 1s 22s 22p 63s 23p64s 23d2 | 4 |
| 23 | V | ванадий | 1s 22s 22p 63s 23p64s 23d3 | 4 |
| 24 | Cr | хром | 1s 22s 22p 63s 23p64s 13d5 | 4 |
| 25 | Mn | марганец | 1s 22s 22p 63s 23p64s 23d5 | 4 |
| 26 | Fe | железо | 1s 22s 22p 63s 23p64s 23d6 | 4 |
| 27 | Co | кобальт | 1s 22s 22p 63s 23p64s 23d7 | 4 |
| 28 | Ni | никель | 1s 22s 22p 63s 23p64s 23d8 | 4 |
| 29 | Cu | медь | 1s 22s 22p 63s 23p64s 13d10 | 4 |
| 30 | Zn | цинк | 1s 22s 22p 63s 23p64s 23d10 | 4 |
| 31 | Ga | галлий | 1s 22s 22p 63s 23p64s 23d104p1 | 4 |
| 32 | Ge | германий | 1s 22s 22p 63s 23p64s 23d104p2 | 4 |
| 33 | As | мышьяк | 1s 22s 22p 63s 23p64s 23d104p3 | 4 |
| 34 | Se | селен | 1s 22s 22p 63s 23p64s 23d104p4 | 4 |
| 35 | Br | бром | 1s 22s 22p 63s 23p64s 23d104p5 | 4 |
| 36 | Kr | криптон | 1s 22s 22p 63s 23p64s 23d104p6 | 4 |
| 37 | Rb | рубидий | 1s 22s 22p 63s 23p64s 23d104p65s1 | 5 |
| 38 | Sr | стронций | 1s 22s 22p 63s 23p64s 23d104p65s2 | 5 |
| 39 | Y | иттрий | 1s 22s 22p 63s 23p64s 23d104p65s24d1 | 5 |
| 40 | Zr | цирконий | 1s 22s 22p 63s 23p64s 23d104p65s24d2 | 5 |
| 41 | Nb | ниобий | 1s 22s 22p 63s 23p64s 23d104p65s14d4 | 5 |
| 42 | Mo | молибден | 1s 22s 22p 63s 23p64s 23d104p65s14d5 | 5 |
| 43 | Tc | технеций | 1s 22s 22p 63s 23p64s 23d104p65s24d5 | 5 |
| 44 | Ru | рутений | 1s 22s 22p 63s 23p64s 23d104p65s14d7 | 5 |
| 45 | Rh | родий | 1s 22s 22p 63s 23p64s 23d104p65s14d8 | 5 |
| 46 | Pd | палладий | 1s 22s 22p 63s 23p64s 23d104p64d10 | 5 |
| 47 | Ag | серебро | 1s 22s 22p 63s 23p64s 23d104p65s14d10 | 5 |
| 48 | Cd | кадмий | 1s 22s 22p 63s 23p64s 23d104p65s24d10 | 5 |
| 49 | In | индий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p1 | 5 |
| 50 | Sn | олово | 1s 22s 22p 63s 23p64s 23d104p65s24d105p2 | 5 |
| 51 | Sb | сурьма | 1s 22s 22p 63s 23p64s 23d104p65s24d105p3 | 5 |
| 52 | Te | теллур | 1s 22s 22p 63s 23p64s 23d104p65s24d105p4 | 5 |
| 53 | I | йод | 1s 22s 22p 63s 23p64s 23d104p65s24d105p5 | 5 |
| 54 | Xe | ксенон | 1s 22s 22p 63s 23p64s 23d104p65s24d105p6 | 5 |
| 55 | Cs | цезий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s1 | 6 |
| 56 | Ba | барий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s2 | 6 |
| 57 | La | лантан | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s25d1 | 6 |
| 58 | Ce | церий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f2 | 6 |
| 59 | Pr | празеодим | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f3 | 6 |
| 60 | Nd | неодим | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f4 | 6 |
| 61 | Pm | прометий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f5 | 6 |
| 62 | Sm | самарий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f6 | 6 |
| 63 | Eu | европий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f7 | 6 |
| 64 | Gd | гадолиний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f75d1 | 6 |
| 65 | Tb | тербий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f9 | 6 |
| 66 | Dy | диспрозий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f10 | 6 |
| 67 | Ho | гольмий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f11 | 6 |
| 68 | Er | эрбий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f12 | 6 |
| 68 | Tm | тулий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f13 | 6 |
| 70 | Yb | иттербий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f14 | 6 |
| 71 | Lu | лютеций | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d1 | 6 |
| 72 | Hf | гафний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d2 | 6 |
| 73 | Ta | тантал | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d3 | 6 |
| 74 | W | вольфрам | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d4 | 6 |
| 75 | Re | рений | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d5 | 6 |
| 76 | Os | осмий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d6 | 6 |
| 77 | Ir | иридий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d7 | 6 |
| 78 | Pt | платина | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s14f145d9 | 6 |
| 79 | Au | золото | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s14f145d10 | 6 |
| 80 | Hg | ртуть | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d10 | 6 |
| 81 | Tl | таллий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p1 | 6 |
| 82 | Pb | свинец | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p2 | 6 |
| 83 | Bi | висмут | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p3 | 6 |
| 84 | Po | полоний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p4 | 6 |
| 85 | At | астат | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p5 | 6 |
| 86 | Rn | радон | 1s 22s 22p 63s 23p64s 23d104p65s14d105p66s24f145d106p6 | 6 |
| 87 | Fr | франций | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s1 | 7 |
| 88 | Ra | радий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s2 | 7 |
| 89 | Ac | актиний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s26d1 | 7 |
| 90 | Th | торий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s26d25f0 | 7 |
| 91 | Pa | протактиний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f26d1 | 7 |
| 92 | U | уран | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f36d1 | 7 |
| 93 | Np | нептуний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f46d1 | 7 |
| 94 | Pu | плутоний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f56d1 | 7 |
| 95 | Am | америций | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f7 | 7 |
| 96 | Cm | кюрий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f76d1 | 7 |
| 97 | Bk | берклий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f86d1 | 7 |
| 98 | Cf | калифорний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f10 | 7 |
| 99 | Es | эйнштейний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f11 | 7 |
| 100 | Fm | фермий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f12 | 7 |
| 101 | Md | менделеевий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f13 | 7 |
| 102 | No | нобелий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f14 | 7 |
| 103 | Lr | лоуренсий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d1 | 7 |
| 104 | Rf | резерфордий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d2 | 7 |
| 105 | Db | дубний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d3 | 7 |
| 106 | Sg | сиборгий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d4 | 7 |
| 107 | Bh | борий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d5 | 7 |
| 108 | Hs | хассий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d6 | 7 |
| 109 | Mt | мейтнерий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d7 | 7 |
| 110 | Ds | дармштадтий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d8 | 7 |
| 111 | Rg | рентгений | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d9 | 7 |
| 112 | Cn | коперниций | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d10 | 7 |
| 113 | Nh | нихоний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d107p1 | 7 |
| 114 | Fl | флеровий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d107p2 | 7 |
| 115 | Mc | московий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d107p3 | 7 |
| 116 | Lv | ливерморий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d107p4 | 7 |
| 117 | Ts | теннесcин | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d107p5 | 7 |
| 118 | Og | оганесон | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d107p6 | 7 |
| Таблица 2. Электронная конфигурация атомов |
Если Вы хотите узнать, как составить электронную конфигурацию, обратитесь к статье
«как написать электронную конфигурацию»
Квантовые числа электронов в атомах

Установление электронной структуры
Вспомним некоторые моменты атомной физики и квантовой механики. Когда мы имеем дело с одноэлектронным атомом, (рисунок ядра атома с положительно заряженным ядром и вокруг него можно представить вращающиеся электроны). Энергетическое состояние электрона может быть описано четырьмя квантовыми числами: главным квантовым числом n, орбитальным квантовым числом l, магнитным квантовым числом ml, (проекция орбитального момента на выделенное направление), спиновым квантовым числом ms (проекция спина на выделенное направление). Электроны – это частицы, подчиняющиеся статистике Ферми-Дирака (фермионы) [правилу запрета Паули]. В ансамбле одинаковых фермионов не может быть двух , обладающих одинаковыми квантовыми числами. Главное квантовое число n может принимать положительные целые значения, l может принимать значения от 0 до (n-1), ml принимает значения от -l до l через единицу (всего 2l+1 значений), ms принимает значения ± ½. Совокупность электронов атома с определенным значением главного квантового числа n образует электронный слой. Совокупность электронов с заданными n и l образует оболочку.
Заполнение электронных оболочек
Если вокруг ядра «вращается» только один электрон (атом водорода), то возможным его состояниям отвечают энергетические уровни, определяемые набором четырех квантовых чисел (n=1, l=0, ml=0, ms=± ½). В простейшей модели многоэлектронного атома – без учета взаимодействий между электронами – заполнение электронных оболочек происходит так, что электроны последовательно заполняют состояния с минимальным значением энергии. Сначала заполняется оболочка с n=1, на которой могут разместиться 2 электрона. Эта оболочка обозначается как 1s2. Здесь первый индекс соответствует главному квантовому числу, буква s показывает, что l=0, а верхний индекс 2 показывает, что в этой оболочке находятся 2 электрона. Следующей заполняется оболочка с n=2 и l=0. Эту оболочку можно записать как 2s2. Далее заполняется следующая оболочка 2p с n=2 и l=1. В ней может находиться 6 электронов, так как ml может принимать значения -1, 0, 1 и каждому значению соответствуют два значения проекции спина. Дальнейшая схема заполнения электронных оболочек по этой модели представлена в таблице 1.
Таблица 1:
|
l |
|||||
|
n |
s |
p |
d |
f |
g |
|
0 |
1 |
2 |
3 |
4 |
|
|
1 |
2 |
||||
|
2 |
2 |
6 |
|||
|
3 |
2 |
6 |
10 |
||
|
4 |
2 |
6 |
10 |
14 |
|
|
5 |
2 |
6 |
10 |
14 |
18 |
Полностью заполненные оболочки называются замкнутыми.
Модель, на основе которой рассмотрено заполнение, соответствует действительности лишь до атома аргона Ar с порядковым номером 18 и электронной структурой 1s2 2s2 2p6 3s2 3p6. У следующего элемента периодической системы химических элементов K заполняется не 3d
1
оболочка, как следовало ожидать, а 4s. Это связано с так называемой «центробежной» энергией, зависящей от оболочки, в которой находится электрон. Это приводит к тому, что начинают заполняться состояния с большими n, но меньшими l, поскольку большему значению l соответствуют большие значения момента импульса электрона и его «центробежной» энергии.
Химические элементы с не полностью заполненной 3d оболочкой называются 3dпереходными металлами, или металлами группы железа. Элементы с частично заполненной 4f оболочкой называются редкоземельными металлами, или лантаноидами, или лантанидами.
Для нас интересны электроны 4f, это та самая оболочка в редкоземельных элементах, которая несет магнетизм, поскольку у 13 элементов эта оболочка не является заполненной. У лантана 4f электронов нет, а у лютеция эта оболочка полностью заполнена. В промежутке между этими элементами оболочка заполнена частично, что приводит возникновению специфических магнитных свойств у этих металлов в конденсированной фазе. Выше была рассмотрена модель с одним электроном, однако мы имеем дело с многоэлектронными атомами, для описания заполнения оболочек которых необходимо применять векторную модель атома.
Векторная модель атома
В предыдущем параграфе состояние электронов в атоме характеризовалось электронной конфигурацией. Если электроны заполняют целиком несколько электронных оболочек, то орбитальные и спиновые моменты электронов компенсируют друг друга и суммарный орбитальный и суммарный спиновый магнитные моменты всех электронов равны нулю. У всех инертных газов полные моменты равны нулю. У атомов щелочных металлов с одним электроном в s-состоянии сверх замкнутых оболочек суммарный спиновый момент равен ±½, орбитальный момент равен нулю, таким образом полный момент электронов атома равен спиновому.
Электронная конфигурация не полностью описывает состояние атома, поскольку не учитывает «направления» спинового и орбитального моментов. Поясним на примере. В атоме углерода в 2p оболочке находятся 2 электрона. Их орбитальные моменты могут быть параллельны, тогда у атома будет результирующий орбитальный момент, а могут быть антипараллельны и тогда у атома результирующего орбитального момента не будет. Ситуация со спиновыми моментами аналогична. Таким образом каждой электронной конфигурации соответствует несколько состояний, различающихся значениями полного момента электронов. Это объясняется тем, что в модели самосогласованного поля (самосогласованным называется результирующее поле, создаваемое ядром атома и электронной оболочкой) не учитываются два типа взаимодействия: остаточное взаимодействие (часть кулоновского взаимодействия не сводящаяся к центральносимметричному согласованному полю) и спин-орбитальное взаимодействие.
Обычно в атомах спин-орбитальное взаимодействие меньше остаточного и последним можно пренебречь. Такое приближение называется случаем Расселя-Саундерса, или РассельСаундерской связью, или LS-связью, или нормальной связью. Полный момент атома с Рассель-Саундерской связью определяется по формуле (1):
|
, |
(1) |
||||||||
|
J |
=L S |
||||||||
|
N |
, |
N |
|||||||
|
где L=∑ li |
S=∑ si – полные орбитальный и спиновый моменты соответственно. |
||||||||
|
i=1 |
i =1 |
2

Такая связь реализуется в переходных атомах группы железа.
В тяжелых атомах реализуется jj-связь, поскольку спин-орбитальное взаимодействие превосходит электростатическое. Полный момент атома с jj-связью определяется по формуле (2):
|
N |
|||
|
, |
(2) |
||
|
J |
=∑ ji |
i=1
где ji=si li .
В чистом виде в атомах jj-связь не реализуется, а реализуется промежуточная связь, поскольку спин-орбитальное и электростатическое взаимодействия сравнимы по порядку величины.
Переход от LS-связи к jj-связи с ростом заряда ядра объясняется разной зависимостью взаимодействия от Z: электростатическое ~Z, а спин-орбитальное ~Z4.
Магнитный момент свободного атома
Поскольку при заполнении оболочки складываются орбитальные и спиновые моменты электронов, то складываются и соответствующие им магнитные моменты. Из квантовой механики известно, что электрон обладает собственным моментом количества движения, или спином ps :
ps = s s 1 (3)
Спину соответствует спиновый магнитный момент электрона μs:
|
s=2 B |
=2 |
B |
ps ,(4) |
||||
|
s s 1 |
|||||||
|
где |
B = |
e |
— магнетон Бора. |
||||
|
2mc |
|||||||
В атоме электрон занимает определенную оболочку и обладает определенным моментом количества движения, связанным с оболочкой и определяемым орбитальным квантовым
числом l, pl :
pl = l l 1 (5)
Магнитный момент, связанный с орбитальным движением электрона, l записывается в виде:
l= B l l 1 (6)
Полный магнитный магнитный момент атома складывается из орбитального и спинового моментов каждого электрона аналогично полному механическому моменту. Поскольку правила сложения механических моментов определены выше, то магнитный момент можно записать через механический:
|
J = g J B |
J J 1 |
, (7) |
||
|
где gJ называется g-фактором Ланде: |
||||
|
g J =1 |
J J 1 S S 1 − L L 1 |
(8) |
||
|
2J J 1 |
Из формулы 8 можно видеть справедливость коэффициентов в формулах (4) и (6).
3
Правила Хунда
Правила Хунда — правила для нахождения самых глубоких уровней энергии, соответствующих определенной электронной конфигурации атома при нормальной связи спиновых и орбитальных моментов образующих эти конфигурации электронов. Правила Хунда были установлены эмпирически в 1925 году.
1.Основным является уровень с максимальным полным спином S при определенной электронной конфигурации.
2.Основному состоянию атома при наибольшем значении S соответствует состояние с максимальным полным орбитальным моментом L.
3.При заполнении первой половины оболочки полный механический момент атома J
|
минимален, то есть L и |
S |
антипараллельны (J=L-S). При заполнении второй |
||
|
S |
параллельны (J=L+S). |
|||
|
половины оболочки J максимален, то есть L и |
||||
Электронная конфигурация редкоземельных металлов
Если бы электронные конфигурации РЗМ определялись нормальной связью, то выглядели бы следующим образом: 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4fn 5s2 5p6 5d1 6s2. Общее число электронов составляет 57+n. Фактор переходности этих элементов проявляется в том, что при переходе от элемента к элементу в ряду лантана, внешняя электронная оболочка 5d1 и 6s2 остается, а заполняется состояние внутри 4f от 1 до 14.
Реальная электронная конфигурация атомов РЗМ представлена в таблицах 2 и 3.
Таблица 2: белов, белянчикова и др, боровик и др
|
Обо |
||||||||||||||||
|
N |
знач |
1s |
2s |
2p |
3s |
3p |
3d |
4s |
4p |
4d |
4f |
5s |
5p |
5d |
5f |
6s |
|
ени |
||||||||||||||||
|
е |
||||||||||||||||
|
57 |
La |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
2 |
6 |
1 |
2 |
||
|
58 |
Ce |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
2 |
2 |
6 |
2 |
||
|
59 |
Pr |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
3 |
2 |
6 |
2 |
||
|
60 |
Nd |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
4 |
2 |
6 |
2 |
||
|
61 |
Pm |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
5 |
2 |
6 |
2 |
||
|
62 |
Sm |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
6 |
2 |
6 |
2 |
||
|
63 |
Eu |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
7 |
2 |
6 |
2 |
||
|
64 |
Gd |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
7 |
2 |
6 |
1 |
2 |
|
|
65 |
Tb |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
8 |
2 |
6 |
1 |
2 |
|
|
66 |
Dy |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
10 |
2 |
6 |
2 |
||
|
67 |
Ho |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
11 |
2 |
6 |
2 |
||
|
68 |
Er |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
12 |
2 |
6 |
2 |
||
|
69 |
Tu |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
13 |
2 |
6 |
2 |
||
|
70 |
Yb |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
14 |
2 |
6 |
2 |
||
|
71 |
Lu |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
14 |
2 |
6 |
1 |
2 |
|
4

|
Обо |
||||||||||||||||
|
N |
знач |
1s |
2s |
2p |
3s |
3p |
3d |
4s |
4p |
4d |
4f |
5s |
5p |
5d |
5f |
6s |
|
ени |
||||||||||||||||
|
е |
||||||||||||||||
|
39 |
Y |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
1 |
2 |
|||||
Таблица 3:
|
Обо |
|||||||||||||||
|
N |
знач |
1s |
2s |
2p |
3s |
3p |
3d |
4s |
4p |
4d |
4f |
5s |
5p |
5d 5f |
6s |
|
ени |
|||||||||||||||
|
е |
|||||||||||||||
|
57 |
La |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
2 |
6 |
1 |
2 |
|
|
58 |
Ce |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
1 |
2 |
6 |
1 |
2 |
|
59 |
Pr |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
3 |
2 |
6 |
2 |
|
|
60 |
Nd |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
4 |
2 |
6 |
2 |
|
|
61 |
Pm 2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
5 |
2 |
6 |
2 |
||
|
62 |
Sm |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
6 |
2 |
6 |
2 |
|
|
63 |
Eu |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
7 |
2 |
6 |
2 |
|
|
64 |
Gd |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
7 |
2 |
6 |
1 |
2 |
|
65 |
Tb |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
9 |
2 |
6 |
2 |
|
|
66 |
Dy |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
10 |
2 |
6 |
2 |
|
|
67 |
Ho |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
11 |
2 |
6 |
2 |
|
|
68 |
Er |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
12 |
2 |
6 |
2 |
|
|
69 |
Tu/ |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
13 |
2 |
6 |
2 |
|
|
Tm |
|||||||||||||||
|
70 |
Yb |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
14 |
2 |
6 |
2 |
|
|
71 |
Lu |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
14 |
2 |
6 |
1 |
2 |
|
39 |
Y |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
1 |
2 |
Проследим теперь за изменением квантовых числе S, L и J. Не совпадет что-то из рассказа и двух таблиц. + надо брать таблицы с величинами магнитных моментов
Величины L, S и J, полученные применением правила Хунда представлены на рисунке 1.
5

Рисунок 1:
Из рисунка видно, что орбитальный момент Gd равен нулю. Это состояние интересно тем, что электронная оболочка пространственно симметрична, поэтому такая конфигурация электронов слабо взаимодействует с электрическими полями, особенно с их градиентами кристаллической решетке. Таким образом чистый Gd и его сплавы и соединения как правило имеют значительно меньшую по величине магнитокристаллическую анизотропию.
В таблице 4 приведены значения количества 4f электронов в ионах РЗМ, полного спина, полного орбитального момента, полного механического момента, g-фактора и магнитного момента электронной оболочки. Магнитный момент электронной оболочки атома был рассчитан по формулам (7) и (8) в приближении LS-связи. В таблице значения приведены в магнетонах Бора. Такие цифры получаются для величины магнитного момента 4f оболочки свободного редкоземельного атома. Как видно из таблицы, у тяжелых элементов величины магнитных моментов существенно выше, чем у легких. В таблице приведены некоторые данные для металлических состояний элементов, то есть чистых металлов в конденсированном состоянии.
Таблица 4 — Некоторые параметры R ионов в свободном состоянии (теоретические) и в металлах (экспериментальные) при 4,2 K.
|
R-ион |
La |
Ce |
Pr |
Nd |
Pm |
Sm |
Eu |
Gd |
Tb |
Dy |
Ho |
Er |
Tm |
Yb |
Lu |
|
Число 4f электронов |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
|
S |
0 |
1/2 |
1 |
3/2 |
2 |
5/2 |
3 |
7/2 |
3 |
5/2 |
2 |
3/2 |
1 |
1/2 |
0 |
|
L |
0 |
3 |
5 |
6 |
6 |
5 |
3 |
0 |
3 |
5 |
6 |
6 |
5 |
3 |
0 |
|
J |
0 |
5/2 |
4 |
9/2 |
4 |
5/2 |
0 |
7/2 |
6 |
15/2 |
8 |
15/2 |
6 |
7/2 |
0 |
|
g |
— |
6/7 |
4/5 |
8/11 |
3/5 |
2/7 |
— |
2 |
3/2 |
4/3 |
5/4 |
6/5 |
7/6 |
8/7 |
— |
|
gJ |
2,14 |
3,2 |
3,27 |
2,4 |
0,72 |
0 |
7 |
9 |
10 |
10 |
9 |
7 |
4 |
0 |
|
6
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #