Как определить общее число электронов в соединении?
Общее число электронов в соединении равно сумме электронов химических элементов этого соединения.
Число электронов химического элемента равно его порядковому номеру в периодической таблице: атом электронейтрален, а нумерация идет по заряду ядра. Каждый последующий химический элемент имеет заряд ядра на единицу больше, чем предыдущий. Водород +1, гелий +2, литий +3, бериллий +4, бор +5 и так далее.
При подсчете мы должны учитывать индексы (число атомов) элементов в соединении. Для этого число атомов данного химического элемента нужно умножить на число его электронов.
Примеры
Для начала рекомендую вам вспомнить, как определить общее число электронов в атоме?
Число электронов в молекуле хлора (Cl2) будет равно сумме электронов двух атомов хлора. Один атом хлора имеет 17 электронов, значит в молекуле хлора всего имеется 17 * 2 = 34 электрона.
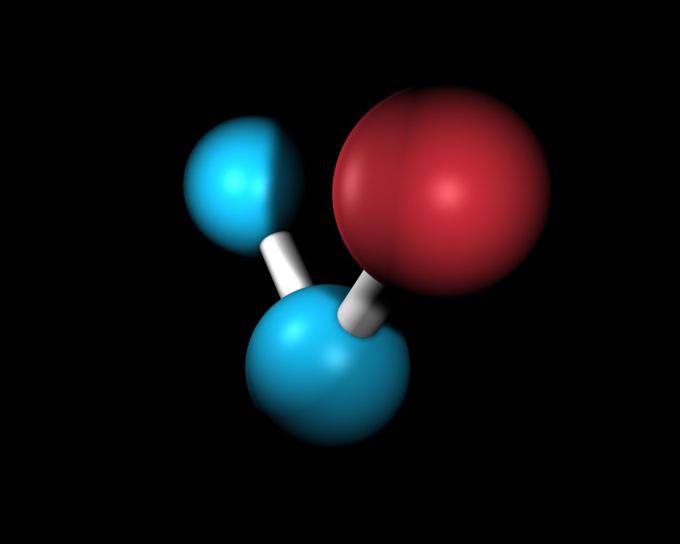
Число электронов в молекуле воды (H2O) будет равно сумме электронов двух атомов водорода и одного атома кислорода: 1 * 2 + 8 = 10 электронов.
В молекуле глюкозы (C6H12O6) общее число электронов будет равно сумме электронов 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода: 6 * 6 + 12 * 1 + 6 * 8 = 36 + 12 + 48 = 96 электронов.
Суммарное число электронов в молекуле дактиномицина (C62H86N12O16) составляет собой сумму электронов 62 атомов углерода, 86 атомов водорода, 12 атомов азота и 16 атомов кислорода: 62 * 6 + 86 * 1 + 12 * 7 + 16 * 8 = 372 + 86 + 84 + 128 = 670 электронов.
Похожие вопросы:
– Как определить число протонов и нейтронов в атоме?
– Как определить общее число электронов в атоме?
Как определить количество электронов
Атом химического элемента состоит из ядра и электронов. Количество электронов в атоме зависит от его атомного номера. Электронная конфигурация определяет распределение электрона по оболочкам и подоболочкам.
Вам понадобится
- Атомный номер, состав молекулы
Инструкция
Если атом электронейтрален, то число электронов в нем равно числу протонов. Число протонов соответствует атомному номеру элемента в таблице Менделеева. Например, водород имеет первый атомный номер, поэтому его атом имеет один электрон. Атомный номер натрия — 11, поэтому атом натрия имеет 11 электронов.
Атом также может терять или присоединять электроны. В этом случае атом становится ионом, имеющим электрический положительный или отрицательный заряд. Допустим, один из электронов натрия покинул электронную оболочку атома. Тогда атом натрия станет положительно заряженным ионом, имеющим заряд +1 и 10 электронов на своей электронной оболочки. При присоединении электронов атом становится отрицательным ионом.
Атомы химических элементов могут также соединяться в молекулы, наименьшую частицу вещества. Количество электронов в молекуле равно количеству электронов всех входящих в нее атомов. Например, молекула воды H2O состоит из двух атомов водорода, каждый из которых имеет по одному электрону, и атома кислорода, который имеет 8 электронов. То есть, в молекуле воды всего 10 электронов.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Загрузить PDF
Загрузить PDF
Протоны, нейтроны и электроны – основные частицы, из которых состоит атом. Протоны заряжены положительно, электроны – отрицательно, а нейтроны и вовсе не имеют заряда.[1]
Масса электронов очень мала, а масса протонов и нейтронов практически одинакова.[2]
На самом деле, найти в атоме количество протонов, нейтронов и электронов довольно просто, нужно только научиться ориентироваться по периодической таблице химических элементов Д.И.Менделеева.
-
1
Возьмите периодическую таблицу элементов. Это система, в которой элементы организованы в зависимости от их атомной структуры. Цветное одно- или двухбуквенное сокращение – это название элемента в сокращенном виде. В таблице также представлена информация об атомном номере элемента и атомной массе.[3]
- Таблицу Менделеева можно найти в учебнике по химии или в Интернете.
- Во время контрольных работ периодическую таблицу обычно предоставляют.
-
2
Найдите в таблице нужный вам элемент. Каждый элемент в таблице располагается под своим номером. Все элементы можно разделить на металлы, неметаллы и метоллоиды (полуметаллы). В этих группах элементы классифицируются еще на несколько групп: щелочные металлы, галогены, инертные газы.[4]
- Группы (столбцы) и периоды (строки) нужны для систематизации, по ним легко найти нужный вам элемент.
- Если вы ничего не знаете о нужном вам элементе, просто найдите его в таблице.
-
3
Найдите атомный номер элемента. Атомный номер обозначает число протонов в ядре атома.[5]
Атомный номер располагается над символом элемента, обычно в левом верхнем углу клетки. Он покажет вам, сколько протонов содержится в одном атоме элемента.- Например, Бор (В) обозначен в таблице под номером 5, поэтому у него 5 протонов.
-
4
Определите количество электронов. Протоны — это положительно заряженные частицы в ядре атома. Электроны представляют собой частицы, которые несут отрицательный заряд. Поэтому когда элемент находится в нейтральном состоянии, то есть его заряд будет равен нулю, число протонов и электронов будет равным.
- Например, Бор (В) обозначен в таблице под номером 5, поэтому можно смело утверждать, что у него 5 электронов и 5 протонов.
- Однако если элемент содержит отрицательный или положительный ион, то протоны и электроны не будут одинаковыми. Вам придется вычислить их. Число ионов выглядит как маленький, верхний индекс после элемента.
-
5
Найдите атомную массу элемента. Чтобы найти число нейтронов, вам сначала нужно вычислить атомную массу элемента. Атомная масса – это средняя масса атомов данного элемента, ее нужно рассчитывать. Имейте в виду, что у изотопов атомная масса отличается.[6]
. Атомная масса указана под символом элемента.- Округляйте атомную массу до ближайшего целого числа. Например, атомная масса бора = 10,811, соответственно, ее можно округлить до 11.
-
6
Вычтите из атомной массы атомный номер. Чтобы определить количество нейтронов, нужно вычесть атомный номер из атомной массы. Помните, что атомный номер — это число протонов, которое вы уже определили.[7]
- Возьмем наш пример с бором: 11 (атомная масса) – 5 (атомный номер) = 6 нейтронов.
Реклама
-
1
Определите число ионов. Ион — это атом, состоящий из положительно заряженного ядра, в котором находятся протоны и нейтроны, и отрицательно заряженных электронов. Атом несет нейтральный заряд, но заряд может быть положительным и отрицательным из-за электронов, которые атом может отдавать и принимать.[8]
Поэтому число протонов в атоме не меняется, а число электронов в ионе может меняться.- Электрон несет отрицательный заряд, поэтому если атом отдает электроны, то сам становится заряженным положительно. Когда атом принимает электроны, он становится отрицательно заряженным ионом.
- Например, у N3- заряд -3, а у Ca2+ заряд +2.
- Помните, если число ионов не указано в таблице, вам не нужно делать подобные вычисления.
-
2
Вычтите заряд из атомного номера. Если ион положительно заряжен, нужно вычесть из атомного номера заряд. Если у иона положительный заряд, значит, он отдал электроны. Чтобы подсчитать оставшееся число электронов, нужно вычесть заряд от атомного номера. Если ион заряжен положительно, значит, в нем больше протонов, чем электронов.
- Например, у Ca2+ заряд +2, поэтому можно сказать, что он отдал два электрона. Атомный номер кальция = 20, поэтому у его иона 18 электронов (20-2=18).
-
3
Если ион заряжен отрицательно, чтобы узнать число электронов, нужно добавить заряд к атомному номеру. Потому что ион стал отрицательным из-за того, что принял лишние электроны. Так что нужно просто прибавить заряд к атомному номеру, тогда вы получите число электронов. Разумеется, если ион заряжен отрицательно, то электронов в нем больше, чем протонов.
- Например, у N3- заряд -3, значит, азот получил три дополнительных электрона. Атомный номер азота 7, поэтому число электронов у азота = 10. (то есть 7+3=10).
Реклама
Об этой статье
Эту страницу просматривали 955 472 раза.
Была ли эта статья полезной?
Download Article
Download Article
All basic elements are made up of electrons, protons, and neutrons. An electron is a negatively charged particle that makes up part of an atom. A fundamental concept in chemistry is the ability to determine how many electrons an atom contains. By using a periodic table of elements, this can easily be determined. Other important concepts involve how to find the number of neutrons and valence electrons (number of electrons in its outermost shell) in an element.
-
1
Obtain a periodic table of elements. This is a color-coded table that organizes all the known elements by atomic structure. Each element has a 1, 2, or 3-letter abbreviation and is listed along with its atomic weight and atomic number.[1]
- Periodic tables can easily be found in chemistry books as well as online.
-
2
Find the element in question on the periodic table. The elements are ordered by atomic number and separated into three main groups: metals, non-metals, and metalloids (semi-metals). They are further grouped into families including alkali metals, halogens, and noble gases.[2]
Every column of the table is called a group and every row is called a period.- If you know the details of your element, such as what group or period it is in, it will be easier to locate.
- If you don’t know anything about the element in question, just search the table for its symbol until you find it.
Advertisement
-
3
Find the atomic number of an element. The atomic number appears in the upper left-hand corner or centrally above the element symbol in the square. The atomic number defines the number of protons present in that particular element.[3]
Protons are the particles in an element that provide a positive charge. Because electrons are negatively charged, when an element is in its neutral state, it will have the same number of protons as electrons.- For instance, boron (B) has an atomic number of 5, meaning that it has 5 protons and 5 electrons.
Advertisement
-
1
Identify the charge of the ion. Adding and removing electrons from an atom does not change its identity, but it changes its charge. In these cases, you now have an ion, such as K+, Ca2+, or N3-. Usually, the charge is expressed in a superscript to the right of the atom abbreviation.
- Because an electron has a negative charge, when you add extra electrons, the ion becomes more negative.
- When you remove electrons, the ion becomes more positive.
- For example, N3- has a -3 charge while Ca2+ has a +2 charge.
-
2
Subtract the charge from the atomic number if the ion is positive. If the charge is positive, the ion has lost electrons. To determine how many electrons are left, subtract the amount of charge from the atomic number. In this case, there are more protons than electrons.
- For example, Ca2+ has a +2 charge, therefore, it has 2 fewer electrons than a neutral calcium atom. Calcium’s atomic number is 20, therefore this ion has 18 electrons.
-
3
Add the charge to the atomic number if the charge is negative. If the charge is negative, the ion has gained electrons. To determine how many total electrons there are, add the amount of charge to the atomic number. In this case, there are fewer protons than electrons.
- For example, N3- has a -3 charge which means it has 3 more electrons than a neutral nitrogen atom. Nitrogen’s atomic number is 7, therefore this ion has 10 electrons.
Advertisement
Add New Question
-
Question
What if the charge has no number?
If the charge has no number (is 0), then the number of electrons is the same as the number of protons.
-
Question
How do I calculate the number of electrons by looking at a periodic table?
It is the atomic number. However, if it has positive ion, then this electron number will go down (ie +2 charge means two electrons have been lost, so the electron/atomic number will go down by two) and vice versa.
-
Question
How do I figure out the number of valence electrons?
Valence electrons are the electrons contained in the outermost shell. If you look at the periodic table and at the period numbers, that is the number of valence electrons. If the number is larger than 10, subtract 10 so you get two valence electrons. Example: Oxygen is in the 16th period. If we subtract 10 from 16, we get 6; therefore, oxygen has six valence electrons.
See more answers
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
Video
References
About This Article
Article SummaryX
To find the number of electrons an atom has, start by looking up the element you’re working with on the periodic table and locating its atomic number, which will be in the upper left-hand corner of the square. Then, identify the charge of the ion, which will be written as a superscript to the right of the element. Finally, subtract the charge from the atomic number if the ion is positive or add the charge to the atomic number if the ion is negative. To learn how to read and use a periodic table, keep reading!
Did this summary help you?
Thanks to all authors for creating a page that has been read 365,113 times.
Reader Success Stories
-
Jeff Rodniklaem
Apr 18, 2016
«The article really informed me about finding the electrons as my school teacher struggled to help me a bit. I am…» more
Did this article help you?
Электроны в координационных соединениях
С металлами и лигандами более-менее разобрались, займемся теперь электронами. Сначала посчитаем валентные электроны в системе металл-лиганды. Это приведет нас к очень интересному эмпирическому правилу, на основании которого можно “на глазок” прикинуть, насколько тот или иной нарисованный на бумаге комплекс имеет право на существование и насколько он способен вступать в реакции. Это очень важные вопросы, и даже удивительно, что мы собираемся решать их на основании такого простого действия. На самом деле, не столько решать, сколько именно оценивать, насколько разумно написанное или запланированное. Что поделать, в естественных науках не бывает абсолютно правильных утверждений, догматов, но любая идея может быть верной или неверной с некоторой степенью вероятности, и не более. Стремиться надо только к тому, чтобы идеи были более обоснованы, опирались на более достоверные исходные данные или высказанные ранее гипотезы.
Считаем валентные электроны в комплексах
В любой химии, как бы сложна она ни была, действуют довольно простые закономерности, установленные давным-давно, еще в самом начале развития электронной теории структуры молекул. “Давным-давно” это конечно преувеличение – самые первые идеи на этот счет были высказаны Джилбертом Ньютоном Льюисом всего-то сто лет назад, в 1916 году. И с тех пор мы считаем электроны в молекулах парами, представляя себе химическую связь как такое хорошее взаимодействие (хорошее = удерживающее атомы рядом) между атомами, обеспечиваемое более-менее общим владением парой электронов. И в самом начале все было просто – каждому атому приписывались валентные возможности, основанные на знании числа и типа электронов на его валентной оболочке. И утверждалось, что каждый атом стремится к идеалу – к обладанию полностью заполненной оболочкой как у соответствующего инертного газа в конце каждого длинного периода. Отсюда возникло сначала правило октета Льюиса для p-элементов, и довольно быстро после этого, в 1921 году Ирвин Лангмюр, хорошо знакомый всем, кто занимается изучением поверхностных явлений, сформулировал похожее правило для d-элементов, предписав им стремиться к конфигурации с 18 электронами. В дальнейшем это правило пытались сделать более строгим через учет вообще всех электронов, не только валентных, но получилось тяжеловесно и непродуктивно, поэтому правило вернулось к 18-электронному счету.
Это не просто простая, а очень простая процедура. Мы уже научились определять типы лигандов, размечать их на L и X, определять степень окисления и число d-электронов на металле. Осталось посчитать все электроны на валентных оболочках.
Есть два способа подсчета, один называется ковалентным, другой ионным. Удобно владеть обоими – это позволяет проверять себя, правильно ли посчитал(а).
Ковалентный способ
- Определяем обобщенную формулу комплекса (структурный тип), разметив лиганды на L и X-типы.
- Складываем номер группы металла, заряд комплекса с обратным знаком, по одному электрону на каждый X-лиганд, по два на каждый L-лиганд.
- Рассматриваем получившееся число
Ионный способ
- Первый шаг такой же. Определяем обобщенную формулу комплекса (структурный тип), разметив лиганды на L и X-типы.
- Определяем степень окисления металла, сложив количество X-лигандов и заряд комплекса (с учетом знака)
- Определяем количество d-электронов вычитанием степени окисления из номера группы металла
- Складываем число d-электронов и по два на каждый лиганд X или L-типа
- Рассматриваем полученное число – оно должно быть таким же, как в ковалентном способе
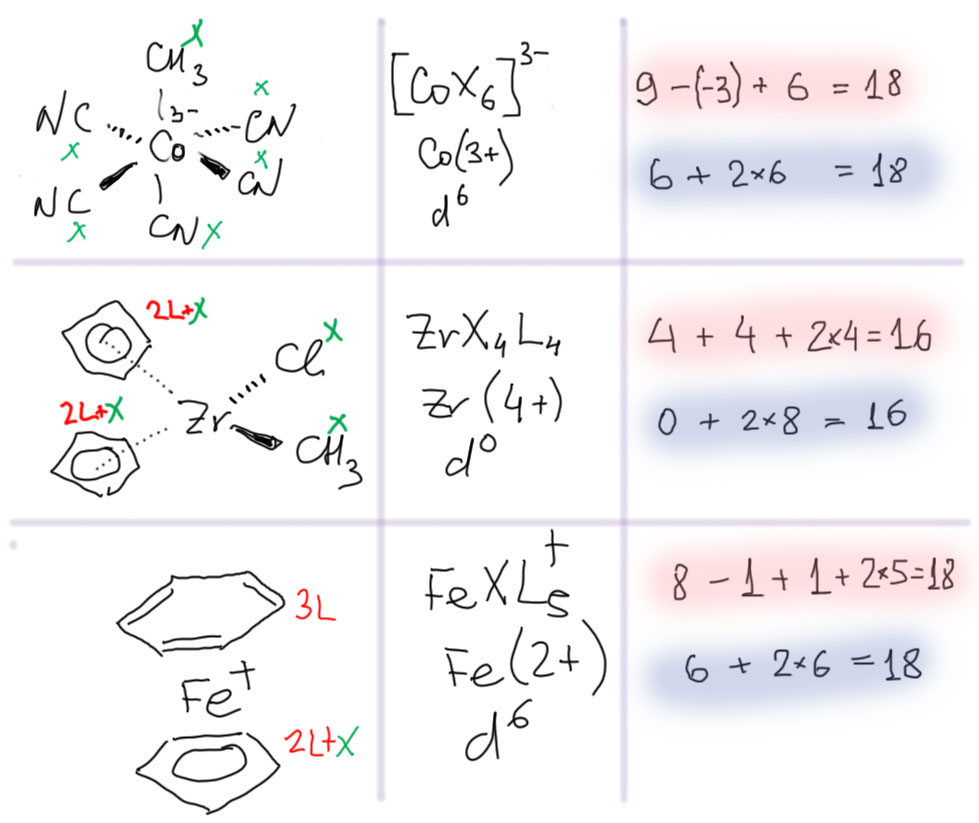
Потренируемся. Возьмем самые разные комплексы с разнообразными лигандами, с зарядом и без, поздних и ранних переходных металлов.
Результат вполне представительный. Видно, что почти всегда получается число 18, и иногда 16.
В стабильных комплексах переходных металлов число валентных электронов обычно равно 18, но часто бывает и 16.
Это действительно так, и если бы мы взяли не шесть, а шестьсот комплексов, получили бы почти то же самое, но очень редко встречались бы числа меньше 16 (12 и 14), и иногда, но гораздо реже числа больше 18 – 19 и 20. Один комплекс с 20 электронами очень хорошо известен – это никелевый аналог ферроцена никелоцен, изумительно красивые кристаллы, совершенно стабильное вещество, хотя и не такое дубовое, как неубиваемый ферроцен – на воздухе никелоцен довольно быстро окисляется, как раз и теряя “лишние” электроны. Комплексов с 12 и 14 электронами, вообще говоря, довольно много среди соединений ранних переходных металлов, особенно с конфигурацией d0. Даже очень много, настолько много, что уже 18-электронное правило для таких металлов кажется редким исключением. И если бы мы занимались координационной химией вообще, на всем множестве металлов и их валентных состояний, то мы не стали бы так настаивать на большой важности 18-электронного правила, а постарались бы рассмотреть в деталях частные закономерности структуры в более узких группах металлов. Но…
18-электронное правило особенно актуально в применении к комплексам, участвующим в реакциях с органическими соединениями
… мы занимаемся вполне конкретной частью химии переходных металлов в применении к органическому синтезу. И в этой области, по крайней мере до сих пор существовал жесткий перекос в пользу соединений поздних переходных металлов с большим количеством d-электронов, а для таких соединений 18-электронное правило работает очень хорошо и действительно описывает львиную долю комплексов и закономерностей их устойчивости и реакционной способности. Итак, этот результат настолько впечатляющий, что его полезно сформулировать еще раз, но немного в другом виде. Это наблюдение называют правилом Толмена (или Толмана), в честь Чедвика Толмена, который спустя полвека после Лангмюра приспособил общее и далеко не всегда верное высказывание об особой стабильности комплексов с 18-электронной оболочкой металла именно к потребностям гомогенного катализа, заметив, что
комплексы, участвующие в каталитических реакциях имеют 18 и 16-электронные конфигурации, превращаясь друг в друга в каталитических циклах
Сам Толмен сформулировал это правило гораздо категоричнее, фактически как правило отбора правильных реакций – типа, если вы видите что-то другое, какое-то другое число электронов, то это ошибка. Толмен работал не в академической, а в промышленной химии, и вообще увлекался формулированием простых и, как ему возможно казалось, универсальных принципов, которые позволили бы сделать подбор и разработку катализаторов точной и эффективной наукой, и даже скорее технологией. Кроме этого правила он же предложил количественные характеристики лигандов, конический угол и угол укуса, с которыми мы еще познакомимся. В то романтическое время, когда каталитические реакции открывали дюжинами в месяц, и эта новая химия казалась универсальным ключом ко всем проблемам синтеза, а обилие новых реакций и механизмов ошарашивало, было естественное желание все это максимально упорядочить и привести в строгую систему, похожую на то, что немного раньше было сделано в обычной органической химии с помощью науки об электронной структуре, эффектах и механизмах. Реальность как всегда оказалась намного богаче и сложнее, простые рецепты Толмена не превратились в универсальные законы, но остались как весьма полезные правила, сильно облегчающие жизнь и анализ результатов.
Правило 18 электронов очень похоже на правило октета Льюиса, которое тоже включает некоторую неопределенность – в устойчивых соединениях элементов второго периода не может быть больше 8 валентных электронов (шесть может быть вполне, и трехфтористый бор – отличный пример совершенно устойчивого соединения с секстетом электронов у бора, хотя мы, конечно, знаем, что это кислота Льюиса, не упускающая возможность добить оболочку до октета). Но правило октета во втором периоде категорически не допускает расширение оболочки свыше восьми. Но то же правило октета применяют и к p-элементам третьего и последующих периодов, для которых хорошо известна способность формально образовывать больше связей, чем позволяет октет (это называется гипервалентностью). Один из способов представления о том, как это получается состоит в том, чтобы добавить пустую d-оболочку к валентной оболочке, и использовать эти d-орбитали для образования донорно-акцепторных связей за счет электронной пары второго атома связи. Увы, это описание давным-давно сочтено неверным, а это означает, что все связи в таких соединениях обслуживаются тем же самым октетом электронов, и правило октета фактически не нарушается. Не нарушается, но мы не обязаны об этом знать, и когда мы рисуем общепринятую формулу, например, серной кислоты с шестью связевыми черточками на атоме серы, то просто обязаны посчитать их все в счет электронов на сере, а иначе мы обидим кислород. Рисовать же формулу с двумя плюсами на сере мы как-то не обучены и она кажется нам неестественной и странной. К тому же серная кислота серной кислотой, но как тогда рисовать структуру, например, гексафторида серы? Причина таких недоразумений до обидного проста – у нас нет четких правил подсчета валентных электронов для соединений непереходных элементов, да и структурные формулы не так однозначны, как нам хотелось бы. Но живем как-то с этими, а значит не больно-то нам они и нужны. Чуть ниже попробуем разобраться в этой проблеме подробнее, и убедимся, что проблема гипервалентности и приспособления правила октета ко всему множеству соединений имеет отношение и к химии переходных металлов.
Это противопоставление довольно явно показывает, что любые правила подсчета электронов – занятие сугубо формальное, и работать оно будет только в одном случае – если правила подсчета будут сформулированы однозначно и без исключений.
Но у такого формализма есть и неказистая обратная сторона – ни в коем случае не нужно путать формальный счет электронов с реальной электронной структурой молекулы. Формальный счет электронов подразумевает, что каждый лиганд или лигандный (координационный) центр в сложном лиганде участвует в образовании связи с металлом одной орбиталью с одной парой электронов. То, что это не всегда так, довольно хорошо понятно даже просто из общих соображений. Но мы добровольно накладываем это ограничение для того чтобы считать электроны однозначным образом.
18-Электронное правило формулируется без категорических заявлений. Оно как будто просто задает норму – говорит, что подавляющее большинство комплексов ему подчиняется, но найти исключения и вниз и вверх очень просто. Но очень важно, что каждое исключение должно привлечь внимание и быть объяснено. Например, отличное от 18 число электронов у сандвичевых металлоценов, аналогов ферроцена, просто объясняется исключительной выгодностью образования двух ароматических колец, которое перевешивает другие факторы. Комплексы с малым числом электронов (14, 12) часто образуются, потому что используются очень громоздкие лиганды, которые просто не пускают в координационную сферу дополнительные лиганды со своими электронами. Мы увидим, что изобретение таких лигандов – один из важнейших приемов в разработке активных катализаторов.
Посмотрим, как работает счет электронов на нескольких примерах
Посмотрим, что получится на нескольких, взятых наугад, реальных комплексах. Начнем с нейтральных. Красненьким подсвечен расчет по ковалентной модели, синеньким – по ионной. Как видим, получается или 18 или 16. В этой, мягко говоря, непредставительной выборке получился счет 2:1. Если бы мы взяли не три, а тридцать, и тоже случайно, то счет в пользу 18 получился бы более разгромным, что-то типа 5:1, что вполне отражало бы реальную картину – 18-электронных комплексов намного больше всех остальных, но и 16-электронные встречаются нередко, и, что даже важнее, среди таких комплексов немало важнейших. Вот, например, в химии элементов 10 группы просто очень распространен 16-электронный тип MX2L2. А в химии 4 группы, невероятно популярной, например, в процессах полимеризации, – также 16-электронный тип MX4L4.
Еще три примера, два с зарядами, один из уже упомянутой химии раннего переходного металла. Результат тот же.
Как не потерять заряд комплекса, если заряд есть на лигандах
Обычно с зарядами на комплексе проблем не бывает, особенно если мы видим, как комплекс получился – в результате какого процесса. Но если нам просто дан комплекс, и нужно определить формальные параметры комплексообразования, заряды могут быть источником неожиданных проблем, если они находятся где-то на периферии более-менее сложного лиганда. В этих случаях заряд очень просто потерять и получить проблемы с определением, в первую очередь, степени окисления металла, а значит и всего остального. Вот я тут в коротком ролике разобрал один такой довольно коварный пример с весьма знаменитым комплексом Чугаева.
- Когда анализирум комплексы, нужно быть особенно внимательным с зарядом, если комплекс имеет заряд. Где тот заряд сидит, на металле или нет? Это как раз не так важно, и, более того, это очень непросто выяснить без хороших квантовых расчётов. Нас интересует формальный заряд. Мы его учитываем в расчёте степени окисления и всего остального.
Простые правила таковы:
- лиганды L-типа (любые, и 2L и 3L и т.п.) приходят в комплекс со своим зарядом. Молекула, которая вознамерилась стать L-лигандом вполне может иметь заряд где-то, а на самом деле, где угодно. Например, пиридин – нейтральный L-лиганд, заряда не имеет, а анион пиридин-4-карбоновой кислоты, если связан с металлом по азоту, то это тоже L-лиганд, но отрицательно заряженный. Он принесёт в общий заряд комплекса свой -1.
- лиганды X-типа всегда приходят как анионы и приносят -1. И любые лиганды, имеющие X-составляющие тоже. Аллил в обоих типах, и моно- и тригапто принесёт -1. Циклопентадиенил тоже. А если в составе X-лиганда есть ещё что-то с зарядом, кидаем этот заряд в общий котёл. Скажем, винная кислота может цапнуть металл обоими гидроксилами как Х-лигандами, а карбоксилы в таком комплексе могут быть в виде анионов: такой лиганд принесёт 4-.
- X2 лиганд принесёт -2. X3 лиганд -3. Ну и если у них где-то ещё в составе заваляются какие-то заряды, валим в общий котёл.
Сделав это для всех лигандов комплекса, получим общий заряд, который притащили с собой лиганды. Дальше есть две возможности.
- Вы откуда-то знаете степень окисления металла. Это вполне возможно, потому что вы, например, знаете, что комплекс, который вы рассматриваете получен из другого, более очевидного комплекса с известной степенью окисления за счёт обмена лигандов – процесса, не изменяющего степень окисления. Тогда суммируете с учётом знаков степень окисления и общий заряд, принесённый лигандами, и получаете заряд всей комплексной частицы.
- Вы знаете заряд комплекса. Просто знаете, и всё. В книжке или журнале нарисован комплекс с зарядом, например. Тогда вычитаете из заряда комплекса общий заряд, принесённый лигандами, и получаете степень окисления металла.
- Если вы не знаете ни степень окисления, ни заряд комплекса, у вас проблемы. Остаётся надеяться на аналогии и косвенные данные. Может повезёт догадаться.
- Если вы знаете и то и другое, то делать ничего не надо. Райское наслаждение.
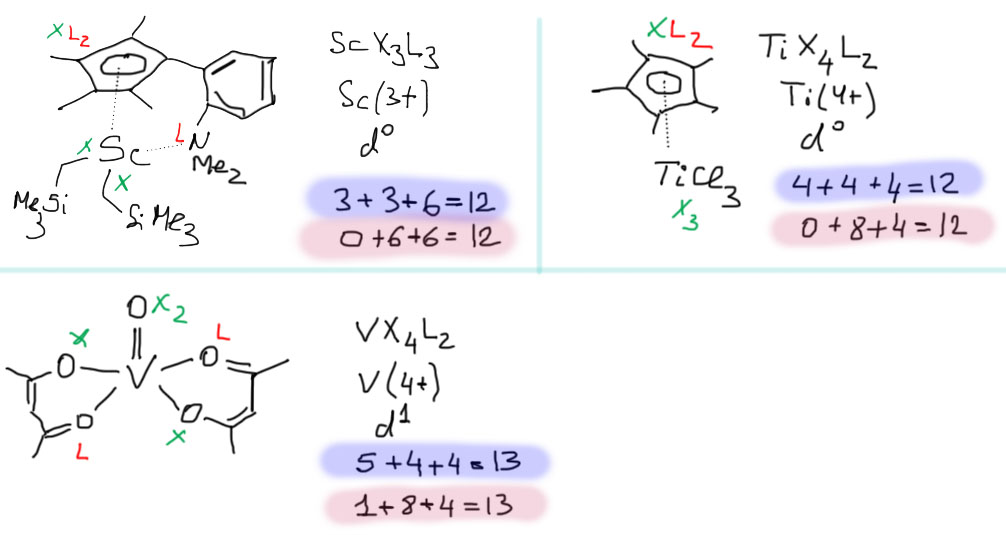
Особенности ранних переходных металлов
У 18-электронного правила есть и еще одна проблема – оно, строго говоря, не имеет простого и убедительного обоснования, а является просто обобщением большого количества структур реальных комплексов. Да, можно посчитать, что это и правда просто обобщение правила октета на d-элементы, валентная оболочка у которых по определению включает d, s, и p-оболочки (в первом ряду, например, 3d, 4s, 4p), как это формально и подразумевает нахождение элемента в длинном периоде.
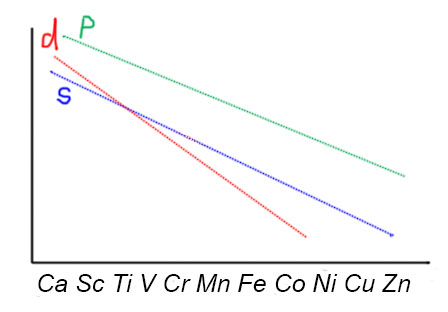
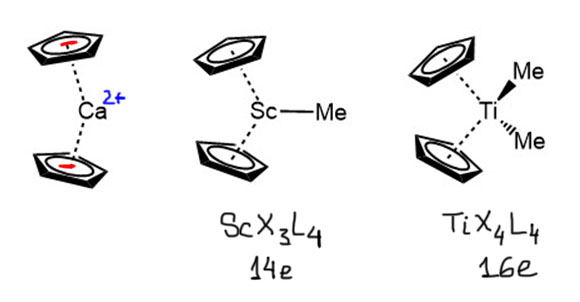
P-оболочка в начале d-элементов очень высока, и практически общепризнанно, что она недоступна, фактически не является валентной оболочкой. В этом случае работать должны были бы только d- и s-оболочки, то есть всего 12 электронов (10d + 2s) максимум. Нет ли в таком случае особого, 12-электронного правила у ранних переходных металлов, хотя бы самых первых, из 3-5 групп?
Посмотрим на типичные комплексы скандия, титана, ванадия. У скандия действительно преобладают комплексы типа ScX3L3. 12-Электронный счет для самого раннего из переходных металлов преобладает. Среди комплексов титана тоже очень много 12-электронных комплексов TiX4L2, но вполне широко представлены и 14, и 16-электронные, к тому же появляется и низкая степень окисления Ti(2+), для которой можно найти и 18-электронные комплексы, и мы ими еще займемся. Когда доходим до ванадия, 12-электронные комплексы практически исчезают, и основным типом для максимальной степени окисления становится VX5L2 с 14-электронным счетом, комплексы с 13-электронным счетом встречаются среди соединений V(4+), вполне неплохо представлены и более низкие степени окисления со счетом электронов до 18. Для хрома 12-электронный счет совсем нехарактерен, хотя можно вспомнить про такое простое соединение как CrO3 – ведь это тоже комплекс, триоксохром(6+), и если эта молекула существует реально, то это комплекс CrX6 – то, что нужно. То же самое будет и у таких простых соединений как хроматы, бихроматы и т.п. – все это оксо/гидроксо-комплексы хрома(6+). Если мы не ограничимся первым рядом переходных металлов, а спустимся во второй или третий, то у молибдена и вольфрама мы найдем много интересных комплексов типа MX6 – мы еще встретимся с ними в катализе, потому что к этому типу относятся важнейшие катализаторы метатезиса олефинов и ацетиленов.
Но за исключением скандия, для которого 12-электронный тип действительно преобладающий с разгромным счетом, хотя исключения встречаются, и прелюбопытные, то уже для 4 группы так сказать нельзя. К тому же, если спуститься в группе немного вниз, то для более тяжелых элементов комплексы с большим счетом попадаются гораздо чаще, чем для элементов первого ряда. Важнейшие для катализа бис-циклопентадиенильные комплексы титана, циркония и гафния принадлежат к типу MX4L4 – то есть имеют 16-электронный счет, вполне вписывающийся в правило Толмена, хотя до 18 электронов счет у комплексов металлом 4 группы, вероятно, не доходит никогда, а в реакциях таких комплексов обмен лигандов происходит не через ассоциацию, а через диссоциацию, то есть не в режиме Толмена 16/18, а в режиме 16/14. Начиная с 5 группы разнообразие комплексов с разным счетом возрастает, и 18-электронный счет становится привычным, но не преобладающим.
Вот, попробуйте сами разобраться в структурах нескольких комплексов по рентгеноструктурным данным (атомы водорода не показаны).
- 1
- 2
- 3
- 4
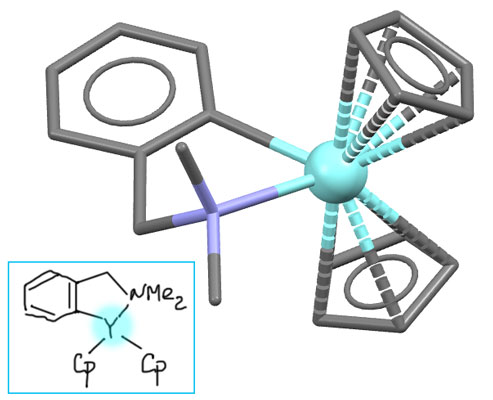
Комплекс иттрия (M.D.Rausch, D.F.Foust, R.D.Rogers, J.L.Atwood, J.Organomet.Chem. (1984), 265, 241)
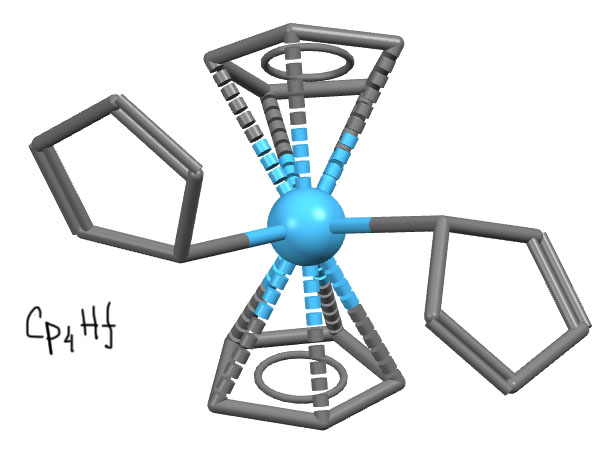
Удивительный гафноцен с четырьмя циклопентадиенилами (R.D.Rogers, R.V.Bynum, J.L.Atwood, J.Am.Chem.Soc. (1981), 103, 692)
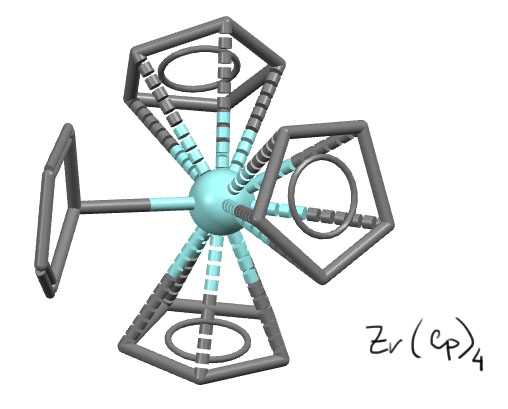
А вот ещё один цен с четырьмя Cp.
В.И.Кулишов, Н.Г.Бокий, Ю.T.Стручков, Ж.Структ.Хим. 1970, 11, 700
А может быть комплекс d-элемента с четырьмя пентагапто-Cp? Судя по этому комплексу они могут влезть, так что стерика не может быть критической причиной.
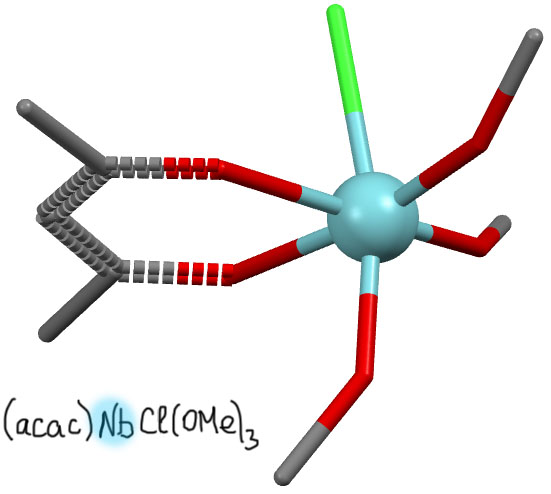
Ацетилацетонатный комплекс ниобия (L.Herbst, R.Koen, A.Roodt, H.G.Visser, Acta Crystallogr.,Sect.E:Struct.Rep.Online (2010), 66, m801)
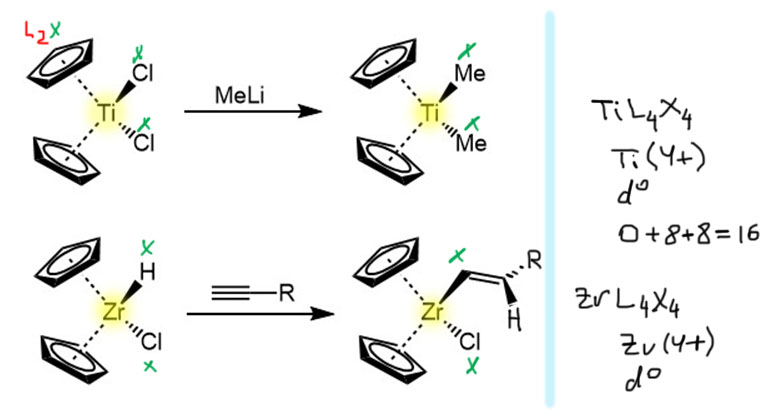
Отсюда следует минимум один вывод и минимум один вопрос. Вывод простой – как бы ни было важно и полезно 18-электронное правило, в химию ранних переходных металлов с ним лучше не соваться – не работает оно там. Но не работает и чуть было не возникшее 12-электронное, обусловленное почти бесспорным неучастием p-оболочки в химии как минимум первых двух групп переходных металлов. А как тогда там вообще возникает счет электронов больше 12? Куда эти электроны попадают при sd-оболочке?? Один из возможных ответов на этот вопрос мог бы быть таким же, как и в случае комплексов поздних переходных металлов с счетом электронов, превышающим 18 – попадают на высоколежащие свободные орбитали. Но очень непохоже, чтобы это было так. В той химии всегда очень хорошо видно эти комплексы с избыточным электронным счетом – они заметно отличаются от “нормальных”, например, потому что, например, очень легко окисляются, и вообще легко вступают в реакции, в которых электронный ссчет возвращается в норму. Они как будто знают, что лишнее прихватили, и готовы с этим расстаться почти без сожаления. Но в ранних переходных металлов все не так – те же 16-электронные комплексы металлов 4 группы очень стабильны и многочисленны, а их наиболее типичные реакции – это превращение одного лиганда в другой, того же типа, и не приводят к уменьшению счета электронов. Вот пара характерных примеров реакций таких комплексов- замещение (переметаллирование) и присоединение (гидрометаллирование):
Гипервалентность
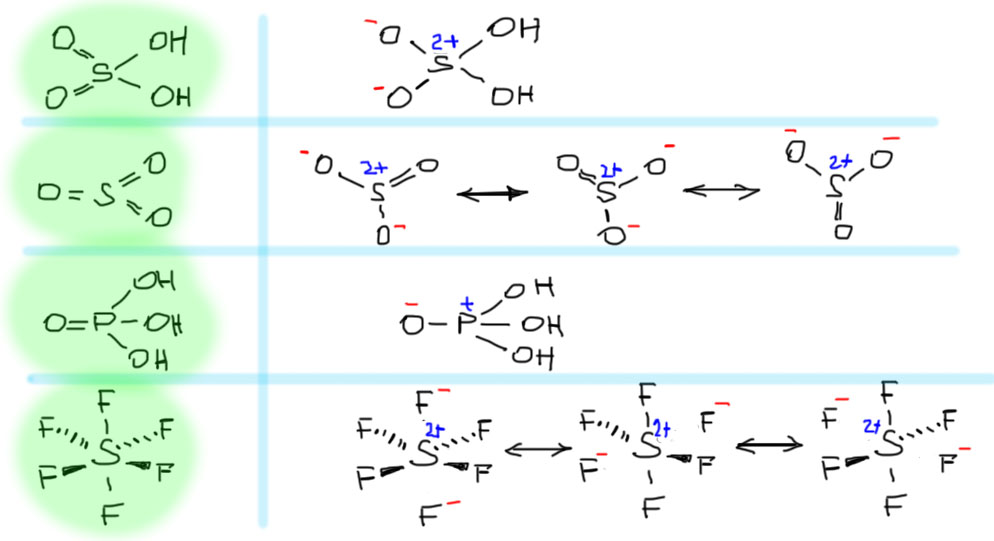
Альтернативный вариант объяснения может показаться демагогией и сущим издевательством, но именно он успешно используется для объяснения похожего явления – гипервалентности в химии непереходных элементов, где проблема, в сущности, точно такая же – как втиснуть формальный счет электронов, превышающий 8 в рамки октета, то есть предельной емкости sp-оболочки. Типичный пример – гексафторид серы: формальный счет по 6 ковалентным связям получается 12, а куда можно воткнуть такое количество электронов, на первый взгляд, непонятно, если мы категорически отказываемся от участия d-орбиталей.
Но решается эта проблема весьма просто – мы вдруг спрашиваем себя, а кто сказал, что электронные пары, отвечающие за связь, ровно поровну распределены между атомами связи – ведь если это так, то мы просто обязаны найти у серы шесть атомных орбиталей и прихватить пару ячеек в d-оболочке. А если нам совесть не позволяет таскать с потолка d-орбитали, то может быть, она нам позволит пойти на такой трюк – мы объявим только 4 связи ковалентными, а две чисто ионными. Но если бы это было и правда так, то гексафторид серы был бы SF42+F22-. Выглядит немного странно, но рецепт-то прописан простой: возьмите 6 валентных электронов серы, 4 используйте на ковалентные связи, а два оставшихся просто отберите и отдайте фтору, ему нужнее, он все же возглавляет шкалу электроотрицательностей. Это было бы здорово, если бы реальная структура гексафторида серы это подтверждала бы, показав различные атомы фтора, четыре на одном расстоянии, а два на другом, ну и всякие другие свойства бы подтверждали ионный характер этой молекулы. Но, – не показывает, не подтверждают – это совершенно симметричный октаэдр, совершенно неполярная молекула.
Попробуем удержать завоевания такой смешанной ковалентно-ионной модели – давайте представим себе, что в реальных связях сера-фтор пара находится не совсем в равном ведении обоих атомов, а сильнее принадлежит фтору. В этом месте любого нормального человека начнет просто трясти от злобы и ненависти к демагогам – да любая ковалентная связь между неравными атомами поляризована с сторону более электроотрицательного атома – в органической химии на этом индуктивный эффект основан, а то, что ковалентные связи полярны, сдают в ЕГЭ! Тогда всегда так должно быть – разница в полярности приводить к этой самой гипервалентности! Нет, не всегда, а только тогда, когда разница в электроотрицательности такова, что наведенный заряд на менее электроотрицательном атоме будет достаточен (будет набираться в сумме целый минус, или даже два или еще больше) для добавления новых анионов и изменения стехиометрии. Это, безусловно, немного упрощенная картина, потому что тогда кто мешал бы получить нечто промежуточное между 4 и 6 для той же серы, правда это был бы радикал (5 – нечетное число электронов). Ой, пока не сел писать этот текст, не знал, а такая штука есть, оказывается – радикалы только сдваиваются и получается F5S-SF5, существует такая молекула, и вполне надежно охарактеризована. Хорошо, а почему нельзя больше – семь, например. Можно, но это уже будет анион, и только в том случае, если места хватит у центрального шарика размером с серу на семь шариков вокруг размером с фтор (спойлер: не хватит, а вот у более крупных селена и теллура такие соединения есть, посмотрите сами, например, в замечательном учебнике Химия элементов). Получается, что такое простое, даже примитивноватое, какое-то школьно-егэшное объяснение гипервалентности у непереходных элементов вполне работает, и позволяет понять парадокс, как же одной sp-оболочкой создать больше 4 связей. Это просто ковалентные связи с высокой степенью ионности, очень высокой. Безусловно, в таком объяснении есть и большая проблема – мы как бы используем для каждой связи не полную пару, а какую-то долю ее, что выглядит чистейшей ересью в свете абсолютной неделимости электрона. Но это противоречие мнимое, вытекающее из представления о том, что каждое двухатомное взаимодействие (двухцентровая связь) обслуживается целой и неделимой парой электронов. Это противоречие элементарно снимается любой современной квантовой теорией структуры, хотя бы той же теорией молекулярных орбиталей – там все взаимодействия многоцентровые и пары обслуживают эти многоцентровые связывания, заселяя МО, а доля общей электронной плотности в области между двумя какими-нибудь атомами определяется суммированием всех занятых МО с помощью той или иной схемы деления пространства на атомы. Вернемся к этому ниже, а пока успокоимся – частично ионная связь не ересь, а вполне разумная вещь, спасение для правила октета, и не только. Фторы в этом случае (все шесть в гексафториде) одинаковы, и все вместе с сумме делокализуют лишний заряд.
Для этого нужны только очень электроотрицательные элементы типа фтора или кислорода. Для серы даже хлор не годится – не существует гексахлорида серы. Для менее электроотрицательного фосфора годится даже бром, но это совсем не гипервалентное соединение, а просто бромид тетрабромфосфония PBr4+Br– с нормальным октетным фосфором. И, кстати, заметим, что никто не говорит о нарушении правила октета для дианиона SiF62- , хотя это совершенно изоэлектронная и изоструктурная частица по отношению и к PF6– , и также SF6. И вообще все это вещи совершенно тривиальные и общеизвестные, но почему-то непопулярные.
Причина этой непопулярности, видимо, в том что хоть это и понятно и даже довольно убедительно, но рисовать такие структуры – мука смертная. И хорошо еще, когда гипервалентность обеспечивается кратными связями, как в хлорной, серной, фосфорной кислотах, серном ангидриде и т.п. Тогда мы поморщимся, но расставим заряды, и так можно жить, но и в этих случаях часто придется прибегать к резонансным структурам. Но в случае простых связей, как в том же гексафториде серы придется обязательно рисовать резонансные структуры с “оторванными” атомами-ионами, а это уже сильно коробит, хотя ничего страшного в этом нет – при изображении граничных структур важно только, чтобы атомы оставались на месте, а перемещались только электроны, и только парами, как советские первоклассники на перемене. Понятно, что никого заставить писать вместо привычных гипервалентных формул более правильные, октетные, невозможно, да и не нужно.
Но представлять себе, как устроена гипервалентность, желательно, и потому что на дворе 21 век, а не начало 20-го, и для того, чтобы перестать считать фосфор, серу, хлор и другие достойные непереходные элементы тайными d-элементами, да и сразу становится понятно, например, отчего серная кислота такая сильная, сильнее азотной, при том что азот гораздо электроотрицательнее серы; а серный ангидрид – такой невероятно мощный электрофил, и т.п.
Еще раз о ранних переходных металлах
Теперь вернемся к ранним переходным металлам, где у нас та же проблема – как запихать семь или восемь координационных мест в максимум 6 валентных ячеек. Да, видимо, так же – представив, что связи с лигандами имеют значительную долю ионности. Если мы привыкли к гипервалентности серьезных неметаллов (вплоть до хлора), обеспечиваемой связями с еще более электроотрицательными неметаллами, то в комплексах металлов, особенно ранних, очень электроположительных, не то что хлор, а даже и углерод покажется невероятной мощи акцептором, и ионность связей с лигандами не покажется преувеличением. На самом деле, не стоит забывать, что мы въезжаем в ранние переходные металлы со стороны s-элементов. Между скандием и кальцием, особенно в максимальной степени окисления, разницы немного. Может даже показаться, что ее вовсе нет – электронная конфигурация у ионов Ca2+ и Sc3+ одинакова, но она есть! – d-оболочка у скандия уже доступна, а у кальция нет.
А что там у кальция и его родственников с комплексами – неужели прямо один шаг делаем из s-элементов в d-элементы, и сразу пропасть, мост в другой мир… Нет никакой пропасти, но мир другой есть – Периодическая Таблица тем и хороша, что все изменения происходят постепенно, но каждый маленький шаг многое сохраняет, но что-то важное добавляет (или отнимает) – и в результате ни один элемент не повторяет другие. Можно было бы в качестве комплексов для сравнения взять что-нибудь простое, типа алкильных комплексов, которые мы во 2 группе хорошо знаем, это же, например, гриньяры. Но возьмем любопытства ради что-нибудь побольше. Вот, например, у всех элементов 2 группы есть бис-циклопентадиенильные комплексы типа ферроцена – бериллоцен, магнезоцен, кальцоцен, стронцоцен, бароцен – и структура у них просто один в один сандвичи (сендвичи? сэндвичи?), шарик между двух ломтиков, немного изделека – просто вылитый ферроцен, хотя у некоторых из них блины чуть-чуть скособочены. И как же они устроены? Официально тут доступна только s-оболочка, то есть одно единственное гнездо, а нам туда надо запихать два циклопентадиенила, то есть шесть лигандных мест, 12 электронов. Неужели нас обманули, и в элементах 2 группы уже есть доступная d-оболочка, ведь прямо соблазн какой – ровно 12 электронов можно было бы насчитать в таких металлоценах! Соблазн соблазном, но все данные, и расчеты, и даже такая простая вещь, как то, что расстояние от металла до кольца лиганда почти ровно соответствует сумме ионных радиусов металла и толщине циклопентадиенильного аниона (как это определяется – отдельный вопрос, если захотите разузнать поподробнее, посмотрите T. P. Hanusa, Organometallics, 2002, 21, 2559). Да и ведут себя эти соединения почти так же как циклопентадиенилнатрий, который уж точно никто за комплекс с координационной связью не держит, а считают просто карбанионом с противоионом. И получается, что металлоцены 2 группы построены как ионные соединения, степень ионности связи металл-лиганд можно считать 100% (при желании можно все-таки использовать s-оболочку и поддать чуток ковалентности, но это неважно). А почему форма такая – как у настоящих металлоценов, если эти блины просто к металлу притягиваются силой Кулона, и никаких, или почти никаких направленных, зависящих от формы связевых орбиталей (опять прокол – связевая орбиталь там – шарообразный s, – и формы никакой у нее нет) взаимодействий там нет? Да просто, видимо, потому что между собой два отрицательных блина отталкиваются, и это и есть та форма, при которой баланс взаимодействий притяжение-отталкивание оптимален. В любом случае, это очень широкий угол, не соответствующий никаким определенным структурным типам комплексных соединений. И теперь мы от чисто ионного металлоцена s-элемента въезжаем в переходные металлы, и берем два первых металлоцена из 3 и 4 групп. Увы, там не обойтись без дополнительных лигандов, но они принципиально ничего не меняют. Переход от 2 группы – от s-элемента к d-элементу сразу сказывается на структуре: уже скандоцен является вполне полноценным координационным соединением, и расстояние от металла до кольца существенно меньше суммы ионных размеров, тем более это характерно для производного титана. В этих комплексах счет электронов превышает возможности sd-оболочки, и достигается это, вероятно, за счет более высокой ионности связей металла с лигандами – лишняя электронная плотность живет именно на лигандах, и, скорее всего, на алкилах, а не циклопентадиенилах, так как последние уже и так отрицательно заряжены. Кстати, это неплохо подтвержадется и тем, что в таких комплесках алкилы и другие σ-связанные углеводородные лиганды имеют существенно карбанионный характер, что проявляется в их реальной химии, и мы с этим еще столкнемся, когда дойдем до реакций.
Получается замечательная картина, показывающая очень наглядно, с одной стороны, настолько сильно изменяет вступление в игру d-оболочки структуру и свойства комплексов, и как ион становится лигандом, и с другой стороны, как постепенно изменяются и свойства и природа связывания – ионность связей сохраняется, обслуживая явление, очень похожее на гипервалентность в химии непереходных элементов.
18-Электронные комплексы
Начиная с 5 группы 18-электронные комплексы становятся уже не редким исключением, а обычным явлением. Очень хорошо это видно, например, по таким классическим комплексам как гомолептические карбонилы M(CO)x. Такие комплексы есть у всех переходных металлов, начиная с 5 группы и до 10-й, то есть начиная с ванадия (наличие таких комплексов у титана спорно, но в любом случае это малоустойчивые соединения, то же можно сказать и про гомолептические карбонилы меди, существование Cu2(CO)6 было доказано, но в специальных условиях). В комплексах этого типа металл находится в степени окисления 0, а связь с лигандом осуществляется за счет координационной связи углерод-металл. В дальнейшем мы внесем в эту простую картину некоторые важные изменения, но сейчас ее вполне достаточно. Карбонилы металлов из нечетных групп в нульвалентном состоянии имеют нечетное число d-электронов, и поэтому вынуждены существовать в виде димеров, в которых неспаренный электрон от каждого из атомов металла образует ковалентную связь металл-металл. Единственным исключением является карбонил ванадия, сохраняющий конфигурацию с 17 электронами, но его неспособность образовать димер связывают просто с тем, что 6 лигандов CO занимают все координационные места в лигандной оболочки, и на сдваивание просто не остается места в координационной сфере. Карбонилы металлов четных групп мономерны. Все карбонилы, кроме карбонила ванадия имеют 18-электронную конфигурацию.
V(CO)6 Cr(CO)6 Mn2(CO)10 Fe(CO)5 Co2(CO)8 Ni(CO)4
Очень похожую тенденцию можно увидеть и на других типах комплексов. И хотя у каждого металла есть своя специфика, иногда очень яркая как, например, у марганца в степени окисления 2+, но в целом можно сказать, что мы попадаем в область, где 18-электронное правило, как нынче принято говорит, рулит.
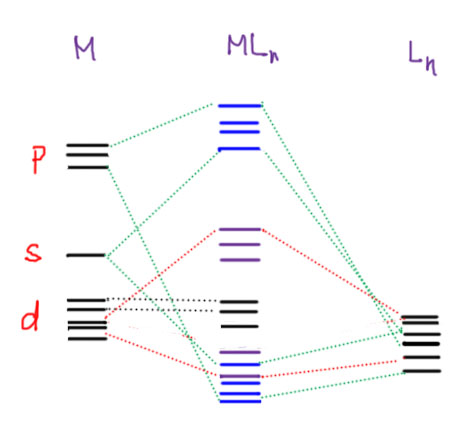
Означает ли это, что p-оболочка опустилась уже достаточно, чтобы полноценно участвовать в связывании с металлом, валентная оболочка которого становится dsp-типа c 5+1+3=9 атомными орбиталями? И да, и нет. Если заинтересоваться данными квантовохимических расчетов электронной структуры комплексов, которые вполне недвусмысленно дают вклады каждой из атомных орбиталей в молекулярных орбиталях, отвечающих за образование связей в комплексах, то мы увидим за редчайшими исключениями совершенно ничтожный вклад p-орбиталей металла. Высоковато они все же лежат. Но это, оказывается, не проблема. Молекулярные орбитали комплекса образуются за счет взаимодействия атомных орбиталей металла и молекулярных орбиталей лигандов. При этом, в самой простой картине, а мы только об ней сейчас и говорим, каждый лиганд дает для этого столько своих МО, сколько у него есть формально двухэлектронных центров связывания – то есть в полном соответствии с своей X/L-маркировкой, точно так же, как мы считаем электроны для 18-электронного правила. Скажем, хлор (X-лиганд) дает одну МО, CO или фосфин (L-лиганды) – тоже одну, а циклопентадиенил или бензол – три. Насколько эта картина верна? Ответ однозначный – нет, она неверна, реальная картина сложнее, но именно эта картина лежит в основе обоснования 18-электронного правила. Она так же условна, как и это правило. И как и любое научное понятие, она работает, пока мы понимаем границы этой условности. В теории химической структуры полно таких условных понятий – это и гибридизация, и порядок связи, и сама химическая связь, и ковалентность, и степень окисления, и сами молекулярные орбитали, и т.д. и т.п. – все это ужасно грубо и примитивно, и полностью растворяется, если мы начинаем анализировать структуру с помощью наиболее совершенных методов расчета, которые непосредственно дают не эти абстракции, а физические свойства молекулы. Увы, эти совершенные методы расчета не только до сих пор не совсем, а чаще даже совсем не – доступны, но и обращаться с ними крайне неудобно. Поэтому, и до сих пор, и, видимо, еще довольно долго мы будем анализировать структуру с помощью всех этих гибридизаций, связей и орбиталей.
18-электронные комплексы не могут образоваться без участия p-орбиталей металла
Итак, договорились, что металл предоставляет 9 атомных орбиталей, а лиганды соответствующее количество своих МО, причем это количество точно совпадает со вкладом лиганда в формулу подсчета электронов – мы же договорились, что лиганд дает по одной МО на каждое X/L-место. А металл дает 9 атомных орбиталей, которые некоторым образом распределяются по энергии, все d- и, видимо, s-орбиталь пониже, а p-орбитали повыше, d зависимости от положения металла в периоде. Распределение по энергии d-орбиталей металла в каждом типе комплекса разное, и вы наверняка это когда-то изучали хотя бы мельком – как расщепляются d-орбитали металла в теории кристаллического поля или теории поля лигандов в типичных координационных окружениях – октаэдрическом, тетраэдрическом, квадратном. В очень умных учебниках, книгах и обзорах можно найти типичные диаграммы МО комплексов для типичных высокосимметричных структур, доказывающие справедливость 18-электронного правила для таких структур. Возникает сразу вопрос – а такие диаграммы нужно нарисовать вообще для любых случаев? Поспешу успокоить – нам это даром не нужно. Просто совершенно бесполезная информация. Если хотите, освежите картинки расщепления d-орбиталей по любому учебнику, и найдите диаграммы МО для таких типичных случаев. И отложите для какого-нибудь другого курса, например, такого, где серьезно изучают именно структуру координационных и металлоорганических соединений. Нам же она бесполезна хотя бы потому, что в той химии, которую мы собрались изучать, очень часто (почти всегда) встречаются совершенно несимметричные комплексы, у которых все лиганды не только разные, но и расположены еще очень криво и косо, совсем не похоже на эти идеальные тетраэдры-октаэдры-квадраты. А 18-электронное правило все равно работает чаще, чем не работает, совершенно без какой-либо видимой связи с тем, симметрично лигандное окружение или нет, можем мы нарисовать красивую диаграмму или нет. Можно привести такую странную аналогию из обычной органической химии: ароматичность определяется на основании очень формального правила Хюккеля, выведенного для идеализированных высокосимметричных плоских циклических молекул, но признаки ароматичности в реальности находят у молекул, чрезвычайно далеких от этой идеальной модели – и несимметричных, и неплоских. Каким образом, кто и когда приспособил правило Хюккеля для таких разных случаев, неизвестно, но оно, видимо, неплохо работает несмотря на полное отсутствие адекватного обоснования.
Ярким подтверждением того, что в образовании связей участвует вся dsp-оболочка металла, можно считать комплексы с координационным числом 9. 
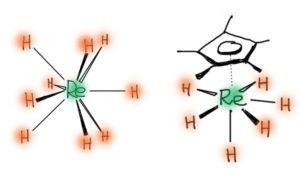
И каким же образом высоколежащие и пустые p-орбитали умудряются участвовать в связывании?
И тогда мы снова возвращаемся к этому вопросу – участвуют ли p-орбитали металла в связывании, или нет. Наличие комплексов с координационным числом от 7 до 9 требует такого участия, а многочисленные расчеты электронной структуры комплексов самых разных переходных металлов вроде бы говорят обратное – вклады p-АО металла в МО комплексов незначительные или никакие. Как это примирить? На самом деле, довольно просто, потому что все правильно. Молекулярные орбитали образуются из орбиталей фрагментов, причем можно не опускаться до уровня, когда молекула строится из составляющих атомов, а получить неплохое приближение, взяв АО металла и уже готовые молекулярные орбитали лигандов (это именно приближение, а точнее, очередной уровень приближения, ведь вся теория электронной структуры в любом варианте уже является приближением – но в химии привычно строит модели из различных уровней приближений, вставленных друг в друга матрешками). Спросим себя, когда исходные орбитали взаимодействуют. Ответ – когда они хотя бы не очень сильно различаются по энергии (а это равнозначно утверждению, что они относятся к валентным оболочкам), и при этом соответствуют друг другу по симметрии. Второе требование кажется немного заумным, но это тоже очень просто – они должны перекрываться так, чтобы в сумме не получался ноль, например, если мы подкатим одноцветный шарик s-орбитали к двухцветной восьмерке p-орбитали сбоку, то получим ноль, а если со стороны одного из лепестков – то не ноль. Понятно, что для более сложно устроенных орбиталей это представить не так просто, и даже возможно пришлось бы заняться законами симметрии, но нам это сейчас до лампочки. Нам нужно принцип понять всего-навсего, не углубляясь слишком сильно в электронную структуру комплексов.
Итак, представим себе, что орбитали подходят по симметрии, а значит взаимодействуют. Можно увидеть два таких крайних случая взаимодействия. Нарисуем их условными диаграммами: орбиталь металла и орбиталь лиганда взаимодействуют, образовав две МО комплекса, и всегда будет так: нижняя МО ниже нижнего из фрагментов, верхняя выше высшего. Обратим внимание, что орбитали лигандов почти всегда ниже орбиталей металла, хотя бы потому, что лиганд – это нечто, сделанное из атомов неметаллов, атомов с большой и очень большой электроотрицательностью, а это фактически синоним понятия “ниже по энергии”. Левая картинка показывает случай, когда орбитали взаимодействуют, но разница в энергии очень большая. Тогда результирующие МО будут не очень сильно отличаться от орбиталей фрагментов, нижняя будет почти неотличима от орбитали лиганда, а высшая – от орбитали металла. Электроны остаются в собственности лиганда. Это не что иное, как ионная связь – электроны (минус) на лиганде, дыра (плюс) на металле. Или, поскольку мы не отрицаем некоторого взаимодействия, хотя бы в общем случае, и некоторой примеси орбитали металла в нижней МО, то назовем это координационной связью с (очень) высокой долей ионности. Весь или почти весь вклад p-орбитали металла в таком взаимодействии идет в пустую разрыхляющую (в современной литературе предпочитают термин антисвязывающая, потому что большинство таких орбиталей никогда даже не нюхают реальных электронов и ничего не разрыхляют) орбиталь, а следовательно, никому нет дела до этих орбиталей. Получается немного парадоксальная картина – p-орбитали металла участвуют в связывании тем, что в нем не участвуют, а точнее, участвуют опосредованно через вовлечение орбиталей лиганда. Правая картинка показывает случай, когда взаимодействующие орбитали металла и лиганда гораздо ближе по энергии друг к другу. Тогда их взаимодействие сильно, результирующие МО содержат серьезные вклады обеих, и мы, заселив нижнюю из образовавшейся пары, получаем электронную плотность на системе металл-лиганд – а это именно то, что обслуживает координационную или ковалентную связь металла и лиганда в комплексе. Левая картинка ближе соответствует участию p-орбиталей металла, а правая – d-орбиталей. S-орбитали обычно находятся где-то посредине, и обслуживают и ионный, и ковалентный вклады в связывание.
Попробуем теперь представить, как выглядит картинка орбиталей комплекса. Очень условная картинка с самом общем случае. Нас не интересуют ни расщепления d-уровней в поле лигандов, ни симметрия комплекса – все те вещи, которые очень подробно рассматриваются почти в любом учебнике. Нас интересуют только самые общие вещи. Слева – валентная оболочка металла в обычном порядке – d, потом s с большим или меньшим зазором, в зависимости от реального положения металла в ряду, чем ближе к концу, тем ближе к d-уровням; и на самой верхотуре p. Эта оболочка имеет некоторое количество электронов в зависимости от металла и его степени окисления (примем для определенности ионную модель комплекса, но вообще это не важно, так как мы все равно возьмем все наличные электроны и заселим ими орбитали комплекса), которые заполняют частично или полностью d-уровни. Справа – пакет лигандов, показаны совершенно условно просто n орбиталей соответствующих n лигандов, подходящих для связывания.
И эта чрезвычайно условная картинка приведена только с одной целью – показать три существенных составляющих электронной структуры комплексов переходных металлов.
- взаимодействие высоколежащих орбиталей металла (в основном p, но возможно и s) с орбиталями лигандов, подобно тому как это показано на предыдущей картинке слева, дает орбитали комплекса в основном расположенные на лигандах, и этот компонент отвечает за ионный характер связей металла с лигандами;
- взаимодействие подходящих по симметрии (точнее, по расположению долей относительно расположения орбиталей лигандов) d-орбиталей металла с орбиталями лиганда дает соответствующее число орбиталей комплекса, отвечающих за ковалентное связывание лиганда с металлом;
- неиспользованный остаток d-орбиталей, не подходящих по симметрии (по расположению долей) для взаимодействия с орбиталями лигандов, остается без изменения (это только относительно верно – энергия этих орбиталей в новом окружении неизбежно изменится, но на условной картинке они условно показаны черным цветом и без изменения положения) – это несвязывающие орбитали; если на этих орбиталях есть электроны, то им может найтись ценное применение в дополнительном связывании по механизму back-donation; и даже если эти орбитали не заполнены, то им все равно может найтись применение в дополнительном связывании с лигандом – но ни первое, ни второе все равно не учитываются в счете электронов.
Попутно мы видим и то, почему так часто работает 18-электронное правило. В образовании орбиталей комплекса участвуют все 9 атомных орбиталей металла и орбитали лигандов по их числу в комплексе – в результате будет 9+n орбиталей комплекса, Поскольку все орбитали лигандов по определению участвуют в связывании, то из этого набора n штук почти наверняка окажутся антисвязывающими, а остальные 9 (девять) либо связывающими, либо несвязывающими, и их полное заполнение и даст нам 18-электронную, и при этом стабильную конфигурацию, потому что электроны в ней не попадают на антисвязывающие орбитали.
В n-ный раз подчеркну – это очень упрощенное и даже профанированное описание того, как устроены комплексы переходных металлов, но и само 18-электронное правило тоже не вершина теории, а просто удобное и очень полезное обобщение. Если вам станет интересно, как действительно устроены комплексы переходных металлов, займитесь этой темой серьезно – это очень интересно, но это другая тема.
14- и 16-электронные комплексы поздних переходных металлов: исключение, подтверждающее правило
Ничто так не подтверждает правило или закон, как исключения из него. Как только появляется объект, который не вписывается в правило, мы пытаемся понять почему, и в этом процессе начинаем лучше понимать, как работает правило.
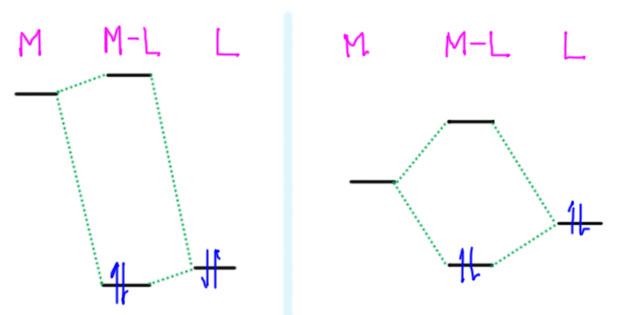
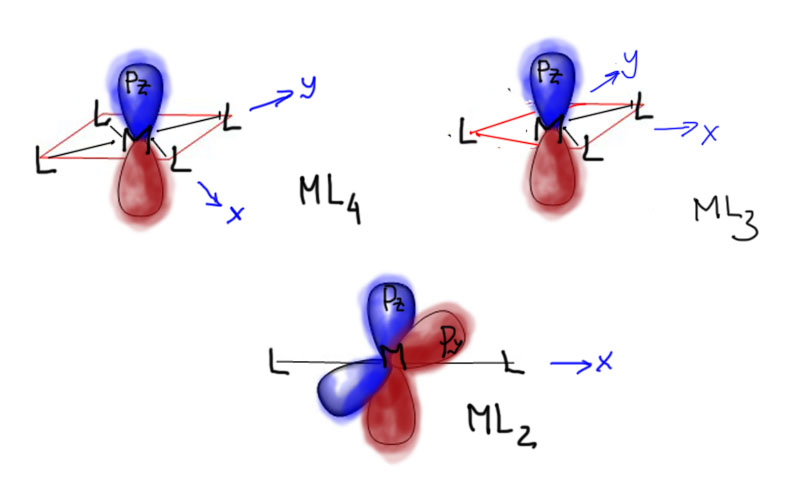
Но можно и так к этому подойти – вышесказанное выглядит просто, но довольно убедительно, и почему тогда все же есть много комплексов, не удовлетворяющих 18-электронному правилу. Мы не имеем в виду ранние переходные металлы, с которыми мы уже разбирались, и рассмотрели гипотезу о 12-электронной конфигурации и гипервалентности. Но нарушения правила очень распространены и с другой стороны таблицы – в 9, 10 и 11 группах. В 9 и особенно 10 группе есть очень большая группа очень стабильных 16-электронных комплексов с конфигурацией d8 и координационным окружением в виде плоского квадрата. У одного палладия таких комплексов с подтвержденной структурой многие тысячи. Это именно стандартный структурный тип, а не какое-то отклонение. А в 11 группе очень популярны 14-электронные комплексы с конфигурацией d10 и линейной координацией (координационным числом 2), а также плоские треугольные комплексы с той же конфигурацией d10 и координационным числом 3. И все эти комплексы очень важны именно для той науки, которой мы и решили заняться – среди них множество важнейших пред-катализаторов. Что с ними не так? Все так, и это просто такие конфигурации-исключения. Объяснить это можно разными способами, но один, самый, на мой взгляд, наглядный, состоит в том, чтобы просто посмотреть на p-орбитали.
Действительно, в плоском квадрате одна из p-орбиталей металла, перпендикулярная к плоскости комплекса, явно не при делах – нет на нее лиганда. А мы же помним, что высоколежащие p-орбитали оказываются включенными в связывающие взаимодействия только за счет взаимодействия с лигандами, и в этом случае эта перпендикулярная орбиталь (обычно ее обозначают pz) просто остается на месте и переходит в комплекс как несвязывающая, но пустая, и дела до нее никому нет. Получается, что в плоском квадрате валентная оболочка металла это 5d + 1s + 2p, итого 8 мест, и 16-электронный счет. Как только конфигурация меняется на неплоскую, например, тетраэдрическую, то в дело идут все три p-орбитали, и счет переходит в 18-электронный. Это очень наглядная и яркая демонстрация – элемент один, координационное число то же самое, и даже лиганды часто бывают такими же или одного типа, но в плоском комплексе счет электронов 16, а в неплоском (тетраэдрическом) – 18. Вот например, пара таких – комплексы палладия с дифосфиновым лигандом цис-бис(дифенилфосфино)этеном совершенно одинакового состава (если опустить противоион в комплексе Pd(2+)), но левый – 18-электронный комплекс нульвалентного палладия, а справа плоскоквадратный 16-электронный комплекс Pd(2+).
Slide 1
Структуры по данным рентгеноструктурного анализа (Polyhedron 1997, 16, 2827). Для простоты все лишнее, водороды и противоионы, опущены.
У металлов 11 группы, меди, и особенно серебра и золота, это даже еще более демонстративно. Они образуют три ряда комплексов – обычные 18-электронные, тетраэдрические (не обязательно настоящий правильный тетраэдр, но все разновидности тригональных пирамид), с координационным числом 4, плоские треугольные 16-электронные , и линейные 14-электронные . Приведенная выше картинка показывает, почему это может быть именно так. В линейной конфигурации не одна, а две p-орбитали металла не участвуют в деле, и металл в этом случае предоставляет всего семь атомных орбиталей: 5d + 1s + 1p. А треугольная плоская форма выводит из оборота одну p-орбиталь, точно так же как в плоской квадратной форме в комплексах металлов 9 и 10 групп, и результат тот же. В отличие от этих последних в 11 группе конкретный вид комплекса определяется не степенью окисления металла, а структурой лигандов, в частности их стерическим объемом, но не только. Игра на этих структурных типах оказалась очень плодотворным занятием для подбора катализаторов из комплексов этой группы – и когда в этом стали получше разбираться, а произошло это весьма недавно, то это привело к бурному развитию каталитической химии этих металлов. Вот три типичных примера таких комплексов. Обратите внимание, что последний из этих комплексов, тетракис(трифенилфосфиновый) комплекс серебра [Ag(PPh3)4]+,как две капли воды похож на известный всем комплекс палладия [Pd(PPh3)4], что совершенно неудивительно, потому что эти комплексы действительно мало чем отличаются – Ag(+1) и Pd(0) изоэлектронны.