Download Article
Download Article
All basic elements are made up of electrons, protons, and neutrons. An electron is a negatively charged particle that makes up part of an atom. A fundamental concept in chemistry is the ability to determine how many electrons an atom contains. By using a periodic table of elements, this can easily be determined. Other important concepts involve how to find the number of neutrons and valence electrons (number of electrons in its outermost shell) in an element.
-
1
Obtain a periodic table of elements. This is a color-coded table that organizes all the known elements by atomic structure. Each element has a 1, 2, or 3-letter abbreviation and is listed along with its atomic weight and atomic number.[1]
- Periodic tables can easily be found in chemistry books as well as online.
-
2
Find the element in question on the periodic table. The elements are ordered by atomic number and separated into three main groups: metals, non-metals, and metalloids (semi-metals). They are further grouped into families including alkali metals, halogens, and noble gases.[2]
Every column of the table is called a group and every row is called a period.- If you know the details of your element, such as what group or period it is in, it will be easier to locate.
- If you don’t know anything about the element in question, just search the table for its symbol until you find it.
Advertisement
-
3
Find the atomic number of an element. The atomic number appears in the upper left-hand corner or centrally above the element symbol in the square. The atomic number defines the number of protons present in that particular element.[3]
Protons are the particles in an element that provide a positive charge. Because electrons are negatively charged, when an element is in its neutral state, it will have the same number of protons as electrons.- For instance, boron (B) has an atomic number of 5, meaning that it has 5 protons and 5 electrons.
Advertisement
-
1
Identify the charge of the ion. Adding and removing electrons from an atom does not change its identity, but it changes its charge. In these cases, you now have an ion, such as K+, Ca2+, or N3-. Usually, the charge is expressed in a superscript to the right of the atom abbreviation.
- Because an electron has a negative charge, when you add extra electrons, the ion becomes more negative.
- When you remove electrons, the ion becomes more positive.
- For example, N3- has a -3 charge while Ca2+ has a +2 charge.
-
2
Subtract the charge from the atomic number if the ion is positive. If the charge is positive, the ion has lost electrons. To determine how many electrons are left, subtract the amount of charge from the atomic number. In this case, there are more protons than electrons.
- For example, Ca2+ has a +2 charge, therefore, it has 2 fewer electrons than a neutral calcium atom. Calcium’s atomic number is 20, therefore this ion has 18 electrons.
-
3
Add the charge to the atomic number if the charge is negative. If the charge is negative, the ion has gained electrons. To determine how many total electrons there are, add the amount of charge to the atomic number. In this case, there are fewer protons than electrons.
- For example, N3- has a -3 charge which means it has 3 more electrons than a neutral nitrogen atom. Nitrogen’s atomic number is 7, therefore this ion has 10 electrons.
Advertisement
Add New Question
-
Question
What if the charge has no number?
If the charge has no number (is 0), then the number of electrons is the same as the number of protons.
-
Question
How do I calculate the number of electrons by looking at a periodic table?
It is the atomic number. However, if it has positive ion, then this electron number will go down (ie +2 charge means two electrons have been lost, so the electron/atomic number will go down by two) and vice versa.
-
Question
How do I figure out the number of valence electrons?
Valence electrons are the electrons contained in the outermost shell. If you look at the periodic table and at the period numbers, that is the number of valence electrons. If the number is larger than 10, subtract 10 so you get two valence electrons. Example: Oxygen is in the 16th period. If we subtract 10 from 16, we get 6; therefore, oxygen has six valence electrons.
See more answers
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
Video
References
About This Article
Article SummaryX
To find the number of electrons an atom has, start by looking up the element you’re working with on the periodic table and locating its atomic number, which will be in the upper left-hand corner of the square. Then, identify the charge of the ion, which will be written as a superscript to the right of the element. Finally, subtract the charge from the atomic number if the ion is positive or add the charge to the atomic number if the ion is negative. To learn how to read and use a periodic table, keep reading!
Did this summary help you?
Thanks to all authors for creating a page that has been read 365,035 times.
Reader Success Stories
-
Jeff Rodniklaem
Apr 18, 2016
«The article really informed me about finding the electrons as my school teacher struggled to help me a bit. I am…» more
Did this article help you?
Загрузить PDF
Загрузить PDF
Протоны, нейтроны и электроны – основные частицы, из которых состоит атом. Протоны заряжены положительно, электроны – отрицательно, а нейтроны и вовсе не имеют заряда.[1]
Масса электронов очень мала, а масса протонов и нейтронов практически одинакова.[2]
На самом деле, найти в атоме количество протонов, нейтронов и электронов довольно просто, нужно только научиться ориентироваться по периодической таблице химических элементов Д.И.Менделеева.
-
1
Возьмите периодическую таблицу элементов. Это система, в которой элементы организованы в зависимости от их атомной структуры. Цветное одно- или двухбуквенное сокращение – это название элемента в сокращенном виде. В таблице также представлена информация об атомном номере элемента и атомной массе.[3]
- Таблицу Менделеева можно найти в учебнике по химии или в Интернете.
- Во время контрольных работ периодическую таблицу обычно предоставляют.
-
2
Найдите в таблице нужный вам элемент. Каждый элемент в таблице располагается под своим номером. Все элементы можно разделить на металлы, неметаллы и метоллоиды (полуметаллы). В этих группах элементы классифицируются еще на несколько групп: щелочные металлы, галогены, инертные газы.[4]
- Группы (столбцы) и периоды (строки) нужны для систематизации, по ним легко найти нужный вам элемент.
- Если вы ничего не знаете о нужном вам элементе, просто найдите его в таблице.
-
3
Найдите атомный номер элемента. Атомный номер обозначает число протонов в ядре атома.[5]
Атомный номер располагается над символом элемента, обычно в левом верхнем углу клетки. Он покажет вам, сколько протонов содержится в одном атоме элемента.- Например, Бор (В) обозначен в таблице под номером 5, поэтому у него 5 протонов.
-
4
Определите количество электронов. Протоны — это положительно заряженные частицы в ядре атома. Электроны представляют собой частицы, которые несут отрицательный заряд. Поэтому когда элемент находится в нейтральном состоянии, то есть его заряд будет равен нулю, число протонов и электронов будет равным.
- Например, Бор (В) обозначен в таблице под номером 5, поэтому можно смело утверждать, что у него 5 электронов и 5 протонов.
- Однако если элемент содержит отрицательный или положительный ион, то протоны и электроны не будут одинаковыми. Вам придется вычислить их. Число ионов выглядит как маленький, верхний индекс после элемента.
-
5
Найдите атомную массу элемента. Чтобы найти число нейтронов, вам сначала нужно вычислить атомную массу элемента. Атомная масса – это средняя масса атомов данного элемента, ее нужно рассчитывать. Имейте в виду, что у изотопов атомная масса отличается.[6]
. Атомная масса указана под символом элемента.- Округляйте атомную массу до ближайшего целого числа. Например, атомная масса бора = 10,811, соответственно, ее можно округлить до 11.
-
6
Вычтите из атомной массы атомный номер. Чтобы определить количество нейтронов, нужно вычесть атомный номер из атомной массы. Помните, что атомный номер — это число протонов, которое вы уже определили.[7]
- Возьмем наш пример с бором: 11 (атомная масса) – 5 (атомный номер) = 6 нейтронов.
Реклама
-
1
Определите число ионов. Ион — это атом, состоящий из положительно заряженного ядра, в котором находятся протоны и нейтроны, и отрицательно заряженных электронов. Атом несет нейтральный заряд, но заряд может быть положительным и отрицательным из-за электронов, которые атом может отдавать и принимать.[8]
Поэтому число протонов в атоме не меняется, а число электронов в ионе может меняться.- Электрон несет отрицательный заряд, поэтому если атом отдает электроны, то сам становится заряженным положительно. Когда атом принимает электроны, он становится отрицательно заряженным ионом.
- Например, у N3- заряд -3, а у Ca2+ заряд +2.
- Помните, если число ионов не указано в таблице, вам не нужно делать подобные вычисления.
-
2
Вычтите заряд из атомного номера. Если ион положительно заряжен, нужно вычесть из атомного номера заряд. Если у иона положительный заряд, значит, он отдал электроны. Чтобы подсчитать оставшееся число электронов, нужно вычесть заряд от атомного номера. Если ион заряжен положительно, значит, в нем больше протонов, чем электронов.
- Например, у Ca2+ заряд +2, поэтому можно сказать, что он отдал два электрона. Атомный номер кальция = 20, поэтому у его иона 18 электронов (20-2=18).
-
3
Если ион заряжен отрицательно, чтобы узнать число электронов, нужно добавить заряд к атомному номеру. Потому что ион стал отрицательным из-за того, что принял лишние электроны. Так что нужно просто прибавить заряд к атомному номеру, тогда вы получите число электронов. Разумеется, если ион заряжен отрицательно, то электронов в нем больше, чем протонов.
- Например, у N3- заряд -3, значит, азот получил три дополнительных электрона. Атомный номер азота 7, поэтому число электронов у азота = 10. (то есть 7+3=10).
Реклама
Об этой статье
Эту страницу просматривали 955 472 раза.
Была ли эта статья полезной?
Возьмём два одинаковых электрометра и один из них зарядим (рис. а). Его заряд соответствует (6) делениям шкалы.
Рис. (1). Электрометры
Если соединить эти электрометры стеклянной палочкой, то никаких изменений не произойдёт. Это подтверждает тот факт, что стекло является диэлектриком. Если же для соединения электрометров использовать металлический стержень А (рис. б), держа его за не проводящую электричество ручку В, то можно заметить, что первоначальный заряд разделится на две равные части: половина заряда перейдёт с первого шара на второй. Теперь заряд каждого электрометра соответствует (3) делениям шкалы. Продолжим опыт. Разъединим электрометры и коснёмся второго шара рукой. От этого он потеряет заряд — разрядится. Соединим его снова с первым шаром, на котором осталась половина первоначального заряда. Оставшийся заряд снова разделится на две равные части, и на первом шаре останется четвёртая часть первоначального заряда. Таким же образом можно получить одну восьмую часть, одну шестнадцатую часть первоначального заряда и т.д.
Возникает вопрос, до каких пор можно уменьшать заряд? Существует ли предел деления электрического заряда? Чтобы выяснить это, понадобилось выполнить более сложные и точные опыты, чем описанный выше, так как очень скоро оставшийся на шаре заряд оказывается столь малым, что обнаружить его при помощи школьного электрометра не удаётся. Более точные опыты показали, что электрический заряд нельзя уменьшать бесконечно: он имеет предел делимости.
Электрический заряд — это физическая величина, которую обозначают буквой (q).
За единицу электрического заряда принят кулон (Кл). Частицу, имеющую самый маленький заряд, назвали электроном. Этот заряд нельзя «снять» с электрона. Заряд электрона обозначают буквой е. Заряд электрона является отрицательным. (e = -0,00000000000000000016) Кл = (-)
1,6
·10
−19
()Кл. Этот заряд в миллиарды раз меньше того, что обычно получают в опытах по электризации тел трением.
Чтобы узнать заряд тела, необходимо заряд электрона умножить на количество зарядов n:
q=e
·n
.
Электрон — очень маленькая частица. Его масса (m =)9,1
·10
−31 кг. Крылышко мухи имеет массу примерно в (5·10²²) большую, чем масса электрона.
Если тело не заряжено и при электризации оно приобрело электроны, то оно зарядится отрицательно. Его заряд будет равен сумме зарядов полученных электронов.
Обрати внимание!
Если тело заряжено отрицательно и при электризации оно ещё приобретает электроны, то отрицательный заряд тела возрастает.
Пример:
Например, до электризации тело с зарядом (2е) в ходе электризации приобретает ещё (4) заряда электрона. Тогда после электризации заряд тела равен (2е + 4е = 6е).
Обрати внимание!
Если тело заряжено отрицательно и при электризации оно теряет электроны, то отрицательный заряд тела уменьшается.
Например, до электризации тело с зарядом (8е) в ходе электризации теряет (3) заряда электрона. Тогда после электризации заряд тела равен (8е — 3е = 5е).
Все вещества состоят из атомов.
Обрати внимание!
Атом состоит из ядра, а вокруг него движутся электроны.
Модель атома можно представить себе следующим образом:
Рис. (2). Модель атома
Обрати внимание!
Ядро тоже имеет свой состав: протоны и нейтроны.
Информация об этих частицах дана в таблице.
|
Частицы |
Обозначение |
Заряд |
Заряд, |
Масса, |
|
Протон |
p |
+1 |
1,6 |
1,7 |
|
Нейтрон |
n |
0 |
(0) |
1,7 |
|
Электрон |
e |
-1 |
(-1,6·10^{-19}) |
9,1 |
Рис. (3). Состав атома
Обрати внимание!
Атом не имеет заряда, т.к. количество электронов в атоме равно количеству протонов.
Количество нейтронов в атомах может быть отлично от количества протонов и электронов.
Атом, потерявший один или несколько электронов, не будет нейтральным, а будет иметь заряд «+». Его называют положительным ионом.
Атом, потерявший один или несколько электронов, называют положительным ионом.
Атом, к которому присоединился электрон, приобретает заряд «-» и становится отрицательным ионом.
Атом, к которому присоединился один или несколько электронов, называется отрицательным ионом.
|
Нейтральный атом |
Отрицательный ион |
Положительный ион |
|
|
|
|
|
Рис. (4). Число протонов и электронов одинаково |
Рис. (5). Число электронов больше числа протонов |
Рис. (6). Число электронов меньше числа протонов |
Узнать, сколько тех или иных частиц содержит нейтральный атом, поможет периодическая система химических элементов (таблица Менделеева). Любой элемент в таблице имеет порядковый номер и относительную атомную массу.
Рис. (7). Обозначение элемента в периодической таблице
Обрати внимание!
Количество протонов, а также электронов в нейтральном атоме всегда совпадает с порядковым номером.
Количество нейтронов равно разности относительной атомной массы (выраженной целым числом) и порядкового номера.
Например:
|
Элемент |
Порядковый номер |
Относительная атомная масса |
Число протонов |
Число электронов |
Число нейтронов |
|
Медь |
29 |
63,546 |
29 |
29 |
64 — 29=35 |
Зная строение атома, можно объяснить электризацию тел.
Обрати внимание!
При трении двух тел электроны переходят с одного тела (где силы притяжения к ядру меньше) на другое (в котором эти силы больше).
Зная строение атома, можно объяснить существование проводников и диэлектриков.
Проводник — это тело, внутри которого содержится достаточное количество свободных электрических зарядов.
Так, в металлах это — электроны, в растворах солей, кислот, щелочей — положительные и отрицательные ионы. Например, когда прикасаются металлической проволокой к отрицательно заряженному электрометру, свободные электроны передвигаются по проволоке, а электрометр разряжается.
Изолятор (или диэлектрик) — тело, не содержащее внутри свободные электрические заряды.
Поэтому прикосновение деревянной линейки к заряженному электрометру не вызывает никаких изменений.
Зная строение атома, можно объяснить явление притяжения ненаэлектризованных тел к наэлектризованным.
Рис. (8). Воздействие положительно заряженной палочки на гильзу
В металлической гильзе есть свободные электроны. Под действием электрического поля палочки они приходят в движение, так как начинают притягиваться к ней. В результате происходит перераспределение заряда. Электроны скапливаются на стороне, которая ближе к палочке, и она заряжается отрицательно. На противоположной стороне недостаток электронов, поэтому она заряжается положительно. Но в целом заряд гильзы равен нулю (в соответствии с законом сохранения заряда).
Рис. (9). Распределение заряда при воздействии на нейтральную гильзу положительно заряженной палочки
Если палочка будет заряжена отрицательно, то свободные электроны будут отталкиваться от неё и перемещаться в противоположную сторону.
Рис. (10). Распределение заряда при воздействии на нейтральную гильзу отрицательно заряженной палочки
По такому же принципу происходит отклонение листочков незаряженного электроскопа при поднесении к нему (не касаясь) заряженной палочки.
Рис. (11). Распределение заряда на электроскопе
Электрическое поле палочки вызывает перераспределение зарядов в металлическом стержне электроскопа. В верхней части будет избыток электронов, а в нижней — недостаток. Поэтому оба листочка зарядятся положительно и оттолкнутся друг от друга.
Источники:
Рис. 1. Электрометры. © ЯКласс.
Рис. 2. Модель атома. © ЯКласс.
Рис. 3. Состав атома. © ЯКласс.
Рис. 4. Число протонов и электронов одинаково. © ЯКласс.
Рис. 5. Число электронов больше числа протонов. © ЯКласс.
Рис. 6. Число электронов меньше числа протонов. © ЯКласс.
Рис. 7. Обозначение элемента в периодической таблице. © ЯКласс.
Рис. 8. Воздействие положительно заряженной палочки на гильзу. © ЯКласс.
Рис. 9. Распределение заряда при воздействии на нейтральную гильзу положительно заряженной палочки. © ЯКласс.
Рис. 10. Распределение заряда при воздействии на нейтральную гильзу отрицательно заряженной палочки. © ЯКласс.
Рис. 11. Распределение заряда на электроскопе. © ЯКласс.
Как определить количество электронов
Атом химического элемента состоит из ядра и электронов. Количество электронов в атоме зависит от его атомного номера. Электронная конфигурация определяет распределение электрона по оболочкам и подоболочкам.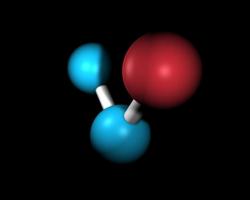
Если атом электронейтрален, то число электронов в нем равно числу протонов. Число протонов соответствует атомному номеру элемента в таблице Менделеева. Например, водород имеет первый атомный номер, поэтому его атом имеет один электрон. Атомный номер натрия — 11, поэтому атом натрия имеет 11 электронов.
Атом также может терять или присоединять электроны. В этом случае атом становится ионом, имеющим электрический положительный или отрицательный заряд. Допустим, один из электронов натрия покинул электронную оболочку атома. Тогда атом натрия станет положительно заряженным ионом, имеющим заряд +1 и 10 электронов на своей электронной оболочки. При присоединении электронов атом становится отрицательным ионом.
Атомы химических элементов могут также соединяться в молекулы, наименьшую частицу вещества. Количество электронов в молекуле равно количеству электронов всех входящих в нее атомов. Например, молекула воды H2O состоит из двух атомов водорода, каждый из которых имеет по одному электрону, и атома кислорода, который имеет 8 электронов. То есть, в молекуле воды всего 10 электронов.
Совет 1: Как определить число электронов в атоме
Атом состоит из исключительно плотного ядра, окруженного электронным «облаком». Ядро жалко немного по сопоставлению с внешними размерами облака, и состоит из протонов и нейтронов. Атом в обыкновенном состоянии нейтрален, а электроны несут негативный заряд. Но атом может также перетянуть чужие электроны, либо отдать свои. В таком случае он теснее будет являться негативно заряженным либо позитивно заряженным ионом. Как определить, сколько электронов содержится в атоме ?
Инструкция
1. Раньше каждого, вам на поддержка придет Таблица Менделеева. Заглянув в нее, вы увидите, что весь химический элемент имеет не только свое сурово определенное место, но и личный порядковый номер. Скажем, у водорода он равен единице, у углерода – 6, у золота – 79 и так дальше.
2. Именно порядковый номер характеризует число протонов в ядре, то есть правильный заряд ядра атома. От того что атом в обыкновенном состоянии нейтрален, позитивный заряд должен быть уравновешен негативным зарядом. Следственно, у водорода – один электрон, углерода – шесть электронов , у золота – семьдесят девять электронов .
3. Ну а как определить число электронов в атоме , если атом, в свою очередь, входит в состав какой-нибудь больше трудной молекулы? Скажем, каково число электронов в атомах натрия и хлора, если они образуют молекулу каждым вам отменно знаменитой обыкновенной поваренной соли?
4. И здесь нет ничего трудного. Начните с того, что напишите формулу этого вещества, она будет иметь дальнейший вид: NaCl. Из формулы вы увидите, что молекула поваренной соли состоит из 2-х элементов, а именно: щелочного металла натрия и газа-галогена хлора. Но это теснее не нейтральные атомы натрия и хлора, а их ионы. Хлор, образуя ионную связь с натрием, тем самым «перетянул» к себе один из его электронов , а натрий, соответственно, его «отдал».
5. Вновь посмотрите в Таблицу Менделеева. Вы увидите, что натрий имеет порядковый номер 11, хлор – 17. Следственно, сейчас у иона натрия будет 10 электронов , у иона хлора – 18.
6. Действуя по такому же алгорифму, легко дозволено определить число электронов у всякого химического элемента, будь то в виде нейтрального атома либо иона.
Совет 2: Как определить число нейтронов
Атом химического элемента состоит из ядерного ядра и электронов. В состав ядерного ядра входят два типа частиц – протоны и нейтроны. Примерно каждая масса атома сфокусирована в ядре, потому что протоны и нейтроны гораздо тяжелее электронов.
Вам понадобится
- атомный номер элемента, изотопы
Инструкция
1. В различие от протонов, нейтроны не имеют электрического заряда, то есть их электрический заряд равен нулю. Следственно, зная ядерный номер элемента, невозможно однозначно сказать, сколько нейтронов содержится в его ядре. К примеру в ядре атома углерода неизменно содержится 6 протонов, впрочем протонов в нем может быть 6 и 7. Разновидности ядер химического элемента с различным числом нейтронов в ядре именуются изотопами этого элемента. Изотопы могут быть как природными, так и полученными неестественно.
2. Ядерные ядра обозначаются буквенным символом химического элемента из таблицы Менделеева. Справа от символа вверху и внизу стоят два числа. Верхнее число A – это массовое число атома, A = Z+N, где Z – заряд ядра (число протонов),а N – число нейтронов . Нижнее число – это Z – заряд ядра. Такая запись дает информацию о числе нейтронов в ядре. Видимо, оно равно N = A-Z.
3. У различных изотопов одного химического элемента число A меняется, что отражено в записи этого изотопа. Определенные изотопы имеют свои подлинные наименования. Скажем, обыкновенное ядро водорода не имеет нейтронов и имеет один протон. Изотоп водорода дейтерий имеет один нейтрон (A = 2), а изотоп тритий – два нейтрона (A = 3).
4. Связанность числа нейтронов от числа протонов отражена на N-Z диаграмме ядерных ядер. Стабильность ядер зависит от отношения числа нейтронов и числа протонов. Ядра легких нуклидов особенно устойчивы при N/Z = 1, то есть при равенстве числа нейтронов и протонов. С ростом массового числа область стабильности сдвигается к величинам N/Z>1, достигая величины N/Z ~ 1,5 для особенно тяжелых ядер.
Видео по теме
Совет 3: Как обнаружить число электронов в атоме
Атом состоит из ядра и окружающих его электронов , которые вращаются вокруг него по ядерным орбиталям и образуют электронные слои (энергетические ярусы). Число негативно заряженных частиц на внешних и внутренних ярусах определяет свойства элементов. Число электронов , содержащихся в атоме, дозволено обнаружить, зная некоторые ключевые моменты.
Вам понадобится
- – бумага;
- – ручка;
- – периодическая система Менделеева.
Инструкция
1. Дабы определить число электронов , воспользуйтесь периодической системой Д.И. Менделеева. В этой таблице элементы расположены в определенной последовательности, которая узко связана с их ядерным строением. Зная, что позитивный заряд атома неизменно равен порядковому номеру элемента, вы легко обнаружите число негативных частиц. Чай вестимо – атом в совокупности нейтрален, а значит, число электронов будет равно числу протонов и номеру элемента в таблице. Скажем, порядковый номер алюминия равен 13. Следственно, число электронов у него будет 13, у натрия – 11, у железа – 26 и т.д.
2. Если вам нужно обнаружить число электронов на энергетических ярусах, вначале повторите правило Пауля и правило Хунда. Потом распределите негативные частицы по ярусам и подуровням с подмогой все той же периодической системы, а вернее ее периодов и групп. Так номер горизонтального ряда (периода) указывает на число энергетических слоев, а вертикального (группы) – на число электронов на внешнем ярусе.
3. Не забывайте о том, что число внешних электронов равно номеру группы только у элементов, которые находятся в основных подгруппах. У элементов побочных подгрупп число негативно заряженных частиц на последнем энергетическом ярусе не может быть огромнее 2-х. Скажем, у скандия (Sc), находящегося в 4 периоде, в 3 группе, побочной подгруппе, их 2. В то время как у галия (Ga), тот, что находится в том же периоде и той же группе, но в основной подгруппе, внешних электронов 3.
4. При подсчете электронов в атоме, учтите, что последние образуют молекулы. При этом атомы могут принимать, отдавать негативно заряженные частицы либо образовывать всеобщую пару. Скажем, в молекуле водорода (H2) всеобщая пара электронов . Иной случай: в молекуле фторида натрия (NaF) всеобщая сумма электронов будет равна 20. Но в ходе химической реакции атом натрия отдает свой электрон и у него остается 10, а фтор принимает – получается тоже 10.
Полезный совет
Помните, что на внешнем энергетическом ярусе может быть только 8 электронов. И это не зависит от расположения элемента в таблице Менделеева.
Совет 4: Как соединяются атомы в молекулу
Атом – это мельчайшая стабильная (в большинстве случаев) частица вещества. Молекулой же называют несколько атомов, связанных между собой. Именно молекулы хранят в себе информацию о всех свойствах определенного вещества.
Атомы образуют молекулу при помощи различных типов связи. Они отличаются между собой направленностью и энергией, с подмогой которых дозволено эту связь образовать.
Квантовомеханическая модель ковалентной связи
Ковалентная связь образуется при помощи валентных электронов. При сближении 2-х атомов отслеживается перекрытие электронных облаков. При этом электроны всякого атома начинают двигаться в области, принадлежащей иному атому. В пространстве, окружающем их, возникает излишний негативный потенциал, тот, что стягивает позитивно заряженные ядра. Это допустимо только при условии, что спины всеобщих электронов антипараллельны (направлены в различные стороны).Ковалентная связь характеризуется достаточно огромным значением энергии связи на весь атом (около 5 эВ). Это обозначает, что нужно 10 эВ, дабы молекула из 2-х атомов, образованная ковалентной связью, распалась. Атомы могут приблизиться друг к другу на сурово определенное состояние. При таком сближении отслеживается перекрытие электронных облаков. Тезис Паули гласит, что вокруг одного и того же атома не может вращаться два электрона в идентичном состоянии. Чем огромнее отслеживается перекрытие, тем больше отталкиваются атомы.
Водородная связь
Это частный случай ковалентной связи. Ее образуют два атома водорода. Именно на примере этого химического элемента в двадцатых годах прошлого столетия был показан механизм образования ковалентной связи. Атом водорода дюже примитивен в своем строении, что дозволило ученым касательно верно решить уравнение Шредингера.
Ионная связь
Кристалл каждом вестимой поваренной соли образуется при помощи ионной связи. Она появляется, когда атомы, образующие молекулу, владеют огромный разницей в электроотрицательности. Менее электроотрицательный атом (в случае кристалла поваренной соли это натрий) отдает все свои валентные электроны хлору, превращаясь в правильно заряженный ион. Хлор, в свою очередь, становится негативно заряженным ионом. Эти ионы связаны в структуре электростатическим взаимодействием, которое характеризуется достаточно огромный силой. Вот отчего ионная связь владеет наибольшей прочностью (10 эВ на атом, что в два раза огромнее, чем энергия ковалентной связи). В ионных кристаллах дюже редко отслеживаются недостатки разного рода. Электростатическое взаимодействие крепко удерживает позитивные и негативные ионы в определенных местах, не давая возникнуть вакансии, междоузелью и иным недостаткам кристаллической решетки.
Видео по теме
Полезный совет
Протоны – это одобрительно заряженные частицы, нейтроны же не несут какого-нибудь заряда.