Войти
Задать вопрос
Химия
Парфентий
26 сентября, 18:09
Чем определяется количество элементов в периоде?
+1
Ответы (2)
-
Савиниан
26 сентября, 18:54
0
количеством электронов на последнем уровне.
- Комментировать
- Жалоба
- Ссылка
-
Лизута
26 сентября, 19:37
0
Електронами может быть …
- Комментировать
- Жалоба
- Ссылка
Знаешь ответ?
Не уверен в ответе?
Найди верный ответ на вопрос ✅ «Чем определяется количество элементов в периоде? …» по предмету 📙 Химия, а если ответа нет или никто не дал верного ответа, то воспользуйся поиском и попробуй найти ответ среди похожих вопросов.
Искать другие ответы
Новые вопросы по химии
Что произойдёт с железом при взаимодействии с водой? 3 класс.
Ответы (8)
C8h18 формула глюкозы
Ответы (1)
1. Цинк растворили в концентрированной азотной кислоте. Полученный газ растворили в горячей воде. В ходе этого взаимодействия образовался бесцветный газ. Он легко окисляется кислородом воздуха до образования бурого газа.
Ответы (2)
Закончите формулы. H2+CuO= Na+HCl =
Ответы (2)
Что такое макроэлементы и ультромикроэлементы?
Ответы (1)
Главная » Химия » Чем определяется количество элементов в периоде?

- Периодическая система Менделеева систематизирует элементы и их свойства. В ней все элементы упорядочены с учетом их атомного числа и повторяющихся химических свойств.
- Периодический закон: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
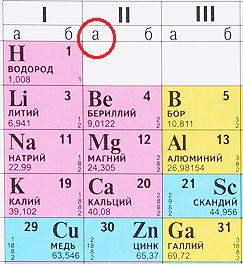
Расшифровка обозначений элементов
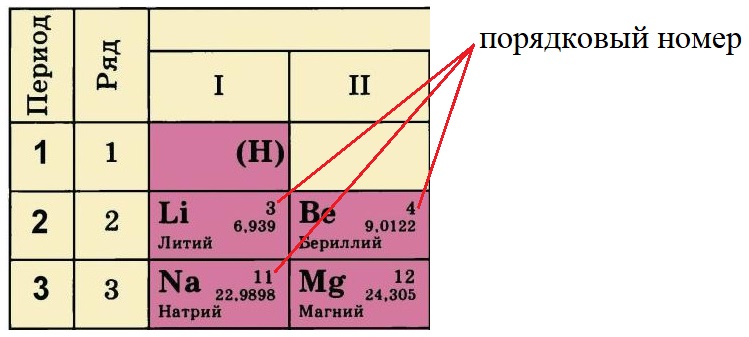
Каждому химическому элементу в таблице отведена одна клеточка, в которой указаны символ и название элемента, порядковый номер и относительная атомная масса.
Расшифровка обозначений элементов таблицы Менделеева:
- Обозначение: одной или двумя латинскими буквами.
- Порядковый номер элемента или атомный номер равен числу протонов в его ядре. Обычно пишется в левом верхнем углу.
- Относительная атомная масса (сумма масс протонов и нейтронов). Это усреднённая величина, для расчёта которой используются атомные массы всех изотопов элемента с учетом их содержания в природе. Поэтому обычно она является дробным числом.
- Если округлить атомную массу до ближайшего целого, мы получим так называемое массовое число.
- Разность массового числа и атомного числа дает количество нейтронов в ядре. Так, число нейтронов в ядре гелия равно двум, а у лития – четырем.
- Число положительных протонов, как правило, равно числу отрицательных электронов в атоме (за исключением изотопов).
- Электронная конфигурация — формула расположения электронов по различным электронным оболочкам атома химического элемента или молекулы.
-
Чтобы узнать количество нейтронов в ядре элемента, необходимо из относительной атомной массы (массового числа) вычесть порядковый номер.
Элементы периодической таблицы Менделеева
Металлы расположены в левом нижнем углу таблицы, неметаллы — в правом верхнем углу. Между ними находятся полуметаллы. Все периоды, кроме первого, начинается щелочным металлом. Каждый период заканчивается инертным газом.
- Металлы обладают хорошей электро- и теплопроводностью, способны отражать яркий свет, имеют высокую температуру плавления (остаются твердыми при нормальных значениях окружающей среды, исключение — ртуть).
- Неметаллы встречаются в природе в трех состояниях: газ (например, водород), жидкость (например, бром) и твердые вещества (например, фосфор). Он не способны проводить тепло и электричество. Имеют более низкую температуру плавления в сравнении с металлами, более хрупкие и ломкие. Могут иметь разнообразный внешний вид (элементы с низкой плотностью и яркостью).
- Металлоиды имеют смешанные свойства металлов и неметаллов (например, кремний). Они имеют среднюю тепло- и электропроводность. Различаются между собой по температуре плавления, плотности, цвету и форме. Внешний вид может быть схож с металлами или неметаллами.
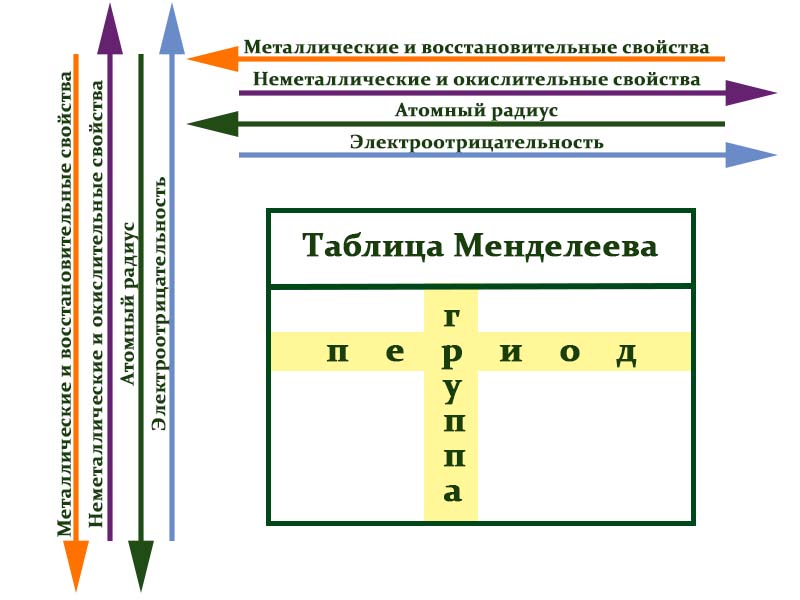
Расшифровка групп и периодов таблицы Менделеева
В таблице химические вещества расположены в специальном порядке: слева направо по мере роста их атомных масс. Все они в периодической системе объединены в периоды и группы.
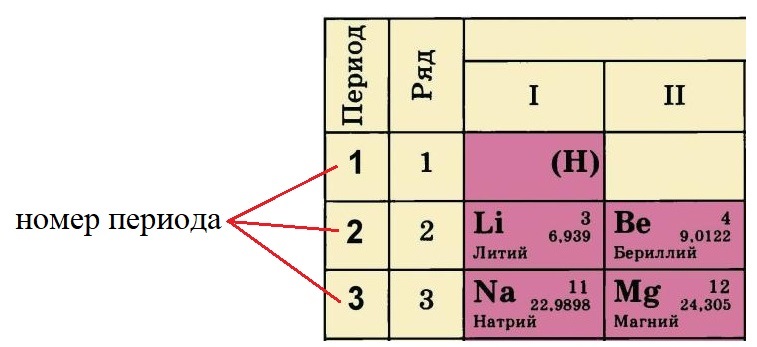
Периоды — это горизонтальные ряды в таблице. У всех элементов одного периода одинаковое количество заполненных электронами энергетических уровней.
Номер периода, в котором находится элемент, совпадает с номером его валентной оболочки. Эта валентная оболочка постепенно заполняется от начала к концу периода.
Закономерности периодов:
- Металлические свойства убывают, неметаллические и окислительные -возрастают. Каждый период начинается активным металлом и заканчивается инертным газом.
- Уменьшается атомный радиус.
- Увеличивается электроотрицательность.
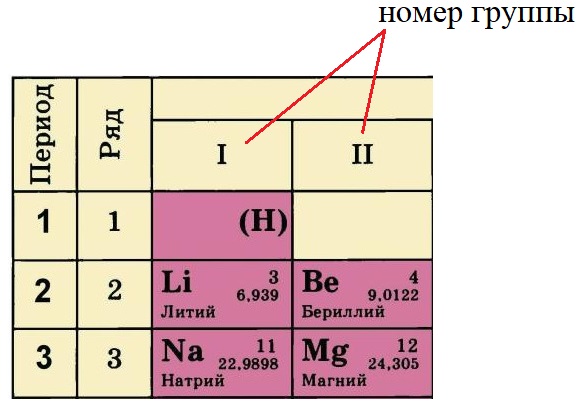
Группы — это столбцы. Элементы во всех группах имеют одинаковое электронное строение внешних электронных оболочек. В каждой группе на внешнем энергетическом атома одинаковое число электронов, то есть номер группы совпадает с числом валентных электронов, которые могут участвовать в образовании химических связей. Поэтому номер группы часто совпадает с валентностью элементов. Например, номер группы совпадает с валентностью s-элементов и с наибольшей возможной валентностью p-элементов.
Закономерности групп:
- Металлические свойства увеличиваются, неметаллические и окислительные- убывают.
- Увеличивается радиус атома элементов в рамках одной группы.
- Уменьшается электроотрицательность.
Атомное число показывает, сколько протонов содержит ядро атома элемента и сколько электронов в атоме находятся вокруг него. Атом каждого последующего элемента содержит на один протон больше, чем предыдущий.
Валетность — это свойство элементов образовывать химические связи. То есть это количество химических связей, которые образует атом или число атомов, которое может присоединить или заместить атом данного элемента. Валентность бывает: постоянная и переменная (зависит от состава вещества, в которое входит элемент).
Определить валентность:
— Постоянная валентность идентична номеру группы главной подгруппы. Номера групп в таблице изображаются римскими цифрами.
— Переменная валентность (часто бывает у неметаллов) определяется по формуле: 8 вычесть № группы, в которой находится вещество.
Расшифровка периодов и групп периодической таблицы Менделеева
Каждый элемент имеет свой порядковый (атомный) номер, располагается в определённом периоде и определённой группе.
Периоды
- Малые периоды: первый, второй и третий периоды. В них содержится соответственно 2, 8 и 8 элементов;
- Большие периоды: остальные элементы. В четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент.
В таблице 7 периодов. В каждом содержится определённое число элементов:
1-й период — 2 элемента (малый период),
2-й период — 8 элементов (малый период),
3-й период — 8 элементов (малый период),
4-й период — 18 элементов (большой период),
5-й период — 18 элементов (большой период),
6-й период — 32 элемента (18+14) (большой период),
7-й период — 32 элемента (18+14) (большой период).
Группы и подгруппы
- Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов.
- Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
В Периодической таблице может использоваться разное обозначение групп. Поэтому согласно такому обозначению бывает разная расшифровка групп таблицы менделеева:
- 18 групп, пронумерованных арабскими цифрами.
- 8 групп, пронумерованных цифрами с добавлением букв A или B.
Группы A — это главные подгруппы.
Группы B — это побочные подгруппы в больших периодов. Это только металлы.
IA, VIIIA — по 7 элементов;
IIA — VIIA — по 6 элементов;
IIIB — 32 элемента (4+14 лантаноидов +14 актиноидов);
VIIIB — 12 элементов;
IB, IIB, IVB — VIIB — по 4 элемента.
Римский номер группы, как правило, показывает высшую валентность в оксидах (но для некоторых элементов не выполняется).
Элементы с порядковыми номерами 58–71 (лантаноиды) и 90–103 (актиноиды) вынесены из таблицы и располагаются под ней. Это элементы IIIB группы. Лантаноиды относятся к шестому периоду, а актиноиды — к седьмому.
Элементы главной подгруппы
1 группа главная подгруппа элементов (IA) — щелочные металлы.
Это мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним электроном на внешней оболочке и прекрасно вступают в реакцию.
Литий Li (3), Натрий Na (11), Калий K (19), Рубидий Rb (37), Цезий Cs (55), Франций Fr (87).
2 группа главная подгруппа (IIА) -щелочноземельными металлами.
Имеют серебристый оттенок. На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами. По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах.
Кальций Ca (20), Стронций Sr (38), Барий Ba (56), Радий Ra (88).
3 группа главная подгруппа (IIIА).
Все элементы данной подгруппы, за исключением бора, металлы. Главную подгруппу составляют составляют бор, алюминий, галлий, индий и таллий. На внешнем электронном уровне элементов по три электрона. Они легко отдают эти электроны или образуют три неспаренных электрона.
4 группа главная подгруппа (IVА) .
Углерод и кремний обладают всеми свойствами неметаллов, германий и олово занимают промежуточную позицию, а свинец имеет выраженные металлические свойства. Большинство элементов подгруппы углерода — полупроводники (проводят электричество за счёт примесей, но хуже, чем металлы).
5 группа главная подгруппа (VA).
Физические свойства элементов подгруппы азота различны. Азот является бесцветным газом. Фосфор, мягкое вещество, образует несколько вариантов аллотропных модификаций — белый, красный и чёрный фосфор. Мышьяк — твёрдый полуметалл, способный проводить электрический ток. Висмут — блестящий серебристо-белый металл с радужным отливом.
6 группа главной подгруппы (VIA) .
Для завершения внешнего электронного уровня атомам этих элементов не хватает лишь двух электронов, поэтому они проявляют сильные окислительные (неметаллические) свойства.
7 группа главная подгруппа (VIIA) — галогены .
(F, Cl, Br, I, At). Имеют семь электронов на внешнем электронном слое атома. Это сильнейшие окислители, легко вступающие в реакции. Галогены («рождающие соли») назвали так потому, что они реагируют со многими металлами с образованием солей.
Самый активный из галогенов — фтор. Он способен разрушать даже молекулы воды, за что и получил своё грозное имя (слово «фтор» переводится на русский язык как «разрушительный»). А его «близкий родственник» — иод — используется в медицине в виде спиртового раствора для обработки ран.
8 группа главная подгруппа (VIIIA) — инертные (благородные) газы.
(He, Ne, Ar, Kr, Xe, Rn, Og). У них полностью заполнен внешний электронный уровень. Они практически не способны участвовать в реакциях. Поэтому их иногда называют «благородными». У инертных газов есть способность: они светятся под действием электромагнитного излучения, поэтому используются для создания ламп. Так, неон используется для создания светящихся вывесок и реклам, а ксенон — в автомобильных фарах и фотовспышках.
Элементы побочной подгруппы
Элементы побочных подгрупп кроме лантаноидов и актиноидов — переходные металлы.
Твёрдые (исключение жидкая ртуть), плотные, обладают характерным блеском, хорошо проводят тепло и электричество.
Переходные металлы занимают группы 3—12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
3 группа побочная подгруппа (IIIB) шестого и седьмого периодов — лантаноиды и актиноиды.
Для удобства их помещают под основной таблицей.
- Лантаноиды иногда называют «редкоземельными элементами», поскольку они были обнаружены в небольшом количестве в составе редких минералов и не образуют собственных руд.
- Актиноиды имеют одно важное общее свойство — радиоактивность. Все они, кроме урана, практически не встречаются в природе и синтезируются искусственно.
Неметаллы
Правый верхний угол таблицы до инертных газов -неметаллы.
Неметаллы плохо проводят тепло и электричество и могут существовать в трёх агрегатных состояниях: твёрдом (как углерод или кремний), жидком (как бром) и газообразном (как кислород и азот). Водород может проявлять как металлические, так и неметаллические свойства, поэтому его относят как к первой, так и к седьмой группе.
Кислородные и водородные соединения
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения.
Существует 8 форм кислородных соединений: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4,
где R — элемент группы.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют 4 формы водородных соединений: RH4, RH3, RH2, RH.
Характер соединений: RH — сильнокислый; RH2 — слабокислый; RH3 — слабоосновный; RH4 — нейтральный.
Загрузить PDF
Загрузить PDF
Протоны, нейтроны и электроны – основные частицы, из которых состоит атом. Протоны заряжены положительно, электроны – отрицательно, а нейтроны и вовсе не имеют заряда.[1]
Масса электронов очень мала, а масса протонов и нейтронов практически одинакова.[2]
На самом деле, найти в атоме количество протонов, нейтронов и электронов довольно просто, нужно только научиться ориентироваться по периодической таблице химических элементов Д.И.Менделеева.
-
1
Возьмите периодическую таблицу элементов. Это система, в которой элементы организованы в зависимости от их атомной структуры. Цветное одно- или двухбуквенное сокращение – это название элемента в сокращенном виде. В таблице также представлена информация об атомном номере элемента и атомной массе.[3]
- Таблицу Менделеева можно найти в учебнике по химии или в Интернете.
- Во время контрольных работ периодическую таблицу обычно предоставляют.
-
2
Найдите в таблице нужный вам элемент. Каждый элемент в таблице располагается под своим номером. Все элементы можно разделить на металлы, неметаллы и метоллоиды (полуметаллы). В этих группах элементы классифицируются еще на несколько групп: щелочные металлы, галогены, инертные газы.[4]
- Группы (столбцы) и периоды (строки) нужны для систематизации, по ним легко найти нужный вам элемент.
- Если вы ничего не знаете о нужном вам элементе, просто найдите его в таблице.
-
3
Найдите атомный номер элемента. Атомный номер обозначает число протонов в ядре атома.[5]
Атомный номер располагается над символом элемента, обычно в левом верхнем углу клетки. Он покажет вам, сколько протонов содержится в одном атоме элемента.- Например, Бор (В) обозначен в таблице под номером 5, поэтому у него 5 протонов.
-
4
Определите количество электронов. Протоны — это положительно заряженные частицы в ядре атома. Электроны представляют собой частицы, которые несут отрицательный заряд. Поэтому когда элемент находится в нейтральном состоянии, то есть его заряд будет равен нулю, число протонов и электронов будет равным.
- Например, Бор (В) обозначен в таблице под номером 5, поэтому можно смело утверждать, что у него 5 электронов и 5 протонов.
- Однако если элемент содержит отрицательный или положительный ион, то протоны и электроны не будут одинаковыми. Вам придется вычислить их. Число ионов выглядит как маленький, верхний индекс после элемента.
-
5
Найдите атомную массу элемента. Чтобы найти число нейтронов, вам сначала нужно вычислить атомную массу элемента. Атомная масса – это средняя масса атомов данного элемента, ее нужно рассчитывать. Имейте в виду, что у изотопов атомная масса отличается.[6]
. Атомная масса указана под символом элемента.- Округляйте атомную массу до ближайшего целого числа. Например, атомная масса бора = 10,811, соответственно, ее можно округлить до 11.
-
6
Вычтите из атомной массы атомный номер. Чтобы определить количество нейтронов, нужно вычесть атомный номер из атомной массы. Помните, что атомный номер — это число протонов, которое вы уже определили.[7]
- Возьмем наш пример с бором: 11 (атомная масса) – 5 (атомный номер) = 6 нейтронов.
Реклама
-
1
Определите число ионов. Ион — это атом, состоящий из положительно заряженного ядра, в котором находятся протоны и нейтроны, и отрицательно заряженных электронов. Атом несет нейтральный заряд, но заряд может быть положительным и отрицательным из-за электронов, которые атом может отдавать и принимать.[8]
Поэтому число протонов в атоме не меняется, а число электронов в ионе может меняться.- Электрон несет отрицательный заряд, поэтому если атом отдает электроны, то сам становится заряженным положительно. Когда атом принимает электроны, он становится отрицательно заряженным ионом.
- Например, у N3- заряд -3, а у Ca2+ заряд +2.
- Помните, если число ионов не указано в таблице, вам не нужно делать подобные вычисления.
-
2
Вычтите заряд из атомного номера. Если ион положительно заряжен, нужно вычесть из атомного номера заряд. Если у иона положительный заряд, значит, он отдал электроны. Чтобы подсчитать оставшееся число электронов, нужно вычесть заряд от атомного номера. Если ион заряжен положительно, значит, в нем больше протонов, чем электронов.
- Например, у Ca2+ заряд +2, поэтому можно сказать, что он отдал два электрона. Атомный номер кальция = 20, поэтому у его иона 18 электронов (20-2=18).
-
3
Если ион заряжен отрицательно, чтобы узнать число электронов, нужно добавить заряд к атомному номеру. Потому что ион стал отрицательным из-за того, что принял лишние электроны. Так что нужно просто прибавить заряд к атомному номеру, тогда вы получите число электронов. Разумеется, если ион заряжен отрицательно, то электронов в нем больше, чем протонов.
- Например, у N3- заряд -3, значит, азот получил три дополнительных электрона. Атомный номер азота 7, поэтому число электронов у азота = 10. (то есть 7+3=10).
Реклама
Об этой статье
Эту страницу просматривали 956 052 раза.
Была ли эта статья полезной?
Чем определяется количество элементов в периоде?
Перед вами страница с вопросом Чем определяется количество элементов в периоде?, который относится к
категории Химия. Уровень сложности соответствует учебной программе для
учащихся 5 — 9 классов. Здесь вы найдете не только правильный ответ, но и
сможете ознакомиться с вариантами пользователей, а также обсудить тему и
выбрать подходящую версию. Если среди найденных ответов не окажется
варианта, полностью раскрывающего тему, воспользуйтесь «умным поиском»,
который откроет все похожие ответы, или создайте собственный вопрос, нажав
кнопку в верхней части страницы.
Строение атома
Материал по химии
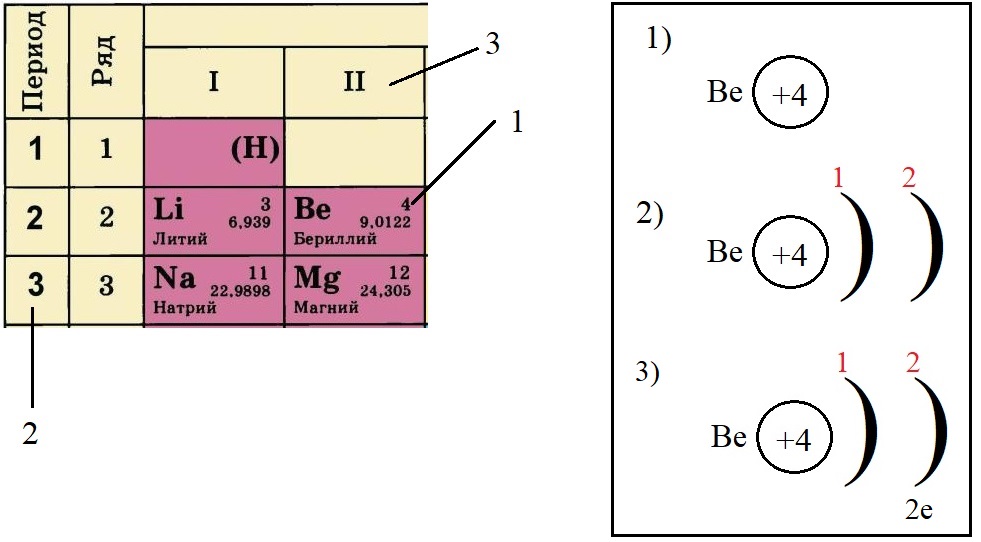
Порядковый номер, группа и период.
Для удобства будем использовать планетарную модель строения атома Н. Бора, согласно которой в центре атома располагается положительно заряженное ядро, состоящее из протонов и нейтронов, а вокруг двигаются электроны по «орбитам» и образуют электронную оболочку
Вся необходимая для построения модели атома информация находится в Периодической системе химических элементов Д.И. Менделеева:
-
Порядковый номер элемента равен количеству протонов (р+) в ядре этого атома, так у лития три протона, у бериллия – четыре, а у натрия одиннадцать. Известно, что атом – нейтральная частица, количество протонов в ней всегда будет равно количеству электронов. Поэтому порядковый номер определяет не только заряд ядра, но и общее количество электронов на всех орбиталях атома этого элемента.
Строение атома
Порядковый номер в таблице Менделеева
-
Номер периода, в котором располагается данный элемент, показывает, на каком количестве уровней находятся электроны. Так, электроны лития и бериллия располагаются на двух уровнях, а натрия и магния – на трёх.
-
Номер группы, в котором стоит элемент определяет количество электронов на внешнем уровне (валентные электроны). У лития и натрия по одному электрону на внешнем уровне, а у бериллия и магния – по два. Это правило действует только на элементы А-подгрупп.
А-подгруппа и Б-подгруппа.
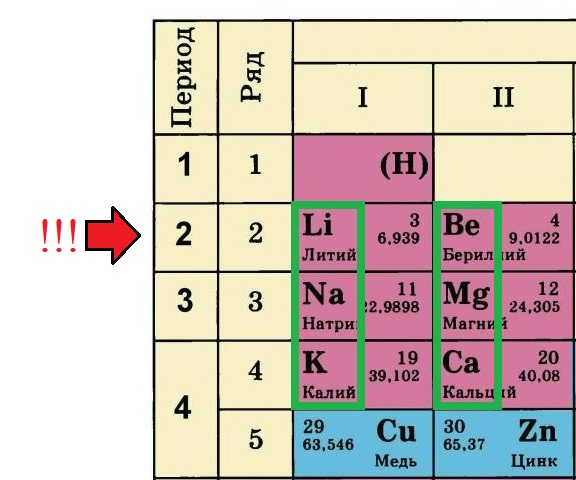
Как определить, какой элемент относится к А-подгруппе, а какой – к B (Б)-подгруппе?
Некоторые таблицы содержат эту информацию:
Но большинство таблиц имеет только обозначения групп. Что делать в таком случае? Всё просто: ориентируйтесь по элементам второго периода, они все являются элементами А-подгрупп (литий, бериллий, бор, углерод, азот, кислород, фтор, неон), те элементы, что располагаются прямо под ними тоже относятся к А-подуровню:
В данном примере зеленым прямоугольником выделены элементы А-подгрупп, так как с них начинается второй период ПС. А значок меди и цинка расположен с другой стороны, это элементы В-подгрупп.
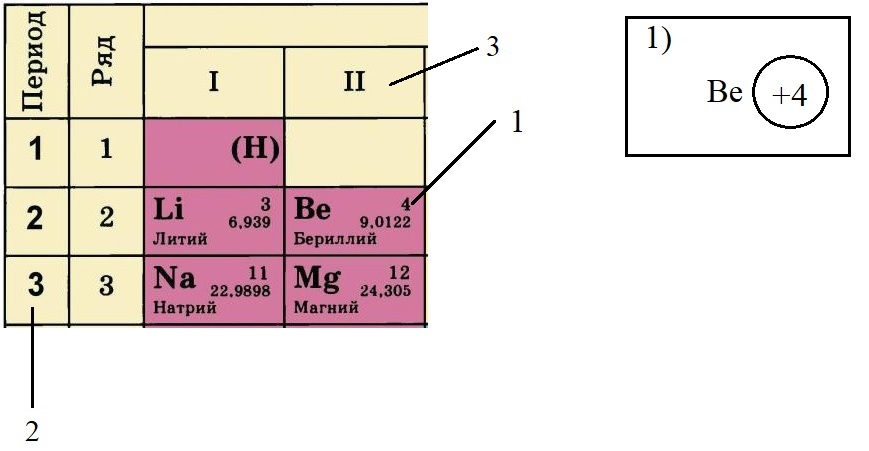
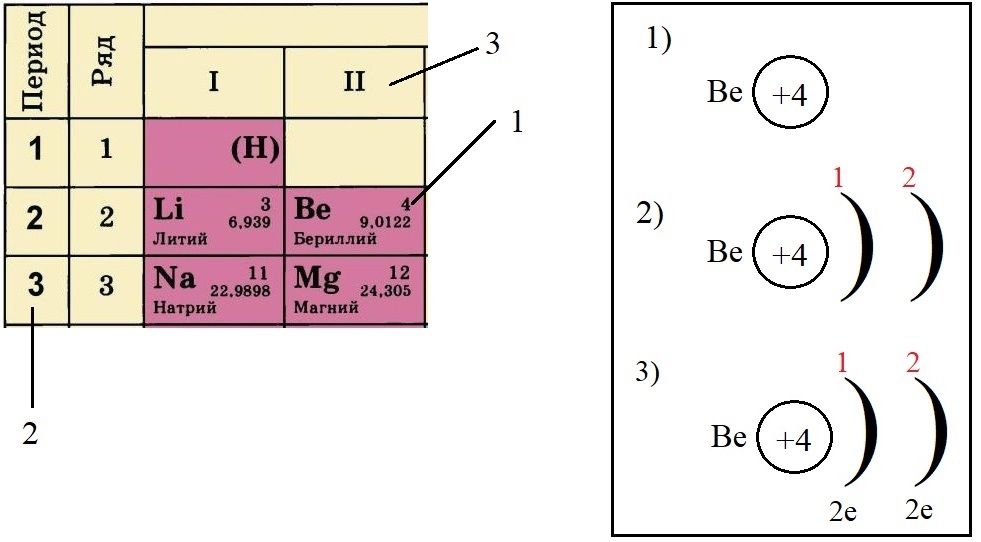
Пример построения модели атома.
Теперь попробуем составить электронную конфигурацию атома бериллия. Последовательность действий отображена цифровыми обозначениями на рисунке, изображающем фрагмент ПС:
-
По порядковому номеру определяем заряд ядра, записываем в круг после символа элемента. Помним, что это еще и количество электронов.
-
Определяем количество энергетических уровней, оно равно номеру периода, в котором стоит элемент. Бериллий стоит во втором периоде, значит, у него два энергетических уровня:
-
Определяем количество электронов на внешнем уровне, оно равно номеру группы. Бериллий стоит во второй группе, у него два электрона на внешнем слое:
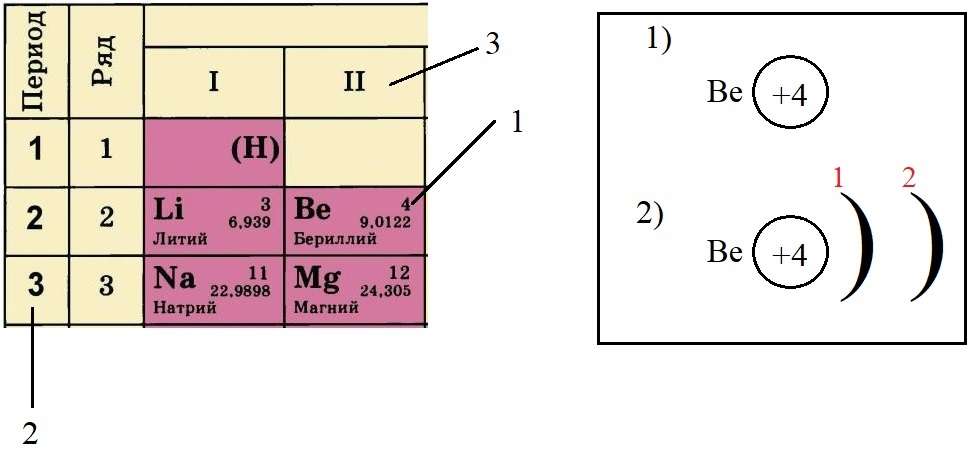
-
Не трудно догадаться, что если всего у бериллия должно быть четыре электрона, два из которых находятся на внешнем слое, то оставшиеся два находятся на внутреннем слое:
Максимальное количество электронов на уровнях
Чтобы строить электронные конфигурации более крупных атомов, необходимо ввести еще несколько данных. Начнем с максимального количества электронов на определенном уровне, это количество показано на рисунке:
Стоит помнить, что это лишь максимальное количество, большинство элементов не имеют на каждом уровне такого количества электронов.
Так же следует помнить, что какой бы номер не имел бы внешний уровень, на нем максимальное количество электронов не должно превышать восьми.
Следует учитывать, что предвнешний слой следует заполнять последним, чтобы избежать ошибок.
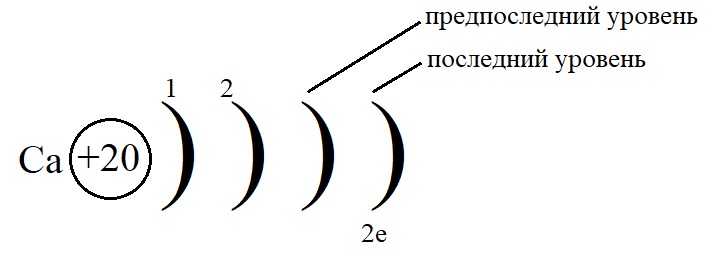
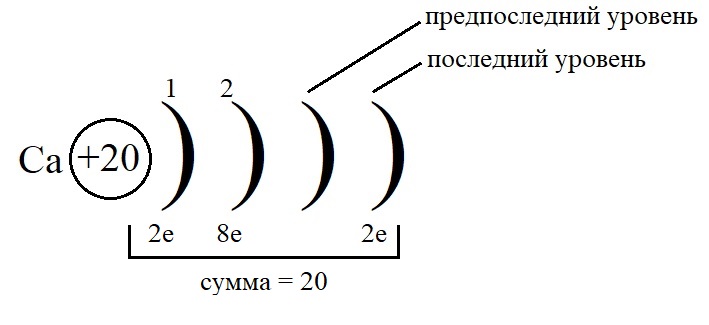
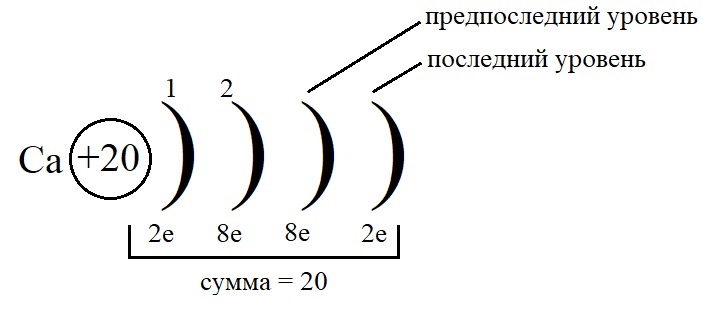
Рассмотрим данные правила на примере построения конфигурации атома кальция.
-
Порядковый номер кальция – 20, у него 20 протонов в ядре и 20 электронов на орбиталях. Кальций стоит во второй группе, значит, на внешнем слое у него 2 электрона.
-
Остальные уровни, кроме предвнешнего, заполняем по максимальному количеству на этих слоях:
-
Как показано на рисунке, общее количество электронов должно быть равным двадцати, а пока мы распределили только двенадцать, значит, на предпоследнем уровне необходимо поставить восемь электронов:
Каждый энергетический уровень можно разбить на подуровни (орбитали). Их существует 4 вида: s-, p-, d-, f-орбитали. Они характеризуют область пространства, в которой электрон находится с наибольшей вероятностью.