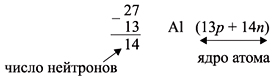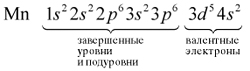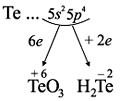Быть
может, эти электроны –
Миры,
где пять материков,
Искусство,
знания, войны, троны
И
память сорока веков.
Вспомним,
из чего состоит атом. Помните планетарную модель строения атома,
согласно которой, в центре атома расположено положительно заряженное ядро,
вокруг которого вращаются отрицательно заряженные электроны, подобно тому,
как вращаются планеты вокруг Солнца.
Строение
атома
Электроны,
двигаясь вокруг ядра, в совокупности образуют электронную оболочку атома.
Число электронов в атоме равно числу протонов в ядре и соответствует
порядковому номеру элемента.
Электроны
двигаются в определённом порядке и различаются своей энергией.
Электроны с маленьким запасом энергии расположены ближе к ядру, они связаны
крепко с ядром и их тяжелее вырвать из электронной оболочки. А вот электроны с
большим запасом энергии, напротив, находятся дальше от ядра, слабо с ним
связаны, поэтому их легче оторвать.
Несмотря
на это, в атоме находятся электроны, которые имеют близкие значения энергии.
Эти электроны образуют электронные слои, или энергетические уровни.
Чтобы
определить число энергетических уровней, достаточно знать номер периода, в
котором находится данный элемент. Например, у азота семь
электронов в атоме, и два энергетических уровня. Теперь распределим эти семь
электронов по уровням. Получается на первом их 2, а на втором – оставшиеся 5.
Максимальное
число электронов на энергетическом уровне определяется по
формуле: 2n2,
где n –
номер периода.
Если
подставить значения первых трех периодов, то получится, что максимально на
первом энергетическом уровне возможно только 2 электрона, на втором – 8, на
третьем – 18.
Число
электронов на внешнем энергетическом уровне для элементов главных подгрупп равно
номеру группы.
Рассмотрим
это на примере атома натрия.
Ядро
атома натрия имеет заряд +11, т.е. и электронов в атоме тоже 11.
Натрий находится в третьем периоде, значит, у него три энергетических
уровня, которые мы будем изображать в виде скобки «)». Это записывают с
помощью электронной формулы следующим образом: 11Na
2ē, 8ē, 1ē.
И
так, на первом уровне 2 электрона (это максимально), на втором – 8 (больше быть
не может), а на третий остается один электрон. Вот этот электрон и будет
электроном внешнего энергетического уровня. Натрий – элемент главной
подгруппы I
группы, поэтому число электронов на внешнем уровне равно
номеру группы, т.е. единице.
Двигаясь,
электроны образуют своеобразный рисунок, так называемое электронное облако,
которое можно ещё назвать орбиталью. Электронное облако, или орбиталь, –
пространство вокруг ядра, где наиболее вероятно нахождение данного электрона.
На
всех энергетических уровнях есть s-орбитали,
они сферической формы, и она только одна, на втором уровне уже появляются p-орбитали,
которые имеют форму гантели, их всего три. На каждой орбитали максимально может
находится не более двух электронов, следовательно, на s-орбитали
– их два, на р-орбитали – шесть.
Для
того, чтобы записать электронную формулу атома, для обозначения уровня
используют арабские цифры, орбитали соответственно буквами s
и
р, а число электронов данной орбитали – арабской цифрой сверху справа над
буквой орбитали.
Например,
азот будет иметь электронную формулу 1s22s22p3.
Если
элементы имеют одинаковое число электронов на внешнем уровне, значит, у них
будут схожие свойства. Вспомните, благородные газы – инертны,
не вступают в химические реакции, ведь у них, кроме гелия, восемь электронов на
внешнем уровне, который считается завершенным. Вот почему они все инертны.
Е.Н.ФРЕНКЕЛЬ
Самоучитель по химии
Пособие для тех, кто не знает, но хочет
узнать и понять химию
Продолжение. Начало см. в № 13, 18, 23/2007
Глава 3. Элементарные сведения о
строении атома.
Периодический закон Д.И.Менделеева
В с п о м н и т е, что такое атом, из чего состоит
атом, изменяется ли атом в химических
реакциях.
Атом – это электронейтральная частица,
состоящая из положительно заряженного ядра и
отрицательно заряженных электронов.
Число электронов в ходе химических процессов
может изменяться, но заряд ядра всегда остается
неизменным. Зная распределение электронов в
атоме (строение атома), можно предсказать многие
свойства данного атома, а также свойства простых
и сложных веществ, в состав которых он входит.
Строение атома, т.е. состав ядра и распределение
электронов вокруг ядра, несложно определить по
положению элемента в периодической системе.
В периодической системе Д.И.Менделеева
химические элементы располагаются в
определенной последовательности. Эта
последовательность тесно связана со строением
атомов этих элементов. Каждому химическому
элементу в системе присвоен порядковый номер,
кроме того, для него можно указать номер периода,
номер группы, вид подгруппы.
Спонсор публикации статьи интернет-магазин «Мегамех». В магазине Вы найдёте изделия из меха на любой вкус — куртки, жилетки и шубы из лисы, нутрии, кролика, норки, чернобурки, песца. Компания также предлагает Вам приобрести элитные меховые изделия и воспользоваться услугами индивидуального пошива. Меховые изделия оптом и в розницу — от бюджетной категории до класса люкс, скидки до 50%, гарантия 1 год, доставка по Украине, России, СНГ и странам Евросоюза, самовывоз из шоу-рума в г.Кривой Рог, товары от ведущих производителей Украины, России, Турции и Китая. Посмотреть каталог товаров, цены, контакты и получить консультацию Вы сможете на сайте, который располагается по адресу: «megameh.com».
Зная точный «адрес» химического элемента –
группу, подгруппу и номер периода, можно
однозначно определить строение его атома.
Период – это горизонтальный ряд химических
элементов. В современной периодической
системе семь периодов. Первые три периода – малые,
т.к. они содержат 2 или 8 элементов:
1-й период – Н, Не – 2 элемента;
2-й период – Li … Nе – 8 элементов;
3-й период – Na … Аr – 8 элементов.
Остальные периоды – большие. Каждый из них
содержит 2–3 ряда элементов:
4-й период (2 ряда) – K … Kr – 18 элементов;
6-й период (3 ряда) – Сs … Rn – 32 элемента. В этот
период входит ряд лантаноидов.
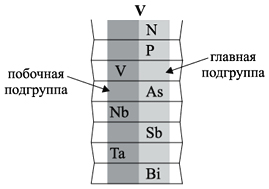
Группа – вертикальный ряд химических
элементов. Всего групп восемь. Каждая группа
состоит из двух подгрупп: главной подгруппы и
побочной подгруппы. Например:
Главную подгруппу образуют химические
элементы малых периодов (например, N, P) и больших
периодов (например, As, Sb, Bi).
Побочную подгруппу образуют химические
элементы только больших периодов (например, V, Nb,
Ta).
Визуально эти подгруппы различить легко.
Главная подгруппа «высокая», она начинается с
1-го или 2-го периода. Побочная подгруппа –
«низкая», начинается с 4-го периода.
Итак, каждый химический элемент периодической
системы имеет свой адрес: период, группу,
подгруппу, порядковый номер.
Например, ванадий V – это химический элемент
4-го периода, V группы, побочной подгруппы,
порядковый номер 23.
Задание 3.1. Укажите период, группу и
подгруппу для химических элементов с
порядковыми номерами 8, 26, 31, 35, 54.
Задание 3.2. Укажите порядковый номер и
название химического элемента, если известно,
что он находится:
а) в 4-м периоде, VI группе, побочной подгруппе;
б) в 5-м периоде, IV группе, главной подгруппе.
Каким образом можно связать сведения о
положении элемента в периодической системе со
строением его атома?
Атом состоит из ядра (оно имеет положительный
заряд) и электронов (они имеют отрицательный
заряд). В целом атом электронейтрален.
Положительный заряд ядра атома равен
порядковому номеру химического элемента.
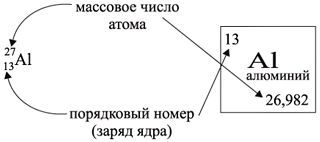
Ядро атома – сложная частица. В ядре
сосредоточена почти вся масса атома. Поскольку
химический элемент – совокупность атомов с
одинаковым зарядом ядра, то около символа
элемента указывают следующие его координаты:
По этим данным можно определить состав ядра.
Ядро состоит из протонов и нейтронов.
Протон p имеет массу 1 (1,0073 а. е. м.) и заряд +1.
Нейтрон n заряда не имеет (нейтрален), а масса
его приблизительно равна массе протона (1,0087 а. е.
м.).
Заряд ядра определяют протоны. Причем число
протонов равно (по величине) заряду ядра
атома, т.е. порядковому номеру.
Число нейтронов N определяют по разности
между величинами: «масса ядра» А и
«порядковый номер» Z. Так, для атома алюминия:
N = А – Z = 27 –13 = 14n,
Задание 3.3. Определите состав ядер атомов,
если химический элемент находится в:
а) 3-м периоде, VII группе, главной подгруппе;
б) 4-м периоде, IV группе, побочной подгруппе;
в) 5-м периоде, I группе, главной подгруппе.
Внимание! При определении массового числа ядра
атома приходится округлять атомную массу,
указанную в периодической системе. Так поступают
потому, что массы протона и нейтрона практически
целочисленны, а массой электронов можно
пренебречь.
Определим, какие из приведенных ниже ядер
принадлежат одному и тому же химическому
элементу:
А (20р + 20n),
Б (19р + 20n),
В (20р + 19n).
Атомам одного химического элемента
принадлежат ядра А и В, поскольку они
содержат одинаковое число протонов, т. е. заряды
этих ядер одинаковые. Исследования показывают,
что масса атома не оказывает существенного
влияния на его химические свойства.
Изотопами называют атомы одного и того же
химического элемента (одинаковое число
протонов), различающиеся массой (разное число
нейтронов).
Изотопы и их химические соединения отличаются
друг от друга по физическим свойствам, но
химические свойства у изотопов одного
химического элемента одинаковы. Так, изотопы
углерода-14 (14С) имеют такие же химические
свойства, как и углерода-12 (12С), которые
входят в ткани любого живого организма. Отличие
проявляется только в радиоактивности (изотоп 14С).
Поэтому изотопы применяют для диагностики и
лечения различных заболеваний, для научных
исследований.
Вернемся к описанию строения атома.
Как известно, ядро атома в химических
процессах не изменяется. А что изменяется?
Переменным оказывается общее число электронов в
атоме и распределение электронов. Общее число
электронов в нейтральном атоме определить
несложно – оно равно порядковому номеру, т.е.
заряду ядра атома:
Электроны имеют отрицательный заряд –1, а масса
их ничтожна: 1/1840 от массы протона.
Отрицательно заряженные электроны
отталкиваются друг от друга и находятся на
разных расстояниях от ядра. При этом электроны,
имеющие приблизительно равный запас энергии,
находятся на приблизительно равном расстоянии
от ядра и образуют энергетический уровень.
Число энергетических уровней в атоме равно
номеру периода, в котором находится химический
элемент. Энергетические уровни условно
обозначают так (например, для Al):
Задание 3.4. Определите число энергетических
уровней в атомах кислорода, магния, кальция,
свинца.
На каждом энергетическом уровне может
находиться ограниченное число электронов:
• на первом – не более двух электронов;
• на втором – не более восьми электронов;
• на третьем – не более восемнадцати
электронов.
Эти числа показывают, что, например, на втором
энергетическом уровне может находиться 2, 5 или 7
электронов, но не может быть 9 или 12 электронов.
Важно знать, что независимо от номера
энергетического уровня на внешнем уровне
(последнем) не может быть больше восьми
электронов. Внешний восьмиэлектронный
энергетический уровень является наиболее
устойчивым и называется завершенным. Такие
энергетические уровни имеются у самых
неактивных элементов – благородных газов.
Как определить число электронов на внешнем
уровне остальных атомов? Для этого существует
простое правило: число внешних электронов
равно:
• для элементов главных подгрупп – номеру
группы;• для элементов побочных подгрупп оно не может
быть больше двух.
Например (рис. 5):
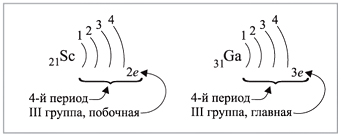 |
Рис. 5.
|
Задание 3.5. Укажите число внешних
электронов для химических элементов с
порядковыми номерами 15, 25, 30, 53.
Задание 3.6. Найдите в периодической системе
химические элементы, в атомах которых имеется
завершенный внешний уровень.
Очень важно правильно определять число внешних
электронов, т.к. именно с ними связаны важнейшие
свойства атома. Так, в химических реакциях атомы
стремятся приобрести устойчивый, завершенный
внешний уровень (8е). Поэтому атомы, на внешнем
уровне которых мало электронов, предпочитают их
отдать.
Химические элементы, атомы которых способны
только отдавать электроны, называют металлами.
Очевидно, что на внешнем уровне атома металла
должно быть мало электронов: 1, 2, 3.
Если на внешнем энергетическом уровне атома
много электронов, то такие атомы стремятся
принять электроны до завершения внешнего
энергетического уровня, т. е. до восьми
электронов. Такие элементы называют неметаллами.
В о п р о с. К металлам или неметаллам
относятся химические элементы побочных
подгрупп? Почему?
О т в е т. Металлы и неметаллы главных
подгрупп в таблице Менделеева отделяет линия,
которую можно провести от бора к астату. Выше
этой линии (и на линии) располагаются неметаллы,
ниже – металлы. Все элементы побочных подгрупп
оказываются ниже этой линии.
Задание 3.7. Определите, к металлам или
неметаллам относятся: фосфор, ванадий, кобальт,
селен, висмут. Используйте положение элемента в
периодической системе химических элементов и
число электронов на внешнем уровне.
Для того, чтобы составить распределение
электронов по остальным уровням и подуровням,
следует воспользоваться следующим а л г о р и т м
о м.
1. Определить общее число электронов в атоме (по
порядковому номеру).
2. Определить число энергетических уровней (по
номеру периода).
3. Определить число внешних электронов (по виду
подгруппы и номеру группы).
4. Указать число электронов на всех уровнях,
кроме предпоследнего.
5. Рассчитать число электронов на предпоследнем
уровне.
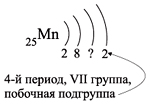
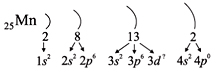
Например, согласно пунктам 1–4 для атома
марганца определено:
Всего 25е; распределили (2 + 8 + 2) = 12e;
значит, на третьем уровне находится: 25 – 12 = 13e.
Получили распределение электронов в атоме
марганца:
Задание 3.8. Отработайте алгоритм, составив
схемы строения атомов для элементов № 16, 26, 33, 37.
Укажите, металлы это или неметаллы. Ответ
поясните.
Составляя приведенные выше схемы строения
атома, мы не учитывали, что электроны в атоме
занимают не только уровни, но и определенные подуровни
каждого уровня. Виды подуровней обозначаются
латинскими буквами: s, p, d.
Число возможных подуровней равно номеру
уровня. Первый уровень состоит из одного
s-подуровня. Второй уровень состоит из двух
подуровней – s и р. Третий уровень – из
трех подуровней – s, p и d.
На каждом подуровне может находиться строго
ограниченное число электронов:
на s-подуровне – не больше 2е;
на р-подуровне – не больше 6е;
на d-подуровне – не больше 10е.
Подуровни одного уровня заполняются в строго
определенном порядке: s p
d.
Таким образом, р-подуровнь не может начать
заполняться, если не заполнен s-подуровень
данного энергетического уровня, и т.д. Исходя из
этого правила, несложно составить электронную
конфигурацию атома марганца:
В целом электронная конфигурация атома марганца
записывается так:
25Мn 1s22s22p63s23p63d54s2.
Здесь и далее приняты следующие обозначения:
Задание 3.9. Составьте электронные
конфигурации атомов для химических элементов №
16, 26, 33, 37.
Для чего необходимо составлять электронные
конфигурации атомов? Для того, чтобы
определять свойства этих химических элементов.
Следует помнить, что в химических процессах
участвуют только валентные электроны.
Валентные электроны находятся на внешнем
энергетическом уровне и незавершенном
d-подуровне предвнешнего уровня.
Определим число валентных электронов для
марганца:
или сокращенно: Мn … 3d54s2.
Что можно определить по формуле электронной
конфигурации атома?
1. Какой это элемент – металл или неметалл?
Марганец – металл, т.к. на внешнем (четвертом)
уровне находится два электрона.
2. Какой процесс характерен для металла?
Атомы марганца в реакциях всегда только отдают
электроны.
3. Какие электроны и сколько будет отдавать атом
марганца?
В реакциях атом марганца отдает два внешних
электрона (они дальше всех от ядра и слабее
притягиваются им), а также пять предвнешних d-электронов.
Общее число валентных электронов – семь (2 + 5).
В этом случае на третьем уровне атома
останется восемь электронов, т.е. образуется
завершенный внешний уровень.
Все эти рассуждения и заключения можно
отразить при помощи схемы (рис. 6):
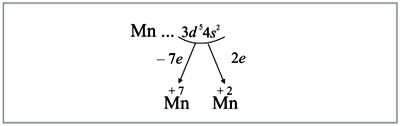 |
Рис. 6.
|
Полученные условные заряды атома
называют степенями окисления.
Рассматривая строение атома, аналогичным
способом можно показать, что типичными степенями
окисления для кислорода является –2, а для
водорода +1.
В о п р о с. С каким из химических
элементов может образовывать соединения
марганец, если учесть полученные выше степени
его окисления?
О т в е т. Только с кислородом, т.к. его атом
имеет противоположную по заряду степень
окисления. Формулы соответствующих оксидов
марганца (здесь степени окисления соответствуют
валентностям этих химических элементов):
Строение атома марганца подсказывает, что
большей степени окисления у марганца быть не
может, т.к. в этом случае пришлось бы
затрагивать устойчивый, теперь уже завершенный
предвнешний уровень. Поэтому степень окисления +7
является высшей, а соответствующий оксид Мn2О7
– высшим оксидом марганца.
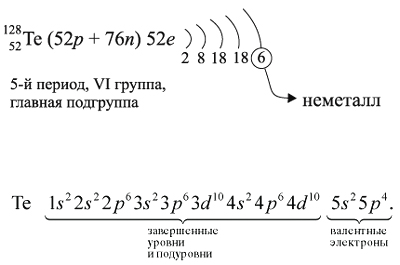
Для закрепления всех этих понятий рассмотрим
строение атома теллура и некоторые его свойства:
Как неметалл, атом Te может принять 2 электрона
до завершения внешнего уровня и отдать «лишние» 6
электронов:
Задание 3.10. Изобразите электронные
конфигурации атомов Nа, Rb, Cl, I, Si, Sn. Определите
свойства этих химических элементов, формулы их
простейших соединений (с кислородом и водородом).
Практические выводы
1. В химических реакциях участвуют только
валентные электроны, которые могут находиться
только на двух последних уровнях.
2. Атомы металлов могут только отдавать
валентные электроны (все или несколько), принимая
положительные степени окисления.
3. Атомы неметаллов могут принимать электроны
(недостающие – до восьми), приобретая при этом
отрицательные степени окисления, и отдавать
валентные электроны (все или несколько), при этом
они приобретают положительные степени
окисления.
Сравним теперь свойства химических элементов
одной подгруппы, например натрия и рубидия:
Nа …3s1 и Rb …5s1.
Что общего в строении атомов этих элементов?
На внешнем уровне каждого атома по одному
электрону – это активные металлы. Металлическая
активность связана со способностью отдавать
электроны: чем легче атом отдает электроны, тем
сильнее выражены его металлические свойства.
Что удерживает электроны в атоме? Притяжение их
к ядру. Чем ближе электроны к ядру, тем сильнее
они притягиваются ядром атома, тем труднее их
«оторвать».
Исходя из этого, ответим на вопрос: какой
элемент – Nа или Rb – легче отдает внешний
электрон? Какой из элементов является более
активным металлом? Очевидно, рубидий, т.к. его
валентные электроны находятся дальше от ядра (и
слабее удерживаются ядром).
Вывод. В главных подгруппах сверху вниз
металлические свойства усиливаются, т.к.
возрастает радиус атома, и валентные электроны
слабее притягиваются к ядру.
Сравним свойства химических элементов VIIa
группы: Cl …3s23p5 и I …5s25p5.
Оба химических элемента – неметаллы, т.к. до
завершения внешнего уровня не хватает одного
электрона. Эти атомы будут активно притягивать
недостающий электрон. При этом чем сильнее
притягивает атом неметалла недостающий
электрон, тем сильнее проявляются его
неметаллические свойства (способность принимать
электроны).
За счет чего происходит притяжение электрона?
За счет положительного заряда ядра атома.
Кроме того, чем ближе электрон к ядру, тем сильнее
их взаимное притяжение, тем активнее неметалл.
В о п р о с. У какого элемента сильнее
выражены неметаллические свойства: у хлора или
йода?
О т в е т. Очевидно, у хлора, т.к. его валентные
электроны расположены ближе к ядру.
Вывод. Активность неметаллов в подгруппах
сверху вниз убывает, т.к. возрастает радиус
атома и ядру все труднее притянуть недостающие
электроны.
Сравним свойства кремния и олова: Si …3s23p2
и Sn …5s25p2.
На внешнем уровне обоих атомов по четыре
электрона. Тем не менее эти элементы в
периодической системе находятся по разные
стороны от линии, соединяющей бор и астат.
Поэтому у кремния, символ которого находится
выше линии В–At, сильнее проявляются
неметаллические свойства. Напротив, у олова,
символ которого находится ниже линии В–At,
сильнее проявляются металлические свойства. Это
объясняется тем, что в атоме олова четыре
валентных электрона удалены от ядра. Поэтому
присоединение недостающих четырех электронов
затруднено. В то же время отдача электронов
с пятого энергетического уровня происходит
достаточно легко. Для кремния возможны оба
процесса, причем первый (прием электронов)
преобладает.
Выводы по главе 3. Чем меньше внешних
электронов в атоме и чем дальше они от ядра, тем
сильнее проявляются металлические свойства.
Чем больше внешних электронов в атоме и чем
ближе они к ядру, тем сильнее проявляются
неметаллические свойства.
Основываясь на выводах, сформулированных в
этой главе, для любого химического элемента
периодической системы можно составить
«характеристику».
Алгоритм описания свойств
химического элемента по его положению
в периодической системе
1. Составить схему строения атома, т.е.
определить состав ядра и распределение
электронов по энергетическим уровням и
подуровням:
• определить общее число протонов, электронов
и нейтронов в атоме (по порядковому номеру и
относительной атомной массе);• определить число энергетических уровней (по
номеру периода);• определить число внешних электронов (по виду
подгруппы и номеру группы);• указать число электронов на всех
энергетических уровнях, кроме предпоследнего;• рассчитать число электронов на
предпоследнем уровне.
2. Определить число валентных электронов.
3. Определить, какие свойства – металла или
неметалла – сильнее проявляются у данного
химического элемента.
4. Определить число отдаваемых (принимаемых)
электронов.
5. Определить высшую и низшую степени окисления
химического элемента.
6. Составить для этих степеней окисления
химические формулы простейших соединений с
кислородом и водородом.
7. Определить характер оксида и составить
уравнение его реакции с водой.
8. Для указанных в пункте 6 веществ составить
уравнения характерных реакций (см. главу 2).
Задание 3.11. По приведенной выше схеме
составить описания атомов серы, селена, кальция и
стронция и свойства этих химических элементов.
Какие общие свойства проявляют их оксиды и
гидроксиды?
Если вы выполнили упражнения 3.10 и 3.11, то
легко заметить, что не только атомы элементов
одной подгруппы, но и их соединения имеют общие
свойства и похожий состав.
Периодический закон Д.И.Менделеева:
свойства химических элементов, а также свойства
простых и сложных веществ, образованных ими,
находятся в периодической зависимости от заряда
ядер их атомов.
Физический смысл периодического закона: свойства
химических элементов периодически повторяются
потому, что периодически повторяются
конфигурации валентных электронов
(распределение электронов внешнего и
предпоследнего уровней).
Так, у химических элементов одной и той же
подгруппы одинаковое распределение валентных
электронов и, значит, похожие свойства.
Например, у химических элементов пятой группы
пять валентных электронов. При этом в атомах
химических элементов главных подгрупп – все
валентные электроны находятся на внешнем уровне:
… ns2np3, где n – номер
периода.
У атомов элементов побочных подгрупп на
внешнем уровне находятся только 1 или 2 электрона,
остальные – на d-подуровне предвнешнего
уровня: … (n – 1)d3ns2, где n
– номер периода.
Задание 3.12. Составьте краткие электронные
формулы для атомов химических элементов № 35 и 42,
а затем составьте распределение электронов в
этих атомах по алгоритму. Убедитесь, что ваше
предсказание сбылось.
Упражнения к главе 3
1. Сформулируйте определения понятий
«период», «группа», «подгруппа». Что общего у
химических элементов, которые составляют: а)
период; б) группу; в) подгруппу?
2. Что такое изотопы? Какие свойства –
физические или химические – совпадают у
изотопов? Почему?
3. Сформулируйте периодический закон
Д.И.Менделеева. Поясните его физический смысл и
проиллюстрируйте примерами.
4. В чем проявляются металлические
свойства химических элементов? Как они
изменяются в группе и в периоде? Почему?
5. В чем проявляются неметаллические
свойства химических элементов? Как они
изменяются в группе и в периоде? Почему?
6. Составьте краткие электронные формулы
химических элементов № 43, 51, 38. Подтвердите свои
предположения описанием строения атомов этих
элементов по приведенному выше алгоритму.
Укажите свойства этих элементов.
7. По кратким электронным формулам
а) …4s24p1;
б) …4d15s2;
в) …3d54s1
определите положение соответствующих
химических элементов в периодической системе
Д.И.Менделеева. Назовите эти химические элементы.
Свои предположения подтвердите описанием
строения атомов этих химических элементов по
алгоритму. Укажите свойства этих химических
элементов.
Продолжение следует
Атомно-молекулярное учение
Мы приступаем к изучению химии — мира молекул и атомов. В этой статье мы рассмотрим базисные понятия и разберемся с электронными
формулами элементов.
Атом (греч. а — отриц. частица + tomos — отдел, греч. atomos — неделимый) — электронейтральная частица вещества микроскопических
размеров и массы, состоящая из положительно заряженного ядра (протонов) и отрицательно заряженных электронов (электронные орбитали).
Описываемая модель атома называется «планетарной» и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом

Протон (греч. protos — первый) — положительно заряженная (+1) элементарная частица, вместе с нейтронами образует ядра атомов
элементов. Нейтрон (лат. neuter — ни тот, ни другой) — нейтральная (0) элементарная частица, присутствующая в ядрах всех
химических элементов, кроме водорода.
Электрон (греч. elektron — янтарь) — стабильная элементарная частица с отрицательным электрическим зарядом (-1), заряд атома —
порядковый номер в таблице Менделеева — равен числу электронов (и, соответственно, протонов).
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20)
в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.

Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило:
порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим
электроны занимают различные энергетические уровни.
Энергетические уровни подразделяются на несколько подуровней:
- Первый уровень
- Второй уровень
- Третий уровень
- Четвертый уровень
Состоит из s-подуровня: одной «1s» ячейки, в которой помещаются 2 электрона (заполненный электронами — 1s2)
Состоит из s-подуровня: одной «s» ячейки (2s2) и p-подуровня: трех «p» ячеек (2p6), на которых
помещается 6 электронов
Состоит из s-подуровня: одной «s» ячейки (3s2), p-подуровня: трех «p» ячеек (3p6) и d-подуровня:
пяти «d» ячеек (3d10), в которых помещается 10 электронов
Состоит из s-подуровня: одной «s» ячейки (4s2), p-подуровня: трех «p» ячеек (4p6), d-подуровня:
пяти «d» ячеек (4d10) и f-подуровня: семи «f» ячеек (4f14), на которых помещается 14
электронов

Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число
электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а
также узнаете об исключении, которое только подтверждает данные правила.
Подуровни: «s», «p» и «d», которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или
атомным орбиталям, движутся электроны, создавая определенный «рисунок».
S-орбиталь похожа на сферу, p-орбиталь напоминает песочные часы, d-орбиталь — клеверный лист.

Правила заполнения электронных орбиталей и примеры
Существует ряд правил, которые применяют при составлении электронных конфигураций атомов:
- Сперва следует заполнить орбитали с наименьшей энергией, и только после переходить к энергетически более высоким
- На орбитали (в одной «ячейке») не может располагаться более двух электронов
- Орбитали заполняются электронами так: сначала в каждую ячейку помещают по одному электрону, после чего орбитали дополняются
еще одним электроном с противоположным направлением - Порядок заполнения орбиталей: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было
бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Без практики теория мертва, так что приступает к тренировке. Нам нужно составить электронную конфигурацию атомов углерода и
серы. Для начала определим их порядковый номер, который подскажет нам число их электронов. У углерода — 6, у серы — 16.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.

Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил.
А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся
одним электроном дополнили первую ячейку.
Таким образом, электронные конфигурации наших элементов:
- Углерод — 1s22s22p2
- Серы — 1s22s22p63s23p4
Внешний уровень и валентные электроны
Количество электронов на внешнем (валентном) уровне — это число электронов на наивысшем энергетическом уровне, которого достигает элемент. Такие электроны называются валентными: они могут быть спаренными или неспаренными. Иногда
для наглядного представления конфигурацию внешнего уровня записывают отдельно:
- Углерод — 2s22p2 (4 валентных электрона)
- Сера -3s23p4 (6 валентных электронов)
Неспаренные валентные электроны способны к образованию химической связи. Их число соответствует количеству связей, которые данный атом может образовать с другими атомами. Таким образом неспаренные валентные электроны тесно связаны с валентностью — способностью атомов образовывать определенное число химических связей.

- Углерод — 2s22p2 (2 неспаренных валентных электрона)
- Сера -3s23p4 (2 неспаренных валентных электрона)
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных
электронов. Ниже будет дано наглядное объяснение этой задаче.

Запишем получившиеся электронные конфигурации магния и скандия:
- Магний — 1s22s22p63s2
- Скандий — 1s22s22p63s23p64s23d1
В целом несложная и интересная тема электронных конфигураций отягощена небольшим исключением — провалом электрона, которое только подтверждает общее
правило: любая система стремится занять наименее энергозатратное состояние.
Провал электрона
Провалом электрона называют переход электрона с внешнего, более высокого энергетического уровня, на предвнешний, энергетически более
низкий. Это связано с большей энергетической устойчивостью получающихся при этом электронных конфигураций.
Подобное явление характерно лишь для некоторых элементов: медь, хром, серебро, золото, молибден. Для примера выберем хром, и рассмотрим
две электронных конфигурации: первую «неправильную» (сделаем вид, будто мы не знаем про провал электрона) и вторую правильную, написанную
с учетом провала электрона.
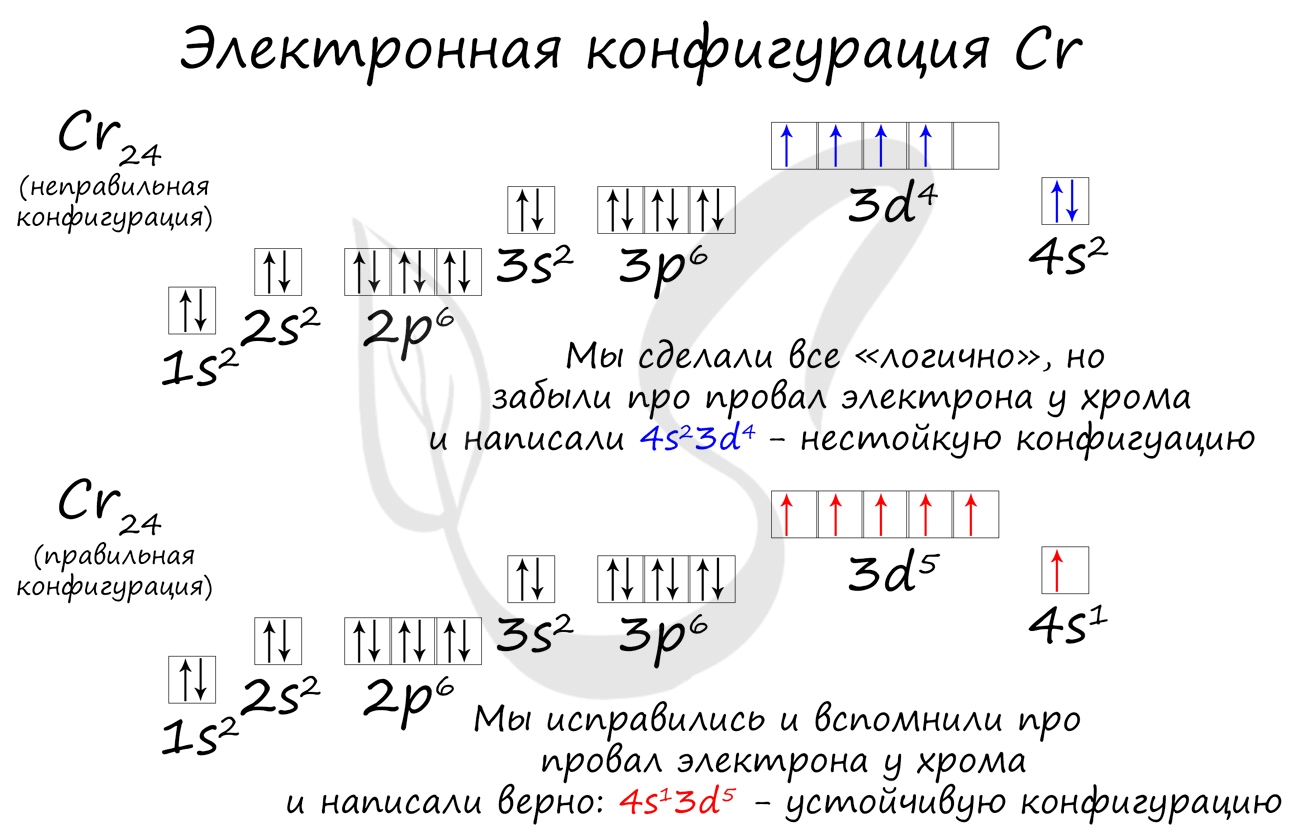
Теперь вы понимаете, что кроется под явлением провала электрона. Запишите электронные конфигурации хрома и меди самостоятельно еще раз и
сверьте с представленными ниже.

Основное и возбужденное состояние атома
Основное и возбужденное состояние атома отражаются на электронных конфигурациях. Возбужденное состояние связано с движением электронов
относительно атомных ядер. Говоря проще: при возбуждении пары электронов распариваются и занимают новые ячейки.
Возбужденное состояние является для атома нестабильным, поэтому долгое время в нем он пребывать не может. У некоторых атомов: азота,
кислорода , фтора — возбужденное состояние невозможно, так как отсутствуют свободные орбитали («ячейки») — электронам некуда перескакивать, к тому
же d-орбиталь у них отсутствует (они во втором периоде).
У серы возможно возбужденное состояние, так как она имеет свободную d-орбиталь, куда могут перескочить электроны. Четвертый энергетический
уровень отсутствует, поэтому, минуя 4s-подуровень, заполняем распаренными электронами 3d-подуровень.
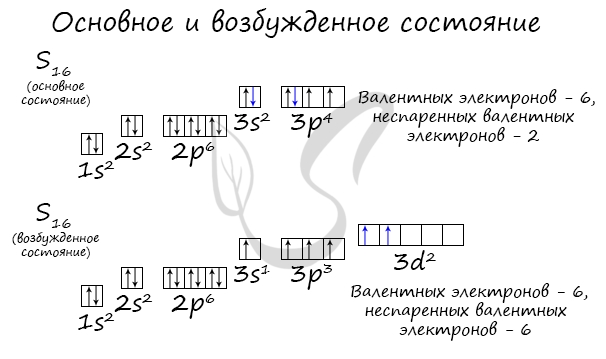
По мере изучения основ общей химии мы еще не раз вернемся к этой теме, однако хорошо, если вы уже сейчас запомните, что возбужденное состояние
связано с распаривание электронных пар.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Строение электронных оболочек атомов
На этом уроке вы узнаете, как устроена электронная оболочка атома, и сможете объяснить явление периодичности. Познакомитесь с моделями строения электронных оболочек атомов, с помощью которых можно предсказать и объяснить свойства химических элементов и их соединений.
I. Состояние электронов в атоме
Выдающийся датский физик Нильс Бор (Рис. 1) предположил, что электроны в атоме могут двигаться не по любым, а по строго определенным орбитам.
При этом электроны в атоме различаются своей энергией. Как показывают опыты, одни из них притягиваются к ядру сильнее, другие – слабее. Главная причина этого заключается в разном удалении электронов от ядра атома. Чем ближе электроны к ядру, тем они прочнее связаны с ним и их труднее вырвать из электронной оболочки. Таким образом, по мере удаления от ядра атома запас энергии электрона увеличивается.
Электроны, движущиеся вблизи ядра, как бы загораживают (экранируют) ядро от других электронов, которые притягиваются к ядру слабее и движутся на большем удалении от него. Так образуются электронные слои.
Каждый электронный слой состоит из электронов.
Электрон вращается вокруг ядра атома с невообразимой скоростью. Так, за 1 секунду он делает столько оборотов вокруг ядра атома, сколько оборотов делает пропеллер самолета вокруг оси за 5–5,5 лет непрерывной работы двигателя. Пропеллер самолета образует «облако», находящееся в одной плоскости, а электрон образует объемное облако –электронное облако, форма и размер которого зависят от энергии электрона.
Если обозначить точками все вероятные места нахождения электрона в атомном пространстве за некоторое время, то совокупность этих точек будет представлять собойэлектронное облако.
II. Электронное облако
Электронное облако – это модель, которая описывает состояние (движение) электрона в атоме.
Электронное облако не имеет строго очерченных границ и плотность его неравномерна.
Часть атомного пространства, в котором вероятность нахождения электрона наибольшая (~90%), называется орбиталью.
|
Виды электронных орбиталей |
Форма орбитали в пространстве |
Количество орбиталей в атоме. Условное обозначение орбитали – клетка: |
|||||||
|
s – орбиталь (электронное облако s – электрона) |
сфера (шар) |
Электронное облако такой формы может занимать в атоме одно положение (условное обозначение) |
|||||||
|
p – орбиталь (электронное облако p – электрона) |
гантель (восьмёрка) |
Электронное облако такой формы может занимать в атоме три положения вдоль осей координат пространства x, y и z. (условное обозначение) |
|||||||
|
d – орбиталь (электронное облако d – электрона) |
четырёхлепестковая форма |
Все d-орбитали (а их может быть уже пять) одинаковы по энергии, но по-разному расположены в пространстве. Да и по форме, напоминающей перевязанную лентами подушечку, одинаковы только четыре. (условное обозначение) |
|||||||
|
f – орбиталь (электронное облако f – электрона) |
сложная форма |
Электронное облако такой формы может занимать в атоме семь положений. (условное обозначение) |
Условное обозначение электрона – стрелка, направленная вверх↑ (электрон вращается вокруг собственной оси по часовой стрелке) или стрелка, направленная вниз↓ (электрон вращается вокруг собственной оси против часовой стрелки).
Число электронов в атоме определяют по порядковому номеру
О – 8 электронов, S – 16 электронов.
На одной орбитали могут находиться только ДВА электрона, которые вращаются вокруг своей оси в противоположных направлениях (по часовой стрелке и против часовой стрелке) – электроны с противоположными спинами:
Cледовательно, на s – орбитали максимально может разместиться два электрона (s2); на p – орбитали максимально может разместиться шесть электронов (p6) на d – орбитали максимально может разместиться десять электронов (d10); f – четырнадцать электронов (f14).
Располагаясь на различных расстояниях от ядра, электроны образуют электронные слои (энергетические уровни) – каждому слою соответствует определённый уровень энергии.
Условное обозначение уровня — скобка: )
Число энергетических уровней определяют по номеру периода, в котором находится химический элемент
О – 2 уровня, S – три уровня.
Для элементов главных подгрупп (А) число электронов на внешнем уровне = номеру группы.
+15P – V группа (А) – на внешнем уровне 5 электронов
Для элементов побочных подгрупп (В) число электронов на внешнем уровне = двум.
Исключения (один электрон) – хром, медь, серебро, золото и некоторые другие.
III. Формулы отражающие строение атомов первого и второго периодов
H +1 )1e
– схема строения атома, отображает распределение электронов по энергоуровням.
+1 Н 1s1
– электронная формула, отображает число электронов по орбиталям.
+1 Н
— электронно-графическая формула – показывает распределение электронов по орбиталям и отображает спин электрона.
У элементов второго периода начинается заполнение второго энергетического уровня — он включает восемь электронов (n = 2, N = 8). Второй период содержит восемь элементов. У неона, элемента, завершающего второй период, первый и второй энергетические уровни оказываются целиком заполненными.
Американский химик Гилберт Льюис дал объяснение этому и выдвинул правило октета, в соответствии с которым устойчивым является восьмиэлектронный слой (за исключением 1 слоя: т. к. на нем может находиться не более 2 электронов, устойчивым для него будет двухэлектронное состояние).
IV. Распределение электронов по энергетическим уровням элементов третьего и четвертого периодов ПСХЭ
1. Порядок заполнения уровней и подуровней электронами
Электронные формулы атомов химических элементов составляют в следующем порядке:
- Сначала по номеру элемента в таблице Д. И. Менделеева определяют общее число электронов в атоме;
- Затем по номеру периода, в котором расположен элемент, определяют число энергетических уровней;
- Уровни разбивают на подуровни и орбитали, и заполняют их электронами в соответствии Принципом наименьшей энергии
- Для удобства электроны можно распределить по энергетическим уровням, воспользовавшись формулой N=2n2 и с учётом того, что:
- У элементов главных подгрупп (s-;p-элементы) число электронов на внешнем уровне равно номеру группы.
- У элементов побочных подгрупп на внешнем уровне обычно дваэлектрона (исключение составляют атомы Cu, Ag, Au, Cr, Nb, Mo, Ru, Rh, у которых на внешнем уровне один электрон, у Pd на внешнем уровне нольэлектронов);
- Число электронов на предпоследнем уровне равно общему числу электронов в атоме минус число электронов на всех остальных уровнях.
Порядок заполнения электронами атомных орбиталей определяется:
Принципом наименьшей энергии
Шкала энергий:
1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f<5d<6p<7s…
2. Семейства химических элементов
Элементы, в атомах которых происходит заполнение электронами s-подуровня внешнегоэнергетического уровня, называются s-элементами. Это первые 2 элемента каждого периода, составляющие главные подгруппы I и II групп.
Элементы, в атомах которых электронами заполняется p-подуровень внешнегоэнергетического уровня, называются p-элементами. Это последние 6 элементов каждого периода (за исключением I и VII), составляющие главные подгруппы III—VIII групп.
Элементы, в которых заполняется d-подуровень второго снаружи уровня, называются d-элементами. Это элементы вставных декад IV, V, VI периодов.
Элементы, в которых заполняется f-подуровень третьего снаружи уровня, называются f-элементами. К f-элементам относятся лантаноиды и актиноиды.
В третьем периоде происходит заполнение третьего энергетического уровня. Третий уровень (n = 3) может максимально вмещать 18 электронов. Однако элементов в третьем периоде всего восемь. К концу третьего периода (у аргона) полностью заполняются 3s- и 3p-подуровни, а 3d-подуровень остается пустым, поэтому третий уровень не заполняется до конца.
В четвертом периоде у первых двух элементов (калия и кальция) электроны идут на четвертый энергетический уровень (4s-подуровень), а затем у последующих десяти элементов (от скандия до цинка) завершается заполнение третьего энергетического уровня (3d-подуровня).
«Проскок» или «провал» электрона
У атомов Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au имеет место «провал» электрона с s-подуровня внешнего слоя на d-подуровень предыдущего слоя, что приводит к энергетически более устойчивому состоянию атома. Например, электронная формула атома меди, исходя из вышенаписанного, должна иметь вид: Cu 1s22s22p63s23p64s23d9. Однако в действительности один из двух 4s-электронов «проваливается» на 3d-подуровень, и атом меди имеет следующую конфигурацию: 1s22s22p63s23p64s13d10.
Для элементов IБ-подгруппы характерна конфигурация внешнего слоя: ns1(n−1)d10.
Для элементов Cr и Mo характерна конфигурация внешнего слоя: ns1(n−1)d5.
Особо следует отметить палладий, у которого «проваливаются» два электрона:
Pd1s22s22p63s23p64s23d104p65s04d10
V. Тест
Решите тестовые задания (один верный вариант ответа).
1. Заряд ядра атома фосфора равен
а) +30
б) +31
в) +15
г) +5
2. Количество энергоуровней в атоме равно
а) порядковому номеру элемента;
б) номеру группы;
в) заряду ядра атома;
г) номеру периода
3. Число нейтронов в атоме цинка равно
а) 30
б) 35
в) 4
г) 2
4. В ряду элементов Na, Mg, Al, Cl металлические свойства
а) убывают;
б) возрастают;
в) не изменяются;
г) сначала убывают, а затем возрастают
5. Формула высшего оксида RO2 характерна для
а) Li
б) Br
в) C
г) N
6. Электронная формула строения атома меди, это-
а) 1s22s22p63s23p64s23d10;
б) 1s22s22p63s23p64s23d9;
в) 1s22s22p63s13p64s23d10;
г) 1s22s22p63s23p64s23d11.
7. Заряд ядра атома кальция равен
а) 20
б) 2
в) 40
г) 41
8. Число электронов на внешнем энергоуровне для элементов главных подгрупп равно
а) номеру периода;
б) номеру группы;
в) порядковому номеру элемента;
г) атомной массе.
9. Число нейтронов в атоме железа равно
а) 26
б) 55
в) 56
г) 30
10. В ряду элементов C, Si, Ge, Sn способность отдавать валентные электроны
а) уменьшается;
б) не изменяется;
в) увеличивается;
г) сначала увеличивается, а затем уменьшается.
11. Формула летучего водородного соединения для элемента с электронным строением атома 1s22s22p2 – это
а) RH4;
б) RH3;
в) RH2;
г) RH.
12. Электронная формула строения атома мышьяка, это-
а) 1s22s22p63s23p64s13d114p3;
б) 1s22s22p63s23p64s23d94p4;
в) 1s22s22p63s23p64s13d104p4;
г) 1s22s22p63s23p64s23d104p4.
Тренажер №1
Тренажер №2
Электронная конфигурация атома
Электронная конфигурация атома — это формула, показывающая расположение электронов в атоме по уровням и
подуровням. После изучения статьи Вы узнаете, где и как располагаются электроны, познакомитесь с квантовыми числами и
сможете построить электронную конфигурацию атома по его номеру, в конце статьи приведена таблица элементов.
Для чего изучать электронную конфигурацию элементов?
Атомы как конструктор: есть определённое количество деталей, они отличаются друг от друга, но две детали
одного типа абсолютно одинаковы. Но этот конструктор куда интереснее, чем пластмассовый и вот почему.
Конфигурация меняется в зависимости от того, кто есть рядом. Например, кислород рядом с водородом может
превратиться в воду, рядом с натрием в газ, а находясь рядом с железом вовсе превращает его в ржавчину.
Что бы ответить на вопрос почему так происходит и предугадать поведение атома рядом с другим необходимо
изучить электронную конфигурацию, о чём и пойдёт речь ниже.
Сколько электронов в атоме?
Атом состоит из ядра и вращающихся вокруг него электронов, ядро состоит из протонов и нейтронов. В нейтральном
состоянии у каждого атома количество электронов равно количеству протонов в его ядре. Количество
протонов обозначили порядковым номером элемента, например, сера, имеет 16 протонов — 16й элемент периодической
системы. Золото имеет 79 протонов — 79й элемент таблицы Менделеева. Соответственно, в сере в нейтральном
состоянии 16 электронов, а в золоте 79 электронов.
Где искать электрон?
Наблюдая поведение электрона были выведены определённые закономерности, они описываются
квантовыми числами, всего их четыре:
- Главное квантовое число
- Орбитальное квантовое число
- Магнитное квантовое число
- Спиновое квантовое число
Орбиталь
Далее, вместо слова орбита, мы будем использовать термин «орбиталь», орбиталь — это волновая функция электрона,
грубо — это область, в которой электрон проводит 90% времени.
N — уровень
L — оболочка
Ml — номер орбитали
Ms — первый или второй электрон на орбитали
Орбитальное квантовое число l
В результате исследования электронного облака, обнаружили, что в зависимости от уровня энергии,
облако принимает четыре основных формы: шар, гантели и другие две, более сложные.
В порядке возрастания энергии, эти формы называются s-,p-,d- и f-оболочкой.
На каждой из таких оболочек может располагаться 1 (на s), 3 (на p), 5 (на d) и 7 (на f)
орбиталей. Орбитальное квантовое число — это оболочка, на которой находятся
орбитали. Орбитальное квантовое число для s,p,d и f-орбиталей соответственно
принимает значения 0,1,2 или 3.
На s-оболочке одна орбиталь (L=0) — два электрона
На p-оболочке три орбитали (L=1) — шесть электронов
На d-оболочке пять орбиталей (L=2) — десять электронов
На f-оболочке семь орбиталей (L=3) — четырнадцать электронов
Магнитное квантовое число ml
На p-оболочке находится три орбитали, они обозначаются цифрами
от -L, до +L, то есть, для p-оболочки (L=1) существуют орбитали «-1», «0» и «1».
Магнитное квантовое число обозначается буквой ml.
Внутри оболочки электронам легче
располагаться на разных орбиталях, поэтому первые электроны заполняют по одному на каждую
орбиталь, а затем уже к каждому присоединяется его пара.
Рассмотрим d-оболочку:
d-оболочке соответствует значение L=2, то есть пять орбиталей (-2,-1,0,1 и 2), первые пять
электронов заполняют оболочку принимая значения Ml=-2,Ml=-1,Ml=0,
Ml=1,Ml=2.
Спиновое квантовое число ms
Спин — это направление вращения электрона вокруг своей оси, направлений два, поэтому спиновое квантовое число
имеет два значения: +1/2 и -1/2. На одном энергетическом подуровне могут находиться два электрона только с
противоположными спинами. Спиновое квантовое число обозначается ms
Главное квантовое число n
Главное квантовое число — это уровень энергии, на данный момент известны семь энергетических уровней,
каждый обозначается арабской цифрой: 1,2,3,…7. Количество оболочек на каждом уровне равно номеру уровня:
на первом уровне одна оболочка, на втором две и т.д.
Номер электрона
Итак, любой электрон можно описать четырьмя квантовыми числами, комбинация из этих чисел уникальна для каждой
позиции электрона, возьмём первый электрон, самый низкий энергетический уровень это N=1, на первом уровне
распологается одна оболочка, первая оболочка на любом уровне имеет форму шара (s-оболочка), т.е. L=0,
магнитное квантовое число может принять только одно значение, Ml=0 и спин будет равен +1/2.
Если мы возьмём пятый электрон (в каком бы атоме он не был), то главные квантовые числа для него будут:
N=2, L=1, M=-1, спин 1/2.
Энергетические уровни с подуровнями для наглядности изображены ниже, сверху вниз расположены уровни
и цветом разделены подуровни:
| 1 | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2 | |||||||||||||||||||
| 3 | |||||||||||||||||||
| 4 | |||||||||||||||||||
| 5 | |||||||||||||||||||
| 6 | |||||||||||||||||||
| 7 | |||||||||||||||||||
| 8 | |||||||||||||||||||
| Таблица 1. Распределение электронов по энергетическим уровням |
Здесь, сверху-вниз показаны энергетические уровни (1-7), слева-направо разделены по группам электронные
подуровни (s,p,d,f), в каждой ячейке располагаются по два электрона в противоположных направлениях. Общий
принцип распределения электронов такой, что энергетические подуровни заполняются в порядке суммы главного
и орбитального квантовых чисел, то есть: 1S, 2S, 2P, 3S, 3P, 4S, 3D и так далее, если сумма одинакова, то
сначала заполняется уровень с меньшим главным квантовым числом N.
У некоторых элементов имеются отклонения в формировании электронной конфигурации, а именно у
24Cr,
29Cu,
41Nb,
42Mo,
44Ru,
45Rh,
46Pd,
47Ag,
78Pt,
79Au
Элементы
Проверьте себя, составьте электронную конфигурацию для элементов #5, #9 и #22, затем проверьте себя по таблице ниже.
| № | Элемент | Название | Электронная конфигурация | Энергетических уровней |
|---|---|---|---|---|
| 1 | H | водород | 1s 1 | 1 |
| 2 | He | гелий | 1s 2 | 1 |
| 3 | Li | литий | 1s 22s 1 | 2 |
| 4 | Be | бериллий | 1s 22s 2 | 2 |
| 5 | B | бор | 1s 22s 22p 1 | 2 |
| 6 | C | углерод | 1s 22s 22p 2 | 2 |
| 7 | N | азот | 1s 22s 22p 3 | 2 |
| 8 | O | кислород | 1s 22s 22p 4 | 2 |
| 9 | F | фтор | 1s 22s 22p 5 | 2 |
| 10 | Ne | неон | 1s 22s 22p 6 | 2 |
| 11 | Na | натрий | 1s 22s 22p 63s 1 | 3 |
| 12 | Mg | магний | 1s 22s 22p 63s 2 | 3 |
| 13 | Al | алюминий | 1s 22s 22p 63s 23p1 | 3 |
| 14 | Si | кремний | 1s 22s 22p 63s 23p2 | 3 |
| 15 | P | фосфор | 1s 22s 22p 63s 23p3 | 3 |
| 16 | S | сера | 1s 22s 22p 63s 23p4 | 3 |
| 17 | Cl | хлор | 1s 22s 22p 63s 23p5 | 3 |
| 18 | Ar | аргон | 1s 22s 22p 63s 23p6 | 3 |
| 19 | K | калий | 1s 22s 22p 63s 23p64s 1 | 4 |
| 20 | Ca | кальций | 1s 22s 22p 63s 23p64s 2 | 4 |
| 21 | Sc | скандий | 1s 22s 22p 63s 23p64s 23d1 | 4 |
| 22 | Ti | титан | 1s 22s 22p 63s 23p64s 23d2 | 4 |
| 23 | V | ванадий | 1s 22s 22p 63s 23p64s 23d3 | 4 |
| 24 | Cr | хром | 1s 22s 22p 63s 23p64s 13d5 | 4 |
| 25 | Mn | марганец | 1s 22s 22p 63s 23p64s 23d5 | 4 |
| 26 | Fe | железо | 1s 22s 22p 63s 23p64s 23d6 | 4 |
| 27 | Co | кобальт | 1s 22s 22p 63s 23p64s 23d7 | 4 |
| 28 | Ni | никель | 1s 22s 22p 63s 23p64s 23d8 | 4 |
| 29 | Cu | медь | 1s 22s 22p 63s 23p64s 13d10 | 4 |
| 30 | Zn | цинк | 1s 22s 22p 63s 23p64s 23d10 | 4 |
| 31 | Ga | галлий | 1s 22s 22p 63s 23p64s 23d104p1 | 4 |
| 32 | Ge | германий | 1s 22s 22p 63s 23p64s 23d104p2 | 4 |
| 33 | As | мышьяк | 1s 22s 22p 63s 23p64s 23d104p3 | 4 |
| 34 | Se | селен | 1s 22s 22p 63s 23p64s 23d104p4 | 4 |
| 35 | Br | бром | 1s 22s 22p 63s 23p64s 23d104p5 | 4 |
| 36 | Kr | криптон | 1s 22s 22p 63s 23p64s 23d104p6 | 4 |
| 37 | Rb | рубидий | 1s 22s 22p 63s 23p64s 23d104p65s1 | 5 |
| 38 | Sr | стронций | 1s 22s 22p 63s 23p64s 23d104p65s2 | 5 |
| 39 | Y | иттрий | 1s 22s 22p 63s 23p64s 23d104p65s24d1 | 5 |
| 40 | Zr | цирконий | 1s 22s 22p 63s 23p64s 23d104p65s24d2 | 5 |
| 41 | Nb | ниобий | 1s 22s 22p 63s 23p64s 23d104p65s14d4 | 5 |
| 42 | Mo | молибден | 1s 22s 22p 63s 23p64s 23d104p65s14d5 | 5 |
| 43 | Tc | технеций | 1s 22s 22p 63s 23p64s 23d104p65s24d5 | 5 |
| 44 | Ru | рутений | 1s 22s 22p 63s 23p64s 23d104p65s14d7 | 5 |
| 45 | Rh | родий | 1s 22s 22p 63s 23p64s 23d104p65s14d8 | 5 |
| 46 | Pd | палладий | 1s 22s 22p 63s 23p64s 23d104p64d10 | 5 |
| 47 | Ag | серебро | 1s 22s 22p 63s 23p64s 23d104p65s14d10 | 5 |
| 48 | Cd | кадмий | 1s 22s 22p 63s 23p64s 23d104p65s24d10 | 5 |
| 49 | In | индий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p1 | 5 |
| 50 | Sn | олово | 1s 22s 22p 63s 23p64s 23d104p65s24d105p2 | 5 |
| 51 | Sb | сурьма | 1s 22s 22p 63s 23p64s 23d104p65s24d105p3 | 5 |
| 52 | Te | теллур | 1s 22s 22p 63s 23p64s 23d104p65s24d105p4 | 5 |
| 53 | I | йод | 1s 22s 22p 63s 23p64s 23d104p65s24d105p5 | 5 |
| 54 | Xe | ксенон | 1s 22s 22p 63s 23p64s 23d104p65s24d105p6 | 5 |
| 55 | Cs | цезий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s1 | 6 |
| 56 | Ba | барий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s2 | 6 |
| 57 | La | лантан | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s25d1 | 6 |
| 58 | Ce | церий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f2 | 6 |
| 59 | Pr | празеодим | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f3 | 6 |
| 60 | Nd | неодим | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f4 | 6 |
| 61 | Pm | прометий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f5 | 6 |
| 62 | Sm | самарий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f6 | 6 |
| 63 | Eu | европий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f7 | 6 |
| 64 | Gd | гадолиний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f75d1 | 6 |
| 65 | Tb | тербий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f9 | 6 |
| 66 | Dy | диспрозий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f10 | 6 |
| 67 | Ho | гольмий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f11 | 6 |
| 68 | Er | эрбий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f12 | 6 |
| 68 | Tm | тулий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f13 | 6 |
| 70 | Yb | иттербий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f14 | 6 |
| 71 | Lu | лютеций | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d1 | 6 |
| 72 | Hf | гафний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d2 | 6 |
| 73 | Ta | тантал | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d3 | 6 |
| 74 | W | вольфрам | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d4 | 6 |
| 75 | Re | рений | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d5 | 6 |
| 76 | Os | осмий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d6 | 6 |
| 77 | Ir | иридий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d7 | 6 |
| 78 | Pt | платина | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s14f145d9 | 6 |
| 79 | Au | золото | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s14f145d10 | 6 |
| 80 | Hg | ртуть | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d10 | 6 |
| 81 | Tl | таллий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p1 | 6 |
| 82 | Pb | свинец | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p2 | 6 |
| 83 | Bi | висмут | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p3 | 6 |
| 84 | Po | полоний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p4 | 6 |
| 85 | At | астат | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p5 | 6 |
| 86 | Rn | радон | 1s 22s 22p 63s 23p64s 23d104p65s14d105p66s24f145d106p6 | 6 |
| 87 | Fr | франций | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s1 | 7 |
| 88 | Ra | радий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s2 | 7 |
| 89 | Ac | актиний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s26d1 | 7 |
| 90 | Th | торий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s26d25f0 | 7 |
| 91 | Pa | протактиний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f26d1 | 7 |
| 92 | U | уран | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f36d1 | 7 |
| 93 | Np | нептуний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f46d1 | 7 |
| 94 | Pu | плутоний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f56d1 | 7 |
| 95 | Am | америций | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f7 | 7 |
| 96 | Cm | кюрий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f76d1 | 7 |
| 97 | Bk | берклий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f86d1 | 7 |
| 98 | Cf | калифорний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f10 | 7 |
| 99 | Es | эйнштейний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f11 | 7 |
| 100 | Fm | фермий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f12 | 7 |
| 101 | Md | менделеевий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f13 | 7 |
| 102 | No | нобелий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f14 | 7 |
| 103 | Lr | лоуренсий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d1 | 7 |
| 104 | Rf | резерфордий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d2 | 7 |
| 105 | Db | дубний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d3 | 7 |
| 106 | Sg | сиборгий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d4 | 7 |
| 107 | Bh | борий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d5 | 7 |
| 108 | Hs | хассий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d6 | 7 |
| 109 | Mt | мейтнерий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d7 | 7 |
| 110 | Ds | дармштадтий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d8 | 7 |
| 111 | Rg | рентгений | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d9 | 7 |
| 112 | Cn | коперниций | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d10 | 7 |
| 113 | Nh | нихоний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d107p1 | 7 |
| 114 | Fl | флеровий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d107p2 | 7 |
| 115 | Mc | московий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d107p3 | 7 |
| 116 | Lv | ливерморий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d107p4 | 7 |
| 117 | Ts | теннесcин | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d107p5 | 7 |
| 118 | Og | оганесон | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d107p6 | 7 |
| Таблица 2. Электронная конфигурация атомов |
Если Вы хотите узнать, как составить электронную конфигурацию, обратитесь к статье
«как написать электронную конфигурацию»
Квантовые числа электронов в атомах