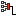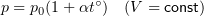Тема: Определить число молей одноатомного идеального газа (Прочитано 10146 раз)
0 Пользователей и 1 Гость просматривают эту тему.
kirill5555
Определить число молей одноатомного идеального газа, если известно, что при температуре 500 К его внутренняя энергия составляет 249,3 кДж.
Записан
Kivir
Решение: внутренняя энергия идеального одноатомного газа определяется:
[ U=frac{3}{2}cdot nu cdot Rcdot T, ]
Здесь R = 8,31 Дж/(моль∙К) – универсальная газовая постоянная, ν – искомое количество вещества. Получаем:
[ nu =frac{2cdot U}{3cdot Rcdot T}, ]
Ответ: 40 моль
Записан
Содержание
- 1 Внутренняя энергия идеального одноатомного газа равна U = 15 кДж при температуре Т = 300 оК. Определить количество молей газа
- 2 Определить количество молей одноатомного газа
- 3 Определить количество молей одноатомного газа
- 4 Термодинамика
- 5 Определить количество молей одноатомного газа
- 6 Сколько молей одноатомного газа нагрели на 10 К, если количество подведенной
- 7 Определить количество молей одноатомного газа
- 8 Какое количество теплоты нужно передать 2 моль идеального одноатомного газа, чтобы изобарно увеличить его объем в 3 раза
- 9 Определить количество молей одноатомного газа
Внутренняя энергия идеального одноатомного газа равна U = 15 кДж при температуре Т = 300 оК. Определить количество молей газа
Ваш ответ
Условие задачи:
Сколько молей одноатомного газа нагрели на 10 К, если количество подведенной теплоты равно 249 Дж? Процесс нагревания изохорический.
Задача №5.5.19 из «Сборника задач для подготовки к вступительным экзаменам по физике УГНТУ»
(Delta T=10) К, (Q=249) Дж, (V=const), (nu-?)
Ответ: 2 моль.
Если Вы не поняли решение и у Вас есть какой-то вопрос или Вы нашли ошибку, то смело оставляйте ниже комментарий.
Определить количество молей одноатомного газа
Пять молей идеального одноатомного газа совершают процесс, график которого изображён на рисунке. Определите, какое количество теплоты было передано газу в этом процессе. Ответ выразите в кДж и округлите до десятых долей.
На графике изображен изохорный процесс, а значит, работа газа равна нулю. Согласно первому началу термодинамики, количество теплоты, переданное газу в этом процессе пойдет только на увеличение внутренней энергии газа.
Определить количество молей одноатомного газа
Материал
предоставлен
Е.И.Шабалиным
(www.reppofiz.info)
и другими авторами
Реальные задачи с решениями. МКТ и термодинамика. Часть «С».
2011 год 109 вариант СЗ
В сосуде лежит кусок льда. Температура льда t1 = 0°С. Если сообщить ему количество теплоты Q = 50 кДж, то 3/4 льда растает. Какое количество теплоты q надо после этого сообщить содержимому сосуда дополнительно, чтобы весь лёд растаял и образовавшаяся вода нагрелась до температуры t2 = 20°С? Тепловыми потерями на нагрев сосуда пренебречь. (Решение)
2011 год. 01-2 вариант. С3
В бутылке объемом V = 1 л находится гелий при нормальном атмосферном давлении. Горлышко бутылки площадью S = 2 см 2 заткнуто короткой пробкой, имеющей массу m = 20 г. Если бутылка лежит горизонтально, то для того, чтобы медленно вытащить из ее горлышка пробку, нужно приложить к пробке горизонтально направленную силу F = 1 Н. Бутылку поставили на стол вертикально горлышком вверх. Какое количество теплоты нужно сообщить гелию в бутылке для того, чтобы он выдавил пробку из горлышка? (Решение)
2011 год. 01-1 вариант. С3
Один моль идеального одноатомного газа переводят из состояния 1 с температурой Т1 = 300 К в состояние 2 таким образом, что в течение всего процесса давление газа возрастает прямо пропорционально его объему. В ходе этого процесса газ получает количество теплоты Q = 14958 Дж. Во сколько раз n уменьшается в результате этого процесса плотность газа? (Решение)

В кабинете физики проводились опыты с разреженным газом постоянной массы. По невнимательности ученик, отметив на графике начальное и конечное состояния газа (см. рисунок), не указал, какие две величины из трёх (давление р, объём V, температура Т) отложены по осям. В журнале осталась запись, согласно которой названные величины изменялись следующим образом: p1 V2, Τ1 -4 м 2
, закрытое предохранительным клапаном. Клапан удерживается в закрытом состоянии невесомым стержнем длиной 0,5 м, который может свободно поворачиваться вокруг оси в точке А (см. рисунок). Расстояние АВ равно 0,1 м. К свободному концу стержня подвешен груз массой 2 кг. Клапан открывается через 580 с работы насоса, если в начальный момент времени давление воздуха в цилиндре было равно атмосферному. Температура воздуха в цилиндре и снаружи не меняется и равна 300 К. Определите объём цилиндра. (Решение)
2009 год. 133 вариант. С1
В цилиндрическом сосуде под поршнем длительное время находятся вода и ее пар. Поршень начинают вдвигать в сосуд. При этом температура воды и пара остается неизменной. Как будет меняться при этом масса жидкости в сосуде? Ответ поясните. (Решение)

Один моль одноатомного идеального газа переходит из состояния 1 в состояние 3 в соответствии с графиком зависимости его объёма V от температуры T (T = 100 К). На участке 2 − 3 к газу подводят 2,5 кДж теплоты. Найдите отношение работы газа А123 ко всему количеству подведенной к газу теплоты Q123. (Решение)

Постоянная масса одноатомного идеального газа совершает циклический процесс, показанный на рисунке. За цикл от нагревателя газ получает количество теплоты QH = 8 кДж. Какую работу совершают внешние силы при переходе газа из состояния 2 в состояние 3? (Решение)

Разогретый сосуд прикрыли поршнем, который с помощью вертикальной нерастяжимой нити соединили с потолком. На сколько процентов от начальной понизится температура воздуха в сосуде к моменту, когда сосуд оторвется от поверхности, на которой он расположен? Масса сосуда 5 кг. Поршень может скользить по стенкам сосуда без трения. Площадь дна сосуда 125 см 2 . Атмосферное давление 10 5 Па. Тепловым расширением сосуда и поршня пренебречь. (Решение)
2008 год. 5941 вариант. С2
В калориметре находился m1 = 1 кг льда при температуре t1 = -5°С. После добавления в калориметр m2 = 25 г воды в нем установилось тепловое равновесие при температуре t = 0°С. Какова температура t2 добавленной в калориметр воды, если в калориметре оказался в итоге только лёд? Теплоёмкостью калориметра пренебречь. (Решение)
2008 год. 05205939 вариант. С2
В горизонтально расположенной трубке постоянного сечения, запаянной с одного конца, помещен столбик ртути длиной 15 см, который отделяет воздух в трубке от атмосферы. Трубку расположили вертикально запаянным концом вниз. На сколько градусов следует нагреть воздух в трубке, чтобы объём, занимаемый воздухом, стал прежним? Температура воздуха в лаборатории 300 К, а атмосферное давление составляет 750 мм рт.ст. (Решение)

Вертикально расположенный замкнутый цилиндрический сосуд высотой 50 см разделен подвижным поршнем весом 110 Н на две части, в каждой из которых содержится одинаковое количество водорода при температуре 361 К. Какая масса газа находится в каждой части цилиндра, если поршень находится на высоте 20 см от дна сосуда? Толщиной поршня пренебречь. (Решение)
2007 год. 19 вариант. С2
В сосуде находится одноатомный идеальный газ, масса которого 12 г, а молярная масса 0,004 кг/моль. Вначале давление в сосуде было равно 4•10 5 Па при температуре 400 К. После охлаждения газа давление понизилось до 2•10 5 Па. Какое количество теплоты отдал газ? (Решение)
2006 год. 61 вариант. С2
В водонепроницаемый мешок, лежащий на дне моря на глубине 73,1 м, закачивается сверху воздух. Вода вытесняется из мешка через нижнее отверстие, и когда объём воздуха в мешке достигает 28,0 м 3 — мешок всплывает вместе с прикреплённым к нему грузом. Масса оболочки мешка 2710 кг. Определите массу груза. Температура воды равна 7°С, атмосферное давление на уровне моря равно 10 5 Па. Объёмом груза и стенок мешка пренебречь. (Решение)
2006 год. 86 вариант. С2
Теплоизолированный сосуд объемом V = 2 м 3 разделен теплоизолирующей перегородкой на две равные части. В одной части сосуда находится 2 моль гелия, а в другой — такое же количество молей аргона. Начальная температура гелия равна 300 К, а температура аргона 600 К. Определите давление смеси после удаления перегородки. Теплоемкостью сосуда пренебречь. (Решение)
2006 год. 33 вариант. С2
Воздушный шар объемом 2500 м 3 с массой оболочки 400 кг имеет внизу отверстие, через которое воздух в шаре нагревается горелкой. Температура окружающего воздуха 7°С, его плотность 1,2 кг/м 3 . При какой минимальной разности температур воздуха внутри шара и снаружи шар взлетит вместе с грузом (корзиной и воздухоплавателем) массой 200 кг? Оболочку шара считать нерастяжимой. (Решение)

С одним молем идеального одноатомного газа совершают процесс 1-2-3-4, показанный на рисунке в координатах V-Т. Во сколько раз количество теплоты, полученное газом в процессе 1-2-3-4, больше работы газа в этом процессе? (Решение)

Идеальный одноатомный газ в количестве 1 моль сначала изотермически расширился при температуре T1 = 300 К. Затем газ изобарно нагрели, повысив температуру в 3 раза. Какое количество теплоты получил газ на участке 2-3? (Решение)

10 моль одноатомного идеального газа сначала охладили, уменьшив давление в 3 раза, а затем нагрели до первоначальной температуры 300 К (см. рисунок). Какое количество теплоты получил газ на участке 2-3? (Решение)

Идеальный одноатомный газ используется в качестве рабочего тела в тепловом двигателе. В ходе работы двигателя состояние газа изменяется в соответствии с циклом, состоящим из двух адиабат и двух изохор (см. рисунок). Вычислите КПД такого двигателя. (Решение)
2004 год. 49 вариант. С5
При электролизе воды образуется кислород О2 и водород Н2. Газы отводят в сосуд объёмом 100 л, поддерживая в нём температуру 300 К. Чему равна масса воды, которая разложилась в результате электролиза, чтобы суммарное давление в сосуде достигло 0,1 атм? Считать, что ничего не взрывается. (Решение)
2004 год. 35 вариант. С5
Смесь одинаковых масс гелия, водорода и азота помещена в сосуд и нагрета до температуры 350 К. Плотность смеси оказалась равной 50 г/м 3 . Чему равно давление в сосуде? (Решение)
Термодинамика
На рисунке показан циклический процесс постоянное количество одноатомного газа. Работу, которую совершают внешние силы при переходе газа из состояния 2 в состояние 3, равна 5 кДж. Какое количество теплоты газ отдаёт за цикл холодильнику? Ответ дайте в кДж
Работа внешних сил в процессе 2–3 равна площади под графиком. [A_=dfracleft(3V_0-V_0right)=3p_0V_0] (p) – давление, (V) – объем газа, (nu) – количество вещества, (T) – температура газа в Кельвинах.
Воспользуемся первым законом термодинамики [|Q_>|=|Q_|=Delta U_+A_=dfracleft( nu R T_2 -nu R T_3right)+ 3p_0V_0quad (1)] Также по уравнению Клапейрона – Менделеева [p_2V_2=nu R T_2= 2p_0 cdot 3V_0 =6p_0V_0 quad (2)] [p_2V_2=nu R T_3=p_0V_0 quad (3)] Подставим в (1) формулы (2) и (3) [|Q_>|=dfracleft(6p_0V_0-p_0V_0right)+3p_0V_0= dfracp_0V_0=dfracA_=3,5 cdot 5text =17,5text]+2p_0>
Одно и то же постоянное количество одноатомного идеального газа расширяется из одного и того же начального состояния (p_1) , (V_1 ) до одного и того же конечного объёма (V_2) первый раз по изобаре 1–2, а второй – по адиабате 1–3 (см. рисунок). Отношение количества теплоты (Q_) , полученного газом от нагревателя в ходе процесса 1–2, к модулю изменения внутренней энергии газа в ходе процесса 1–3 равно k = 5. Определите отношение (dfrac>>) работы газа в процессе 1–2 к работе газа в процессе 1–3.
Запишем уравнение Клапейрона–Менделеева [pV=nu RT] По первому закону термодинамики количество теплоты, получееное телом в процессе 1–2 равно [Q=Delta U +A,] где (Q) – количество теплоты, полученное системой, (Delta U) – изменение внутренней энергии системы, (A) – работа газа.
Или с учетом уравнения Клапейрона–Менделеева [Q_=U_2-U_1+A=dfracleft(nu RT_2-nu R T_1right)+ p_1 left(V_2-V_1right) =dfrac p_1 left(V_2-V_1right)+ p_1 left(V_2-V_1right)=dfrac p_1 left(V_2-V_1right)=dfracA_] Процесс 1–3 адиабатный, а значит работа газа равна [A_=|Delta U|=|U_3-U_1|] [dfrac=dfraccdot dfrac>=dfraccdot 5 =2]
В тепловом двигателе 2 моль гелия совершают цикл 1–2–3–4–1, показанный на графике в координатах (р—Т) , где ( р) – давление газа, ( Т ) – абсолютная температура. Температуры в точках 2 и 4 равны и превышают температуру в точке 1 в 2 раза. Определите КПД цикла.
1. КПД находится по формуле: [eta=dfrac] где (A) – работа газа, (Q) – количество теплоты, полученное нагревателем.
2.Перерисуем данный график в коорданатах (p-V) 
Согласно закону Шарля и условию, что (2T_1=T_2) [dfrac=dfracRightarrow 2p_1=p_3=p_2] Согласно закону Гей-Люссака и условию, что (T_4=T_2=2T_1) [dfrac=dfracRightarrow V_3 = V_4 = 2V_1] 4.Работа, совершённая газом за цикл, численно равна площади фигуры под графиком в координатах (p-V) [A=(p_2-p_-1)(V_4-V_2)=p_1V_1] 5. Газ получает положительное количество теплоты на участках 1–2 и 2–3 [Q=Q_+Q_] 6. По первому закону термодинамики количество теплоты, полученое телом в процессе 1–2 равно изменению внтуренней энергии в этом процессе [Q_=Delta U_ =dfrac left(nu RT_2-nu RT_1right)=dfrac nu R T_1,] Для процесса 2–3 первый закон термодинамики выглядит следующим образом [Q_23=Delta U_+A_=dfrac left(nu RT_3-nu RT_2right)+p_2left(V_3-V_2right)] С учетом уравнения Клапейрона–Менделеева [pV=nu R T] получим [Q_=dfracp_1V_1 hspace Q_=5p_1V_1] 7. Тогда КПД равен [eta=dfracp_1V_1 +5p_1V_1 >approx 15,4 %]
Два одинаковых теплоизолированных сосуда соединены короткой трубкой с краном. В первом сосуде находится (nu_1) =3 моль гелия при температуре (T_1 = 350) К, во втором (nu_2) = 2 моль аргона при температуре (T_2 = 400) К. Кран открывают. В установившемся равновесном состоянии давление в сосудах становится (p = 6 ) кПа. Определите объём (V ) одного сосуда. Объёмом трубки пренебречь. Ответ дайте в м (^3) и округлите до тысячных.
Так как сосуды теплоизолированные, а газ не совершает работы, то изменение внутренней энергии равно 0, то есть [U_1+U_2=U] где (U_1) – внутренняя энергия первого сосуда, (U_2) – внтуренняя энергия второго сосуда, (U) – внутренняя энергия сосудов после открытия краника.
Или [dfracnu_1R T_1+dfracnu_2RT_2=dfracleft(nu_1+nu_2right)RT] Отсюда установившаяся температура [T=dfrac] По закону Клапейрона – Менделеева [p2V=left(nu_1+nu_2right)RT] Отсюда объем одного сосуда [V=dfrac=dfrac cdot 350text+2text cdot 400textright)cdot 8,31 text>>approx 1,28text]
Цикл тепловой машины, рабочим веществом которой является (nu) молей идеального одноатомного газа, состоит из изотермического расширения, изохорного охлаждения и адиабатического сжатия. Работа, совершённая газом в изотермическом процессе, равна (A) , а КПД тепловой машины равен (eta) . Максимальная температура в этом цикле равна (T_o) . Определите минимальную температуру (T) в этом циклическом процессе. Ответ дайте в Кельвинах
В гладком вертикальном цилиндре под подвижным поршнем массой (M) и площадью (S) находится идеальный одноатомный газ. Поршень в равновесии располагается на высоте (h) над дном цилиндра. После сообщения газу количества теплоты (Q) поршень приподнялся, а газ нагрелся. Найдите, на какой высоте (H) над дном цилиндра находится поршень. Давление в окружающей цилиндр среде равно (p_o) .
Рассматриваемый процесс — изобарный (так как поршень подвижный и количество вещества газа не изменяется).
Запишем первое начало термодинамики для изобраного процесса: [; ; ; ; Q = A+Delta U ; ; ; ; (1)] где (A) — работа газа, (Delta U) — изменение внутренней энергии газа.
Работа газа и изменение его внутренней энергии равны: [; ; ; ; A = pDelta V ; ; ; ; (2) ; ; ; ; ; ; ; ; ; ; ; Delta U = dfracnu RDelta T ; ; ; ; (3)] где (p) — давление газа под поршнем, (Delta V) — изменение объема газа, (i) — число степеней свободы (для одноатомного газа (i = 3) ), (nu) — количество вещества газа, (R) — универсальная газовая постоянная, (Delta T) — изменение температуры газа.
Подставим (2), (3) в (1): [Q = pDelta V + dfracnu RDelta T] Для изобраного процесса справедливо равенство: (pDelta V = nu RDelta T) .
Тогда уравнение (4) примет вид: [; ; ; ; Q = pDelta V + dfracpDelta V = dfracpDelta V ; ; ; ; (5)] Давление внутри сосуда складывается из атмосферного давления и давления, оказываемого порш12 нем (так как у него есть масса): [; ; ; ; p = p_o + dfrac; ; ; ; (6)] где (g) — ускорение свободного падения.
Изменение объема, занимаемого газом, после сообщения теплоты равно: [; ; ; ; Delta V = (H-h)S ; ; ; ; (7)] Подставим (6), (7) в (5) и выразим высоту, на которой будет находиться поршень над дном цилиндра: [Q = dfracleft( p_o + dfracright) (H-h)S] [H=h+dfrac]
1 моль идеального одноатомного газа сначала изотермически расширили. Затем изохорно нагрели, при этом его его давление возросло в 3 раза (см. рисунок). Какое количество теплоты получил газ на участке 2–3, если (T_1=100) К? Ответ дайте в Дж.
1. Воспользуемся первым законом термодинамики [Q=Delta U+A,] где (Q) – количество теплоты, полученное системой, (Delta U) – изменение внутренней энергии системы, (A) – работа газа.
Так как процесс изохорный, то работа газа равна 0. Распишем изменение внутренней энергии и получим [Q=dfracnu R Delta T=dfracnu R left(T_3-T_2right)] 2. Воспользуемся законом Шарля [dfrac=dfracRightarrow T_3=dfrac=3T_2] 3. По условию процесс 1–2 изотермический, значит [T_1=T_2] Следовательно, первый закон термодинамики выглядит [Q=dfracnu R left(3T_1-T_1right)=3nu R T_1= 3cdot 1 text cdot 8,31 textcdot 100text=2493text]
Определить количество молей одноатомного газа
решение вопроса
- Все категории
- экономические 42,694
- гуманитарные 33,415
- юридические 17,860
- школьный раздел 592,144
- разное 16,674
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Сколько молей одноатомного газа нагрели на 10 К, если количество подведенной
Разделы 
Решение задачи:
Чтобы найти количество подведённой теплоты (Q), запишем первое начало термодинамики:
Изменение внутренней энергии одноатомного идеального газа (Delta U) можно определить по такой формуле:
Работа газа (A) в изохорическом процессе ((V=const)) равна нулю, поскольку газ не изменяет в таком процессе своего объема.
Формула (1) с учётом полученных выражений (2) и (3) примет вид:
[Q = fracnu RDelta T]
Откуда выразим количество вещества (nu):
Задача решена, теперь подставим численные значения величин в формулу и посчитаем ответ:
Дополнительно
Задача по физике — 3689
На сколько увеличится внутренняя энергия одноатомного идеального газа в процессе изобарического расширения, если газу сообщили при этом количество теплоты $Q = 30 кДж$?
Задача по физике — 3690
Некоторое количество идеального одноатомного газа участвует в процессе, в ходе которого сначала давление газа изохорически увеличили $n = 2$ раза, а затем его объем изобарически увеличили в $k = 3$ раза. Какое количество теплоты сообщают газу в указанном процессе? Начальное давление и объем газа $p_ = 10^ Па$ и $V_ = 100 л$ соответственно.
Задача по физике — 3691
Водород массой $m = 0,5 кг$ участвует в процессе, в ходе которого сначала его давление изохорически уменьшают в $n = 5$ раз, а затем его объем изобарически увеличивают таким образом, что начальная и конечная температуры газа в процессе совпадают. Молярная масса водорода $mu = 2 г/моль$. Какую работу совершил газ в указанном процессе, если его начальная температура $T_ = 500 К$?
Задача по физике — 3692
При изобарном расширении $m = 20 г$ водорода его объем увеличился в $n = 2$ раза. Начальная температура газа $T = 300 К$. Определите работу газа при расширении. Молярная масса водорода $mu = 2 г/моль$.
Задача по физике — 3693
В теплоизолированный цилиндрический сосуд, закрытый легко перемещающимся практически невесомым поршнем, поместили $nu$ молей атомарного газа при температуре $T_$. Начальный объем газа — $V_$. В результате поршень двигается до тех пор, пока объем газа не увеличится до $V$. Во сколько раз уменьшилась при этом температура газа, если давление окружающей среды остается постоянным. Газ — идеальный.
Задача по физике — 3694
Один моль одноатомного газа, имевшего температуру $0^ С$, нагревается при постоянном давлении. Какое количество теплоты необходимо сообщить газу, чтобы его объем удвоился? Какая работа при этом будет совершена газом?
Задача по физике — 3695
В теплоизолированный сосуд поместили $nu_$ молей атомарного газа при температуре $T_$ и $nu_$ молей при температуре $T_$. Определить установившуюся температуру газа. Газ — идеальный.
Задача по физике — 3696
Считая известной молярную теплоемкость газа при постоянном объеме $c_$, вывести формулы для величины молярной теплоемкости идеального газа для процессов, описываемых законами:
a) $p = frac$;
б) $V = frac$;
в) $V = alpha T^$;
г) $p = alpha V$.
В этих формулах $p, V, T$ — давление, объем и температура (по абсолютной шкале) газа соответственно; $alpha$ — некоторая изначально заданная константа.
Задача по физике — 3697
Один моль идеального одноатомного газа участвует в термодинамическом процессе, для которого его теплоемкость меняется по закону $c = R(T_^ / T^)$, где $T_ = 300 К$. При какой температуре объем газа будет максимальным?
Задача по физике — 3698
Один моль идеального одноатомного газа участвует в термодинамическом процессе, для которого его теплоемкость меняется по закону $c = R (T_/T), T_ = 400 К$. При какой температуре давление газа будет минимальным?
Задача по физике — 3699
В двух объемах находится: в одном $N_ = 10^$, а в другом $N_ = 0,4 cdot 10^$ молекул одного и того же газа. В исходном состоянии внутренняя энергия первого объема газа была на $Delta U = 1,9 Дж$ больше, второго. Объемы приводят в тепловой контакт. В установившемся состоянии средняя энергия, приходящаяся на одну молекул в первом объеме уменьшилась на 25 %. Какова внутренняя энергия газа в первом объеме в исходном состоянии? Газ — идеальный. Теплообмен с внешней средой отсутствует.
Задача по физике — 3700
В тающий снег поместили пробирку со льдом, имеющим температуру $0^ С$. Будет ли таять лед в пробирке?
Задача по физике — 3701
Почему электрическая лампочка заполняется инертным газом до давления, существенно меньшего атмосферного?
Задача по физике — 3702
Вода в стакане замерзает при $0^ С$. Если это воду расчленить на маленькие капельки, то вода в некоторых из них может быть переохлаждена до $- 40^ С$. Так, капельки воды, из которых состоят облака, обычно начинают замерзать при температуре ниже $- 17^ С$. Как объяснить этот факт?
Задача по физике — 3703
Как можно охладить воду ниже $0^ С$ так, чтобы она не замерзала?
Определить количество молей одноатомного газа
1. для обоих газов работа расширения будет равна нулю;
2. для одноатомного газа, так как для него изохорная теплоемкость больше;
3. для двухатомного газа, так как для него изохорная теплоемкость больше;
4. для ответа на этот вопрос необходимо знать, на какую величину увеличилось давление одного и другого газа.
Задача №1
. Какое количество теплоты потребуется для нагревания 1 м 3 воздуха от 0 до 1°С при постоянном объеме и начальном давлении 101,3 кПа? Теплоемкость воздуха Сv = 21 Дж/(моль К).
Задача №2.
Определить количество теплоты, необходимое для нагревания 5 г азота от 15 до 25°С при постоянном объеме.
Задача №3.
Вычислить работу, совершаемую при расширении газовой системы на 5 л и постоянном давлении 101,3 кПа.
Задача №4.
Какое количество работы будет совершено 1000 г СО2 при повышении его температуры на 200° при постоянном давлении?
Задача №5.
При начальных давлении 101,3 кПа, объеме 2,5 л и постоянной температуре 15°С воздух расширяется до объема 100 л. Определить работу, совершенную газом, и его конечное давление.
Задача №6.
Найти изменение внутренней энергии при испарении 200 г этанола при температуре его кипения под давлением 101,3 кПа. Теплота парообразования спирта при температуре кипения равна 857,7 Дж/г, а удельный объем пара равен 0,607 м 3 /кг. Объемом жидкости пренебречь.
Задача №7.
Вычислить работу расширения, если 100 г водорода при 50 °С расширяются от 40 до 200 л.
Задача №8.
Какое количество теплоты выделится при изотермическом сжатии 15 л идеального газа при 36,8 °С и начальном давлении 101,3 кПа, если его объем уменьшится в 5 раз?
Задача №9.
Определить работу адиабатического сжатия 1 моль двухатомного идеального газа при повышении температуры от 15 до 25 °С.
Задача №10.
При начальных условиях 27 °С и 10130 кПа 8 г кислорода расширяются адиабатически до давления 1013 кПа. Вычислить конечную температуру и работу, совершаемую кислородом.
Тестовое задание считается выполненным, если решена задача и даны 6 правильных ответов на тестовые вопросы.
Какое количество теплоты нужно передать 2 моль идеального одноатомного газа, чтобы изобарно увеличить его объем в 3 раза
Задача: Какое количество теплоты нужно передать 2 моль идеального одноатомного газа, чтобы изобарно увеличить его объем в 3 раза, если начальная температура 300 К?
Пояснение: Обозначим ν количество молей газа (количество вещества), V1 — начальный объем газа, V2 — конечный объем газа, Т1 — начальную температуру газа, Т2 — конечную температуру газа, Q — переданное количество теплоты, р — давление газа, ∆U — изменение внутренней энергии газа, А — работу изобарного расширения газа, R — молярную газовую постоянную.
Определить количество молей одноатомного газа
Вопрос по физике:
Один моль идеального одноатомного газа, находящегося при температуре 300К, изохорно охлаждается так, что его давление падает в 3 раза. Определить количество отданной газом теплоты.
Ответы и объяснения 1
По 1 закону термодинамики:
дельтаU=Q+A; т.к.V=const, то А=0; тогда
По закону Шарля: p1/p2=T1/T2=3 => T2=T1/3
Ответ:2493Дж было отдано газом
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Физика.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Условие задачи:
Сколько молей одноатомного газа нагрели на 10 К, если количество подведенной теплоты равно 249 Дж? Процесс нагревания изохорический.
Задача №5.5.19 из «Сборника задач для подготовки к вступительным экзаменам по физике УГНТУ»
Дано:
(Delta T=10) К, (Q=249) Дж, (V=const), (nu-?)
Решение задачи:
Чтобы найти количество подведённой теплоты (Q), запишем первое начало термодинамики:
[Q = Delta U + A;;;;(1)]
Изменение внутренней энергии одноатомного идеального газа (Delta U) можно определить по такой формуле:
[Delta U = frac{3}{2}nu RDelta T;;;;(2)]
Работа газа (A) в изохорическом процессе ((V=const)) равна нулю, поскольку газ не изменяет в таком процессе своего объема.
[A = 0;;;;(3)]
Формула (1) с учётом полученных выражений (2) и (3) примет вид:
[Q = frac{3}{2}nu RDelta T]
Откуда выразим количество вещества (nu):
[nu = frac{{2Q}}{{3RDelta T}}]
Задача решена, теперь подставим численные значения величин в формулу и посчитаем ответ:
[nu = frac{{2 cdot 249}}{{3 cdot 8,31 cdot 10}} = 2;моль]
Ответ: 2 моль.
Если Вы не поняли решение и у Вас есть какой-то вопрос или Вы нашли ошибку, то смело оставляйте ниже комментарий.
Смотрите также задачи:
5.5.18 Количество теплоты, передаваемое газу, одинаково. В каком газовом процессе нагрев
5.5.20 Один моль одноатомного идеального газа нагревается при постоянном объеме
5.5.21 При нагревании 1 кг неизвестного газа на 1 К при постоянном давлении требуется
Молекулярная физика Основные формулы
1. Основы молекулярно-кинетической теории. Газовые законы
1.1 Количество вещества
m — масса;
μ — молярная масса вещества;
N — число молекул;
NA = 6,02·1023 моль-1 — число Авогадро
1.2 Основное уравнение молекулярно-кинетической теории идеального газа
p — давление идеального газа;
m — масса одной молекулы;
n = N/V — концентрация молекул;
V — объем газа;
N — число молекул;

1.3 Средняя квадратичная скорость молекул идеального газа
k = 1,38·10-23 Дж/К — постоянная Больцмана;
R = kNA = 8,31 Дж/(моль·К) — универсальная газовая постоянная;
T = t+273 — абсолютная температура;
t — температура по шкале Цельсия.
1.4 Средняя кинетическая энергия молекулы одноатомного газа
1.5 Давление идеального газа
n — концентрация молекул;
k — постоянная Больцмана;
T — абсолютная температура.
1.6 Закон Бойля-Мариотта
p — давление;
V — объем газа.
1.7 Закон Шарля
p0 — давление газа при 0 °С;
α = 1/273 °C-1 — температурный коэффициент давления.
1.8 Закон Гей-Люссака
V0 — объем газа при 0 °С.
1.9 Уравнение Менделеева-Клапейрона
1.10 Объединенный закон газового состояния (уравнение Клапейрона)
1.11 Закон Дальтона
pi — парциальное давление i-й компоненты смеси газов.
2. Основы термодинамики
2.1 Внутренняя энергия идеального одноатомного газа
ν — количество вещества;
R = 8,31 Дж/(моль·К) — универсальная газовая постоянная;
T — абсолютная температура.
2.2 Элементарная работа, совершаемая газом,
при изменении объема на бесконечно малую величину dV
p — давление газа.
При изменении объема от V1 до V2
2.3 Первый закон термодинамики
ΔQ — количество подведенной теплоты;
ΔA — работа, совершаемая веществом;
ΔU — изменение внутренней энергии вещества.
2.4 Теплоемкость идеального газа
ΔQ — количество переданной системе теплоты на участке процесса;
ΔT — изменение температуры на этом участке процесса.
Уравнение состояния идеального газа
теория по физике 🧲 молекулярная физика, МКТ, газовые законы
Уравнение состояния идеального газа было открыто экспериментально. Оно носит название уравнения Клапейрона — Менделеева. Это уравнение устанавливает математическую зависимость между параметрами идеального газа, находящегося в одном состоянии. Математически его можно записать следующими способами:
Уравнение состояния идеального газа
Внимание! При решении задач важно все единицы измерения переводить в СИ.
Пример №1. Кислород находится в сосуде вместимостью 0,4 м 3 под давлением 8,3∙10 5 Па и при температуре 320 К. Чему равна масса кислорода? Молярная масса кислорода равна 0,032 кг/моль.
Из основного уравнения состояния идеального газа выразим массу:
Уравнение состояния идеального газа следует использовать, если газ переходит из одного состояния в другое и при этом изменяется его масса (количество вещества, число молекул) или молярная масса. В этом случае необходимо составить уравнение Клапейрона — Менделеева отдельно для каждого состояния. Решая систему уравнений, легко найти недостающий параметр.
Подсказки к задачам
Важна только та масса, что осталась в сосуде. Поэтому:
| Давление возросло на 15% | p2 = 1,15p1 |
| Объем увеличился на 2% | V2 = 1,02V1 |
| Масса увеличилась в 3 раза | m2 = 3m1 |
| Газ нагрелся до 25 о С | T2 = 25 + 273 = 298 (К) |
| Температура уменьшилась на 15 К (15 о С) | T2 = T1 – 15 |
| Температура уменьшилась в 2 раза |  |
| Масса уменьшилась на 20% | m2 = 0,8m1 |
| Выпущено 0,7 начальной массы | |
| Какую массу следует удалить из баллона? | Нужно найти разность начальной и конечной массы: |
| Газ потерял половину молекул |  |
| Молекулы двухатомного газа (например, водорода), диссоциируют на атомы |  |
| Озон (трехатомный кислород) при нагревании превращается в кислород (двухатомный газ) | M (O3) = 3Ar (O)∙10 –3 кг/моль M (O2) = 2Ar (O)∙10 –3 кг/моль |
| Открытый сосуд | Объем V и атмосферное давление pатм остаются постоянными |
| Закрытый сосуд | Масса m, молярная масса M, количество вещества ν, объем V, число N и концентрация n частиц, плотность ρ— постоянные величины |
| Нормальные условия | Температура T0 = 273 К Давление p0 = 10 5 Па |
| Единицы измерения давления | 1 атм = 10 5 Па |
Пример №2. В баллоне содержится газ под давлением 2,8 МПа при температуре 280 К. Удалив половину молекул, баллон перенесли в помещение с другой температурой. Определите конечную температуру газа, если давление уменьшилось до 1,5 МПа.
2,8 МПа = 2,8∙10 6 Па
1,5 МПа = 1,5∙10 6 Па
Так как половина молекул была выпущена, m2 = 0,5m1. Объем остается постоянным, как и молярная масса. Учитывая это, запишем уравнение состояния идеального газа для начального и конечного случая:
Преобразим уравнения и получим:
Приравняем правые части и выразим искомую величину:

Алгоритм решения
Решение
График построен в координатах (V;Ek). Процесс 1–2 представляет собой прямую линию, исходящую из начала координат. Это значит, что при увеличении объема растет средняя кинетическая энергия молекул. Но из основного уравнения МКТ идеального газа следует, что мерой кинетической энергии молекул является температура:
Следовательно, когда кинетическая энергия молекул растет, температура тоже растет.
Запишем уравнение Менделеева — Клапейрона:
Так как количество вещества одинаковое для обоих состояния 1 и 2, запишем:
ν R = p 1 V 1 T 1 . . = p 2 V 2 T 2 . .
Мы уже выяснили, что объем и температура увеличиваются пропорционально. Следовательно, давление в состояниях 1 и 2 равны. Поэтому процесс 1–2 является изобарным, давление во время него не меняется.
Процесс 2–3 имеет график в виде прямой линии, перпендикулярной кинетической энергии. Так как температуры прямо пропорциональна кинетической энергии, она остается постоянной вместе с этой энергией. Следовательно, процесс 2–3 является изотермическим, температура во время него не меняется. Мы видим, что объем при этом процессе уменьшается. Но так как объем и давление — обратно пропорциональные величины, то давление на участке 2–3 увеличивается.
pазбирался: Алиса Никитина | обсудить разбор | оценить
На высоте 200 км давление воздуха составляет примерно 10 –9 от нормального атмосферного давления, а температура воздуха Т – примерно 1200 К. Оцените плотность воздуха на этой высоте.
Уравнение Клапейрона-Менделеева
Что такое уравнение Клапейрона-Менделеева
Идеальный газ — это газ, в котором пренебрегают взаимодействием молекул газа между собой.
Идеальными считают разреженные газы. Особенно близкими к идеальным считают гелий и водород.
Идеальный газ — это упрощенная математическая модель, которая широко применяется для описания свойств и поведения реальных газов при атмосферном давлении и комнатной температуре.
Давление, объем и температура — это основные параметры состояния системы, и они связаны друг с другом. Соотношение, при котором определяется данная связь, называется уравнением состояния данного газа.
Существует эквивалентная макроскопическая формулировка идеального газа — это такой газ, который одновременно будет подчиняться закону Бойля-Мариотта и Гей-Люссака, то есть:
p V = c o n s t * T
В представленном выше уравнении состоянии газа под const подразумевается количество молей.
Свойства классического и квазиклассического идеального газа описываются уравнением состояния идеального газа, которое называется уравнением Менделеева-Клапейрона, ниже представлена формула Менделеева-Клапейрона.
p V = m M R T = n R T , где m — масса газа, M — молярная масса газа, R = 8 , 314 Д ж / ( м о л ь * К ) — универсальная газовая постоянная, T — температура (К), n — количество молей газа.
Таким образом давление и объем прямо пропорциональны количеству молей и температуре.
Также уравнение Клапейрона-Менделеева можно записать в ином виде:
p V = N k T , где N — это количество молекул газа массой m , k = 1 , 38 * 10 — 23 Д ж / К — постоянная Больцмана, которая определяет «долю» газовой постоянной, приходящуюся на одну молекулу и определяется по формуле:
N = m N A M , где
N A = 6 . 02 * 10 23 м о л ь — 1 ; — это постоянная Авогадро.
Какое значение имеет универсальная газовая постоянная
Универсальная газовая постоянная (R) — это величина, которая является константой, численно равная работе расширения одного моля идеального газа в изобарном процессе при увеличении температуры на 1 K.
Значение данной константы находится как произведение постоянной Больцмана ( k = 1 , 38 * 10 — 23 Д ж / К ) на число Авогадро ( N A = 6 . 02 * 10 23 м о л ь — 1 ) . Таким образом универсальная газовая постоянная принимает следующее значение: R = 8 , 314 Д ж / ( м о л ь * К ) .
Постоянную Больцмана используют в формулах, описывающих изучаемое явление или поведение рассматриваемого объекта с микроскопической точки зрения, тогда как универсальная газовая постоянная более удобна при расчетах, касающихся макроскопических систем, когда число частиц задано в молях.
Связь с другими законами состояния идеального газа
С помощью уравнения состояния идеального газа можно исследовать процессы, в которых масса и один трех макропараметров (давление, температура или объем) — остаются неизменными.
Количественные зависимости между двумя параметрами газа при фиксированном третьем параметре называют газовыми законами, которые связывают эти параметры.
Изопроцессы — это термодинамические процессы, во время протекания которых количество вещества и один из макропараметров состояния: давление, объем, температура или энтропия — остается неизменным.
В зависимости от того, какой параметр остается неизменным различают разные процессы, которые выражаются законами, являющимися следствием уравнения состояния газа:
- изотермический процесс (T=const);
- изохорный процесс (V=const);
- изобарный процесс (p=const).
Изотермический процесс (T=const)
Процесс изменения состояния термодинамической системы при постоянной температуре называют изотермическим.
Для поддержания температуры газа постоянной необходимо, чтобы он мог обмениваться теплотой с большой системой — термостатом. Им может служить атмосферный воздух, если температура его заметно не меняется на протяжении всего процесса.
Согласно уравнению Клапейрона-Менделеева, в любом состоянии с неизменной температурой произведение давления газа на объем одно и то же, то есть постоянно:
Этот закон был открыт экспериментально английским ученым Бойлем и несколько позднее французским ученым Мариоттом. Именно поэтому он называется закон Бойля-Мариотта.
Закон Бойля-Мариотта справедлив для любых газов, а также для смеси газов (например, для воздуха).
Зависимость давления газа от объема при постоянной температуре изображается графической кривой — изотермой. Изотерма для различных температур представлена в координатах pV на рис.1. и представляет собой гиперболу.
Рис.1. Изотерма в pV — координатах.
Изохорный процесс (V=const)
Процесс изменения состояния термодинамической системы при постоянном объеме называют изохорным.
Из уравнения состояния следует, что отношение давлений газа данной массы при постоянно объеме равно отношению его абсолютных температур:
p 1 p 2 = T 1 T 2
Газовый закон был установлен экспериментально в 1787 г. французским физиком Ж. Шарлем и носит название закона Шарля: давление данной массы газа при постоянном объеме прямо пропорционально абсолютной температуре.
Так, если в качестве одного из состояний газа выбрать состояние газа при нормальных условиях, тогда
p = p 0 T T 0 = p 0 γ T
Коэффициент γ называют температурным коэффициентом давления газа. Он одинаков для всех газов.
Зависимость давления газа от температуры при постоянном объеме изображается графически прямой, которая называется изохорой (Рис.2).
Рис.2 Изображение изохоры в pT-координатах.
Изобарный процесс (p=const)
Процесс изменения состояния термодинамической системы при постоянном давлении называют изобарным.
Из уравнения Клапейрона-Менделеева вытекает, что отношение объемов газа данной массы при постоянном давлении равно отношению его абсолютных температур.
V 1 V 2 = T 1 T 2
Если в качестве второго состояния газа выбрать состояние при нормальных условиях (нормальном атмосферном давлении, температуре таяния льда) следует:
V = V 0 T T 0 = V 0 α T
Этот газовый закон был установлен экспериментально в 1802 г французским ученым Гей-Люссаком.
Закон Гей-Люссака: объем данной массы газа при постоянном давлении прямо пропорционален абсолютной температуре.
Коэффициент α называют температурным коэффициентом объемного расширения газов.
Зависимость объема газа от температуры при постоянном давлении изображается графической прямой, которая называется изобарой (Рис.3).
Рис. 3. Изобара в VT-координатах.
Использование универсального уравнения для решения задачи
В реальности проводятся различные физико-химические процессы. Рассмотрим каким образом уравнение состояния идеального газа и законы, связанные с ним находят применение для решения физических и химических задач.
Определить давление кислорода в баллоне объемом 1 м 3 при температуре t = 27 C o . Масса кислорода 1 кг.
Так как в уравнении даны объем и температура — два из трех макроскопических параметров, а третий (давление) нужно определить, то мы можем использовать уравнение Клапейрона-Менделеева:
p V = n R T = m M R T
Не забываем перевести температуру в Кельвины:
T = t + 273 = 27 + 273 = 300 K
Молярная масса кислорода известна из таблицы Менделеева:
M ( O 2 ) = 2 * 16 = 32 г / м о л ь = 32 * 10 — 3 к г / м о л ь
Выразим из уравнения состояния давления и поставим все имеющиеся данные:
p = n R T V = m R T M V = 1 * 8 . 31 * 300 32 * 10 — 3 * 1 = 77 . 906 П а = 78 к П а
Ответ: p = 78 кПа.
Каким может быть наименьший объем баллона, содержащего кислород массой 6,4 кг, если его стенки при t = 20 C o выдерживают p = 1568 Н / с м 2 ?
Используем уравнение Менделеева-Клапейрона, из которого выражаем объем кислорода, который нужно найти:
p = n R T V = m R T M V
Молярная масса кислорода предполагается равной:
M ( O 2 ) = 2 * 16 = 32 г / м 3
Не забываем перевести температуру в Кельвины:
T = t + 273 = 20 + 273 = 293 K
Переводим давление: p = 15680000 Па
Выражаем из уравнения Клапейрона-Менделеева объем и подставляем значения, данные в условиях задачи:
V = n R T p = m R T M p = 6 . 4 * 8 . 31 * 293 15680000 * 32 * 10 — 3 = 3 . 1 * 10 — 2 м 3 = 31 л .
Используя уравнение состояния идеального газа, доказать, что плотность любого газа равна половине плотности водорода ( ρ Н 2 ) , взятого при тех же условиях, умноженной на относительную молекулярную массу этого газа M_r, то есть ρ = ρ Н 2 * M r 2 .
Согласно уравнению Менделеева-Клапейрона:
p = n R T V = m R T M V
Плотность — это величина, характеризующая массу некоторого объема и находится по формуле:
ρ = m V и л и V = m ρ
Тогда p m ρ = n R T = m R T M
Откуда выражаем плотность газа:
Для водорода эта формула запишется следующим образом:
ρ H 2 = p M H 2 R T
По условию задачи водород и любой другой газ находятся при одинаковых условиях, откуда следует, что:
ρ H 2 M H 2 = p R T
Поставим последнее выражение в выражение для плотности любого газа:
ρ = M * ρ H 2 M H 2
Молярная масса водорода, исходя из таблицы Менделеева равна 2 г/моль и тогда. Молекулярная масса численно равная молярной и представляет собой массу молекулы в атомных единицах, поэтому в дальнейшем мы совершили переход к молекулярной массе.
ρ = M r * ρ H 2 2
Вывод: плотность любого газа равна половине плотности водорода ( ρ Н 2 ) , взятого при тех же условиях, умноженной на относительную молекулярную массу этого газа M_r, то есть ρ = ρ Н 2 * M r 2 .
Рассмотрим несколько задач на законы, связанные с уравнение Клапейрона-Менделеева, то есть на изотермические, изохорные, изобарные процессы.
При уменьшении давления газа в 2,5 раза его объем увеличился на 12 л. Какой объем занимал газ в начальном состоянии, если температура на протяжении всего процесса оставалась постоянной?
По условию задачи температура в ходе всего процесса оставалась постоянной, откуда следует, что у нас изотермический процесс, и мы можем воспользоваться для решения законом Бойля-Мариотта.
p 1 V 1 = p 2 V 2 , г д е p 1 – давление газа в начальном состоянии (до расширения), V 1 — объем газа в начальном состоянии, p 2 = p 1 2 . 5 — давление газа в конечном состоянии (после расширения), V 2 = V 1 + ∆ V — объем газа в конечном состоянии.
Откуда можем найти начальный объем:
p 1 V 1 = p 1 2 . 5 ( V 1 + ∆ V ) = p 1 2 . 5 V 1 + p 1 2 . 5 ∆ V
V 1 ( p 1 — p 1 2 . 5 ) = p 1 2 . 5 ∆ V
p 1 2 . 5 V 1 ( 2 . 5 — 1 ) = p 1 2 . 5 ∆ V
V 1 = ∆ V 1 , 5 = 8 л
Ответ: первоначальный объем газа был равен 8 л.
Газ находится в баллоне при температуре 400 К. До какой температуры нужно нагреть газ, чтобы его давление увеличилось в 1,5 раза?
Так как нагревание газа по условиям данной задачи происходит при постоянном объеме, значит перед нами изохорный процесс.
При изохорном процессе:
p 1 T 1 = p 2 T 2
T 2 = p 2 T 1 p 1
p 2 p 1 = 1 . 5 T 2 = 1 . 5 * T 1 = 1 . 5 * 400 = 600 K
При 27°C объем газа равен 600 мл. Какой объем займет газ при 57°C, если давление будет оставаться постоянным?
Так как давление по условию остается постоянным, то можем использовать закон Гей-Люссака.
V 1 V 2 = T 1 T 2
V_2 – искомый объем
Для правильного расчета необходимо перевести температуры из Цельсий в Кельвины:
T 1 = 273 + 27 = 300 K
T 2 = 273 + 57 = 330 K
T 2 V 1 T 1 = V 2
V 2 = ( 600 * 330 ) / 300 = 660 м л
Газ в трубе плавильной печи охлаждается от температуры t 1 = 1150 ° С д о t 2 = 200 ° С . Во сколько раз увеличивается плотность газа при этом? Давление газа не меняется.
Так как по условию задания давления газа не изменяется, значит перед нами изобарный процесс. Для решения воспользуемся законом Гей-Люссака:
V 1 V 2 = T 1 T 2
Перейдем к абсолютной температуре:
T 1 = 1150 + 273 = 1423 K
T 2 = 200 + 273 = 473 K
Масса газа: m = ρ 1 V 1 = ρ 2 V 2
Использование этих формул приводит к следующему:
Прменение уравнения Менделеева — Клапейрона в рассчетах объма и количества газообразных веществ
Задача 36.
Рассчитайте, какой объем (в литрах) занимают:
а) 1,2 кг водяного пара при 100 °С и 1,013· 10 5 Па;
б) 1,2 кг метана при 25 °С и 1,013· 10 5 Па.
Решение:
M[Н2О(пар)] = 18 кг/моль . 10 -3 ;
М(СН4) = 16 кг/моль . 10 -3 ;
T1 = 100 °С = (100 + 273) = 373 K;
T2 = (25 + 273 = 298 K);
P1 = P2 = 1,013· 10 5 Па.
Для решения задачи прменим уравнение Менделеева — Клапейрона:
PV = nRT = mRT/M, где
n – число молей газа;
P – давление газа (например, в атм или Па;
V – объем газа (в литрах);
T – температура газа (в кельвинах);
R – газовая постоянная [0,0821 л·атм/моль·K)] или [8,314 Дж/(моль . К)];
M — молярная масса вещества (в г/моль или кг/моль;
m — масса вещества (например, в г или кг).
Рассчитаем объемы газов:
а) объем 1,2 кг водяного пара:
PV = mRT/M, V(пар) = mRT1/MР = [1,2 . 8,314 Дж/(моль . К) . 373 К]/[(18 кг/моль . 10 -3 ) . 1,013· 10 5 Па] =
= 3721,3464/1823,4 = 2,04 м 3 = 2040 л.
б) объем 1,2 кг метана:
V(СН4) = mRT1/MР = [1,2 . 8,314 Дж/(моль . К) . 298 К]/[(16 кг/моль . 10 -3 ) * 1,013· 10 5 Па] =
= 2973,0864/1620,8 = 1,834 м 3 = 1834 л.
Ответ: V(пар) = 2040 л; V(СН4) = 1834 л.
Задача 37.
Некоторое количество газа гелия при 78 °С и давлении 15,6 атм занимает объем 26,5 л. Каков объем этого газа при нормальных условиях? Сколько это молей гелия?
Решение:
Для решения задачи прменим уравнение Менделеева — Клапейрона:
n – число молей газа;
P – давление газа (например, в атм или Па;
V – объем газа (в литрах);
T – температура газа (в кельвинах);
R – газовая постоянная [0,0821 л·атм/моль·K)] или [8,314 Дж/(моль . К)].
Уравнение Клапейрона-Менделеева одинаково справедливо как для начального состояния газа, так и для конечного:
Если почленно разделим верхнее уравнение на нижнее, то при неизменном числе молей n мы получаем:
Найдем число молей гелия:
n(Hе) = V/Vm = 321,5/22,4 = 14,35 моль.
Ответ: V2(He) = 321,5 л; n(Hе) = 14,35 моль.
Задача 38.
В стальном баллоне объемом 40 л находится водород под давлением 60 атм и температуре 25 °С. Сколько молей водорода в баллоне? Сколько граммов? Какой объем займет водород из баллона при н.у.?
Решение:
М(Н2) — 2 г/моль;
V1 = 40 л;
Р1 — 60 атм;
Т1 = Т0 = 25 °С = 298 К;
Р0 = 1 атм.
n(H2) = ?
m(H2) = ?
V0(Н2) = ?
Для решения задачи прменим уравнение Менделеева — Клапейрона:
n – число молей газа;
P – давление газа (например, в атм или Па;
V – объем газа (в литрах);
T – температура газа (в кельвинах);
R – газовая постоянная [0,0821 л·атм/моль·K)] или [8,314 Дж/(моль / К)].
1. Расчитаем сколько молей водорода в баллоне, получим:
PV = nRT, n = PV/RT;
n(H2) = P1V1/RT1 = (60 . 40)/(0,0821 . 298) = 2400/24,4658 = 98,1 моль.
2. Находим массу водорода в баллоне:
m(H2) = n(H2) . М(Н2) = 98,1 . 2 = 196,2 г.
3. Рассчитаем объем водорода из баллона (н.у.), получим:
PV = nRT, V = nRT/P;
V0(Н2) = n(H2)RT0/P0 = (98,1 . 0,0821 . 298)/1 = 2400 л.
источники:
http://wika.tutoronline.ru/fizika/class/10/uravnenie-klapejronamendeleeva
http://buzani.ru/zadachi/obshchaya-khimiya/1622-raschet-kolichestva-i-ob-ema-gazov-zadachi-36-38