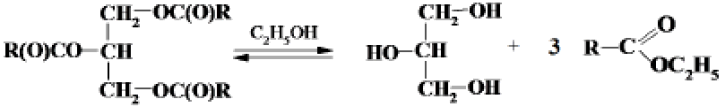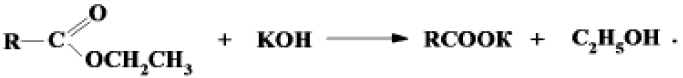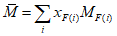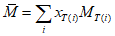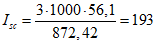-
Определение числа омыления
Числом омыления
называется число миллиграммов гидроксида
калия, необходимое для нейтрализации
свободных и омыления связанных (в форме
глицеридов) жирных кислот, содержащихся
в 1 г масла.
Количество КОН,
которое требуется для омыления 1 г жира,
зависит от молекулярной массы жирных
кислот глицеридов жира. Чем больше
молекулярная масса жирных кислот,
входящих в состав жира, тем меньше
молекул будет в 1 г жира и, следовательно,
меньше КОН пойдет на омыление.
Принцип метода:
основан на связывании (омылении)
гидроксидом калия жирных кислот,
входящих в триглицерид, и нейтрализации
свободных жирных кислот.
Реакция омыления:
С3Н5
(ОСОR)3
+ 3КОН = С3Н5(ОН)3
+ RСООК
На омыление 1
молекулы жира затрачивается 3 молекулы
КОН.
Количество щелочи,
не связавшейся с жиром, оттитровывают
соляной кислотой.
Техника
определения:
в одну колбу вместимостью 50 см3
вносят 0,5 г жира, отвешенного на
аналитических весах, в другую – 0,5 см3
воды, затем в обе добавляют из бюретки
по 15 см3
0,5 н. спиртового раствора гидроксида
калия. Колбы закрывают пробками с
обратным воздушным холодильником
(длиной 70 см3
) и нагревают на кипящей водяной бане в
течение 30-40 минут при периодическом
встряхивании. Следят, чтобы жидкость в
колбе кипела слабо, а верхняя часть
трубки не нагревалась.
После полного
омыления глицеридов и нейтрализации
свободных жирных кислот к прозрачному
и однородному мыльному раствору добавляют
по 15-20 см3
воды, по 3-4 капли фенолфталеина и титруют
0,5 н. раствором соляной кислоты до
исчезновения розового окрашивания
(определяется количество не связавшейся
щелочи). Исходя из того, что 1 см3
0,5 н. раствора КОН соответствует 28 мг
его, расчет числа омыления определяется
по формуле:
,
где: Vк
и Vо
– объем 0,5 н. раствора НСL,
затраченного на титрование, соответственно,
контроля (колба с водой) и опыта (колба
с эфиром); см3;
k
– коэффициент поправки к титру 0,5 н.
раствора НСL;
m
– масса жира, г
Материалы,
реактивы и оборудование:
спиртовой раствор гидроксида калия 0,5
н. (30 г химически чистого КОН растворяют
в 1 дм3
этилового спирта при нагревании в колбе
с обратным холодильником, через сутки
раствор фильтруют и сохраняют в склянке
из темного стекла), раствор соляной
кислоты (0,5 н.), раствор фенолфталеина 1
%-й, масло, водяная баня, пробки, пробирки.
-
Определение кислотного числа
Кислотное число
характеризует кислотность жира и
измеряется количеством миллиграммов
гидроксида калия, необходимого для
нейтрализации свободных жирных кислот
в 1 г жира.
Кислотное число,
наряду с другими физико-химическими
показателями, характеризует качество
масла. Например, если масло получено из
зерен семян, то свободных жирных кислот
в нем мало, в масле же из незрелых семян
содержание свободных жирных кислот
значительно выше. При хранении масла
наблюдается гидролиз глицеридов, который
приводит к накоплению свободных жирных
кислот, т.е. возрастанию кислотности.
Повышение кислотности масла указывает
на снижение его качества.
Принцип метода
основан на том, что свободные жирные
кислоты, имеющиеся в масле, оттитровываются
0,1 н. раствором КОН. Обычно титрование
проводят гидроксидом калия, а не
гидроксидом натрия, так как образующиеся
калиевые мыла лучше растворимы в условиях
опыта.
Техника
определения.
2-3 г жира помещают в коническую колбу
вместимостью 50-100 см3,
растапливают на водяной бане с температурой
50-60 0С
и растворяют в 10-15 см3
нейтральной спиртоэфирной смеси.
К прозрачному
раствору добавляют 3-4 капли фенолфталеина
и при постоянном перемешивании по каплям
титруют 0,1 н. спиртовым раствором
гидроксида калия до появления
слабо-розового окрашивания. Окраска
после взбалтывания не должна исчезнуть
в течение 0,5-1 минут.
Кислотное число
определяют по формуле:
где V
– количество 0,1 н. раствора КОН,
израсходованное на титрование, см3;
k
– коэффициент поправки на титр 0,1 н.
раствора КОН; 5,611 – коэффициент пересчета
миллилитров 0,1 н. раствора КОН в
миллиграммы (1 см3
0,1 н. раствора КОН содержится 5,611 мг КОН);
m
– навеска жира, г.
Материалы,
реактивы и оборудование:
нейтрализованная спиртоэфирная смесь
(смесь спирта и эфира в соотношении 1:1
нейтрализуют в присутствии фенолфталеина
0,1 н. спиртовым раствором КОН до
слабо-розового окрашивания), Гидроксид
калия 0,1 н. раствор в 96 %-м спирте, спиртовой
раствор фенолфталеина 1 %-й (1 г фенолфталеина,
70 см3
спирта и 30 см3
воды) масло
растительное или жир животный.
Соседние файлы в папке МЕТОДИЧЕСКИЕ УКАЗАНИЯ
- #
- #
- #
- #
- #
- #
Число омыления характеризует общее число свободных и связанных жирных кислот в жире и выражается количеством гидроксида калия (мг), необходимых для омыления ацилглицеридов и дальнейшей нейтрализации свободных и связанных жирных кислот, содержащихся в 1 г жира (мг КОН/г жира).
Число омыления зависит от молекулярной массы жирных кислот, входящих в ацилглицериды, содержания неомыляемых веществ, свободных жирных кислот, моно- и диацилглицеридов. При повышении содержания неомыляемых веществ, моно- и диацилглицеридов число омыления понижается и повышается с увеличением низкомолекулярных кислот.
Косвенно число омыления характеризует среднюю молекулярную массу смеси жирных кислот: чем больше в жире содержится низкомолекулярных кислот, тем выше число омыления. Совместно с кислотным числом оно служит показателем степени окислительной порчи жира, сопровождающейся накоплением низкомолекулярных кислот, и является нормируемым показателем.
|
Число омыления, |
мг КОН/г жира: |
|
подсолнечное масло оливковое масло рапсовое масло кукурузное масло пальмовое масло соевое масло молочный жир сливочное масло говяжий жир бараний жир свиной жир |
– 186–194; – 185–196; – 180–200; – 188–193; – 196–210; – 188–195; – 220–235; – 188–198; – 190–200; – 193–203; – 193–203. |
Число омыления молочного жира выше, чем у других животных жиров, так как он содержит низкомолекулярные жирные кислоты. Понижение значения этой константы, так же как и снижение чисел Рейхерта – Мейссля и Поленски, служит признаком фальсификации молочного жира другими жирами.
В основе метода определения числа омыления лежит щелочной гидролиз жира при избытке гидроксида калия в среде этилового спирта. Спиртовой раствор гидроксида калия используют для достижения полноты реакции и устранения гидролиза образующегося мыла. При нагревании жиров в присутствии гидроксида калия в среде этанола реакция алкоголиза протекает практически нацело:
Продукты алкоголиза – этиловые эфиры жирных кислот – хорошо растворимы в этаноле и легко омыляются в дальнейшем гидроксидом калия с образованием калиевых солей жирных кислот (мыла):
Избыток гидроксида калия оттитровывают раствором соляной кислоты.
Ход анализа. В колбу вместимостью 100 мл отвесить на аналитических весах 2–3 г жира. Для проведения гидролиза добавить 25 мл 0,5 н спиртового раствора гидроксида калия (пипеткой), подсоединить обратный холодильник и поместить в кипящую водяную баню. Не следует допускать испарения спирта через холодильник (недостающее количество спирта можно добавить после окончания гидролиза).
По истечении одного часа, когда гидролизат приобретет вид прозрачного не расслаивающегося раствора, колбу с анализируемой пробой вынуть из бани, слегка охладить и отсоединить от холодильника. К теплому раствору добавить 1–2 капли раствора фенолфталеина, при этом цвет анализируемого раствора должен измениться на розовый из-за присутствия гидроксида калия. Избыток гидроксида калия оттитровать 0,5 н раствором соляной кислоты до исчезновения окраски (опыт). Объем титранта не должен превышать 5 мл для предотвращения гидролиза образующегося мыла.
Контрольный опыт проделать с тем же количеством реагентов. Отобрать пипеткой в коническую колбу 25 мл 0,5 н спиртового раствора гидроксида калия, добавить 1 мл дистиллированной воды, закрыть колбу воздушными холодильниками и поставить в кипящую водяную баню на один час. Оттитровать полученный раствор 0,5 н раствором соляной кислоты в присутствии фенолфталеина аналогично опытному образцу.
По разности объемов, полученных от титрования опыта и контроля, рассчитать число омыления (ЧО, мг КОН/г) по формуле:
ЧО=(VK-VO)×28,055m,
где Vо — количество 0,5 н раствора соляной кислоты, пошедшего на титрование опытного образца, мл;
Vк — количество 0,5 н раствора соляной кислоты, пошедшего на титрование контрольного образца, мл;
28,055 — титр 0,5 н раствора гидроксида калия, мг/мл;
m — масса исследуемого жира, г.
На основании числа омыления (при незначительном кислотном числе) расчетным путем можно определить среднюю молекулярную массу соответствующих ацилглицеридов (МГЛ) и среднюю молекулярную массу смеси жирных кислот (МЖК), входящих в состав исследуемого жира, по формулам:
MГЛ=56,11×n×1000ЧО, MЖК=MГЛ-(92,06-54,05)3,
где 56,11 – молекулярная масса гидроксида калия;
92,06 – молекулярная масса глицерина;
54,05 – утроенная масса воды;
n – коэффициент для расчета молекулярной массы три-, ди- и моноглицеридов (3, 2, 1 соответственно);
3 – основность глицерина.
From Wikipedia, the free encyclopedia
Saponification value or saponification number (SV or SN) represents the number of milligrams of potassium hydroxide (KOH) or sodium hydroxide (NaOH) required to saponify one gram of fat under the conditions specified.[1][2][3] It is a measure of the average molecular weight (or chain length) of all the fatty acids present in the sample in form of triglycerides. The higher the saponification value, the lower the fatty acids average length, the lighter the mean molecular weight of triglycerides and vice versa. Practically, fats or oils with high saponification value (such as coconut and palm oil) are more suitable for soap making.
Determination[edit]
To determine saponification value, the sample is treated with an excess of alkali (usually an ethanolic solution of potassium hydroxide) for half an hour under reflux. The KOH is consumed by reaction with triglycerides, which consume three equivalents of base. Diglycerides consume two equivalents of KOH. Monoglycerides and free fatty acids, as well as by other esters such as lactones consume one equivalent of base[4]: 98 At the end of the reaction the quantity of KOH is determined by titrated using standard solution of hydrochloric acid (HCl). Key to the method is the use of phenolphthalein indicator, which indicates the consumption of strong base (KOH) by the acid, not the weak base (potassium carboxylates). The SV (mg KOH/ g of sample) is calculated as following:[2]
Eq. 1
-
(1)
- where:
is the volume of HCl solution used for the blank run, in mL;
is the volume of HCl solution used for the tested sample, in mL;
is the molarity of HCl solution, in mol / L;
- 56.1 is the molecular weight of KOH, in g / mol;
is the weight of sample, in g.
For example, standard methods for determination of SV of vegetable and animal fats are as follows:
| Product | Standard method |
|---|---|
| Fats and oils | ISO 3657:2020 ASTM D5558 |
| Petroleum products | ASTM D94 |
| Mineral oils | DIN 51559 |
The SV can also be calculated from the fatty acid composition as determined by gas chromatography (AOCS Cd 3a-94).[5]
Handmade soap makers who aim for bar soap use sodium hydroxide (NaOH), commonly known as lye, rather than KOH (caustic potash) which produces soft paste, gel or liquid soaps. In order to calculate the lye amount needed to make bar soap, KOH values of SV can be converted to NaOH values by dividing KOH values by the ratio of the molecular weights of KOH and NaOH (1.403).[6]
Calculation of average molecular weight of fats and oils[edit]
The theoretical SV of a pure triglyceride molecule can be calculated by the following equation (where MW is its molecular weight):[7][8]
Eq. 2
-
(2)
- where:
- 3 is the number of fatty acids residues per triglyceride
- 1000 is the conversion factor for milligrams to grams
- 56.1 is the molar mass of KOH.[7]
For instance, triolein, a triglyceride occurring in many fats and oils, has three oleic acid residues esterified to a molecule of glycerol with a total MW of 885.4 (g / mol). Therefore, its SV equals 190 mg KOH / g sample.[9] In comparison, trilaurin with three shorter fatty acid residues (lauric acid) has a MW of 639 and an SV of 263.
As it can be seen from equation (2), the SV of a given fat is inversely proportional to its molecular weight. Actually, as fats and oils contain a mix of different triglycerides species, the average MW can be calculated according to the following relation:[9]
Eq. 3
-
(3)
This means that coconut oil with an abundance of medium chain fatty acids (mainly lauric acid) contain more fatty acids per unit of weight than, for example, olive oil (mainly oleic acid). Consequently, more ester saponifiable functions were present per g of coconut oil, which means more KOH is required to saponify the same amount of matter, and thus a higher SV.[9] The calculated molecular weight (Eq. 3) is not applicable to fats and oils containing high amounts of unsaponifiable material, free fatty acids (> 0.1%), or mono- and diacylglycerols (> 0.1%).[7]
Unsaponifiables [edit]
Unsaponifiables are components of a fatty substance (oil, fat, wax) that fail to form soaps when treated with alkali and remain insoluble in water but soluble in organic solvents. For instance, typical soybean oil contains, by weight, 1.5 – 2.5% of unsaponifiable matter. Unsaponifiables include nonvolatile components : alkanes, sterols, triterpenes, fatty alcohols, tocopherols and carotenoids as well as those that mainly result from the saponification of fatty esters (sterols esters, wax esters, tocopherols esters, …). This fraction may also contain environmental contaminants and residues of plasticizers, pesticides, mineral oil hydrocarbons and aromatics.[10]
Unsaponifiable constituents are an important consideration when selecting oil mixtures for the manufacture of soaps. Unsaponifiables can be beneficial to a soap formula because they may have properties such as moisturization, conditioning, antioxidant, texturing etc. On the other hand, when proportion of unsaponifiables is too high (> 3%), or the specific unsaponifiables present do not provide significant benefits, a defective or inferior soap product can result. For example, shark oil is not suitable for soap making as it may contain more than 10% of unsaponifiable matter.[11]
For edible oils, the tolerated limit of unsaponifiable matter is 1.5% (olive, refined soybean), while inferior quality crude or pomace oil could reach 3%.[12][13]
Determination of unsaponifiables involves a saponification step of the sample followed by extraction of the unsaponifiable using an organic solvent (i.e. diethyl ether). Official methods for animal and vegetable fats and oils are described by ASTM D1065 — 18, ISO 3596: 2000 or 18609: 2000, AOCS method Ca 6a-40.
Saponification values and unsaponifiables of various oils and fats[edit]
| Fat / oil | Saponification value (mg KOH / g sample)[14][15] | Unsaponifiable matter (%)[7][14][16] |
|---|---|---|
| Beeswax | 60 – 102 | > 52 |
| Canola oil | 182 – 193 | < 0.2 |
| Cocoa butter | 192 – 200 | 0.2 – 1 |
| Coconut oil | 248 – 265 | 0.1 – 1.4 |
| Corn oil | 187 – 195 | 1 – 3 |
| Cottonseed oil | 189 – 207 | < 2 |
| Fish oil[17] | 179 – 200 | 0.6 – 3 |
| Lanolin[18][19] | 80 – 127 | 40 – 50 |
| Lard[20] | 192 – 203 | < 10 |
| Linseed oil | 188 – 196 | 0.1 – 2 |
| Mineral oil | 0 | 100 |
| Olive oil | 184 – 196 | 0.4 – 1.1 |
| Palm kernel oil | 230 – 254 | < 1 |
| Palm oil | 190 – 209 | < 1.4 |
| Peanut oil | 187 – 196 | 0.2 – 4.4 |
| Rapeseed oil | 168 – 181 | 0.7 – 1.1 |
| Safflower oil | 188 – 194 | < 1.6 |
| Shea butter | 170 – 190 | 6 – 17 |
| Soybean oil | 187 – 195 | 1.5 – 2.5 |
| Sunflower oil | 189 – 195 | 0.3 – 1.2 |
| Whale oil[4]: 183 | 185 – 202 | < 2 |
See also[edit]
- Acid value – Milligrams of a base needed to neutralize 1 gram of a given acid
- Amine value – Measure of an organic compound’s nitrogen content
- Bromine number – Mass of bromine absorbed by 100 grams of a given substance
- EN 14214 – Fuel standard for biodiesel
- Epoxy value – Measure of the epoxy content of a substance
- Hydroxyl value – Mass of KOH needed to neutralize 1 gram of acetylized substance
- Iodine value – Mass of iodine absorbed by 100 grams of a given substance
- Peroxide value – Measure of peroxide content of a fat or oil
- Saponification – Process that converts fat, oil, or lipid into soap and alcohol
- Soapmaking — Small scale process of producing soap
References[edit]
- ^ «Saponification Value of Fats and Oils». Retrieved January 18, 2018.
- ^ a b «Saponification value of Fat and Oil» (PDF). kyoto-kem.com. Retrieved July 8, 2016.
- ^ Klaus Schumann, Kurt Siekmann (2005). «Soaps». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. pp. a24_247. doi:10.1002/14356007.a24_247. ISBN 3527306730.
{{cite encyclopedia}}: CS1 maint: uses authors parameter (link) - ^ a b Chakrabarty, M. M. (November 9, 2003). Chemistry and Technology of Oils & Fats. New Delhi: Allied Publishers. ISBN 9788177644951. OCLC 771847815.
- ^ Knothe, Gerhard (2002). «Structure indices in FA chemistry. How relevant is the iodine value?». Journal of the American Oil Chemists’ Society. 79 (9): 847–854. doi:10.1007/s11746-002-0569-4. ISSN 1558-9331. S2CID 53055746.
- ^ «Saponification Chart». www.fromnaturewithlove.com. Retrieved September 13, 2020.
- ^ a b c d Nielsen, Suzanne (September 4, 2014). Food Analysis. Springer Science & Business Media. ISBN 9781441914774.: 247–248
- ^ Gunstone, F.D.; Harwood, J.L. (2007). The Lipid Handbook (Third ed.). Boca Raton, FL: CRC Press. p. 424. ISBN 9781420009675. OCLC 327018169.
- ^ a b c Gunstone, F.D.; Harwood, J.L. (2007). The Lipid Handbook (Third ed.). Boca Raton, FL: CRC Press. p. 424. ISBN 978-1-4200-0967-5. OCLC 327018169.
- ^ Belitz, H.-D.; Grosch, Werner; Schieberle, Peter (2013). Food Chemistry. Springer Science & Business Media. ISBN 978-3-662-07279-0.
- ^ Fryer, Percival J.; Weston, Frank E. (December 19, 2013). Technical Handbook of Oils, Fats and Waxes. Cambridge University Press. ISBN 978-1-107-68731-8.
- ^ «Trade standard applying to olive oils and olive pomace oils (COI/T.15/NC No 3/Rev. 14)» (PDF). internationaloliveoil.org. 2019. Retrieved September 15, 2020.
- ^ «USDA commodity requirements document for bulk oil and tallow» (PDF). fsa.usda.gov. 2013. Retrieved September 15, 2020.
- ^ a b Gunstone, Frank (2009). Oils and Fats in the Food Industry. John Wiley & Sons. ISBN 978-1-4443-0243-1.
- ^ Akoh, Casimir C.; Min, David B. (2008). Food Lipids: Chemistry, Nutrition, and Biotechnology, Third Edition. CRC Press. ISBN 9781420046649.
- ^ «Physical Properties of fats and Oils» (PDF). Deutsche Gesellschaft für Fettwissenschaft e.V. Retrieved September 14, 2020.
- ^ Turchini, Giovanni M.; Ng, Wing-Keong; Tocher, Douglas Redford (2010). Fish Oil Replacement and Alternative Lipid Sources in Aquaculture Feeds. CRC Press. ISBN 978-1-4398-0863-4.
- ^ «Lanolin — CAMEO». cameo.mfa.org. Retrieved September 14, 2020.
- ^ Wilkie, John M. (1917). «The estimation of unsaponifiable matter in oils, fats, and waxes». Analyst. 42 (495): 200–202. Bibcode:1917Ana….42..200W. doi:10.1039/AN9174200200. ISSN 1364-5528.
- ^ «SECTION 3. Codex Standard for Fats and Oils from Animal Sources». www.fao.org. Retrieved September 14, 2020.
Число омыления (ОФС.1.2.3.0008.15)
Государственная фармакопея 13 издание (ГФ XIII)
Число омыления (Is) — количество калия гидроксида выраженное в миллиграммах, необходимое для нейтрализации свободных кислот и омыления сложных эфиров, содержащихся в 1,0 г испытуемого вещества.
ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ
ОФС.1.2.3.0008.15 Число омыления
Взамен ст. ГФ XI, вып.1
Числом омыления (Is) называют количество калия гидроксида выраженное в миллиграммах, необходимое для нейтрализации свободных кислот и омыления сложных эфиров, содержащихся в 1,0 г испытуемого вещества.
Методика
Точную навеску испытуемого вещества в зависимости от ожидаемого числа омыления (таблица) помещают в колбу с обратным холодильником вместимостью 250 мл. Прибавляют 25,0 мл калия гидроксида раствора спиртового 0,5 М и несколько стеклянных бусин, нагревают при кипении на водяной бане в течение 30 мин или времени, указанного в фармакопейной статье, до получения прозрачного раствора. Прибавляют 1 мл фенолфталеина раствора 1 % и немедленно, пока раствор горячий, оттитровывают избыток калия гидроксида хлористоводородной кислоты раствором 0,5 М.
Проводят контрольный опыт в тех же условиях.
Таблица. Навеска испытуемого вещества в зависимости от ожидаемого числа омыления
Число омыления (Is) вычисляют по формуле:
где
V1 – объем хлористоводородной кислоты раствора 0,5 М, израсходованный на титрование в основном опыте, мл;
V2 – объем хлористоводородной кислоты раствора 0,5 М, израсходованный в контрольном опыте, мл;
a – навеска испытуемого вещества, г;
28,05 – количество калия гидроксида, содержащееся в 1 мл калия гидроксида раствора спиртового 0,5 М, мг.
В случае трудно омыляемых веществ прибавляют 5 – 10 мл ксилола и нагревают более продолжительное время (время нагревания указывают в фармакопейной статье).
При анализе окрашенных масел конечную точку титрования устанавливают потенциометрически.
ВЫЧИСЛЕНИЕ ЧИСЛА ОМЫЛЕНИЯ ПО ДАННЫМ СОСТАВА ЖИРНЫХ КИСЛОТ
B.1 Общие положения
Формулы, приведенные в B.3 — B.6, позволяют рассчитать число омыления жиров и масел и составляющих их глицеридов на основе состава жирных кислот, выражаемого в форме жирных кислот, метиловых или других эфиров жирных кислот.
Приведенные формулы являются, таким образом, в полной мере подходящими для использования на компьютере. В B.7 приведен типичный пример, когда вычисления проводят вручную.
Метиловые эфиры жирных кислот определяют согласно [4], [5] и [6].
B.2 Символы и сокращения
Isc — вычисленное число омыления;
i — отдельная жирная кислота, эфир или триглицерид;
MF(i) — относительная молекулярная масса i-й жирной кислоты или эфира;
MT(i) — относительная молекулярная масса i-го триглицерида;
— относительная молекулярная масса CH2 (14,0267);
— относительная молекулярная масса H2 (2,0159);
MHCOOH — относительная молекулярная масса HCOOH (46,0255);
CF(i) — углеродное число i-й жирной кислоты или эфира;
CT(i) — углеродное число i-го триглицерида;
nF(i) — количество двойных связей в i-й жирной кислоте или эфире;
k — целочисленная постоянная для производной жирной кислоты;
NT(i) — количество двойных связей в i-м триглицериде;
— средняя относительная молекулярная масса всех жирных кислот в пробе;
wF(i) — процентная массовая доля i-й жирной кислоты или эфира;
xF(i) — процентная мольная доля i-й жирной кислоты или эфира;
wT(i) — процентная массовая доля i-го триглицерида;
xT(i) — процентная мольная доля i-го триглицерида.
B.3 Вычисление относительной молекулярной массы жирных кислот или эфиров
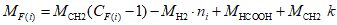
что эквивалентно
MF(i) = 14,0267·(CF(i) — 1) — 2,0159 ni +
+ 46,0255 + 14,0267 k,
где
k = 0 для кислоты;
k = 1 для метилового эфира;
k = 2 для этилового эфира;
k = 3 для пропилового эфира;
k = 4 для бутилового эфира.
Для кислот, относительная молекулярная масса которых дана пользователем:
MF(i) = MF(i) + 14,0267 k.
B.4 Вычисление относительной молекулярной массы триглицеридов
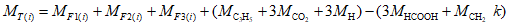
что эквивалентно
MT(i) = MF1(i) + MF2(i) + MF3(i) +
+ 176,1248 — 3·(46,0255 + 14,0267 k);
MT(i) = 14,0267 (CT(i) — 3) — 2,0159 nT(i) + 176,1248.
B.5 Вычисление средней относительной молекулярной массы триглицеридов
B.6 Вычисление числа омыления
Из определения числа омыления (см. раздел 3) для триглицеридов:
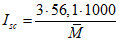
Для диглицеридов множитель 3 заменяют на 2, а для жирных кислот и моноглицеридов — на 1.
B.7 Пример
B.7.1 Состав метиловых эфиров жирных кислот в пробе
Используют пробу со следующим составом метиловых эфиров: 16:0 (массовая доля 10,6%), 18:0 (массовая доля 4,2%), 18:1 (массовая доля 22,7%), 18:2 (массовая доля 54,5%), 18:3 (массовая доля 8,0%).
B.7.2 Вычисление относительной молекулярной массы метиловых эфиров (k = 1)
MF(i) = 14,0267 (CF(i) — 1) — 2,0159 ni +
+ 46,0255 + (14,0267·1)
Ниже приведено несколько значений относительных молекулярных масс (г/моль):
— пальмитиновой кислоты — 270,45;
— стеариновой кислоты — 298,51;
— олеиновой кислоты — 296,49;
— линолевой кислоты — 294,47;
— линоленовой кислоты — 292,46.
B.7.3 Вычисление относительной молекулярной массы триглицеридов (k = 1)
Относительная молекулярная масса триглицеридов (ОММТ) является суммой молекулярных масс трех метиловых эфиров жирных кислот за вычетом молекулярной массы четырех атомов водорода (равной 4,0318).
MT(i) = MF1(i) + MF2(i) + MF3(i) — 4,0318
Для 16:0 ОММТ = 270,45 + 270,45 + 270,45 — 4,0318 = 806,72 г/моль;
Для 18:0 ОММТ = 298,51 + 298,51 + 298,51 — 4,0318 = 891,50 г/моль;
Для 18:1 ОММТ = 296,49 + 296,49 + 296,49 — 4,0318 = 885,44 г/моль;
Для 18:2 ОММТ = 294,47 + 294,47 + 294,47 — 4,0318 = 879,38 г/моль;
Для 18:3 ОММТ = 292,46 + 292,46 + 292,46 — 4,0318 = 873,35 г/моль.
B.7.4 Вычисление средней относительной молекулярной массы
При вычислении вручную для облегчения работы делают малое приближение, принимая, что wT(i) = wF(i), т.е. что массовые доли эквивалентных триглицеридов такие же, как массовые доли метиловых эфиров жирных кислот.
Средняя относительная молекулярная масса для всех триглицеридов равна:
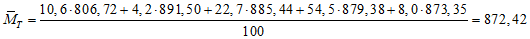
B.7.5 Вычисление числа омыления
Примечание — Окончательный результат округляют до целого числа.
B.8 Поправки на свободные жирные кислоты, частично этерифицированные глицериды и неомыляемое вещество
Для свободных жирных кислот и частично этерифицированных глицеридов соответствующие молекулярную массу и числа омыления вычисляют по формулам, приведенным в B.3 — B.6. Затем общую молекулярную массу и число омыления вычисляют посредством баланса масс из указанных процентных долей свободных жирных кислот и частично этерифицированных глицеридов.
Поправку на неомыляемое вещество вычисляют по формуле:
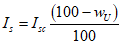
где wU — массовая доля неомыляемого вещества.
Приложение ДА
(справочное)
Скачать документ целиком в формате PDF