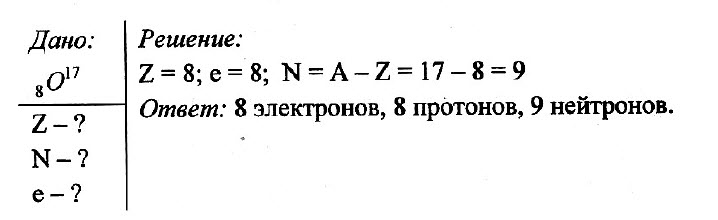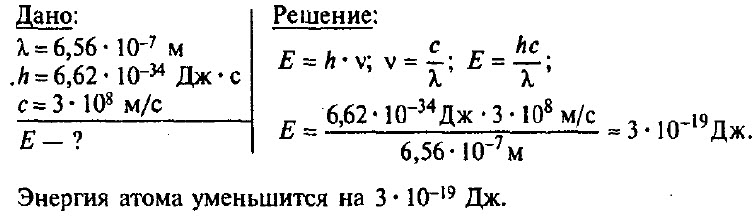Загрузить PDF
Загрузить PDF
Протоны, нейтроны и электроны – основные частицы, из которых состоит атом. Протоны заряжены положительно, электроны – отрицательно, а нейтроны и вовсе не имеют заряда.[1]
Масса электронов очень мала, а масса протонов и нейтронов практически одинакова.[2]
На самом деле, найти в атоме количество протонов, нейтронов и электронов довольно просто, нужно только научиться ориентироваться по периодической таблице химических элементов Д.И.Менделеева.
-
1
Возьмите периодическую таблицу элементов. Это система, в которой элементы организованы в зависимости от их атомной структуры. Цветное одно- или двухбуквенное сокращение – это название элемента в сокращенном виде. В таблице также представлена информация об атомном номере элемента и атомной массе.[3]
- Таблицу Менделеева можно найти в учебнике по химии или в Интернете.
- Во время контрольных работ периодическую таблицу обычно предоставляют.
-
2
Найдите в таблице нужный вам элемент. Каждый элемент в таблице располагается под своим номером. Все элементы можно разделить на металлы, неметаллы и метоллоиды (полуметаллы). В этих группах элементы классифицируются еще на несколько групп: щелочные металлы, галогены, инертные газы.[4]
- Группы (столбцы) и периоды (строки) нужны для систематизации, по ним легко найти нужный вам элемент.
- Если вы ничего не знаете о нужном вам элементе, просто найдите его в таблице.
-
3
Найдите атомный номер элемента. Атомный номер обозначает число протонов в ядре атома.[5]
Атомный номер располагается над символом элемента, обычно в левом верхнем углу клетки. Он покажет вам, сколько протонов содержится в одном атоме элемента.- Например, Бор (В) обозначен в таблице под номером 5, поэтому у него 5 протонов.
-
4
Определите количество электронов. Протоны — это положительно заряженные частицы в ядре атома. Электроны представляют собой частицы, которые несут отрицательный заряд. Поэтому когда элемент находится в нейтральном состоянии, то есть его заряд будет равен нулю, число протонов и электронов будет равным.
- Например, Бор (В) обозначен в таблице под номером 5, поэтому можно смело утверждать, что у него 5 электронов и 5 протонов.
- Однако если элемент содержит отрицательный или положительный ион, то протоны и электроны не будут одинаковыми. Вам придется вычислить их. Число ионов выглядит как маленький, верхний индекс после элемента.
-
5
Найдите атомную массу элемента. Чтобы найти число нейтронов, вам сначала нужно вычислить атомную массу элемента. Атомная масса – это средняя масса атомов данного элемента, ее нужно рассчитывать. Имейте в виду, что у изотопов атомная масса отличается.[6]
. Атомная масса указана под символом элемента.- Округляйте атомную массу до ближайшего целого числа. Например, атомная масса бора = 10,811, соответственно, ее можно округлить до 11.
-
6
Вычтите из атомной массы атомный номер. Чтобы определить количество нейтронов, нужно вычесть атомный номер из атомной массы. Помните, что атомный номер — это число протонов, которое вы уже определили.[7]
- Возьмем наш пример с бором: 11 (атомная масса) – 5 (атомный номер) = 6 нейтронов.
Реклама
-
1
Определите число ионов. Ион — это атом, состоящий из положительно заряженного ядра, в котором находятся протоны и нейтроны, и отрицательно заряженных электронов. Атом несет нейтральный заряд, но заряд может быть положительным и отрицательным из-за электронов, которые атом может отдавать и принимать.[8]
Поэтому число протонов в атоме не меняется, а число электронов в ионе может меняться.- Электрон несет отрицательный заряд, поэтому если атом отдает электроны, то сам становится заряженным положительно. Когда атом принимает электроны, он становится отрицательно заряженным ионом.
- Например, у N3- заряд -3, а у Ca2+ заряд +2.
- Помните, если число ионов не указано в таблице, вам не нужно делать подобные вычисления.
-
2
Вычтите заряд из атомного номера. Если ион положительно заряжен, нужно вычесть из атомного номера заряд. Если у иона положительный заряд, значит, он отдал электроны. Чтобы подсчитать оставшееся число электронов, нужно вычесть заряд от атомного номера. Если ион заряжен положительно, значит, в нем больше протонов, чем электронов.
- Например, у Ca2+ заряд +2, поэтому можно сказать, что он отдал два электрона. Атомный номер кальция = 20, поэтому у его иона 18 электронов (20-2=18).
-
3
Если ион заряжен отрицательно, чтобы узнать число электронов, нужно добавить заряд к атомному номеру. Потому что ион стал отрицательным из-за того, что принял лишние электроны. Так что нужно просто прибавить заряд к атомному номеру, тогда вы получите число электронов. Разумеется, если ион заряжен отрицательно, то электронов в нем больше, чем протонов.
- Например, у N3- заряд -3, значит, азот получил три дополнительных электрона. Атомный номер азота 7, поэтому число электронов у азота = 10. (то есть 7+3=10).
Реклама
Об этой статье
Эту страницу просматривали 956 052 раза.
Была ли эта статья полезной?
Задачи на Состав атома и ядерные реакции с решениями
Формулы, используемые на уроках «Задачи на Состав атома, ядерные реакции и энергия связи атомного ядра».
Название величины |
Обозначение |
Единица измерения |
Формула |
| Масса протона | mp | а.е.м | mp = 1,00728 |
| Масса нейтрона | mn | а.е.м | mn = 1,00867 |
| Число протонов | Z | ||
| Число нейтронов | N | ||
| Масса ядра | Mя | а.е.м | |
| Дефект масс | Δm | а.е.м, кг | Δm = (Zmp + Nmn) – Mя |
| Энергия связи ядра | ΔE0 | Дж | ΔE0 = Δmc2 |
| Скорость света |
c |
м/с |
c = 3•108 |
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Задача № 1.
Определите число электронов, протонов и нейтронов в атоме кислорода 8O17.
Задача № 2.
В результате α-pacnada ядро некоторого элемента превратилось в ядро радона 86Rn222. Что это был за элемент?
Задача № 3.
На сколько уменьшилась энергия атома, если при переходе из одного энергетического состояния в другое атом излучил свет длиной волны 6,56 • 10–7 м?
Задача № 4.
В какое ядро превращается торий после трех последовательных α-распадов?
Ответ:
Задача № 5.
В какое ядро превращается сурьма после четырех β-распадов?
Ответ:
Задача № 6.
Каким образом можно осуществить давнюю мечту алхимиков средневековья — превратить ртуть в золото?
Задача № 7.
Определите дефект масс и энергию связи ядра атома .
Ответ: 3,18 • 10–27 кг; 28,6 • 10–11 Дж.
Задача № 8.
Выделяется или поглощается энергия при следующей ядерной реакции: ?
Ответ: энергия поглощается.
Задача № 9.
Вычислите энергию связи ядра лития 3Li7. Масса ядра равна 7,01436 а.е.м.
Задача № 10.
Определите неизвестный продукт X каждой из ядерных реакций:
Решение:
Краткая теория для решения Задачи на Состав атома и ядерные реакции.
Алгоритм решения задачи на расчет энергии связи атомного ядра:
1. Определить количество протонов и нейтронов в ядре атома.
2. Вычислить дефект масс в атомных единицах массы.
3. Перевести атомные единицы массы в килограммы: 1 а.е.м. = 1,6605•10-27 кг.
4. Вычислить энергию связи; ответ записать в стандартном виде.
Важные замечания:
1. Вычисления сложные, поэтому лучше их производить с помощью микрокалькулятора.
2. В ходе вычисления дефекта масс нельзя ничего округлять, иначе дефект масс обратится в ноль. Округлить можно только результат.
Это конспект по теме «ЗАДАЧИ на Состав атома и ядерные реакции». Выберите дальнейшие действия:
- Перейти к теме: ЗАДАЧИ на
- Посмотреть конспект по теме ДИНАМИКА: вся теория для ОГЭ (шпаргалка)
- Вернуться к списку конспектов по Физике.
- Проверить свои знания по Физике.
|
Задание 10 № 8856 Произошла следующая ядерная реакция: Чему равно количество протонов в ядре атома Х? Это задание ОГЭ по физике и девятиклассникам совсем несложно решать такие задачи. Число протонов совпадает с зарядовым числом, а электрический заряд при любых процессах сохраняется, значит не меняется и количество протонов. На этом и основано решение подобных задач. Определяем количество протонов до реакции: 7 + 2 = 9. После реакции сумма также должна равняться 9. Составляем уравнение: 1+х = 9. х = 8. Ответ: количество протонов в ядре атома Х равно 8. Можно даже определить название этого элемента. Это изотоп кислорода с массовым числом 17. автор вопроса выбрал этот ответ лучшим Знаете ответ? |
Химический элемент
Химический элемент — совокупность атомов с одним и тем же зарядом ядра, числом протонов в ядре и электронов
в электронной оболочке. Закономерную связь химических элементов отражает периодическая таблица Д.И. Менделеева.
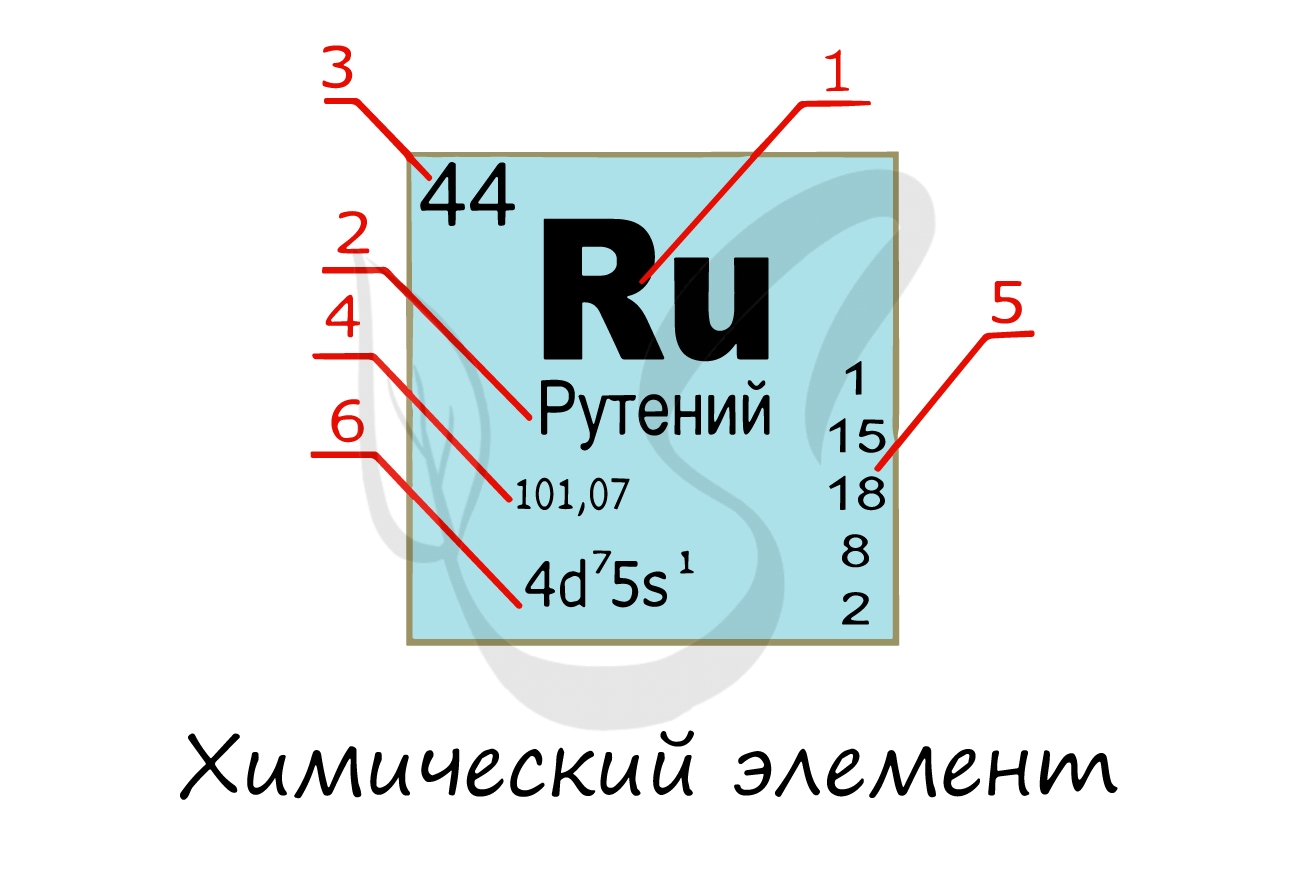
Изучая подобную карточку химического элемента, можно узнать о нем многое:
- Обозначение химического элемента
- Русское наименование
- Порядковый номер = заряд атома = число электронов = число протонов
- Атомная масса
- Распределение электронов по энергетическим уровням
- Электронная конфигурация внешнего уровня
Надо заметить, что на экзамене часто из карточки элемента скрывают распределение электронов и конфигурацию внешнего
уровня. Тем не менее, если вы успешно освоили предыдущую тему, то для вас не составит труда написать электронную
конфигурацию атома зная его порядковый номер в таблице Д.И. Менделеева (номер уж точно не тронут!))
Протоны, нейтроны и электроны
Вы уже знаете, что порядковый номер элемента в периодической таблице Д.И. Менделеева равен числу протонов, а число протонов
равно числу электронов.
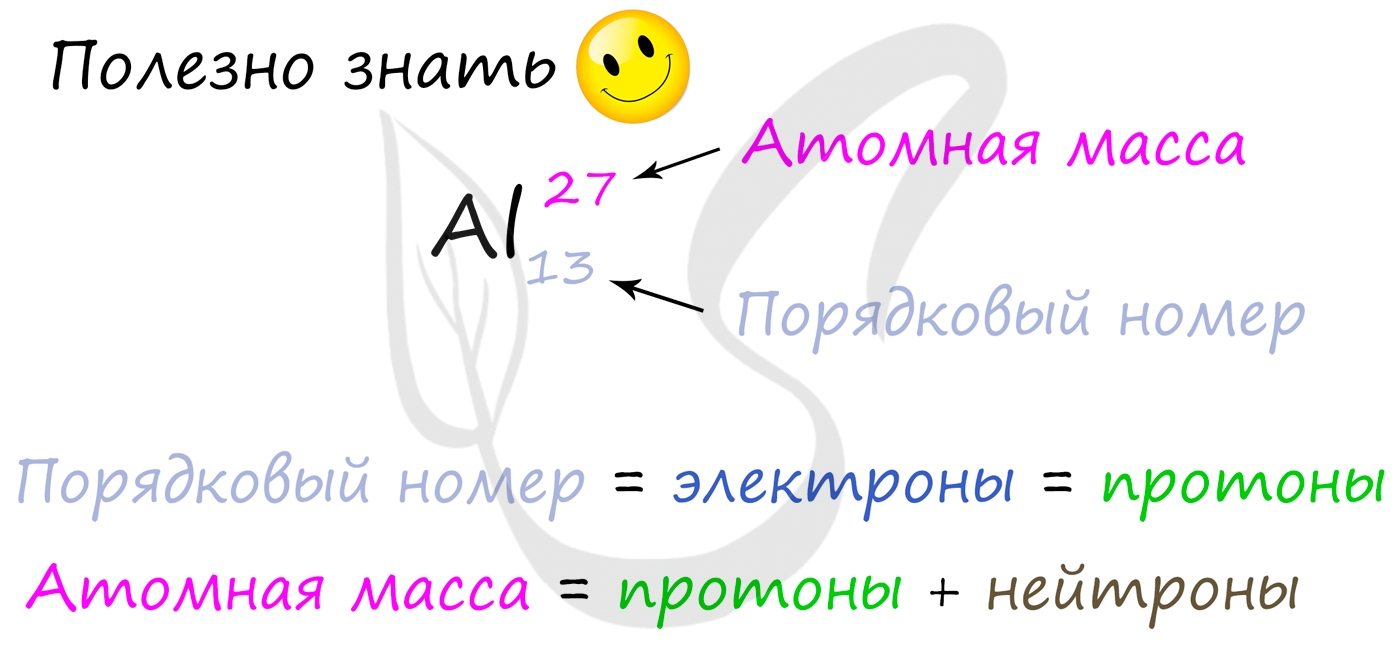
Для того чтобы найти число нейтронов в атоме алюминия, необходимо вычесть из атомной массы число протонов:
27 — 13 = 14
Получается, что в атоме алюминия 14 нейтронов. Посчитайте число нейтронов, электронов и протонов самостоятельно для атомов бериллия,
кислорода, меди. Решение вы найдете ниже.

Если вы поняли суть и научились считать протоны, нейтроны и электроны, самое время приступать к следующей теме.
Изотопы
Изотопы (греч. isos — одинаковый + topos — место) — общее название разновидностей одного и того же химического элемента,
имеющих одинаковый заряд ядра (число протонов), но разное число нейтронов.
Вероятно, вы не задумывались, но вся таблица Д.И. Менделеева и представленные в ней химические элементы — это самые распространенные
на земле изотопы.
Лучше всего объяснить, что такое изотопы наглядным примером. Широко известны три изотопа водорода: протий, дейтерий и тритий.
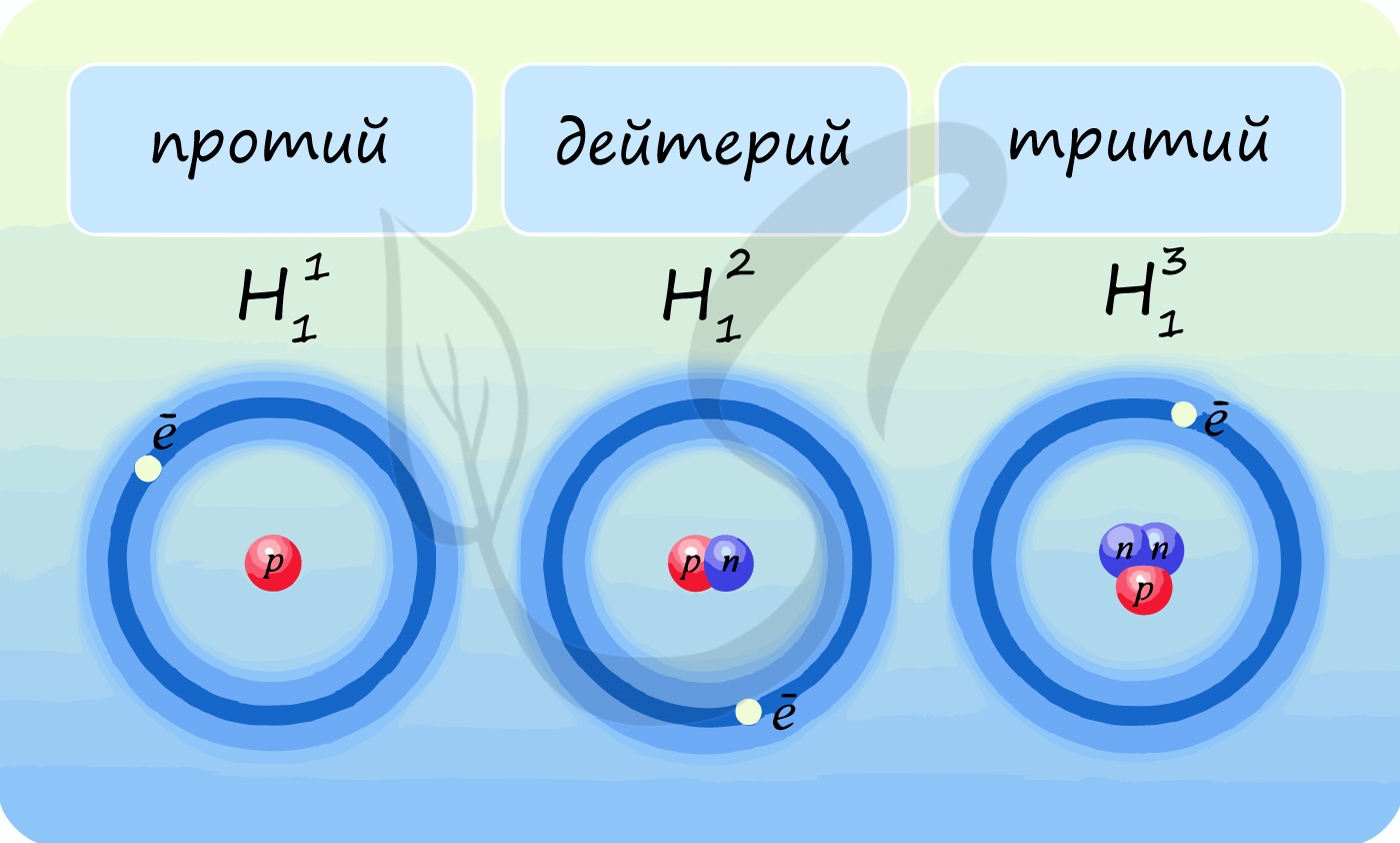
В таблице Д.И. Менделеева представлен самый распространенный из трех — протий. Он содержит 1 протон и 1 электрон, нейтроны отсутствуют. У
дейтерия 1 протон, 1 нейтрон и 1 электрон. У трития 1 протон, 2 нейтрона, 1 электрон.
Теперь очевидно, что изотопы — атомы одного и того же химического элемента, различающиеся числом нейтронов.
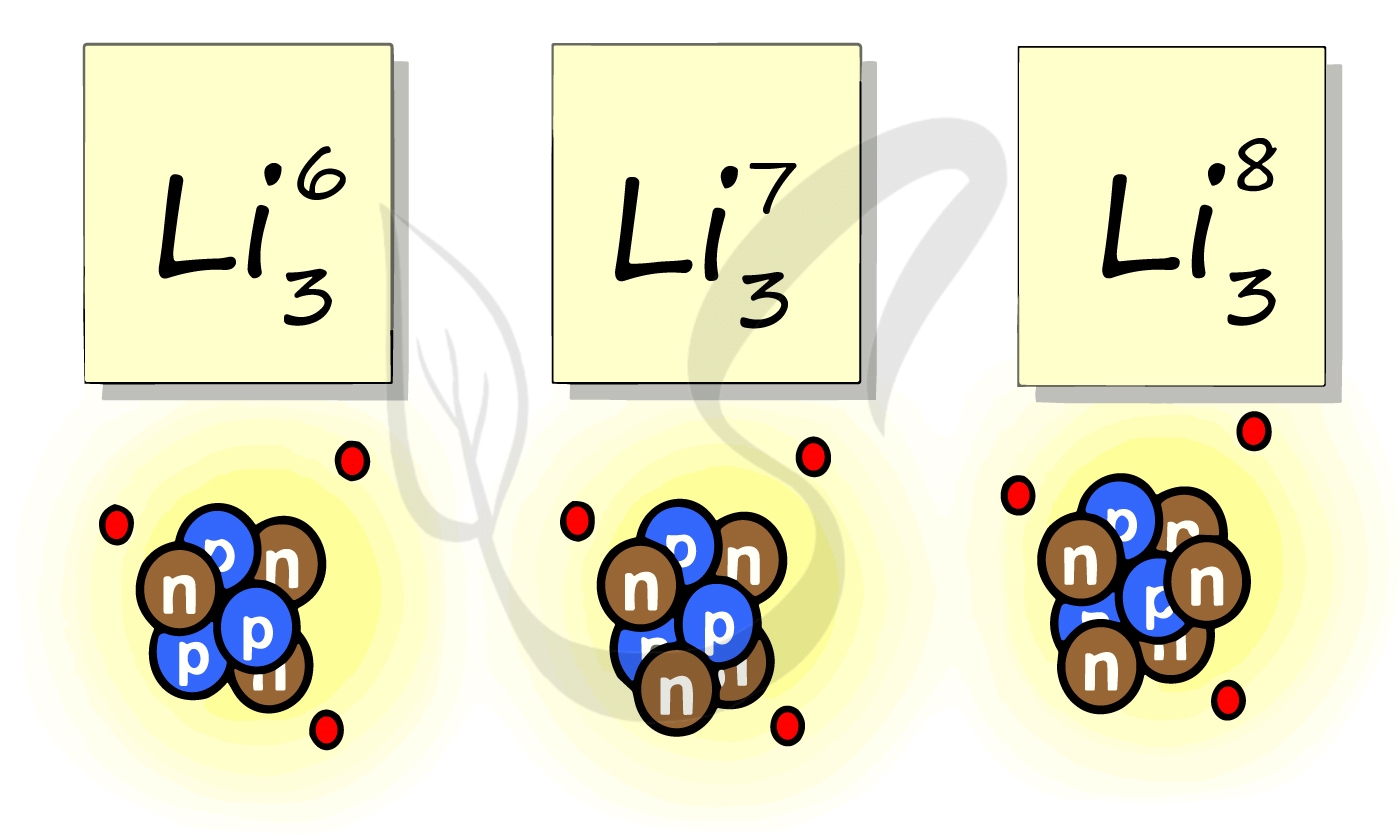
Рассмотрим пример с изотопами лития. Самостоятельно посчитайте количество нейтронов у каждого изотопа. Найдите тот, который
включен в таблицу Д.И. Менделеева.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
В курсе ядерной физики в школе изучается явление взаимного превращения одного вещества в другое. Данные превращения могут быть как спонтанные (радиоактивный распад), так и индуцированные (несколько ядер сталкивают друг с другом). В результате такой реакции получается новые вещества. Для описания таких превращений используют введённую нами форму записи для элементов и организуют их в подобие уравнения:
(1)
- где
Единственное, чем мы можем пользоваться в таких уравнениях, это простая логика — количество нуклонов и протонов в ходе реакции измениться не должно, таким образом, мы можем получить два уравнения:
(2)
(3)
Такие задачи обычно нацелены на поиск неизвестного элемента, и соотношений (2) — (3) для этого хватает. Находим количество протонов и нейтронов и, используя таблицу Менделеева, определяем нужный элемент.
Пример: пусть ядро азота и ядро гелия, сталкиваясь образуют ядро кислорода и неизвестный элемент. Найти данный элемент. По задаче сформируем уравнение:
(4)
Воспользуемся законом сохранения нуклонов (2) и (3):
Тогда искомый элемент — водород ().
Среди элементов, которые текстово могут встретиться в таких задачах, присутствуют:
Бетта-частица является обычным электроном, однако в ядре электронов нет, тогда электроны из ядра получается в результате ядерной реакции: .
Вывод: задачи на данную тематику практически всегда касаются поиска конкретного элемента в реакции. Поиск осуществляется законом сохранения нуклонов (уравнения (1) и (2)).