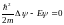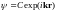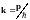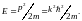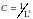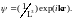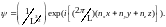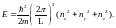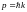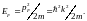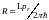Рассмотрим образец металла, который
для простоты будем считать имеющим
форму куба со стороной L. Допустим, что
электроны проводимости движутся в
пределах образца совершенно свободно,
т.е. U = 0. Тогда уравнение Шредингера для
свободного электрона в металле
(1.16)
Решение этого уравнения имеет вид
,
где
— волновой вектор электрона, связанный
с энергией соотношением
( 1.17)
Условие нормировки пси-функции запишется
в виде
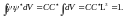
Полагая С вещественным, получим
,
и тогда
( 1.18)
Волновая функция должна удовлетворять
граничным условиям, которые заключаются
в том, что она должна быть периодической
по х, у, z с периодом L, тогда

где nx , nу
, nz — целые числа, принимающие
независимо друг от друга значения 0,
1, 2 ….
Следовательно, волновая функция
квантуется
(1.19)
Из (1.19) следует, что и энергия свободного
электрона в металле квантуется
( 1.20)
Таким образом, состояние электрона
задается четырьмя квантовыми числами
nx
, nу , nz
и s = 1/2.
Энергия электрона определяется суммой
квадратов квантовых чисел nx ,
nу , nz. Одной
и той же сумме квадратов квантовых чисел
соответствует несколько различных
комбинаций чисел nx , nу
, nz . Следовательно, уровни
энергии являются вырожденными . Уровень
Е0 (nx =0, nу
= 0, nz = 0) имеет кратность
вырождения, равную двум s =
12, Е1 —
двенадцать, Е2 — двадцать четыре
и т.д. Таким образом, с ростом энергии
увеличивается число состояний, отвечающих
данному значению Е. Теперь предположим,
что в нашем воображаемом кубе при Т = 0
содержится n свободных электронов.
Согласно принципу Паули, в каждом из
состояний может находиться не более
двух электронов. Все n электронов
стремятся заполнить низшие энергетические
состояния, образуя так называемый ферьми
— газ. Такой газ обладает
интересными свойствами, необычными с
точки зрения классической физики, на
которые впервые обратил внимание Энрико
Ферми. Данные n электронов заполнят все
энергетические уровни от низшего до
состояния с энергией ЕF. Поэтому
все состояния с энергией Е
ЕF будут заполнены, а с Е
ЕF — свободны. Энергия ЕF
называется энергией Ферми или уровнем
Ферми при абсолютном нуле.
Введем воображаемое k -пространство
( или, что то же самое, р — пространство;
),
по осям которого будем откладывать
значения квантовых чисел nx ,
nу , nz .
В этом пространстве каждой паре состояний
(отличающихся значениями s) соответствует
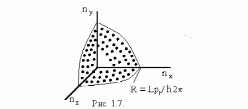
точка. Поверхность равных значений
энергии имеет форму сферы радиуса,
равного
.
Изоэнергетическая поверхность
в этом пространстве, соответствующая
энергии ЕF, носит название
поверхности Ферми. В случае
свободных электронов эта поверхность
описывается уравнением
и имеет форму сферы радиуса
.
Верхний квадрант этой сферы показан на
рис.1.7.
Величина ЕF играет существенную
роль в статистике Ферми-Дирака.
Лекция 4.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
1.3. Проводники и изоляторы
По поведению зарядов в наэлектризованном теле все вещества делятся на проводники и изоляторы (диэлектрики). В диэлектриках сообщённый им заряд остаётся в том месте, куда он был помещён при электризации. В проводниках сообщённый заряд может свободно перемещаться по всему телу. Именно поэтому проводящие тела можно заряжать электризацией через влияние. Почти все природные материалы попадают в одну из этих двух резко различных категорий. Есть, однако, вещества (среди которых следует назвать кремний, германий, углерод), принадлежащие к промежуточной, но тоже резко обособленной категории. Их называют полупроводниками.
С точки зрения атомной теории электроны в изоляторах связаны с атомами очень прочно, в то время как в проводниках многие электроны связаны с атомами очень слабо и могут свободно перемещаться внутри вещества. Такие электроны называют «свободными», или электронами проводимости. Слово «свободными» взято в кавычки, так как свойства электронов в металле значительно отличаются от свойств действительно свободных электронов в вакууме. В металлических телах – проводниках электричества – число свободных электронов огромно. Проиллюстрируем это утверждение на следующем примере.
Оцените число `n` свободных электронов в `V=1″м»^3` меди, считая, что в меди в среднем в расчёте на один атом свободным является один электрон. Плотность меди `rho=8,9*10^3 «кг»//»м»^3`, в `M=64` г меди содержится `N_A=6,02*10^(23)` атомов.
Согласно условию число свободных электронов в любом объёме меди равно числу атомов в нём. Поэтому определим число атомов в объёме `V`. Для этого следует массу меди `rhoV` разделить на `M` и умножить на `N_A`, т. е.
`N=(rhoV)/M N_A=(8,9*10^3*1)/(64*10^(-3))*6,02*10^(23)~~8,4*10^(28)`.
Найденная величина называется концентрацией носителей.
|
Посмотрим на гениальную таблицу «Периодическая система элементов» от русского ученого Дмитрия Менделеева. Таблица Дмитрия Менделеева весьма стройная и системная. Она отвечает на многие вопросы, в том числе и на заданный вами. Максимальное число электронов на энергетическом уровне: где n — номер энергетического уровня система выбрала этот ответ лучшим Вита75 8 лет назад Таблица Менделеева состоит из 8-ми столбцов, соответственно элементы в 1-ом столбце будут иметь по 1 электрону на внешнем слое , а в 8-ом по 8. Собственно количество электронов и определяет свойства элемента, (например щелчные металлы очень активны, а энертвые газы наоборот фактически не вступают ни в какие реакции). это связано с тем, что чем меньше электронов на внешнем слое тем их легче потерять, и труднее захватить свободный электрон при потере. Так же есть такие элементы как изотопы, которые при одинаковом количестве электронов на внешней оболочке имеют кординально разные свойства. (например дейтерий и тритий) оба имеют по 1-му электрону, но ядро дейтерия состоит из положительно заряженного протона и нейтрального нейтрона, он стабилен и относится скорее к водороду (тяжелый водород), а тритий, состоящий из протона и 2-ух нейтронов, радиактивен и по свойствам ближе к литию. В порироде не встречается из-за короткой живучести (период полураспада примерно 12 лет). Так к слову, есть такой изотоп кальция 48, имеется в виду что у него не 40 нейтронов в ядре как у обычного кальция у нас в костях, а 48, радиактивен, (в природе встречается крайне редко), нарабатывается в атомных реакторах, обстрелом нейтронами, несколько грамм за год. Служит для получения сверхтяжелых элементов (путем обстрела мишени из урана, плутония и т.д.). на данный момент самый дорогой элемент, 1 грамм стоит около 400000 евро. Чосик более года назад Для этого потребуется таблица Менделеева. В ней восемь групп, которые представлены как восемь столбиков. И как раз номер группы указывает, сколько электронов у элемента на последнем внешнем уровне. Например, берем водород — Н. Он относится к первой группе, идет первым. А мы знаем, что порядковый номер элемента совпадает с числом электронов на обиталях и с числом протонов в ядре. И у водорода на s-орбитали один электрон. Теперь берем литий — Li. Он также относится к первой группе, идет третьим. Его s-орбиталь заполнена, там два электрона. А последний, третий, находится на второй s-орбитали. Номер же периода указывается на число энергетических уровней. Литий относится ко второму периоду, потому у него два энергетических уровня. KritikSPb 4 года назад Чтобы определить, сколько электронов на внешнем энергетическом уровне, нужно открыть Периодическую таблицу Менделеева. В ней расположено 8 групп элементов. Номера группы и соответствуют количеству электронов на внешнем уровне. Например, элементы Гелий, аргон, железо, криптон, рутений, ксенон, осмий и радон принадлежат к восьмой группе, значит и электронов на внешнем уровне 8. У лития, натрия и калия — по одному электрону, у берилия, магния и кальция — 2, у алюминия — 3, у кремния и титана — по 4, у серы и хрома — по 6, у хлора и марганца — 7. Далее определяем электронные уровни элементов по аналогии. владсандрович более года назад Для решения данной задачи, нам просто необходимо, будет взглянуть в таблицу Менделеева. Она насчитывает в себе восемь групп. Они расположены в порядке восьми столбиков. Каждая группа имеет свой номер и этот самый номер как раз таки и говорит нам о том , сколько электронов имеет в себе тот или иной элемент, касательно его последнего внешнего уровня. Например железо относится к восьмой группе, а значит электронов на внешнем уровне оно имеет именно 8. Знаете ответ? |
По электронной формуле)
Например,возьмём литий(3-й по порядковому номеру)и составим его электронную формулу:
Порядковый номер=количество протонов=количество электронов
Значит,у Лития 3 электрона:
1s22s1
на втором s уровне к Лития всего один электрон из двух возможных,значит он неспаренный(то есть свободный)
Силиций 14-й в системе,значит у него 14 электронов:
1s2,2s2,2p6,3s2,3р2
На внешней орбитали(третьем уровне) у силиция 4 электрона(3s2,3p2)
3s уровень может содержать только 2 электрона,так что он заполним полностью и все электроны спаренные.
3р уровень может содержать 6 электронов,а у стлиция только 2,а так как (если представить себе структурно) сначала мы рисуем по одной стрелочке(электрону) в каждой ячейке,а потом уже заполняем по второй,то эти два электрона пошли в разные ячейки,а значит они неспаренные(свободные).
Если бы у какого-то элемента на 3р уровне было 5 электронов,то у него бы был 1 неспаренный электрона,если бы 4-2 электрона)))
Если что-то не ясно,жду вопросы в комментарии
Атомно-молекулярное учение
Мы приступаем к изучению химии — мира молекул и атомов. В этой статье мы рассмотрим базисные понятия и разберемся с электронными
формулами элементов.
Атом (греч. а — отриц. частица + tomos — отдел, греч. atomos — неделимый) — электронейтральная частица вещества микроскопических
размеров и массы, состоящая из положительно заряженного ядра (протонов) и отрицательно заряженных электронов (электронные орбитали).
Описываемая модель атома называется «планетарной» и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом

Протон (греч. protos — первый) — положительно заряженная (+1) элементарная частица, вместе с нейтронами образует ядра атомов
элементов. Нейтрон (лат. neuter — ни тот, ни другой) — нейтральная (0) элементарная частица, присутствующая в ядрах всех
химических элементов, кроме водорода.
Электрон (греч. elektron — янтарь) — стабильная элементарная частица с отрицательным электрическим зарядом (-1), заряд атома —
порядковый номер в таблице Менделеева — равен числу электронов (и, соответственно, протонов).
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20)
в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.

Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило:
порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим
электроны занимают различные энергетические уровни.
Энергетические уровни подразделяются на несколько подуровней:
- Первый уровень
- Второй уровень
- Третий уровень
- Четвертый уровень
Состоит из s-подуровня: одной «1s» ячейки, в которой помещаются 2 электрона (заполненный электронами — 1s2)
Состоит из s-подуровня: одной «s» ячейки (2s2) и p-подуровня: трех «p» ячеек (2p6), на которых
помещается 6 электронов
Состоит из s-подуровня: одной «s» ячейки (3s2), p-подуровня: трех «p» ячеек (3p6) и d-подуровня:
пяти «d» ячеек (3d10), в которых помещается 10 электронов
Состоит из s-подуровня: одной «s» ячейки (4s2), p-подуровня: трех «p» ячеек (4p6), d-подуровня:
пяти «d» ячеек (4d10) и f-подуровня: семи «f» ячеек (4f14), на которых помещается 14
электронов

Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число
электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а
также узнаете об исключении, которое только подтверждает данные правила.
Подуровни: «s», «p» и «d», которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или
атомным орбиталям, движутся электроны, создавая определенный «рисунок».
S-орбиталь похожа на сферу, p-орбиталь напоминает песочные часы, d-орбиталь — клеверный лист.

Правила заполнения электронных орбиталей и примеры
Существует ряд правил, которые применяют при составлении электронных конфигураций атомов:
- Сперва следует заполнить орбитали с наименьшей энергией, и только после переходить к энергетически более высоким
- На орбитали (в одной «ячейке») не может располагаться более двух электронов
- Орбитали заполняются электронами так: сначала в каждую ячейку помещают по одному электрону, после чего орбитали дополняются
еще одним электроном с противоположным направлением - Порядок заполнения орбиталей: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было
бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Без практики теория мертва, так что приступает к тренировке. Нам нужно составить электронную конфигурацию атомов углерода и
серы. Для начала определим их порядковый номер, который подскажет нам число их электронов. У углерода — 6, у серы — 16.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.

Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил.
А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся
одним электроном дополнили первую ячейку.
Таким образом, электронные конфигурации наших элементов:
- Углерод — 1s22s22p2
- Серы — 1s22s22p63s23p4
Внешний уровень и валентные электроны
Количество электронов на внешнем (валентном) уровне — это число электронов на наивысшем энергетическом уровне, которого достигает элемент. Такие электроны называются валентными: они могут быть спаренными или неспаренными. Иногда
для наглядного представления конфигурацию внешнего уровня записывают отдельно:
- Углерод — 2s22p2 (4 валентных электрона)
- Сера -3s23p4 (6 валентных электронов)
Неспаренные валентные электроны способны к образованию химической связи. Их число соответствует количеству связей, которые данный атом может образовать с другими атомами. Таким образом неспаренные валентные электроны тесно связаны с валентностью — способностью атомов образовывать определенное число химических связей.

- Углерод — 2s22p2 (2 неспаренных валентных электрона)
- Сера -3s23p4 (2 неспаренных валентных электрона)
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных
электронов. Ниже будет дано наглядное объяснение этой задаче.

Запишем получившиеся электронные конфигурации магния и скандия:
- Магний — 1s22s22p63s2
- Скандий — 1s22s22p63s23p64s23d1
В целом несложная и интересная тема электронных конфигураций отягощена небольшим исключением — провалом электрона, которое только подтверждает общее
правило: любая система стремится занять наименее энергозатратное состояние.
Провал электрона
Провалом электрона называют переход электрона с внешнего, более высокого энергетического уровня, на предвнешний, энергетически более
низкий. Это связано с большей энергетической устойчивостью получающихся при этом электронных конфигураций.
Подобное явление характерно лишь для некоторых элементов: медь, хром, серебро, золото, молибден. Для примера выберем хром, и рассмотрим
две электронных конфигурации: первую «неправильную» (сделаем вид, будто мы не знаем про провал электрона) и вторую правильную, написанную
с учетом провала электрона.
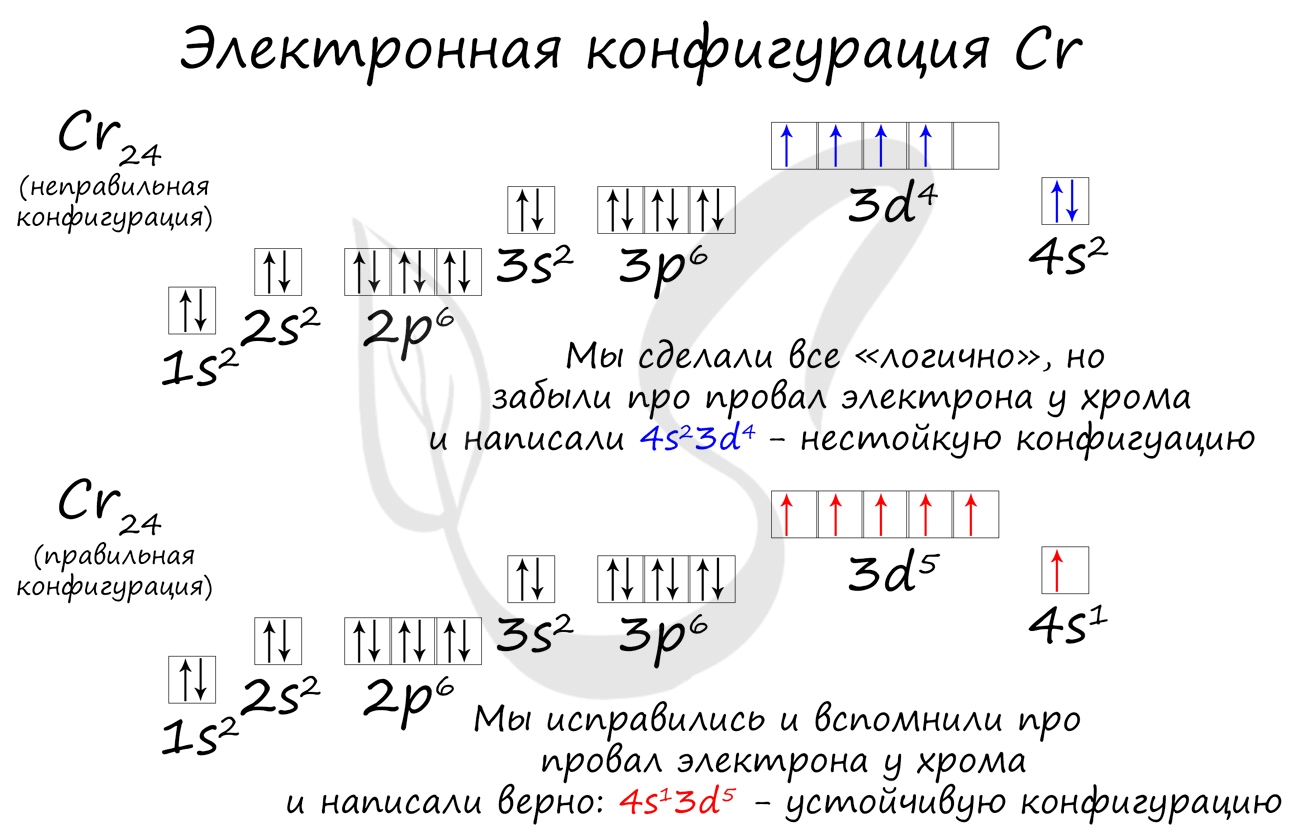
Теперь вы понимаете, что кроется под явлением провала электрона. Запишите электронные конфигурации хрома и меди самостоятельно еще раз и
сверьте с представленными ниже.

Основное и возбужденное состояние атома
Основное и возбужденное состояние атома отражаются на электронных конфигурациях. Возбужденное состояние связано с движением электронов
относительно атомных ядер. Говоря проще: при возбуждении пары электронов распариваются и занимают новые ячейки.
Возбужденное состояние является для атома нестабильным, поэтому долгое время в нем он пребывать не может. У некоторых атомов: азота,
кислорода , фтора — возбужденное состояние невозможно, так как отсутствуют свободные орбитали («ячейки») — электронам некуда перескакивать, к тому
же d-орбиталь у них отсутствует (они во втором периоде).
У серы возможно возбужденное состояние, так как она имеет свободную d-орбиталь, куда могут перескочить электроны. Четвертый энергетический
уровень отсутствует, поэтому, минуя 4s-подуровень, заполняем распаренными электронами 3d-подуровень.
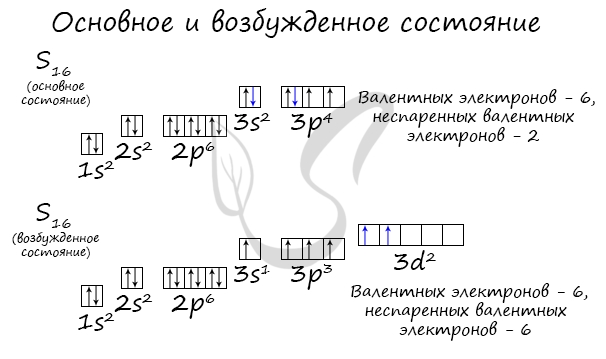
По мере изучения основ общей химии мы еще не раз вернемся к этой теме, однако хорошо, если вы уже сейчас запомните, что возбужденное состояние
связано с распаривание электронных пар.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.