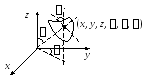12. Число степеней свободы молекул. Внутренняя энергия идеального газа
При
определении внутренней энергии газа важную роль играет понятие числа степеней
свободы молекул. Под числом степеней свободы системы подразумевается число
независимых координат, полностью определяющих положение системы в пространстве.
В первом приближении молекула газа может быть рассмотрена как материальная
точка, обладающая тремя степенями свободы поступательного движения. Однако,
такое приближение оказывается справедливым только для одноатомных молекул, для
которых можно пренебречь энергией вращательного движения из-за малости ее
момента инерции.
В механике многоатомные молекулы принято рассматривать как
совокупность жестко связанных материальных точек. Например, двухатомная
молекула состоит из двух материальных точек. Такая молекула обладает тремя
степенями свободы поступательного движения (тремя координатами центра масс) и
двумя степенями свободы вращательного движения вокруг двух осей,
перпендикулярных линии связи атомов. Вращение молекулы вокруг третьей оси не
учитывается ввиду чрезвычайной малости энергии вращательного движения вокруг
этой оси. Это значит, что жесткая двухатомная молекула обладает пятью степенями
свободы (. Трехатомная нелинейная молекула имеет шесть
степеней свободы: три поступательные и три вращательные степени свободы вокруг
трех осей симметрии молекулы (рис.7).
Рис. 7
Считать, что связи атомов в молекулах являются жесткими
несправедливо. Поэтому в реальных молекулах следует учитывать также степени
свободы колебательного движения атомов в молекулах. Очевидно, что независимо от
общего числа степеней свободы три степени свободы молекул всегда поступательные
степени свободы. Все три степени свободы равноправны и поэтому естественно
полагать, что на каждую степень свободы поступательного движения приходится
энергия . В классическую статистическую физику Больцман
ввел теорему, согласно которой не только на каждую поступательную степень
свободы, но и на вращательные степени свободы приходится одинаковая энергия . На каждую колебательную степень свободы
приходится энергия , т.е в два раза большая энергия, так как
колеблющаяся частица обладает не только кинетической также и потенциальной
энергией, причем их средние значения одинаковы. С учетом всех степеней свободы
молекулы ее средняя энергия может быть выражена формулой
,
(2.40)
где —
сумма чисел поступательных, вращательных и удвоенного числа колебательных
степеней свободы молекулы
. (2.41)
В
идеальном газе потенциальная энергия взаимодействия молекул равна нулю, поэтому
внутренняя энергия идеального газа складывается только из кинетических энергий
движения. Внутренняя энергия одного моля газа складывается из энергий молекул:
. (2.42)
Внутренняя
энергия любой массы газа
. (2.43)
Молекулы могут участвовать в разных типах движения: поступательном (любые молекулы), вращательном (двух – и многоатомные), колебательном (двух – и многоатомные).
это число независимых параметров (координат), необходимых для однозначного описания положения тела в пространстве.
Для описания положения в пространстве одноатомной молекулы потребуется всего три координаты, что соответствует тому, что она обладает тремя степенями свободы (см. рис. 1).
Принято обозначать число степеней свободы буквой ii. Для рассматриваемого примера i=3.i = 3. Наличие этих трёх координат фактически указывает на способность тела двигаться в трёх направлениях, или, как говорят, обладает тремя поступательными степенями свободы (рис. 1).
Для описания положения в пространстве двухатомной молекулы потребуется учесть способность центра масс этой молекулы двигаться в трёх направлениях (три поступательные степени свободы) и способность вращаться вокруг двух осей, проходящих через центр масс (две вращательные степени свободы). Третья ось, проходящая и через центры атомов двухатомных молекул, не изменяет положения атомов, и потому не рассматривается (на рис. 2 пунктирные оси и фигурные оси).
У трёхатомных или многоатомных молекул их было бы три.
И последнее возможное движение — это колебания атомов относительно центра масс молекулы. Такое движение приводит к изменению расстояния dd. (на рис. 2 показано для одного атома).
Этот тип движения атомов в молекуле «даёт о себе знать» только при температурах выше некоторой характерной температуры (для большинства молекул она составляет примерно `1000` К). При более высокой температуре есть смысл рассматривать эту одну колебательную степень свободы, а при более низкой — считать, что данная степень свободы отсутствует.
Таким образом, для описания положения в пространстве двухатомной молекулы требуется 6 величин:
1) три координаты центра масс (поступательные степени свободы),
2) два угла (вращательные степени свободы) и
3) одно расстояние dd между атомами (колебательная степень свободы).
| В итоге имеем | i=6 i = 6 при высокой температуре (T>1000 К)(T>1000;mathrm К) и |
| i=5 i = 5 при низкой температуре (T<1000 К)(T<1000;mathrm К). |
Число степеней свободы, подсчитываемое для расчёта энергии, отличается от выше описанного в части колебательного движения.
128
11.1. Число степеней свободы молекулы. Закон равномерного распределения энергии по степеням свободы молекул
Напишем рядом
выражение для давления и уравнение
состояния идеального газа:


,
средняя кинетическая
энергия поступательного движения
молекул:
.
Вывод:
абсолютная температура есть величина,
пропорциональная средней энергии
поступательного
движения молекул.
Это выражение
замечательно тем, что средняя энергия
оказывается зависящей только от
температуры и не зависит от массы
молекулы.
Однако, наряду с
поступательным
движением возможны также вращение
молекулы и колебания атомов, входящих
в состав молекулы. Оба этих вида движения
(вращение и
колебание)
связаны с некоторым запасом энергии,
определить который позволяет положение
о равнораспределении энергии по степеням
свободы молекулы.
Числом степеней
свободы механической системы называется
количество независимых величин, с
помощью которых может быть задано
положение системы.
Например: 1.
Материальная точка имеет 3 степени
свободы, так как ее положение в пространстве
полностью определяется заданием значений
трех ее координат.
2. Абсолютно
твердое тело имеет 6 степеней свободы,
так как его положение можно определить
задав координаты его центра масс (x,
y,
z)
и углы ,
и .
Измерение координат центра масс при
неизменных углах ,
и
обуславливается поступательным движением
твердого тела, следовательно,
соответствующие степени свободы
называются поступательными. Степени
свободы, связанные с вращением твердого
тела называются вращательными.
3. Система из N
материальных точек имеет 3N
степеней свободы. Любая жесткая связь,
устанавливающая неизменное взаимное
расположение двух точек уменьшает число
степеней свободы на единицу. Так, если
точек две, то число степеней свободы
равно 5: 3 поступательные и 2 вращательные
(вокруг осей
).
Если связь не
жесткая, а упруга, то число степеней
свободы равно 6 – три поступательные,
две вращательные и одна колебательная
степень свободы.
Из опытов по
измерению теплоемкости газов вытекает,
что при определении числа степеней
свободы молекулы следует рассматривать
атомы как материальные точки. Одноатомной
молекуле приписывают 3 поступательные
степени свободы; двухатомной молекуле
с жесткой связью – 3 поступательные и
2 вращательные степени свободы; двухатомной
молекуле с упругой связью – 3 поступательные,
2 вращательные и 1 колебательную степень
свободы; трехатомной молекуле приписывают
3 поступательные и 3 вращательные степени
свободы.
Закон Больцмана
о равнораспределении энергии по степеням
свободы: сколько бы степеней свободы
не имела молекула три из них поступательные.
Поскольку ни одна из поступательных
степеней свободы не имеет преимуществ
перед остальными, на любую из них должна
приходиться в среднем одинаковая
энергия, равная 1/3 значения
,
т.е..
Итак, закон
распределения: на каждую степень свободы
приходится в среднем одинаковая
кинетическая энергия, равная
(поступательную и вращательную), а на
колебательную степень свободы – энергия,
равнаяKT.
Согласно закону равнораспределения
среднее значение энергии одной молекулы
тем больше, чем сложнее молекула, чем
больше у нее степеней свободы.
Колебательная
степень свободы должна обладать вдвое
большей энергетической емкостью, чем
поступательная или вращательная степень
свободы, потому что на нее приходится
не только кинетическая, но и потенциальная
энергия (среднее значение потенциальной
и кинетической энергии для гармонического
осциллятора оказывается одинаковым);
таким образом, средняя энергия молекулы
должна равняться
, где
.
Таблица 11.1
|
Газ |
Модель |
Число |
|||
|
|
|
|
Всего |
||
|
Одноатомный |
|
3 |
|
|
3 |
|
Двухатомный |
Жесткая |
3 |
2 |
|
5 |
|
Двухатомный |
Упругая |
3 |
2 |
1 |
7 |
|
Трехатомный |
|
3 |
3 |
|
6 |
Соседние файлы в папке 432_lecfiz
- #
- #
- #
- #
- #
- #
- #
- #