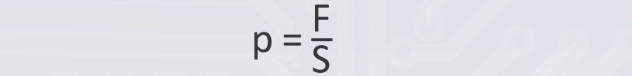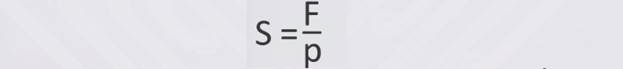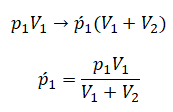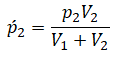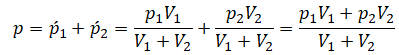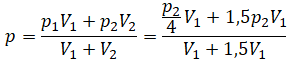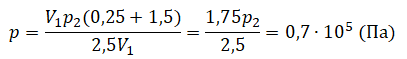Задачи на давление жидкостей и газов
с ответами и решениями
Формулы, используемые на уроках «Задачи на давление жидкостей и газов».
Название величины |
Обозначение |
Единица измерения |
Формула |
Высота столба жидкости |
h |
м |
h = p / (pg) |
Плотность жидкости |
р |
кг/м3 |
p = p / (gh) |
Давление |
р |
Па |
p = pgh |
Постоянная |
g ≈ 10 или 9,8 или 9,81(зависит от условия задачи) |
Н/кг
|
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Задача № 1.
Определить давление бензина на дно цистерны, если высота столба бензина 2,4 м, а его плотность 710 кг/м3.
ОТВЕТ: 17,04 кПа.
Задача № 2.
Какая жидкость находится в сосуде, если столб высотой 0,3 м оказывает давление 5400 Па ?
ОТВЕТ: Серная кислота (1800 кг/м3).
Задача № 3.
Плотность спирта 800 кг/м3. Какова будет высота столба спирта при давлении 2,4 кПа?
ОТВЕТ: 0,3 м. Чтобы увидеть решение, нажмите на спойлер ниже.
Смотреть РЕШЕНИЕ задачи в тетради
Задача № 4.
В цилиндре с маслом на поршень действует сила 40 Н. Чему равна сила давления на внутреннюю поверхность цилиндра площадью 8 дм2? Площадь поршня 2,5 см2. Вес масла не учитывайте.
ОТВЕТ: 12,8 кН.
Смотреть РЕШЕНИЕ задачи в тетради
Задача № 5.
Вычислите давление и силу давления керосина на дно бака площадью 50 дм2, если высота столба керосина в баке 40 см.
ОТВЕТ: 3200 Па; 1600 Н.
Смотреть РЕШЕНИЕ задачи в тетради
Задача № 6.
В мензурку, площадь дна которой 20 см2, налита вода до высоты 10 см. Сколько граммов воды налито? Чему равно давление воды на дно мензурки?
ОТВЕТ:
Смотреть РЕШЕНИЕ задачи в тетради
Задача № 7.
Рыба камбала находится на глубине 1200 м и имеет площадь поверхности 560 см2. С какой силой она сдавливается водой?
ОТВЕТ: 678 кН.
Смотреть РЕШЕНИЕ задачи в тетради
Задача № 8.
На какой глубине давление воды в море равно 412 кПа?
ОТВЕТ: 40 м.
Смотреть РЕШЕНИЕ задачи в тетради
Задача № 9.
Поршневой насос может произвести давление 5 • 105 Па. На какую высоту можно поднять воду этим насосом?
ОТВЕТ: 51 м.
Смотреть РЕШЕНИЕ задачи в тетради
Задача № 10.
В сталелитейном производстве «изложницей» называется чугунный стакан без дна, в который выливают расплавленный металл. Верхнее отверстие изложницы немного меньше нижнего для того, чтобы можно было изложницу снять с отвердевшего слитка, когда остынет металл. Чтобы металл снизу не выливался, изложницы ставят на плоское основание и делают их очень массивными. На рисунке слева изображена изложница, справа — подъем изложницы с отлитого слитка. Определите силу давления, которую производит на подложку изложницы налитый чугун, если высота изложницы 1,5 м, а площадь нижнего основания 1600 см2. Плотность чугуна 7000 кг/м3.
ОТВЕТ: 17 кН.
Смотреть РЕШЕНИЕ задачи в тетради
Задача № 11.
Как велика должна быть высота столба ртути и столба спирта, если этот столб производит давление в 105 Па?
ОТВЕТ: ртути — 75 см, спирта — 12,76 см.
Смотреть РЕШЕНИЕ задачи в тетради

Задача № 12.
Батискаф опустился в море на глубину 50 м. Каково давление на поверхность батискафа на данной глубине? (Плотность морской воды 1010 кг/м3.)
ОТВЕТ: 606 кПа.
Смотреть РЕШЕНИЕ задачи в тетради

Задача № 13.
Человек стоит на кожаном мешке с водой. Рассчитайте, на какую высоту поднимается вода в трубке, если масса человека 75 кг, площадь соприкасающейся с мешком поверхности платформы 1000 см2.
ОТВЕТ: 0,75 м.
Смотреть РЕШЕНИЕ задачи в тетради
Задача № 14 (повышенной сложности).
Брусок массой m = 2 кг имеет форму параллелепипеда. Лежа на одной из граней, он оказывает давление p1 = 1 кПа, лежа на другой — давление 2 кПа, стоя на третьей — давление 4 кПа. Каковы размеры бруска?
ОТВЕТ: 5 см, 10 см, 20 см.
Указание к РЕШЕНИЮ. Обозначим размеры бруска а, b, с, где а > b > с. Тогда из условия следует, что b = а/2, с = а/4, p1 = mg/(ab) = 2mg/a2. Отсюда , а = 20 см, b = 10 см, c = 5 см.
Задача № 15 (олимпиадный уровень).
Оцените массу атмосферы Земли (радиус Земли R = 6400 км)
ОТВЕТ: примерно 5 • 1018 кг.
Указание к РЕШЕНИЮ. Вес атмосферы равен силе давления воздуха на всю поверхность Земли, площадь которой S = 4πR2. Следовательно, mg = ра • 4πR2, где ра = 105 Па — атмосферное давление. Отсюда m = 4πR2 ра /g = 5 • 1018 кг. Эта величина составляет менее одной миллионной части полной массы нашей планеты. Такая простая оценка массы атмосферы возможна потому, что основная часть атмосферы сосредоточена на высотах, малых по сравнению с радиусом Земли. Поэтому можно считать, что вес атмосферы равен mg, где g — ускорение свободного падения вблизи поверхности Земли.
Краткая теория по теме «Задачи на давление жидкостей»
Давление жидкости на покоящееся в ней тело называют гидростатическим давлением. Гидростатическое давление на глубине h равно р = ратм + p*g*h
Закон Паскаля. Жидкость и газ передают оказываемое на них давление во всех направлениях одинаково.
Вы смотрели конспект урока «Задачи на Давление жидкостей с ответами и решениями». Выберите дальнейшие действия:
- Перейти к теме: ЗАДАЧИ на Давление твердых тел с ответами и решениями.
- Перейти к теме: ЗАДАЧИ на Сообщающиеся сосуды и гидравлический пресс с решениями.
- Вернуться к Списку конспектов по физике для 7-11 классов
- Найти конспект через Кодификатор ОГЭ по физике
- Найти конспект через Кодификатор ЕГЭ по физике
Уравнение Менделеева-Клапейрона .
( PV=nu RT )
( P ) — Давление газа (Паскали)
( V ) — Объем газа
( nu ) — Количество вещества
( R ) — Универсальная газовая посиоянная
( T ) — Температура в Кельвинах
Репетитор по физике
8 916 478 10 32
Задача 1.
В баллоне находится газ под давлением (P= 8,31 cdot 10^6 ; Па ), температура газа (T=300 К ).
Количество вещества газа ( nu=100 Моль ).
Найти объем баллона
Универсальная газовая постоянная ( R=8,31 frac{Дж}{Моль cdot K} )
Дать ответ в литрах.
Показать ответ
Показать решение
Видеорешение
Задача 2.
Давление сжатого воздуха в баллоне (P= 1,662 cdot 10^7 ; Па ; ), а его температура (T=400 К )
Количество вещества газа ( nu=50 Моль )
Найти объем баллона
Универсальная газовая постоянная ( R=8,31 frac{Дж}{Моль cdot K} )
Дать ответ в литрах.
Показать ответ
Показать решение
Видеорешение
Задача 3.
Найти давление газа, находящегося в баллоне вместимостью (V=41,55 литров ) при ( T=273 К ; ), если количество
вещества этого газа ( nu=10 моль . )
Универсальная газовая постоянная ( R=8,31 frac{Дж}{Моль cdot K} )
Дать ответ в килопаскалях.
Показать ответ
Показать решение
Видеорешение
Задача 4.
Каково давление кислорода, если объем занимаемый газом (V=66,48 л) при (t=27^0C ), если
его количество вещества ( nu=30 моль ? )
Универсальная газовая постоянная ( R=8,31 frac{Дж}{Моль cdot K} )
Дать ответ в килопаскалях.
Показать ответ
Показать решение
Видеорешение
Задача 5.
Какое количество вещества воздуха содержится в куполе воздушного шара, если при давлении (P=10^5 Па ) и температуре (t=57^0C ) его объем
(V=150 м^3 ? )
Ответ округлить до целых
Универсальная газовая постоянная ( R=8,31 frac{Дж}{Моль cdot K} )
Показать ответ
Показать решение
Видеорешение
Задача 6.
Вычислить температуру ( nu = 0,5 моль ) воздуха , если при давлении (P=9 cdot 10^5 Па)
его объем (V=950 см^3 )
Ответ округлить до целых
Универсальная газовая постоянная ( R=8,31 frac{Дж}{Моль cdot K} )
Показать ответ
Показать решение
Видеорешение
Содержание:
- § 1 Повторение необходимых формул
- § 2 Решение задач
- § 3 Важно запомнить
§ 1 Повторение необходимых формул
В этом уроке мы рассмотрим решение задач на расчет давления в жидкостях и газах, атмосферное давление и законы сообщающихся сосудов.
Для решения задач нам нужно вспомнить формулы: давление равно отношению силы, действующей перпендикулярно поверхности, к площади поверхности:
Сила давления равна весу P = mg, площадь поверхности прямоугольной формы S = ab.
Давление в жидкостях и газах зависит от плотности и высоты столба жидкости или газа:
p = gρh.
Нам также пригодится знание нормального атмосферного давления: 760 мм рт.ст. = 101300 Па = 1 013гПа. Перевод атмосферного давления в международную систему единиц: 1 мм рт.ст. = 133,3 Па.
При решении задач на сообщающиеся сосуды нам нужно помнить, что при равенстве давлений поверхности однородной жидкости находятся на одном уровне, поверхности разнородных жидкостей устанавливаются на высоте, обратно пропорциональной их плотностям.
§ 2 Решение задач
Рассмотрим решение первой задачи:
Определите глубину погружения батискафа, если на его иллюминатор площадью 0,12 м2 давит вода с силой 1,9 МН.
Запишем условие задачи: площадь иллюминатора S = 0,12 м3, сила давления F = 1,9 МН = 1 900 000 Н в системе СИ, плотность морской воды ρ = 1030 кг/м3. Найти глубину погружения h.
Ответ: глубина погружения батискафа 1530 м
Ширина шлюза 10 м. Шлюз заполнен водой на глубину 5 м. С какой силой вода давит на ворота шлюза?
Запишем условие задачи: ширина шлюза а = 10 м, глубина воды h = 5 м, плотность воды ρ = 1000 кг/м3. Найти силу давления F на ворота шлюза.
Решение: Силу давления воды можем найти из формулы давления. Выразим: F = pS. В этой формуле p – давление воды. Если бы нам нужно было найти силу давления воды на дно реки, то мы учли бы всю высоту столба воды над дном. В этой задаче требуется найти силу давления на ворота, т.е. на стенку сосуда. Давление воды на верхнюю и нижнюю части стенки неодинаково, так как давление жидкости зависит от высоты столба жидкости. В таких случаях определяют среднее значение силы давления. Для этого силу давления, испытываемую воротами шлюза на максимальной глубине, делят на 2. Итак, средняя сила давления воды на ворота шлюза (на стенки сосуда) F = pS/2.
Ворота шлюза прямоугольной формы, поэтому S = ab = ah = 10 м · 5 м = 50 м2.
Ответ: сила давления воды на ворота 1250 кН
Каково показание барометра на уровне высоты Останкинской телебашни (540 м), если у поверхности земли нормальное атмосферное давление?
Запишем условие задачи. Известна высота башни h = 540 м, p1 — нормальное атмосферное давление 760 мм рт. ст., в системе СИ 101 300 Па. Найти давление на высоте: p2.
Решение. Измерениями установлено, что в среднем через каждые 12 м высоты атмосферное давление уменьшается на 1 мм рт.ст. Составим пропорцию, обозначим за х изменение давления на высоте 540 м. Тогда х = 540 м умножаем на 1 мм рт.ст. и делим на 12 м = 45 мм рт.ст.
Вычтем ответ из значения давления на поверхности земли: 760 – 45 мм рт.ст. = 715 мм рт.ст. Выразим ответ в международной системе единиц: 1 мм рт.ст. = 133, 3 Па. Тогда 715 мм.рт.ст. умножим на 133,3, получим 95 309,5 Па.
Ответ: давление на высоте 540 м составляет 95 309,5 Па
В правое колено сообщающихся сосудов налит керосин, а в левое – вода. Высота керосина 20 см. Определите, на сколько уровень керосина выше верхнего уровня воды.
§ 3 Важно запомнить
Чтобы найти давление тела на опору, надо силу давления (вес тела) разделить на площадь опоры:
Из формулы давления можно найти силу давления (вес тела) F = pS и площадь поверхности, на которую тело оказывает давление:
Давление в жидкостях и газах определяется по формуле p = gρh . Из этой формулы можно найти высоту столба жидкости или газа:
Две формулы
можно использовать вместе в одной задаче для расчета неизвестных величин, характеризующих жидкости или газы.
Нормальное атмосферное давление равно 760 мм рт.ст. или 101 300 Па.
Соотношение между единицей Паскаль и мм рт.ст.: 1 мм рт.ст. = 133,3 Па.
Список использованной литературы:
- Волков В.А. Поурочные разработки по физике: 7 класс. – 3-е изд. – М.: ВАКО, 2009. – 368 с.
- Волков В.А. Тесты по физике: 7-9 классы. – М.: ВАКО, 2009. – 224 с. – (Мастерская учителя физики).
- Кирик Л.А. Физика -7. Разноуровневые самостоятельные и контрольные работы. — М.: Илекса, 2008. – 192 с.
- Контрольно-измерительные материалы. Физика: 7 класс / Сост. Зорин Н.И. – М.: ВАКО, 2012. – 80 с.
- Марон А.Е., Марон Е.А. Физика. 7 Дидактические материалы. – М.: Дрофа, 2010. – 128 с.
- Перышкин А.В. Физика. 7 класс — М.: Дрофа, 2011.
- Тихомирова С.А. Физика в пословицах и поговорках, стихах и прозе, сказках и анекдотах. Пособие для учителя. – М.: Новая школа, 2002. – 144 с.
- Я иду на урок физики: 7 класс. Часть III: Книга для учителя. – М.: Издательство «Первое сентября», 2002. – 272 с.
Давление смеси газов равно сумме их парциальных давлений.
p = p1’ + p2’ + … .
К примеру, давление воздуха складывается из давления азота, кислорода, углекислого газа, водяного пара и т. д.
Определение
Парциальное давление — давление, которое производил бы данный газ, если бы другие газы отсутствовали.
Применение закона Дальтона при решении задач
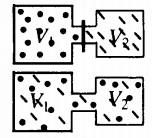
Самая популярная задача на закон Дальтона, это случай, когда газы находятся в сосудах, соединенных трубкой с краном. По условию этой задачи нужно найти давление, которое установится после того, как этот кран будет открыт.
После открытия крана первый и второй газы заполнят оба сосуда. Используем закон Бойля — Мариотта для первого газа (так как температура остается постоянной):
Этот же закон можем применить для второго газа. Тогда мы получим:
Применим закон Дальтона и получим:
Пример №1. Два сосуда соединены трубкой с краном. Определить давление, которое установится после того, как кран будет открыт. Считать, что объем второго сосуда в 1,5 раза больше первого. Давление во втором сосуде составляет половину от атмосферного давления. В первом сосуде оно меньше в 4 раза.
Проанализируем условия задачи и запишем:
V2 = 1,5V1
p2 = 4p1
p2 = 105 Па
Теперь можем применить выведенную ранее формулу:
Преобразуем выражение и найдем установившееся давление:
Задание EF17512
Три одинаковых сосуда, содержащих разреженный газ, соединены друг с другом трубками малого диаметра: первый сосуд – со вторым, второй – с третьим. Первоначально давление газа в сосудах было равно соответственно р, 3р и р. В ходе опыта сначала открыли и закрыли кран, соединяющий второй и третий сосуды, а затем открыли и закрыли кран, соединяющий первый сосуд со вторым. Как изменилось в итоге (уменьшилось, увеличилось или осталось неизменным) количество газа в первом сосуде? (Температура газа оставалась в течение всего опыта неизменной.)
Алгоритм решения
1.Записать исходные данные.
2.Применить закон Дальтона для определения давления в первом сосуде.
3.Применить закон Менделеева — Клапейрона для установления характера изменения количества газа в первом сосуде в ходе эксперимента.
Решение
Запишем исходные данные:
• Объемы сосудов равны: V1 = V2 = V3 = V.
• Температуры равны: T1 = T2 = T3 = T.
• Давления распределены следующим образом: p1 = p, p2 = 3p, p3 = p.
После того, как открыли кран между 2 и 3 сосудом, объем возрос вдвое, и давление распределилось по нему равномерно. Согласно закону Дальтона, оно стало равным сумме давлений, оказываемых газами в количестве вещества ν2 и ν3. Так как объем после открытия крана увеличивается вдвое, то парциальное давление каждого из количества вещества равно половине исходного давления:
p23=p2+3p2=2p
Потом кран 2–3 закрыли, но открыли кран 1–2. Применим закон Дальтона, получим:
p12=2p2+p2=3p2
Теперь применим закон Менделеева — Клапейрона:
pV=νRT
Для начального состояния газа в 1 сосуде:
pV=ν1RT
Для конечного состояния газа в 1 сосуде:
3p2V=ν2RT
Так как температура и объем неизменны, но давление увеличилось в 1,5 раза, то и количество газа в первом сосуде увеличилось в 1,5 раза.
Ответ: Увеличилось
pазбирался: Алиса Никитина | обсудить разбор
Задание EF18873

Для каждой величины определите соответствующий характер изменения:
- увеличилась
- уменьшилась
- не изменилась
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
Алгоритм решения
1.Записать исходные данные.
2.Установить характер изменения парциального давления неона.
3.Применить закон Менделеева — Клапейрона, чтобы установить характер изменения общего давления смеси газов.
Решение
Исходные данные:
• Количество неона: ν1 = 1 моль.
• Количество аргона: ν2 = 1 моль.
• Количество впущенного аргона: ν4 = 1 моль.
Сначала парциальное давление неона и аргона равно. Это объясняется тем, что давление газов при неизменном количестве вещества зависит только от объема и температуры. Эти величины постоянны.
Когда из сосуда выпустили половину газовой смеси, в нем оказалось по половине моля каждого из газов. Затем в сосуд впустили 1 моль аргона. Следовательно, в сосуде стало содержаться 0,5 моль неона и 1,5 моль аргона. Запишем уравнение Менделеева — Клапейрона:
pV=νRT
Из уравнения видно, что давление и количество вещества — прямо пропорциональные величины. Следовательно, если количество неона уменьшилось, то его парциальное давление тоже уменьшилось.
Общая сумма количества вещества равна сумме количеств вещества 1 (неона) и 2 (аргона): 0,5 + 1,5 = 2 (моль). Изначально в сосуде тоже содержалось 2 моль газа. Так как количество вещества, температура и объем сохранились, давление тоже осталось неизменным.
Ответ: 23
pазбирался: Алиса Никитина | обсудить разбор
Алиса Никитина | Просмотров: 3.5k
Задание. В идеальном газе проводят процесс, при котором $p=frac,$ где $U$ — внутренняя энергия газа; $A=const$ для определенного газа. Сравните коэффициенты пропорциональности $A$, если в первом случае газ одноатомный, во втором двух атомный. textit<>
Решение. Внутренняя энергия идеального газа для любого процесса равна:
Подставим правую часть уравнения, которое описывает заданный в условиях задачи процесс ($p=frac$) вместо давления в (1.2), имеем:
Для одноатомного газа $i=3$; для двухатомного газа (без учета колебаний молекул) $i=5$.
Задание. На рис.1 представлены процессы, проводимые с постоянной массой идеального газа, укажите, как изменяются давления в процессах?
Решение. Уравнение процесса можно аналитически описать уравнением:
где $A$ и $B$ положительные постоянные величины.
Из уравнения (2.4) следует, что при увеличении температуры $frac$ уменьшается, следовательно, знаменатель дроби правой части выражения (2.4) увеличивается, значит, давление уменьшается.
Ответ. Давление в заданном процессе уменьшается.
Источник
Как вычислить давление газа
Как найти давление газа? Какие есть формулы?
Формулы для определения давления газа применимы только для так называемого идеального газа. Это такой газ, когда пренебрегается взаимодействием между молекулами. Для этого газ должен быть достаточно разряженным.
Газ с хорошей точностью можно считать идеальным вплоть до давлений 20 – 30 атмосфер. Так что атмосферу Земли можно считать идеальной даже у самой поверхности Земли. Давление газа на какую-либо поверхность определяется ударами молекул об эту поверхность.
Естественно, что тогда давление газа должно зависеть от скоростей движения молекул. Вот формула для определения давления газа р
Естественно, что давление зависит от числа молекул N, от массы молекулы m, от средней скорости движения молекул v и от объема сосуда V, где находятся молекулы. Средняя кинетическая энергия молекулы равна Е = mv^2/2. Тогда получим следующую формулу для расчета давления газа через среднюю энергию молекул
Больцман рассчитал, что средняя кинетическая энергия молекул пропорциональна абсолютной температуре Т. Е = (3/2)kT, где k – постоянная Больцмана и T – абсолютная температура. Тогда получим для давления идеального газа формулу р = (NkT)/V. Перепишем эту формулу в следующем виде
Концентрация молекул в газе равна n = N/V. Тогда формула (3) примет такой вид
Концентрацию молекул можно выразить через произведение числа молей ν на число частиц в моле N = νNa. Произведение Na*k = R. Где R – газовая постоянная. Тогда (4) запишется в виде
Число молей газа ν = M/μ, где М – масса газа и μ – масса одного моля (молярная масса). Тогда уравнение (5) примет вид
Уравнение состояния идеального газа в таком виде называют уравнением Клапейрона – Менделеева. При постоянных температуре и массе из (6) следует, что
То есть давление будет обратно пропорционально объему газа. Такой закон получил название закона Бойля – Мариотта. Если же постоянным является давление, то
Давление пропорционально абсолютной температуре. Этот закон получил название закон Шарля.
Вот и используйте любую из этих формул для расчета давления газа.
Давление идеального газа, теория и примеры
На нашем сайте собрано более 100 бесплатных онлайн калькуляторов по математике, геометрии и физике.
Основные формулы, таблицы и теоремы для учащихся. Все что нужно, чтобы сделать домашнее задание!
Не можете решить контрольную?!
Мы поможем! Более 20 000 авторов выполнят вашу работу от 100 руб!
Молекулы в идеальном газе совершают движения, при этом они ударяются о стенки сосуда, в котором газ находится, создавая этим давление газа на стенки. Это давление (p) легко вычисляется исходя из представлений молекулярно-кинетической теории (МКТ). Для облегчения данной задачи вводят следующие упрощения:
- Так как давление газа не зависит от формы сосуда, в котором этот газ находится, поэтому будем считать, что сосуд имеет форму прямоугольного параллелепипеда, стороны которого.
- Пусть сталкивающиеся со стенкой молекулы газа испытывают зеркальное отражение от нее, без изменения величины скорости, взаимодействуют со стеной по закону абсолютно упругого удара.
- Все направления движения молекул следует считать равновероятными, если газ находится в равновесии. Для упрощения считаем, что молекулы движутся только в трех взаимно перпендикулярных направлениях, которые совпадают с ребрами параллелепипеда. Тогда, если в сосуде находится N молекул, то в каждом направлении движетсямолекул (вдоль одного ребра).
Вычисление давления идеального газа
Выделим на стенке сосуда маленькую площадку, определим каково давление, которое газ оказывает на нее.
При соударении молекула, которая движется по нормали к площадке, передает ей импульс равный:
где– масса молекулы, v – скорость молекулы. За время равноевыделенной площадки достигают только те молекулы, которые находятся в объеме цилиндра основание которого равно, а высота:. Количество таких молекул равно, где n – число молекул в единице объема газа.
На самом деле молекулы движутся к выделенной площади под разными углами и имеют разные скорости, и скорость молекулы при каждом соударении со стенкой изменяется. Тогда принимая во внимание пункт 3 сделанных нами допусков имеем, что число ударов молекул о площадкубудет равно:.
Импульс, который получает стенка при ударах этого числа молекул, равен:
В таком случае давление газа на стенку получается равно:
Определим среднеквадратичную скорость (), которая характеризует всю совокупность молекул газа, как:
где N – число молекул в объема газа равном V. Тогда давление идеального газа равно:
Уравнение (5) называют основным уравнением МКТ. Приведенный вывод формулы (5) является очень приблизительным, но точный расчет давления с учетом движения молекул по всем направлениям даст такую же формулу.
Основное уравнение МКТ часто записывают в виде:
где– средняя кинетическая энергия поступательного перемещения молекул газа.
Давление идеального газа можно вычислить, применяя уравнения состояния:
где T – температура газа по абсолютной шкале температур (в К).
или уравнение состояния, называемое уравнением Менделеева — Клапейрона
где– молярная масса газа; R- универсальная газовая постоянная.
Примеры решения задач
Понравился сайт? Расскажи друзьям!
Давление газа
Отвечая на первый, из поставленных выше, вопрос, предположим, что давление газов на стенки сосуда объясняется ударами молекул.
Для того, чтобы в процессе поиска расчетной формулы этого давления ограничиться знаниями элементарной математики и физики, введем некоторые упрощения.
- Форма, строение молекул достаточно сложны. Но попробуем представить их в виде маленьких шариков. Это позволит нам применить к описанию процесса удара молекул о стенки сосуда законы механики, в частности, второй закон Ньютона.
- Будем считать, что молекулы газа находятся на достаточно большом расстоянии друг от друга, так, что силы взаимодействия между ними пренебрежимо малы. Если между частицами отсутствуют силы взаимодействия, соответственно, равна нулю и потенциальная энергия взаимодействия. Назовем газ, отвечающий этим свойствам, .
- Известно, что молекулы газа движутся с разными скоростями. Однако, усредним скорости движения молекул и будем считать их одинаковыми.
- Предположим, что удары молекул о стенки сосуда абсолютно упругие (молекулы ведут себя при ударе подобно резиновым мячикам, а не подобно куску пластилина). При этом скорости молекул изменяются лишь по направлению, а по величине остаются прежними. Тогда изменение скорости каждой молекулы при ударе равно –2υ.
Введя такие упрощения, рассчитаем давление газа на стенки сосуда.
Давление – это физическая величина, равная отношению перпендикулярной составляющей силы, действующей на поверхность, к площади этой поверхности.
Сила действует на стенку со стороны множества молекул. Она может быть рассчитана как произведение силы, действующей со стороны одной молекулы, на число молекул, движущихся в сосуде в направлении этой стенки.
Так как пространство трехмерно и каждое измерение имеет два направления: положительное и отрицательное, можно считать, что в направлении одной стенки движется одна шестая часть всех молекул (при большом их числе): N = N0 / 6.
Сила, действующая на стенку со стороны одной молекулы, равна силе, действующей на молекулу со стороны стенки. Сила, действующая на молекулу со стороны стенки, равна произведению массы одной молекулы на ускорение, которое она получает при ударе о стенку:
Ускорение же – это физическая величина, определяемая отношением изменения скорости ко времени, в течение которого это изменение произошло: a = Δυ / t.
Изменение скорости равно удвоенному значению скорости молекулы до удара: Δυ = –2υ.
Если молекула ведет себя подобно резиновому мячику, нетрудно представить процесс удара: молекула, ударяясь, деформируется. На процесс сжатия и разжатия затрачивается время.
Пока молекула действует на стенку сосуда, о последнюю успевает удариться еще некоторое число молекул, находящихся от нее на расстояниях не дальше l = υt. (Например, условно говоря, пусть молекулы имеют скорость 100 м/с. Удар длится 0,01 с.
Тогда за это время до стенки успеют долететь и внести свой вклад в давление молекулы, находящиеся от нее на расстояниях 10, 50, 70 см, но не далее 100 см).
Будем рассматривать объем сосуда V = lS.
Подставив все формулы в исходную, получаем уравнение:
где:– масса одной молекулы,– среднее значение квадрата скорости молекул, N – число молекул в объеме V.
Сделаем некоторые пояснения по поводу одной из величин, входящих в полученное уравнение.
Так как движение молекул хаотично и преимущественного движения молекул в сосуде нет, их средняя скорость равна нулю. Но ясно, что это не относится к каждой отдельной молекуле.
Для вычисления давления идеального газа на стенку сосуда используется не среднее значение x-компоненты скорости молекула среднее значение квадрата скорости
Чтобы введение этой величины было более понятным, рассмотрим численный пример.
Пусть четыре молекулы имеют скорости 1, 2, 3, 4 усл. ед.
Квадрат среднего значения скорости молекул равен:
Среднее значение квадрата скорости равно:
Если скорости молекул равны +1, –2 , –3 , +4 усл. ед., то квадрат среднего значения скорости равен:
Среднее значение квадрата скорости равно:
Средние значения проекций квадрата скорости на оси x, y, z связаны со средним значением квадрата скорости соотношением:
Если извлечь квадратный корень изто получим величину, которая называется молекул.
Величина, определяемая отношением числа частиц к объему, в котором они находятся, называется (обозначается буквой n).
Величина же– это каждой молекулы газа.
С учетом этого полученное уравнение можно переписать в виде:
Уравнения связывают макропараметры газа – его давление и объем (p, V) с микропараметрами – массой молекул и их скоростью (m0, υ), или энергией
Последнее уравнение читается следующим образом: давление идеального газа на стенки сосуда прямо пропорционально концентрации молекул в сосуде и их средней кинетической энергии.
Как найти массу газа зная объем давление и температуру
Молярную массу обычно выражают в г/моль, реже в кг/кмоль. Поскольку в одном моле любого вещества содержится одинаковое число структурных единиц, то молярная масса вещества пропорциональная массе соответствующей структурной единицы, т.е. относительной атомной массе данного вещества (Mr):
где κ – коэффициент пропорциональности, одинаковый для всех веществ. Относительная молекулярная масса – величина безразмерная. Её вычисляют, используя относительные атомные массы химических элементов, указанных в Периодической системе Д.И. Менделеева.
Молекулярную массу вещества в газообразном состоянии можно определить, используя понятие о его молярном объеме. Для этого находят объем, занимаемый при нормальных условиях определенной массой данного вещества, а затем вычисляют массу 22,4 л этого вещества при тех же условиях.
Для достижения данной цели (вычисление молярной массы) возможно использование уравнения состояния идеального газа (уравнение Менделеева-Клапейрона):
где p – давление газа (Па), V – объем газа (м3), m – масса вещества (г), M – молярная масса вещества (г/моль), Т – абсолютная температура (К), R – универсальная газовая постоянная равная 8,314 Дж/(моль×К).
Молярную массу газа можно рассчитать, как произведение его плотности по отношению к любому другому газу на молекулярную массу последнего. Под плотностью понимают отношение массу определенного объема данного газа к массе такого же объема другого газа (при одинаковых температуре и давлении), молекулярная масса которого известна.
Примеры решения задач
Как вычислить давление газа
Для решения некоторых физических задач бывает необходимо рассчитывать давление газа. При этом в задаче может упоминаться как окружающий воздух и пары вещества, так и газ, который находится в сосуде. Как именно вычислить давление газа, зависит от того, какие параметры заданы в задаче.
— формулы для расчета давления газа.
Спонсор размещения P&G Статьи по теме «Как вычислить давление газа» Как вычислить объем газа Как найти объем газа при нормальных условиях Куда углекислый газ уносится кровью
Найдите давление идеального газа при наличии значений средней скорости молекул, массы одной молекулы и концентрации вещества по формуле P=?nm0v2, где n – концентрация (в граммах или молях на литр), m0 – масса одной молекулы.
Если в условии дана плотность газа и средняя скорость его молекул, рассчитайте давление по формуле P=??v2, где ? — плотность в кг/м3.
Вычислите давление, если вы знаете температуру газа и его концентрацию, используя формулу P=nkT, где k – постоянная Больцмана (k=1,38·10-23 моль·К-1), Т — температура по абсолютной шкале Кельвина.
Найдите давление из двух равноценных вариантов уравнения Менделеева-Клайперона в зависимости от известных значений: P=mRT/MV или P=?RT/V, где R – универсальная газовая постоянная (R=8,31 Дж/моль·К), ? — количество вещества в молях, V – объем газа в м3.
Если в условии задачи указана средняя кинетическая энергия молекул газа и его концентрация, найдите давление с помощью формулы P=?nEк, где Eк — кинетическая энергия в Дж.
Найдите давление из газовых законов — изохорного (V=const) и изотермического (T=const), если дано давление в одном из состояний.
При изохорном процессе отношение давлений в двух состояниях равно отношению температур: P1/P2=T1/T2.
Во втором случае, если температура остается постоянной величиной, произведение давления газа на его объем в первом состоянии равно тому же произведению во втором состоянии: P1·V1=P2·V2. Выразите неизвестную величину.
Рассчитайте давление из формулы внутренней энергии идеального одноатомного газа: U=3·P·V/2, где U – внутренняя энергия в Дж. Отсюда давление будет равняться: P=?·U/V.
При расчете парциального давления пара в воздухе, если в условии даны температура и относительная влажность воздуха, выразите давление из формулы ?/100=Р1/Р2, где ?/100 — относительная влажность, Р1 — парциальное давление водяного пара, Р2 — максимальное значение паров воды при данной температуре. В ходе расчета пользуйтесь таблицами зависимости максимальной упругости пара (максимального парциального давления) от температуры в градусах Цельсия.
Давление газа
ПодробностиКатегория: О давленииОпубликовано 02.12.2014 16:18Просмотров: 8631
Где бы ни находился газ: в воздушном шаре, автомобильной шине, или металлическом баллоне — он заполняет собой весь объём сосуда, в котором находится.
Давление газа возникает совсем по другой причине, нежели давление твёрдого тела. Оно образуется в результате ударов молекул о стенки сосуда.
Давление газа на стенки сосуда
Двигаясь хаотично в пространстве, молекулы газа сталкиваются между собой и со стенками сосуда, в котором находятся. Сила удара одной молекулы мала. Но так как молекул очень много, и сталкиваются они с большой частотой, то, действуя сообща на стенки сосуда, они создают значительное давление. Если в газ помещено твёрдое тело, то оно также подвергается ударам молекул газа.
Проведём несложный опыт. Под колокол воздушного насоса поместим завязанный воздушный шарик, не полностью наполненный воздухом. Так как воздуха в нём мало, шарик имеет неправильную форму. Когда же мы начнём откачивать воздух из-под колокола, шарик станет раздуваться. Через некоторое время он примет форму правильного шара.
Что же произошло с нашим шариком? Ведь он был завязан, следовательно, количество воздуха в нём осталось прежним.
Всё объясняется довольно просто. Во время движения молекулы газа сталкиваются с оболочкой шарика снаружи и внутри него. Если воздух откачивается из колокола, молекул становится меньше.
Уменьшается плотность, а значит и частота ударов молекул о наружную оболочку также уменьшается. Следовательно, давление снаружи оболочки падает. А так как внутри оболочки число молекул осталось прежним, то внутреннее давление превышает наружное.
Газ давит изнутри на оболочку. И по этой причине она постепенно раздувается и принимает форму шара.
Закон Паскаля для газов
Молекулы газа очень подвижны. Благодаря этому давление они передают не только в направлении действия силы, вызывающей это давление, но и равномерно по всем направлениям.
Закон о передаче давления сформулировал французский учёный Блез Паскаль: «Давление, производимое на газ или жидкость, передаётся без изменений в любую точку по всем направлениям».
Этот закон называют основным законом гидростатики — науки о жидкости и газе в состоянии равновесия.
Закон Паскаля подтверждается опытом с прибором, который называют шаром Паскаля. Этот прибор представляет собой шар из твёрдого вещества с проделанными в нём крошечными отверстиями, соединённый с цилиндром, по которому двигается поршень. Шар заполняется дымом. При сжатии поршнем дым выталкивается из отверстий шара одинаковыми струйками.
Давление газа вычисляют по формуле:
где еlin— средняя кинетическая энергия поступательного движения молекул газа;
n — концентрация молекул
Парциальное давление. Закон Дальтона
На практике чаще всего нам приходится встречаться не с чистыми газами, а с их смесями. Мы дышим воздухом, являющимся смесью газов. Выхлопные газы автомобилей — тоже смесь. При сварке уже давно не применяется чистый углекислый газ. Вместо него также используют газовые смеси.
Газовой смесью называют смесь газов, не вступающих в химические реакции между собой.
Давление отдельного компонента газовой смеси называется парциальным давлением.
Если предположить, что все газы смеси являются идеальными газами, то давление смеси определяется законом Дальтона: «Давление смеси идеальных газов, не взаимодействующих химически, равно сумме парциальных давлений».
Его величина определяется по формуле:
Каждый газ в смеси создаёт парциальное давление. Его температура равна температуре смеси.
Давление газа можно изменить, меняя его плотность. Чем больше газа будет закачано в металлический баллон, тем больше в нём будет молекул, ударяющихся о стенки, и тем выше станет его давление. Соответственно, откачивая газ, мы разрежаем его, и давление снижается.
Но давление газа также можно изменить, изменив его объём или температуру, то есть, сжав газ. Сжатие проводят, воздействуя силой на газообразное тело. В результате такого воздействия уменьшается занимаемый им объём, повышается давление и температура.
Газ сжимается в цилиндре двигателя при движении поршня. На производстве высокое давление газа создают, сжимая его с помощью сложных устройств — компрессоров, которые способны создать давление до нескольких тысяч атмосфер.
Уравнение Клапейрона-Менделеева. Связь между числом молей газа, его температурой, объемом и давлением
Калькулятор ниже предназначен для решения задач на использование уравнения Клапейрона-Менделеева, или уравнение состояния идеального газа. Некоторая теория изложена под калькулятором, ну а чтобы было понятно, о чем идет речь — пара примеров задач:
Примеры задач на уравнение Менделеева-Клапейрона
В колбе объемом 2,6 литра находится кислород при давлении 2,3 атмосфер и температуре 26 градусов Цельсия .
Вопрос: сколько молей кислорода содержится в колбе?
Вопрос: Каков объем этого газа при нормальных условиях? (Напомню, что нормальными условиями для газов считается давление в 1 атмосферу и температура 0 градусов Цельсия)
В калькулятор вводим начальные условия, выбираем, что считать (число моль, новые объем, температуру или давление), заполняем при необходимости оставшиеся условия, и получаем результат.
Знаков после запятой: 2
Теперь немного формул.
Уравнение Клапейрона-Менделеева
где P — давление газа (например, в атмосферах) V — объем газа (в литрах); T — температура газа (в кельвинах); R — газовая постоянная (0,0821 л·атм/моль·K).
Если используется СИ, то газовая постоянная равна 8,314 Дж/K·моль
Так как m-масса газа в (кг) и M-молярная масса газа кг/моль, то m/M — число молей газа, и уравнение можно записать также
где n — число молей газа
И как нетрудно заметить, соотношение
есть величина постоянная для одного и того же количества моль газа.
И эту закономерность опытным путем установили еще до вывода уравнения. Это так называемые газовые законы — законы Бойля-Мариотта, Гей-Люссака, Шарля.
Так, закон Бойля-Мариотта гласит (это два человека):
Для данной массы газа m при неизменной температуре Т произведение давления на объем есть величина постоянная.
Закон Гей-Люссака (а вот это один человек):
Для данной массы m при постоянном давлении P объем газа линейно зависит от температуры
Закон Шарля:
Для данной массы m при постоянном объеме V давление газа линейно зависит от температуры
Посмотрев на уравнение, нетрудно убедиться в справедливости этих законов.
Уравнение Менделеева-Клапейрона, также как и опытные законы Бойля-Мариотта, Гей-Люссака и Шарля справедливы для широкого интервала давлений, объемов и температур. То есть во многих случаях эти законы удобны для практического применения.
Однако не стоит забывать, что когда давления превышают атмосферное в 300-400 раз, или температуры очень высоки, наблюдаются отклонения от этих законов.
Собственно, идеальный газ потому и называют идеальным, что по определению это и есть газ, для которого не существует отклонений от этих законов.
Связь между давлением, температурой, объемом и количеством молей газа («массой» газа). Универсальная (молярная) газовая постоянная R. Уравнение Клайперона-Менделеева = уравнение состояния идеального газа
Связь между давлением, температурой, объемом и количеством молей газа («массой» газа). Универсальная (молярная) газовая постоянная R. Уравнение Клайперона-Менделеева = уравнение состояния идеального газа.
| Ограничения практической применимости:Внутри диапазона точность уравнения превосходит точность обычных современных инженерных средств измерения. Для инженера важно понимать, что для всех газов возможна существенная диссоциация или разложение при повышении температуры. |
где:
|
Давайте решим парочку задач относительно газовых объемных и массовых расходов в предположении, что состав газа не изменяется (газ не диссоциирует) — что верно для большинства газов в указанных выше пределах применимости.
1) Доставка объемов газа одинаковой массы при одинаковом давлении но различных температурах.
Данная задача актуальна в основном, но не только, для применений и устройств, в которых напрямую измеряется объем газа.
Пусть счетчик (расходомер) в точке доставки дает объемные накопленные расходы V1 и V2, при температурах, соответственно, T1 и T2 и, пусть T1 V2 для одинаковых количеств газа при данных условиях. Попробуем сформулировать несколько важных на практике выводов для данного случая:
- показатели объемного счетчика газа тем «весомее», чем выше давление
- выгодно поставлять газ низкого давления
- выгодно покупать газ высокого давления
Как с этим бороться? Необходима хотя бы простая компенсация по давлению, т.е в считающее устройство должна подаваться информация с дополнительного датчика давления.
В заключение, хотелось бы отметить, что, теоретически, каждый газовый счетчик должен иметь и температурную компенсацию и компенсацию по давлению. Практически же….. привет от проекта TehTab.ru.
Давление газа и атмосферное давление
ПодробностиМаксим Федоров11 января 20144184
Недавно я уже рассказывал о давлении твердого тела, давлении жидкости, а также, в чем их особенности, и по какой формуле они вычисляются. Сегодня очередь давления газа.
Газ, заключенный в каком-либо объеме, стремится заполнить весь этот объем и оказывает на ограничивающие стенки давление — это и есть давление газа. Кроме того, газ имеет вес (по крайней мере, на земле), и верхние слои газа давят на средние, те еще больше на нижние — это называется барометрическим или атмосферным давлением.
Давление газа
Любой газ стремится занять все доступное пространство. Например, если у космонавта в открытом космосе вдруг возникнет хоть маленькая дырочка в скафандре — весь воздух очень быстро выйдет через эту дырочку и будет распространяться по космосу все дальше и дальше. Если некоторое количество газа запереть в каком-либо сосуде, то, стремясь расшириться, газ будет давить на стенки сосуда.
Это происходит, потому, что при любой температуре, кроме абсолютного нуля, молекулы газа находятся в хаотическом тепловом движении и иногда ударяются о стенки сосуда и действуют на них. Впервые на это обратил внимание Михаил Ваcильевич Ломоносов в середине XVIII века.
Он опытным путем опроверг популярные в то время теории о теплороде и флогистоне, подготовив тем самым почву для молекулярно-кинетической теории XIX века.
В рамках этой теории Рудольфу Клаузиусу, Людвигу Больцману и Джеймсу Максвеkлу удалось связать макроскопические параметры газа (давление, объем, температура) с микроскопическими (масса молекул, средняя скорость их движения) и вывести основное уравнение молекулярно-кинетической теории (см. вывод уравнения):
где P — это давление, V — это объем, ν — количество вещества, R — универсальная газовая постоянная, а T — абсолютная температура.
Атмосферное давление
Гравитационное притяжение Земли заставляет воздух оказывать давление на все находящиеся на земле предметы и земную поверхность, и это давление называется атмосферным.
В отличии от жидкостей, газ подвержен сжатию, поэтому атмосферное давление с ростом высоты изменяется не линейно (как давление жидкости с уменьшением глубины), а более быстро.
Представим себе атмосферу, разделенную на много-много уровней одинаковой высоты, где самый верхний уровень считается под номером 1. Первый уровень оказывает давление p1 на второй, поэтому газ на втором уровне более плотный.
Поэтому, несмотря на то, что уровни одинаковой высоты, второй уровень оказывает давление на третий более сильное, чем первый на второй: p2=p1•q2 + p1 (коэффициент q2 соответствует увеличению плотности газа) и, кроме того, передает давление p1. Дальше: p3=p2•q3 + p2, и так далее.
Такое изменение давление называется экспоненциальным. Для идеального газа расчетная формула давления (ее называют барометрической формулой) записывается как
где p — давление газа в слое на высоте h, p0 — давление газа на нулевом уровне, M — молярная масса газа.
Несмотря на то, что формула будет абсолютно точной только для идеального газа, для обычного воздуха она тоже позволяет вычислить давление с хорошей точностью.
Персональный сайт — Давление
F
P = —
S
P – давление; F— сила, действующая на поверхность; S – площадь поверхности.
Единица давления – паскаль (Па).
В Международной системе (СИ) давление измеряют в ньютонах на квадратный метр: 1 Н/м2:
1Па = 1 Н/м2.
1 Па = 0,001 кПа = 0,01 гПа.
Формула расчета давления жидкости:
p = gρh
g – ускорение свободного падения, равное 9,8 Н/кг; ρ (ро) – плотность жидкости (см. таблицу плотностей); h – высота жидкости в сосуде.
Закон Паскаля
Давление, производимое на жидкость или газ, передается в любую точку без изменений во всех направлениях.
Измерение атмосферного давления.
Атмосферное давление измеряют с помощью ртутного столба.
Чем больше атмосферное давление, тем выше столб ртути в стеклянной трубке. Поэтому на практике атмосферное давление можно измерять высотой ртутного столба (в миллиметрах или сантиметрах). Если, например, атмосферное давление равно 780 мм рт.ст., то это значит, что воздух производит такое же давление, какое производит вертикальный столб ртути высотой 780 мм.
Плотность ртути равна 13.600 кг/м3.
Значит, давление столба ртути pртути высотой 1 мм (0,001 м) равно:
P = gρh, следовательно: P = 9,8 Н/кг · 13.600 кг/м3 · 0,001 м ≈ 133,3 Па.
Итак, 1 мм рт.ст = 133,3 Па
Источник