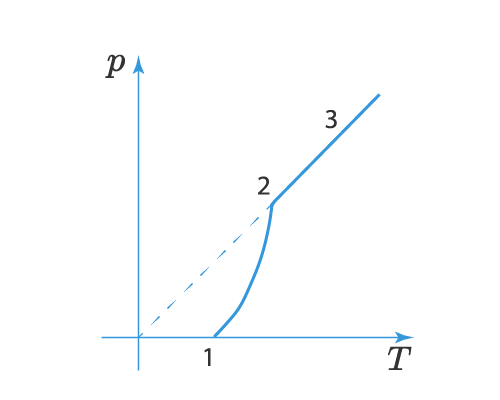Это пар, находящийся в термодинамическом равновесии с жидкой (или твёрдой) фазой одного и того же вещества.
Одним из параметров, характеризующим насыщенный пар, является его давление.
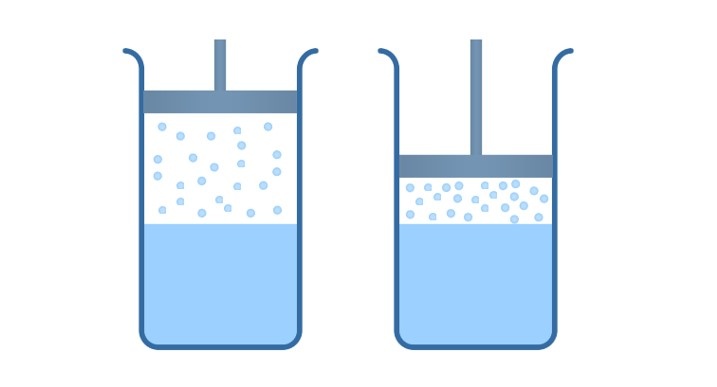
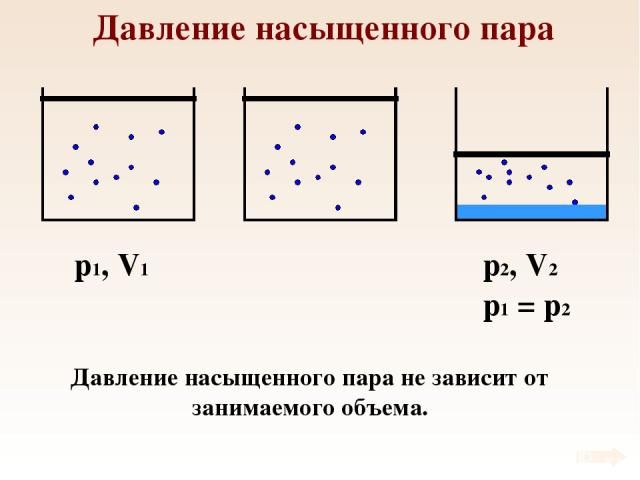
Давление насыщенного пара зависит от температуры и не зависит от объема.
Разберемся подробнее, почему так происходит.
Почему давление насыщенного пара не зависит от объема?
Рассмотрим этот вопрос на примере дистиллированной воды.
Возьмем цилиндр с поршнем, в полости которого находится дистиллят в термодинамическом равновесии с паром. Начинаем двигать поршень вниз, объем цилиндра начинает уменьшаться, происходит сжатие насыщенного пара, при этом мы поддерживаем постоянную температуру.
Система начнёт выходить из равновесия, плотность пара будет увеличиваться, и из газообразной фазы в жидкую будет переходить молекул больше, чем из жидкой в газообразную.
Другими словами, мы будем наблюдать процесс превращения насыщенного пара обратно в жидкость, этот процесс называется конденсация.
Если мы начнем поднимать поршень, объем полости увеличится, концентрация водяных паров над жидкостью начнет уменьшаться, вследствие чего, вода в сосуде начнет испаряться до тех пор, пока давление и концентрация насыщенного пара над жидкостью не придет в исходное состояние, то есть пока не наступит термодинамическое равновесие.
Из выше сказанного мы делаем вывод, что концентрация молекул насыщенного пара над жидкостью при постоянной температуре не зависит от его объема.
P=nkT,P=nkT,
где PP – давление пара (Па), nn – концентрация молекул пара (м-3), kk – постоянная Больцмана (равна 1,380649 Дж/К), ТТ – температура (К).
Из приведенной формулы мы видим, что давление насыщенного пара прямо пропорционально концентрации молекул и температуре паров над жидкостью (или твердым веществом) и, следовательно, не зависит от занимаемого им объема.
Как давление насыщенного пара зависит от температуры?
Из формулы, приведенной выше, мы наблюдаем, что давление насыщенного пара прямо пропорционально температуре термодинамической системы.
Несмотря на это, экспериментальная зависимость отличается от описанной уравнением, и давление пара увеличивается с большей скоростью с повышением температуры, нежели по линейному закону. Почему так происходит?
Всё дело в том, что во время увеличения подведенной температуры растёт и скорость испарения жидкости (или сублимации твёрдого вещества), вследствие этих факторов, увеличивается и концентрация испарённых (или сублимированных) молекул в газообразном состоянии над жидкой (или твёрдой) фазой. Поэтому и давление насыщенных паров изменяется быстрее. Плотность пара будет возрастать до тех пор, пока термодинамическое равновесие для данной температуры вновь не восстановится.
На участке 1-2 мы как раз видим влияние двух факторов – увеличение температуры и концентрации паров. В точке 2 вся жидкость испаряется (или твердое вещество сублимируется) и пар становится ненасыщенным, тогда давление начинает расти по линейному закону, что видно на участке 2-3.
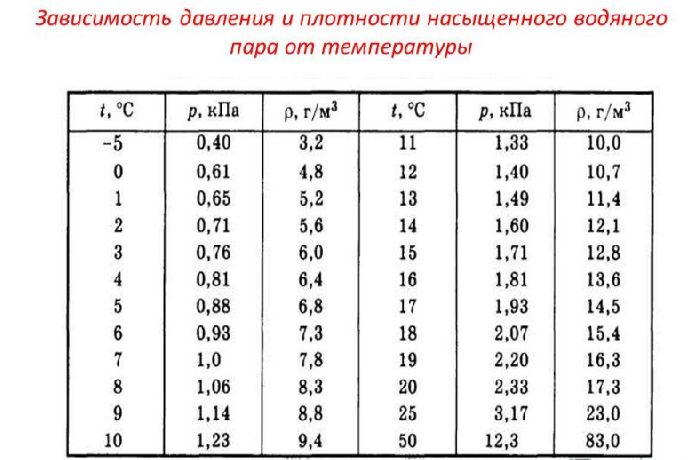
Значения давления насыщенного пара для воды и других веществ при различных температурах получены эмпирическим методом. Эти данные можно найти в справочных материалах.
Тест по теме «Давление насыщенного пара»
Насыщенный пар
-
Темы кодификатора ЕГЭ: насыщенные и ненасыщенные пары, влажность воздуха.
-
Испарение и конденсация
-
Динамическое равновесие
-
Свойства насыщенного пара
-
Влажность воздуха
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: насыщенные и ненасыщенные пары, влажность воздуха.
Если открытый стакан с водой оставить на долгое время, то в конце концов вода полностью улетучится. Точнее — испарится. Что такое испарение и почему оно происходит?
Испарение и конденсация
При данной температуре молекулы жидкости обладают разными скоростями. Скорости большинства молекул находятся вблизи некоторого среднего значения (характерного для этой температуры). Но попадаются молекулы, скорости которых значительно отличаются от средней как в меньшую, так и большую сторону.
На рис. 1 изображён примерный график распределения молекул жидкости по скоростям. Голубым фоном показано то самое большинство молекул, скорости которых группируются около среднего значения. Красный «хвост» графика — это небольшое число «быстрых» молекул, скорости которых существенно превышают среднюю скорость основной массы молекул жидкости.
Рис. 1. Распределение молекул по скоростям
Когда такая весьма быстрая молекула окажется на свободной поверхности жидкости (т.е. на границе раздела жидкости и воздуха), кинетической энергии этой молекулы может хватить на то, чтобы преодолеть силы притяжения остальных молекул и вылететь из жидкости. Данный процесс и есть испарение, а молекулы, покинувшие жидкость, образуют пар.
Итак, испарение — это процесс превращения жидкости в пар, происходящий на свободной поверхности жидкости (при особых условиях превращение жидкости в пар может происходить по всему объёму жидкости. Данный процесс вам хорошо известен — это кипение).
Может случиться, что через некоторое время молекула пара вернётся обратно в жидкость.
Процесс перехода молекул пара в жидкость называется конденсацией. Конденсация пара — процесс, обратный испарению жидкости.
к оглавлению ▴
Динамическое равновесие
А что будет, если сосуд с жидкостью герметично закрыть? Плотность пара над поверхностью жидкости начнёт увеличиваться; частицы пара будут всё сильнее мешать другим молекулам жидкости вылетать наружу, и скорость испарения станет уменьшаться. Одновременно начнёт увеличиваться скорость конденсации, так как с возрастанием концентрации пара число молекул, возвращающихся в жидкость, будет становиться всё больше.
Наконец, в какой-то момент скорость конденсации окажется равна скорости испарения. Наступит динамическое равновесие между жидкостью и паром: за единицу времени из жидкости будет вылетать столько же молекул, сколько возвращается в неё из пара. Начиная с этого момента количество жидкости перестанет убывать, а количество пара — увеличиваться; пар достигнет «насыщения».
Насыщенный пар — это пар, который находится в состоянии динамического равновесия со своей жидкостью. Пар, не достигший состояния динамического равновесия с жидкостью, называется ненасыщенным.
Давление и плотность насыщенного пара обозначаются и
. Очевидно,
и
— это максимальные давление и плотность, которые может иметь пар при данной температуре. Иными словами, давление и плотность насыщенного пара всегда превышают давление и плотность ненасыщенного пара.
к оглавлению ▴
Свойства насыщенного пара
Оказывается, что состояние насыщенного пара (а ненасыщенного — тем более) можно приближённо описывать уравнением состояния идеального газа (уравнением Менделеева — Клапейрона). В частности, имеем приближённое соотношение между давлением насыщенного пара и его плотностью:
(1)
Это весьма удивительный факт, подтверждаемый экспериментом. Ведь по своим свойствам насыщенный пар существенно отличается от идеального газа. Перечислим важнейшие из этих отличий.
1. При неизменной температуре плотность насыщенного пара не зависит от его объёма.
Если, например, насыщенный пар изотермически сжимать, то его плотность в первый момент возрастёт, скорость конденсации превысит скорость испарения, и часть пара конденсируется в жидкость — до тех пор, пока вновь не наступит динамическое равновесие, в котором плотность пара вернётся к своему прежнему значению.
Аналогично, при изотермическом расширении насыщенного пара его плотность в первый момент уменьшится (пар станет ненасыщенным), скорость испарения превысит скорость конденсации, и жидкость будет дополнительно испаряться до тех пор, пока опять не установится динамическое равновесие — т.е. пока пар снова не станет насыщенным с прежним значением плотности.
2. Давление насыщенного пара не зависит от его объёма.
Это следует из того, что плотность насыщенного пара не зависит от объёма, а давление однозначно связано с плотностью уравнением (1).
Как видим, закон Бойля — Мариотта, справедливый для идеальных газов, для насыщенного пара не выполняется. Это и не удивительно — ведь он получен из уравнения Менделеева — Клапейрона в предположении, что масса газа остаётся постоянной.
3. При неизменном объёме плотность насыщенного пара растёт с повышением температуры и уменьшается с понижением температуры.
Действительно, при увеличении температуры возрастает скорость испарения жидкости.
Динамическое равновесие в первый момент нарушается, и происходит дополнительное испарение некоторой части жидкости. Пара будет прибавляться до тех пор, пока динамическое равновесие вновь не восстановится.
Точно так же при понижении температуры скорость испарения жидкости становится меньше, и часть пара конденсируется до тех пор, пока не восстановится динамическое равновесие — но уже с меньшим количеством пара.
Таким образом, при изохорном нагревании или охлаждении насыщенного пара его масса меняется, поэтому закон Шарля в данном случае не работает. Зависимость давления насыщенного пара от температуры уже не будет линейной функцией.
4. Давление насыщенного пара растёт с температурой быстрее, чем по линейному закону.
В самом деле, с увеличением температуры возрастает плотность насыщенного пара, а согласно уравнению (1) давление пропорционально произведению плотности на температуру.
Зависимость давления насыщенного пара от температуры является экспоненциальной (рис. 2). Она представлена участком 1–2 графика. Эту зависимость нельзя вывести из законов идеального газа.
Рис. 2. Зависимость давления пара от температуры
В точке 2 вся жидкость испаряется; при дальнейшем повышении температуры пар становится ненасыщенным, и его давление растёт линейно по закону Шарля (участок 2–3).
Вспомним, что линейный рост давления идеального газа вызван увеличением интенсивности ударов молекул о стенки сосуда. В случае нагревания насыщенного пара молекулы начинают бить не только сильнее, но и чаще — ведь пара становится больше. Одновременным действием этих двух факторов и вызван экспоненциальный рост давления насыщенного пара.
к оглавлению ▴
Влажность воздуха
Воздух, содержащий водяной пар, называется влажным.Чем больше пара находится в воздухе, тем выше влажность воздуха.
Абсолютная влажность — это парциальное давление водяного пара, находящегося в воздухе (т. е. давление, которое водяной пар оказывал бы сам по себе, в отсутствие других газов). Иногда абсолютной влажностью называют также плотность водяного пара в воздухе.
Относительная влажность воздуха — это отношение парциального давления водяного пара в нём к давлению насыщенного водяного пара при той же температуре. Как правило, это отношение выражают в процентах:
Из уравнения Менделеева-Клапейрона (1) следует, что отношение давлений пара равно отношению плотностей. Так как само уравнение (1), напомним, описывает насыщенный пар лишь приближённо, мы имеем приближённое соотношение:
Одним из приборов, измеряющих влажность воздуха, является психрометр. Он включает в себя два термометра, резервуар одного из которых завёрнут в мокрую ткань. Чем ниже влажность, тем интенсивнее идёт испарение воды из ткани, тем сильнее охлаждается резервуар «мокрого» термометра, и тем больше разность его показаний и показаний сухого термометра. По этой разности с помощью специальной психрометрической таблицы определяют влажность воздуха.
Спасибо за то, что пользуйтесь нашими публикациями.
Информация на странице «Насыщенный пар» подготовлена нашими авторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать необходимые и поступить в ВУЗ или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими статьями из данного раздела.
Публикация обновлена:
08.05.2023
-
Давление насыщенного пара.
И что будет происходить с насыщенным
паром, если уменьшить занимаемый им
объем? Например, если сжимать пар,
находящийся в равновесии с жидкостью
в цилиндре под поршнем, поддерживая
температуру содержимого цилиндра
постоянной.
При сжатии пара равновесие
начнет нарушаться. Плотность пара в
первый момент немного увеличится, и из
газа в жидкость начнет переходить
большее число молекул, чем из жидкости
в газ. Ведь число молекул, покидающих
жидкость в единицу времени, зависит
только от температуры, и сжатие пара
это число не меняет. Процесс продолжается
до тех пор, пока вновь не установится
динамическое равновесие и плотность
пара, а значит, и концентрация его молекул
не примут прежнее значение. Следовательно,
концентрация молекул
насыщенного пара при постоянной
температуре не зависит от его объема.
Так как давление пропорционально
концентрации молекул (p
= nkT),
то из этого определения
следует, что давление
насыщенного пара не зависит oт
занимаемого им объема.
Давление пара
,
при котором жидкость
находится в равновесии со своим паром,
называют давлением насыщенного пара.
-
Ненасыщенный пар.
Мы много раз употребляли
слова газ и
пар. Никакой
принципиальной разницы между газом и
паром нет. Но если при
неизменной температуре газ простым
сжатием можно превратить в жидкость,
то мы называем его паром, точнее,
ненасыщенным паром.
-
Зависимость давления насыщенного пара от температуры.
Состояние
насыщенного
пара, как говорит опыт, приближенно
описывается уравнением
состояния идеального газа,
а его давление определяется формулой
С ростом температуры давление
растет.
Так как д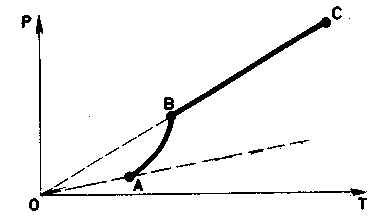
насыщенного
пара не зависит от объема, оно
зависит только от
температуры.
Однако
эта зависимость ро(Т),
найденная
экспериментально, не является
прямо пропорциональной, как
у идеального газа при постоянном
объеме. С увеличением температуры
давление насыщенного пара растет
быстрее, чем давление идеального
газа (рис. 30, участок кривой АВ).
Это становится
особенно очевидным,
если провести изохору через точку
А
(пунктирная
прямая) Почему
это происходит?
Однако эта зависимость
р(Т), найденная
экспериментально, не является
прямо пропорциональной, как
у идеального газа при постоянном
объеме. С увеличением температуры
давление насыщенного парабыстрее,
чем давление идеального
газа (рис. 30).Почему это
происходит?
При
нагревании жидкости в закрытом
сосуде часть жидкости превращается
в пар. В результате согласно
формуле
давление
насыщенного
пара растет не только вследствие
повышения температуры жидкости,
но и вследствие увеличения
концентрации молекул (плотности)
пара.
В основном
увеличение давления при повышении
температуры определяется именно
увеличением концентрации. Главное
различие в поведении идеального газа
и насыщенного пара состоит в том, что
при изменении температуры пара в закрытом
сосуде (или при изменении объема при
постоянной температуре) меняется масса
пара. Жидкость частично превращается
в пар или, напротив, пар частично
конденсируется. Когда вся жидкость
испарится, пар при дальнейшем нагревании
перестанет быть насыщенным и его давление
при постоянном объеме будет возрастать
прямо пропорционально абсолютной
температуре (см. рис. 30, участок ВС).
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Калькулятор определяет парциальное давления водяного пара в зависимости от температуры.
Определение парциального давления водяного пара.
Примечание.
Расчет выполнен на основании п.8.6. СП 50.13330.2012 «Тепловая защита зданий». Парциальное давление насыщенного водяного пара по данной формуле определяется в пределах температур от минус 40 °С до плюс 45 °С.
Для внутреннего воздух помещения парциальное давления рассчитывается с учетом относительной влажности:
Расчет парциального давления насыщенного водяного пара внутреннего воздуха.
Для наружного воздух парциальное давление определяется согласно таблицы 7 СП 131.13330.2018 «Строительная климатология. Актуализированная редакция СНиП 23-01-99*»:
Строительная климатология онлайн. Данные из СП 131.13330.2018 (СП 131.13330.2012).
В комментарии приветствуются пожелания, замечания и рекомендации по улучшению программы.
Поделиться ссылкой:
Давление насыщенного пара

4.6
Средняя оценка: 4.6
Всего получено оценок: 163.
4.6
Средняя оценка: 4.6
Всего получено оценок: 163.
Процесс перехода быстрых (высокоэнергетичных) молекул из жидкого (или твердого) состояния в пар называется испарением. Обратный процесс, когда молекулы из газообразного состояния возвращаются в жидкое, называется конденсацией. Пар, находящийся в равновесии с жидкостью (веществом), называется насыщенным паром. Важным параметром, характеризующим этот процесс является давление насыщенного пара.
Удельная теплота парообразования
Наблюдения показывают, что для перевода жидкости в пар при постоянной температуре необходимо передать ей количество теплоты Q, пропорциональное массе m жидкости, превратившейся в пар, что можно записать в виде формулы:
$ Q = r * m $ (1),
где: коэффициент пропорциональности r — удельная теплота парообразования, (Дж/кг). Удельная теплота парообразования указывает, какое количество теплоты требуется для превращения 1 кг жидкости в пар при постоянной температуре. Экспериментальные значения удельной теплоты парообразования для разных веществ приведены в справочных таблицах.
Давление пара
Пускай имеется цилиндр, в котором находится жидкость в равновесии с насыщенным паром. Будем считать, что температура не меняется. При сжатии насыщенного пара, находящегося в равновесии с жидкостью, сначала равновесие будет нарушено. Плотность пара увеличится, и из газа в жидкость будет переходить молекул больше, чем из жидкости в газ, так как количество испаряющихся молекул зависит только от температуры, а сжатие пара на это не влияет. Этот процесс выравнивания потоков молекул будет происходить до установления динамического равновесия, и достижения (концентрации молекул) первоначального значения плотности пара (концентрации молекул).
Значит, концентрация молекул насыщенного пара при постоянной температуре не зависит от его объема. Давление газа p описывается известной формулой:
$ p = n * k* T $ (2),
где: n — концентрация молекул газа, T — температура, k — постоянная Больцмана.
Следовательно, давление насыщенного пара не зависит от занимаемого им объема.
Зависимость давления насыщенного пара от температуры
Из формулы (2) следует, что давление насыщенного пара pнп зависит только от температуры.
Из экспериментальных графиков видно, что зависимость pнп(T) не линейна (не прямо пропорциональна). С ростом Т давление pнп растет быстрее, чем давление идеального газа. Дело в том, что давление насыщенного пара растет также за счет увеличения концентрации молекул (плотности) пара, так как с ростом температуры растет число испарившихся молекул. В идеальном газе такой механизм отсутствует — давление в нем растет только за счет роста кинетической энергии молекул.
Для большинства веществ экспериментально получены значения давлений насыщенных паров при различных температурах. Эти данные можно найти в справочниках или на соответствующих интернет-ресурсах. В качестве примера ниже приведена такая таблица для воды и ртути.
Таблица зависимости давления насыщенных паров от температуры для воды и ртути
|
Температура,0С |
Давление паров воды, мм.рт.ст. |
Давление паров ртути, мм.рт.ст. |
Температура,0С |
Давление паров воды, мм.рт.ст. |
Давление паров ртути, мм.рт.ст. |
|
0 |
4,58 |
0,00021 |
100 |
760 |
0,28 |
|
20 |
17,5 |
0,0013 |
120 |
1489 |
0,76 |
|
40 |
55,3 |
0,0065 |
140 |
2711 |
1,85 |
|
60 |
149 |
0,026 |
200 |
11660 |
17,2 |
|
80 |
355 |
0,092 |
300 |
64450 |
245 |
|
90 |
526 |
0,16 |
374 |
165530 |
1100 |
На предметах, принесенных в помещение с мороза образуются капли воды, “выпадает роса”. Это происходит из-за насыщения водяными парами. Также объясняется запотевание оконных стекол в наших квартирах. Образование капелек конденсата связано с термином “точка росы”. Точка росы — это температура, при которой водяной пар в охлажденном воздухе становиться насыщенным и начинает конденсироваться.
Что мы узнали?
Итак, мы узнали, что пар, находящийся в равновесии с жидкостью называется насыщенным. Давление насыщенного пара не зависит от занимаемого им объема. С ростом температуры давление насыщенного пара растет.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Мэйс Винду
5/5
-
Айана Капсаргина
4/5
Оценка доклада
4.6
Средняя оценка: 4.6
Всего получено оценок: 163.
А какая ваша оценка?